BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
Bagian ini akan dikemukakan teori-teori atau penelitian yang telah dilakukan yang mendasari penelitian pengaruh kitosan p-t-butilkaliks[4]arena sebagai adsorben logam Cu2+.
1. Pencemaran Logam Tembaga
Logam secara khas menggambarkan suatu unsur yang merupakan konduktor listrik yang baik dan mempunyai konduktivitas panas, rapatan, kemudahan ditempa, kekerasan dan keelektropositifan yang tinggi (Connel dan Miller 1995). Logam berat masih termasuk golongan logam dengan kriteria-kriteria yang sama dengan logam-logam lain. Perbedaannya terletak pada pengaruh yang dihasilkan bila logam berat berikatan dan atau masuk ke dalam tubuh organisme hidup (Palar, 2004). Proses alam seperti perubahan siklus alamiah, memberikan kontribusi yang sangat besar ke lingkungan. Kegiatan manusia juga merupakan suatu sumber utama pemasukan logam ke lingkungan perairan, seperti pertambangan minyak, emas dan batu bara, pembangkit tenaga listrik, pestisida, keramik, peleburan logam, pabrik-pabrik pupuk dan kegiatan industri lainnya.
Tembaga dapat mengakibatkan keracunan atas makhluk hidup, dalam jumlah yang sangat kecil merupakan logam atau mineral penting tubuh. Namun bila jumlahnya berlebih, maka akan berubah fungsi menjadi zat racun bagi tubuh. Secara alamiah tembaga dapat masuk ke dalam suatu tatanan lingkungan akibat dari berbagai peristiwa alam. Unsur ini dapat bersumber dari peristiwa pengikisan (erosi) dari batuan mineral. Melalui jalur non alamiah, tembaga masuk ke tatanan lingkungan sebagai akibat aktivitas manusia. Sebagai contoh adalah limbah industri yang menggunakan tembaga dalam proses produksinya. Toksisitas logam yang dimiliki logam tembaga baru akan bekerja dan memperlihatkan pengaruhnya bila logam ini telah masuk ke dalam tubuh organisme dalam jumlah besar atau melebihi nilai toleransi organisme tersebut.
Tembaga (Cu) merupakan unsur logam yang dalam berada pada periode empat, golongan IB, mempunyai nomor atom 29, massa atom relatif 63,5 bentuknya padat pada suhu kamar, warna kuning kemerahan, berat jenis 9,94 gr cm-3 dan titik lebur 1083oC.
Logam tembaga (Cu) merupakan logam transisi, berwarna coklat kemerahan dengan nomor atom 29 dan berat atom relatif 63,546 g/mol, terletak pada periode keempat golongan IB dalam sistem periodik unsur. Logam Cu2+ mempunyai jari jari 0,7 Å , titik leleh 1083oC dan titik didih 2595 oC. Tembaga mempunyai sifat kelistrikan dan konduktivitas termal yang bagus, bersifat lunak sehingga mudah dibentuk, tahan terhadap korosi dan mudah dibuat alloy (paduan logam). Konfigurasi tembaga pada keadaan dasar adalah 1s2 2s2 2p6 3s2 3p6 3d10 4s1. Konfigurasi elektron Cu dapat dituliskan [Ar] 3d10 4s1 sedangkan pada Logam Cu2+ adalah [Ar] 3d9 4s0 (Lee, 1991). Logam Cu2+ memiliki stabilitas kompleks yang paling besar jika dibandingkan dengan logam transisi deret pertama yang lain dan paling stabil jika dibandingkan bilangan oksidasi Cu yang lain (Day and Selbin, 1985). Tembaga terdistribusi secara luas di alam diantaranya sebagai logam membentuk senyawa sulfida, oksida, klorida dan karbonat. Pada temperatur tinggi senyawa oksida dan sulfida dari Cu(I) lebih stabil dari pada Cu(II). Sifat tembaga dalam air tergantung pada tingkat pH dan konsentrasi anion-anion di dalam air. Tembaga dengan bilangan oksidasi +1 mudah membentuk kesetimbangan menjadi Cu2+ dan Cu0. Ion Cu+ dalam konsentrasi yang sangat rendah (kurang dari 1 x 10
-2M) berada dalam kesetimbangan dengan membentuk senyawa sederhana yang
stabil dalam air dengan kelarutan rendah sebagai CuCl dan CuCN. Keberadaan tembaga di dalam air laut dominan sebagai kompleks karbanato dan hidroksil (Palar, 1994),
Tembaga dialam ditemukan sebagai deposit berbentuk bijih tembaga yang bersenyawa dengan unsur lain seperti CuO. CuO banyak digunakan sebagai katalis, baterai, elektrode dan sebagai pigmen pencegah pertumbuhan lumut. Turunan senyawa tembaga karbonat banyak digunakan sebagai insektisida dan fungisida. Senyawa kloridanya banyak digunakan dalam bidang metalurgi, fotografi,
Cu-protein yang memiliki fungsi tertentu dalam pembentukan haemoglobin, kolagen, pembuluh darah dan myelin otak (Palar, 1994).
2. Adsorben
Kitosan banyak dimanfaatkan sebagai adsorben karena mempunyai kemampuan yang cukup tinggi dalam mengikat ion logam dan kemungkinan pengambilan kembali yang relatif mudah terhadap ion logam yang terikat pada kitosan dengan menggunakan pelarut tertentu. Keunggulan adsorben kitosan adalah dapat digunakan untuk penanganan limbah secara berulang-ulang. (Muzzarelli, 1997 dalam Darjito, 2011).
a. Kitosan
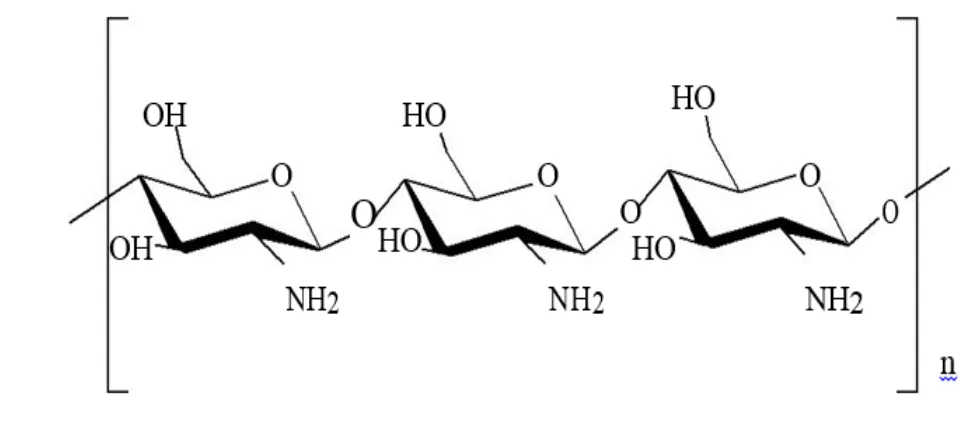
Kitosan merupakan polisakarida rantai lurus yang tersusun oleh monomer glukosamin yang terhubung melalui ikatan (1-4) β-glikosidik. Kitosan diperoleh dari proses deasetilasi kitin. Kitin merupakan poli-N-asetil-glukosamin, sedangkan kitosan adalah kitin terdeasetilasi sebanyak mungkin tapi tidak cukup sempurna untuk dinamakan poli glukosamin. Struktur kitosan ditampilkan pada Gambar 1.
Gambar 1. Struktur Kitosan (Muzzarelli, 1977)
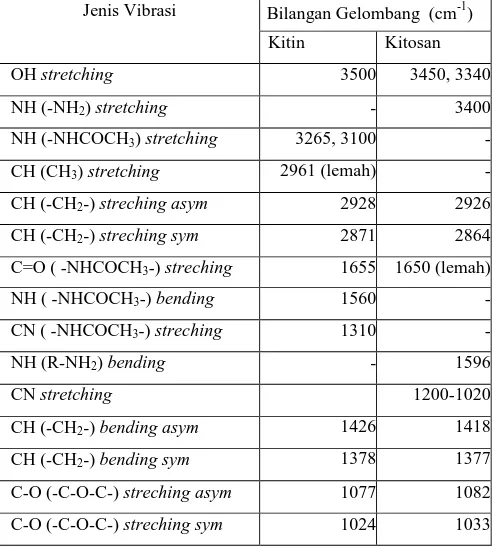
Proses deasetilasi kitin menggunakan larutan NaOH pekat bertujuan untuk mengubah gugus asetil dari kitin menjadi gugus amina pada kitosan. Gugus fungsi yang karakteristik dari spektra FTIR kitin dan kitosan dapat dilihat pada Tabel 1.
Tabel 1. Serapan FTIR karakteristik untuk kitin dan kitosan (Gyliene et al., 2003).
Jenis Vibrasi Bilangan Gelombang (cm-1
) Kitin Kitosan OH stretching 3500 3450, 3340 NH (-NH2) stretching - 3400 NH (-NHCOCH3) stretching 3265, 3100 - CH (CH3) stretching 2961 (lemah) - CH (-CH2-) streching asym 2928 2926 CH (-CH2-) streching sym 2871 2864
C=O ( -NHCOCH3-) streching 1655 1650 (lemah)
NH ( -NHCOCH3-) bending 1560 - CN ( -NHCOCH3-) streching 1310 - NH (R-NH2) bending - 1596 CN stretching 1200-1020 CH (-CH2-) bending asym 1426 1418 CH (-CH2-) bending sym 1378 1377
C-O (-C-O-C-) streching asym 1077 1082
C-O (-C-O-C-) streching sym 1024 1033
Proses adsorbsi secara fisika yang disebabkan gaya Van der Walls pada permukaan adsorben dimana terjadi perbedaan energi atau gaya tarik Van der Walls adsorbat dan adsorben yang menyebabkan adsorbat terikat atau tertarik pada molekul adsorben. Adsorbsi ini bersifat reversible dimana atom-atom atau ion-ion yang sudah terikat dapat dilepaskan kembali dengan bantuan pelarut tertentu yang memiliki sifat yang sama dengan atom yang diikat.
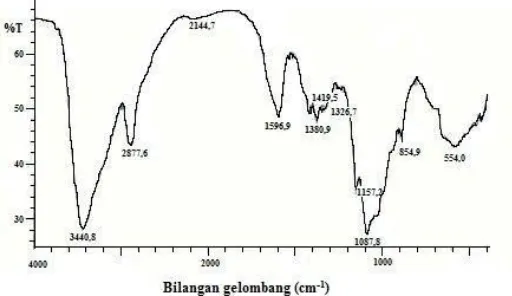
Gambar 2. Spektra FTIR Kitosan (Kurniasih et al., 2011)
Kitosan merupakan produk biologis yang bersifat kationik, nontoksik,
biodegradable dan biokompatibel. Kitosan memiliki gugus amino (NH2) yang
relatif lebih banyak dibandingkan kitin sehingga lebih nukleofilik dan bersifat basa. Kitosan merupakan padatan amorf putih yang tidak larut dalam alkali dan asam mineral kecuali pada keadaan tertentu. Kitosan merupakan molekul polimer yang mempunyai berat molekul tinggi. Kitosan dengan berat molekul tinggi dan mempunyai viskositas yang baik dalam suasana asam (Onsoyen dan Skaugrud, 1990). Kitosan hasil deasetilasi kitin larut dalam asam encer seperti asam asetat dan asam formiat (Kumar, 2000).
Kitosan memiliki sifat unik yang dapat digunakan dalam berbagai cara serta memiliki kegunaan yang beragam, antara lain sebagai perekat, bahan aditif pada kertas dan tekstil, penjernihan air minum, dan untuk mempercepat penyembuhan luka, serta memperbaiki sifat pengikatan warna. Kitosan merupakan pengkelat yang kuat untuk ion logam transisi. Kitosan mempunyai kemampuan untuk mengadsorpsi logam dan membentuk kompleks kitosan dengan logam (Roberts, 1992).
Kristalinitas kitosan yang disebabkan oleh ikatan hidrogen intermolekuler maupun intramolekuler lebih rendah dibandingkan kitin sehingga lebih mudah diaplikasikan dalam beberapa reagen. Kitosan tidak larut dalam air dan beberapa
pelarut organik seperti dimetilsulfoksida (DMSO), dimetilformamida (DMF), pelarut alkohol organik dan piridin. Kitosan larut dalam asam organik/mineral encer lalui protonasi gugus amino bebas ( NH2 NH3 ) pada pH kurang dari 6,5.
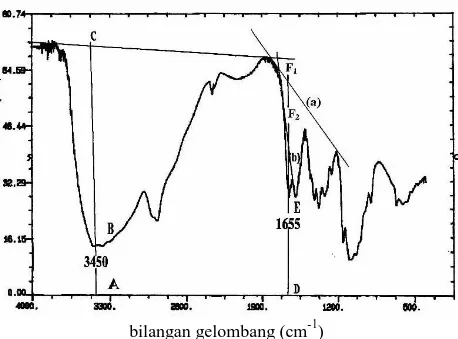
Pelarut yang baik untuk kitosan adalah asam format, asam asetat dan asam glutamat. Kelarutan kitosan menurun dengan bertambahnya berat molekul kitosan. Parameter lain yang berpengaruh pada sifat kitosan adalah berat molekul (BM) dan derajat deasetilasi (DD). Derajat deasetilasi menunjukkan berkurangnya gugus asetil dari kitin menjadi gugus amino pada kitosan. Penentuan DD dapat dilakukan dengan beberapa metode, seperti titrimetri HBr, spektroskopi IR, FDUV-spektrofotometri, X-Ray Diffraction dan spektroskopi 1H NMR. Serapan khas gugus hidroksil kitosan terletak pada bilangan gelombang 3550-3300 cm-1 dan gugus amida pada bilangan gelombang 1655-1310 cm-1 (Sannan et al., 1987). Berdasarkan transmitansi yang diperoleh pada masing-masing serapan menghasilkan nilai absorbansi. Persamaan sederhana untuk menentukan absorbansi. Dimana DF1 (untuk baseline a) atau DF2 (untuk baseline
b) DE, AC, dan AB menggambarkan ketinggian dari serapan gugus fungsional pada masing-masing panjang gelombang (Khan et al., 2002). Penarikan garis pada spektra FTIR dalam penentuan nilai DD ditampilkan pada Gambar 2.3.
Perbandingan antara absorbansi pada serapan gugus amida dengan absorbansi pada serapan gugus hidroksil. Derajat deasetilasi kitin yang sempurna (100%) diperoleh nilai 1,33 yang merupakan perbandingan Aamida dengan Ahidroksil. Perhitungan DD dengan baseline (a) yang diusulkan oleh Domszy dan Robert (1985). Sedangkan baseline (b) yang diusulkan (Baxter et al., 1992)
bilangan gelombang (cm-1)
Gambar 3. Garis dasar untuk base line (a) dan base line (b) (Khan et al., 2002) Khan et al. (2002) mengatakan garis dasar ditentukan berdasarkan serapan hidroksil dan amida yang dipilih. Nilai absorbansi dapat dihitung dengan
menggunakan persamaan (1).
A = ………...(1)
Dimana,
Po = Intensitas cahaya sebelum mengenai sampel P = Intensitas cahaya setelah melewati sampel
Kitosan merupakan biopolimer yang sumbernya melimpah dan dapat terbarukan sehingga termasuk sumber daya alternatif yang harus dimanfaatkan semaksimal mungkin. Sifat polikationik kitosan menjadi dasar pemanfaatan kitosan dalam berbagai bidang. Kitosan dimanfaatkan dalam bidang pertanian karena sifatnya yang biodegradable. Tanaman yang diperlakukan dengan kitosan memiliki ketahanan yang baik terhadap serangan jamur. Dalam bidang kesehatan, kitosan bermanfaat dalam program diet karena kemampuannya menurunkan jumlah kolesterol, antikoagulan dalam darah serta digunakan sebagai agen antibakteri. Bidang bioteknologi memanfaatkan kitosan sebagai zat yang berperan dalam imobilisasi enzim, pemisahan protein dan regenerasi sel. Dalam industri makanan,
kitosan digunakan sebagai antioksidan, pengawet alami, penyerap zat warna dan pengemulsi. Kitosan juga dimanfaatkan sebagai adsorben/penghelat logam.
b. Kitosan p-t-butilkaliks[4]arena
Kitosan p-t-butilkaliks[4]arena merupkan gabungan dari senyawa kitosan dengan salah satu kaliksarena. Salah satu senyawa kaliksarena adalah senyawa p-t-butilkaliks[4]arena. Senyawa induk p-t-butilkaliks[4]arena mengandung dua bagian struktur yang menarik karena mempunyai empat gugus hidroksi pada bagian lower rim dengan posisi yang sangat dekat satu sama lain sehingga dapat digunakan untuk mengikat kation (Izatt et al, dalam Firdaus et al., 2007).
Imobilisasi kaliksarena pada suatu polimer juga pernah dilakukan oleh Tabakci dan Yilmaz (2008) dengan melakukan sambung silang antara kitosan dan kaliks[4]arena membentuk polimer khelat. Hasil sintesis ini digunakan untuk adsorpsi kation logam berat dan anion dikromat. Hasil penelitian menunjukkan bahwa polimer yang dihasilkan mempunyai kemampuan mengadsorp kation logam berat yang lebih tinggi (80-93 %) dibandingkan dengan kitosan (25-33 %). Penelitian serupa masih dilakukan oleh Tabakci dan Yilmaz (2008) yang melakukan immobilisasi kaliksarena-silika gel dan polimer yang dihasilkan juga mampu mengadsorpsi ion logam Cu2+ dengan hasil yang memuaskan. Salah satu kelompok senyawa sintesis yang memiliki potensi besar untuk dikembangkan sebagai adsorben adalah kaliksarena (calixarene), suatu senyawa oligomer siklis yang tersusun dari satuan-satuan aromatis yang dihubungkan oleh suatu jembatan. Kaliksarena mempunyai kemungkinan untuk dimodifikasi secara hampir tak terbatas, baik pada jenis dan jumlah satuan aromatis, jenis jembatan, maupun jenis gugus fungsional, selain itu kaliksarena mempunyai geometri unik, berbentuk seperti keranjang dan berrongga, sehingga dapat digunakan dalam sistem guest-host (inang-tamu), dengan kaliksarena berperan sebagai host, dan ion atau molekul lain berperan sebagai guest-nya (Linane dan Shinkai, 1994).
Bagian upper rim terdapat rongga hidrofobik yang potensial sebagai pengompleks molekul netral (Loon et al., 1990). Struktur molekul
Gambar 4. Struktur molekul p-t-butilkaliks[4]arena (Gutsche, 1998).
Penelitian yang dilakukan oleh Jumina et al. (2007) menunjukkan kemungkinan untuk memasukkan gugus alkenil seperti gugus alil pada lingkar bawah senyawa tetrahidroksi-kaliks[4]arena sehingga menghasilkan senyawa monoalilkaliks[4]arena. Adanya gugus pendonor elektron ini diharapkan memberi kontribusi untuk terjadinya kompleksasi dengan ion logam. Senyawa monoalilkaliks[4]arena ini kemudian oleh Utomo et al. (2009) dipolimerisasi dalam kondisi asam menghasilkan polipropilkaliks[4]arena yang tidak larut dalam air. Pemanfaatan polimer ini sebagai adsorben ion logam berat Pb (II) dan Cr (III) ternyata menunjukkan kapasitas adsorpsi yang jauh lebih besar jika dibandingkan dengan monomernya. Penelitian selanjutnya dilakukan oleh Handayani (2011) juga berhasil mensintesis senyawa poli-5-alilkaliks[4]arena dan menunjukkan hasil yang cukup baik dalam menyerap kation-kation logam berat.
Kitosan memiliki daya serap yang baik karena memiliki gugusgugus yang reaktif seperti OH dan amina yang membuat kitosan bersifat basa. Hastuti et al.
(2011) melakukan modifikasi terhadap kitosan melalui proses swelling agar kitosan tidak mudah larut dalam suasana asam. Kitosan juga memiliki sifat mudah larut sebagian dalam asam encer, seperti HNO3, HCl, HClO4, dan lain-lain,
sehingga penggunaan kitosan secara langsung sebagai adsorben akan menjadi kurang efektif (Pasaribu, 2004 dalam Hastuti 2011).
O H H O O H O H
Modifikasi kitosan juga dapat dilakukan dengan crosslinking yaitu dengan mengikatkan senyawa lain ke dalam kitosan. Tujuannya yaitu untuk menambahkan gugus fungsi yang reaktif sehingga dapat meningkatkan kemampuan kitosan sebagai adsorben. Salah satu faktor kelarutan kitosan adalah berat molekul dimana dengan adanya peningkatan berat molekul kitosan dapat menyebabkan kelarutan kitosan menurun. Sebuah hasil penelitian menunjukkan bahwa kemampuan adsorpsi kitosan terhadap logam berat sangat dipengaruhi oleh sifat fisika-kimiawi kitosan. Kitosan yang berikat silang mempunyai ketahanan fisik terhadap asam yang lebih baik dari pada kitosan tak berikat silang (Wan et al., 2002). Berdasarkan pernyataan tersebut maka penelitian kali ini kitosan dimodifikasi dengan turunan senyawa makromolekul p-t-butilkaliks[4]arena yang berongga sehingga memiliki kemampuan menyerap yang baik. Struktur molekul kitosan p-t-butilkaliks[4]arena ditunjukkan Gambar 2.5.
Gambar 5. Struktur kitosan p-t-butilkaliks[4]arena (Restuti, 2012)
3. Adsorpsi
Adsorpsi (penyerapan) merupakan salah satu cara perawatan/perlakuan logam berat yang paling banyak digunakan karena metode ini aman, tidak memberikan efek samping yang membahayakan kesehatan, tidak memerlukan peralatan yang rumit dan mahal, mudah pengerjaannya dan dapat di daur ulang.
a. Kinetika Adsorpsi
Kinetika kimia mempelajari kecepatan (laju) reaksi dan bagaimana proses reaksi berlangsung. Orde reaksi merupakan bagian dari persamaan laju reaksi. Orde reaksi terhadap suatu komponen menurut merupakan pangkat dari konsentrasi komponen itu dalam persamaan laju reaksi (Atkins, 1999).
Kinetika adsorpsi menyatakan kecepatan proses penyerapan adsorbat oleh adsorben yang dinyatakan dalam fungsi konsentrasi terhadap waktu. Pendekatan model empiris yang digunakan untuk menentukan model kinetika adsorpsi yaitu model pseudo order satu (pseudo first order) dan pseudo order dua (pseudo second order) (Ho dan McKay, 1997).
Laju pengambilan adsorbat oleh adsorben pada bertambahnya waktu kontak yang merupakan salah satu parameter yang menggambarkan efisiensi adsorben. Model kinetika pseudo orde satu dinyatakan oleh persamaan.
log (qe – qt) = log qe - t ………..(2)
atau,
ln (qe – qt) = ln qe - kf t
……….
(3)Nilai konstanta laju reaksi adsorpsi orde satu (kf) ditentukan dari plot ln (qe –
qt) terhadap t pada persamaan (2) Model kinetika pseudo orde dua dinyatakan oleh
persamaan.
= kS (qe – qt)2 ……….(4)
Dimana ks adalah konstanta laju reaksi pseudo-orde kedua (g/mg min). Integrasi persamaan tersebut dengan batas qt = 0 pada t = 0 dan qt = qt pada t = t akan menghasilkan persamaan berikut :
……… (5)
Nilai qe diperoleh dari slope pada alur t/qt versus t, dan ks diperoleh dari intersepnya. qe bisa diperoleh dari slope garis tersebut, ks bisa dihitung dari nilai
ks (Ho et al., 1999). Dimana qe : konsentrasi saat setimbang (mg/g), qt : konsentrasi zat teradsorpsi pada waktu t (mg/g), t : waktu kontak (jam), kf : konstanta pseudo orde satu, dan ks : konstanta pseudo orde dua.
b. Isoterm Adsorpsi
Adsorpsi atau penyerapan merupakan suatu proses dimana suatu molekul menjadi terserap dalam suatu permukaan bahan penyerap atau adsorben. Penyerapan secara fisika terjadi bila perbedaan enregi atau perbedaan gaya tarik Van der Waals antara adsorbat dan adsorben menyebabkan adsorbat terikat atau tertarik pada molekul adsorben. Penyerapan ini bersifat reversibel,yang berarti atom-atom atau ion-ion yang sudah terikat dapat dilepaskan kembali dengan bantuan pelarut tertentu yang memiliki sifat sama dengan atom yang diikat. Penyerapan secara kimia terjadi bila antara kedua zat terjadi reaksi kimia membentuk senyawa baru pada permukaan adsorben. Ikatan yang terjadi lebih kuat dan bersifat reversibel, karena pada pembentukannya diperlukan energi yang besarnya relatif sama dengan energi pada pembentukannya. Adsorpsi oleh zat padat ditandai oleh hal-hal sebagai berikut:
1) Adsorpsi bersifat selektif, artinya suatu absorben dapat menyerap banyak sekali suatu zat, tetapi tidak menyerap zat-zat tertentu.
2) Kecepatan adsorpsi berkurang dengan semakin banyaknya zat yang diserap. 3) Jumlah zat yang diserap tergantung temperatur, semakin jauh jarak antara
temperatur penyerapan dari temperatur kritis, maka semakin sedikit jumlah zat yang diserap.
Faktor-faktor yang mempenguhi adsorpsi antara lain struktur adsorben, berat adsorben, pH media, ukuran partikel, kapasitas pertukaran elektron, dan suhu. Adsorpsi tergantung luas permukaan adsorben, semakin poros adsorben, maka daya adsorpsinya semakin besar. Adsorben padat yang baik yaitu porositasnya tinggi, permukaannya sangat luas sehingga adsorpsi terjadi pada banyak tempat. Demikian juga untuk konsentrasi dan luas permukaan, semakin besar konsentrasi adsorbat maka semakin banyak adsorbat yang teradsorpsi dan semakin besar luas permukaan
terserapnya suatu molekul atau ion pada permukaan suatu adsorben. Dapat dikatakan bahwa adorpsi terjadi karena adanya partike yang terakumulasi pada suatu permukaan. Menurut Bird (1993), partikel yang terakumulasi dan diserap oleh permukaan disebut adsorbat, sedangkan material tempat terjadinya adsorpsi, terjadi tarik-menarik antara molekul adsorbat disebut adsorben. Adsorpsi terjadi jika gaya tarik menarik antara zat terlarut dengan permukaan penyerap dapat mengatasi gaya tarik menarik antara pelarut dengan permukaan penyerap (Oscik, 1982). Kecepatan adsorpsi sangat dipengaruhi oleh beberapa faktor, antara lain konsentrasi awal larutan, luas permukaan adsorben, temperatur, ukuran partikel, pH, dan waktu kontak (Bernasconni, 1995).
Jenis adsorpsi yang umum dikenal adalah adsorpsi kimia (kemisorpsi) dan adsorpsi fisika (fisisorpsi).
a) Adsorpsi Fisika (fisisorpsi)
Adsorpsi fisika ini melibatkan gaya Van der Waals dimana gaya tarik molekul antara larutan dan permukaan media lebih besar daripada gaya tarik substansi terlarut dan larutan, maka substansi terlarut akan diadsorpsi oleh permukaan media. Menurut Barrow (1979), adsorpsi juga mungkin terjadi dengan mekanisme pertukaran ion. Permukaan padatan dapat mengadsorpsi ion-ion dari larutan dengan mekanisme pertukaran ion. Karena itu ion pada gugus senyawa permukaan padatan adsorbennya dapat bertukar tempat dengan ion-ion adsorbat. Molekul-molekul yang diadsorpsi secara fisika tidak terikat kuat pada permukaan dan biasanya terjadi proses balik yang cepat (reversible), sehingga mudah untuk diganti dengan molekul yang lain (Atkins, 1999).
b) Adsorpsi Kimia (kemisorpsi)
Adsorpsi kimia terjadi dengan melibatkan rekasi-reaksi kimia. Seperti yang dijelaskan oleh Barrow (1979), adsorpsi jenis ini menyebabkan terbentuknya ikatan secara kimia sehingga diikuti dengan reaksi kimia. Ikatan kimia yang terjadi pada kemisorpsi sangat kuat mengikat molekul gas atau cairan dengan permukaan padatan, sehingga sangat sulit untuk dilepaskan kembali. Artinya, pelepasan kembali molekul yang terikat di adsorben pada kemisorpsi sangat kecil.
Pada proses adsorpsi kimia, interaksi adsorbat diawali dengan adsorpsi fisik, yaitu partikel-partikel adsorbat mendekat ke permukaan adsorben melalui gaya Van der Waals atau melalui ikatan hidrogen. Kemudian diikuti oleh adsorpsi kimia yang terjadi setelah adsorpsi fisika. Dalam adsorpsi kimia partikel melekat pada permukaan dengan membentuk ikatan kimia (biasanya ikatan kovalen) (Atkins, 1999).
Isoterm adsorpsi adalah adsorpsi yang menggambarkan hubungan antara zat yang teradsorpsi oleh adsorben dengan tekanan atau konsentrasi pada keadaan kesetimbangan dan temperatur tetap (Barrow, 1988; Alberty dan Daniel, 1983). Ada beberapa jenis isoterm, antara lain :Isoterm Adsorpsi Langmuir dan Isoterm Adsorpsi Freundich
Isoterm Langmuir menggambarkan bahwa pada permukaan adsorben terdapat sejumlah tertentu situs aktif yang sebanding dengan luas permukaan dimana setiap situs aktif hanya ada satu molekul yang dapat diadsorpsi.(Sari, 2009). Isoterm adsorpsi Langmuir digunakan untuk menggambarkan adsorpsi kimia (Alberty et al., 1983). Persamaan isoterm adsorpsi Langmuir yang merupakan jenis adsorpsi monolayer dapat dijelaskan sebagai berikut (Goksungup et al, 2002) Irving Langmuir mengemukakan hubungan antara jumlah gas yang terjerap pada permukaan dengan tekanan gas tersebut. Isoterm Langmuir biasanya digunakan untuk menggambarkan proses kimisorpsi. Sistem yang menjalani tipe isoterm Langmuir akan terus melakukan adsorpsi sampai tercapai lapisan monolayer. Persamaan untuk isoterm Langmuir adalah:
𝑄 =
𝑘1 𝑐1+𝑘2 𝑐 ………(5)
Bentuk linear persamaan isoterm Langmuir adalah sebagai berikut:
𝑥 𝑄
=
1 𝑘1+
𝑘2 𝑘1𝑐
………...(6) KeteranganQ = jumlah adsorbat per unit adsorben K = konstanta empiris
namun dapat menggambarkan konsep yang jelas tentang lapisan monolayer.
Isoterm Freundlich. Herbert Max Finley Freundlich mengemukakan suatu persamaan isoterm adsorpsi untuk sistem non ideal pada tahun 1906. Isoterm ini paling umum digunakan karena dapat mengkarakterisasi kebanyakan proses adsorpsi dengan baik (Pope, 2004), selain itu dapat digunakan untuk permukaan yang heterogen yang sering terdapat pada bahan alam. Persamaan untuk isoterm Freundlich adalah:
𝑄 = 𝑘𝑐1/𝑛………..(7) Apabila persamaan tersebut diubah ke dalam bentuk logaritma akan diperoleh
𝐿𝑜𝑔 𝑄 = 𝐿𝑜𝑔 𝑘 +1
𝑛𝐿𝑜𝑔 𝐶………. (8)
Dimana :
Q = berat adsorben (g)
C = konsentrasi sebelum teradsorpsi (mg/L) K dan n adalah konstanta
(Castellan. 1983) Isoterm Freundlich menganggap bahwa pada sisi permukaan adsorben akan terjadi proses adsorpsi di bawah kondisi yang diberikan. Isoterm Freundlich tidak mampu memperkirakan adanya sisi-sisi pada permukaan yang mempu mencegah adsorpsi pada saat kesetimbangan tercapai, dan hanya ada beberapa sisi aktif saja yang mampu mengadsorpsi molekul terlarut (Pope, 2004).
B. Kerangka Pemikiran
Kegiatan manusia dapat menjadi suatu sumber utama pencemaran logam ke lingkungan perairan, seperti pertambangan minyak, emas dan batu bara, pembangkit tenaga listrik, pestisida, keramik, peleburan logam, pabrik-pabrik pupuk dan kegiatan industri lainnya. Oleh karena itu hal semacam ini perlu diantisipasi penyebaran limbah logam tersebut. Salah satunya ialah menggunakan metode adsorpsi. Adsorpsi menjadi pilihan yang baik karena metode ini merupakan metode yang paling efektif dan ekonomis (Park et al., 2007 dalam Mulyasuryani, 2013). Keberadaan beberapa logam dalam limbah, tentu saja membutuhkan penanganan khusus sebelum melakukan pengelolahan limbah. Salah satunya ion
logam Cu2+. Logam Cu2+ memiliki stabilitas kompleks yang paling besar jika dibandingkan dengan logam transisi deret pertama yang lain dan paling stabil jika dibandingkan bilangan oksidasi Cu yang lain. Sehingga digunakan logam Cu2+
untuk diadsorbsi menggunakan suatu adsorben.
Penelitian ini menggunakan adsorben kitosan p-t-butilkaliks[4]arena yang dibandingkan dengan adsorben kitosan. Adsorpsi dilakukan oleh adsorben kitosan dengan menggabungkan senyawa p-t-butilkaliks[4]arena. Senyawa
p-t-butilkaliks[4]arena merupakan salah satu senyawa kaliksarena. Senyawa kaliksarena memiliki dua bagian yaitu upper rim dan lower rim. Senyawa
p-t-butilkaliks[4]arena memiliki bentuk yang berongga seperti keranjang sehingga dapat digunakan seperti sistem tamu-inang, dengan kaliksarena berperan sebagai inang dan ion atau molekul lain berperan sebagai tamunya (Linane dan shinkai dalam Hilmiyana, 2013). Modifikasi kitosan dengan kaliksirena telah dilakukan oleh Tabachi dan Mustafa (2008) yang berhasil menyintesis dan mengaplikasikan senyawa kaliks[4]arena (p-t-butilkaliks[4]arena dengan gugus dinitril mono karboksilat) berbasis kitosan menghasilkan polimer p-t-butilkaliks[4]arena. Pengikatan p-t-butilkaliks[arena] pada kitosan akan meningkatkan kapasitas adsorpsi terhadap adsorbat dibandingkan kitosan tanpa p-t-butilkaliks[4]arena (Restuti, 2012).
Kemampuan kitosan maupun kitosan p-t-butilkaliks[4]arena terhadap logam Cu2+ dipengaruhi oleh beberapa faktor, antara lain derajat keasaman (pH) awal
larutan, waktu kontak antara adsorben dengan adsorbat dan konsentrasi awal adsorbat. Variasi pH dilakukan untuk mengetahui pH optimum dari adsorben dalam proses adsorpsi. Derajat keasaman (pH) optimum dicapai pada variasi pH yang mempunyai kemampuan adsorpsi tinggi.
Proses adsorbsi dilakukan pada pH asam dan basa. Kondisi optimum yang diharapkan yaitu pada pH yang tidak terlalu asam dan tidak terlalu basa, dikarenakan apabila pada kondisi asam, proton dari asam justru akan menganggu proton dari logam Cu2+ disebabkan adanya kompetisi antar proton yang mengikat gugus aktif pada kitosan.
Laju reaksi adsorpsi oleh kitosan p-t-butilkaliks[4]arena dan kitosan ditentukan dari jenis model kinetikanya mengikuti pseudo orde satu (model kinetika Lagergren) atau pseudo orde dua (mengikuti kinetika Ho) dengan memvariasikan waktu kontak antara adsorben dengan adsorbat.
Isoterm adsorpsi yang terjadi dapat diketahui dengan variasi konsentrasi Logam Cu2+ sehingga akan diketahui jenis adsorpsinya. Semakin tinggi konsentrasi
akan semakin banyak zat yang teradsorpsi hingga mengalami kesetimbangan pada konsentrasi tertentu. Persamaan isoterm yang sesuai adalah isoterm Langmuir. Karena kitosan p-t-butilkaliks[4]arena dan kitosan mempunyai gugus aktif yang dimungkinkan terjadi ikatan kimia dengan logam Cu2+. Berdasarkan jenis isoterm juga diperoleh energi adsorpsi dan kapasitas maksimum adsorpsi.
Karakteristik adsorben sebelum dan sesudah adsorpsi juga dapat mendukung apakah proses adsorpsinya berlangsung atau tidak. Karakterisasi menggunakan spektroskopi FTIR untuk mengetahui pergeseran dari gugus fungsi dan SEM-EDX untuk mengetahui bentuk morfologi dan komposisi dalam adsorben.
C. Hipotesis
Berdasarkan penulusuran literatur dan juga penelitian sebelumnya serta landasan teori maka hipotesis penelitian ini dapat disusun sebagai berikut :
a. Adsorpsi logam Cu2+ oleh kitosan p-t-butilkaliks[4]arena dan kitosan akan
mencapai maksimum pada pH tidak terlalu asam dan tidak terlalu basa. b. Kinetika reaksi dari adsorpsi logam Cu2+ menggunakan kitosan
p-t-butilkaliks[4]arena dan kitosan cenderung mengikuti model pseudo orde dua (Ho).
c. Adsorpsi logam Cu2+ oleh kitosan dan kitosan p-t-butilkaliks[4]arena cenderung mengikuti isoterm Langmuir.
d. Kapasitas adsorpsi logam Cu2+ oleh kitosan p-t-butilkaliks[4]arena lebih besar dibanding kapasitas adsorpsi oleh kitosan.
![Gambar 4. Struktur molekul p-t-butilkaliks[4]arena (Gutsche, 1998).](https://thumb-ap.123doks.com/thumbv2/123dok/2238669.2177340/9.892.348.605.171.403/gambar-struktur-molekul-p-t-butilkaliks-arena-gutsche.webp)
![Gambar 5. Struktur kitosan p-t-butilkaliks[4]arena (Restuti, 2012)](https://thumb-ap.123doks.com/thumbv2/123dok/2238669.2177340/10.892.259.672.575.868/gambar-struktur-kitosan-p-t-butilkaliks-arena-restuti.webp)