1 UJI HISTOPATOLOGI ORGAN REN, INSANG, GINJAL, INTESTINUM DAN HEPAR
IKAN MAS (Cyprinus caprio)
Histopathology TEST ORGAN REN , GILLS , KIDNEY , intestinal hepatic COMMON CARP ( Cyprinus Caprio )
Oleh
Muhammad Rizki1, Tia Rostiana S.M2, Bastian Damanik3 Email : muhammadrizki02666@gmail.com
Fakultas Perikanan dan Ilmu Kelautan, Universitas Padjadjaran, 45363, Indonesia ABSTRAK
Ikan mas merupakan ikan yang memenuhi syarat bahan uji karena bersifat reaktif terhadap racun. Pestisida merupakan bahan yang digunakan untuk mengendalikan organisme pengganggu namun memiliki efek racun terhadap mahluk hidup yang bukan sasarannya dan efek terhadap lingkungan sehingga ikan yang terkena racun dapat di identifikasi dengan histopatologi. Histopatologi adalah cabang biologi yang mempelajari kondisi dan fungsi jaringan dalam hubungannya dengan penyakit. Adapun tujuan dari penelitian ini yaitu agar memahami dan mampu menginterprestasi kerusakan jaringan(organ) ikan melalui preparat histopatologi. Adapun parameter yang diamati adalah warna, ukuran, tanda hitam, dan karakter khusus lainnya pada sel ikan. Hasil penelitian menunjukkan pada organ insang patologis terdapat necrosis dan hyperplasia. Pada organ hati kerusakan yang terjadi yaitu adanya rongga (hyperplasia). Organ intestinum pun terjadi kerusakan yaitu adanya necrosis. Sedangkan pada ginjal(ren) kerusakan yang terjadi yaitu nekrosis dan jaringan menjadi melebar dan memanjang.
Kata kunci : Ikan Mas, Pestisida, Histopatologi
ABSTRACT
Carp is a fish that qualify the test material because it is reactive to toxins. Pesticides are the materials used to control pests but have toxic effects on living organisms and non-target effects on the environment so that fish exposed to toxic ang can be identified with histopathology. Histopathology is the branch of biology that studies the condition and function of the network in relation to disease. The purpose of this study is to understand and are able to interpret the tissue damage (organ) fish through histopathological preparations. The parameters measured were the color, size, black marks and other special characters in fish cells. The results showed there were pathologically organ-gill necrosis and hyperplasia.Pada liver damage that occurs is a cavity (hyperplasia). Intestinal organ damage ensued that the presence of necrosis. While in the kidney (ren) that the damage and tissue necrosis became dilated and elongated.
2 PENDAHULUAN
Pada umumnya pestisida yang
digunakan untuk mengendalikan organisme pengganggu adalah biosida yang tidak saja
bersifat racun terhadap organisme
pengganggu sasaran,tetapi juga dapat memberikan pengaruh yang tidak diinginkan
terhadap organisme bukan sasaran,
termasuk manusia serta lingkungan hidup. Salah satu organisme bukan sasaran yaitu ikan. Pestisida yang mengenai badan air kemudian masuk ke lingkungan perairan tentu saja akan memberikan dampak buruk bagi organisme perairan seperti ikan. Untuk
mengetahuinya dapat dilakukan uji
histopatologi terhadap ikan yang terindikasi terkena paparan pestisida tersebut.
Histopatologi adalah cabang biologi yang mempelajari kondisi dan fungsi
jaringan dalam hubungannya dengan
penyakit. Histopatologi sangat penting dalam kaitan dengan diagnosis penyakit karena salah satu pertimbangan dalam
penegakan diagnosis melalui hasil
pengamatan terhadap jaringan yang diduga terganggu.
Analisis histopatologi dilakukan dengan membandingkan kondisi jaringan
sehat terhadap jaringan sampel dapat diketahui apakah suatu penyakit yang diduga benar-benar menyerang atau tidak.
Adapun cara pembuatan preparat histopatologi jaringan hewan mula-mula dengan menyiapkan jaringan segar dalam pengamatan mikroskopis yaitu dengan cara fiksasi. Tujuan dilakukannya fiksasi adalah mencegah terjadi kerusakan pada jaringan, menghentikan proses metabolisme secara cepat, mengawetkan komponen sitologis dan
histologis, mengawetkan keadaan
sebenarnya, mengeraskan materi yang lembek, dan jaringan-jaringan dapat diwarnai sehingga bisa diketahui bagian-bagian jaringan (Affuwa 2007)
Selanjutnya tahap dehidrasi,
dehidrasi dilakukan setelah fiksasi dengan tujuan untuk mengeluarkan air dari jaringan, ini merupakan prinsip dari teknik parafin yaitu air dikeluarkan dan diganti dengan parafin sehingga blok jaringan mudah dipotong, ini dilakukan 2 tahap yakni dehidrasi dan penjernihan. Proses dehidrasi dilakukan dengan memasukkan jaringan yang sudah difiksasi kedalam larutan alkohol berturut-turut dari kadar 70% sampai 100% (Robby 2000)
3 Selanjutnya dengan proses clearing,
untuk memungkinkan paraffin dapat masuk ke dalam sel, haruslah alkohol di dalam organ diganti dengan zat yang mudah mengusir alkohol tetapi kemudian harus bisa diusir oleh paraffin. Clearing atau dealkoholisasi ini dapat menggunakan aceton, benzol,toluol, dan xilol. Proses clearing dapat dilakukan selama 24 jam (Jvetunud 2008).
Setelah dilakukan proses Clearing kemudian Embedding dilakukan dengan
membuat kotak kertas. Beberapa
keuntungan menggunakan kotak kertas yaitu bisa membuat arah sayatan dan menandai jaringan. Sebelum jaringan atau sampel ditanam maka terlebih dahulu paraffin dalam kotak harus membeku pada bagian dasarnya sehingga memungkinkan objek tidak langsung menempel pada dasar kertas. Blok paraffin yang akan disayat dulu maka dibentuk dulu (trimming). Bentuk blok disesuaikan dengan bentuk pitanya yang diinginkan. (Botanika 2008).
Tahap selanjutnya yaitu pemotongan
jaringan dengan menggunakan pisau
mikrotom. Proses ini disebut cutting
menggunakan pisau mikrotom. Pisau
mikrotom merupakan pisau khusus yang digunakan untuk pemotongan preparat histologis jaringan. Proses sectioning
diawali dengan pengirisan blok parafin dengan scalpel, sehingga permukaan blok parafin yang akan diiris dengan mikrotom berbentuk segi empat. Irislah sedemikian rupa, sehingga preparat akan terletak tepat berada di tengah blok (Botanika 2008).
Prosedur terakhir yang dilakukan pada jaringan jantung adalah proses pewarnaan atau staining. Hal ini dilakukan agar memperjelas bagian-bagian jaringan pada jantung ikan nila saat pengamatan, dalam proses pewarnaan menggunakan haematoxilin berwarna biru yang berfungsi memberikan warna pada inti sel, xylene yang berfungsi untuk membersihkan parafin, eosin yang berwarna merah bersifat asam tujuannya untuk melawan sitoplasma, dan rehidrasi dengan alkohol 96% - 70% sebagai media penghantar untuk proses pewarnaan dengan HE. Apabila proses ini tidak dilakukan maka akan mempersulit pada saat pengamatan di bawah mikroskop.
Beberapa bagian tubuh ikan yang biasanya dijadikan sampel untuk uji histopatologis adalah insang, ginjal, hati, usus dan jantung. Pada insang, sel-sel yang berperan dalam osmoregulasi adalah sel-sel
chloride yang terletak pada dasar
lembaranlembaran insang. Studi mengenai fungsi dan biokimiawi insang teleostei mengindikasikan bahwa insang teleostei
4 merupakan pompa ion untuk chloride (Cl-),
sodium (Na+) dan potasium (K+). Ion Na+
dibutuhkan dalam proses pemompaan
NH4+dan H+ dari dalam tubuh ikan ke lingkungannya (Kusrini dkk 2007).
Ginjal adalah organ ekskresi dalam vertebrata yang berbentuk mirip kacang. Sebagai bagian dari sistem urin, ginjal berfungsi menyaring kotoran (terutama urea) dari darah dan membuangnya bersama dengan air dalam bentuk urin. Sel-sel yang bertanggung jawab pada penyaringan ini adalah glomerulus, yamg disebut kapsul bowman. Sedangkan yang berfungsi sebagai reabsorpsi ion adalah tubuli ginjal (Kusrini dkk 2007).
Hati adalah sebuah organ yang
memainkan peran penting dalam
metabolisme dan memiliki beberapa fungsi
dalam tubuh termasuk penyimpanan
glikogen, sintesis protein plasma, dan penetralan racun (Kusrini dkk, 2007).
Intestinum (usus) ikan terdiri dari sel enterosit (memiliki villi berbentuk menyerupai sarang tawon) dan mukosit (sel goblet penghasil lendir), segmenterpanjang dari saluran pencernaan, bagian depannya terdapat dua saluranyang masuk didalamnya yang berasal dari kantung empedu (ductus choledochus) dan pancreas.
Peranan jantung sangat penting dalam hubungannya dengan pemompaan darah ke seluruh tubuh melalui sistem sirkulasi darah. Sirkulasi darah adalah sistem yang berfungsi dalam pengangkutan dan penyebaran enzim, zat nutrisi, oksigen, karbondioksida, garam-garam, antibodi, senyawa N, dari tempat asal ke seluruh bagian tubuh sehingga diperlukan tekanan yang cukup untuk menjamin aliran darah sampai ke bagian-bagian jaringan-jaringan tubuh (Kusrini dkk 2007).
Penelitian ini bertujuan untuk mengetahui histopatologi insang, ginjal, hati dan usus ikan mas (Cyprinus carpio) akibat pemaparan pestisida.
METODE PENELITIAN
Penelitian ini dilakukan pada hari Rabu 18 November 2015, 10.00 WIB di
Laboratorium Manajemen Sumberdaya
Perairan, gedung dekanat Fakultas
Perikanan dan Ilmu Kelautan, Universitas Padjadjaran.
Alat yang digunakan pada praktikum ini yaitu microscope binokuler, minyak imersi dan atlas “fish histopatology”, bahan yang digunakan yaitu preparat histopatologi ikan mas akibat pemaparan pestisida.
Prosedur yang digunakan pada penelitian ini yaitu diamati preparat
5 histologi organ insang (gill), ginjal (Ren),
hati (hepar), intestinum, dan ren dari ikan uji normal dan telah diberi toksik, kemudian dilakukan perbandingan antara keduanya berdasarkan warna, ukuran, ada tidaknya neukrosis atau tanda dan karakter khusus lainnya selanjutnya masing-masing preparat
histologi organ hewan uji
didokumentasikan.
Prosedur pembuatan preparat yaitu : pembedahan ikan, fiksasi, pencucian, dehidrasi, clearing, infiltrasi, embedding, sectioning, afixing, deparafinisasi, staining, moulting dan labeling.
HASIL DAN PEMBAHASAN
Berdasarkan pengujian histopatologi terhadap beberapa organ ikan mas, ditemukan perbedaan antara organ yang normal dan yang terkena patogen.
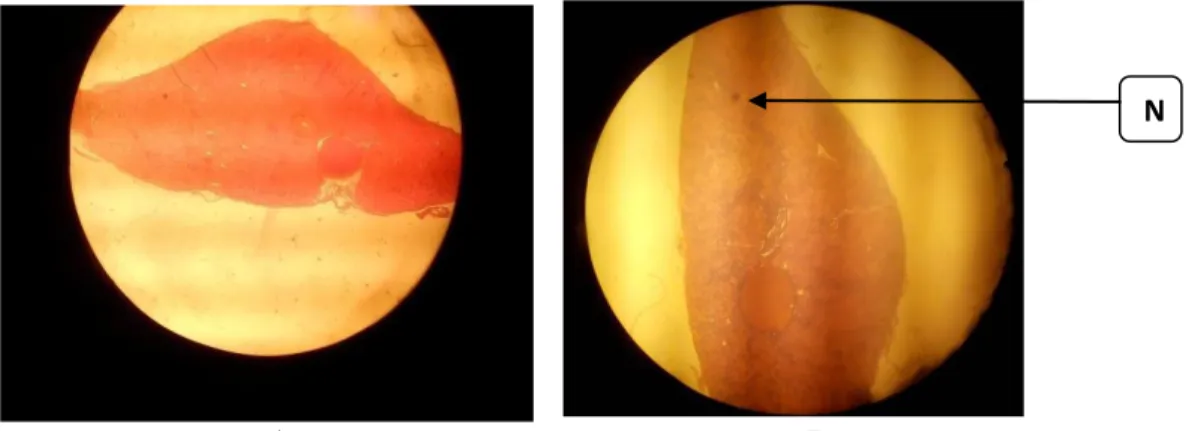
Organ Ren
Setelah dilakukan pengamatan, didapatkan hasil sebagai berikut :
A B
Gambar 1. Kontrol Organ Ren (A), Patologis Organ Ren (B) Keterangan : Nekrosis (N)
Tabel 1. Hasil Pengamatan Preparat Analisis Histopatologi Ren
Parameter Kontrol Patologis
Warna Merah cerah Merah kehitaman
Ukuran Normal Besar
Tanda Hitam (Necrosis) Tidak ada necrosis Terdapat necrosis
Karakter Khusus Normal Hyperplasia
Hasil pengamatan, antara ginjal kontrol dan ginjal patologis terdapat perbedaan, mulai dari warna yang cenderung lebih
merah kehitaman pada ginjal patologis. Kemudian ukuran ginjal patologis yang juga lebih besar dibandingkan dengan kontrol.
6 Hal ini disebabkan karena terjadinya
peradangan akibat adanya bahan toksik. Peradangan adalah respons fisiologi lokal terhadap cedera jaringan. Radang bukan suatu penyakit melainkan suatu manifestasi suatu penyakit. Peradangan merupakan reaksi infeksi akibat masuknya toksik dari dalam darah. Ada beberapa penyebab terjadinya radang salah satunya yaitu zat kimiawi misalnya korosif, asam, basa, agen pengurang dan toksin bakteri. Bahan kimiawi yang menyebabkan korosif akan merusak jaringan, yang kemudian akan memprofokasi terjadinya proses radang. Disamping itu, agen penyebab infeksi dapat melepaskan bahan kimia spesifik yang mengiritasi dan dapat mengakibatkan peradangan (Harjono, 1996).
Selain itu, dilihat dari adanya noktah/tanda hitam pada ginjal patologis ikan mas. Tanda hitam tersebut merupakan
nekrosis, yang terjadi akibat adanya sel yang mati. Menurut Anderson (1976)nekrosis merupakan kematian sel atau jaringan yang bersifat irreversible atau tidak dapat disembuhkan. Penyebab nekrosis cukup beragam diantaranya adalah toksin bakteri, bahan kimia yang korosif, agen fisik seperti suhu tinggi dan melemahkan kemampuan suplai darah, nekrosis ditandai dengan rusaknya nukleus (bentuk ireguler, kromotin memadat, nukleolus hilang). Nekrosis dapat disebabkan karena epitel tubulus dari ginjal ikan terpapar logam berat sebagai suatu zat yang bersifat toksik.
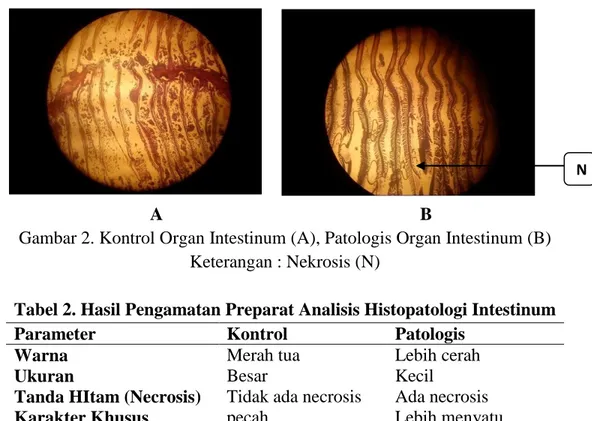
7 Organ Intestinum
Setelah dilakukan pengamatan, didapatkan hasil sebagai berikut :
A B
Gambar 2. Kontrol Organ Intestinum (A), Patologis Organ Intestinum (B) Keterangan : Nekrosis (N)
Tabel 2. Hasil Pengamatan Preparat Analisis Histopatologi Intestinum
Parameter Kontrol Patologis
Warna Merah tua Lebih cerah
Ukuran Besar Kecil
Tanda HItam (Necrosis) Tidak ada necrosis Ada necrosis
Karakter Khusus pecah Lebih menyatu
Perbedaan usus ikan mas pada kontrol dengan usus yang telah diberikan bahan toksik terlihat dari warnanya, pada usus kontrol terlihat usus berwarna merah cerah sedangkan pada patologisnya usus berwarna merah tua, dari ukurannya yang awalnya berukuran normal menjadi lebih kecil atau usus terlihat mengecil yang dapat disebut dengan hipoplasia. Selain terlihat dari warna dan ukurannya terlihat pula dari ada tidaknya noktah hitam/putih pada usus.
Pada usus kontrol tidak terlihat noktah-noktah sedangkan pada patologisnya terlihat noktah berwarna hitam. Ada pula karkater khusus untuk membandingkan usus kontrol dan patologisnya, yaitu pada usus kontrol bentuknya bulat dan sel nya utuh atau rapat sedangkan pada usus patologis selnya mengalami perenggangan.
8 Organ Insang
Setelah dilakukan pengamatan, didapatkan hasil sebagai berikut :
A B
Gambar 3. Kontrol Organ Insang (A), Patologis Organ Insang (B) Keterangan : Necrosis (N), Hyperplasia (H)
Tabel 3. Hasil Pengamatan Preparat Analisis Histopatologi Insang
Parameter Kontrol Patologis
Warna Merah muda Merah kehitaman
Ukuran Normal Lebih besar
Tanda Hitam (Necrosis) Tidak ada necrosis Terdapat necrosis Karakter Khusus Lamela tersusun rapi Lamela berdempetan
Perbedaan insang ikan mas pada kontrol dengan insang yang telah diberikan bahan toksik terlihat dari warnanya, pada insang kontrol terlihat insang berwarna merah sedangkan pada patologisnya insang pucat berwarna merah keunguan, dari ukurannya yang awalnya berukuran normal dengan lamela tipis menjadi berukuran lebih besar dengan lamela yang menebal atau disebut juga hiperplasia. Selain terlihat dari warna dan ukurannya terlihat pula dari ada tidaknya noktah hitam/putih pada insang.
Pada insang kontrol tidak terlihat
noktah-noktah hitam/putih sedangkan pada
patologisnya terlihat ada noktah hitam. Noktah/tanda hitam ini disebut juga dengan nekrosis. Akibat kondisi sel yang tidak mampu lagi untuk memperbaiki kerusakan sel, maka akan menyebabkan terjadinya kematian sel atau nekrosis (Robbins dan Kumar, 1995).
Ada pula karkater khusus untuk
membandingkan insang kontrol dan
9 ada karakter khusus sedangkan pada insang
patologis lamelanya mengalami penebalan, cenderung mengalami pembengkakan. Hal ini diakibatkan pemaparan bahan toksik yang menyebabkan terjadinya perubahan fisiologis pada organ insang.
Selain hyperplasia terdapat juga kerusakan lain yaitu fusion yang dapat mempengaruhi pernafasan ikan. Terjadinya fusion disebabkan karena luka pada lamela
sekunder memaksa organ tersebut
mengeluarkan banyak lendir untuk menutupi luka tersebut sehingga terjadi pendempetan antara lamela sekunder yang satu dengan lainnya. Selain fusion terjadi karena lamela mengalami pembengkakan atau hyperflasia sehingga proses pernafasan terganggu.
Keadaan ini mengakibatkan ukuran rongga (kapiler lumen) mengalami penyempitan dan sel yang berada di tengah lamela sekunder bergeser ke ujung lamela sekunder lainnya sehingga terjadi pendempetan (Anugrah dalam Ramli 2008).
Insang berfungsi sebagai alat pernafasan pada ikan, dan lamela adalah tempat pertukaran oksigen. Jika terjadi kerusakan pada lamela tersebut, akibatnya peredaran
darah ikan terganggu, dan terjadi
pembendungan darah. Semakin lama,
kerusakan ini akan menyebabkan gangguan sirkulasi yang dapat mengakibatkan suplai oksigen berkurang.Pada akhirnya, akan terjadi efek letal pada ikan karena terganggunya sistem pernafasan.
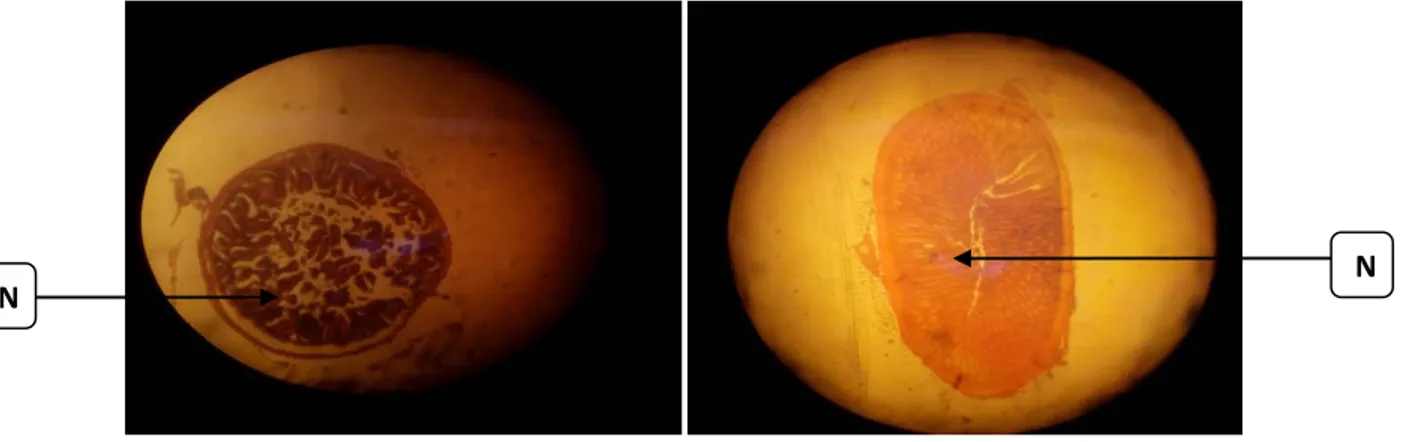
Organ Ginjal dan Insang Patologis
A B
Gambar 4. Organ Ginjal Patologis (A), Organ Insang Patologis (B) Keterangan : Necrosis (N)
10 Tabel 4. Hasil Pengamatan Preparat Analisis Histopatologi Hati
Parameter Patologis
Ginjal
Patologis Insang
Warna Merah Merah hati
Ukuran Besar Lebih besar
Tanda Hitam (Necrosis)
Terdapat necrosis Terdapat necrosis Karakter Khusus Terdapat cincin
hitam
Lamella padat
Hasil pengamatan dapat
dibandingkan antara ginjal yang
patologis dan insang yang patologis pada warna, warna pada ginjal patologis lebih merah dibandingkan dengan insang yang patologis. Selain dari warna dapat dilihat juga dari ukuran, tetapi dari ukuran ginjal dan insang yang patologis
sama-sama besar, berarti mengalami
pembengkakan. Pada ginjaldan insang patologis juga terdapat nekrosis. Tetapipada ginjal patologis terdapat cincin hitam pada karakter khususnya sedangkan pada insang lamella menjadi padat.
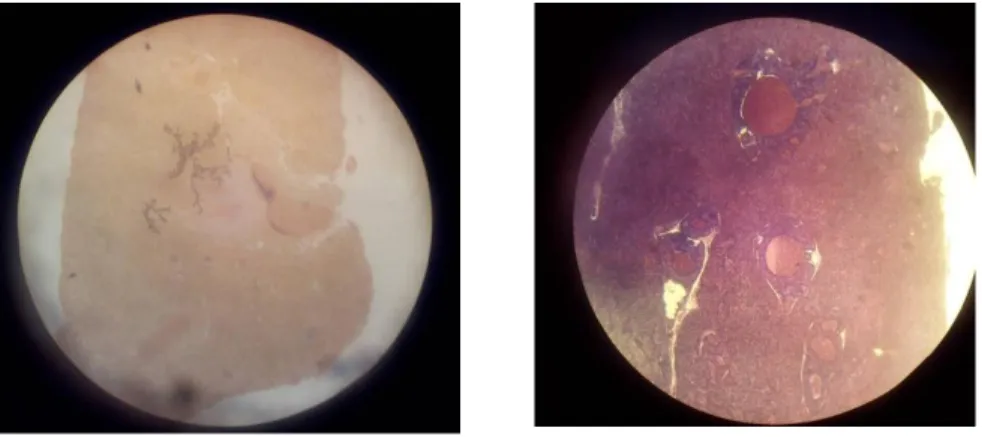
Organ Hati
Hasil pengamatan menunjukkan bahwa pada jaringan hati ikan mas normal, belum terlihat perubahan baik dari warna, ukuran, maupun gejala adanya nekrosis. Warna terlihat merah cerah dan bening, ukuran hati masih normal dan tidak adanya nekrosis. Struktur sel masih teratur dan tidak rusak atau tidak ada rongga yang di akibatkan kematian sel.
Pada pengamatan preparat hati
patologis, terjadi perubahan struktur jaringan hati. Perubahan struktur jaringan sel hati yang disebabkan oleh zat kimia yang bersifat racun antara lain perlemakan hati, nekrosis dan sirosis (Lu 1995). Gambar tersebut memperlihatkan kerusakan sel hati ikan mas. Kerusakan berat sel hati adalah kematian sel atau sering disebut nekrosis.
11
A B
Gambar 5. Kontrol Organ Hati (A), Patologis Organ Hati (B)
Tabel 5. Hasil Pengamatan Preparat Analisis Histopatologi Hati Parameter Kontrol Patologis
Warna Merah hati Merah kehitaman Ukuran Normal Lebih besar Tanda Hitam (Necrosis) Tidak ada necrosis Tidak ada necrosis Karakter Khusus Rapat dan menggumpal Agak renggang dan pecah
Gambar di atas mununjukan adanya kerusakan jaringan yang mengakibatkan adanya sel-sel mati (nekrosis) dan tidak ada penggantian sel sehingga terbentuknya rongga di dalam jaringan tersebut.
Necrosis menggambarkan keadaan dimana terjadi penurunan aktivitas jaringan yang ditandai dengan hilangnya beberapa bagian sel satu demi satu dari satu jaringan sehingga dalam waktu yang tidak lama akan mengalami kematian. Necrosis dapat terjadi karena denaturasi protein plasma, dan
pemecahan oraganel sel. Dapat juga disebabkan karena terinfeksi bakterial sehingga menyebabkan terakumulasinya sel darah putih.
Pada sel hati patologis, terjadi hiperplansia yang mengakibatkan sinusoid menyempit sehingga aliran darah terganggu
dan terdapat banyak nekrosis yang
menyebabkan rongga pada jaringan hati tersebut.
Pembengkakan sel atau degenerasi vakuola bersifat reversibel sehingga apabila
12 paparan zat toksik tidak berlanjut maka sel
dapat kembali normal. Namun jika pengaruh zat toksik berlangsung lama maka sel tidak dapat mentolerir kerusakan yang diakibatkan oleh zat toksik tersebut. Hal tersebut juga didukung oleh Hinton dan Lauren, yang melaporkan bahwa dengan terpaparnya cadmium maka menyebabkan terjadinya pembengkakan hepatosit sebagai akibat langsung dari zat toksik yang berpengaruh langsung pada mekanisme transpor ion.
Simpulan
Berdasarkan pengamatan, dapat diperoleh kesimpulan bahwa :
• Pada pengamatan preparat kontrol dan preparat yang terkena toksik itu berbeda.
• Kerusakan jaringan yang terjadi antara lain necrosis, hyperplasia, hypoplasia, dan fusion.
• Kerusakan jaringan akibat kematian patologis satu atau lebih sel (Necrosis) terdapat pada organ insang, organ intestinum, dan organ ginjal.
• Kerusakan akibat perbanyakan sel – sel yang tak terkendali (hyperplasia) terdapat pada organ insang.
• Kerusakan akibat
pengecilan/penyempitan
organ(hypoplasia) terdapat pada organ intestinum.
• Fusion hanya terdapat pada insang yang mengakibatkan pernafasan ikan terganggu.
Daftar Pustaka
Affuwa. 2007.Jaringan pada
Hewan.http://affuwa.wordpress.com. Diakses pada tanggal 11 Nopember 2014.
Anderson, P.S.1976. Patofisiologi Konsep Klinis Proses-Proses Penyakit. Alih bahasa: Peter Anugerah. Jakarta: EGC. Penerbit Buku Kedokteran.
Bavelander G, dkk. 1998. Dasar-Dasar Histologi. Erlangga. Jakarta.
Botanika. 2008. Fixation mbedding
sectioning.http//botanika.biologija.or g. Diakses tanggal 11 Nopember 2014.
EDMONSON, W. T., 1958. Fresh Water Biology. 2 nd. John Wiley and Sons, inc NewYork.
Effendie, M. I. 1997. Biologi perkanan.
Yayasan Pustaka nusantara.
Yogyakarta. 163 hal.
EVY,R., ENDANG MUJIANI dan K. SUJONO.2001. Usaha Perikanan di Indonesia.Mutiara Sumber Widya. Jakarta. 96 hal.
Fujaya, Y, 2004. Fisiologi Ikan. Dasar Pengembangan Teknologi Perikanan. Rineka Cipta. Jakarta
13 Harjono, R. M., Andry Hartono, Surya S.
1996. Kamus Kedokteran Dorland. Jakarta: Penerbit Buku Kedokteran EGC. Anatomi Organ Pencernaan Ikan Nila Merah Oreochromis sp. ITB. Bogor.
Hinton DE, Lauren DJ. 1990. Integrative
histopathological effects of
environmental stressors on fishes.
American Fisheries Society
Symposium; 8: 51–66.
Jvetunud. 2008. Parafin
Hewan.http://www.jvetunud.com. Diakses tanggal 11 Nopember 2014.
Kusrini, Eni, Nurul Hanum Kharisma, Adi Sucipto, Marlina Ahmad, 2007. Lu, C.F. 1995. Toksikologi Dasar. Jakarta:
Universitas Indonesia.
Robby N, dkk. 2000. Histologi. Fakultas Kedokteran Universitas Hasanuddin. Makassar.
Wahyuningsih, Hesti dan Dr. Ing Ternala Alexander Barus. 2006. Buku Ajar Ikhtiologi. Universitas Sumatera Utara.
14 LAMPIRAN
Gambar 6. Prosedur Kerja
Gambar 7. Prosedur Pembuatan Preparat Mengamati preparat
histology (Insang, Ren, Ginjal, Hati, dan Usus)
Membandingkan perbedaan antara keduanya
Mendokumentasihan hasil yang diamati dan mencatat perandingannya Dedah ikan Awetkan Fiksasi Dehidrasi Clearing Infiltrasi sectioning Embiiding Affixing Defarafinisasi staining Miuting