KUMPULAN LAPORAN HASIL PENELITIAN TAHUN 2004 ISBN.978-979-99141-2-5
PENETAPAN MANGAN (Mn) DENGAN PEREAKSI TEA DAN PERIODAT SECARA SPEKTROFOTOMETRI
(P2BGGN/PGN- TPBGN/P/08/2004) Oleh : Rusydi S, Budi Sarono, Sumiarti, Sujono
ABSTRAK
PENTAPAN MANGAN (Mn) DENGAN PEREAKSI TEA DAN PERIODAT SECARA SPEKTROFOTOMETRI. Untuk menunjang penelitian pemumian air tanah dari unsur mangan (Mn), maka perlu dilakukan penelitian penetapan mangan (Mn) dengan tujuan untuk mendapatkan metoda analisis Mn dengan spektofotometer menggunakan pereaksi TEA dan KI04. Variabel yang diamati dari kompleks berwama adalah: spketrum, kondisi larutan kompleks, konsentrasi pereaksi, linieritas, limit deteksi, unsur pengganggu, kestabilan kompleks, pemakaian sulfat, penambahan kalium iodat. Hasil penelitian dengan pereaksi TEA adalah panjang gelombang maksimum spektum Mn- TEA 745 urn dengan kondisi pH
11,5 dan pemakain TEA 1ml. Kompleks berwama Mn- TEA stabil sampai 7 jam, kurva standar komplek Mn- TEA terlihat linier 1-40 ppm dan deteksi limit unsur Mn menggunakan pereaksi TEA dengan spektrofotometer UV 2101 adalah 1,06 ppm, unsur pengganggu relatif tidak ada. Dengan pereaksi periodat panjang gelombang maksimum MN04 adalah 525 urn dengan kondisi 1 ml asam sulfat pekat, 2 ml asam fosfat pekat dan 0,15 sid 0,3 gram KI04 dengan linieritas 0,5-8 ppmMn. Kompleks berwama Mn04 stabil sampai 7 jam dan limit deteksi adalah 0,50 ppm. Un sur pengganggu adalah Fe, apabila reaksi oksidasi tidak sempuma. Metoda penentuan Mn- TEA sangan baik digunakan apabila konsentrasi Mn< 40 ppm, sedangkan dengan pereaksi perioadat konsentrasi Mn< 6 ppm.
Kata kunci : Mangan, Tea dan periodat, spektrometri. ABSRACT
DETERMINATION OF MANGAN (Mu) BY SPECTROFOTOMETRIC USING TEA AND PERIODATE REAGENTS. To support a research manganese element purification of ground water, it is necessary doing the experiment which the purpose to get method for determination of Mn element content in waterby spektrofotometri using TEA and KI04. The experiment parameter are measuring of spektrum of Mn- TEA and Mn04 complex solution, concentration of reagents, detected limit, interfere elements, complex solution stability, concentration of sulphuric acic and potasium periodate. The results of experiment using TEA are maximum wavelength of coloring complex Mn-TEA 745 urn, pH condition 11.5 using 1 ml TEA. The coloring complex stable for 7 hours, the standard curve linier from 1 to 40 ppm, detected limit for Mn by spectrophotometric UV 2101 1.06 ppm, and none interfere element. Using periodate reagent are maximum wavelength of Mn04 525urn, using 1 ml of H2S04 concentrated, 2 ml of H3P04 concentrated, 0.15 to 0.30 gr KI04. The linierity 0.5 to 8 ppm, coloring complex of Mn04 stable for 7 hours, detected limit 0.5 ppm, and intefere element Fe if oxidation uncomplete. Determination of Mn using TEA reagent is suitable for Mn< 40 ppm, while using periodate reagent is suitable for Mn< 6 ppm.
Key word: Mangan, Tea and Periodate, spectrometric.
302 PUSA T PENGEMDANGAN GEOLOGI NUKLIR-DA TAN
KUMPULAN LAPORAN HASIL PENELITIAN TAHUN 2004
PENDAHULUAN
ISBN.978-979-99141-2-5
Mangan (Mn) pertama kali dikenal sebagai unsur oleh seorang ahli kimia Swedia, C.W Schule pada tahun 1774. Mangan ban yak digunakan di pabrik kimia, sebagai desinfektan (KMn04),pupuk, pewama gelas, batu bata, keramik, cat dan sebagai flux dalam lelehan bijih emas dan perak. Sebagai bahan mentah, Mn digunakan baik dalam kimia organik maupun anorganik sebagai oksidator, katalis dan intermediasi bahan kimia. Terdapat lebih dari 100 mineral yang mengandung mangan. Mineral-mineral tersebut bervariasi dari mineral yang komposisinya didominasi mangan hingga mineral yang persentase mangannya rendah. Mineral-mineral terse but antara lain: haumannite (Mn304), polianite (Mn02),
pyrolusite (Mn02), cryptomelane (KRgOI6R), psi/omelane (Ba Mn MngOI6), manganite (Mn203 H20) dan braunite (3 Mn203 MnSi03)
[I].
Mn merupakan unsur minor yang terlarut dalam air tanah dalam jumlah kecil.Tujuan dari penelitian ini untuk mendapatkan metoda analisis Mn secara spektrofotometri guna menunjang penelitian pemumian air tanah dari unsur mangan (Mn) menggunakan zeolit alamo Pada penelitian metoda analisis Mn ini menggunakan pereaksi TEA dan periodat karena bahan mudah didapat dengan harga yang murah dan mudah dalam pelaksanaannya .. Adapun variabel yang diamati untuk pereaksi TEA adalah spektrum dari Mn dengan TEA, kondisi larutan kompleks, konsentrasi pereaksi, limit deteksi, unsur pengganggu, kestabilan kompleks. Sedangkan untuk pereaksi periodat variabel yang diamati adalah spektrum Mn-periodat, pemakaian suifat, penambahan kalium iodat, deteksi limit, unsur pengganggu dan kestabilan kompleks
Teori
Penetapan Mn secara spektrofototmetri dilakukan berdasarkan pada metode kolorimetri, Mn membentuk senyawa kompleks berwama dengan ligan yang ditambahkan, intensitas cahaya yang diserap cairan berwama sebanding dengan konsentrasi dari larutan yang dilalui, hal ini sesuai dengan Hukum Lambert-Beer e]. Dalam penelitian ini dipakai senyawa pengompleks TEA dan senyawa oksidan periodat. Kompleks Mn dengan TEA dan Periodat akan menjadi sempuma apabila berada dalam keadaan optimum dari variabel yang berpengaruh.
KUMPULAN LAPORAN BASIL PENELITIAN TABUN 2004 ISBN.978-979-99141-2-S
Mn, Tc dan Rc termasuk grup VII A pada Tabel Periodic. Keberadaan Mn di alam dalam bentuk kelumit (tracer) memainkan peran penting dalam pisiologi, biologi dan metalurgi. Un sur Mn terdistribusi secara luas dan sangat bervariasi antara 10-8 - 10-3 dalam
mineral, tumbuhan dan hewan.
Penentuan Mn biasa dilakukan melalui analisis volumetri, spektrofotometri, AAS, "flame photometri" dan polarograpfi. Pada umumnya analisis Mn dilakukan secara spektrofotometri, berdasarkan absorsi ion permanganat dalam larutan (Mn04-) yang mempunyai panjang gelombang antara 450 run sampai dengan 590 nm dan mempunyai puncak pada 525 dan 550 run terbentuk karena terjadinya oksidasi Mn II, Mn III dan Mn IV menjadi ion Mn-4
e].
Oksidator yang banyak digunakan adalah persulfat, bismutat dan periodat, kompleks ion berwarna yang terbentuk bisa dipengaruhi pada saat pengukuran, namun dapat dihindari dengan menggunakan larutan blanko yang diperIakukan sarna dengan contoh tanpa oksidator. Reaksi yang terjadi:Dengan TEA 3 Mn
+
N(CHz-CHOH) ~- N(Mn)3+
(CHz-CHOH) []4Mangan mempunyai sifat kelarutan yang relatif tinggi, sehingga banyak ditemukan dalam air dan keberadaanya dalam jumlah yang besar berupa logam berat. Dalam air baku tidak baik untuk kesehatan, jika melebihi nilai ambang yang diperbolehkan menurut Biro Teknologi Kesehatan Lingkungan adalah 0,5 mg/liter
BAHAN DAN TATA KERJA
Bahan
1. Larutan standar 4000 ppm dari unsur Mn, Fe, Mo, dan Cu 2. TEA 99%, H2S04, H3P04 , KI04 dan aquades.
Peralatan
Spektrofotometer Shimadzu UV 2101 PC, neraca analitis Sartorius, pH meter Metrohm, kompor pemanas dan alat-alat gelas.
KUMPULAN LAPORAN BASIL PENELIrIAN rABUN 2004 ISBN.978-979-99141-2-5
Tata Kerja
A. Penelitian Mn dengan pereaksi TEA
1. Menentukan panjang gelombang kompleks Mn- TEA
Standar mangan dengan konsentrasi 20 ppm ditambahkan 0,5 ml TEA dan 20 ml aquades, pH diatur sampai 11 dengan penambahan NaOH encer, kemudian larutan dimasukkan ke dalam Iabu ukur 25 ml dan ditepatkan sampai tanda garis dengan aquades pH 11. Serapan dari larutan kompleks diukur dengan spektrofotometer Shimadzu UV 2100 PC setelah didiamkan selama 30 menit dari penjang gelom bang 800 nm sampai dengan 700 nm menggunakan slit 2.
2. Penentuan kondisi keasaman kompleks (pH)
Kondisi kompleks dicari dengan cara larutan standar Mn 20 ppm ditambahkan 0,5 ml TEA dan 20 ml aquades, pH diatur sampai II dengan penambahan NaOH encer, kemudian larutan dipindahkan ke dalam labu ukur 25 ml dan ditepatkan sampai tandai garis dengan aquades pH 11. Perlakuan yang sarna dengan percobaan 1, dengan variasi pH 10,0 ; 10,5 ; 11,0 ; 11,5 ; 12.0 ; 12,5. Serapan diukur pada panjang gelombang optimal yang diperoleh pada percobaan 1.
3. Penentuan konsentrasi (TEA)
Konsentrasi TEA diperoleh dengan cara larutan standar Mn 20 ppm ditambahkan 20 ml aquades dan penambahan TEA berurutan 0,25 ml ; 0,50 ml; 0,75 ml ; 1 ml ; 1,25 ml ; 1,50 ml dan 2 m!. Selanjutnya sarna dengan percobaan 2.
4. Linieritas
Dibuat deret standar Mn dengan konsentrasi 5 ; 10 ; 15: 20 ; 40 ppm masukkan kedalam labu ukur 25 m!. Penambahan TEA, pH dan panjang gelombang pengukuran dilakukan pada kondisi optimal pada percobaan 1,2 dan 3.
5. Unsur pengganggu
Ke dalam 20 ppm standar Mn ditambahkan masing-masing ditambahkan 1000 ppm unsur yang diperkirakan mengganggu yang terdiri dan Fe, Mo dan Cu Kemudian ditambahkan 0,5 ml TEA, pH diatur pada 11,5 dengan NaOH encer, larutan dipindahkan ke dalam labu ukur 25 ml, volume larutan ditepatkan dengan aquades pH
KUMPULAN LAPORAN HASIL PENELITIAN TAHUN 2004 ISBN.978-979-99141-2-S
11,5. Setelah 30 menit serapan larutan kompleks Mn- TEA diukur pada panjang gelombang 745 nm menggunakan slit 2.
6. Kestabilan kompleks
Larutan standar Mn dengan kadar 20 ppm ditambahkan 0,5 ml TEA, pH larutan diatur pada pH 11,5 dengan NaOH encer. Absorban dari larutan kompleks diukur pada 747 nm menggunakan slit 2 dengan selang waktu pengukuran 0,5 , 1 ,2,3 ,4, 5 , 6, 7 jam.
7. Deteksi limit
Ke dalam 3 beker glas masing-masing berisi larutan standar Mn 1 ppm ditambahkan 0,5 ml TEA dan 20 ml aquades, pH larutan diatur sampai 11,5 dengan NaOH encer. Larutan dipindahkan ke dalam labu ukur 25 ml volume larutan ditepatkan sampai tanda garis, dibuat larutan
"blank"
yang terdiri dari 0,5 ml TEA dan 20 ml aquades pH diatur sampai 11,5. Serapan dari larutan standar dan larutan blanko diukur selama10 menit pada pada panjang 745nm.
B. Penelitian Mn dengan pereaksi periodat
1. Penentuan panjang gelombang Mn-periodat
Dipipet Imllarutan standar mangan 4 ppm kedalam beker glas ditambahkan 40 ml aquades kemudian ditambahkan 5 ml H2S04 pekat, 5 ml H3P04 pekat dan 0,3 gram KI04. Larutan dipanaskan sampai mendidih selama 10 menit, setelah dingin larutan dipindahkan ke dalam labu ukur 50 ml., volume larutan ditepatkan dengan aquades sampai tanda garis. Serapan dari larutan kompleks Mn-periodat diukur dengan spektrofotometer Shimadzu UV 2100 PC setelah didiamkan selama 30 menit dari panjang gelombang 580 nm sampai dengan 500 nm menggunakan slit 2.
2. Penentuan konsentrasi KI04
Konsentrasi KI04 dicari dengan standar mangan 2 ppm ditambahkan 40 ml aquades kemudian ditambahkan 5 ml H2S04 pekat, 5 ml H3P04 pekat dan penambahan KI04 dengan bervariasi sehingga konsentrasi KI04 berurutan 0,05 gram; 0,10 gram; 0,15 gram; 0,20 gram; 0,25 gram; 0,30 gram, perlakuan selanjutnya sama dengan
KUMPULAN LAPORAN HASIL PENELITIAN TAHUN 2004 ISBN.978-979-99141-2-5
percobaan 1. Serapan dari larutan kompleks diukur pada panjang gelombang 525 (optimal yang diperoleh dari percobaan 1).
3. Penentuan pemakaian H2S04
Ke dalam larutan standar Mn
2
ppm ditambahkan H2S04 dengan variasi0,5;
1 ;2;
3; 4 ; 5 ; 6 ml dan ditambahkan 5 ml H3P04 kemudian 0.15 gram KI04 (optimum pada percobaan 2), selanjutnya sarna dengan percobaan 1 dan 2.
4. Penentuan pemakaian Fosfat
Ke dalam larutan standar Mn 2 ppm ditambahkan 0,5 ml H2S04 (optimun pada percobaan 2) dan H3P04 dengan variasi 0,5; 1 ; 2 ; 3 ; 4 ; 5 ; 6 ml kemudian ditambahkan 0,15 gram KI04. selanjutnya sarna dengan percobaan 2 dan 3 3. Menentukan linieritas
Dibuat sederet standar Mn dengan konsentrasi 1; 2 ; 3; 4; 5; 6; 8 ppm ditambahkan 0,5 ml H2S04 dan 0,5 ml H3P04 serta 0,15 gram KI04 , kemudian larutan dipanaskan sampai mendidih selama 10 menit, setelah dingin larutan dipindahkan ke dalam labu ukur 50 ml, volume larutan ditepatkan dengan aquades sampai tanda garis. Setelah 30 menit serapan larutan kompleks Mn-periodat diukur pada panjang gelombang 545 nm menggunakan slit 2.
4. Unsur pengganggu
Ke dalam larutan standar Mn 2 ppm ditambahkan masing-masing 1000 ppm unsur yang diperkirakan mengganggu yang terdiri dari Ca, Mg, Fe, AI, Mo, Zr, Cu, Pb dan Zn. Kemudian ditambahkan 0,5 ml H2S04 dan 0,5 ml H3P04 serta 0,15 gram KI04, larutan dipanaskan sampai mendidih selama 10 menit, setelah dingin larutan dipindahkan kedalam labu ukur 50 ml, volum larutan ditepatkan dengan aquades sampai tanda garis. Setelah 30 menit serapan larutan kompleks Mn-periodat diukur pada panjang gelombang 525 nm menggunakan slit 2.
5. Menentukan kestabilan kompleks
Larutan standar Mn dengan kadar 4 ppm ditambahkan 0,5 ml H2S04 dan 0,5 ml H3P04 serta 0,15 gram KI04 kemudian larutan dipanaskan selama 10 menit. larutan dipindahkan ke dalam labu ukur 50 ml, volume larutan ditepatkan dengan aquades sampai tanda garis. Setelah 30 menit serapan larutan kompleks Mn periodat diukur
KUMPULAN LAPORAN HASIL PENELlTlAN TAHUN 2004 ISBN.978-979-99141-2-5
780 800
Panjang gelombang (nm)
pada panjang gelombang 525 nm menggunakan slit 2 dengan selang waktu pengukuran 0,5 , 1 , 2 , 3 , 4 , 5 , 6, 7 jam.
6. Menentukan limit deteksi
Ke dalam 3 beker gelas mmasing-masing berisi 0,4 ppm standar Mn ( dalam labu ukur 50 ml) ditambahkan 0,5 ml H2S04 dan 0,5 ml H3P04 kemudian ditambahkan 0,15 gram KI04 , larutan dipanaskan sampai mendidih selama 10 menit. Setelah
dingin larutan dipindahkan ke dalam labu ukur 50 ml volume larutan ditepatkan sampai tanda garis dengan aquades, dibuat larutan "blank" yang terdiri dari 0,5 ml H2S04 dan 0,5 ml H3P04 serta 0,15 gram KI04, perlakuan selanjutnya sarna dengan standar. Serapan dari larutan standar dan larutan blanko diukur selama 10 menit pada pada panjang 525 nm menggunakan slit 2.
HASIL DAN PEMBAHASAN
1. Spektrum Mn TEA dan Mn Periodat
0.1
r....
0.095 I/j I I:: n:s 0.09 -j.c
.c
0
I/j•.. <t 0.085 0.08 700 720 740 760Gambar 1. Spektrum serapan Mn- TEA pada A 700 sid 800 nm dengan Spektrofotometer Shimadzu double beam UV 2101 PC Kondisi [Mn] =20 ppm, pH 11,5
KUMPULAN LAPORAN HASIL PENELITIAN TAHUN 1004 ISBN.978-979-99141-2-S
Pada Gambar 1. Spektrum kompleks Mn-TEA terlihat optimal pada 745 nm, pada panjang gelombang 700 nm absorbansi naik sampai puncaknya pada 745 nm dan kemudian absorbansi akan turun pada panjang gelombang yang lebih tinggi.
<II :; 0.15 .c •.. o ~ 0.1 <I: 0.05 o 500 520 540 560 580 Panjang Gelombang (nm)
Gambar 2. Spektrum serapan Mn - periodat pada A 500 sid 580 dengan Spektrofotometer Shimadzu double beam UV 2101 PC Kondisi [Mn]
=
4ppmPada Gambar 2. Spektrum Mn04-. Pada kondisi terjadi oksidasi dari Mn bervalensi rendah menjadi Mn04- menghasilkan warna pink pada dua maksimam yaitu pada 525 nm dam 545 nm. Dalam pengukuran untuk analisis secara kuantitatif diambil maksimal pertama pada 525 nm karena mempunyai puncak yang lebih ekstrim dari yang kedua.
2. Kondisi keasaman kompleks Mn- TEA dan pemakaian TEA 0,11 0,1 ~ 0,09 III ~o 0,08 III JJ 0 07
« ,
0,06---~·_---·_··-I
i i i 0,05 10 10,5 11 11,5 pH 12 12,5Gambar 3. Pengaruh pH pada pembentukan kompleks Mn-TEA Kondisi [Mn] = 20 ppm, A = 745 nm
KUMPULAN LAPORAN HASIL PENELITIAN TAHUN 2004 ISBN.978-979-99141-2-5
Pada Gambar 3. Penentuan kondisi keasaman komplek Mn-TEA dengan variasi pH, terlihat bahwa absorbansi kompleks Mn- TEA mulai pH 10 naik sampai dengan pH 11,5 dan pada pH yang lebih besar absorbansi akan turun kembali, ini terjadi karena larutan kompleks yang terjadi akan terurai kembalio
0,095 0,094 Ow :ii 0,093 .c•.. o E 0,092
«
0,091 0,091 o ~ 2 Pemakaian TEA (ml) 3Gambar 4. Pengaruh penambahan TEA dalam pembentukan kompleks Mn-TEA. Kondisi [Mn] =20 ppm, "A =745 nm
Pada Gambar 4. Konsentrasi TEA yang rendah terlihat absorbansi juga rendah ini teIjadi karena pada penambahan TEA yang kecil tidak semua gugus alkohol digantikan oleh gugus Mn, sedangkan pada penambahan yang lebih besar dari 1 ml maka absorbansi juga menurun karena reaksi kesetimbangan bergeser ke kiri kembali dan terlihat stabil pada pemakaian yang lebih besar dari 1,5 ml
3. Pemakaian KI04 dan pemakain sulfat
0.085 0.08 II) c .• -e 0.075 o II) .0 « 0.07 0.065 o 0.1 0.2 0.3 0.4 310 Pemakaian 1<104(gram)
Gambar 5. Pengaruh penambahan KI04 terhadap serapan dalam pembentukan kompleks Mn-periodat. Kondisi [Mn] = 2 ppm, "A = 525 nm
KUMPULAN LAPORAN BASIL PENELITIAN TA HUN 1004 ISBN.978-979-99141-2-5
Pada Gambar 5. Konsentrasi KI04 juga berpengaruh pada wama yang terbentuk, pada penambahan yang kecil dari 0,15 gram serapan masih rendah. Pada penambahan KI04 0,15 gram sid 0,25 gram serapan dari larutan berwama terlihat stabil, sedangkan pada penambahan yang lebih besar serapan larutan berwama terlihat turun, hal ini disebabkan oleh kesetimbangan reaksi.
0,08 'iijI: CIS
€
o ~ 0,05<
0,03°
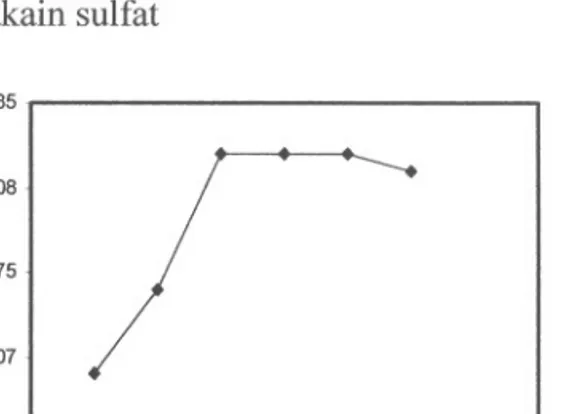
2 4 6 Pemakaian sulfat (m I)Gambar 6. Pengaruh penambahan sulfat dalam pembentukan kompleks Mn-periodat. Kondisi [Mn] =2 ppm, A= 525 nm
Pada Gambar 6. Pemakaian sui fat dengan pereaksi periodat juga berpengaruh dim ana pada pemakaian yang lebih kecil dari 1 ml absorbasi kecil karena oksidasi belum sempuma sedang pada konsentrasi yang lebih besar dari 1 ml reaksi juga bergeser ke kiri kembali (absorbansi menjadi kecil)
4. Pemakaian fosfat 0.08 0.079 -;; ; 0.078
••
•
•
•
\
.c 11 0.0770<.. 0.076 0.075 0 2 4 68 Pemakaian fospot (ml)Gambar 7. Pengaruh penambahan fosfat pada pembentukan kompleks Mn-periodat. Kondisi [Mn] = 2 ppm, A= 525 nm
KUMPULAN LAPOR4N HASIL PENELITIAN TAHUN 2004 ISBN .978-979-99141-2-5
Pada Gambar 7. Pemakaian fosfat dengan pereaksi periodat juga berpengaruh dimana pada pemakaian 0,5 ml sampai dengan 5 ml absorbansi terlihat stabil. Sedangkan pada konsentrasi yang besar dari 5 ml reaksi juga bergeser ke kiri kembali (absorbansi menjadi kecil)
5. Kestabilan wama kompleks
0.09 j ••••
o 2 4
Waktu (Jam)
6 8
Gambar 8. Pengaruh waktu terhadap kestabilan kompleks Mn- TEA Kondisi [Mn] = 20 ppm, pH 11,5 pada A = 745 nm
Kompleks berwama Mn- TEA mempunyai waktu stabil yang cukup panjang yaitu mulai dari 1 jam sampai dengan 7 jam, hal ini sangat baik karena persyaratan pada analisa secara spektrofotometri larutan berwama harus stabil dalam waktu yang cukup lama.
0.175
f17l/
I/)~ 0.165
..-.
••••
3120.16
~I---~
o 1 2 3 456 7 8 Waktu Uam)Gambar 9. Pengaruh waktu terhadap kestabilan kompleks Mn-periodat Kondisi [Mn] = 4 ppm, A= 525 nm.
KUMPULAN LAPORAN BASIL PENELITIAN TABUN 2004 ISBN.978-979-99141-2-5
Kompleks Mn-periodat stabil dalam waktu yang cukup lama, mulai 1 sampai dengan 7 jam, sarna dengan pereraksi TEA
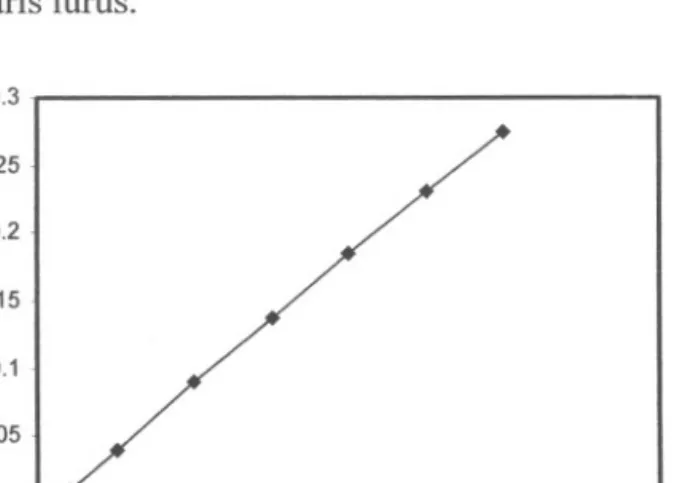
6. Linieritas 0.25 0.2 ;;; 1ij 0.15 s::>.en0 0.1 s::>. cI: 0.05 10 20 30 40 50 Konsntrasi Mn (ppm)
Gambar 10. Kurva standar Mn-TEA, A
=
745 nm pada pH 11,5Linieritas adalah suatu hubungan yang sebanding antara konsentrasi dari larntan standar dengan absorbansi yang memenuhi hukum Lambert-Beer, kenaikan konsentrari larntan sebanding dengan kenaikan absorbansi. Pengukuran linieritas bertujuan untuk melihat batas pengukuran maksimum dan minimun.
Pada gambar 10 terlihat konsentrasi standar Mn dengan TEA dari 1 sid 40 ppm, kurva menunjukkan garis lurns.
0.3 0.250.2 en cC'G -e'"0 0.15 s::>.cI: 0.1 0.05 2 4 6 8 Konsentrasi Mn (ppm)
Gambar 11. Kurva standar Mn-periodat pada A
=
525 nm.KUMPULAN LAPORAN HASIL PENELITIAN TAHUN 2004 ISBN.978-979-99141-2-5
Pada gambar 11 Mn dengan pereaksi periodat kurva menujukkan garis lurus dari 0,5 sid 6 ppm
7. Oeteksi limit
Oeteksi limit adalah kemampuan dari suatu metoda untuk mendeteksi (mengukur) suatu unsur. Oeteksi limit dihitung dengan menggunakan rumus:
Deteksi limit dengan pereaksi TEA
_ 3(amax-amin)+Xo
CDL-
XC 3(0.0005 - (-0.0015) + 0.00013 10 0.005773 'DL
= = 1,06 ppmDeteksi limit dengan pereaksi periodat
3(amax-amin)+Xo C XC 3(0.0031- 0.0003) + 0.001505 0.007496
=
0,50 ppm Keterangan:a max : absorbansi maksimum dari blank a min : absorbansi minimun dari blank Xo : absorbansi rata-rata blank XC : absorbansi rata-rata dari Mn C : konsentrasi dari Mn
0,4
314
Dari deteksi limit terlihat bahwa dengan pereksi periodat mempunyai deteksi limit pengukuran yang lebih kecil dari deteksi pengukuran dengan pereaksi TEA. Maka untuk pengukuran kadar kecil periodat lebih sensitif terhadap Mn dari TEA.
8.Unsur pengganggu
Dari beberapa unsur yang diperkirakan mengganggu dengan pereaksi TEA tidak ada. Sedangkan dengan pereaksi periodat unsur Fe tidak mengganggu karena pada reaksi yang terjadi, Fe dioksidasi menjadi Fe+3dan tidak memberikan wama.
KUMPULAN LAPORAN HASIL PENELlTlAN TAHUN 2004
KESIMPULAN
ISBN .978-979-99141-2-5
Dari hasil percobaan penentuan Mn menggunakan 2 pereaksi berbeda yaitu TEA dan periodat, dapat disimpulkan sebagai berikut:
Pada analisis Mn dengan pereaksi periodat lebih baik dari pereaksi TEA karena mempunyai deteksi limit yang lebih kecil (lebih sensitif) 0,50 ppm dan linieritas 0.5 sid 6 ppm dengan kondisi puncak pada 0,5 ml H2S04
+
0,5 ml H3P04 dan 0,15 gram KI04 pada panJang gelombang 525 nm slit 2 serta kompleks stabil sampai dengan 7 jam.PUST AKA
1. CHARLES H. JACOBY, " Indutrial Mineral and Rocks" American Institute of Mining, Metallurgical and Petroleum Engineers, Inc New York, N. Y, (1975) Halaman 821.
2. E.B. SANDELL,HIROSHI ONHISI, "Photometric Determination of Traces Metals General Aspects," A WILEY-INTERSCIENCE PUBLICATION. New York! Chichester/ Bribane/ Toronto (1976). Halaman 81.
3. M. PINTA, "Detection and Determination of Tace Elements" ANN ARBOR SCIENCE Publishers, Inc (1975) Halaman 141.
4. J. FRIES/ H.GETROST, "Organic Reagents for Trace Analysis" E.Merck Darmastadt, (1977).
PUSAT PENGEMBANGAN GEOLOGI NUKLIR-BATAN 315
![Gambar 1. Spektrum serapan Mn- TEA pada A 700 sid 800 nm dengan Spektrofotometer Shimadzu double beam UV 2101 PC Kondisi [Mn] =20 ppm, pH 11,5](https://thumb-ap.123doks.com/thumbv2/123dok/4392130.3200989/7.918.230.625.631.918/gambar-spektrum-serapan-tea-spektrofotometer-shimadzu-double-kondisi.webp)
![Gambar 3. Pengaruh pH pada pembentukan kompleks Mn-TEA Kondisi [Mn] = 20 ppm, A = 745 nm](https://thumb-ap.123doks.com/thumbv2/123dok/4392130.3200989/8.927.323.649.811.1034/gambar-pengaruh-pembentukan-kompleks-mn-tea-kondisi-mn.webp)
![Gambar 6. Pengaruh penambahan sulfat dalam pembentukan kompleks Mn-periodat. Kondisi [Mn] =2 ppm, A= 525 nm](https://thumb-ap.123doks.com/thumbv2/123dok/4392130.3200989/10.932.336.630.341.556/gambar-pengaruh-penambahan-sulfat-pembentukan-kompleks-periodat-kondisi.webp)
![Gambar 9. Pengaruh waktu terhadap kestabilan kompleks Mn-periodat Kondisi [Mn] = 4 ppm, A = 525 nm.](https://thumb-ap.123doks.com/thumbv2/123dok/4392130.3200989/11.918.341.643.741.953/gambar-pengaruh-waktu-kestabilan-kompleks-mn-periodat-kondisi.webp)