STUDI KEMAMPUAN VAKSIN ND-IB LIVED: PEMBENTUK
KEKEBALAN DAN PERLINDUNGAN TERHADAP PAPARAN
VIRUS NEWCASTLE DISEASE PADA AYAM PEDAGING
WILYANTI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2013
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Studi Kemampuan Vaksin ND-IB Lived: Pembentuk Kekebalan dan Perlindungan terhadap Paparan Virus Newcastle Disease pada Ayam Pedaging adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013 Wilyanti NIM B04090096
ABSTRAK
WILYANTI. Studi Kemampuan Vaksin ND-IB Lived: Pembentuk Kekebalan dan Perlindungan terhadap Paparan Virus Newcastle Disease pada Ayam Pedaging. Dibimbing oleh SRI MURTINI dan RETNO DAMAJANTI SOEJOEDONO.
Penelitian ini dilakukan untuk mengukur respon kebal ayam yang divaksin dengan vaksin hidup ND LaSota-IB H120, serta gejala klinis dan gambaran patologi-anatomi pada ayam yang ditantang. Penelitian menggunakan 60 ekor ayam pedaging, dua puluh ekor ayam di awal penelitian diambil darahnya untuk pengamatan titer antibodi asal induk terhadap infeksi virus Newcastle Disease (ND) pada hari ke-1 dengan uji Hemaglutination Inhibition (HI) mikrotitrasi. Empat puluh ekor sisanya dibagi menjadi 4 kelompok masing-masing 10 ekor. Kelompok K1 dan K2 tidak divaksinasi. Kelompok K3 dan K4 divaksinasi pada umur 2 hari. Penantangan dilakukan pada kelompok K1 dan K3 pada hari ke-14 (12 hari setelah vaksinasi) dengan virus ND galur lapang. Sampel darah dari kelompok yang tidak divaksinasi dan divaksinasi diambil pada hari ke-7, 14, dan 22. Hasil penelitian menunjukkan ayam yang diamati memiliki titer antibodi asal induk yang tinggi. Vaksinasi secara tetes hidung dan mulut yang diberikan pada hari ke-2 mampu menginduksi kekebalan antibodi pada batas nilai perlindungan. Vaksinasi pada kelompok yang ditantang dapat mengurangi munculnya kelemahan dan kerusakan pada sekal tonsil. Kemunculan gejala klinis dan perubahan patologi-anatomi lebih tinggi terjadi pada kelompok yang tidak divaksinasi.
Kata kunci: Ayam pedaging, LaSota H-120, Newcastle Disease, uji HI, vaksin
ABSTRACT
WILYANTI. Study on Protection to Newcastle Disease Virus Provide by ND-IB Lived Vaccine on Broiler. Supervised by of SRI MURTINI and RETNO
DAMAJANTI SOEJOEDONO
The objective of this study was to measure the antibody titer of broilers were vaccinated with lived ND LaSota-IB H120 vaccine, and to observe the clinical signs and pathological lesions on challenged group. As much as 60 commercial Day Old Chicks were used in the experimental. Twenty chickens were bleed at day one to measure maternal antibody against Newcastle Disease (ND) using Hemaglutination Inhibition (HI) Test. The remaining fourty chickens were divided into four groups. Each group consisted of ten broilers. Group K1 and K2 were unvaccinated. Group K3 and K4 were vaccinated on the 2nd day according to the manufacture procedure. Challenge was carried out on 14th day (12th day post vaccination) to group K1 and K3 with ND Indonesia isolate virus. Blood samples from unvaccinated and vaccinated group were taken on 7th, 14th, and 22nd day. The result showed that chickens had high maternal antibody titer. The combination of intranasal and oral vaccination was able to produced protective antibody against ND viral infection. Vaccination was able to reduced
lethargy and petechiae cecal tonsil. The clinical signs and pathological lesions were more severe on unvaccinated group.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran hewan
STUDI KEMAMPUAN VAKSIN ND-IB LIVED: PEMBENTUK
KEKEBALAN DAN PERLINDUNGAN TERHADAP PAPARAN
VIRUS NEWCASTLE DISEASE PADA AYAM PEDAGING
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Skripsi : Studi Kemampuan Vaksin ND-IB Lived: Pembentuk Kekebalan
dan Perlindungan terhadap Paparan Virus Newcastle Disease
pada Ayam Pedaging Nama : Wilyanti
NIM : B04090096
Disetujui oleh
~'~i
Dr drh Sri Murtini, M Si Prof Dr drh Retno D Soejoedono, MS
Pembimbing I Pembimbing II
Judul Skripsi : Studi Kemampuan Vaksin ND-IB Lived: Pembentuk Kekebalan dan Perlindungan terhadap Paparan Virus Newcastle Disease pada Ayam Pedaging
Nama : Wilyanti
NIM : B04090096
Disetujui oleh
Dr drh Sri Murtini, M Si Pembimbing I
Prof Dr drh Retno D Soejoedono, MS Pembimbing II
Diketahui oleh
drh Agus Setiyono, MS, Ph.D, APVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esaatas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Judul untuk skripsi ini adalah Studi Kemampuan Vaksin ND-IB Lived: Pembentuk Kekebalan dan Perlindungan terhadap Paparan Virus Newcastle Disease pada Ayam Pedaging. Terima kasih penulis ucapkan kepada Dr drh Sri Murtini, M Si selaku dosen pembimbing skripsi I, Prof Dr drh Retno D Soejoedono, MS selaku dosen pembimbing skripsi II dan Dr drh Sus Derthi Widhyari, M Si selaku dosen pembimbing akademik, atas segala bimbingan, nasehat, dorongan, kritik, dan saran yang telah diberikan selama penelitian dan penulisan skripsi ini. Di samping itu, penulis juga mengucapkan terimakasih kepada drh Okti Nadya Poetri, drh Ni Luh Putu Ika Mayasari, drh Linatul Musyafa’ah, drh Vivi Maryuni, Mega Sary, SKH, Pak Nur, Mas Wahyu, dan Pak Lukman, atas bantuan, dorongan, masukan selama pengumpulan dan pengolahan data.
Ungkapan terima kasih juga disampaikan kepada ayah, ibu, dan kakak atas doa serta dukungan yang diberikan selama ini. Selanjutnya ungkapan terima kasih penulis ucapkan kepada teman sepenelitian (Fitri, Jati, Yuli, Chiko, Uya, Denny), sahabat-sahabat terdekat (Risna, Ayu Agustri, DK Farah Ana, Puspasari, Refangga), teman-teman Kost GIC, dan teman teman seangkatan Geochelone 46 yang sama-sama berjuang dalam menempuh pendidikan di Institut Pertanian Bogor.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2013 Wilyanti
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi PENDAHULUAN Latar Belakang 1 Tujuan Penelitian 3 Manfaat Penelitian 4MATERI DAN METODE
Waktu dan Tempat 4
Alat dan Bahan 4
Hewan Coba 4
Rancangan Percobaan 5
Pembuatan Sel Darah Merah atau Red Blood Cell (RBC) 6 Prosedur penyiapan virus standar dengan haemagglutination (HA) test 6
Prosedur uji HI Mikrotitrasi 7
Analisis Statistik 7
HASIL DAN PEMBAHASAN
Hasil 8 Pembahasan 10 Titer Antibodi 10 Gejala Klinis 10 Patologi Anatomi 11 PENUTUP Simpulan 12 DAFTAR PUSTAKA 12 LAMPIRAN 14 RIWAYAT HIDUP 17
DAFTAR TABEL
1 Rancangan Percobaan 5
2 Rataan Geometrik Mean Titer (GMT) setiap kelompok 8 3 Gejala klinis ayam tidak divaksin dan ditantang virus ND (K1) 8 4 Gejala klinis ayam divaksin dan ditantang virus ND (K3) 9 5 Pengamatan jumlah kematian ayam yang ditantang virus ND 9 6 Pengamatan perubahan patologi anatomi ayam yang ditantang virus ND 9 7 Evaluasi perbandingan antara kelompok K1 dan K3 terhadap kondisi
titer antibodi, gejala klinis, dan patologi anatomi 12
DAFTAR GAMBAR
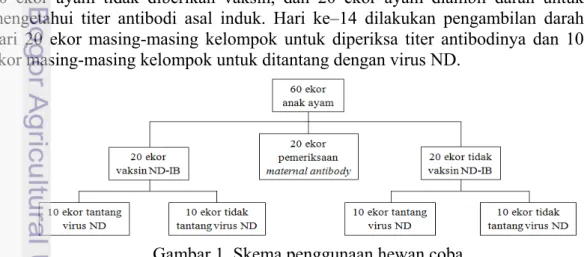
1 Skema penggunaan hewan coba 4
2 Rataan Geometrik Mean Titer (GMT) setiap kelompok 8
DAFTAR LAMPIRAN
1 Titer antibodi asal induk (hari ke-1) 14
2 Titer antibodi kelompok tidak divaksinasi dan divaksinasi (hari ke–7) 14 3 Titer antibodi kelompok ayam yang tidak divaksinasi dan divaksinasi
(hari ke–14) 15
4 Titer antibodi kelompok ayam yang ditantang virus ND (hari ke–22) 15 5 Titer antibodi kelompok ayam yang tidak ditantang virus ND (hari
1
PENDAHULUAN
Latar Belakang
Ayam pedaging komersial pada awalnya hanya berkembang di Benua Amerika dan Eropa. Sejalan dengan perkembangan globalisasi, penyebaran penduduk, dan kemudahan sarana transportasi, ayam pedaging komersial yang telah dikembangkan potensi genetiknya menyebar hampir ke seluruh pelosok dunia. Sebelum berkembang, ayam pedaging komersial yang dihasilkan mempunyai tingkat produktivitas rendah, karena selain menghasilkan daging juga menghasilkan telur. Perkembangan ayam pedaging di Indonesia dimulai pada pertengahan dasawarsa 1970-an dan merebakpada awal 1980-an (Fadilah 2005).
Nama Newcastle disease (ND atau NCD) memiliki sinonim penyakit Tetelo, Pseudo Fowl Pest, dan Ranikhet disease. Nama ini diambil dari sebuah nama kota di Inggris Newcastle on Tyne, tempat penemuan penyakit ini untuk pertama kali dilaporkan oleh Doyle (1927). Penyakit ini sebenarnya telah ditemukan satu tahun sebelumnya (1926) oleh Kraneveld di Batavia (Jakarta), namun publikasi mengenai penyakit tersebut lebih hebat di Inggris, sehingga nama Newcastle disease (ND) lebih terkenal dibandingkan dengan nama lokal yang lain. Di India, penyakit ini dikenal dengan nama Ranikhet disease, yang diambil dari nama sebuah kota di bagian Utara India. Di Indonesia, ND merupakan penyakit unggas yang paling ditakuti karena kerugian yang ditimbulkan sangat besar (Soeharsono 2005). Morbiditas dapat mencapai 100% sedangkan mortalitas mencapai 90% pada ayam yang masih muda (Saif 2003).
Virus ND berasal dari famili Paramyxoviridae, subfamili Paramyxovirinae, dan genus Paramyxovirus. Virionnya pleomorfik, biasanya sedikit membulat atau memanjang, dengan diameter 150 nm atau lebih. Virus ini terdiri dari nukleokapsid dengan simetri heliks, berdiameter 13–18 nm, yang dikelilingi oleh amplop yang berasal dari membran permukaan sel (Fenner et al. 1993). Genom virus ini mempunyai 6 protein utama yang menyusunnya yaitu Nucleocapsid protein (N), Phosphoprotein (P), Matrix protein (M), Fusion protein (F), Hemagglutinin-neuraminidase protein (HN) dan Large polymerase protein (L). Protein N, P, HN, dan F terletak di bagian luar envelope sedangkan protein M terdapat di lapisan dalam virion. Protein HN dan F mempunyai kontribusi yang sangat signifikan dalam virulensi dan penyebaran virus ND dalam tubuh induk semang. Protein N berhubungan dengan virus polimerase (P-L) selama ekspresi genom terjadi serta berhubungan dengan protein P selama pemasangan nukleokapsid. Protein P membentuk senyawa komplek dengan protein N dan L serta berperan dalam sintesis RNA. Protein L terdapat dalam jumlah paling besar dalam virus ND dan mempunyai aktivitas katalitik yang berhubungan dengan polimerase virus (Hewajuli dan Dharmayanti 2011).
Gejala penyakit dimulai dengan anoreksia, meningkatnya temperatur tubuh sampai 43 °C (normal: 40–41 °C), lesu, haus, bulu kusam, jengger berdarah, mata tertutup, diare berair, bersin-bersin, gangguan pernapasan, dan larings serta farings yang kering. Ayam yang sembuh memperlihatkan tanda kerusakan sistem saraf pusat, dicirikan oleh paresis kaki, ataksia, tortikolis, pergerakan berputar-putar, dan tremor (Fenner et al. 1993). Penularan terjadi secara inhalasi melalui
2
bahan yang terinfeksi seperti litter, kontak langsung dengan ayam yang terinfeksi atau bangkai, kontak fomites, kontaminasi pada pakan, dan kontaminasi pada air minum (Saif 2003).
Masa inkubasi penyakit ini beragam 2–15 hari, tergantung dari virus yang menginfeksi, umur, status kekebalan ayam, infeksi dengan organisme lain, kondisi lingkungan, dan jalur penularan. Berdasarkan sifat keganasannya, ND diklasifikasikan sebagai berikut.
• Bersifat tidak menyebabkan sakit (apathogenic atau asymptomatic enteric), ND yang tidak tampak menyerang daerah usus (intestinal infection).
• Bersifat ringan (lentogenik), ayam yang terinfeksi ND tidak menampakkan gejala sakit atau hanya sedikit dan menyebabkan sedikit kematian atau tidak ada sama sekali.
• Bersifat sedang (mesogenic) biasanya menyerang anak ayam yang ditandai dengan gejala adanya gangguan pernapasan, nervous, dan tingkat kematian tinggi. Serangan pada ayam produksi bisa menyebabkan penurunan produksi yang drastis.
• Bersifat ganas (velogenic atau neurotropic) menyerang ayam secara tiba-tiba dan bersifat ganas atau akut. Gejala yang tampak adalah adanya gangguan pernapasan (ngorok), diare, leher berputar (torticolis), dan kelumpuhan yang diikuti dengan kematian.
• Bersifat sangat ganas (viscerotropic velogenic; exotic ND; dan asiatic type) menyerang ayam sangat virulence (virus ganas) dan tingkat kematiannya tinggi. Gejala yang tampak adalah adanya gangguan pernapasan, nervous, pergerakan leher memutar dan tidak terkontrol, serta ayam mati mendadak (Fadilah dan Polana 2004).
Infeksi virus ND terjadi melalui penempelan virus yang dilakukan dengan penyatuan virus dan membran sel yang diperantarai oleh protein F. Virus RNA kemudian dilepaskan dalam sitoplasma dan terjadi replikasi. Envelope virus masuk ke dalam sel melalui dua jalan utama yaitu pertama, penyatuan secara langsung antara envelope virus dengan membran plasma dan kedua, diperantarai oleh reseptor endositosis yang tergantung pada kondisi pH-nya. Sel harus mempunyai reseptor yang cocok sehingga virus dapat melakukan penempelan dan masuk ke dalam sel. Replikasi virus yang terjadi di limfosit menghasilkan suatu respon kebal dan produksi antigen virus yang cukup dibutuhkan untuk meningkatkan efektivitas sistem kebal. Di dalam saluran pencernaan terdapat faktor-faktor nonspesifik yang mempengaruhi replikasi virus ND. Enzim protease dan pH yang bervariasi mempunyai pengaruh dalam proses penempelan virus pada reseptor sel (Hewajuli dan Dharmayanti 2011).
Perubahan pasca mati meliputi perdarahan ekimotik pada larings, trakea, esophagus, dan disepanjang usus. Lesi histologi yang paling menonjol adalah nekrosis terpusat pada mukosa usus dan jaringan limfe dan perubahan hiperemia di sebagian besar organ, termasuk otak (Fenner et al. 1993).
Respon kekebalan seluler dan kekebalan humoral berperan penting dalam melawan infeksi virus ND. Respon kekebalan seluler dan humoral timbul setelah dua sampai tiga hari pascavaksinasi ND tetapi respon kekebalan seluler hanya berperan kecil pada ayam yang divaksinasi ND. Antibodi merupakan suatu unit yang berfungsi dalam kekebalan humoral. Antibodi dihasilkan oleh sel plasma dari permukaan limfosit B yang mengandung molekul-molekul immunoglobulin
3 (Ig). Terdapat 3 immunoglobulin yang ditemukan dalam sistem kebal unggas yaitu IgM, IgG dan IgA. Kekebalan yang diperantarai sel atau cell- mediated immunity (CMI) efektif melawan infeksi yang terjadi di dalam sel (intra sel) dengan cara menghancurkan sel yang terinfeksi virus atau masuk ke dalam sel untuk menghilangkan antigen virus. Sel limfosit T adalah antigen spesifik dalam respon CMI dan mampu melawan infeksi patogen secara luas. Semua sel T mengekspresikan CD3 kompleks pada permukaan selnya serta terpisah dari reseptor sel T. Sel T helper (CD4) berperan dalam regulasi kekebalan humoral, CMI, mengaktifkan makrofag dengan mensekresikan sitokin, dan menstimulasi pertumbuhan serta diferensiasi sel B. Cytotoxic limfosit T (CD8) terdapat pada permukaan sel T yang berperan dalam melisiskan sel yang terinfeksi virus. Stimulasi salah satu tipe limfosit oleh antigen meningkatkan proliferasi dan diferensiasi sel limfosit yang terjadi dalam sel efektor dan sel memori. Sel memori akan kembali muncul ketika antigen yang sama menyerang lagi. Sel ini berdiferensiasi dengan cepat dalam sel efektor untuk melawan antigen. Produksi sel memori yang spesifik terhadap antigen merupakan awal pertahanan terhadap infeksi serta konsep vaksinasi (Hewajuli dan Dharmayanti 2011).
Vaksinasi merupakan cara yang paling umum diterapkan untuk mencegah penyakit virus. Terdapat dua strategi utama pembuatan vaksin virus, yaitu menggunakan virus hidup (aktif) dan virus tidak aktif. Sebagian besar vaksin hidup diinjeksikan di bawah kulit (subkutan) atau pada otot (intramuskuler), tetapi beberapa diberikan lewat mulut (per oral), dan sejumlah kecil lewat aerosol atau pada unggas air dalam air minumnya. Virus vaksin bereplikasi dalam sel inang, menimbulkan respon kekebalan dalam jangka waktu yang lama, tetapi tidak menyebabkan penyakit. Vaksin tidak aktif biasanya dibuat dari virus virulen. Vaksin tidak aktif diinjeksikan dalam jumlah banyak untuk menimbulkan respon antibodi dalam jumlah yang sama dengan penggunaan vaksin virus hidup dengan dosis yang jauh lebih kecil (Fenner et al. 1993). Vaksin aktif adalah vaksin yang mengandung antigen yang sudah dilemahkan untuk menghilangkan sifat-sifat virulensinya. Vaksin inaktif adalah vaksin yang berisi antigen yang sudah diinaktifkan (dimatikan) tetapi masih memiliki sifat imunogenitas. Vaksin dapat berisi satu jenis antigen yang disebut vaksin monovalen atau dapat pula berisi beberapa jenis antigen atau disebut vaksin polivalen (Tizard 2000). Secara teknis, vaksin harus memenuhi kriteria dapat memberikan perlindungan semaksimal mungkin terhadap ternak yang divaksin dan terhadap fetus melalui maternal immunity, tidak menimbulkan sakit jika diaplikasikan dan cara pemberiannya mudah serta tidak berulang-ulang agar dapat menghemat waktu, tenaga, dan biaya, serta tidak menimbulkan stres berulang pada ternak (Soeripto 2002).
Tujuan Penelitian
Tujuan yang ingin dicapai dari penelitian ini adalah untuk mengukur respon kebal ayam yang divaksin dengan vaksin ND-IB lived (LaSota H-120), serta gejala klinis dan perubahan patologi-anatomi pada ayam yang ditantang oleh virus ND isolat lapang.
4
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai respon kebal ayam yang divaksin dengan vaksin ND-IB lived (LaSota H-120), gejala klinis, perubahan patologi-anatomi, dan kemampuan ayam dalam menghadapi efek tantang oleh virus ND isolat lapang.
MATERI DAN METODE
Waktu dan Tempat
Penelitian dilakukan pada bulan Mei–Juni 2012. Penelitian ini berupa percobaan laboratorium dan lapangan yang dilakukan di Laboratorium di Bagian Mikrobiologi Medis Departemen IPHK, dan kandang Unit Pengelola Hewan Laboratorium (UPHL) Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Alat dan Bahan
Bahan yang digunakan dalam penelitian ini adalah suspensi sel darah merah atau Red Blood Cell (RBC) 5% dan 1%, NaCl fisiologis, Na-sitrat 3,8% steril, alkohol 70%, virus ND isolat lapang dari Balai Besar Pengujian Mutu dan Sertifikasi Obat Hewan (BBPMSOH), vaksin uji ND-IB lived (LaSota H-120), Phosphat Buffer Saline (PBS).
Alat yang digunakan dalam penelitian ini adalah tabung standart 10 ml, syringe 3 ml, laminar flow cabinet tipe 1, refrigerator, micropippete, microplate, pippete tip, tabung mikro, kapas, kandang litter, rak tabung mikro, ice pack, cooler box, alat sentrifugasi, alat-alat nekropsi.
Hewan Coba
Sebanyak 60 ekor ayam pedaging umur 1 hari (Day Old Chick). Hari kedua ayam dibagi menjadi 20 ekor ayam diberikan vaksin ND-IB lived (LaSota H-120), 20 ekor ayam tidak diberikan vaksin, dan 20 ekor ayam diambil darah untuk mengetahui titer antibodi asal induk. Hari ke–14 dilakukan pengambilan darah dari 20 ekor masing-masing kelompok untuk diperiksa titer antibodinya dan 10 ekor masing-masing kelompok untuk ditantang dengan virus ND.
5
Rancangan Percobaan
Persiapan kandang dilakukan dengan desinfeksi kandang menggunakan KMnO4 sebanyak 20 gram dan formalin sebanyak 40 cc/3m kubik serta pemberian sekam pada lantai kandang. Pakan dan air minum diberikan secara ad libitum. Pemeliharaan dilakukan selama 22 hari. Ayam yang digunakan adalah ayam pedaging komersial.
Hari ke-1 dilakukan pengambilan darah dari 20 ekor ayam. Vaksinasi dilakukan pada hari ke–2 melalui tetes mata dan hidung pada 20 ekor ayam, sedangkan 20 ekor sisanya tidak divaksinasi. Vaksin yang digunakan dalam penelitian ini adalah vaksin ND-IB lived (LaSota-H120).
Hari ke–7 sampel darah diambil sebanyak 20 ekor masing-masing dari kelompok yang divaksinasi dan tidak divaksinasi. Hari ke–14 dilakukan pengambilan darah dengan menggunakan syringe 3 ml melalui vena brachialis. Sampel darah disimpan dalam refrigerator selama 24 jam untuk diambil serumnya. Selanjutnya serum digunakan dalam pengukuran titer antibodi.
Uji tantang dilakukan dengan pemberian virus ND isolat lapang dosis 109 EID50/0,5 ml/ekor. Penantangan dilakukan hari ke–14 pada 10 ekor masing-masing dari kelompok yang divaksinasi dan tidak divaksinasi dengan pemberian secara oral.
Ayam-ayam yang sudah ditantang dengan virus lapang diamati gejala klinis yang tampak setiap hari selama 1 minggu. Pada hari ke–22 dilakukan pengambilan darah dan ayam dimatikan untuk diamati perubahan patologi anatomi yang terjadi.
Pengukuran titer antibodi ND dilakukan dengan menggunakan uji Hambat Aglutinasi (HI Test) mikrotitrasi. Sebelum dilakukan uji HI terlebih dahulu dilakukan pembuatan virus standar 4 HAU/25μl yang diperoleh dari pengenceran stok virus yang telah dititrasi sebelumnya dan suspensi RBC 1%.
Tabel 1 Rancangan percobaan
Kelompok Perlakuan (hari ke–)
1 2 7 14 22 K1 Pengambilan serum darah Tidak vaksin ND-IB lived Pengambilan serum darah Pengambilan serum darah dan uji tantang
Pengambilan serum darah dan nekropsi K2 Pengambilan
serum darah Tidak vaksin
ND-IB lived
Pengambilan
serum darah Pengambilan serum darah
dan tidak uji tantang
Pengambilan serum darah dan nekropsi K3 Pengambilan
serum darah Vaksin ND-IB lived
Pengambilan
serum darah Pengambilan serum darah
dan uji tantang
Pengambilan serum darah dan nekropsi K4 Pengambilan
serum darah Vaksin ND-IB lived
Pengambilan
serum darah Pengambilan serum darah
dan tidak uji tantang
Pengambilan serum darah dan nekropsi
6
Pembuatan Sel Darah Merah atau Red Blood Cell (RBC)
Darah utuh (whole blood) ditambahkan antikoagulan Natrium Sitrat 3.8%, disentrifugasi pada 1500 rpm selama 10 menit. Supernatan yang terbentuk dibuang, sedangkan sel darah merah yang mengendap dicuci/dibilas dengan NaCl fisiologis pada tempat yang sama, kemudian disentrifugasi kembali. Pencucian dilakukan sebanyak 3 kali. Hasilnya didapatkan sel darah merah dengan konsentrasi 100%, kemudian dilakukan pengenceran dengan penambahan NaCl fisiologis secara bertingkat menjadi 50% kemudian diencerkan kembali menjadi 5%. Suspensi RBC tersebut bisa langsung digunakan dengan diencerkan terlebih dahulu menjadi suspensi 1% untuk uji Hambat Aglutinasi (HI Test) mikrotitrasi. Prosedur penyiapan virus standar dengan haemagglutination (HA) test (OIE 2012)
• Sebanyak 25μl PBS dimasukkan ke sumur microplate berbentuk V (V bottom microplate) baris pada A sampai F, kolom dua sampai 12.
• Sebanyak 50μl antigen ND dimasukkan ke sumur A1 sampai E1.
• Antigen ND sebanyak 25μl dipindahkan dari sumur A1 sampai E1 ke dalam sumur A2 sampai E2 menggunakan pipet multichanel lalu dihomogenkan lima kali dengan cara memipet naik dan turun. Setiap memasukkan antigen dilakukan penggantian tips.
• Sebanyak 25μl PBS dimasukkan ke dalam sumur B2 dan dihomogenkan 10 kali dengan cara memipet naik dan turun. Selanjutnya dari sumur B2 dikeluarkan sebanyak 25μl campuran tersebut sehingga pengenceran pada sumur B2 menjadi 1/3.
• PBS sebanyak 75μl dimasukkan ke dalam sumur C2 dan dihomogenkan 10 kali dengan cara cara memipet naik dan turun. Dari sumur C2 diambil 75μl campuran pada sumur tersebut sehingga pengencerannya menjadi 1/5.
• PBS sebanyak 125μl dipipet ke dalam sumur D2 dan dihomogenkan 10 kali dengan cara memipet naik dan turun. Dari sumur D2 diambil 125μl suspensi sehingga pengenceran pada sumur tersebut menjadi 1/7.
• PBS sebanyak 175μl dipipet ke dalam sumur E2 dan dihomogenkan 10 kali dengan cara memipet naik dan turun. Dari sumur E2 diambil 175μl suspensi sehingga pengenceran pada sumur tersebut menjadi 1/9.
• Selanjutnya digunakan multichanelpipet dengan tips baru. Dipipet 25μl suspensi dari kolom A2 sampai E2 ke dalam A3 sampai E3 dan dihomogenkan lima kali dengan cara memipet naik dan turun. Dipipet dengan tips yang sama 25 μl suspensi dari kolom A3 sampai E3 ke dalam kolom A4 sampai E4 dan dihomogenkan lima kali dengan cara memipet naik dan turun. Langkah ini diulangi hingga kolom A12 sampai E12. Setelah dihomogenkan lima kali dari A12 sampai E12 dibuang 25 μl suspensi.
• Selanjutnya dimasukkan sebanyak 25μl PBS ke dalam setiap sumur.
• Terakhir ditambahkan 25μl RBC (1% v/v) ke dalam setiap sumur. Plate dikocok selama 10 detik.
• Kemudian plate diinkubasi selama 60 menit pada suhu 4°C.
• Hasil diamati setelah sumur kontrol positif tampak adanya reaksi penghambatan aglutinasi dengan memiringkan plate.
7
Prosedur uji HI Mikrotitrasi (OIE 2012)
• PBS sebanyak 25μl dimasukkan ke dalam sumur microplate berbentuk V (V bottom microplate).
• 25μl serum ayam dimasukkan pada lubang pertama dan dilakukan pengenceran menggunakan micropipette dengan cara menghisap dan mengeluarkan campuran sebanyak lima kali lalu memindahkan 25μl campuran ke sumur kedua. Pengenceran dilakukan hingga sumur ke 12. Pada sumur ke 12, campuran sebanyak 25μl dibuang.
• Suspensi virus ND standar (4 HAU) sebanyak 25μl dimasukkan ke dalam sumur berisi serum yang telah diencerkan lalu dihomogenkan dan inkubasi pada suhu 4°C selama 60 menit.
• Tambahkan RBC 1% sebanyak 25μl dimasukkan ke semua sumur.
• Plate digoyang selama 10 detik untuk menghomogenkan larutan dan inkubasi pada suhu 4°C selama 60 menit.
• Hasil diamati setelah sumur kontrol positif tampak adanya reaksi penghambatan aglutinasi.
Titer antibodi dihitung dengan melihat batas akhir penghambatan aglutinasi sempurna. Batas akhir pada pengenceran tertinggi yang mampu menghambat terjadinya aglutinasi secara sempurna dan disebut dengan “end point”.
Rataan titer antibodi dihitung dengan menggunakan Geometric Mean Titre (GMT) dengan rumus:
Log2 GMT = (Log2 t1)(S1) + (Log2 t2)(S2) + ... + (Log2 tn)(Sn) N
Keterangan : N = Jumlah contoh serum yang diamati
t = Titer antibodi pada pengenceran tertinggi (yang masih dapat menghambat aglutinasi sel darah merah)
S = Jumlah contoh serum yang bertiter t n = Titer antibodi pada sampel ke-n
Analisis Statistik
Data titer antibodi yang diperoleh dari penelitian ini dianalisis menggunakan metode analysis of variance (Anova) dan dilanjutkan dengan uji Duncan untuk membuktikan adanya perbedaan yang nyata antar perlakuan. Pengamatan gejala klinis dan perubahan patologi anatomi dianalisis secara deskriptif.
8
HASIL DAN PEMBAHASAN
Hasil
Gambar 2 Rataan Geometrik Mean Titer (GMT) setiap kelompok
Tabel 2 Rataan Geometrik Mean Titer (GMT) setiap kelompok
Hari ke- K1 K2 K3 K4 Rataan Titer Antibodi ND
1 5.63±0.67a 5.63±0.67a 5.63±0.67a 5.63±0.67a
7 3.80±1.48a 3.80±1.48a 3.90±1.29a 3.90±1.29a
14 3.15±1.09a 3.15±1.09a 3.15±0.88a 3.15±0.88a
22 3.88±1.73b 1.60±0.70a 5.00±1.31b 2.10±1.10a
Keterangan: Huruf superscript yang berbeda pada baris yang sama menunjukkan perbedaan yang
nyata pada taraf p<0.05
Hasil rataan Geometrik Mean Titer (GMT) setiap kelompok dapat dilihat pada Gambar 2 dan Tabel 2. Pada hari ke-1 titer antibodi bernilai 25.63±0.67. Pada hari ke–7 kelompok yang tidak divaksin memiliki nilai titer antibodi 23.80±1.48 dan kelompok yang divaksin memiliki nilai titer antibodi 23.90±1.29. Pada hari ke– 14 kelompok yang tidak divaksin memiliki nilai titer antibodi 23.15±1.09 dan kelompok yang divaksin memiliki nilai titer antibodi 23.15±0.88. Pada hari ke–22, kelompok K1 (tidak divaksin dan ditantang) memiliki nilai titer antibodi 23.88±1.73, kelompok K2 (tidak divaksin dan tidak ditantang) memiliki nilai titer antibodi 21.60±0.70, kelompok K3 (divaksin dan ditantang) memiliki nilai titer antibodi 25.00±1.31, kelompok K4 (divaksin dan tidak ditantang) memiliki nilai titer antibodi 22.10±1.10.
Tabel 3 Gejala klinis ayam tidak divaksin dan ditantang virus ND (K1)
Gejala klinis 1 2 3 4 5 6 7 Hari ke-
Lemah 0/10 0/9 8/9 1/9 2/9 2/7 6/7
Bulu kusam 0/10 0/9 0/9 1/9 0/9 2/7 4/7
Diare 0/10 0/9 1/9 0/9 1/9 1/7 2/7
Ngorok 0/10 0/9 0/9 0/9 0/9 2/7 0/7
Tak ada kelainan 9/10 9/9 9/9 0/9 0/9 0/7 0/7
Umur ayam Titer an tibod i (lo g2 )
9 Tabel 4 Gejala klinis ayam divaksin dan ditantang virus ND (K3)
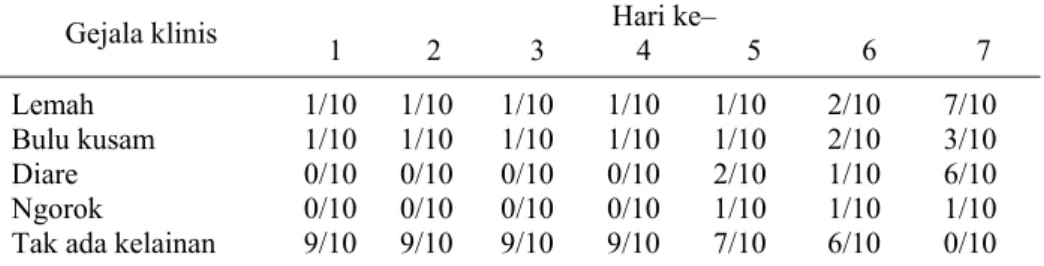
Gejala klinis 1 2 3 4 5 6 7 Hari ke–
Lemah 1/10 1/10 1/10 1/10 1/10 2/10 7/10
Bulu kusam 1/10 1/10 1/10 1/10 1/10 2/10 3/10
Diare 0/10 0/10 0/10 0/10 2/10 1/10 6/10
Ngorok 0/10 0/10 0/10 0/10 1/10 1/10 1/10
Tak ada kelainan 9/10 9/10 9/10 9/10 7/10 6/10 0/10
Gejala klinis kelompok yang mendapat perlakuan tantang dapat dilihat pada Tabel 3 dan Tabel 4. Gejala klinis memperlihatkan ayam yang ditantang mengalami gejala lemah, bulu kusam, demam, dan ngorok.
Tabel 5 Pengamatan jumlah kematian ayam yang ditantang virus ND
Perlakuan 1 2 3 4 5 6 7 Hari ke–
K1 (tidak divaksinasi) 1/10 0/9 0/9 0/9 0/9 2/9 0/7
K3 (divaksinasi) 0/10 0/10 0/10 0/10 0/10 0/10 0/10
Pengamatan jumlah kematian ayam yang ditantang virus ND dapat dilihat pada Tabel 5. Kelompok ayam yang tidak divaksinasi mengalami kematian sebanyak 3 ekor, sedangkan pada kelompok ayam yang divaksinasi tidak mengalami kematian.
Tabel 6 Pengamatan perubahan patologi anatomi ayam yang ditantang virus ND
Perubahan patologi anatomi (PA) K1 (tidak divaksinasi) K3 (divaksinasi)
Kebengkakan ginjal 10/10 3/10
Hiperemi trakea 10/10 3/10
Petechiae proventrikulus 10/10 1/10
Petechiae cecal tonsil 10/10 0/10
Enteritis kattarhalis et hemorrhagi
ekimosa 10/10 4/10
Pengamatan patologi anatomi pada kelompok yang ditantang dapat dilihat pada Tabel 6. Pada umumnya penantangan menyebabkan adanya hiperemi dan kelainan pada organ pernapasan, pencernaan, dan pembengkakan ginjal. Pada ayam yang ditantang virus lapang dan tidak divaksin mengalami perubahan patologi anatomi berupa kebengkakan ginjal, hiperemi trakea, petechiae proventrikulus, petechiae cecal tonsil, dan enteritis kattarhalis et hemorrhagi ekimosa. Pada ayam yang ditantang virus lapang dan divaksin, beberapa ayam tidak mengalami perubahan patologi anatomi.
10
PEMBAHASAN Titer Antibodi
Pemeriksaan titer antibodi pada hari pertama terhadap anak ayam umur satu hari atau Day Old Chick (DOC) menunjukkan titer antibodi yang cukup protektif terhadap ND yaitu 25.63. Berdasarkan penelitian Ardhiani (2011), ayam dinyatakan protektif terhadap ND bila memiliki titer antibodi sebanyak 24.70. Antibodi yang terukur pada ayam berumur satu hari ini merupakan antibodi asal induk (maternal antibody). Antibodi asal induk adalah antibodi yang diperoleh dari induk secara pasif melalui kuning telur. Kuning telur mendapatkan antibodi dari serum induk ayam ketika proses pembentukan telur berlangsung di ovarium (Putra 2005).
Vaksinasi DOC dilakukan pada hari ke–2 menggunakan vaksin aktif melalui tetes mata dan hidung. Pemeriksaan titer antibodi pada hari ke–7 menunjukkan penurunan titer antibodi baik pada kelompok yang divaksin (K1 dan K2) maupun pada kelompok yang tidak divaksin (K3 dan K4) dengan nilai titer antibodi masing-masing kelompok tidak berbeda nyata (p>0.05). Hal ini juga terjadi pada pemeriksaan titer antibodi pada hari ke-14 sebelum dilakukan penantangan. Antibodi yang diamati pada hari ke–1 sampai ke–14 kemungkinan besar merupakan antibodi asal induk. Hal ini sesuai dengan penelitian Ardhiani (2011) bahwa hasil pengujian titer antibodi pada ayam umur 14 hari mulai menurun dan persentase ayam yang memiliki titer protektif hanya 70%. Tingginya titer antibodi asal induk pada anak ayam juga dapat menghambat respon pembentukkan kekebalan yang digertak melalui vaksinasi. Hal ini terjadi karena adanya netralisasi oleh antibodi asal induk terhadap virus vaksin yang ada dalam tubuh anak ayam (Puspitasari 2009). Selain itu, pembentukan antibodi menjadi kurang optimal pada kelompok ayam yang divaksin karena vaksin yang digunakan adalah vaksin bivalen.
Pemeriksaan titer antibodi dilakukan pada hari ke–22 atau 7 hari setelah penantangan. Kelompok K1 dan K3 memiliki titer antibodi yang berbeda nyata (p<0.05) bila dibandingkan dengan kelompok K2 dan K4 (p>0.05). Kelompok K3 memiliki titer antibodi tertinggi, hal ini dapat terjadi karena antibodi yang terukur merupakan hasil induksi dari vaksin dan penantangan yang dilakukan pada akhirnya akan meningkatkan titer antibodi. Kelompok K1 memiliki titer antibodi yang lebih rendah bila dibandingkan kelompok K3 karena pada kelompok K1 antibodi asal induk sudah menurun sehingga gertakan virus tantang tidak mampu menginduksi antibodi pada tubuh ayam. Kelompok K4 memiliki titer antibodi yang lebih rendah dibandingkan kelompok K1 dan K3, hal ini terjadi karena adanya respon netralisasi antibodi asal induk oleh antibodi hasil vaksinasi. Kelompok K2 memiliki titer antibodi paling rendah karena antibodi asal induk perlahan mulai menurun seiring dengan bertambahnya umur ayam tersebut. Antibodi asal induk hanya akan bermanfaat sampai ayam berumur dua sampai tiga minggu (Partadiredja 1983).
Gejala Klinis
Berdasarkan gejala klinis yang terlihat setelah penantangan baik pada ayam yang divaksin maupun tidak divaksin terdapat perbedaan. Pada kelompok K1, kematian terjadi pada hari pertama pengamatan yaitu sebanyak 1 ekor dan pada hari keenam yaitu 2 ekor. Hari ketiga setelah penantangan sekitar 90%
11 menunjukkan gejala klinis berupa kelemahan dan satu ekor yang mengalami diare dengan feses berwarna putih kehijauan. Selama sakit, ayam mengeluarkan virus dalam jumlah besar melalui feses (Kencana et al. 2012). Feses merupakan ekskreta ayam yang dapat menulari ayam lain dalam kelompok tersebut. Hari berikutnya, ayam pada kelompok ini mulai memperlihatkan keragaman gejala klinis dari ND. Pada kelompok K3, gejala klinis banyak terlihat pada hari kelima setelah penantangan yaitu sekitar 30%. Gejala klinis lain berupa lemah, bulu kusam, dan diare mulai jelas terlihat dihari berikutnya.
Menurut Ardana (2011) masa inkubasi ND sekitar 5–7 hari, sedangkan menurut Fadilah dan Polana (2004) masa inkubasi ND 2–15 hari, tergantung dari virus yang menginfeksi, umur, status kekebalan ayam, infeksi dengan organisme lain, kondisi lingkungan, dan jalur penularan. Hal ini membuktikan bahwa vaksinasi dapat menekan timbulnya gejala klinis sampai hari ke–5 pada kelompok K3. Penantangan yang dilakukan pada ayam merupakan pemaparan kedua kalinya dengan antigen yang sama. Adanya sel memori dalam sistem kekebalan menyebabkan sel limfosit B sebagai pembentuk antibodi memiliki kemampuan untuk mengingat paparan dengan antigen sebelumnya (Puspitasari 2009).
Patologi Anatomi
Manifestasi klinik akibat replikasi virus dan lesi yang ditimbulkan setelah vaksinasi diharapkan hanya menimbulkan perubahan patologi yang ringan pada ayam sehat yang dipelihara pada lingkungan yang optimal. Reaksi setelah vaksinasi akan muncul pada hari ketiga sampai dengan hari kelima dan berlangsung tiga sampai lima hari berikutnya dalam kondisi normal (Tarmudji 2005). Perubahan patologi anatomi yang patognomonis pada penyakit ND ditandai dengan ptechie pada proventrikulus, usus, sekal tonsil, trakea, dan paru-paru (Kencana et al. 2012). Hasil nekropsi kelompok K1 semuanya mengalami kebengkakan ginjal, hiperemi trakea, petechiae proventrikulus, petechiae cecal tonsil, dan enteritis kattarhalis et hemorrhagi ekimosa. Beberapa ayam pada kelompok K3 tidak menunjukkan patologi anatomi yang sama yaitu mengalami kebengkakan ginjal, hiperemi trakea, petechiae proventrikulus, dan enteritis kattarhalis et hemorrhagi ekimosa. Kelompok ayam yang divaksin dapat mentralkan sebagian virus tantang sehingga tidak menyebabkan kerusakan organ. Hal ini terbukti dari pengamatan patologi anatomi, hanya 30% ayam yang mengalami kerusakan organ, sedangkan 70% ayam tidak mengalami kerusakan organ.
12
Tabel 6 Evaluasi perbandingan antara kelompok K1 dan K3 terhadap kondisi titer antibodi, gejala klinis, dan patologi anatomi
Kelompok Titer antibodi Gejala klinis Patologi anatomi
Ayam tidak
divaksin (K1) Titer antibodi rendah karena tidak
divaksinasi
Muncul gejala klinis berupa lemah, bulu kusam, diare, dan ngorok. Kematian sebanyak 3 ekor
Semua ayam mengalami kebengkakan ginjal, hiperemi trakea,
petechiae proventrikulus, petechiae cecal tonsil,
dan enteritis kattarhalis et hemorrhagi ekimosa
Ayam divaksin
(K3) Titer antibodi lebih tinggi dibandingkan
dengan kelompok K1 dan mampu mencapai nilai batas protektif
Vaksinasi dapat mengurangi gejala kelemahan dan demam pada ayam. Tidak terjadi kematian.
Tidak muncul petechiae
cecal tonsil
Kelompok K1 memiliki titer antibodi lebih rendah dibandingkan dengan kelompok K3. Terdapat korelasi antara nilai titer antibodi dengan gejala klinis dan perubahan patologi anatomi yang muncul yaitu pada kelompok K1 lebih tinggi dibanding dengan K3. Gejala klinis yang ditimbulkan lebih banyak terjadi pada kelompok K1. Selain itu, pada perubahan patologi anatomi yang muncul juga lebih tinggi pada kelompok K1. Vaksinasi yang dilakukan mampu mengurangi terjadinya gejala klinis dan perubahan patologi anatomi pada ayam.
PENUTUP Simpulan
Pemberian vaksin aktif ND-IB (LaSota H-120) pada penelitian mampu menginduksi titer antibodi mencapai nilai batas perlindungan. Vaksinasi dapat mengurangi munculnya gejala kelemahan dan kerusakan cecal tonsil.
DAFTAR PUSTAKA
Ardana IBK. 2011. Strategi pencegahan penyakit inefeksius pada peternakan broiler berbasis laboratorium. Buletin Veteteriner Udayana. 3(1):51-59. Ardhiani S. 2011. Gambaran respon kebal Newcastle Disease (ND) pada ayam
petelur yang divaksinasi dengan vaksin AI-ND inaktif [skripsi]. Bogor (ID): Institut Pertanian Bogor
Fadilah R. 2005. Panduan Mengelola Peternakan Ayam Broiler. Jakarta (ID): Agromedia Pustaka.
Fadilah R. dan Polana A. 2004. Aneka Penyakit pada Ayam dan Cara Mengatasinya. Jakarta (ID): Agromedia Pustaka.
13 Fenner FJ, Gibbs IPJ, Murphy FA, Rott R, Studdert MJ, White DO. 1993.
Virologi Veteriner. Edisi Kedua. P Harya, Penerjemah. Semarang, IKIP Semarang Press. Terjemahan dari: Veterinary Virology.
Hewajuli DA, Dharmayanti NLPI. 2011. Patogenitas virus Newcastle Disease pada ayam. Wartazoa. 21(2):72-80.
Kencana GAY, Kardena IM, Mahardika IGNK. 2012. Peneguhan diagnosis penyakit Newcastle Disease lapang pada ayam buras di Bali menggunakan teknik RT-PCR. Jurnal Kedokteran Hewan. 6(1):28-31.
[OIE] Office International des Epizooties World Organization. 2012. OIE Terestrial Manual. Paris (FR):1-19.
Partadiredja M. 1983. Penyebaran penyakit Gumboro di wilayah Jabodetabek dan cara pencegahannya. Hemera Zoa. 71(1):34-38
Puspitasari S. 2009. Gambaran respon kebal tehadap Newcastle Disease (ND) pada ayam pedaging yang divaksin IBD-killed setengah dosis [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Putra LN. 2005. Perbandingan daya proteksi program vaksinasi tunggal dan ganda dengan vaksin Newcastle Disease aktif dan inaktif pada ayam broiler [skripsi]. Bogor (ID): Institut Pertanian Bogor
Saif YM, Barnes HJ, Glisson JR, Fadly AM, McDougald LR, Swayne DE. 2003.
Diseases of Poultry,11th Edition. Iowa (US): Iowa State Press.
Soeharsono. 2005. Zoonosis-Penyakit menular dari Hewan ke Manusia Volume 2. Yogyakarta (ID): Kanisius.
Soeripto. 2002. Pendekatan konsep kesehatan hewan melalui vaksinasi. Jurnal Litbang Pertanian. 21(2):48-55
Tarmudji. 2005. Penyakit pernapasan pada ayam ditinjau dari aspek klinik dan patologik serta kejadiannya di Indonesia. Wartazoa. 15(2):72–83.
Tizard I. 2000. Veteriner Immunology an Introduction. Canada(USA): W. B. Saunders Company.
14
Lampiran 1 Titer antibodi asal induk (hari ke–1)
No. Ayam Kelompok Titer Ab (Log 2)
1 DOC 6 2 DOC 5 3 DOC 6 4 DOC 5 5 DOC 6 6 DOC 6 7 DOC 7 8 DOC 5 9 DOC 5 10 DOC 5 11 DOC 6 12 DOC 5 13 DOC 6 14 DOC 6 15 DOC 5 16 DOC 5 17 DOC 7 18 DOC 5 19 DOC 6 20 DOC 6
Lampiran 2 Titer antibodi kelompok tidak divaksinasi dan divaksinasi (hari ke–7)
No. Ayam Titer Ab (Log 2)
Tidak divaksinasi Divaksinasi
1 4 4 2 3 4 3 5 5 4 0 5 5 4 4 6 5 3 7 5 3 8 4 5 9 4 1 10 4 5
15 Lampiran 3 Titer antibodi kelompok ayam yang tidak divaksinasi dan divaksinasi
(hari ke–14)
No. Ayam Titer Ab (Log 2)
Tidak divaksinasi (K2) Divaksinasi (K4)
1 4 3 2 4 2 3 4 3 4 3 4 5 4 2 6 1 3 7 4 4 8 4 3 9 3 4 10 4 4 11 3 1 12 3 3 13 0 4 14 3 2 15 2 3 16 3 4 17 4 3 18 3 4 19 3 3 20 4 4
Lampiran 4 Titer antibodi kelompok ayam yang ditantang virus ND (hari ke–22)
No. Ayam Titer Ab (Log 2)
Tidak divaksinasi (K1) Divaksinasi (K3)
1 4 6 2 4 5 3 7 6 4 4 3 5 3 5 6 1 6 7 3 3 8 5 6
16
Lampiran 5 Titer antibodi kelompok ayam yang tidak ditantang virus ND (hari ke–22)
No. Ayam Titer Ab (Log 2)
Tidak divaksinasi Divaksinasi
1 2 3 2 2 2 3 1 3 4 2 1 5 1 4 6 1 2 7 1 2 8 3 2 9 2 0 10 1 2
17
RIWAYAT HIDUP
Penulis lahir di Jakarta pada tanggal 24 Mei 1991 sebagai anak kedua dari dua bersaudara pasangan Bapak Eddy Chandra dan Ibu Miniarti. Penulis menyelesaikan sekolah dasar di SDN Karang Baru 04, Cikarang pada tahun 2003. Penulis melanjutkan pendidikan di SMP Negeri 1 Cikarang Utara dan lulus tahun 2006. Tahun 2009 penulis lulus dari SMA Negeri 1 Cikarang Utara dan pada tahun yang sama diterima sebagai mahasiswa Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama mengikuti perkuliahan, penulis pernah menjadi bendahara umum Himpunan Minat Profesi Hewan Kesayangan dan Satwa Akuatik Eksotik (HKSA) (2011/2012), anggota divisi InfokusHimpunan Minat Profesi Hewan Kesayangan dan Satwa Akuatik Eksotik (HKSA) (2010/2011). Penulis pernah mengikuti magang profesi di Taman Marga Satwa Ragunan Jakarta Selatan dan My Vets BSD Tanggerang.