KEMAMPUAN TANGGAP KEBAL AYAM PETELUR YANG DIVAKSIN DENGAN VAKSIN AKTIF NEWCASTLE DISEASE STRAIN LASOTA TERHADAP PAPARAN VIRUS NEWCASTLE DISEASE GEN VII
JATI HERMINA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Kemampuan Tanggap Kebal
Ayam Petelur yang Divaksinasi dengan Vaksin Aktif
Newcastle Disease
Strain LaSota
Terhadap Paparan Virus
Newcastle
Disease
Gen VII adalah benar karya saya dengan
arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada
perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang
diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan
dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut
Pertanian Bogor.
Bogor, Agustus 2013
Jati Hermina
ABSTRAK
JATI HERMINA. Kemampuan Tanggap Kebal Ayam Petelur yang Divaksinasi dengan Vaksin Aktif Newcastle Disease Strain LaSota Terhadap Paparan Virus Newcastle Disease Gen VII. Dibimbing oleh RETNO DAMAJANTI SOEJOEDONO dan SRI MURTINI.
Penelitian ini bertujuan untuk mengetahui respon imun dari vaksin Newcastle Disease strain LaSota terhadap tantang virus Newcastle Disease Gen VII, mengamati gejala klinis dan gambaran patologi-anatomi pada ayam diuji tantang. Empat puluh ayam layer digunakan pada penelitian ini. Ayam dibagi menjadi 4 kelompok K1, K2, K3 dan K4, masing-masing kelompok terdiri dari 10 ekor ayam. Kelompok K1 dan K2 adalah kelompok tidak divaksinasi, sedangkan kelompok K3 dan K4 adalah kelompok divaksinasi. Kelompok K2 dan K4 ditantang menggunakan virus Newcastle Disease Gen VII. Vaksinasi dilakukan pada ayam berumur 3minggu, uji tantang dilakukan pada minggu ke-5 (2 minggu setelah vaksinasi), dengan dosis dosis 104 CLD50/ekor , melalui rute oral. Sampel darah diuji dengan uji
serologis HI. Hasil penelitian menunjukkan kelompok K1 dan K2 memiliki titer antibodi lebih yang rendah dibanding kelompok K3 dan K4. Kelompok K2 memperlihatkan gejala klinis diare yang mengakibatkan kematian pada seluruh ayam. Kelompok K4 memiliki titer antibodi 22.5. Hasil penelitian menunjukkan vaksin ND LaSota dapat menginduksi respon imun terhadap paparan Newcastle Disease gen VII serta dapat mengurangi mortalitas dan munculnya gejala klinis
Kata kunci : Gen VII , LaSota, Layer, Newcastle Disease, Uji HI, Vaksin
ABSTRACT
JATI HERMINA. The immune response of Layer Vaccinated with Newcastle Disease Strain LaSota active vaccine against challenge by Newcastle Disease Gen VII. Supervised by RETNO DAMAJANTI SOEJOEDONO and SRI MURTINI.
The objectives of this study were to determine the immune response of vaccinated layer with Newcastle Disease strain Lasota active vaccine against challenged by Newcastle Disease Gen VII and to observe clinical signs and pathology anatomy lesions of challenged chickens. Fourty commercial layer were used in this study and divided into four groups K1, K2, K3, K4 each group consisted of 10 chickens. Group K1 and K2 were unvaccinated and group K3 and K4 were vaccinated. Group K2 and K4 were challenged using Newcastle Disease Gen VII. Chickens were vaccinated at 3 rd weeks and challenge at 5th weeks (2 weeks post vaccination), with dose 104 CLD50/chicken, through oral. ND antibody titer
the chickens. Group K4 has antibody 22.5. Our result showed that ND LaSota could induce immune response against challenge by ND gen VII also reduced mortality and clinical sign.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
KEMAMPUAN TANGGAP KEBAL AYAM PETELUR YANG DIVAKSIN DENGAN VAKSIN AKTIF NEWCASTLE DISEASE STRAIN LASOTA TERHADAP PAPARAN VIRUS NEWCASTLE DISEASE GEN VII
JATI HERMINA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kemampuan Tanggap Kebal Ayam Petelur yang Divaksinasi dengan Vaksin Aktif Newcastle Disease Strain LaSota Terhadap Paparan Virus Newcastle Disease Gen VII
Nama : Jati Hermina NIM : B04090128
Disetujui oleh
Prof Dr drh Retno D. Soejoedono, MS Pembimbing I
Dr drh Sri Murtini, M. Si Pembimbing II
Diketahui oleh
drh Agus Setiyono, MS, Ph.D, APVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan Januari 2013 ini berjudul Kemampuan Tanggap Kebal Ayam Petelur yang Divaksinasi dengan Vaksin Aktif Newcastle Disease Strain LaSota Terhadap Paparan Virus Newcastle Disease Gen VII.
Terima kasih penulis ucapkan kepada Prof Dr drh Retno D Soejoedono, MS selaku dosen pembimbing skripsi I dan Dr drh Sri Murtini, M Si selaku dosen pembimbing skripsi II, Dr drh Retno Wulansari, M Si selaku dosen pembimbing akademik, atas segala bimbingan, nasehat, dorongan, kritik, dan saran yang telah diberikan selama penelitian dan penulisan skripsi ini. Di samping itu, penulis juga mengucapkan terimakasih kepada drh Okti Nadya Poetri Msc MS, drh Ni Luh Putu Ika Mayasari PhD, Pak Nur, Mas Wahyu, Pak Lukman, dan Mba Adeh atas bantuan, dorongan, masukan selama pengumpulan dan pengolahan data.
Ungkapan terima kasih juga disampaikan kepada ayah, ibu, adik-adik, eyang putri dan uwa irma atas doa dan dukungan yang diberikan selama ini. Selanjutnya ungkapan terima kasih penulis ucapkan kepada teman sepenelitian (Wily, Yuli, Chiko, Fitri, Denny, Muhyar), sahabat-sahabat terdekat (Risna, Hendro, Vian, Kevin) dan teman-teman seangkatan Geochelone 46 yang sama-sama berjuang dalam menempuh pendidikan di Institut Pertanian Bogor.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Tujuan Penelitian 4
Manfaat Penelitian 4
METODE 4
Bahan 4
Alat 4
Metode Penelitian 5
Metode Pengujian 5
Analisis Statistik 7
HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 9
SIMPULAN 13
DAFTAR PUSTAKA 13
LAMPIRAN 17
RIWAYAT HIDUP 19
DAFTAR TABEL
1 Gejala klinis ayam tidak divaksin ND Lasota dan ditantang virus
ND gen VII 8
2 Gejala klinis ayam divaksin ND LaSota dan ditantang virus ND
gen VII 8
3 Pengamatan jumlah kematian ayam yang ditantang virus ND gen
VII 8 4 Pengamatan perubahan patologi anatomi ayam yang ditantang
virus ND gen VII 8
5 Rataan titer antibodi pada setiap minggu 9 6 Evaluasi perbandingan antara kelompok K2 dan K4 terhadap
kondisi titer antibodi, gejala klinis, dan patologi anatomi 12
DAFTAR GAMBAR
1 Rataan titer antibodi setiap kelompok 9
DAFTAR LAMPIRAN
1 Titer andibodi ayam umur 3 minggu 17
2 Titer antibodi ayam umur 5 minggu 17
PENDAHULUAN
Latar Belakang
Penyakit pernapasan pada unggas khususnya ayam diantaranya adalah Newcastle Disease (ND), Avian Influenza (Al), Infectious Bronchitis (IB), Infectious Laryngotracheitis (ILT), Chronic Respiratory Disease (CRD) atau CRD Komplek (CRDK), Infectious Coryza (Snot) dan Aspergillosis, kolera unggas, Swollen Head Syndrome (SHS) dan Koliseptisemia (Tarmudji 2005). Salah satu penyakit unggas yang menyerang sistem pernafasan adalah Newcastle Disease (ND). Newcastle disease adalah permasalahan dalam penyakit viral yang menyarang peternakan unggas di Indonesia sejak 1926 (Soedijar 2002). Penyakit unggas ini diketahui menyerang dari tahun 1926 oleh Kraneveld di Batavia (Jakarta), namun pertama kali dilaporkan oleh Doyle tahun 1927 di Inggris Newcastle on Tyne (Soeharsono 2005).
Virus ND (tetelo) merupakan penyakit viral yang infeksius pada peternakan ayam. ND disebabkan oleh Avian Paramyxovirus yang tergolong dalam virus RNA. Kelompok virus RNA, famili paramyxoviridae memiliki bentuk yang lebih besar dari orthomyxoviridae yaitu 100–250 nm. Diameter heliks nuklueoprotein 18 nm. Berat molekul RNA 4–8 x 106 Dalton dan resisten terhadap actinomycin D. Virus memproduksi haemolisin, dalam kultur sel membentuk badan inkulsi (inclusion body) yang terletak di dalam sitoplasma, kadang-kadang di dalam inti (Malole 1988).
Gejala klinis akibat infeksi virus ND dapat bervariasi tergantung patotipe virus dan kepekaan inang (Wibowo et al. 2012). Berdasarkan gejala klinisnya ND terbagi menjadi lima patotipe, yaitu Viscerotropic Velogenic Newcastle Disease (VVND), Neutropic Velogenic Newcastle Disease (NVND), Mesogenic Newcastle Disease, Lentogenic respiratory Newcastle Disease, dan Asymptomatic Enteric Newcastle Disease (Alexander 2003). Tipe Velogenik menyebabkan gangguan pernafasan, perdarahan visceral, tanda-tanda neurologis dan menyebabkan kematian hingga 100% pada ayam (Alexander 2003). Gejala klinis yang timbul karena ND bulu kusam, lethargy, demam sampai 43 °C, gejala respirasi berupa sesak nafas dan batuk, diare, penurunan produksi telur, convulsi, tortikolis, tremor dan paralisis sayap serta kaki (Alders 2001).
Penyakit ini mempunyai dampak ekonomi yang penting karena menimbulkan morbiditas dan mortalitas yang tinggi, penurunan produksi telur dalam kuantitas dan kualitas, gangguan pertumbuhan serta biaya penanggulangan penyakit yang tinggi. Patologi anatomi pada ayam yang dinekropsi menunjukkan kelainan pada saluran pencernaan berupa petechiae pada proventrikulus, ventrikulus, seka tonsil dan nekrosis pada usus. Lesi yang ditemukan pada organ saluran pernafasan seperti perdarahan pada trakea dan paru-paru. Virus neutropik velogenik saat nekropsi ditemukan hemoragi pada otak (Alexander 2003).
2
kondisi lingkungan dan cara penularan. Virus ND mempunyai masa inkubasi antara 2–15 hari tergantung jenis virus (Alexander 2003). Penularan terjadi melalui inhalasi dan kontak langsung.
Vaksinasi adalah suatu tindakan pencegahan penyakit dengan sengaja memasukan agen penyakit (antigen) yang telah dilemahkan kedalam tubuh hewan. Tujuan vaksinasi untuk menggertak pembentukan daya tahan tubuh terhadap suatu penyakit, aman dan tidak menimbulkan penyakit (Akoso 1998). Penggunaan vaksin hidup terhadap ternak dapat menghemat waktu karena cara aplikasinya yang mudah, seperti vaksin spray melalui aerosol. Vaksin ND mampu memberikan proteksi silang untuk semua strain virus ND. Vaksin kombinasi ND dan IB tersedia di pasaran secara komersial dan secara luas digunakan untuk pencegahan (Licata 2007).
Vaksin ND berdasarkan virulensinya terbagi menjadi tipe lentogenik (keganasan rendah), mesogenik (keganasan sedang) dan velogenik (sangat ganas). Tipe lentogenik merupakan strain virus ND yang virulensi dan mortalitasnya rendah yaitu strain B1 (Hitcher), strain LaSota, dan strain F (FAO 2004). Strain F memiliki tingkat virulensi paling rendah dibandingkan dengan strain lain pada tipe lentogenik. Vaksin dengan strain ini paling efektif dilakukan secara individu. Aplikasi strain B1 dilakukan melalui air minum dan spray. Pemberian vaksinasi dilakukan pada DOC (Day Old Chick) kemudian diikuti dengan strain LaSota pada umur 10–14 hari (OIE 2012).
Jenis vaksin ND yang telah dipasarkan adalah vaksin aktif lentogenik (misalnya galur F, B1, dan LaSota), vaksin aktif mesogenik (misalnya Komarov dan Roakin) dan vaksin inaktif (OIE 2012). Vaksin aktif lentogenik adalah jenis vaksin yang paling umum digunakan terutama vaksin LaSota. Imunogenitas vaksin ND ternyata tidak dipengaruhi oleh virulensinya terutama virulensi yang diukur berdasarkan atas Intracerebral pathogenicity index (Orsi et al. 2009).
Identifikasi virus ND dapat dilakukan dengan pengujian serologis, yaitu hemaglutinasi (HA), hambatan hemaglutinasi (HI), MIT test, Egg bit, netralisasi virus dalam embrio ayam, netralisasi virus dalam kultur sel, ELISA (Enzyme-Linked ImmunoSorbent Assay), agar gel presipitasi (AGP). Uji HI digunakan untuk mengukur titer antibodi yang terkandung dalam serum yang berhubungan dengan tingkat kekebalan seekor hewan terhadap virus tertentu dan mengidentifikasi virus. Pengukuran titer antibodi dilakukan menggunakan antibodi dan virus yang homolog.
Virus ND genotipe VII merupakan salah satu genotipe dominan yang beredar di seluruh dunia dan merupakan virus virulen. Virus ND genotipe VII termasuk kedalam patotipe VVND (Raharjo 2013). ND genotipe VII menyebabkan wabah di Asia timur dan Eropa Barat. Virus ND yang diisolasi di Taiwan pada tahun 1984 adalah isolasi awal dari virus genotipe VII (Yang et al.1999). Tahun 1985 virus genotipe VII banyak menyerang peternakan di Jepang (Mase et al. 2002).
3 serotipe avian paramyxovirus. Paramyxovirus tipe I (I) sampai PMV-VIIII. Virus ND yang termasuk PMV-I merupakan virus yang penting dalam unggas. Tipe II dapat ditemukan pada burung dan jarang pada unggas atau kalkun. Tipe III ditemukan pada burung peliharaan dan kalkun di Kanada, USA, UK, Prancis dan Jerman (Tabbu 2000).
Sejak tahun 1926, virus ND tidak pernah menghilang dari Asia. Meskipun semua ayam komersial di Indonesia secara rutin divaksinasi dengan vaksin aktif maupun inaktif. Tahun 2009 dan 2010, wabah ND terjadi pada ayam komersial di Indonesia, menyebabkan kematian hingga 70% sampai 80%. Penelitian yang dilakukan Xiao et al. (2012a) menunjukkan vaksin galur B1 dan LaSota yang berasal dari genotipe II memiliki perbedaan dengan strain virus yang beredar dengan tingkat virulen lebih tinggi.
Virus ND genotipe V, VI, VII, dan VIII adalah genotipe dominan yang beredar di seluruh dunia dan merupakan virus virulen. Virus genotipe V awalnya muncul di Amerika Selatan dan Tengah pada tahun 1970 dan menyebabkan wabah di Eropa pada tahun yang sama (Miller et al. 2010). Virus genotipe VI muncul pada tahun 1960-1985 beredar sebagai genotipe dominan di Asia, kemudian virus genotipe VII muncul dan menyerang peternakan di Jepang (Mase et al. 2002).
Virus ND Genotipe VII terbagi dalam dua subgenotipe yaitu, genotipe VIIA dan genotipe VIIB. Virus genotipe VIIA mewakili virus yang muncul pada 1990 di Timur kemudian menyebar ke Eropa dan Asia. Genotipe VIIB, mewakili virus yang muncul di Timur kemudian, menyebar ke Afrika Selatan (Aldous et al. 2003). Kedua subgenotipe VII dibagi lagi menjadi VIIc, d, dan e, yang merupakan isolat dari China, Kazakhstan dan Afrika Selatan (Wang et al. 2006), dan VIIf, g, dan h yang merupakan isolat Afrika. Genotipe VIII virus telah beredar di Afrika Selatan sejak tahun 1960 dan terus beredar di Asia Tenggara.
Penelitan Yang et al. (1999) virus ND terjadi di Taiwan dalam tiga dekade (tahun 1969, 1984, dan 1995). Virus genotipe VII menyebabkan wabah di Asia timur dan Eropa Barat. Wabah ini telah merupakan panzootik keempat oleh virus ND, yang berbeda dari panzootic ketiga yang disebabkan oleh pigeon PMV-I virus yang banyak menyebar diberbagai Negara di Dunia. Virus ND terisolasi di Taiwan pada tahun 1984 adalah isolasi awal dari virus genotipe VII (Yang et al.1999).
Wabah penyakit ND gen VII ditemukan di pertenakan unggas komersial pada tahun 2009-2010. Wabah ini menimbulkan kekhawatiran mengenai kekebalan protektif dari vaksin yang digunakan terhadap strain virus yang beredar di Indonesia. Virus ND gen VII yang ditemukan di Indonesia diklasifikasikan dalam strain Banjarmasin/010/10 (Ban/010) (Xiao et al. 2012b) dan Bali-1/07 (Adi et al. 2011).
4
disediakan sampai umur 1–2 minggu (King dan Cavanagh 1991). Keberadaan agen penyakit dalam tubuh juga dapat mempengaruhi keberhasilan vaksinasi (Ardana 2011).
Tujuan Penelitian
Tujuan yang ingin dicapai dari penelitian ini adalah mengetahui respon imun terhadap vaksin ND LaSota terhadap paparan virus Newcastle Disease Gen VII pada ayam petelur.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai efektifitas pemberian vaksin aktif LaSota dalam menghadapi paparan virus ND Gen VII pada ayam petelur.
METODE
Penelitian dilakukan pada bulan Desember 2012 sampai dengan Februari 2013. Penelitian ini bertempat di Laboratorium Imunologi bagian Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan Institut Pertanian Bogor dan Kandang Unit Pengelola Hewan Laboratorium (UPHL) Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan
Bahan yang diperlukan adalah vaksin aktif ND LaSota dan virus ND Gen VII untuk uji tantang, alkohol 70%, larutan NaCl fisiologis 0.85%, kapas, Phosphat Buffer Saline (PBS), Natrium Sitrat 3.8% dan suspensi virus ND standar (4 HAU).
Alat
5
Metode Penelitian
Empat puluh ekor ayam Day Old Chick (DOC) jantan petelur dipelihara di kandang isolator PT. Sanbio, kemudian diberi pakan dan minum secara ad libitum. Empat puluh ekor ayam dibagi ke dalam 4 kelompok yaitu kelompok K1, K2, K3 dan K4. Setiap kelompok terdiri dari 10 ekor ayam. Kelompok K1 adalah ayam yang tidak divaksinasi dan tidak ditantang. Kelompok K2 adalah ayam yang tidak divaksinasi dan ditantang. Kelompok K3 adalah ayam yang divaksin dan tidak ditantang. Kelompok K4 adalah ayam yang divaksin dan ditantang.
Ayam umur 3 minggu dilakukan pengambilan darah menggunakan spuid 3ml melalui vena brachialis untuk pengujian titer antibodi. Vaksinasi dilakukan pada kelompok K3 dan K4 setelah pengambilan darah. Vaksin yang diberikan yaitu vaksin ND LaSota dengan dosis 106 EID50/ekor melalui
rute tetes mata dan hidung.
Ayam dipindahkan ke kandang UPHL FKH IPB pada umur 5 minggu (2 minggu setelah vaksinasi) dan di tempatkan di dalam kandang litter terpisah. Kandang litter dialasi sekam serta disediakan pakan dan minum ad libitum. Pengambilan darah dilakukan pada ayam umur 5 minggu sebelum dilakukan uji tantang. Kelompok K2 dan K4 diuji tantang virus ND Gen VII dengan dosis 104 CLD50/ekor rute oral. Pengamatan dilakukan
setiap hari selama 2 minggu setelah uji tantang untuk melihat gejala klinis yang muncul. Ayam yang mati pada saat pengamatan kemudian dinekropsi untuk diamati perubahan patologi anatomi.
Semua ayam yang masih hidup pada umur 7 minggu (2 minggu setelah uji tantang) dilakukan pengambilan darah dan dinekropsi untuk diamati perubahan patologis anatomi. Sampel darah yang telah dikoleksi disimpan dalam kondisi dingin (5–7 °C) dalam kotak pendingin yang berisi ice pack kemudian dibawa ke laboratorium. Sampel darah diinkubasi dalam refrigerator untuk mendapatkan serum, kemudian dipisahkan ke dalam tabung mikro dan disimpan dalam freezer sampai dilakukan pengujian titer antibodi di laboratorium. Metode pengujian untuk mengtahui titer antibodi terhadap virus ND ditentukan dengan uji Haemagglutination Inhibition (HI test).
Metode Pengujian
Pembuatan Red Blood Cell (RBC)
6
dilakukan pengenceran dengan penambahan NaCl fisiologis secara bertingkat menjadi 50%,5% dan 1%. Suspensi RBC tersebut bisa langsung digunakan dengan diencerkan terlebih dahulu menjadi suspensi 1% untuk uji Hambat Aglutinasi (HI Test) mikrotitrasi.
Prosedur penyiapan virus standar dengan haemagglutination (HA) test
(OIE 2012)
Dua puluh lima μl PBS dimasukkan ke sumur microplate berbentuk V (V bottom microplate) baris pada A–F, kolom 2–12, kemudian 50μl antigen ND dimasukkan ke sumur A1–E1. Antigen ND sebanyak 25μl dipindahkan dari sumur A1–E1 ke dalam sumur A2–E2 menggunakan pipet multichanel lalu dihomogenkan 5 kali dengan cara memipet naik dan turun. Setiap memasukkan antigen dilakukan penggantian tips.
Dua puluh lima μl PBS dimasukkan ke dalam sumur B2 dan dihomogenkan 10 kali dengan cara memipet naik dan turun. Selanjutnya dari sumur B2 dikeluarkan sebanyak 25μl campuran tersebut sehingga pengenceran pada sumur B2 menjadi 1/3. Tujuh puluh lima μl PBS dimasukkan ke dalam sumur C2 dan dihomogenkan 10 kali dengan cara cara memipet naik dan turun. Dari sumur C2 diambil 75μl campuran pada sumur tersebut sehingga pengencerannya menjadi 1/5.
Seratus dua puluh lima μl PBS dipipet ke dalam sumur D2 dan dihomogenkan 10 kali dengan cara memipet naik dan turun. Dari sumur D2 diambil 125μl suspensi sehingga pengenceran pada sumur tersebut menjadi 1/7. Seratus tujuh puluh lima μl PBS dipipet ke dalam sumur E2 dan dihomogenkan 10 kali dengan cara memipet naik dan turun. Dari sumur E2 diambil 175μl suspensi sehingga pengenceran pada sumur tersebut menjadi 1/9. Selanjutnya digunakan multichanelpipet dengan tips baru. Dipipet 25μl suspensi dari kolom A2–E2 ke dalam A3–E3 dan dihomogenkan lima kali dengan cara memipet naik dan turun. Dipipet dengan tips yang sama 25 μl suspensi dari kolom A3–E3 ke dalam kolom A4–E4 dan dihomogenkan lima kali dengan cara memipet naik dan turun. Langkah ini diulangi hingga kolom A12–E12. Setelah dihomogenkan lima kali dari A12–E12 dibuang 25
μl suspensi. Dua puluh lima μl PBS dan 25μl RBC (1% v/v) dimasukkan ke dalam setiap sumur. Plate dikocok selama 10 detik. Kemudian plate diinkubasi selama 60 menit pada suhu 4°C. Hasil diamati setelah sumur kontrol positif tampak adanya reaksi penghambatan aglutinasi dengan memiringkan plate.
Prosedur uji HI Mikrotitrasi (OIE 2012)
Dua puluh lima μl PBS dimasukkan ke dalam sumur microplate berbentuk V (V bottom microplate), kemudian 25μl serum ayam dimasukkan pada lubang pertama dan dilakukan pengenceran menggunakan micropipette dengan cara menghisap dan mengeluarkan campuran sebanyak 5 kali lalu 25μl campuran dipindahkan ke sumur kedua. Pengenceran dilakukan sampai sumur ke-12. Sebanyak 25μl pada sumur ke-12 dibuang.
7 25μl ke semua sumur. Plate digoyang selama 10 detik untuk menghomogenkan larutan dan diinkubasi pada suhu 4°C selama 60 menit.
Hasil diamati setelah sumur kontrol positif tampak adanya reaksi penghambatan aglutinasi. Titer antibodi dihitung dengan melihat batas akhir penghambatan aglutinasi sempurna. Batas akhir pada pengenceran tertinggi yang mampu menghambat terjadinya aglutinasi secara sempurna dan disebut dengan “end point”.
Analisis Statistik
Rataan titer antibodi dihitung dengan menggunakan Geometric Mean Titre (GMT) dengan rumus:
log GMT = log S1) + log S2) + … + log n Sn) N
Keterangan : N = Jumlah contoh serum yang diamati
t = Titer antibodi pada pengenceran tertinggi (yang masih dapat menghambat aglutinasi sel darah merah)
S = Jumlah contoh serum yang bertiter t n = Titer antibodi pada sampel ke-n
Data rataan titer antibodi yang diperoleh dari penelitian dianalisis menggunakan metode analysis of variance (Anova) dan dilanjutkan dengan uji Duncan untuk membuktikan adanya perbedaan yang nyata dari perlakuan kelompok. Pengamatan gejala klinis dan perubahan patologi anatomi dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Hasil
Gejala klinis diamati selama 14 hari. Gejala klinis yang diamati selama pengamatan pada kelompok ayam yang tidak divaksinasi dan ditantang dapat dilihat pada Tabel 1. Pengamatan jumlah kematian ayam yang ditantang virus ND gen VII dapat dilihat pada Tabel 3. Kelompok tidak divaksinasi dan ditantang (K2) memperlihatkan gejala diare, lemah dan bulu kusam. Gejala klinis diare kehijauan pada hari ke-3 sebanyak 70% dan kematian sudah mulai terjadi dari hari ke-2 sampai hari ke-4 sebanyak 100%.
8
Tabel 1 Gejala klinis ayam tidak divaksin ND Lasota dan ditantang virus ND gen VII (K2)
Gejala klinis Hari ke- (setelah tantang)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 Tanda hubung em (—) menunjukkan tidak ada sampel yang diamati karena mengalami kematian
Tabel 2 Gejala klinis ayam divaksin ND LaSota dan ditantang virus ND gen VII (K4)
Gejala klinis
Hari ke- (setelah tantang)
1 2 3 4 5 6 7 8 9 10 11 12 13 14
Tabel 3 Pengamatan jumlah kematian ayam yang ditantang virus ND gen VII
Gejala klinis
Hari ke- (setelah tantang)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 K2a 0/10 1/10 2/9 7/7 — — — — — — — — — — K4b 0/10 0/10 3/10 1/7 0/6 0/6 0/6 0/6 0/6 0/6 0/6 0/6 0/6 0/6
a
Kelompok tidak divaksinasi namun ditantang. bKelompok divaksinasi namun ditantang. Tanda hubung em (—) menunjukkan tidak ada sampel yang diamati
Pengamatan perubahan patologi anatomi akibat uji tantang pada kelompok ayam tidak divaksinasi (K2) menunjukkan adanya perdarahan pada saluran pencernaan dan pembengkakan pada limpa. Kelompok ayam divaksinasi (K4) mengalami perdarahan pada saluran pencernaan, sedangkan saluran pernafasan tidak mengalami kelainan. Perubahan patologi anatomi pada kelompok ditantang baik yang tidak divaksin dan divaksin dapat dilihat pada Tabel 4.
Tabel 4 Pengamatan perubahan patologi anatomi ayam yang ditantang virus ND gen VII
Perubahan patologi anatomi (PA) K2a K4b
Kebengkakan limpa 10/10 0/10
Ptechiae proventrikulus 10/10 0/10
Ptechiae seaccal tonsil 10/10 0/10
Enteritis kattarhalis et hemorrhagi
ekimosa 10/10 10/10
a
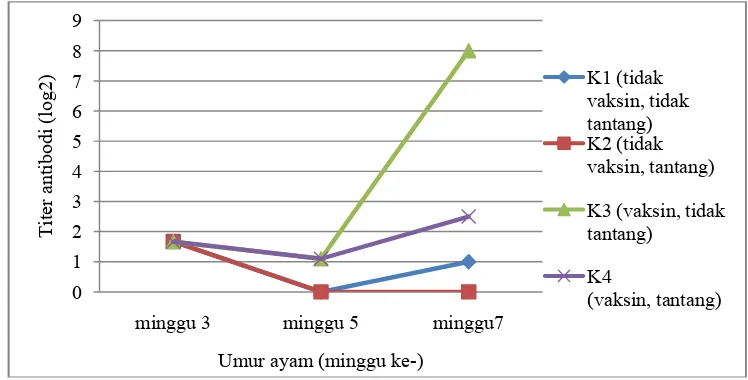
9 Nilai rataan titer antibodi pada setiap minggu dapat dilihat pada Tabel 5, sedangkan perkembangan nilai rataan titer antibodi log setiap kelompok dapat dilihat pada Gambar 1. Hasil pemeriksaan titer antibodi pada saat ayam berumur 3 minggu adalah . . Titer tersebut adalah titer pada seluruh ayam sebelum dilakukan vaksinasi. Ayam berumur 5 minggu titer antibodi pada kelompok tidak divaksinasi (K1 dan K2) adalah . dan kelompok divaksinasi (K3 dan K4) adalah . . Penurunan titer terlihat pada seluruh kelompok perlakuan pada minggu ke-5.
Tabel 5 Rataan titer antibodi pada setiap minggu
Kelompok Rataan titer antibodi (log 2) pada minggu ke-
3 5 7 Tidak vaksinasi, tidak tantang
(K1) 1.667±1.942
a
0.000±0.000 a 1.000±1.290 a Tidak vaksinasi, tantang (K2) 1.667±1.942a 0.000±0.000a — Vaksinasi, tidak tantang (K3) 1.667±1.942a 1.100±0.994b 8.000±0.000b Vaksinasi, tantang (K4) 1.667±1.942a 1.100±0.994b 2.500 ±1.784c Keterangan: Huruf superscript yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata pada taraf p<0.05. Tanda hubung em (—) menunjukkan tidak ada sampel yang diuji.
Gambar 1 Rataan titer antibodi setiap kelompok
Titer antibodi 2 minggu setelah uji tantang nilai rataan titer antibodi kelompok K1 adalah . , sedangkan nilai rataan antibodi K2 tidak dapat dilakukan perhitungan karena ayam mengalami kematian setelah uji tantang. Nilai rataan titer antibodi kelompok K3 adalah . . Nilai rataan titer antibodi K4 adalah . .
Pembahasan
Pengamatan perubahan gejala klinis dilakukan selama 2 minggu setelah uji tantang. Kelompok K2 (tidak divaksinasi, ditantang) memperlihatkan gejala diare sebesar 70%. Infeksi ND yang timbul
0
minggu 3 minggu 5 minggu7
10
menyebabkan kematian sebesar 100% dimulai pada hari ke-2 sampai ke-4. Kematian pada kelompok tidak divaksinasi terjadi karena tidak terdapat antibodi. Gejala klinis berupa tortikolis tidak terlihat pada kelompok K2 karena infeksi virus ND gen VII adalah patotipe velogenik. Patotipe velogenik jenis virus yang sangat virulen sehingga cepat menyebabkan kematian. Infeksi virus VVND merupakan bentuk akut yang menyebabkan kematian pada ayam segala umur dengan mortalitas 100%. Ciri dari virus VVND memperlihatkan diare dengan feses berwarna hijau, tremor otot, serta paralisa kaki dan sayap (Alexander 2003).
Gejala klinis pada kelompok K4 (divaksin, ditantang) muncul pada hari ke-2 setelah uji tantang. Gejala klinis yang muncul berupa diare sebesar 50% dan lemah serta bulu kusam sebesar 30%. Pengamatan pada hari ke-5 sampai akhir pengamatan seluruh ayam pada kelompok ini tidak menunjukan gejala klinis. Vaksinasi yang dilakukan pada kelompok K4 hanya dapat memberikan perlindungan dari kematian sebesar 60%. Vaksinasi yang diberikan dapat mengurangi kematian dan gejala klinis. Vaksinasi dengan ND Lasota mampu menghambat masa inkubasi virus ND gen VII. Virus ND mempunyai masa inkubasi antara 2–15 hari tergantung jenis virus (Alexander 2003), pada infeksi virus ND gen VII inkubasi virus sangat cepat terjadi karena gejala klinis muncul pada hari ke-2.
Vaksinasi yang diberikan pada kelompok K4 dinyatakan tidak memenuhi syarat karena masih terjadi kematian sebanyak 40%, selain itu virus tantang yang digunakan merupakan virus ND gen VII. Vaksinasi dapat dinyatakan memenuhi syarat apabila pada akhir masa pengamatan tidak kurang dari 90% ayam yang divaksinasi dan ditantang tetap hidup tanpa memperlihatkan gejala klinis penyakit ND, sedangkan semua ayam kelompok tidak divaksinasi dan ditantangl mati dengan memperlihatkan gejala klinis ND (Ditjennak 2007).
Perubahan patologi anatomi pada ayam yang ditantang sesuai dengan lesio yang disebabkan infeksi virus VVND. Adanya infeksi virus VVND ditandai dengan perdarahan pada saluran pencernaan (Alexander 2003). Kelompok K2 semua ayam mati selama pengamatan setelah uji tantang. Gambaran patologi anatomi yang terlihat adalah limpa bengkak, ptechiae di proventrikulus dan enteritis kattarhalis et hemorrhagi ekimosa. Organ paru-paru dan trachea tidak ditemukan kelainan. Perubahan patologi anatomi pada kelompok K4 menunjukkan enteritis kattarhalis et hemorrhagi sebanyak 100%. Kelainan tidak ditemukan pada hati, proventrikulus, trakea dan paru-paru.
11 Perdarahan pada saluran pencernaan digolongkan kedalam Viscerotropic Velogenic Newcastle Disease (VVND). Bentuk tersebut merupakan penyakit akut dan menimbulkan kematian pada ayam segala umur dengan mortalitas 100% (Beard 1984). Vaksinasi yang diberikan mampu menurunkan perubahan patologi anatomi pada kelompok K4 dibandingkan dengan kelompok ayam yang tidak divaksinasi (K2).
Sistem kekebalan dibagi menjadi sistem kekebalan non spesifik dan sistem kekebalan spesifik. Sistem kekebalan non spesifik merupakan sistem kekebalan yang secara alami diperoleh tubuh dan proteksinya tidak terlalu kuat (Butcher dan Miles 2013). Sistem ini berupa pertahanan fisik, mekanik, dan kimiawi yang berespon pada awal paparan. Kekebalan non-spesifik berupa makrofag yang bekerja melalui proses fagositosis dengan membunuh, menghancurkan, dan mengeliminasi antigen dari tubuh. Sistem kekebalan spesifik yang terdiri atas kekebalan berperantara sel dan kekebalan humoral. Kekebalan humoral (kekebalan permukaan) memproduksi antibodi yang berasal dari limfosit sel B pada bursa fabricius yang akan berdiferensiasi menjadi sel plasma untuk membentuk immunoglobulin dan sel memori (Wibawan 2003).
Hasil nilai rataan titer antibodi pada minggu ke–3 pada semua kelompok adalah 21.67. Nilai rataan titer antibodi berada dibawah titer protektif. Nahamya et al. (2006) titer antibodi lebih dari 23 adalah titer protektif terhadap tantangan yang berpotensi mematikan oleh virus ND virulen. Menurut Darminto et al. (1998) titer antibodi protektif terhadap ND adalah 24. Menurut Ronohardjo et al. (1989) ayam yang memiliki titer HI ≥ 25 merupakan ayam yang memiliki titer protektif yang dapat melindungi ayam dari munculnya gejala klinis. Nilai rataan antibodi pada minggu ke-3 menunjukkan masih terdapat antibodi asal induk. Menurut Indriani dan Darminto (2000) antibodi asal induk akan turun secara linier seiring bertambahnya umur dan akan mencapai titer setengah dari titer baru menetas setelah 5–6 hari. Proteksi antibodi asal induk terhadap infeksi disediakan sampai umur 1–2 minggu (King dan Cavanagh 1991).
12
Uji tantang dilakukan pada dua kelompok, yaitu K2 dan K4. Kelompok K1 (tidak divaksin dan tidak ditantang), nilai rataan antibodi meningkat tidak signifikan menjadi 21.00. Titer antibodi kelompok K1 pada minggu ke-7 lebih tinggi dibandingkan minggu ke-5 karena adanya paparan virus lapang yang menyerang. Kelompok K2 (tidak divaksin dan ditantang) semua ayam pada kelompok ini mati. Hal ini menunjukkan bahwa virus ND gen VII termasuk virus velogenik dengan tingkat mortalitas 100% dan jika ayam tidak memiliki kekebalan tubuh, maka akan berdampak pada kematian. Kelompok K3 (divaksin dan ditantang) memiliki nilai titer antibodi yang meningkat secara signifikan menjadi 28.00. Vaksinasi yang dilakukan dapat meningkatkan titer antibodi sampai nilai antibodi titer protektif, walaupun dibutuhkan waktu lebih lama. Kelompok K4 (divaksin dan ditantang) memiliki nilai titer antibodi sebesar 22.5. Nilai rataan titer antibodi K4 minggu ke-7 lebih tinggi dibanding minggu ke-5, namun tidak mencapai nilai batas antibodi protektif 23 (Nahamya et al.2006), 24 (Darminto et al. 1998) dan 25 (Ronohardjo et al. 1989).
Menurut Mockett dan Darbyshire (1981) hasil titer antibodi kelompok ditantang akan meningkat setelah ditantang dan akhirnya akan terus menurun sebelum akhirnya akan meningkat kembali. Kelompok K4 memiliki nilai rataan titer antibodi lebih rendah dibanding K3, karena kelompok K4 dilakukan penantangan yang menyebabkan respon tubuh terhadap virus tantang. Berdasarkan analisis statistika (p<0.05) kelompok K3 K4 dan K1 K4 berbeda nyata (p<0.05) karena uji tantang pada K4 mempengaruhi titer antibodi. Kelompok K2 dengan K4 tidak dapat dianalisis karena pada kelompok K2 seluruh ayam mengalami kematian selama pengamatan. Pemberian vaksin pada kelompok K4 mampu melindungi dari virus tantang. Ayam yang divaksin dengan virus hidup atau killed oil-emulsion LaSota (genotipe II), sepenuhnya dilindungi terhadap heterolog tantangan dari strain genotype VIg, VIB, VIId dan IX. Efektivitas perlindungan dari dua vaksin strain komersial di ayam terhadap dua virulen tantangan virus dari genotipe VII (Miller et al. 2010).
Tabel 6 Evaluasi perbandingan antara kelompok K2 dan K4 terhadap kondisi titer antibodi, gejala klinis, dan patologi anatomi
Kelompok Titer antibodi Gejala Klinis Patologi anatomi
Kelompok diare sebanyak 70% dan menyebabkan
13 Kelompok K2 dan K4 memperlihatkan gejala klinis diare berwarna hijau yang menyebabkan kematian. Kelompok K4 terjadi gejala klinis diare sesuai dengan perubahan patologi anatomi yang ditemukan adalah enteritis kataralis et hemoragi. Kelompok K2 memiliki nilai titer antibodi menurun dari minggu ke-3 sampai ke-5 karena titer antibodi asal induk yang terus menurun dan habis. Nilai rataan titer antibodi K4 meningkat pada setiap minggu pengamatan, namun tidak mencapai titer protektif. Nilai Rataan titer antibodi yang tidak terlalu rendah dapat membentuk kekebalan sehingga kematian tidak terjadi terlalu banyak yaitu 40%.
Nilai rataan titer antibodi K2 lebih rendah dari K4, sehingga kelompok K2 menunjukkan gejala klinis diare sebesar 70% dibandingkan kelompok K4 sebesar 30%, gejala klinis yang menyebabkan kematian kelompok K2 sebesar 100% sedangkan K4 sebesar 40% dan perubahan patologi anatomi yang muncul pada kelompok K2 lebih tinggi dibanding K4. Vaksinasi yang dilakukan mampu menurunkan gejala klinis dan kerusakan pada organ karena virus tantang sebagian dapat dinetralisasi.
SIMPULAN
Pemberian vaksin ND LaSota terhadap paparan virus Newcastle Diseases Gen VII pada ayam mampu menggeretak antibodi dan memberi perlindungan sebesar 60%.
DAFTAR PUSTAKA
Adi AAAM, Kardena I, Mantik Astawa N, Santhia Adhy Putra K, Hayashi Y, & Matsumoto Y. 2011. Kloning, Sikuensing dan Analisis Filogenetik Gen Nukleokapsid Protein Virus Tetelo Isolat Bali-1/07. Jurnal Veteriner (ID): 12(3).Akoso TB. 2006. Waspada Flu Burung. Yogyakarta(ID): Kanisius.
Alders Robyn. Spradbrow. 2001. Controling Newcastle Disease in Village Chickens. ACIAR Monograph. 82 (112pp).
Aldous EW, Mynn JK, Banks J, Alexander DJ. 2003. Amolecular epidemiological study of avian paramyxovirus type 1 (Newcastle disease virus) isolates by phylogenetic analysis of a partial nucleotide sequence of the fusion protein gene. Avian Pathol. 32:239–256.
Alexander DJ. 2003. Newcastle Disease, other Avian Paramyxovirus, and Pneumovirus Infections, p. 63-81. In : YM Saif et al. Diseases of Poultry 11th Edition. Iowa. Blackwell Publishing.
Ardana IBK. 2011. Strategi pencegahan penyakit infeksius pada peternakan broiler berbasis laboratorium. Bul Vet Udayana. 3(1):51-59.
14
Butcher GD, Miles RD. 2013. The Avian Immune System [Internet]. [diunduh 2013 Oktober 4]. Tersedia pada: http://edis.ifas.ufl.edu/vm016#
Darminto, Bahri S, Suryana N. 1998. Titer Antibodi Protektif terhadap Newcastle Disease pada Burung Unta (Struthio camelus). Jurnal Ilmu Ternak dan Veteriner. 3( 4 ): 243-250
[Ditjennak] Dirktorat jenderal Peternakan. 2007. Farmakope Obat Hewan Indonesia. Jilid I (Sediaan Biologik). Ed ke-3. Jakarta (ID): Departemen Pertanian Republik Indonesia.
[FAO] Food and Agriculture Organization. 2004. Newcastle Disease Vaccines : an Overview. [diunduh 2013 Juli 20]. Tersedia pada http://www.fao.ore/DOCREP/005/ACSO2E/acX .
Fenner et al. 1993. Virologi Veteriner. P Harya, penerjemah. Semarang(ID): IKIP Semarang Pr. Terjemahan dari: Veterinary Virologi. Ed ke-2. Gillingham Scott. 2008. General principles of vaccination. Artikel Canadian
Poultry [Internet]. [diunduh 2013 September 27]. Tersedia pada: http://www.canadianpoultry.ca/principles_of_vaccination.htm.
Indriani R, Darminto. 2000. Penyakit Infectious Bronchitis pada ayam dan cara mengendalikannya. Wartazoa. 5(2):65-72.
Islam MS, Khasruzzaman KM, Hossain MT, Islam MT, Chowdhruy MH, Rahman MM, Zinnah MA, Banu NA, Islam MA. 2008. Determination of immune response of imported newcastle disease virus vaccines in broiler chickens. Bangl J Vet Med. 6(2): 139-144.
King DJ, Cavanagh D. 1991. Disease of Poultry. 9th ed. Calnek BW, editor. Iowa (US): Iowa State Univ Pr.
Licata, Matthew J. 2007. The Efficacy of Combined Infectious Brochitis/Newcastle Disease Vaccines [Thesis]. Newark, DE (US): University of Delaware
Malole MB. 1988. Virologi Second University Development Project. Indonesia. IBRD LOAN No. 2547.
Mase M, Imai K, Sanada Y, Sanada N, Yuasa N, Imada T, Tsukamoto K, Yamaguchi S, 2002. Phylogenetic analysis of Newcastle disease virus genotipes isolated in Japan. J Clin Microbiol. 40:3826–3830.
Miller PJ, Decanini EL, Afonso CL, 2010. Newcastle disease: Evolution of genotipes and the related diagnostic challenges. Infection, Genetics and Evolution. 10:26–35
Miller PJ, King DJ, Afonso CL, Suarez DL. 2007. Antigenic differences among Newcastle disease virus strains of different genotypes used in vaccine formulation affect viral shedding after a virulent challenge. Elsevier. 25(41): 7238-7246
Mocket APA, Darbyshire JH. 1981. Comparative studies with an enzyme‐linked immunosorbent assay (ELISA) for antibodies to avian Infectious Bronchitis virus. Avian Pathol. 10(1):1-10.
Murphy FA, Paul JG, Manan CH, Michael JS. 1999. Veterinary Virology. 3rd ed. US: Academic Pr.
15 Livestock Research for Rural Development 18 (11) [internet]. [diunduh
2013 Oktober 1]. Tersedia pada: http://www.lrrd.org/lrrd18/11/naha18158.htm/
[OIE] Office International des Epizooties World Organization. 2012. OIE Terestrial Manual. Version adopted by the World Assembly of Delegates of the OIE. Pp.1-19. Paris.
Orsi MA, doretto Jr L, Reischak D, da Silva LHA, Spiki FR, Buzinaro MG, Arns CW. 2009. Newcastle Disease virus vaccine strains: Immunogenicity is not influenced by ICPI. Brazilian Journal of Poultry Science. 11 (2): 129-133.
Raharjo Y. 2013. Ketika ND genotype 7 menjadi sorotan [Internet]. [diunduh 2013 September 20]. Tersedia pada: http://www.majalahinfovet.com/2013/03/ketika-nd-genotipe-7-menjadi-sorotan.html
Ronohardjo P, Darminto, Suryana N, Sauri S, Kusnaedi. 1989. Hubungan antara titer hemaglutinasi Inhibisi (HI) dan status ayam pasca tantang pasca percobaan laboratorium dan lapangan penyakit tetelo. Penyakit hewan. 38:84-90.
Soedijar Ida Lestari, Caravonika Salam. 2002. Comparision between HI titer of ND immune serum from eye drop and intranasal routes In SPF chicken. J. Sain Vet. 20(2):24-27
Soeharsono. 2005. Zoonosis Penyakit menular dari Hewan ke Manusia Vol 2. Yogyakarta (ID): Kanisius.
Tabbu CR. 2000. Penyakit Ayam dan Penanggulangannya: Penyakit Bakterial, Mikal dan Viral. Yogyakarta (ID): Kanisius.
Tarmudji. 2005. Penyakit pernapasan pada ayam ditinjau dari aspek klinik dan patologik serta kejadiannya di Indonesia. Wartazoa 15(2): 72-83. Wang Z, Liu H, Xu J, Bao J, Zheng D, Sun C, Wei R, Song C, Chen J, 2006.
Genotyping of Newcastle disease viruses isolated from 2002 to 2004 in China. Ann. NY. Acad Sci. 1081:228–239.
Wibawan IWT, Soejoedono RD, Damayanti CS, Tauffani TB. 2003. Diktat Imunologi. Bogor: FKH-IPB.
Wibowo MH, Untari T, Wahyuni AETH. 2012. Isolasi, Identifikasi, Sifat Fisik, dan Biologi Virus Tetelo yang Diisolasi dari Kasus di Lapangan. Jurnal Veteriner .13( 4): 425-433
Xiao S, Anandan P, Baibaswata N, Arthur S, Bharoto Eny E, Prajitno TY, Collins Peter L, Samal Siba K. 2012a. Complete genome sequences of Newcastle Disease Virus strains circulating in chicken populations of Indonesia. J Virol. 86(10): 5969–5970.
Xiao S, Nayak B, Samuel A, Paldurai A, Kanabagattebasavarajappa M, Prajitno TY, Bharoto EE, Collins PL, Samal SK. 2012b. Generation by reverse genetics of an effective, stable, live-attenuated newcastle disease virus vaccine based on a currently circulating, highly virulent Indonesian strain. J Pone. 7(12): 1-15.
16
17 Lampiran 1 Titer antibodi ayam umur 3 minggu
Ayam ke-
Tanda hubung em (—) menunjukkan tidak ada sampel yang diamati
18
Lampiran 3 Titer antibodi ayam umur 7 minggu Ayam ke-
Kelompok K1 (tidak tantang,
tidak vaksin)
K2 (tantang, tidak vaksin)
K3 (tidak tantang, vaksin)
K4 (tantang, vaksin)
1 0 — 4 8
2 3 — 4 8
3 0 — 1 8
4 2 — 1 —
5 0 — 2 —
6 2 — 3 —
7 0 — — —
8 — — — —
9 — — — —
10 — — — —
Rata-rata 1 — 2.5 8
Standar deviasi
1.291 — 1.378 0
19