EFIKASI VIRUS
NEWCASTLE DISEASE APATHOGENIC
SEBAGAI VAKSIN AKTIF PADA AYAM PEDAGING
FARIS MAKKAWARU SYUKRI
DEPARTEMEN ILMU PENYAKIT HEWAN DAN KESMAVET FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Efikasi Virus Newcastle Disease sebagai Vaksin Aktif pada Ayam Pedaging adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
FARIS MAKKAWARU SYUKRI. Efikasi Virus Newcastle Disease Apathogenic sebagai Vaksin Aktif pada Ayam Pedaging. Di bimbing oleh SRI MURTINI dan RETNO D. SOEJOEDONO.
Penelitian ini dilakukan untuk mempelajari efikasi virus Newcastle Disease (ND) apathogenic sebagai vaksin aktif pada ayam. Sebanyak 100 ekor ayam digunakan dalam penelitian ini kemudian dibagi ke dalam tiga kelompok. Kelompok pertama adalah kelompok yang divaksinasi dengan vaksin aktif ND apathogenic pada hari ke-3 dan ke-16, kelompok kedua adalah kelompok yang tidak divaksinasi sebagai kelompok kontrol, sedangkan kelompok ketiga diambil sampel darah pada hari ke-0. Uji tantang dilakukan untuk mengetahui kemampuan vaksin dalam mencegah terjadinya penyakit dilakukan pada minggu ke-2 setelah vaksinasi kedua. Pengukuran antibodi dari awal penelitian sampai minggu ke-4 setelah vaksinasi dengan dilakukan dengan uji haemagglutination inhibition (HI). Uji tantang menunjukkan kematian pada kelompok yang divaksin sebesar 20% dan 60% untuk kelompok yang tidak divaksin. Hasil penelitian menunjukkan vaksin ND apathogenic mampu menginduksi antibodi yang protektif pada ayam. Vaksinasi juga mampu melindungi ayam dari infeksi ND.
Kata kunci: Newcastle Disease, uji HI, vaksin aktif ND
ABSTRACT
FARIS MAKKAWARU SYUKRI. The Efficacy of Newcastle Disease Apathogenic Virus as Active Vaccine in Broiler Chicken. Supervised by SRI MURTINI and RETNO D. SOEJOEDONO.
The research was conducted to study the efficacy of apathogenic Newcastle Disease (ND) virus as a live vaccine in broiler chicken. One hundred chickens were used and divided into three groups. The first group was vaccinated with apathogenic ND active vaccine on day 3 and 16, the second group was unvaccinated (control group), while the third group was used as a 0 day blood sampling. Challenge test was done to determine the protection ability of ND active vaccine at two after second vaccination. Antibody titer was measured from first week until the fourth week during research with haemagglutination inhibition (HI) test. The challenged test showed that the mortality number of vaccinated group was smaller (20%) compared to the unvaccinated group (60%). Test results showed that apathogenic ND active vaccine was able to induced antibody titer up to the protective level against the ND virus. Vaccination also able to protect the chicken from ND infection.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
EFIKASI VIRUS NEWCASTLE DISEASE
APATHOGENIC
SEBAGAI VAKSIN AKTIF PADA AYAM PEDAGING
DEPARTEMEN ILMU PENYAKIT HEWAN DAN KESMAVET FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR BOGOR
2015
Judul Skripsi : Efikasi Virus Newcastle Disease Apathogenic sebagai Vaksin Aktif pada Ayam Pedaging
Nama : Faris Makkawaru Syukri NIM : B04110036
Disetujui oleh
Dr Drh Sri Murtini, MSi Pembimbing I
Prof Dr Drh Retno D. Soejoedono, MS Pembimbing II
Diketahui oleh
Drh Agus Setiyono, MS PhD APVet
Wakil Dekan Bidang Akademik dan Kemahasiswaan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penelitian dan skripsi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2015 ini ialah kualitas vaksin, dengan judul Efikasi Virus Newcastle Disease Apathogenic sebagai Vaksin Aktif pada Ayam Pedaging.
Penulis juga mengucapkan terimakasih yang sebesar-besarnya kepada semua pihak yang telah membantu baik secara langsung maupun tidak langsung khususnya kepada:
1. Dr Drh Sri Murtini, MSi selaku dosen pembimbing I, yang telah memberikan bimbingan, nasehat, waktu, dan tenaga selama penelitian dan penulisan skripsi.
2. Prof Dr Drh Retno D. Soejoedono, MS selaku dosen pembimbing I, yang telah memberikan bimbingan, nasehat, waktu, dan tenaga selama penelitian dan penulisan skripsi.
3. Keluarga tercinta, Ayah dan Ibu, Kakak serta Adikku atas do’a, dorongan, dukungan material maupun tenaga yang diberikan.
4. Tenaga kependidikan Mikrobiologi beserta staff UPHL yang telah membantu selama penelitian.
5. Teman sepejuangan pembimbingan penelitian Kenda Adithya Nugraha dan Noor Rohman Setiawan atas bantuannya dari awal penelitian sampai tahap penyusunan skripsi.
6. Rekan sepenelitian Claudia Putri atas segala bantuannya selama penelitian. 7. Sahabat sekaligus mentor Faisal dan Fendi atas motivasi dan bantuan selama
ini.
8. Teman sekamar asrama C1 lorong lima kamar 48 yang telah membimbing saat pertama masuk lingkungan IPB.
9. Teman satu kontrakan di Wisma Aulia yang telah tinggal satu atap dan berbagi selama ini.
Saran dan kritik yang bersifat membangun sangat penulis harapkan, semoga skripsi ini bermanfaat bagi kita semua.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 4
METODE 4
Waktu dan Tempat 4
Bahan dan Alat 4
Metode Penelitian 5
Analisis Data 8
HASIL DAN PEMBAHASAN 8
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 13
LAMPIRAN 15
DAFTAR TABEL
1 Strain virus ND yang digunakan dalam vaksin aktif 2
2 Rancangan percobaan penelitian 5
3 Rataan Titer Antibodi (GMT) pada masing-masing kelompok ayam 8 4 Gejala klinis ayam vaksin dan ditantang virus ND (K1) 10 5 Gejala klinis ayam tidak divaksin dan ditantang virus ND (K2) 10 6 Pengamatan jumlah kematian ayam uji tantang virus ND 10 7 Perubahan patologi anatomi ayam uji tantang virus ND 11
DAFTAR GAMBAR
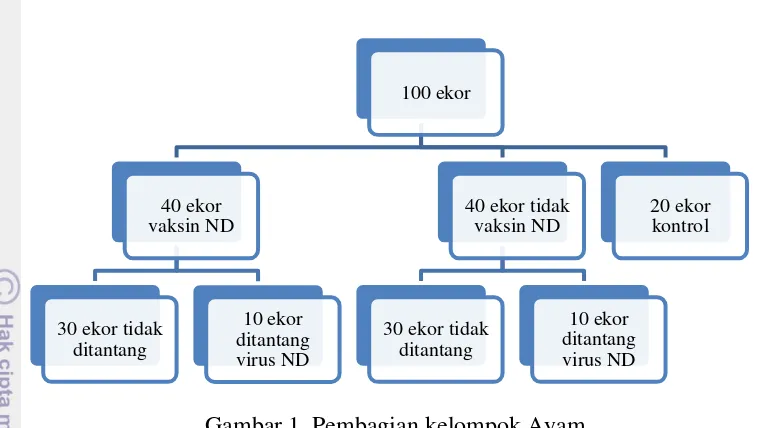
1 Pembagian kelompok ayam 4
DAFTAR LAMPIRAN
1 Data titer antibodi ayam (log 2) 15
PENDAHULUAN
Latar Belakang
Penyakit Newcastle Disease merupakan ancaman terhadap industri unggas di seluruh dunia. Berbagai bentuk gejala klinis, variasi kemunculan dan penyebaran varian genetik baru, menjadi tantangan dalam pengenalan dan diagnosis penyakit ini (Cattoli et al. 2011). Newcastle Disease merupakan penyakit pernapasan dan sistemik, bersifat akut dan mudah sekali menular. Penyakit ini disebabkan oleh virus dan menyerang berbagai jenis unggas terutama ayam. Virus Newcastle Disease sangat bervariasi dalam bentuk derajat keparahan penyakit yang disebabkannya. Pengamatan di lapangan menunjukkan bahwa pada setiap kasus ND selalu ditemukan adanya gejala gangguan pernapasan meskipun dalam bentuk campuran dengan gejala gangguan pencernaan atau gangguan syaraf. Penyakit ini mempunyai dampak ekonomi penting dalam industri perunggasan karena menimbulkan morbiditas dan mortalitas yang tinggi, penurunan produksi telur dalam kuantitas maupun kualitas, gangguan pertumbuhan, biaya penanggulangan penyakit yang tinggi, dan mendukung timbulnya penyakit pernapasan lainnya (Tabbu 2000).
Newcastle Disease disebabkan oleh avian paramyxovirus type 1 (APMV-1) serotipe dari genus Avulavirus dalam subfamili Paramyxovirinae, famili Paramyxoviridae. Jenis Paramyxovirus yang telah diisolasi dari spesies burung telah diklasifikasikan dengan pengujian serologis dan analisis filogenetik menjadi sepuluh subtipe mulai dari APMV-1 hingga APMV-10 (Miller et al. 2010). Virus ND (VND) telah di klasifikasikan dalam APMV-1 (Alexander & Senne 2008).
Newcastle Disease pertama kali dilaporkan pada tahun 1926 di Jawa, Indonesia dan di Newcastle, Inggris. Beberapa peneliti melaporkan bahwa ND mungkin telah ditemukan sebelumnya di Eropa, bahkan diduga penyakit ini telah meletup di Korea pada tahun 1924. Penyakit ini juga dikenal dengan berbagai nama, yaitu pseudofowl pest, pseudovogel pest, atypishe geflugelpest, pseudopoultry plaque, avian pest, avian distemper, Ranikhet disease, tetelo disease (penyakit tetelo), Korean fowl plaque, dan avian pneumoencephalitis (Tabbu 2000).
Kekebalan atau imunitas ayam terhadap VND akan terbentuk setelah ayam bertahan hidup dari serangan VND virulen dan ayam akan mendapatkan kekebalan jangka panjang bahkan hingga seumur hidup dari infeksi VND selanjutnya. Infeksi VND dengan virulensi rendah mengakibatkan adanya respon imun tanpa menyebabkan penyakit yang parah, hal ini merupakan dasar dari vaksinasi. Dasar dari respon imun ada tiga yaitu, antibodi dalam sirkulasi, antibodi yang disekresi untuk kekebalan mukosal, dan kekebalan yang berperantara sel. Newcastle Disease dapat dicegah dengan melakukan vaksinasi (Grimes 2002).
2
virus hidup atau diinaktifkan maupun komponen imunogeniknya. Vaksin virus hidup umumnya dibuat dari virus galur khas yang virulensinya telah dilemahkan (Depkes 1995).
Terdapat dua jenis vaksin secara umum yaitu live vaccine dan killed vaccine. Live vaccine atau vaksin hidup dibuat dari virus yang masih hidup serta dapat menginfeksi sel. Strain virus yang digunakan memiliki tingkat virulensi rendah atau sedang. Vaksin ini meniru infeksi alami virus dan mendorong ketiga respon imun. Killed vaccine adalah virus yang telah diinaktifasi sehingga kehilangan kemampuannya untuk menginfeksi sel. Inaktifasi virus dapat dilakukan dengan penambahan bahan kimiawi, radiasi, atau pemanasan (Senne et al. 2004).
Secara umum strain dari virus ND diklasifikasikan menjadi empat tipe patogenitas yaitu: Apathogenic (tidak menyebabkan penyakit), Lentogenic (virulensi dan mortalitas rendah, menurunkan produksi telur), Mesogenic (virulensi sedang, mortalitas hingga 50%, menurunkan produksi telur), Velogenic (virulensi tinggi, menyebabkan penyakit yang parah dengan tingkat mortalitas tinggi). Produksi vaksin hidup ND menggunakan banyak strain dari virus ND selain dari strain velogenic. Delapan dari strain yang digunakan sebagai vaksin tercantum dalam Tabel 1.
Tabel 1 Strain virus ND yang digunakan dalam vaksin aktif
Strain Keterangan
F Lentogenic. Biasanya digunakan pada ayam muda tetapi cocok digunakan sebagai vaksin pada ayam untuk semua umur.
B1 Lentogenic. Sedikit lebih ganas daripada F, digunakan sebagai vaksin untuk ayam semua umur.
La Sota Lentogenic. Sering menyebabkan tanda-tanda pernapasan saat post vaksinasi, digunakan sebagai booster vaksin dalam flok ayam yang divaksinasi dengan F atau B1
V4 Apathogenic. Digunakan pada ayam untuk semua umur.
V4-HR Apathogenic. Jenis V4 yang tahan panas, termostabil, digunakan untuk ayam semua umur.
I-2 Apathogenic. Termostabil, digunakan pada ayam semua umur Mukteswar Mesogenic. Strain yang invasif, digunakan sebagai booster vaksin.
Dapat menyebabkan reaksi yang merugikan (gangguan pernapasan, kehilangan berat badan atau penurunan produksi telur dan bahkan kematian) jika digunakan pada ayam dengan kekebalan tubuh rendah. Biasanya diberikan melalui injeksi.
Komarov Mesogenic. Kurang patogen daripada Mukteswar, digunakan sebagai booster vaksin. Biasanya diberikan melalui injeksi.
a
3 Rute pemberian vaksin ada berbagai macam tergantung kebutuhan dan kondisi di lapangan. Pemberian vaksin dilakukan melalui spray, tetes mata, air minum, pencampuran dengan makanan dan injeksi. Efektivitas vaksin bervariasi tergantung rute pemberiannya (Alexander et al. 2004).
Vaksinasi untuk penyakit ND secara rutin dilakukan di negara-negara di mana strain virulen dari virus ND bersifat endemik. Di negara-negara yang tidak memiliki strain virulen, bila terjadi paparan oleh strain di lapangan yang memiliki virulensi rendah dapat mengakibatkan kerugian ekonomi yang signifikan bagi para produsen, sehingga vaksinasi juga dilakukan di negara tersebut. Jenis vaksin yang digunakan dan jadwal vaksinasi dilakukan secara bervariasi tergantung pada potensi ancaman, virulensi dari tantangan virus di lapangan, jenis produksi, dan jadwal produksi (Senne et al. 2004).
Umumnya kualitas vaksin ND akan menurun setelah disimpan selama satu atau dua jam dalam suhu kamar. Hal ini membuat vaksin tidak cocok untuk digunakan di daerah terpencil yang memerlukan pengangkutan selama berjam-jam atau dalam beberapa kasus vaksin disimpan sampai beberapa hari pada suhu kamar. Beberapa vaksin dikenal lebih tahan terhadap perubahan suhu karena memiliki sifat termostabil seperti vaksin I-2. Vaksin termostabil masih perlu disimpan dalam lemari es untuk penyimpanan jangka panjang. Namun selama transportasi vaksin tidak akan memburuk secepat vaksin konvensional. Metode evaporative cooling atau pembungkusan vaksin dengan kain lembab dapat mempertahankan viabilitas vaksin selama trasnportasi. Namun jika vaksin disimpan di bawah sinar matahari langsung atau dibiarkan mencapai suhu tinggi (di atas 37 °C) selama lebih dari beberapa jam, kualitas vaksin akan menurun dan tidak dapat digunakan lagi (Grimes 2002).
Uji Haemagglutination Inhibition (HI) merupakan uji serologis yang paling sering digunakan dalam evaluasi antibodi terhadap ND. Kegunaan uji ini dalam diagnosis bergantung pada status kekebalan unggas yang akan diuji dan kondisi kesehatannya. Virus ND dapat digunakan sebagai antigen dalam berbagai uji serologis seperti: uji netralisasi virus, uji HI dan uji enzyme linked immunosorbent assay (ELISA) yang akan digunakan dalam penilaian titer antibodi pada unggas. Saat ini, uji HI merupakan uji yang paling banyak digunakan untuk mendeteksi titer antibodi unggas terhadap APMV-1, sedangkan penggunaan kit ELISA komersial untuk menilai titer antibodi pasca vaksinasi umum. Secara umum, uji netralisasi virus, uji titer HI dan titer ELISA berkorelasi pada sekelompok unggas, bukan pada individu unggas (OIE 2012).
Tujuan Penelitian
4
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai seberapa besar tingkat kemampuan vaksin dalam meningkatkan imunitas ayam dengan perlindungan terhadap paparan virus ND.
METODE
Waktu dan Tempat
Penelitian ini dilakukan pada bulan Februari-April 2015. Penelitian ini dilakukan dalam dua tahap. Tahap I adalah pengambilan sampel darah ayam pedaging setiap minggu secara berkala di Kandang Unggas Unit Pengelola Hewan Labolatorium (UPHL) Fakultas Kedokteran Hewan Institut Pertanian Bogor pada bulan Februari hingga Maret 2015. Tahap II adalah pengujian laboratoris yang dilakukan di Laboratorium Imunologi Bagian Mikrobiologi Medis Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan Institut Pertanian Bogor, pada bulan April 2015.
Bahan dan Alat Hewan Coba
5
Gambar 1 Pembagian kelompok Ayam Bahan Penelitian
Bahan yang digunakan dalam penelitian antara lain suspensi sel darah merah (SDM) 5% dan 1%, alkohol 70%, virus ND Sato, vaksin ND, air minum, air gula, pakan ayam (BR-21E), sampel serum ayam, antigen VND, larutan NaCl fisiologis 0.9%, Natrium Sitrat 3.8%, Phosphate Buffer Saline (PBS) 0.01 M. Alat Penelitian
Peralatan yang digunakan dalam penelitian antara lain syringe 1 dan 3 mL, tabung mikro 1.5 ml, label, kapas, kandang litter, timbangan, rak, lemari pendingin, mikrokapiler, mikropipet, pipet multichannel, microplate, tips, sentrifus, litter, koran, dan alat-alat nekorpsi.
Tabel 2 Rancangan percobaan penelitian
Kelompok Perlakuan (hari ke-)
Persiapan kandang dilakukan dengan desinfeksi kandang dan pemberian sekam dan koran pada lantai kandang. Ayam yang datang dimasukkan dalam kandang yang telah disiapkan sesuai pembagian kelompoknya. Pemberian pakan
6
belum dilakukan pada hari pertama, namun diberian air gula guna memperbaiki kondisi dan tenaga DOC yang hilang selama perjalanan. Pemberian minum ad libitum dan pakan setiap hari mulai pada hari ke-2, jumlah pakan yang diberikan dinaikkan secara bertingkat sesuai dengan berat badan dan nafsu makan ayam. Pemeliharaan dilakukan selama 38 hari. Kandang ayam dibagi menjadi 4 tempat, 2 tempat untuk ayam vaksin dan tidak divaksin, 2 tempat pada kandang tantang untuk masing-masing kelompok.
Vaksinasi Hewan Coba
Rute vaksinasi dilakukan melaui air minum (oral) dengan pencampuran 1000 dosis vaksin kedalam 500 ml air minum. Vaksin diberikan pada hari ke-3 melalui jantung. Pengambilan darah hari ke-8, 16 dan 31 dilakukan melalui vena brachialis. Sampel darah disimpan dalam lemari pendingin dalam suhu 4 °C selama 24 jam hingga terbentuk serum. Serum darah yang terbentuk dipisahkan dan dimasukkan ke dalam tabung mikro 1.5 ml dan diberi label serta disimpan pada suhu -20 °C sampai digunakan dalam Uji HI.
Uji Tantang
Uji tantang dilakukan dengan pemberian virus ND (Newcastle Disease) strain Sato melalui injeksi IM (Intra Muscular) pada hari ke-29. Dosis virus tantang yang digunakan pada uji tantang adalah 104 Chicken Lethal Dose 50 (CLD50) dosis per individu
Penyiapan Sel Darah Merah (SDM) 1%
7
Penyiapan Virus Standar dengan Haemagglutination (HA) Test
Sebanyak 25 µl PBS dimasukkan ke sumur microplate (V bottom microplate) baris pada A sampai F, kolom 2 sampai 12, kemudian sebanyak 50 µl antigen ND dimasukkan ke dalam sumur A1 sampai E1. Antigen ND sebanyak 25 µl dipindahkan dari sumur A1 sampai E1 ke dalam sumur A2 sampai E2 menggunakan pipet multichannel dan dihomogenkan 5 kali. Setiap antigen menggunakan tip yang berbeda.
Dua puluh lima µl PBS dimasukkan ke dalam sumur B2 dan dihomogenkan 10 kali. Selanjutnya dari sumur B2 dikeluarkan sebanyak 25 µl campuran tersebut sehingga pengenceran pada sumur B2 menjadi 1/3. Kemudian PBS sebanyak 75 µl dimasukkan ke dalam sumur C2 dan dihomogenkan 10. Dari sumur C2 diambil 75 µl campuran pada sumur tersebut sehingga pengencerannya menjadi 1/5.
Seratus dua puluh lima µl PBS dipipet ke dalam sumur D2 dan dihomogenkan 10 kali dengan cara memipet naik dan turun. Dari sumur D2 diambil 125 µl suspensi sehingga pengenceran pada sumur tersebut menjadi 1/7. Seratus tujuh puluh lima µl PBS dipipet ke dalam sumur E2 dan dihomogenkan 10 kali dengan cara memipet naik dan turun. Dari sumur E2 diambil 175 µl suspensi sehingga pengenceran pada sumur tersebut menjadi 1/9.
Selanjutnya digunakan pipet multichannel dengan tips baru. Dua puluh lima µl suspensi dipipet dari kolom A2 sampai E2 ke dalam A3 sampai E3 ke dalam kolom A4 sampai E4 dan dihomogenkan 5 kali. Langkah ini diulangi hingga kolom A12 sampai E12. Setelah dihomogenkan 5 kali dari A12 sampai E12 dibuang 25 µl suspensi. Selanjutnya dimasukkan 25 µl PBS dan 25 µl SDM 1% (1% v/v) ke dalam setiap sumur. Microplate digoyang-goyangkan selama 10 detik. Kemudian diinkubasi selama 60 menit pada suhu 4 °C. Hasil diamati setelah sumur kontrol positif terlihat adanya reaksi penghambatan aglutinasi dengan memiringkan microplate, dengan membandingkan kontrol. Pembacaan dilakukan dengan melihat sumur yang menampakkan terjadinya endapan seperti pada lubang kontrol negatif dinyatakan negatif HA, sedangkan yang menunjukkan terjadinya aglutinasi (penggumpalan SDM) dinyatakan positif HA (OIE 2012).
Uji Haemagglutination Inhibition (HI) Microtitration
Dua puluh lima µl PBS dimasukkan ke dalam sumur microplate (V bottom microplate), kemudian 25 µl sampel serum ayam dimasukkan ke dalam lubang pertama dan dilakukan pengenceran menggunakan mikropipet dengan cara menghisap dan mengeluarkan campuran sebanyak 5 kali lalu 25 µl campuran dipindahkan pada sumur kedua. Pengenceran dilakukan hingga sumur ke-12. Pada sumur ke-12 sebanyak 25 µl campuran dibuang.
8
Batas akhir pada pengenceran tertinggi yang mampu menghambat terjadinya aglutinasi secara sempurna dan disebut dengan end point (OIE 2012).
Analisis Data
Rataan titer antibodi dihitung dengan menggunakan Geometric Mean Titre (GMT) dengan rumus matematis:
Keterangan : N = Jumlah contoh serum yang diamati
t = Titer antibodi pada pengenceran tertinggi (yang masi dapat menghambat aglutinasi SDM)
S = Jumlah contoh serum yang bertiter t n = Titer antibodi pada sampel ke-n
Data rataan titer antibodi yang diperoleh dari penelitian dianalisis menggunakan metode analysis of variance (ANOVA) dan dilanjutkan dengan uji Duncan untuk membuktikan adanya perbedaan yang nyata dari perlakuan kelompok. Pengamatan gejala klinis dan perubahan patologi anatomi dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Pengamatan titer antibodi pada kelompok yang tidak divaksin dan tidak ditantang merupakan kondisi kadar antibodi maternal dari awal ayam menetas sampai akhir pemeliharaan. Pada jenis burung, antibodi asal induk diturunkan dari induk ayam yang divaksinasi atau diinfeksi secara alami kepada keturunannya melalui kuning telur. Imunitas pasif ini memiliki durasi yang relatif pendek, biasanya 1‒2 minggu dan umumnya kurang dari 4 minggu. Antibodi asal induk memiliki fungsi untuk melindungi anak ayam (beberapa minggu pertama) selama periode ketika sistem kekebalan mereka belum sepenuhnya berkembang. Secara umum transfer antibodi dari induk ke telur dapat melalui kuning telur dan albumin serta transfer dari kuning telur ke embrio melalui sirkulasi embrio (Soares 2008). Titer antibodi yang protektif terhadap ND pada anak ayam yaitu sebesar 23 atau lebih (Grimes 2002). Menurut Okwor et al. (2014), antibodi asal induk dapat menetralisasi vaksin jika ayam yang divaksinasi memiliki titer antibodi yang tinggi.
9 Tabel 3 Rataan titer antibodi (GMT) pada masing-masing kelompok ayam
Hari ke- Titer antibodi terhadap ND
Kelompok vaksin Kelompok tidak divaksin
0 23.4±0.75b 23.4±0.75b
8 27.9±0.32e 27.3±0.95de
16 26.6±1.71d 25.3±1.57c
23 25.1±1.29c 24.0±1.15bc
31 25.2±2.66c 22.1±1.60a
Keterangan: huruf superscript yang berbeda pada baris yang sama menyatakan perbedaan yang nyata
Hasil pengujian menunjukkan bahwa antibodi asal induk pada ayam pedaging pada penelitian ini mempunyai titer yang tinggi (≥24) hingga ayam berumur 3 minggu (hari ke-23). Antibodi asal induk baru turun setelah ayam 31 hari. Berdasarkan pemeriksaan antibodi kelompok ayam yang divaksinasi menunjukkan bahwa vaksinasi melalui air minum pada hari ke-3 dan 14 mampu mempertahankan titer antibodi diatas antibodi yang protektif terhadap ND yaitu
≥24.
Perbandingan titer antibodi pada kedua kelompok menunjukkan hasil tidak berbeda nyata. Peningkatan titer antibodi yang cukup tinggi dari hari ke-8 diduga karena 20 ekor ayam kontrol berasal dari kelompok ayam yang berbeda (bukan kelompok vaksin maupun tidak divaksin) dan adanya ketidakseragaman titer antibodi pada flock ayam yang digunakan.
Titer antibodi pada ayam minggu ke-2 setelah vaksinasi menunjukkan rataan titer antibodi sebesar 26.6 untuk kelompok vaksin dan 25.3 untuk kelompok tidak divaksin dengan perbandingan yang berbeda nyata. Jumlah titer antibodi pada minggu kedua mengalami penurunan dibandingkan dengan minggu pertama. Hal ini diduga terkait dengan cara pemberian vaksin melalui air minum, sehingga respon kekebalannya tidak bertahan lama. Perbedaan nyata pada kelompok vaksin dan tidak divaksin karena ayam telah diberikan vaksinasi ke-2 atau booster pada hari ke-16 dan antibodi asal induk pada kedua kelompok sudah sangat rendah pada minggu kedua. Pada minggu ke-3 titer antibodi pada kelompok ayam vaksin sebesar 25.1 dan pada tidak divaksin sebesar 24.0 dan perbandingan titer antibodi pada dua kelompok ayam tidak berbeda nyata.
10
kelompok ayam tidak divaksin merupakan akibat tidak adanya respon kekebalan yang muncul karena kelompok ini tidak diberikan vaksinasi.
Respon kekebalan tubuh pada ayam yang optimal bergantung pada beberapa kondisi spesifik seperti kondisi lingkungan, umur ayam, status nutrisi, dan status infeksi pada ayam (Kogut 2009). Selain dari faktor individu, vaksin juga memegang peran penting dalam menginduksi kekebalan ayam, seperti kualitas vaksin (titer, stabilitas, serotype, biotype, inaktivasi, dan adjuvant), administrasi vaksin (rute, keseragaman, kombinasi, program vaksinasi, dan pelarut), dan kondisi ayam (paparan sebelumnya, imunitas pasif, dan imunosupresi).
Titer protektif pada ayam yang divaksin mempengaruhi timbulnya gejala klinis pada uji tantang. Gejala klinis ND yang muncul dapat berupa anoreksia, peningkatan temperatur tubuh sampai 43 °C (normal: 40–41 °C), lesu, haus, bulu kusam, jengger berdarah, mata tertutup, diare berair, bersin, gangguan pernapasan, dan larings serta farings yang kering. Ayam yang sembuh memperlihatkan tanda kerusakan sistem saraf pusat, dicirikan oleh paresis kaki, ataksia, tortikolis, pergerakan berputar-putar, dan tremor (Fenner et al. 1993).
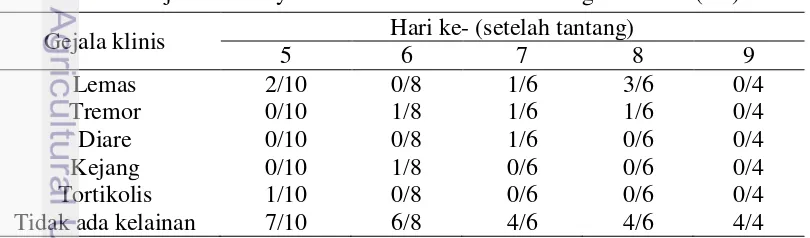
Tabel 4 Gejala klinis ayam vaksin dan ditantang virus ND (K1) Gejala klinis Hari ke- (setelah tantang)
5 6 7 8 9 pagi dan sore per harinya. Gejala klinis pada kelompok ayam dengan uji tantang dapat dilihat pada Tabel 4 dan 5. Ayam yang divaksin baru timbul gejala klinis pada hari ke-7 dan hanya 1 ekor yang menunjukkan gejala klinis. Gejala klinis yang timbul hanya sedikit, berupa lesu, tremor, mata bengkak dan kesulitan bernapas.
Tabel 5 Gejala klinis ayam tidak divaksin dan ditantang virus ND (K2) Gejala klinis Hari ke- (setelah tantang)
11
Pada kelompok ayam tidak divaksin yang ditantang dengan virus ND secara umum memperlihatkan gejala klinis berupa lesu, feses encer dan berwarna putih, gemetar (tremor), kejang, dan kepala terpuntir (tortikolis). Gejala klinis pada kelompok ini juga muncul lebih cepat, yaitu pada hari ke-5. Kelompok ayam vaksin secara umum mampu bertahan dari virus ND tantang. Vaksin pada kelompok ayam ini mampu menahan munculnya gejala klinis, sedang pada kelompok ayam tidak vaksin terdapat banyak gejala klinis yang muncul.
Tabel 6 Pengamatan jumlah kematian ayam uji tantang virus ND
Kelompok Hari ke- sejumlah 6 ekor ayam. Persentase kematian kelompok ayam yang vaksin sebesar 20%, sedangkan persentase kematian untuk ayam tidak divaksinasi sebesar 60%.
Tabel 7 Perubahan patologi anatomi ayam uji tantang virus ND
Perubahan patologi anatomi (PA) Vaksin (K1) Tidak vaksin (K2)
Hati pucat 2/8 3/4
Hati bengkak 1/8 3/4
Ginjal bengkak 4/8 3/4
Hiperemi proventrikulus 1/8 1/4
Hiperemi usus 4/8 4/4
Limpa Bengkak 3/8 3/4
Pemeriksaan patologi anatomi ayam dilakukan pada hari terakhir penelitian. Pada kelompok ayam dengan uji tantang semua ayam hidup yang tersisa diperiksa gambaran patologi anatominya. Perubahan patologi anatomi pada infeksi virus ND meliputi perdarahan ekimotik pada larings, trakea, esophagus, dan disepanjang usus (Fenner et al. 1993).
Perubahan patologi anatomi ayam yang terlihat umumnya berupa petechiae pada usus, hati pucat dan bengkak, kebengkakan pada limpa, dan proventrikulus. Perubahan patologi pada kedua kelompok ayam dapat dilihat pada Tabel 7. Pada kelompok ayam vaksin tanpa uji tantang terlihat tidak ada perubahan patologi anatomi, sedangkan pada kelompok tidak divaksin terdapat petechiae pada usus. Perubahan tersebut dapat disebabkan oleh adanya infeksi organisme asing terhadap ayam selama penelitian.
12
divaksin, banyak organ yang mengalami kelainan dan hanya 4 yang bertahan hidup dari sepuluh ayam awal yang diuji. Pada kelompok ayam vaksin, hanya sedikit organ yang menunjukkan perubahan patologi anatomi dan beberapa ayam tidak menunjukkan perubahan patologi anatomi. Ayam pada kelompok ini juga hanya 2 ekor yang megalami kematian. Pada ayam yang tidak divaksinasi menunjukkan perubahan patologi anatomi (PA) berupa hati pucat dan bengkak, ginjal bengkak, hiperemi proventrikulus, hiperemi usus, dan kebengkakan ginjal pada seluruh ayang yang tersisa. Pada ayam yang mati perubahan PA yang ditemui adalah hati pucat dan bengkak, ginjal bengkak, hiperemi proventrikulus, hiperemi usus, dan kebengkakan pada ginjal.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan data dari hasil penelitian dapat disimpulkan bahwa pemberian vaksin ND aphatogenic mampu menginduksi pembentukan antibodi dan menghasilkan respon kekebalan yang protektif pada ayam pedaging terhadap infeksi virus ND.
Saran
13
DAFTAR PUSTAKA
Alexander DJ, Bell JG, Alders RG. 2004. A Technology Review: Newcastle Disease - With Special Emphasis on Its Effects on Village Chickens. FAO Animal Production and Health. 161(1):19-21.
Alexander DJ, Senne DA. (2008). Newcastle Disease and Other Avian Paramyxoviruses. In: A Laboratory Manual for the Isolation, Identification and Characterization of Avian Pathogens, Dufour-Zavala L. 4th ed. Swayne DE, Glisson JR, Jackwood MW, Pearson JE, Reed WM, Woolcock PR, editor. Athens (GA): American Association of Avian Pathologists. 135–141.
Benĉina D, Narat M, Andrej B, Rojs OZ. 2005. Transfer of maternal immunoglobulins and antibodies to Mycoplasma gallisepticum and Mycoplasma synoviae to the allantoic and amniotic fluid of chicken embryos. Avian Path. 34(6):463-472.doi: 10.1080/03079450500368011. Cattoli J, Susta L, Terregino C, Brown C. 2011. Newcastle disease: a review of
field recognition and current methods of laboratory detection. J Vet Diagn Invest [internet]. [diunduh 2015 Apr 04]; 23(4):637–656.doi: 10.1177/ 1040638711407887. Tersedia pada http://vdi.sagepub.com/content/23/4/ 637.full.pdf.
Departemen Kesehatan RI.1995. Farmakope Indonesia, Edisi IV. Jakarta (ID): Direktorat Jenderal Pengawasan Obat dan Makanan.
Fast J. 2008. Maternal Antibody Transfer [internet]. Abbotsfort (CA) [diunduh 2015 Jun 24]; Tersedia pada http://www.canadianpoultry.ca/maternal_ antibodies.htm.
Fenner FJ, Gibbs IPJ, Murphy FA, Rott R, Studdert MJ, White DO. 1993. Virologi Veteriner. Edisi Kedua. P Harya, Penerjemah. Semarang, IKIP Semarang Press. Terjemahan dari: Veterinary Virology.
14
Kogut MH. 2009. Impact of Nutrition on the Innate Immune Response to Infection in Poultry. J Appl Poult Res. 18(1):111–124.doi: 10.3382/ japr.2008-00081.
Miller PJ, Afonso CL, Spackman E, Scott MA, Pedersen JC, Senne DA, Brown JD, Fuller CM, Uhart MM, Karesh WB, et al. 2010. Evidence for a New Avian Paramyxovirus Serotype-10 Detected in Rockhopper Penguins from the Falkland Islands. J. Virol. 84 (21):11496–11504.
Natsir AM. 2011. Gelombang Serangan Newcastle Disease [internet]. Jakarta (ID): CEVA. [diunduh 2015 Jun 25]. Tersedia pada: http://www.ceva.co.id/ Informasi-Teknis/Informasi-lain/Gelombang-Serangan-Newcastle-Disease. [OIE] World Organization for Animal Health. 2012. Newcastle Disease. OIE
Terestrial Manual 2:555-573.
Okwor GO, El-Yuguda A, Baba SS. 2014. Profile of Maternally Derived Antibody in Broiler Chicks and In-Ovo Vaccination of Chick Embryo against Newcastle Disease. WJV. 4(1):72-80.doi: 10.4236/wjv.2014.42009. Senne DA, King DJ, Kapczynski DR. 2004. Control of Newcastle disease by
vaccination. Dev Biol [internet]. [diunduh 2015 Apr 23]; 119:165-70. Tersedia pada http://www.ncbi.nlm.nih.gov/pubmed/15742628.
Soares R. 2008. Passive Immunity: Part 1 [internet]. Libourne (FR): CEVA. Hlm 1-2; [diunduh 2015 Jun 23]. Tersedia pada: http://www.thepoultrysite.com/ focus/contents/ceva/OnlineBulletins/ob_2008/Article-No18-May08.pdf. Tabbu CR. 2000. Penyakit Ayam dan Penanggulangannya. Yogyakarta (ID):
15 Lampiran 1 Data titer antibodi ayam (log 2)
Minggu
ke-0 Minggu ke-1 Minggu ke-2 Minggu ke-3 Minggu ke-4
No Kontrol Vaksin
Non-vaksin Vaksin
Non-vaksin Vaksin
Non-vaksin Vaksin
Non-vaksin
1 2 8 8 8 6 3 4 4 3
2 3 7 7 8 7 4 4 0 0
3 3 8 8 8 6 4 4 3 3
4 3 8 8 7 6 6 2 6 2
5 3 8 8 8 4 4 4 4 3
6 4 8 8 7 4 5 5 4 2
7 4 8 8 3 3 6 5 8 4
8 2 8 6 5 4 6 6 8 0
9 4 8 6 7 5 7 3 7 4
10 4 8 6 5 8 6 3 8 0
11 4
12 4
13 3
14 4
15 4
16 3
17 4
18 4
19 2
16
Lampiran 2 Analisis data kekebalan ayam
17 Post Hoc Tests
Homogeneous Subsets
Titer
Duncana,b
Minggu N Subset for alpha = 0.05
1 2 3 4 5
Non Vaksin 4 10 2.1000
Kontrol 20 3.4000
Non Vaksin 3 10 4.0000 4.0000
Vaksin 3 10 5.1000
Vaksin 4 10 5.2000
Non Vaksin 2 10 5.3000
Vaksin 2 10 6.6000
Non Vaksin 1 10 7.3000 7.3000
Vaksin 1 10 7.9000
Sig. 1.000 .331 .055 .257 .331
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 10.588.
b. The group sizes are unequal. The harmonic mean of the group sizes is used. Type I
error levels are not guaranteed.
ANOVA
Titer
Sum of Squares df Mean Square F Sig.
Between Groups 309.210 8 38.651 19.358 .000
Within Groups 181.700 91 1.997
Total 490.910 99
18
RIWAYAT HIDUP
Penulis dilahirkan di Jeneponto, pada tanggal 24 November 1993 dari Ayah Muhammad Syukri Sulaiman dan Ibu Syarfah Syam. Penulis merupakan anak kedua dari tiga bersaudara. Penulis tinggal di Kabupaten Takalar, Provinsi Sulawesi Selatan sampai saat ini.
Penulis melewati pendidikan sekolah dasar di SDN 1 Jeneponto dan lulus pada tahun 2005. Kemudian penulis melanjutkan pendidikan ke SMPN 1 Polombangkeng Utara, lulus tahun 2008. Penulis lalu melanjutkan pendidikan di SMAN 1 Takalar dan lulus tahun 2011. Pada tahun yang sama, penulis diterima di Fakultas Kedokteran Hewan Institut Pertanian Bogor (IPB) melalui jalur SNMPTN Undangan.