Laporan Praktikum
Mikrobiologi
Modul I
Pemeriksaan Air
Monica Fakhrizal
1206216891
Sunartriasih
1206216840
Tanggal Praktikum
:
Asisten
: Constantia Huinny Asaloei
Tanggal disetujui
:
Paraf Asisten
:
Nilai
:
LABORATORIUM MIKROBIOLOGI DEPARTEMEN TEKNIK SIPIL
FAKULTAS TEKNIK UNIVERSITAS INDONESIA
DEPOK 2014
I. Pemeriksaan Air
1.1. Tujuan Percobaan
Melihat tingkat pencemaran di lingkungan perairan terutama oleh kotoran (feses) pada sampel air Unit Pengolahan Sampah (UPS) di Teknik Industri UI.
1.2. Dasar Teori
1.2.1. Most Probable Number (MPN) kebelihan kekurangan aplikasi
Metode MPN adalah metode statistik berdasarkan teori probabilitas. Sampel diencerkan hingga ke titik kepunahan yaitu ke titik di mana tidak ada lagi mikroorganisme hidup. Untuk mendeteksi titik akhir, sampel yang telah diencerkan diinokulasi ke dalam media pertumbuhan yang cocok, dan pengembangan beberapa karakteristik seperti produksi asam atau kekeruhan, digunakan untuk menunjukkan pertumbuhan atau kehadiran setidaknya satu mikroorganisme yang hidup dalam sampel diencerkan.
Prinsip utama metode MPN yaitu sampel diencerkan hingga tingkat tertentu sehingga didapatkan konsentrasi mikroorganisme yang sesuai dan jika ditanam didalam tabung akan menghasilkan frekuensi pertumbuhan tabung positif “kadang-kadang”. Semakin besar jumlah sampel yang dimasukkan akan semakin sering tabung positif yang muncul. Tabung positif yang muncul tergantung pada probabilitas sel yang terambil oleh pipet saat dimasukkan kedalam media. Kombinasi kemunculan tabung positif (ya) dan negatif (tidak) menggambarkan perkiraan konsentrasi mikroorganisme pada sampel sebelum diencerkan. Perubahan data positif dan negative hingga menghasilkan angka dilakukan dengan perhitungan statistik. Nilai MPN memperlihatkan jumlah mikroorganisme yang memiliki kemungkinan tertinggi.
Kelebihan dari metode ini yaitu: (1) dapat menentukan jumlah spesifik suatu mikroba menggunakan media yang sesuai, (2) dapat digunakan untuk menentukan densitas bakteri coliform fecal, (3) mudah dilakukan. Sedangakan kekurangan dari metide ini yaitu: (1) tidak dapat digunakan untuk mengamati morfologi organism, dan (2) membutuhkan gelas dalam jumlah yang banyak.
1.2.2. Bioindikator
Bioindikator berasal dari dua kata yaitu bio dan indikator, bio artinya mahluk hidup seperti hewan, tumbuhan dan mikroba. Sedangkan indicator artinya variable yang dapat digunakan untuk mengevaluasi keadaan atau status dan memungkinkan dilakukannya pengukuran terhadap perubahan-perubahan yang terjadi dari waktu ke waktu. jadi bioindikator adalah komponen biotik (mahluk hidup) yang dijadikan sebagai indikator. Bioindikator juga merupakan indikator biotis yang dapat menunjukkan waktu dan lokasi, kondisi alam (bencana alam), serta perubahan kualitas lingkungan yang telah terjadi karena aktifitas manusia (Hendra. 2012:1).Bioindikator dapat dibagi menjadi dua, yaitu bioindikator pasif dan bioindikator aktif. Bioindikator pasif adalah suatu spesies organisme, penghuni asli di suatu habitat, yang mampu menunjukkan adanya perubahan yang dapat diukur (misalnya perilaku, kematian, morfologi) pada lingkungan yang berubah di biotop (detektor). Bioindikator aktif adalah suatu spesies organisme yang memiliki sensitivitas tinggi terhadap polutan, yang mana spesies organisme ini umumnya diintroduksikan ke suatu habitat untuk mengetahui dan memberi peringatan dini terjadinya polusi (Ghia. 2010:1). Jenis-jenis dari bioindikator yaitu bioinfikator hewan, dan bioindikator tumbuhan.
Indikator organisme biasanya digunakan untuk menunjukkan keberadaan kelompok patogen potensial. Indikator mikroba umumnya dipilih untuk alasan berikut:
- Terdapat kolerasi yang kuat antara ada atau tidaknya indikator dan patogen tertentu atau kelompok patogen.
Dua kelompok bakteri, koliform dan fecal streptococci digunakan sebagai indikator untuk kemungkinan kontaminasi limbah, karena mereka biasanya ditemukan pada kotoran manusia dan hewan. Dua bakteri tersebut menunjukkan kemungkinan adanya bakteri patogen atau bakteri penyebab penyakit, virus, dan protozoa yang juga hidup dalam sistem pencernaan manusia dan hewan. Oleh karena itu, kehadiran bakteri tersebut di dalam air menunjukkan bahwa mikroorganisme patogen juga kemungkinan terdapat sehingga jika dikonsumsi akan berdampak buruk terhadap kesehatan manusia. Karena akan sulit untuk mennguji berbagai macam patogen di dalam air, maka dari itu sebagai gantinya diuji coliform dan fecal streptococci pada air. Selain resiko kesehatan yang disebabkan oleh peningkatan bakteri fecal, mereka juga menyebabkan air menjadi keruh, berbau, kadar BOD-nya menjadi meningkat.
Indikator bakteri fecal yang paling sering diuji yaitu total coliforms,fecal coliforms, Escherischia coli, Fecal streptococci, dan Enterococci. Seluruh bakteri ini memiliki karakteristik seperti bentuk, habitat, atau perilaku yang sama kecuali E.coli, E. coli merupakan spesies tunggal dalam kelompok fecal koliform.
Total Coliform merupakan sekelompok bakteri yang tersebar luar di alam. Seluruh anggota dari total coliform bisa terdapat dalam kotoran manusia, akan tetapi beberapat juga bisa terdapat di kotoran hewan, tanah, kayu terendam, dan tempat lainnya diluar tubuh manusia. Karena itulah, pemanfaatan total coliform sebagai indikator kontaminasi feses tergantung pada sejauh mana spesies bakteri yang ditemukan adalah bakteri yang berasal dari kotoran manusia. Untuk recreational water, total coliform tidak dapat lagi digunakan sebagai indikator, sedangkan untuk air minum, total coliform masih merupakan uji standar karena kehadiran mereka menunjukkan kontaminasi pasokan air dengan sumber luar.
Fecal coliform merupakan sub-set dari total coliform bakteri, atau berasal dari fecal lebih spesifik. Akan tetapi, kelompok ini memilki genus klebsiella dengan spesies yang belum tentu berasal dari kotoran. Klebsiella pada umumnya bakteri yang berkaitan dengan pabrik tekstil dan pulp pada limbah kertas. Untuk recreational water kelompok ini adalah indikator bakteri primer. Sedangkan untuk air baku, E.coli dan esterococci merupakan indikator yang lebih baik untuk diuji. Akan tetapi fecal coliromn masih digunakan di beberapa negara sebagai indikator bakteri.
Escherischia coli merupakan jenis bakteri fecal koliform yang secara khusus berasal dari manusia dan binatang berdarah panas lainnya.
Fecal streptococcus umumnya terdapat pada sistem pencernaan manusia dan hewan berdarah pana lainnya, dahulu fecal streptococcus diuji bersama-sama dengan fecal coliform dan rasio dari fecal coliform dan streptococci tersebut kemudia dihitung. Rasio ini digunakan untuk menentukan apakah kontaminasi tersebut berasal dari manusia ataukah berasal dari bukan manusia. Akan tetapi, uji ini tidak lagi direkomendasikan sebagai uji yang akurat.
Enterococci merupakan sub-kelompok dalam kelompok fecal streptococci. Enterococci dibedakan oleh kemampuan mereka untuk bertahan hidup di air asin. Enterococci dapat meniru banyak dari patogen daripada indikator lainnya. Enterococci secara tipikal lebih bersumber dari manusia dibandingkan dengan kelompok fecal streptococcus lainnya. EPA merekomendasikan enterococci sebagai indikator terbaik sebagai indikator untuk air asin dan juga air baku.
1.2.3. Media Tumbuh
Culture media merupakan persiapan cair atau padat yang digunakan untuk tumbuh, berpindah, dan menyimpan mikroorganisme. Agar efektif, media tersebut harus berisi seluruh nutrient yang dibutuhkan oleh mikroorganisme untuk berkembang. Media tertentu dibutuhkan dalam mengisolasi dan mengidentifikasi mikroorganisme, percobaan sensitifitas antibiotik, menganalisis air dan makanan, mikrobiologi industri, dan aktivitas lainnya. Walaupun seluruh
mikroorganisme membutuhkan sumber energi, karbon, nitrogen, fosfor, sulfur, dan mineral, komposisi yang tepat dari media yang memuaskan akan tergantung pada satu spesies sedang mencoba untuk tumbuh karena kebutuhan nutrisinya akan sangat besar. Pengetahuan mengenai habitat normal mikroorganisme penting dalam pemilihan culture media yang tepat karena kebutuhan nutrient alaminya merefleksikan lingkungan alami sekitar.
Culture Media dapat diklasifikasikan dalam beberapa parameter dasar yaitu dari: (1) konstituen kimia dari pembuat, (2) bentuk alaminya, (3) dan fungsinya.
Tabel 1. Tipe Media
Physical Nature Chemical Composition Functional Type
Liquid Sintetik Mendukung
Semi-Solid Kompleks Memperkaya
Solid Memilih
Membedakan
Sumber. Microbiology McGraw-Hill, 2009 A. Tipe Fisika dan Kimia dari Culture Media
Media dimana seluruh komponen kimianya diketahui disebut media sintetik. Dapat berbentuk cair (broth) atau solid (agar). Media sintetik biasanya digunakan untuk culture photolithotrophic autotrophs seperti cyanobakteria dan protista fotosintesis. Mereka dapat berkembang pada media yang sederhana yang berisi CO2 sebagai sumber karbon, nitrat atau
ammonia sebagai sumber sumber nitrogen, sulfat, fosfat, dan variasi mineral. Banyak dari chemoorganotrophic heterotrophs juga dapat berkembang dalam media sintetik dengan glukosa sebagai sumber karbon dan garam ammonium sebagai sumber nitrogen.
Media yang berisi beberapa komposisi bahan kimia yang tidak diketahui disebut media kompleks. Media kompleks dibutuhkan karena kebutuhan nutrisi dari mikroorganisme tertentu tidak diketahui, sehingga medium sintetiknya dapat dibangun. Media kompleks berisi komponen tak diketahui seperti pepton, ekstraksi daging, dan ekstraksi ragi. Pepton merupakan protein hidrolisates yang disiapkan oleh pencernaan proteolytic parsial dari daging, kasein, soya, gelatin, dan sumber protein lainnya. Mereka hadir sebagai sumber karbon, energy, dan nitrogen. Ekstraksi daging berisi asam amino, peptide, nukleotid, asam organic, vitamin, dan mineral. Ekstraksi ragi merupaka sumber dari vitamin B dalam senyawa nitrogen dan karbon. Tiga media kompleks yang sering digunakan yaitu (1) Nutrient Broth, (2) tryptic soy broth, (3) Agar MacConkey.
Media solid dapat digunakan untuk mengisolasi mikroba berbeda satu sama lainnnya untuk menghasilkan pure culture. Biasanya digunakan yaitu agar. Agar biasanya diekstraksi dari alga merah. Agar biasanya cocok sebagai agen dalam mensolidkan dan juga sebagai agen pengeras karena biasanya kebanyakan mikroorganisme tidak dapat mendegradasinya. Jenis agen pemadatan lainnya yaitu silica gel, silica gel digunakan untuk menumbuhkan bakteri autotrophic pada media padat.
B. Tipe Fungsional dari Media
Media seperti tryptic soy broth dan tryptic soy agar disebut sebagai media penyokong karena mereka mempertahankan pertumbuhan dari mikroorganisme. Darah dan nutrient khusus lainnya akan ditambahkan ke media penyokong untuk mendorong pertumbuhan dari mikroba fastidious. Media fortified khusus ini (agar darah) disebut dengan media memperkaya.
Media pemilih membantu dalam mengembangkan mikroorganisme partikular. Garam empedu seperti fuchsin dan kristal violet membantu dalam pertumbuhan bakteri gram-negatif dengan menghambat pertumbuhan bakteri gram-positif. Endo agar, eosin methylene agar, dan MacConkey agar merupakan tiga media yang biasanya digunakan dalam mendeteksi E.Coli dan
bakteri pada suplai air. Media ini berisi dyes yang menekan pertumbuhan bakteri gram-positif. Agar MacConkey juga berisi garam empedu. Bakteri juga dipilih oleh inkubasi dengan nutrient yang secara spesifik dapat mereka gunakan. Media berisi hanya selulosa sebagai sumber karbon dan energy efektif dalam mengisolasi bakteri pencernaan selulosa.
Media pembeda merupakan media yang membedakan kelompok mikroba dan memperbolehkan identifikasi tentative dari mikroorganisme berdasarkan karakteristik biologisnya. Agar darah merupakan media pembeda dan media memperkaya. Ia membedakan antara bakteri hemolytic dengan bakteri non-hemolytic. Agar MacConkey merupakan media pembeda dan media pemilih. Karena ia berisi laktosa dan natural red dye, koloni fermentasi lactose muncul berwarna merah muda atau merah dan dapat dengan mudah dibedakan dari koloni nonfermenter.
1.2.4. Metode Streak-Plate
Jika pencampuran sel disebar pada suatu pemukaan agar pada densitas yang relatif rendah, tiap sel tersebut akan tumbuh menjadi koloni yang terpisah, pertumbuhan makroskopis atau sekelompok mikroorganisme akan terlihat pada medium yang padat. Karena tiap koloni tumbuh dari sel tunggal, tiap koloni merepresentasikan sebuah kultur murni.
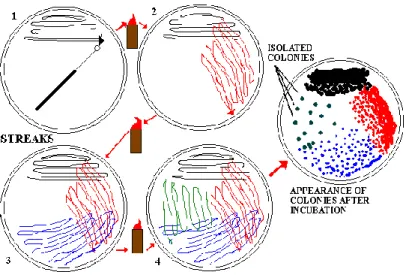
Strek-plate merupakan salah satu metode untuk mendapatkan kultur murni. Metode streak-plate ini pertama kali dikembangkan oleh Loeffer dan Gaffky di laboratorium Koch. Metode ini merupakan metode pengenceran bakteri dengan cara menggores (streak) bakteri pada permukaan agar dalam cawan petri untuk mendapatkan sel-sel terisolasi yang kemudian akan tumbuh menjadi koloni terisolasi. Jika pada permukaan agar tumbuh mikroorganisme yang sama secara genetik, kultur tersebut disebut dengan kultur murni.
Pada metode ini, pencampuran mikroba dipindahkan ke tepi agar plate dengan menggunakan lingkaran untuk meng-inokulasi atau jarum ose, dan kemudian digores (streak) pada permukaan agar di sektor pertama dengan bentuk seperti zig-zag. Setelah sektor pertama di streak, jarum ose atau lingkaran penginokulasi disterilisasikan dan inokulum untuk sector kedua diperoleh dari sektor pertama. Proses yang sama dilakukan untuk menggores (streak) sector ketiga, akan tetapi pada sektor ketiga inokulum diperoleh dari sektor kedua. Jadi, proses ini merupakan proses pengenceran. Pada sektor keempat hasilnya ialah, hanya sedikit sel yang terdapat pada jarum ose, dan sel tunggal tersebut akan terpisah saat ia diusap pada permukaan agar sehingga membentuk koloni yang terpisah. Pada teknik spread-plate dan streak-plate, isolasi yang sukses tergantung pada pemisahan spasial dari sel tunggal.
Selama diinkubasi, mikroba terisolasi akan memperbanyak diri, sehingga menimbulkan koloni yang secara individual terisolasi pada area yang paling encer. Koloni muncul sebagai tumpukan material pada permukaan agar, dan mereka muncul dalam berbagai bentuk, ukuran, dan tekstur mikroorganisme tunggal. Jika Escherischia coli disimoan pada cawan Nutrient Agar dan diinkubasi pada suhu 37oC, sel tersebut akan membagi diri setiap 30 hingga 40 menit. Saat jam ke-10 hingga 12, koloni tersebut akan mencapai populasi satu juta dan koloni pinpoint akan terlihat.
Untuk mendapatkan hasil yang baik menggunakan teknik ini, permukaan agar harus halus, lembab, dan bebas dari kontaminan. Akan tetapi, kelembapan yang berlebihan dari kondensasi air, yang berasal dari pendinginan awal media steril panas, dapat berkumpul di bagian dalam dan tepi cawan bagian atas. Jika air turun ke permukaan agar, penyebaran dan penggabungan koloni dapat terjadi. Hal inilah yang menyebabkan cawan petri haruslah dibalik setelah cawan di streak dan pada saat cawan tersebut diinkubasi
Gambar 1. Metode Streak-Plate
Sumber. http://www.personal.psu.edu/ 1.2.5. Kualitas AirPenggolongan kualitas air terbagi menjadi empat golongan menurut peruntukannya sesuai dengan Peraturan pemerintah RI Nomor 20 Tahun 1990. Berikut merupakan pembagian golongan tersebut:
- Golongan A
Air dapat digunakan sebagai air minum secara langsung, tanpa pengolahan terlebih dahulu. - Golongan B
Air dapat digunakan sebagai air baku air minum. - Golongan C
Air dapat digunakan untuk keperluan perikanan dan peternakan. - Golongan D
Air dapat digunakan untuk keperluan pertanian, usaha di perkotaan, industri, dan pembangkit listrim tenaga air.
Kualitas air menyatakan tingkat kesesuaian air terhadap suatu penggunaan tertentu. Penggunaan tersebut yaitu dalam hal pemenuhan kebutuhan hidup manusia, contohnya: air minum, mandi, cuci, irigasi, peternakan, perikanan, rekreasi, dan transportasi. Kualitas air dapat mencakup keadaan fisik dan kimia yang memengaruhi ketersediaan air untuk kehidupan manusia, perikanan, pertanian, industri, rekreasi, dan pemanfaatan lainnya
Sesuai dengan PERMENKES NO.492/MENKES/PER/IV/2010, standar baku mutu air minum, jumlah kadar maksimum dari bakteri E.coli dan total bakteri coliform pada suatu sampel air yaitu 0 per 100 mL sampel. Hal ini menunjukkan bahwa untuk air minum, bakteri E.coli dan total bakteri coliform sama sekali tidak diperbolehkan untuk hadir pada air minum. Hal ini dikarenakan bakteri tersebut merupakan bakteri yang dapat menyebabkan penyakit thypus sehingga kehadirannya di air minum tidak diperbolehkan.
Sedangkan untuk standar baku mutu air bersih, sesuai dengan PERMENKES NO.416/MENKES/PER/IX/1990, jumlah kadar maksimum yang diperbolehkan untuk koliform untuk air perpipaan yaitu sebesar 10 per 100 mL sampel dan untuk air bukan perpipaan, jumlah kadar maksikum yang diperbolehkan untuk koliform yaitu sebesar 50 pel 100 mL sampel.
Sumber. Permenkes No.492/Menkes/Per/IV/2010 Tabel 2. Standar Baku Mutu Air Bersih
Sumber. Permenkes No.416/Menkes/Per/IX/1990
1.2.6. Karakteristik Sampel
1.2.7. Aplikasi pada Bidang Teknik Lingkungan
Pada bidang teknik lingkungan, indikator mikroorganisme memilki aplikasi yaitu untuk mengetahui tingkat pencemaran pada suatu sumber air sehingga dapat diketahui jenis
pengolahan yang tepat dalam pengolahan sumber air tersebut.
1.3. Alat-alat dan Bahan
1.3.1. Presumtive Test (Uji Penduga)
Sampel air Unit Pengolahan Sampah (UPS) di Teknik Industri
5 Tabung reaksi berisi tabung durham dan medium lactose broth ganda sebanyak 5 mL
10 Tabung reaksi berisi tabung durham dam medium lactose broth tunggal sebanyak 5 mL Pipet otomatis 5 mL 1 Pipet tip 5 mL Pipet otomatis 0.5 mL 1 Pipet tip 0.5 mL Pipet otomatis 0.05 mL 1 Pipet tip 0.05 mL Pembakar spiritus Alkohol 70 %
Inkubator dengan temperature 35o
C
Semua tabung reaksi dari uji penduga yang menunjukkan hasil positif
Tabung yang diisi dengan medium Bile Green Lactose Broth (BGLB) dan tabung durham di dalamnya sebanyak jumlah tabung uji penduga yang positif
Inkubator dengan temperature 44.5o
C Jarum ose Alkohol pendingin Pembakar spiritus Alkohol 70 % 1 Cawan EMBA/EA
1.3.3. Completed Test (Uji Pelengkap)
Cawan petri berisi Endo Agar yang menunjukkan adanya koloni berwarna hijau metalik
Beberapa tabung Nutrient Agar (NA) miring Jarum Ose Pembakar Spiritus Alkohol 70 % 1.4. Cara Kerja 1.5. Hasil Pengamatan 1.6. Analisis/Pembahasan 1.7. Kesimpulan dan Saran 1.8. Daftar Pustaka
1.9. Lampiran
066 957 929 1