SCB1603402 PTA
PRAKTIKUM MIKROBIOLOGI 2014/2015
Drs. IMAM SANTOSO, M.Phil Dra. SITARESMI, M.Sc
LAPORAN PRAKTIKUM MIKROBIOLOGI PEMERIKSAAN AIR
NAMA : ROHMAD JONI PRANOTO
NPM : 1206247240
KELOMPOK : X
TANGGAL PRAKTIKUM : 5 OKTOBER 2014
ASISTEN : EVY WIDYANINGSIH
HARIS OKTAVIANTO
UNIVERSITAS INDONESIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM DEPARTEMEN BIOLOGI
PEMERIKSAAN AIR
I. TUJUAN
1. Mengetahui cara pengambilan sampel. 2. Mengetahui kualitas air
3. Membuktikan keberadaan koliform dalam sampel air
II. HASIL PENGAMATAN
Hasil pengamatan dalam bentuk gambar dan tabel pada lampiran III.PEMBAHASAN
Air merupakan salah satu senyawa paling vital yang diperlukan oleh organisme hidup . Air juga merupakan medium yang dapat dihuni oleh mikroorganisme tertentu. Sebagai salah satu kebutuhan manusia maka kondisi air yang digunakan untuk dikonsumsi tentunya harus terbebas dari kondisi atau substansi yang dapat merugikan. Kondisi dimana air yang
digunakan oleh manusia untuk dikonsumsi mengandung kontaminasi senyawa toksik atau mikroorganisme patogen sering disebut sebagai kondisi tercemar (Tortora dkk 2010: 779— 781; Batzing 2002: 64).
Kondisi tercemarnya air oleh mikrooganisme dapat diketahui dengan melakukan
pendeteksian terhadap mikroorganisme indikator. Mikroorganisme indikator yang digunakan dalam analisis air mengacu pada mikrooganisme jenis tertentu yang keberadaanya di dalam air merupakan bukti bahwa air tersebut terpapar bahan feses manusia atau hewan berdarah panas lainnya, sehingga semakin menambah peluang terdapatnya berbagai macam
mikroorganisme patogen yang berasal dari saluran pencernaan masuk ke dalam air (Pepper & Gerba 2005: 115). Mikroorganisme indikator memiliki karakteristik tertentu, yaitu antara lain:
1. Mikroorganisme indikator harus hanya ada di dalam air yang tercemar.
2. Mikroorganisme indikator harus sesuai untuk analisis segala jenis air, baik air sungai, air limbah, air laut atau air tanah.
3. Mikroorganisme indikator harus ada apabila keberadaan mikroorganisme patogen ada. 4. Mikroorganisme indikator harus lebih mampu bertahan hidup dibanding mikroorganisme patogen.
5. Mikroorganisme indikator harus bersifat tidak berbahaya bagi manusia dan nonpatogen. 6. Mikroorganisme indikator memiliki sifat seragam dan stabil.
7. Mikroorganisme indikator harus berjumlah lebih banyak dibanding mikroorganisme patogen berbanding lurus dengan tingkat polusitas air.
8. Mikroorganisme indikator harus mudah dideteksi dengan metode uji yang sederhana. 9. Prosedur uji mikroorganisme indikator harus memiliki spesifisitas yang besar, yang artinya prosedur tersebut memiliki sensitivitas tinggi dan mampu mendeteksi
mikroorganisme indikator meskipun dalam kadar rendah sekalipun. (Prescott dkk. 1999: 876).
Mikroorganisme indikator yang dapat digunakan dalam pemeriksaan air adalah bakteri koliform. Bakteri koliform didefinisikan sebagai bakteri aerobik atau anaerobik fakultatif, gram negatif, tidak membentuk endospora, dan berbentuk batang atau basil yang mampu memfermentasi laktosa untuk membentuk gas dalam tempo 48 jam di dalam medium laktosa broth pada suhu 35o C (Tortora dkk 2010: 781). Bakteri koliform tidak semuanya
merupakan enteric bacteria namun dapat pula bakteri yang umum ditemukan pada sampel tumbuhan atau tanah. Bakteri koliform yang berupa enteric bacteria berasal dari feses hewan berdarah panas dan manusia disebut fecal coliform, sedangkan yang berasal dari lingkungan alam lainnya disebut nonfecal coliform. Contoh bakteri fecal coliform yang utama yaitu Eschericia coli yang menempati proporsi terbesar dalam usus manusia. Contoh bakteri koliform lainnya yaitu Enterobacter, Citrobacter, dan Klebsiella (Pepper & Gerba 2005: 116; Tortora dkk 2010: 781).
Secara umum dikenal tiga metode yang digunakan untuk melakukan uji kualitas air dan mendeteksi adanya bakteri koliform. Ketiga metode tersebut yaitu metode Multiple-Tube Fermentation (MTF) atau biasa dikenal juga dengan sebutan metode Most Probable Number (MPN), kedua adalah metode filtrasi membran, yaitu metode langsung untuk menentukan keberadaan dan jumlah koliform. Metode ketiga yaitu metode ONPG dan MUG yaitu metode yang menggunakan medium yang mengandung dua substrat
o-nitrophenyl-β-D-galactopyranoside (ONPG) dan 4-methylumbelliferyl-β-D-glucuronid (MUG) (Tortora dkk 2010: 781).
Berbagai metode tersebut memiliki kelebihan dan kekurangan masing-masing. Metode MTF merupakan metode yang spesifik dan akurat untuk digunakan pada sampel air yang bukan air minum (nonpotable) atau sampel air yang mempunyai turbiditas (kekeruhan) tinggi. Kelemahan metode MTF adalah membutuhkan waktu relatif lama untuk mendapatkan hasilnya, karena tahapannya yang cukup banyak (Black 1999: 747; Tortora dkk 2010: 781). Metode filtrasi membran adalah metode yang umum diaplikasikan di Amerika Utara dan Eropa. Hal tersebut berkaitan dengan keunggulannya yang cepat, dan dapat diaplikasikan pada sampel air dengan volume lebih besar dibandingkan dengan uji MTF. Metode filtrasi
membran sesuai digunakan pada sampel air yang mempunyai turbiditas (kekeruhan) rendah yang tidak menyumbat filter, serta pada air yang hanya mempunyai sedikit bakteri non koliform (Black 1999: 747; Tortora dkk 2010: 781). Metode ONPG dan MUG memiliki kelebihan dalam hal deteksi E.coli dengan menggunakan paparan UV. Hal tersebut lebih akurat dibandingkan dengan metode MTF yang menggunakan indikator terbentuknya gas (Tortora dkk 2010: 781).
Metode MTF meliputi tiga tahapan utama yaitu uji penduga (Presumptive test), uji penguat (Confirm test), dan uji pelengkap (Completed test). Uji penduga meliputi proses inokulasi sampel air ke dalam tabung berisi medium lauryl sulfate tryptose (LST) lactose broth ganda dan tunggal. Lauryl sulfate merupakan deterjen aktif permukaan yang
menghambat tumbuhnya bakteri gram positif dan mendukung tumbuhnya koliform. Tabung tersebut kemudian diinkubasi pada suhu 35o C dan dilakukan pengamatan pada tempo 24 dan
48 jam inkubasi. Hasil positif ditunjukkan dengan adanya perubahan warna menjadi kehijauan akibat asam yang terbentuk dan terbentuknya gas. Gas yang terbentuk dapat diamati dengan menggunakan tabung Durham. Adanya gas tersebut dapat pula disebabkan oleh bakteri nonkoliform, misalnya Clostridium perfringens yang merupakan bakteri gram positig. Oleh karena itu, diperlukan tes konfirmasi untuk memastikannya. Uji penguat dilakukan dengan menggunakan medium selektif seperti Levine’s eosin methylene blue (EMB) agar , Endo agar , atau Brilliant Green Lactose Bile (BGLB) Broth (Pepper & Gerba 2005: 117).
Metode MTF yang kami gunakan sedikit dimodifikasi, medium broth yang digunakan yaitu fluorocult broth. Sampel air yang kami gunakan yaitu air sumur dari salah satu anggota kelompok kami, Habsari Ingesti Widati. Cara pengambilan sampel dilakukan dari keran air. Pertama, keran dibuka lalu air dibiarkan mengalir selama 2 – 3 menit, kemudian keran ditutup kembali. Keran kemudian kembali dibuka dan dibiarkan air mengalir beberapa saat lalu air ditampung dalam botol sebanyak 100—200 ml lalu botol ditutup. Hal tersebut, tidak sesuai dengan literatur yang menyebutkan bahwa sebelum keran dibuka kembali keran harus dibersihkan dengan alkohol 70% begitu pula dengan mulut botol sebelum digunakan
seharusnya dilewatkan pada nyala api. Cara pengambilan sampel tersebut pada tiap sumber-sumber diperolehnya sampel dilakukan secara berbeda-beda (Gandjar dkk 1992: 67).
Sampel air tersebut kemudian diinokulasi secara aseptis ke dalam lima tabung berisi medium fluorocult broth ganda sebanyak 5 ml, lalu ke dalam sepuluh tabung berisi medium fluorocult broth tunggal sebanyak 0,5 ml untuk lima tabung pertama dan 0,05 ml untuk tabung kedua. Inokulum tersebut kemudian diinkubasi dalam suhu 35o C. Sampel air hasil
maupun tunggal satu (T1, 0,5 ml) dan tunggal dua (T2, 0,05 ml) terjadi perubahan warna yang semula bening menjadi kehijauan. Hal tersebut mengindikasikan adanya koliform dalam sampel yang kami gunakan. Bakteri koliform dapat digolongkan pula menjadi bakteri
koliform E.coli dan bakteri koliform non E.coli. Bakteri koliform E.coli dan non E.coli dapat dibedakan dengan memaparkannya di bawah sinar UV, bakteri koliform E.coli akan
menunjukkan perpendaran warna (fluoresence) menjadi biru (Tortora dkk 2010: 117). Setelah dilakukan pemaparan sinar UV, dari kelima belas tabung menunjukkan positif fluoresence berwarna biru sebagaimana yang dijelaskan dalam literatur. Hal tersebut mengindikasikan bahwa kelima belas tabung mengandung bakteri koliform E.coli. Bakteri koliform pada tabung ganda kemudian diambil dua tabung yang paling pekat dan banyak terjadi perubahan warnanya. Kedua tabung tersebut kemudian diisolasi ke dalam medium Chromocult agar secara terpisah menggunakan metode four quadrant streak. Hal tersebut dilakukan untuk memastikan lagi apakah benar dalam tabung tersebut mengandung bakteri koliform E.coli. Medium Chromocult agar digunakan karena dapat mendeteksi total koliform melalui produksi warna koloni yang spesifik, yaitu warna koloni ungu untuk bakteri koliform E.coli dan warna koloni merah untuk bakteri non E.coli (Ossmer dkk --- : 2). Setelah diinkubasi kembali selama 24 jam, pada medium Chromocult agar mulai ditumbuhi koloni bakteri yang berwarna merah dan ungu kebiruan. Warna koloni bakteri yang merah tersebut menujukkan koloni bakteri koliform non E.coli, sedangkan yang berwarna ungu-kebiruan adalah koloni bakteri koliform E.coli. Kedua hal tersebut sesuai dengan literatur.
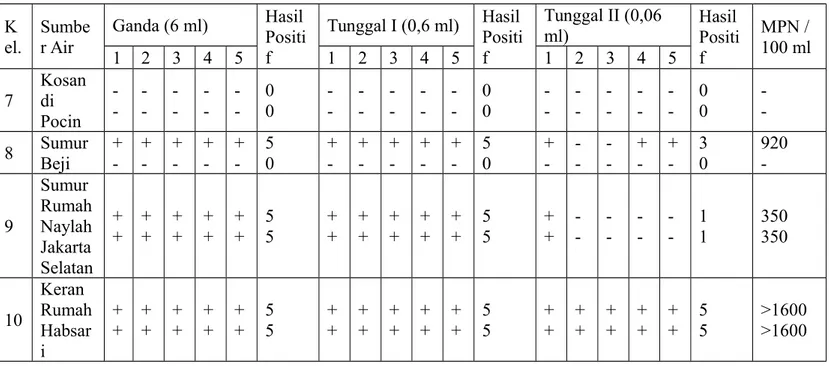
Berdasarkan kelima belas tabung yang positif koliform tersebut, lima ganda semua positif, lima tunggal satu (T1, 0,5 ml) semua positif, dan lima tunggal dua (T2, 0,05 ml) semua positif, dapat ditentukan Most Probable Number (MPN) mikroorganisme yang terkandung dalam sampel. Oleh karena jumlah tabung positif pada 5 ml; 0,5 ml; 0,05 ml adalah 5; 5; 5 maka berdasarkan tabel MPN, nilai MPN sampel tersebut yaitu > 1600 (Gandjar dkk 1992: 84—86).
Data yang kami peroleh selanjutnya dibandingkan dengan data kelompok lain dalam kelas B praktikum mikrobiologi. Perbandingan data dapat dilihat dalam lampiran 1.
Berdasarkan data tersebut yaitu kelompok 7 memiliki sampel air kosan di Pondok Cina, kelompok 8 memiliki sampel air sumur di Beji, kelompok 9 memiliki sampel air sumur di Rumah Naylah Muna di Jakarta Selatan, dan kelompok 10 memiliki sampel air sumur rumah Habsari Ingesti Widati di daerah Jakarta Selatan, kami menentukan kondisi fisik sampel yang tiap sampel relatif sama untuk bau dan kejernihannya, yaitu tidak berbau dan berwarna jernih. Setelah dilakukan uji pemeriksaan air diperoleh dengan metode MPN diperoleh nilai MPN
masing-masing sampel pada tiap kelompok yaitu kelompok 7 bernilai 0 dan 0, kelompok 8 bernilai 920 dan 0, kelompok 9 bernilai 350 dan 350, kelompok 10 bernilai > 1600 dan > 1600. Setelah dilakukan uji deteksi koliform E.coli diperoleh kelompok 7 negatif, kelompok 8 negatif koliform E.coli, kelompok 9 negatif koliform E.coli, dan kelompok 10 positif koliform E.coli. Berdasarkan hasil tersebut dapat diperoleh kesimpulan bahwa sampel tiap-tiap kelompok memiliki kualitas air yang berbeda-beda denga kualitas air terbaik yaitu air sampel yang dibawa oleh kelompok 7, sedangkan kualitas air terburuk yaitu air sampel yang dibawa oleh kelompok 10.
IV. KESIMPULAN
1. Pengambilan sampel dari air keran dilakukan dengan membiarkan air mengalir selama 2-3 menit lalu mematikan keran, kemudian mulut keran dibersihkan dengan alkohol 70%. Keran kembali dibuka dan airnya dibiarkan mengalir beberapa saat kemudian ditampung dalam botol yang telat disterilnkan.
2. Kualitas air ditentukan dari kondisi fisiknya yang ber-pH netral, tidak berbau, tidak berwarna, dan tidak mengandung kontaminasi mikroorganisme patogen yang ditandai adanya bakteri koliform.
3. Keberadaan koliform dalam sampel air dapat diketahui dengan melakukan uji pemeriksaan air, salah satunya dengan metode MTF.
V. DAFTAR ACUAN
Batzing, B. L. 2002. Microbiology: An introduction. Thomson Learning, Inc., Stamford: xx + 780 hlm.
Black, J.G. 1999. Microbiology: Principles and explorations. 4th ed. John Wiley & Sons, Inc., New York: xxiv + 786 hlm.
Gandjar, I. , I. R. Koentjoro, W. Mangunwardoyo, & L. Soebagya. 1992. Pedoman praktikum mikrobiologi dasar. Fakultas Matematika Universitas Indonesia, Depok: 87 hlm. Ossmer, R. W. Schmidt dan U. Mende. ---. Chromocult coliform agar, influence of membrane
filter quality on performance. Merck. Germany: 1—5 hlm.
Pepper, I.L. dan C.P. Gerba. 2005. Environmental microbiology: a laboratory manual. Elsevier Academic Press. California: xv + 197 hlm.
Prescott, L.M. , J.P. Harley & D.A. Klein. 1999. Microbiology. Ed. Ke-4. McGraw-Hill, Boston: xxvi + 962 hlm.
Tortora, G.J., B.R. Funke dan C.L. Case. Microbiology: an introduction. 10th Ed. Pearson
Education Inc,. California: xxxi + 810 hlm.
LAMPIRAN 1 I. Hasil pengamatan
A. Tabel
Kel. Sumber air pH Bau / tidak bau Jernih / tidak jernih 7 Kosan di Pocin Tidak dicek Tidak bau Jernih
8 Sumur Beji 7 Tidak bau Jernih
9 Sumur Rumah Naylah (Jakarta Selatan) Tidak
dicek Tidak Bau Jernih 10
Keran Rumah Habsari
Tidak
dicek Tidak Bau Jernih
Tabel 2. Hasil pengamatan uji tahap satu K
el. Sumber Air
Ganda (6 ml) Hasil Positi f Tunggal I (0,6 ml) Hasil Positi f Tunggal II (0,06 ml) Hasil Positi f MPN / 100 ml 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 7 Kosan di Pocin -- -- -- -- -- 00 -- -- -- -- -- 00 -- -- -- -- -- 00 - -8 Sumur Beji + -+ -+ -+ -+ -5 0 + -+ -+ -+ -+ -5 0 + -+ -+ -3 0 920 -9 Sumur Rumah Naylah Jakarta Selatan + + + + + + + + + + 5 5 + + + + + + + + + + 5 5 + + -1 1 350 350 10 Keran Rumah Habsar i + + + + + + + + + + 5 5 + + + + + + + + + + 5 5 + + + + + + + + + + 5 5 >1600 >1600 Keterangan :
+/+ : terjadi perubahan warna medium dan medium berpendar di UV +/- : terjadi perubahan warna medium tetapi medium tidak berpendar di UV -/- : tidak terjadi perubahan warna medium dan medium tidak berpendar di UV
Tabel 3. Hasil pengamatan uji lanjutan (tahap dua) Kelompok Karakter koloni pada medium
7 Koloni mikroorganisme tidak tumbuh, tidak ada warna pink ataupun ungu 8
Koloni mikroorganisme tumbuh, namun tidak didapatkan warna ungu hanya warna pink
9
Koloni mikroorganisme tumbuh, namun tidak didapatkan warna ungu hanya warna pink
10
Koloni mikroorganisme tumbuh serta didapatkan warna ungu maupun warna pink
LAMPIRAN 2
Gambar 1. Koloni koliform E.coli
[Sumber: dokumentasi pribadi]
Gambar 2. Hasil pada tabung tunggal 1 [Sumber: dokumentasi pribadi]
Gambar 3. Hasil pada tabung tunggal 2 [Sumber: dokumentasi pribadi]
Gambar 4. Hasil pada tabung ganda [Sumber: dokumentasi pribadi]
Gambar 5. Hasil pemaparan sinar UV [Sumber: dokumentasi pribadi]
Gambar 6. Hasil pemaparan sinar UV [Sumber: dokumentasi pribadi]
Gambar 7. Tabel MPN
![Gambar 1. Koloni koliform E.coli [Sumber: dokumentasi pribadi]](https://thumb-ap.123doks.com/thumbv2/123dok/2629768.2246714/10.892.126.762.101.1169/gambar-koloni-koliform-e-coli-sumber-dokumentasi-pribadi.webp)
