ETIOPATOGENESIS KARSINOMA SEL BASAL
Sukmawati Tansil Tan*, Syarifuddin Wahid**, Gabriela Reginata
**Departemen Ilmu Kesehatan Kulit dan Kelamin
FK Universitas Tarumanagara Jakarta
**Departemen Patologi Anatomi FK Universitas Hasanuddin Makassar
ABSTRAK
Karsinoma sel basal (KSB) adalah keganasan kulit
yang berasal dari sel nonkeratinisasi basal epidermis. KSB
merupakan kanker kulit yang terbanyak dijumpai dan kasusnya
semakin meningkat pada beberapa dekade terakhir. Ada lima
subtipe KSB, yaitu nodular, berpigmen, morfea, superfisial, dan
fibroepitelioma. Etiopatogenesis yang berkaitan dengan KSB
adalah genetik, lingkungan, dan yang paling sering adalah
pajanan sinar ultraviolet B (UVB) dengan panjang gelombang
290-320 nm. Faktor genetik yang berperan pada KSB terdapat
pada kromosom 1 dan satu varian dari setiap kromosom 5, 7, 9,
dan 12. Varian tersebut tidak diketahui memiliki keterkaitan
dengan warna rambut, mata, dan warna kulit, tetapi diketahui
berhubungan dengan penurunan genetik heterozigot dan risiko
ketidakmampuan proteksi terhadap pajanan sinar matahari.
Kelainan genetik yang bersifat homozigot berhubungan dengan
aktivasi pengaturan
sonic hedgehog pathway signaling
(SHH).
Pada penelitian terkini, ternyata proses biomolekuler yang
terjadi pada KSB cukup rumit. Terdapat mutasi pada sel punca
epidermal pada jalur proliferasi sel holoklon secara vertikal
tanpa gangguan proliferasi horisontal dalam pembentukan
lapisan basal epidermis dan sebelum terjadi diferensiasi sel
menjadi lapisan spinosum.
Kata kunci : Etiopatogenesis, karsinoma sel basal, kanker kulit
ABSTRACT
Basal cell carcinoma (BCC) is a malignant neoplasm
derived from nonkeratinizing cells that originate in the basal
layer of the epidermis. BCC is the most common skin cancer dan
the case has increased during the last few decades. There are
five types of BCC, namely nodular, pigmented, morpheaform,
superficial, and fibroepithelioma. The etiopathogenesis of BCC
is associated with genetic factors, environmental, and most often
triggered by exposure to sunlight, especially ultraviolet B (UVB)
are surging 290-320 nm. Genetic factors associated with BCC
found on chromosome 1 and one variant of each chromosome 5,
7, 9, and 12. A variant is not known to be associated with hair
color, eye, and skin color, which may be associated with genetic
heterozygous in heritance and additional risk factors for
exposure to the sun. The homozygous genetic disorder that is
primarily related to the setting of sonic hedgehog signaling
pathway. Recents study shows the details biomollecular
changing in etiopathogensis of the BCC. There is epidermal stem
cell mutation in proliferation pathways of holoclone cells
vertically without horizontal proliferation interruption in
epidermis basal layer formation and before differentiation of
cells into spinosum layer.
Key words : Etiopathogenesis, basal cell carcinoma, skin cancer
Korespondensi:
Jl. Letjen S.Parman No.1, Grogol, Jakarta
Barat 11440Telp: 021-5670815,
Fax.021-5663126Email: sukma_tsl@yahoo.com
PENDAHULUAN
Karsinoma
sel
basal
(KSB)
adalah
keganasan kulit yang berasal dari sel nonkeratinisasi
basal epidermis,1 disebut juga basalioma, epitelioma
sel basal, ulkus Rodent, dan ulkus Jacob.2 KSB
merupakan kanker kulit yang paling banyak
dijumpai, berkisar 75-80% dari seluruh kanker kulit.
Angka kejadiannya semakin meningkat dua kali lipat
setiap dua puluh lima tahun tahun sejak tahun
1980.
3,4Diperkirakan
setiap
tahunnya
terdapat
900.000-1 juta orang terdiagnosis KSB di Amerika.1
Prevalensi terjadinya KSB pada laki-laki dan
perempuan adalah 2,1-3 : 1-2%.3 Kasus terbanyak
dijumpai di Australia yang mencapai 2% dari
populasi penduduknya atau sekitar 650-1560 kasus
per 100.000 populasi.5 Hingga saat ini data akurat
insidens KSB di Indonesia belum diketahui dengan
jelas.
Penelitian
di
Palembang
menunjukkan
peningkatan signifikan 10 tahun terakhir. Penelitian
Toruan TL (2000) menyebutkan insidens KSB
0,042%, penelitian Yahya (2008) didapatkan 0,11%,
dan 0,30% (2010).6 Usia pasien KSB berkisar antara
50-80 tahun dengan rerata usia 55 tahun. Beberapa
studi epidemiologi menyebutkan bahwa kejadian
KSB di bawah 35 tahun adalah 1-3%.5 Pasien yang
menderita
sindroma
KSB
nevoid
berpotensi
menderita KSB pada usia muda.7 Fabio dkk.
menemukan hubungan antara kejadian KSB pada
usia muda dengan limfoma non-Hodgkins.5 Terdapat
lima subtipe KSB, yaitu: 1.) tipe nodulo-ulseratif,
termasuk ulkus rodent, 2). tipe berpigmen, 3). tipe
morfea atau fibrosing atau sklerosing, 4). tipe
superfisial, 5). tipe fibroepitelioma.1 Lokasi lesi KSB
paling sering ditemukan di sepertiga tubuh bagian
atas (75-80% di wajah), selanjutnya 25% di badan,
dan 5% di penis, vulva, serta perianal. Pada wajah
paling sering ditemukan di nasal tip dan alae nasi.5
KSB yang terjadi pada daerah genital diduga
berhubungan dengan gangguan pada proses fusi
lempeng embrionik.7 KSB bersifat sangat destruktif
karena dapat merusak jaringan kulit, tulang rawan,
bahkan tulang di sekitarnya sehingga menimbulkan
cacat pada wajah.3 Walaupun jarang menimbulkan
metastasis (0,028-0,55%), namun pada beberapa
kasus dilaporkan bahwa KSB bermetastasis ke
kelenjar getah bening, paru, dan tulang.3,5,8
Mekanisme metastasis KSB itu sendiri masih belum
diketahui.9 Terapi KSB sampai saat ini adalah
medikamentosa, eksisi, kuretase, krioterapi, dan
radiasi.3
ETIOPATOGENESIS
Etiologi KSB yang
selama ini diketahui berhubungan dengan faktor
genetik dan dipicu oleh lingkungan, terutama pajanan
sinar matahari UVB dengan panjang gelombang 290
– 320 nm.10-13
Faktor Genetik
Faktor genetik yang berperan pada KSB
adalah kromosom 1 dan satu varian dari setiap
kromosom 5, 7, 9, dan 12. Varian tersebut bersifat
heterozigot. Walaupun hubungan varian tersebut
dengan warna rambut, mata, dan warna kulit tidak
diketahui,
namun
terdapat
hubungan
dengan
ketidakmampuan kulit dalam memproteksi diri
terhadap pajanan sinar matahari.14 Kelainan genetik
yang bersifat homozigot seperti pada sindroma nevus
sel basal berhubungan dengan aktivasi pengaturan
sonic hedgehog pathway signaling
(SHH).8 Kelainan
tersebut dapat disebabkan oleh aktifnya kembali SHH
yang hanya aktif pada fetus,15,16 atau mutasi pada
SHH dengan mengaktivasi
patched tumor-supressor
homologue
1 (PTCH1) dan
protein forkhead box
(FOX) yang mencetuskan ekspresi gen dalam
pertumbuhan
sel
dengan
memicu
messenger
ribonucleoprotein
(mRNA) untuk berproliferasi,
diferensiasi,
longevity
, dan transformasi.
4,16Faktor Lingkungan
Faktor lingkungan yang sudah diketahui
dapat memicu terjadinya KSB adalah rangsangan
onkogen, luka kronis, trauma akut, hidrokarbon,
arsenik, tar batubara, obat topikal metoksipsoralen,
dan yang terpenting adalah pajanan sinar ultraviolet
(UV).
10-12Luka kronis, trauma akut, dan rangsangan
onkogen diduga dapat mengakibatkan pertumbuhan
keratinosit bulbus folikel rambut yang tumbuh ke
arah epidermis, walaupun mekanismenya belum
diketahui dengan pasti.
17Efek radiasi sinar UV terhadap kulit dapat
bersifat akut dan kronik.18,19 Secara klinis, efek
akut radiasi UV adalah
sunburn inflammation
,
eritema, nyeri, panas,
tanning
karena sintesis
melanin, gangguan modulasi sistem imun atau
imunosupresif lokal dan sistemik.18-20 Oksigen
dalam jaringan berpengaruh terhadap kerusakan
oksidatif oleh sinar UV, yaitu saat hipoksia jaringan
dengan menginduksi pembentukan
sunburn cell
dan
edema kulit,21 sedangkan pada pajanan sinar UV
kronik terjadi inflamasi akibat stres oksidatif.22
Kerusakan DNA yang disebabkan oleh pembentukan
6,4-photoproducts
, misalnya
cyclobutane pyrimidine
dimers
dapat menyebabkan akumulasi perubahan
delesi genetik.23 Kerusakan DNA tersebut akan
direparasi dengan perbaikan eksisi nukleotida atau
nucleotide excision repair
(NER) pada sel punca
yang terletak pada folikel rambut untuk berproliferasi
menggantikan sel yang rusak (homesostasis) yang
dijelaskan pada gambar 1A.20,21 Sel yang rusak
karena radiasi atau radikal bebas akibat stres oksidatif
(sunburn cell) juga dapat menyebabkan timbulnya
klon mutan (contohnya klon mutan p53) dari sel
sekitarnya tanpa mutasi sel.
24,25Pajanan kronis UVB selama 3-5 minggu
atau selama lebih dari 12 jam secara terus-menerus
di keratinosit sel basal dapat merusak gen p53 dan
p63 yang bersifat supresor tumor sehingga tidak
terjadi apoptosis.
26Fungsi normal gen supresor
tumor adalah sebagai barier fisiologis terhadap
ekspansi klonal dan mutasi gen, juga menghalangi
proliferasi sel yang berlebihan maupun metastasis
sel yang dikendalikan oleh onkogen.
26,27Pajanan
kronis UVB juga dapat menginduksi mutasi
ekspresi gen p53 yang spesifik terhadap kerusakan
sinar
matahari
atau
disebut
“mutasi
signature
”.
19,22,28Bila efek protoonkogen atau
fotokarsinogen sinar UV tersebut mengenai sel
punca yang sedang mengalami mitosis atau
proliferasi, maka dapat menyebabkan gangguan
pengaturan pada penggantian sel baru,
19,22,23,29terjadi
akumulasi
mutasi
protoonkogen,
23selanjutnya akan memicu sel punca/progenitor,
mengubah sel transformasi menjadi sel ganas.
26,29Kerusakan DNA kronis menyebabkan
kerusakan
DNA permanen sehingga tidak terjadi proses
reparasi DNA yang menyebabkan mutasi pada
SHH, p53, dan aktifnya telomerase.
26-28Telomerase
adalah enzim yang mengontrol panjang DNA pada
ujung kromosom (telomer). Pada sel normal,
telomer
memendek
setiap
kali
membelah.
Telomerase yang aktif menyebabkan telomer tidak
memendek saat pembelahan sehingga sel bersifat
abadi. Ekspresi gen p53 yang aktif (mutasi
signature) dan mutasi gen p53 mengakibatkan
terhambatnya
apoptosis
sel.
27Mutasi gen p53 ini
akan merangsang Src (protoonkogen tirosin
kinase) untuk memulai siklus cyclic adenosine
monophosphate response element binding (CREB)
yang meningkatkan proliferasi sel punca. Terdapat
dua gen utama pada jalur Hedgehog, yaitu PTCH1
dan
smoothed G-protein-coupled receptor (SMO)
.
Mutasi pada gen PTCH1 mencegah PTCH1
berikatan dengan SMO dan menstimulasi SHH.
Kehadiran SHH akan mengikat PTCH1, lalu
melepaskan dan mengaktifkan SMO
Selanjutnya, akan terjadi aktivasi supresor protein
fused (SuFu) dan glioma (GLI) dengan mentranskrip
gen di nukleus sehingga terjadi proliferasi sel punca
dengan tujuan homeostasis epidermis, juga proliferasi
sel punca yang terus-menerus. Penghantaran sinyal
tanpa hambatan ini menyebabkan pertumbuhan tumor
tidak terkendali, memicu timbulnya KSB seperti yang
dijelaskan pada gambar 1B.27,28,30
Untuk mempertahankan homeostasis kulit,
sel punca epidermis pada lapisan basal epidermis
kulit mengalami pembelahan sel secara asimetris dan
simetris.32-34 Pembentukan asimetris bersifat dua
arah, yaitu pembentukan ke arah horisontal dalam
mempertahankan lapisan basal epidermis, sedangkan
yang vertikal dimulai dengan pembentukan sel
holoklon,
meroklon, dan paraklon,
kemudian
berdiferensiasi
menjadi
lapisan
spinosum,
granulosum, dan korneum.33 Hanya holoklon yang
memiliki
kemampuan
proliferasi
luas
dan
pembaharuan diri. Proliferasi pada meroklon terbatas,
tanpa kemampuan pembaharuan diri, sedangkan
paraklon tidak mampu berproliferasi lebih lanjut.35
Tujuan
pembelahan
asimetris
ini
adalah
mempertahankan rantai DNA sel basal tetap sama
seumur hidup dan mencegah penumpukan DNA yang
telah
bermutasi
(
immortal
strand
hypothesis
).25,36,37
Selain faktor sel punca epidermis, proses
homeostasis kulit juga dipengaruhi oleh autokrin dan
parakrin yang hanya terdapat di lapisan dermis.
Autokrin dan parakrin mempengaruhi hormon
pertumbuhan
(growth factor)
dan memicu terjadinya
proliferasi sel punca.
Epidermal growth factor (EGF)
dan
transforming growth factor-alpha
(TGF-α)
berikatan dengan reseptor tirosin kinase pada sel
basal yang memicu proliferasi sel. Proses tersebut
dibantu oleh
keratinocytes growth factors
(KGF)
yang hanya ditemukan pada lapisan dermis dan
berperan sebagai mitogen pemicu mitosis sel basal
yang mengawali proliferasi sel. Di lain pihak,
TGF-β1 dan β2 menekan sintesis DNA dan menurunkan
kadar β1 integrin sehingga memulai suatu proses
diferensiasi sel ke arah stratum korneum.1 Integrin
β1 berfungsi untuk mempertahankan sel punca,
migrasi sel, dan memicu proliferasi atau menghambat
diferensiasi sel.38 Siklus sel ini dapat meningkat atau
dipercepat
saat
terjadinya
luka
atau
proses
karsinogenesis.
1Sel holoklon pada lapisan basal epidermis
adalah sel yang mempunyai sifat proliferasi tinggi
dan sangat terpengaruh oleh gen p53 dan p63. Gen
p63 juga digunakan sebagai penanda sel punca
keratinosit dalam kultur epitel, aplikasi klinis, dan
dalam studi tumorgenitas epitel.39 Lesi KSB dengan
sel-sel palisade yang tersusun pada tepi lesi
dinyatakan sebagai ciri khas gambaran patologi
anatomi KSB dan selama ini dianggap sebagai bagian
dari lesi KSB. Namun, Tan ST menemukan hal baru
yang sangat menarik dalam penelitiannya dengan
pewarnaan
imunohistokimia (IHK) leucine-rich
repeats
and
immunoglobuline-like domains 1
(LRIG1) dan
leucine-rich repeat containing G
protein-coupled receptor
6 (LGR6) pada lesi KSB.
Sel-sel palisade dari lesi KSB bukanlah bagian dari
lesi KSB, tetapi merupakan sel-sel basal normal yang
terdorong oleh sekelompok sel KSB yang sebenarnya
adalah sel-sel muda yang disebut dengan sel-sel
holoklon. Sel-sel holoklon merupakan kumpulan dari
sel KSB yang tumbuh akibat dari mutasi sel punca
basal dari lapisan basal epidermis yang tidak
terkendali proliferasinya. Sel-sel holoklon ini tidak
pernah tumbuh menjadi sel basal lapisan epidermis,
tetapi
berproliferasi
terus-menerus
menjadi
sekelompok sel yang dikelilingi oleh sel-sel normal
lapisan basal epidermis (palisade). Seperti yang
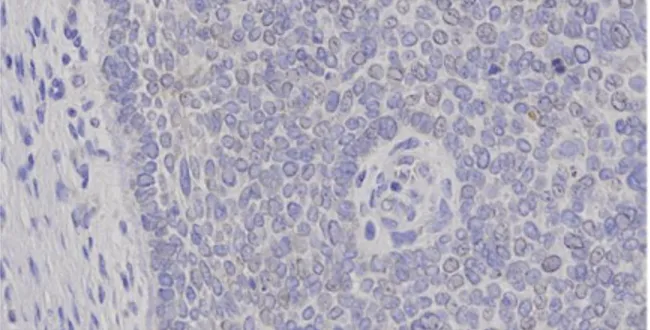
ditunjukkan pada gambar 2, pembentukan sel
holoklon tanpa gangguan pembentukan sel basal jelas
terlihat pada lesi KSB dengan sel monomorf di
tengah lesi yang dikelilingi sel basal palisade.
Pembentukan sel holoklon juga dapat diakibatkan
oleh gangguan pada diferensiasi ke arah transit
amplifying cell (sel TA) epidermis, sehingga tidak
terbentuk sel spinosum, granulosum, maupun stratum
korneum dan terjadi penipisan lapisan epidermis di
atas lesi KSB.
31Gambar 2 : Tampak sel-sel basal tersusun palisade pada pinggir
lesi KSB dengan bagian tengah terdiri dari sel-sel monomorf
poligonal yang tersusun tidak beraturan. (Pewarnaan IHK LGR6
pada sitoplasma sel, pembesaran 1000x) 31
PENUTUP
Etiopatogenesis terbaru karsinoma sel basal
diduga terjadi akibat mutasi pada sel punca epidermis
yang sedang mengalami proliferasi ke arah vertikal
sehingga
membentuk
sel
holoklon
dengan
terhambatnya diferensiasi sel menjadi lapisan
spinosum. Hal tersebut terjadi tanpa gangguan pada
proliferasi horisontal menjadi lapisan sel basal
epidermis, terlihat dengan susunan sel basal pada tepi
lesi yang berbentuk palisade. Mutasi ini dapat
disebabkan oleh
faktor onkogen, fotoonkogen, trauma akut maupun kronis, dan bahan-bahan kimia. Mutasi diawali oleh pembentukan sunburn cell, kerusakan DNA akibat photoproduct misalnya cyclobutane pyrimidine dimers, mutasi gen p53 dan p63, imunosupresi, ekspresi survivin yang berlebihan, dan pembentukan klon mutan. Selain itu, reparasi dengan perbaikan eksisi nukleotida (NER) menyebabkan akumulasi perubahan delesi genetik, hambatan apoptosis, proliferasi holoklon terus-menerus, kemudian menjadi KSB.
DAFTAR PUSTAKA
1. Carucci JA, Leffel DJ. Basal cell carcinoma. Dalam: Wolff K, Goldsmith LA, Katz SI, Glicherst BA, Paller AS, Leffel LJ, penyunting. Fitzpatrick’s Dermatology in General Medicine. Edisi ke-7. New York: Mc Graw-Hill Companies; 2008.h.1036-42.
2. Soomro FR, Bajaj DR, Patham GM, Abbasi P, Hussain J, Abbasi SA. Cutaneous malignant tumors: a profile of ten years at Linar, Larkana-Pakistan. J Pak Assoc Dermatol. 2010;20:133-6.
3. Ramsey ML, Sewell LD. Basal cell carcinoma. Medscape [Serial dalam internet]. 2009. [Disitasi 30 Nov 2012]. Tersedia di:
http://emedicine.medscape.com/article/1100003-overview. 4. Panda S. Nonmelanoma skin cancer in India: current scenario. Indian
J Dermatol. 2010;55(4): 373-8.
5. Fransen M, Karahalios A, Sharma N, English DR, Giles GG, Sinclain RD. Med J Aust. 2012; 197(10):565-8.
6. Yahya YF. Ekspresi β catenin dan β4 integrin pada karsinoma sel basal agresif dan non agresif Surabaya: Fakultas Kedokteran Universitas Airlangga; 2010.
7. Barankin B, Goldenberg G, Searles G. Nevoid basal cell carcinoma syndrome. Medscape [Serial dalam internet]. 2009. [Disitasi 30 Nov 2012]. Tersedia di: http://www.emedicine.com/ped/topic1592.htm. 8. Bader RS, Santacroce L, Diomede L, Kennedy AS. Surgical treatment
of basal cell carcinoma. Medscape [Serial dalam internet]. 2012. [Disitasi 30 Nov 2012]. Tersedia di: http://emedicine.medscape.com/article/27778-overview.
9. Robinson JK, Dahiya M. Basal cell carcinoma with pulmonary and lymph node metastasis causing death. Arch Dermatol. 2003;139(5):643-8.
10. Tilli CM, Steensel MA, Krekels GA, Neumann HA, Ramaekers FC. Molecular aetiology and pathogenesis of basal cell carcinoma. Br J Dermatol. 2005;152(6):1108-24.
11. Cohen P, Schulze K, Nelson B. Basal cell carcinoma with mixed histology : a possible pathogenesis for recurrent skin cancer. Dermatol Surg. 2006;32(4):542-51.
12. Arbiser JL. Translating cyclooxygenase signaling in patch heterozygote mice into a randomized clinical trial in basal cell carcinoma. Cancer Prev Res. 2010; 3:4-7.
13. Sajjiadian A, Barakat M, Negar SM, Rana RM. Skin cancer-basal cell carcinoma. Medscape. [Serial dalam internet]. 2010. [Disitasi 1 Des 2012]. Tersedia di: http://emedicine.medscape.com/article/871502-overview.
14. Santacroce L, Diomede L, Andrew SM. Epitheliomas, basal cell carcinoma. Medscape. [Serial dalam internet]. 2009. [Disitasi 1 Des 2012]. Tersedia di: http://emedicine.medscape.com/article/871502-overview.
15. Donovan J. Review of the hair follicle origin hypothesis for basal cell carcinoma. Dermatol Surg. 2009;35(9):1311-23.16 23.
16. Teh MT, Wong ST, Neill GW, Ghali L, Philpott MP, Quinn AG. FOXM1 is a downstream target of Gli1 in basal cell carcinomas. Cancer Res. 2002; 62(16): 4773-80.
17. Kasper M, Jaks V, Are A, Bergstrom A, Schwager A, Svard J, dkk. Wounding enhances epidermal tumorigenesis by recruiting hair follicle keratinocytes. Proc Natl Acad Sci. 2011; 108(10): 4099-104. 18. Situm M, Buljan M, Bulat V, Lugovic ML, Bolanca Z, Simic D. The
role of UV radiation in the development of basal cell carcinoma. Coll Antropol. 2008; 32(2):167-70.
19. Matsumura Y, Ananthaswamy HN. Molecular mechanisms of photocarcinogenesis. Front Biosci. 2002;7:765-83.2
20. Rass K, Reichrath J. UV damage and DNA repair in malignant melanoma and nonmelanoma Skin Cancer. 2008; 624: 162-78. 21. D’Orazio J, Jarret S, Ortiz AA, Scott T. UV radiation and the skin. Int
J Mol Sci. 2013; 14(6):12222-48.
22. Lacour JP. Carcinogenesis of basal cell carcinomas: genetics and molecular mechanisms. Br J Dermatol. 2002; 146(61):17-9. 23. de Gruijl FR, Kranen HJ, Mullenders LH. UV-induced DNA damage,
repair, mutations and oncogenic pathways in skin cancer. J Photobiol B. 2001; 63(1-3):19-27.
24. Chao DL, Eck JT, Brash DE, Maley CC, Luebeck G. Preneoplastic lesion growth driven by the death of adjacent normal stem cells. Proc Natl Acad Sci. 2008; 105(39): 15034-9.
25. Aberdam, D. Epidermal stem cell fate: what can we learn from embryonic stem cells? Cell Tissue Res. 2008; 331 (1):103-7. 26. Mimeault M, Batra SK. Recent advances on skin-resident
stem/progenitor cell functions in skin regeneration, aging and cancers and novel anti-aging and cancer therapies. J Cell Mol Med. 2010;14(1-2):116-34.
27. Qin JZ, Chaturvedi V, Denning MF, Bacon P, Panella J, Choubey D, dkk. Regulation of apoptosis by p53 in UV-irradiated human epidermis, psoriatic plaques and senescent keratinocytes. Oncogene. 2002; 21(19):2991-3002.
28. Dallaglio K, Marconi A, Pincelli C. Survivin: a dual player in healthy and diseased skin. J Invest Dermatol. 2012;132:18-27.
29. Youssef KK, Van Keymeulen A, Lapouge G, Beck B, Michaux C, Achouri Y, dkk. Identification of the cell lineage at the origin of basal cell carcinoma. Nature Cell Biol. 2010;12(3):299-305.
30. Zhang W, Remenyik E, Zelterman D, Brash DE, Wikonkal NM. Escaping the stem cell compartment: sustained UVB exposure allows p53-mutant keratinocytes to colonize adjacent epidermal proliferating units without incurring additional mutations. Proc Natl Acad Sci. 2001; 98(24):13948-53.
31. Tan ST. Identifikasi lokasi dan stem cell origin serta faktor yang mempengaruhi lemahnya kemampuan metastasis karsinoma sel basal (Disertasi). Makassar: Fakultas Kedokteran Universitas Hasanuddin; 2012.
32. Fuchs E. Finding one’s niche in the skin. Stem Cell. 2009; 4(6): 499-502.
33. Gambardella L, Barrandon Y. The multifaceted adult epidermal stem cell. Cur Opin Cell Biol. 2003;15:771-7.
34. Czuchra AP, Koegel H, Meyer H, Bauer M, Werner S, Brakebusch C, dkk. ß1 integrin-mediated adhesion signalling is essential for epidermal progenitor cell expansion. PLoS ONE. 2009;4(5):1-12. 35. Beaver CM, Ahmed A, Masters JR. Clonogenicity: holoclones and
meroclones contain stem cells. PLoS ONE. 2014;9(2):1-8.
36. Sotiropoulou PA, Candi A, Blanpain C. The majority of multipotent epidermal stem cells do not protect their genome by asymmetrical chromosome segregation. Stem Cells. 2008;26(11):2964-73. 37. Blanpain C, Lowry W E, Geoghegan A, Polak L, Fuchs E.
Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 2004; 118(5):635-48. 38. Pincelli C, Marconi A. Keratinocyte stem cells: friends and foes. J
Cell Physiol. 2010;225(2):310-5.
39. Pellegrini G, Dellambra E, Golisano O, Martinelli E, Fantozzi I, Bondanza S, dkk. p63 identifies keratinocyte stem cells. Proc Natl Acad Sci. 2001; 98(6): 3156-61.