BAB II
TINJAUAN PUSTAKA
2.1. Tension-Type Headache Kronik
Tension Type Headache kronik adalah nyeri kepala yang berasal dari
TTH episodik, dengan serangan setiap hari atau serangan episodik nyeri kepala yang lebih sering yang berlangsung beberapa menit sampai beberapa hari. Nyeri kepala bersifat bilateral, menekan atau mengikat dalam kualitas dan intensitas ringan atau sedang, dan nyeri tidak bertambah memberat dengan aktifitas fisik yang rutin. Kemungkinan `terdapat mual, fotofobia atau fonofobia ringan (Sjahrir, Machfoed, Suharjanti, Basir, Adnjana, 2013).
Prevalensi nyeri kepala pada populasi dewasa berkisar 47% untuk nyeri kepala secara umum, di dalamnya termasuk 10% migren, 38% TTH dan 3% nyeri kepala kronik. Prevalensi migren lebih tinggi di Eropa dan Amerika Utara, sedangkan prevalensi TTH lebih tinggi di Eropa (80%) dibandingkan dengan Asia dan Amerika (20-30%) (Jensen dan Stovner, 2008). Sejumlah 1,4-2,2% dari populasi menderita migren kronik dan 2,2% menderita TTH Kronik, dimana penderitanya mengalami 15 hari atau lebih serangan setiap bulan (Houle, Butschek, Turner, Smitherman, Raphins, 2012).
yang awalnya menderita TTH kronik, 31% tetap menderita TTH kronik, 21% menjadi medication-overuse headache, dan sisanya berubah menjadi TTH episodik, dengan atau tanpa terapi profilaksis (Mork, 2000). Lyngberg dkk meneliti 146 penderita TTH episodik frequent, dan 15 penderita TTH kronik. Ternyata setelah difollow-up dijumpai 45% berubah menjadi TTH infrequent atau tidak ada nyeri kepala, 39% tetap menderita TTH episodik frequent, dan 16% menjadi TTH kronik. Luaran yang buruk berhubungan dengan TTH kronik sejak awal, menderita migren pada saat yang bersamaan, tidak menikah dan adanya gangguan tidur (Lyngberg, 2005). Beberapa faktor risiko kronifikasi nyeri kepala yang dapat dimodifikasi pada populasi non klinis termasuk jenis kelamin wanita, status sosioekonomi rendah, dan riwayat pernikahan sebelumnya. Sedangkan faktor risiko potensial yang dapat dimodifikasi meliputi obesitas, mengorok, komorbid dengan penyakit nyeri lainnya, cedera kepala atau leher, dan pengalaman hidup seperti kematian dan perceraian (Scher, Midgette, Lipton, 2008).
komorbid dengan gangguan psikiatris, atau pemicu nyeri kepala yang tidak jelas yang persisten dapat membatasi efektifitas pengobatan nyeri kepala. Obat-obatan dan terapi behavior saat ini efektif untuk ETTH tetapi kurang begitu efektif untuk CTTH. Kombinasi terapi behavior dan obat preventif mungkin dapat memperbaiki hasil pengobatan CTTH (Holroyd, 2002).
Penelitian-penelitian terdahulu mengenai mekanisme patofisiologi TTH memfokuskan pada faktor muskuler. Namun, telah menjadi lebih nyata bahwa faktor sentral, khususnya sensitisasi sentral juga memiliki peranan yang penting (Matthews, 2006).
Pada nyeri kepala, sensitisasi terdapat di nosiseptor meningeal dan neuron trigeminal sentral. Faktor-faktor miofasial dan sensitisasi perifer dari nosiseptor memegang peranan dalam kejadian TTH episodik, sedangkan sensitisasi sentral berperan dalam TTH kronik. Ketidakseimbangan antara faktor miofasial perifer dengan mekanisme sentral merupakan faktor dasar patogenetik sefalgia (Jensen, Ehde, Hoffman, Patterson, Czerniecki, Robnson, 2002; Sjahrir, 2008).
2.1.1. Faktor Perifer
penting dalam TTH. Mekanisme patofisiologi yang meningkatkan nyeri tekan ini masih belum dapat sepenuhnya dimengerti.
Mekanisme yang mungkin yang menyebabkan nyeri miofasial dan nyeri tekan meliputi (Bendtsen, 2000) : 1. Sensitisasi nosiseptor miofasial; 2. Sensitisasi second order neurons pada level spinal dorsal horn/ trigeminal nucleus. ; 3. Sensitisasi neuron supraspinal ; dan 4. Penurunan
aktifitas antinosiseptif dari struktur supraspinal.
Pada kondisi normal, nyeri miofasial dimediasi oleh serabut tipis bermielin (Aδ) dan serabut C tidak bermielin, dan serabut bermielin yang tebal (Aα dan Aβ) normalnya memediasi sensasi yang tidak berbahaya. Berbagai keadaan yang berbahaya, seperti stimulus mekanik, iskemia dan mediator kimia dapat mengeksitasi dan mensensitisasi serabut Aδ dan serabut C, dan oleh karenanya memiliki peran dalam peningkatan nyeri tekan pada TTH (Matthews, 2006)
Peningkatan kekerasan otot perikranial dijumpai pada penderita TTH kronik, namun hanya sedikit hubungan antara kekerasan dan intensitas nyeri kepala. Pada penelitian oleh Rollnik dkk yang memberikan injeksi toksin botulinum dengan tujuan untuk menurunkan kekerasan otot temporalis dinilai dengan pemeriksaan EMG dan dievalusi setelah 12 minggu, ternyata tidak ditemukan penurunan dalam nyeri kepala (Rollnik, Karst, Fink, Dengler, 2001). Selama istirahat atau olahraga, konsentrasi laktat di otot trapezius tidak berbeda antara penderita TTH kronik dibandingkan dengan orang sehat. Namun peningkatan aliran darah yang diinduksi olahraga berkurang (blunted) pada penderita TTH kronik, diinterpretasikan sebagai peningkatan vasokonstriksi simpatetik sehubungan dengan hipereksitabilitas neuron-neuron SSP (Fernandez-de-las-Penas, Bueno, Ferrando, Elliot, Cuadrado, Pareja, 2007).
Peningkatan nyeri tekan perikranial mungkin disebabkan adanya peningkatan aktifitas pada myofascial trigger points (MTPs). Myofascial trigger points adalah suatu tempat yang hyperirritable yang berhubungan
bebas nyeri (Shah, Danoff, Desai, Parikh, Nakamura, Philips, et.al. 2008). Bila hal ini benar, maka teori MTP aktif yang dapat menyebabkan sensitisasi nosiseptor perifer, yang selanjutnya melalui input nosiseptif yang persisten, berkontribusi terhadap sensitisasi sentral dan kronifikasi dari TTH. Selanjutnya kronifikasi TTH akan menimbulkan peningkatan nyeri tekan perikranial (Bezov, Ashina, Jensen, Bendtsen, 2010). Couppe´ dkk menemukan bahwa trigger points (TPs) aktif jauh lebih sering ditemukan pada TTH kronik dibanding kontrol, dan jumlah serta intensitas nyeri dari TPs dapat digunakan untuk membedakan kedua grup (Couppe, Torelli, Fuglsang-Frederiksen, Andersen, Jensen, 2007). Trigger points aktif multipel ditemukan pada otot temporalis, khususnya di columna anterior dan di medial perut otot (muscle belly) . Lokasi TPs yang aktif di otot temporalis berhubungan dengan area otot dengan ambang nyeri tekan yang rendah, mendukung adanya hubungan antara TPs aktif multipel dengan peta topografis sensitifitas terhadap tekanan pada wanita dengan TTH kronik (Ferna´ndez-de-las-Pen˜as, Caminero, Madeleine, Guillem-Mesado, Ge, Arendt-Nielsen, et.al., 2009). Pada penderita TTH kronik, nyeri lokal dan nyeri referal dari TPs aktif di otot temporalis mungkin berkontribusi terhadap karakteristik nyeri pada TTH kronik (Ferna´ndez-de-las-Pen˜as, Bueno, Ferrando, Elliot, Cuadrado, Pareja, 2007).
Myofascial trigger points yang aktif ditemukan di otot-otot yang
sternokleidomastoideus, suboksipital dan trapezius atas. Penderita TTH kronik memiliki MTP yang lebih banyak dibandingkan dengan orang sehat. Hal ini menunjukkan kemungkinan peranan MTP dalam patofisiologi TTH (Marcus, Scharff, Mercer, Turk,1999).
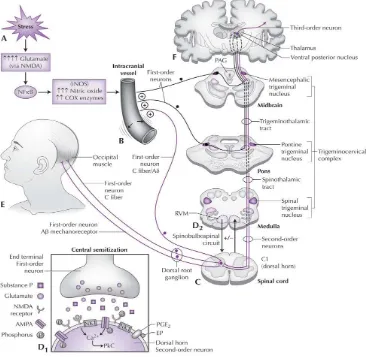
Gambar 1 di bawah ini menunjukkan bagaimana terjadinya konversi dari TTH episodik menjadi TTH kronik. Masukan nyeri yang terus menerus dari jaringan miofasial perikranium menginduksi terjadinya sensitisasi sentral, sehingga lama kelamaan stimulus yang seharusnya tidak menimbulkan nyeri, diterjemahkan sebagai nyeri (Bezov, Ashina, Jensen, Bendtsen, 2011).
Gambar 1. Input nosiseptif perifer yang berkelanjutan sebagai kemungkinan penyebab sensitisasi sentral dan kronifikasi nyeri kepala. Dikutip dari : Bezov, Ashina, Jensen, Bendsten (2011)
imun ini tidak hanya bertanggung jawab untuk mekanisme pertahanan tubuh tetapi juga menginisiasi sensitisasi nosiseptor perifer. Melalui sintesis dan pelepasan mediator inflamasi dan interaksinya dengan neurotransmitter dan reseptornya, sel-sel imun, glia dan neuron-neuron membentuk jaringan yang terintegrasi yang mengkoordinasikan respon imun dan memodulasi eksitabilitas jalur nyeri. Sistem imun juga akan mengurangi sensitisasi dengan menghasilkan immune-derived analgetic dan anti inflamasi atau agen proresolusi (Ren dan Dubner, 2010).
Studi oleh Hubbard dan Berkoff (1993) yang menggunakan elektroda jarum, melaporkan aktifitas EMG pada MTP meningkat secara signifikan dibandingkan aktifitas EMG pada otot yang tidak nyeri (non-tender). Selanjutnya, aktifitas EMG pada trigger points secara signifikan
lebih tinggi pada penderita TTH kronik dibandingkan dengan kontrol yang sehat. Trigger point tersebut ternyata hanya berdiameter beberapa milimeter, yang mungkin dapat menjelaskan mengapa peningkatan aktifitas EMG hanya dapat dideteksi sebahagian pada elektroda permukaan. Aktifitas yang terus-menerus pada beberapa motor unit sepanjang waktu yang lama mungkin cukup untuk perkembangan nyeri miofasial dan nyeri kepala. Oleh karenanya, dapat disimpulkan bahwa nyeri tekan miofasial tidak disebabkan kontraksi otot berlebihan yang menyeluruh sehingga menyebabkan iskemia otot, seperti yang sebelumnya diyakini (Bendsten, 2000).
semua modalitas stimulus, ambang deteksi nyeri, ambang toleransi nyeri dan laporan nyeri dapat dinilai. Ambang deteksi nyeri adalah kemungkinan stimulus terendah yang menimbulkan sensasi nyeri. Ambang toleransi nyeri adalah stimulus nyeri maksimal yang dapat ditoleransi seseorang. Studi ambang nyeri pada penderita TTH menunjukkan perbedaan antara penderita TTH episodik dan TTH kronik. Deteksi ambang nyeri tekan yang normal ditemukan pada penderita TTH episodik pada beberapa studi (Gobel, Weigle, Kropp, Soyka,1992; Jensen, Rasmussen, Pedersen, Olesen, 1993; Bezov, Ashina, Jensen, Bendtsen, 2011). Namun pada penderita TTH kronik, berbagai studi melaporkan adanya ambang nyeri tekan, termal dan elektrik yang lebih rendah pada regio sefalik dibandingkan kontrol. Bendsten dan Jensen juga menemukan adanya penurunan ambang nyeri dan toleransi nyeri pada penderita TTH kronik (Bezov, Ashina, Jensen, Bendtsen, 2011).
Meskipun fungsi fisiologis sitokin di otak adalah sebagai neuromodulator dan memiliki fungsi imunologik untuk preservasi atau restorasi hemostasis, telah diketahui bahwa sedikit saja perubahan pada kadarnya di otak (yang mungkin tidak dapat diukur di CSS) terkadang dapat mengakibatkan reaksi sistemik dan sintesis sitokin perifer (Rothwell, 1995). Mungkin juga bahwa faktor-faktor seperti sitokin dapat memicu sistem trigeminovaskuler, yang dianggap sebagai bagian dari sistem pertahanan otak. Dalam memicu pelepasan neuropeptida vasoaktif dan nosiseptif, sitokin dapat berkontribusi terhadap terjadinya nyeri kepala. Bisa juga sitokin dilepaskan oleh karena aktifasi trigeminovaskuler (Bo, Davidsen, Gulbrandsen, Dietrichs, Bovim, Stovner, et.al., 2008).
Mediator-mediator kimia juga dapat mensensitisasi ujung saraf nosiseptif. Khususnya stimulan-stimulan yang efektif untuk nosiseptor-nosiseptor otot skelet adalah substansi endogen, seperti serotonin, bradikinin dan ion potassium. Substansi-substansi ini dapat dihasilkan melalui berbagai mekanisme. Misalnya, serotonin dilepaskan oleh platelet, bradikinin dapat dipecah dari molekul plasma prekursornya kallin, dan potassium dapat dilepaskan dari sel-sel otot, bila kondisi patologik terjadi (penurunan pH selama iskemia, kerusakan vaskuler, dan cedera terhadap sel otot) (Bendsten, 2000).
2.1.2. Faktor Sentral
pada level spinal dorsal horn/ trigeminal nucleus, sensitisasi neuron supraspinal dan penurunan aktifitas antinosiseptif dari struktur supraspinal (Matthew, 2006)
Mekanisme sentral merupakan hal yang sangat penting dalam patofisiologi TTH kronik. Telah diketahui bahwa deteksi nyeri tekan dan ambang toleransi terhadap stimulus mekanik menurun pada penderita TTH kronik. Selanjutnya, Bendsten (1996) menunjukkan bahwa penderita dengan TTH kronik mengalami persepsi nyeri yang terganggu secara kualitatif. Menurut model yang diajukan oleh Bendtsen pada tahun 2000, masalah utama pada TTH kronik adalah sensitisasi sentral pada level spinal dorsal horn atau trigeminal nucleus yang menyebabkan terjadinya
sensisitasi sentral. Perubahan neuroplastik sentral dapat mempengaruhi regulasi mekanisme perifer dan menyebabkan peningkatan aktifitas otot perikranial atau pelepasan neurotransmitter di jaringan miofasial (Bendtsen, 2000). Berdasarkan hal ini, dianggap bahwa sensitisasi sentral dan keadaan nyeri kronik pada penderita TTH kronik mungkin berhubungan dengan sensitisasi pada level spinal dorsal horn atau trigeminal nucleus, atau keduanya, diinduksi oleh input nosiseptif yang
berkelanjutan dari jaringan miofasial perikranial (Ashina, 2007).
ambang) oleh diffuse noxious inhibitory control (DNIC). Diffuse noxious inhibitory control yang dipicu oleh serabut Aδ perifer dan serabut C, dapat berasal dari aktifasi fisiologis dari beberapa struktur otak yang diduga terlibat dalam inhibisi descending (descending inhibition). Langemark (1993) menemukan penurunan ambang NFR pada penderita TTH kronik dibandingkan kontrol. Studi oleh Pielsticker (2005) menemukan adanya gangguan pada mekanisme inhibisi DNIC pada penderita TTH kronik. Sementara itu, studi Catchart (2010) menunjukkan bahwa respons DNIC menurun pada penderita TTH kronik dalam responsnya terhadap 10 denyut algometer dan inflasi cuff, dibandingkan dengan kontrol yang sehat. Secara kumulatif, studi-studi diatas menunjukkkan disfungsi dari DNIC pada penderita TTH kronik (Bezov, Ashina, Jensen, Bendtsen, 2011).
Calcitonin-gene-related peptide (CGRP) adalah neurotransmitter
yang aktif pada sistem trigeminovaskuler. Konsentrasi plasma CGRP meningkat selama serangan migren dan nyeri kepala klaster. Pada penderita TTH kronik, konsentrasi plasma CGRP normal, tidak bergantung pada keadaan nyeri kepala, dan tidak meningkat setelah pemberian glyceril trinitrate. Namun, pada penderita TTH kronik dengan nyeri yang
berpulsasi, konsentrasi CGRP meningkat pada periode interiktal (Ashina, Bendtsen, Jensen, Schifter, Olesen, 2000).
berlama-lama dapat mengaktifasi reseptor post-sinaptik yang pada keadaan normal terblok, misalnya reseptor N-methyl D-aspartate (NMDA). Aktifasi reseptor NMDA menyebabkan peningkatan influks kalsium, yang menginisiasi kaskade biokimia, termasuk peningkatan produksi nitric oxide, prostaglandin, dan protein-protein kinase. Hal ini dapat
menyebabkan perubahan metabolik jangka panjang dan meningkatkan eksitabilitas sel yang terkena (Coderre, Katz, Vaccarino, Melzack, 1993; Yakhs dan Malmberg 1994; Dickenson, 1996).
antinosiseptif pada penyakit ini (Langemark, Bach, Ekman, Olesen, 1995; Furnal dan Schoenen, 2008).
Studi pada binatang menunjukkan bahwa sensitisasi pathway nyeri dapat disebabkan atau berhubungan dengan aktifasi nitric oxide synthase (NOS) dan pembentukan nitric oxide (NO). Inhibitor NOS mengurangi sensitisasi sentral pada nyeri persisten pada model binatang dengan mengurangi sensitisasi spinal dorsal horn yang diinduksi oleh input nyeri yang berkelanjutan dari perifer. Ashina dan kawan-kawan (1999) meneliti efek analgesik inhibitor NOS, NG-monomethyl-L-arginine hydrochloride (L
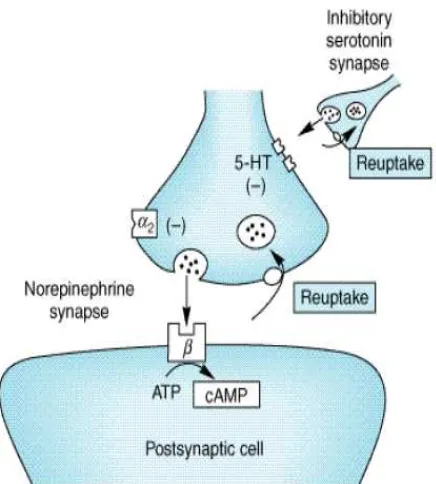
Gangguan pada pain-modulating transmitters, begitu juga dengan perubahan seluler pada SSP tampaknya terlibat dalam perubahan persepsi nyeri pada penderita TTH kronik. Serotonin (5-hydroxytriptamine, 5-HT) merupakan neurotransmitter yang penting namun memiliki peran
yang kompleks dalam modulasi nyeri. Serotonin memiliki aksi algogenik (menghasilkan nyeri) pada saraf perifer, namun tampaknya memiliki efek antinosiseptif yang predominan pada SSP. Serotonin adalah neurotransmitter penting pada pathway anti-nosiseptif yang descending dari brainstem ke spinal dorsal horn, dan mungkin juga terlibat dalam pathway ascending anti-nosiseptif. Efek anti-nosiseptif 5-HT dimediasi
Kriteria diagnostik TTH kronik sesuai The International Classification of Headache Disorders, 2nd Edition (2004) adalah sebagai
berikut (Headache Classification Subcommittee of t
2004 ;
A. Nyeri kepala timbul ≥ 15 hari/b ulan, berlangsung > 3 bulan (≥ 180 hari/tahun) dan juga memenuhi kriteria B-D
Sjahrir, Machfoed, Suharjanti, Basir, Adnjana, 2013) :
B. Nyeri kepala berlangsung beberapa jam atau terus-menerus C. Nyeri kepala memiliki paling tidak 2 karakteristik berikut :
1. Lokasi bilateral
2. Menekan/ mengikat (tidak berdenyut) 3. Ringan atau sedang
4. Tidak memberat dengan aktifitas fisik yang rutin D. Tidak didapatkan :
1. Lebih dari satu : fotofobia, fonofobia atau mual yang ringan 2. Mual yang sedang atau berat, maupun muntah
E. Tidak ada kaitan dengan penyakit lain.
2.2. Tension-Type Headache Kronik dan Stres Psikologis
bahwa TTH dapat diinduksi oleh stres psikologis, dan terapi psikologis dan perilaku tampaknya efektif untuk terapi TTH, seperti halnya dengan farmakoterapi. Mekanisme bagaimana stres psikologis berperan dalam TTH belum dimengerti sepenuhnya, namun faktor sentral seperti kontraksi involunter dari otot-otot sefalik, penurunan aktifitas penghambat nyeri descending supraspinal, hipersensitifitas supraspinal terhadap stimulus nosiseptif mungkin terlibat (Bendsten, 2000). Walaupun banyak penelitian menunjukkan adanya dasar perubahan biokimiawi yang mendasari patologi terjadinya nyeri kepala, masih banyak klinisi yang tetap percaya adanya kontribusi kondisi psikologis dalam proses kronifikasi nyeri kepala (Muller, 2000). Pada penelitian dengan stres buatan di laboratorium oleh Janke dan kawan-kawan, depresi meningkatkan dan dihubungkan dengan meningkatnya pericranial muscle tenderness. Pada individu dengan frequent headache depresi meningkatkan sensitisasi sentral dan
meningkatkan kerentanan terhadap TTH (Janke, Holroyd, Romanek, 2004). Faktor genetik kelihatannya lebih berperan dalam patofisiologi migren bila dibandingkan dengan TTH. Walaupun konsep TTH menunjukkan adanya hubungan dengan faktor psikologis, penelitian menunjukkan profil psikologis penderita ETTH tidak berbeda dengan kontrol (Kelman, 2011).
mengidentifikasi 1319 penderita mengalami TTH dan stres merupakan faktor yang mempresipitasi serangan nyeri kepala pada 651 orang (49,4%, odds ratio 1,4; 95% CI 1,17-1,69) (Torelli, Abrignani, Castellini, Lambru, Manzoni, 2008).
Suatu studi di Italia oleh Beghi yang meneliti komorbiditas nyeri kepala dengan penyakit psikiatrik menemukan bahwa dari 374 penderita yang ikut serta, gangguan psikiatri ditemukan pada 49 penderita (14,6%; 10,9% penderita migren, 12,8% penderita TTH dan 21,4% penderita nyeri kepala tipe mixed). Dari Mini International Neuropsychiatry Interview (MINI) dideteksi adanya episode depresif pada 59,9% penderita migren, 68,3% penderita TTH dan 69,6% penderita nyeri kepala tipe mixed (Beghi, Allais, Cortelli, D’Amico, De Simone, d’Onofrio, et.al., 2007; Beghi, Bussone, D’Amico, Cortelli, Cevoli, Manzoni, et.al., 2010). Ansietas ditemukan pada 18,4% penderita migren, 19,3% penderita TTH, dan 18,4% penderita nyeri kepala tipe mixed (Torelli, Abrignani, Castellini, Lambru, Manzoni, 2008). Peneliti lain menemukan bahwa penderita migren dan TTH memiliki tingkat ansietas dan depresi yang lebih tinggi. Mereka menyimpulkan bahwa penderita migren dan TTH memiliki coping responses yang maladaptif dan inefektif, serta gambaran kepribadian neurotik dibandingkan dengan individu sehat. Hal ini mungkin berperan penting dalam perkembangan dan beratnya nyeri kepala (Ozdemir, Aykan, Ozdemir, 2014).
Maladaptive cognitions ditemukan pada kebanyakan penderita
2010). Namun Puretic dkk yang meneliti penderita TTH dan individu sehat di Zagreab, Kroasia berpendapat bahwa bahwa TTH yang merupakan suatu kondisi nyeri kronik mungkin merupakan konsekuensi dan bukan penyebab dari gejala-gejala depresi (Puretic, Lovrencic-Huzjan, Cvetkovic, Kes, 2014).
Penelitian Yucel (2002) mengevaluasi automatic thoughts, alexithymia dan assertiveness (ketegasan) menemukan bahwa dibandingkan dengan kontrol, penderita nyeri kepala memiliki skor yang lebih tinggi pada pengukuran automatic thoughts dan alexithymia, dan skor assertiveness yang lebih rendah. Penderita TTH kronik memiliki skor yang lebih tinggi untuk automatic thoughts dibandingkan dengan penderita TTH episodik. Penemuan ini menunjukkan bahwa penderita TTH mungkin memiliki kesulitan dalam mengekspresikan emosinya (Yucel, Kora, Ozylcin, Alcalar, Ozay Ozdemir, Yucel, 2002). Sementara Autret dan kawan-kawan menemukan penderita migren lebih rentan terhadap munculnya gejala somatik dan memiliki predisposisi untuk mengembangkan dampak negatif dari nyeri (Autret, Roux, Ribaux-Lepage, Valade, Debiasis, 2010). Penelitian lain menunjukkan bahwa frekuensi nyeri kepala memiliki dampak terhadap kualitas hidup penderitanya pada usia lanjut, khususnya berkaitan dengan nyeri tengkuk dan disabilitas yang diakibatkannya (Uthaikup, Sterling, Jull, 2009).
psikologis dapat terjadi melalui sirkuit yang sama ini, mempengaruhi sinyal nyeri di dalam otak (Nicholson, Houle, Rhudy, Norton, 2007).
Mekanisme yang paling banyak diketahui yang memodifikasi nyeri adalah sirkuit yang terdiri dari neuron-neuron periaquaductal gray (PAG), 5-hydroxytriptamine (5-HT) dari rostral ventromedial medulla (RVM), dan neuron-neuron norepinefrin (NE) dari dorsolateral pontomesencephalic tegmentum (MLPT). Setidaknya beberapa efek pereda nyeri dari analgesik opioid, agonis 5-HT, dan agonis NE terjadi melalui sirkuit ini. Sirkuit PAG-RVM-MLPT menerima input dari banyak regio forebrain yang terlibat juga dalam proses psikologis, khususnya sistem limbik. Contohnya, amigdala, area yang diketahui penting untuk emosi, dapat mengaktifasi sirkuit ini dan penting untuk modulasi nyeri oleh faktor kognitif-emosional. Sementara itu, korteks anterior cingulate, korteks orbitofrontal, insula dan hipokampus terlibat dalam modulasi nyeri yang berasal dari atensi, ekspetasi, persepsi dari pengendalian (controllability) dan atau ansietas (kecemasan). Penemuan-penemuan ini mendukung pandangan biopsikososial dari nyeri kepala (Nicholson, Houle, Rhudy, Norton, 2007).
Stres dan ketegangan mental adalah keluhan utama dalam TTH, dan telah dijumpai hubungan antara stres dan nyeri kepala (Clark, Sakai, Merrill, Flack, McCreary, 1995). Meskipun stres sendiri penting untuk survival, peningkatan stres yang kronik memiliki hubungan langsung
patofisiologi nyeri pada penderita TTH. Satu hubungan yang menarik mengenai nyeri adalah aktifasi faktor transkripsi, faktor nuklear κ-light chain (NFκB). Stres mengaktifasi NFκB dalam 4 jam setelah inisiasi stimulus stres pada tikus (Madrigal, Garcia-Bueno, Caso, Perez-Nievaz, Leza, 2006). Ketika NFκB diaktifasi, ia meningkatkan perubahan post-transkripsional yang mengakibatkan aktifasi iNOS (inducible nitric oxyde synthase) dan COX-2 (cyclo-oxygenase-2) yang berperan dalam nyeri.
Konsisten dengan ini, imobilisasi stres meningkatkan ekspresi iNOS and aktifitasnya pada jam ke-6, dimana inhibisi NFκB oleh pyrrolidine menurunkan ekspresi dan aktifitas iNOS pada binatang yang stres (Madrigal, Moro, Lizasoain, Lorenzo, Castrillo, Bosca, et.al., 2001).
Glyceril trinitrate (GTN), suatu penginduksi TTH, menginduksi aktifasi NFκB pada duramater tikus, seiring dengan peningkatan kadar mRNA iNOS. Selain itu, reseptor NMDA (N-methyl-D-aspartate) memainkan peran esensial dalam aktifasi NFκB. Blokade reseptor NMDA menurunkan translokasi NFκB dan secara bersamaan menghambat secara parsial ekspresi iNOS yang diinduksi stres dan aktifasinya di otak (Munhoz, Lepsch, Kawamoto, Malta, de Sa Lima, Avellar, et.al.,2006; Chen, 2009).
menghasilkan perubahan vasodilatasi dan perubahan-perubahan oksidatif. Hal ini akan menghasilkan nyeri yang berasal dari dilatasi pembuluh darah intrakranial, dura dan struktur-struktur yang lain, dan bila hal ini persisten, akan menyebabkan TTH dan mempotensiasi nyeri pada otot-otot perikranial melalui sensitisasi perifer dan sentral (Chen, 2009).
Gambar 2. Patofisiologi Tension-Type Headache kronik (chronic tension-type headache, TTH Kronik), evolusi dari Tension-Type Headache
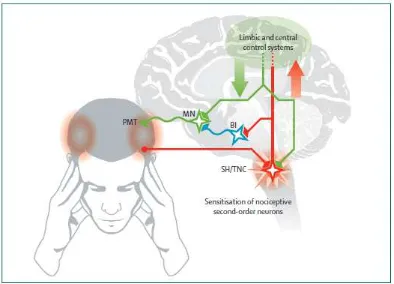
Gambar 3. Gambar model patofisiologi TTH Kronik
Input nosiseptif dari jaringan miofasial perikranial (garis merah) meningkat karena sebab yang tidak diketahui, yang menghasilkan perubahan-perubahan plastis (sensitisasi nosiseptif second order neuron) pada spinal dorsal horn (segmen C2-C3) dan trigeminal nucleus. Input nosiseptif ke struktur supraspinal akan meningkat, yang akan meningkatkan eksitabilitas neuron supraspinal dan menurunkan inhibisi dari transmisi nosiseptif yang meningkat pada spinal dorsal horn dan nucleus trigeminal (garis hijau). Perubahan-perubahan neuroplastis sentral juga dapat meningkatkan perangsangan ke motor neuron pada level supraspinal dan segmental, yang menghasilkan sedikit peningkatan aktifitas otot dan peningkatan kekerasan otot. PMT= pericranial myofascial tissue, BI= brainstem interneurons, MN= motor nuclei, SH/TNC= spinal horn / trigeminal nucleus caudalis.
2.3. Sitokin
Sitokin adalah polipeptida yang diproduksi sebagai respon terhadap mikroba dan antigen lainnya yang memediasi dan meregulasi reaksi imun dan inflamasi (Abbas, Lichtman, Pillai, 2007). Sitokin merupakan peptida pengatur (regulator) yang dapat diproduksi oleh hampir semua sel yang berinti dalam tubuh. Sitokin dikelompokkan dalam mediator yang berfungsi dalam komunikasi antar sel yang berfungsi membawa sinyal yang dikirimkan ke sel sasaran agar melakukan perubahan perilaku. Dalam komunikasi antar sel dibutuhkan sel penghasil mediator, pembawa sinyal dan sel sasaran yang akan menerima sinyal. Sinyal yang dibawa oleh mediator akan diterima oleh molekul reseptor yang akan meneruskan pesan melalui mekanisme transduksi yang berakhir dalam aktifasi gena-gena dalam inti sel sasaran (Subowo, 2009).
Sitokin biasanya mempunyai sel-sel sasaran yang tidak terlalu jauh letaknya, sehingga sitokin tidak bergantung pada peredaran darah, namun tidak berarti bahwa sitokin tidak dapat ditemukan dalam darah. Walaupun umumnya sitokin mempunyai efek pada sel-sel sasaran yang berada di dekatnya, beberapa jenis sitokin, misalnya IL-3 dan GM-CSF yang dilepaskan oleh sel TCD4+
Walaupun berbagai jenis sitokin secara struktural berbeda, mereka memilki beberapa kesamaan : 1. Sekresi sitokin berlangsung singkat dan self-limited. Sitokin biasanya tidak disimpan dan sintesanya diinisiasi oleh
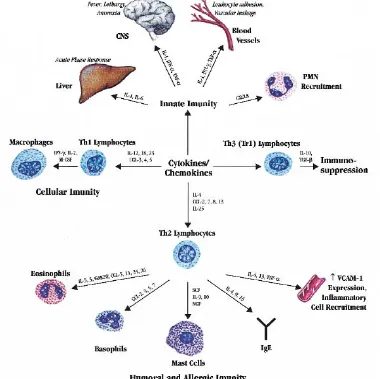
Secara fungsional, sitokin dapat dibagi atas 3 kategori berdasarkan kerja biologis utamanya, yaitu : 1. Mediator dan regulator dari innate immunity yang terutama dihasilkan oleh fagosit mononuklear sebagai
respon terhadap agen infeksius, misalnya TNF, IL-1, IL-12 dan IFN-γ ; 2. Mediator dan regulator adaptive immunity yang terutama dihasilkan oleh limfosit T sebagai respon terhadap pengenalan spesifik antigen asing, misalnya IL-2, IL-4, IL-5 dan IFN-γ ; 3. Stimulator hematopoesis yang dihasilkan oleh sel stroma sumsum tulang, lekosit dan sel-sel lainnya dan berfungsi merangsang pertumbuhan dan diferensiasi lekosit immature (Abbas, Lichtman, Pillai, 2007).
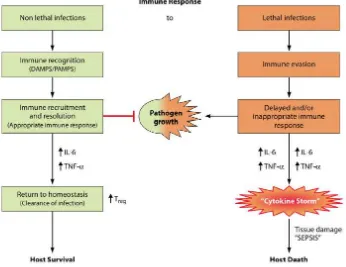
Selama terjadi infeksi, tubuh mengenali bakteri patogen yang mengarah kepada cellular recruitment dan timbulnya respon sitokin proinflamatori termasuk IL-6 dan TNF-α. Respon inflamasi ini berlanjut ke pembersihan bakteri patogen dan memungkinkan tubuh kembali ke keadaan homeostasis imunitas dan penderita selamat. Pada beberapa kasus infeksi, bakteri patogen terlambat diidentifikasi sehingga respon imun pun terlambat muncul. Hal ini memungkinkan bakteri patogen berproliferasi dan memicu hipersitokinemia sehingga mengakibatkan kerusakan jaringan, bahkan kematian (D’Elia, Harrison, Oyston, Lukaszewski, Clark, 2013).
Gambar 5. “Cytokine Storm” Dikutip dari : D’Elia, et.al.(2013)
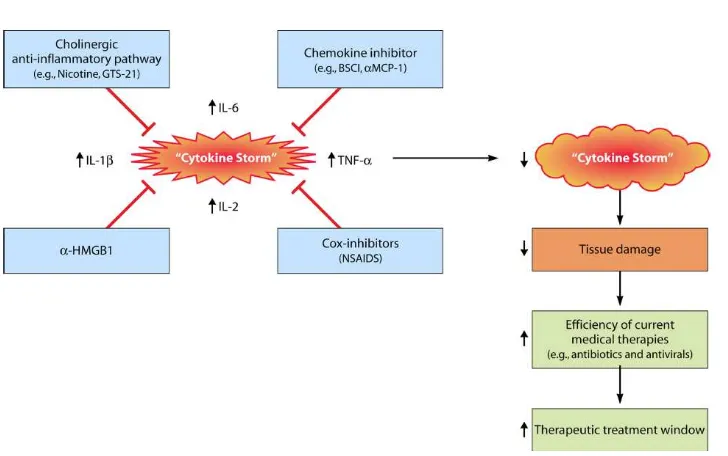
menggunakan zat yang bekerja pada jalur immune fundamental misalnya jaringan chemokine dan pada jalur anti inflamasi kolinergik, dan strategi lebih spesifik termasuk dengan menggunakan antibodi HMGB1 da inhibitor COX-2. Semua strategi ini akan meredakan “cytokine storm” dan mengurangi risiko kerusakan jaringan dan memberikan waktu bagi terapi konvensional untuk bekerja secara langsung terhadap bakteri patogen (D’Elia, Harrison, Oyston, Lukaszewski, Clark, 2013).
2.3.1. Tumor Necrosis Factor
Tumor Necrosis Factor pada awalnya ditemukan pada tumor
tertentu yang mengalami perdarahan yang ternyata disebabkan adanya nekrosis jaringan. Tumor necrosis factor terutama dihasilkan oleh sel makrofag dan sel jenis lain dengan berbagai aktifitas biologik pada sel-sel sasaran yang termasuk sistem imun maupun bukan. Sejumlah sel-sel baru dapat menghasilkan TNF setelah mendapatkan rangsangan yang cocok, misalnya dari limfosit dan sel NK (Subowo, 2009).
Tumor Necrosis Factor merupakan mediator utama pada respon
inflamasi akut terhadap infeksi bakteri gram negatif dan mikroba lainnya, dan bertanggung jawab atas terjadinya beberapa komplikasi sistemik pada infeksi berat. Stimulus terkuat terhadap produksi TNF oleh makrofag adalah berikatannya TLR dengan LPS dan produk mikroba lainnya. Produksi IFN-γ oleh limfosit T dan sel NK akan meningkatkan produksi TNF oleh makrofag yang distimulasi oleh LPS. Fungsi fisiologis utama dari TNF adalah menstimulasi rekrutmen netrofil dan monosit ke lokasi infeksi dan mengaktifkan sel-sel ini untuk menghilangkan mikroba (Abbas, Lichtman, Pillai, 2007).
Tumor Necrosis Factor memiliki jejaring pengawasan induksi dan
efek. Misalnya IL-1 menginduksi produksi TNF dan sebaliknya TNF menginduksi produksi IL-1 oleh sel makrofag, produksi IFN-β1 , dan IFN-β2 oleh fibroblast dan produksi GM-CSF oleh beberapa jenis sel. Tumor
Necrosis Factor-α dihasilkan oleh sel limfosit TН1, sebagian oleh limfosit
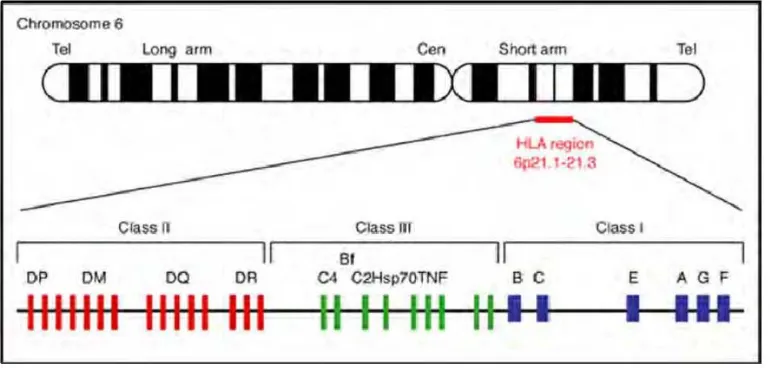
Gena untuk TNF terdapat pada bagian lengan pendek kromosom 6 yang diduga di dekat atau di dalam kompleks MHC. Molekul TNF manusia memiliki homologi sebesar 80% dengan TNF mencit atau kelinci dan 28% dengan limfotoksin. Limfotoksin yang mempunyai mekanisme kerja dan reseptor yang sama dengan TNF disebut sebagai TNF-β (Subowo, 2009). Terdapat 2 jenis reseptor TNF yaitu reseptor TNF tipe I (TNF-RI, 55 kD) dan tipe II (TNF-RII, 75 kD) (Abbas, Lichtman, Pillai, 2007).
Tumor Necrosis Factor memiliki berbagai efek dengan manifestasi
setempat diramalkan berdasarkan pengamatan dalam percobaan in vitro. Misalnya sel netrofil yang bereaksi dengan TNF meningkat pengikatannnya dengan sel endotel, letupan respiratori dan degranulasinya. Pola kerusakan jaringan radang mirip dengan kerusakan oleh IL-1. Demikian pula kemampuan TNF dalam menginduksi proliferasi fibroblas mirip IL-1, sehingga TNF dianggap penting dalam proses penyembuhan luka ; 3. Efek hematopoetik. Efek TNF terhadap aktifitas hematopoetik terlihat dalam bentuk hambatan pembentukan koloni biakan granulosit-monosit, eritroid dan koloni sel multi-potensial pada jaringan sumsum tulang manusia. Tetapi sebaliknya pada mencit, TNF meningkatkan sel-sel progenitor dalam jaringan sumsum tulang pada percobaan in vitro ; 4. Efek imunologik. Walaupun TNF dalam beberapa aktifitas biologik mirip IL-1, namun ada beberapa perbedaan dalam mekanisme pengaturan imun. Secara umum nampak perbedaan bahwa TNF tidak banyak terlibat dalam pengaturan tersebut. Tumor Necrosis Factor mempunyai aktifitas perangsangan yang multipel terhadap limfosit
T teraktifasi, misalnya respon proliferatif limfosit T terhadap antigen, peningkatan reseptor untuk IL-2 dan induksi produksi IFN-γ. Demikian juga imunitas spesifik terhadap tumor ditingkatkan oleh TNF. Tumor Necrosis Factor dapat meningkatkan ekspresi antigen MHC kelas I pada
Bila stimulus cukup kuat, TNF akan diproduksi dalam jumlah besar sehingga memasuki aliran darah dan bekerja di tempat yang jauh sebagai hormon endokrin. Salah satu aktifitas sistemik utama dari TNF adalah menginduksi hipotalamus dan menyebabkan terjadinya demam, sehingga disebut sebagai pirogen endogen untuk membedakannya dari LPS yang berfungsi sebagai pirogen eksogen yang berasal dari mikroba. Terjadinya demam sebagai respon terhadap TNF (dan IL-1) dimediasi oleh meningkatnya sintesa prostaglandin oleh sel-sel hipotalamus (proses ini distimulasi oleh sitokin). Inhibitor sintesa prostaglandin, misalnya apirin, dapat menghambat terjadinya demam dengan jalan menghambat aktifitas TNF dan IL-1 ini (Abbas, Lichtman, Pillai, 2007).
Gen TNF-α mengatur kode protein yang terdiri atas 233 asam amino dengan berat molekul 25,6 kDa. Pada awalnya, TNF-α merupakan suatu protein transmembran yang terdiri atas 212 yang terasosiasi dengan homotrimer : bagian terminal N kehilangan 76 asam amino akibat
pembelahan oleh TNF-α converting enzyme, menghasilkan satu bentuk monomer TNF-α yang dapat larut (17 kD) dan selanjutnya bentuk trimetrik (51 kD). Bentuk trimerik merupakan bentuk dapat larut yang aktif secara biologik karena kemampuannya untuk berikatan dengan reseptornya. Bentuk trimerik ini secara spontan cenderung segera terdisosiasi menjadi bentuk monomerik yang inaktf. Hal ini merupakan proses fisiologis yang memungkinkan untuk membatasi efek merugikan apabila terjadi peningkatan konsentrasi TNF-α yang berlebihan. Respon TNF-α terhadap berbagai sinyal ekstraseluler terjadi dengan sangat cepat dan transien, meliputi komponen transkripsional dan komponen posttranskripsional. Kontrol proses transkripsionalnya terjadi terutama pada tahap inisiasi transkripsional (Cereda, Gagliardi, Cova, Diamanti, Ceroni, 2012).
dengan alella 308A and -863C lebih rentan menderita infeksi yang lebih berat (Kumar, Kumar, Kaur, 2012). TNF-α merupakan mediator neuroinflamasi dan mungkin berperan menimbulkan disfungsi neuronal. Neuroinflamasi kronis berperan dalam beberapa gangguan neurologis yang menimbulkan penurunan fungsi kognitif. Penelitian terhadap analog thalidomide, 3,6’-dithiothalidomide (DT), yang memiliki efek menekan aktifitas TNF-α menunjukkan bahwa DT dapat membalikkan proses penurunan fungsi kognitif yang terjadi akibat gangguan hipokampus akibat induksi neuroinflamasi kronis. Hasil ini menunjukkan bahwa TNF-α merupakan mediator penting dalam proses neuroinflamasi kronis dan gangguan fungsi kognitif dan regulasi terhadap produksinya dapat berperan dalam penatalaksanaan beberapa penyakit neurodegeneratif pada manusia (Belarbi, Jopson, Tweedie, Arellano, Luo, Greig, et.al. 2012). Penelitian pada penderita Cerebral Palsy tipe spastik dan diskinetik menunjukkan adanya peningkatan kadar dopamin, homovanilic acid (HVA), IL-1β dan TNF-α dalam serum (Hadiwidjaja, 2005). Kadar 6, IL-8, TNF-α dan CRP juga meningkat pada penderita penyakit Behcet yang aktif (Karadag, Kozac, Totan, 2010). Tanure dan kawan-kawan membandingkan kadar TNF-α, reseptor 1 TNF-α yang dapat larut (sTNFR1), reseptor 2 TNF-α yang dapat larut (sTNFR2), dan BDNF selama serangan migren dan masa bebas nyeri kepala. Ternyata tidak dijumpai perbedaan yang bermakna pada kadar TNF-α, sTNFR1 dan
Sitokin proinflamasi TNF-α berkontribusi terhadap kematian sel pada penyakit yang mengenai SSP dengan jalan mempengaruhi neurotransmisi sinaptik. Efek eksitotoksik ini terjadi dengan jalan meningkatkan kadar GluA2-lacking AMPA receptor (AMPAR) yang masuk ke membran plasma neuron. In vitro, meningkatnya kadar AMPAR pada permukaan neuron setelah terekspos dengan TNF-α dihubungkan dengan internalisasi yang cepat dari GABAA receptors (GABAAR). Respon SSP
terhadap TNF-α terjadi dengan pengaturan waktu yang kompleks serta bersifat dose dependent. Sedangkan secara in vivo, efek ini belum jelas dipahami. Stuck et.al meneliti efek injeksi TNF-α terhadap perubahan GABAAR pada tikus dan menyimpulkan bahwa TNF-α menginduksi masuknya GABAAR ke dalam sinaps secara dose-dependent dalam waktu 60 menit (Stuck, Christensen, Huie, Tovar, Miller, Nout, et.al, 2011).
korelasi positif kuat antara kadar TNF-α zalir peritoneal dengan kadar TNF-α serum pada penderita endometriosis (Oepomo, 2006). Kadar TNF-α juga telah diteliti pada anak penderita demam berdarah dengue dan
disimpulkan bahwa kadar TNF-α serum awal meningkat secara bermakna lebih tinggi pada kelompok DBD yang mengalami syok dan TNF- α serum awal > 24 pg/ml adalah nilai optimal untuk menentukan terjadinya syok atau tidak penderita DBD pada anak (Ganda, 2010). Kapadia dkk meneliti kadar serum TNF-α dan kadar reseptor TNF 1 dan 2 pada penderita stenosis aorta dan regurgitasi mitral New York Heart Association (NYHA) kelas I atau II dan tanpa penyakit arteri koronaria yang bermakna. Hasilnya menunjukkan peningkatan kadar serum TNF-α pada penderita dengan chronic hemodynamic overloading dan payah jantung dini. Peningkatan kadar reseptor TNF 1 dan 2 juga memiliki hubungan langsung dengan perburukan kelas NYHA (Kapadia, Yakoob, Nader, Thomas, Mann, Griffin, 2000). Furoxan-aspirin (B8), suatu novel NO-aspirin hybrids, secara signifikan menurunkan pelepasan TNF-α dari monosit dan makrofag, dan mungkin bekerja dengan menginhibisi aktifasi NF-kB (Turnbull, Marcarinoo, Sheldrake, Lazzarato, Cena, Fruttero, et.al., 2008).
obesitas dan adiponektin memiliki korelasi negatif dengan TNF-α ( Lina , Pattelongi, Lawrence, Wijaya, As’ad, et.al, 2011). Penelitian pada hewan menunjukkan bahwa setelah pemberian injeksi Growth Hormone (GH) terjadi penurunan kadar TNF-α dan menyimpulkan bahwa terapi GH menurunkan kadar TNF-α plasma pada tikus jantan dislipidemia (Misitahari, 2011).
2.3.2. Interleukin
Berdasarkan jenis sel penghasilnya, sitokin dibedakan atas : 1. Monokin, yaitu sitokin yang dihasilkan terutama oleh monosit dan turunannya, dan 2. Limfokin, yaitu sitokin yang dihasilkan terutama oleh limfosit. Karena banyak sitokin yang dihasilkan oleh lekosit dan bekerja pada lekosit lainnya, mereka disebut interleukin. Istilah ini sebenarnya kurang tepat karena banyak sitokin yang hanya dihasilkan oleh lekosit dan juga hanya bekerja pada lekosit tidak disebut interleukin, sebaliknya banyak sitokin yang disebut interleukin dihasilkan dan bekerja pada sel-sel yang bukan lekosit (Abbas, Lichtman, Pillai, 2007).
2.3.2.1. Interleukin-1 (IL-1).
telah membawa kemajuan penting dalam pemahaman peran IL-1 secara biologik dan patogenesis penyakit (Contassot, Beer, French, 2012).
Interleukin-1 adalah salah satu monokin. Sumber utama IL-1 adalah monosit dan makrofag. Sel-sel jenis lain seperti keratosit (sel epidermis), sel LGL (NK cells), sel dendritik, astrosit, mikroglia, limfosit B dan fibroblast dapat menghasilkan IL-1, walaupun sedikit, setelah mendapatkan rangsangan oleh sejumlah zat tertentu Sifat perangsangan yang terjadi menentukan apakah IL-1 dilepaskan atau tetap berada dalam sel (Subowo, 2009). Interleukin 1 terbagi atas dua protein, yaitu IL-1α dan IL-1β, yang terdiri dari dua gen yang berbeda, tetapi mengenali permukaan reseptor yang sama. Terkecuali pada keratinosit pada kulit, beberapa sel epitel, dan beberapa sel dari sistem saraf pusat, IL-1 tidak diproduksi oleh sel pada orang yang sehat. Namun, sebagai respon terhadap adanya infeksi, akan terjadi peningkatan kadar IL-1 yang diproduksi oleh makrofag dan beberapa sel lainnya (Subowo, 2009).
terdiri dari campuran prekursor maupun bentuk mature dari IL-1β. IL-1α dan IL-1β memiliki efek bila berikatan dengan reseptor khusus. Terdapat dua jenis reseptor yang berbeda. Yang pertama yaitu IL-1 reseptor tipe I (IL-1 RI), yang ada pada sel T, fibroblas, keratinosit, sel endotel, sel yang melapisi sinovial, kondrosit, dan hepatosit. Kedua adalah IL-1 reseptor tipe II (IL-1 RII), yang terdapat pada sel B, neutrofil, dan sel sumsum tulang. Reseptor ini memiliki berat molekul 68 kDa dan merupakan bagian dari imunoglobulin (Ig). Secara umum, IL-1α berikatan lebih baik pada reseptor tipe I dan IL-1β berikatan lebih baik pada reseptor tipe II (Subowo, 2009).
dan sel LAK. Kerjanya pada makrofag/monosit, akan meningkatkan sintesa dan produksi TNF dan IL-6. Interleukin-1 juga meningkatkan produksi GM-CSF dan IL-4, yang mana hal ini akan meningkatkan proliferasi sel B dan sintesa imunoglobulin. Interleukin-1, sama seperti sitokin lainnya, memiliki peranan penting dalam aktifasi sel NK dan produksi LAK, sehingga memiliki efek sebagai tumorisidal. Walaupun produksi IL-1 yang normal penting dalam respon terhadap luka dan infeksi, produksi IL-1 yang berkepanjangan dapat menimbulkan penyakit seperti rematoid arthritis, sepsis, inflammatory bowel disease, leukemia mielogenous akut dan kronik, diabetes melitus bergantung insulin, dan aterosklerosis (Subowo, 2009).
Fungsi utama IL-1, mirip dengan TNF, adalah sebagai mediator respon inflamasi terhadap infeksi dan stimulus lainnya. Interleukin-1 bekerja bersama-sama dengan TNF sebagai innate immunity and inflammation. Sumber utama IL-1, seperti juga TNF, adalah sel-sel fagosit
mononuklear yang teraktifasi. Produksi IL-1 oleh makrofag diinduksi oleh produk bakteri seperti LPS dan oleh sitokin lainnya misalnya TNF. Tidak seperti TNF, IL-1 juga diproduksi oleh sel-sel lain selain makrofag, misalnya netrofil, sel epitel (seperti keratinosit), dan sel endotel (Abbas, Lichtman, Pillai, 2007).
yang mencakup percepatan pertumbuhan sel sasaran (limfosit), menginduksi ekspresi molekul pada permukaan sel (ICAM-1 pada sel endotel), dan pelepasan mediator sekunder seperti prostaglandin dari sel makrofag dan sitokin lain (IL-2) oleh limfosit T, TNF-α, dan GM-CSF dari sel-sel makrofag dan IL-6 dari fibroblast (Subowo, 2009).
Sel sasaran yang menerima induksi dari IL-1 akan merespon dalam bentuk yang berbeda-beda, misalnya sel-sel imunokompeten akan meningkatkan proliferasinya, sedang sel-sel yang terlibat dalam proses radang responnya tergantung pada jenis selnya. Sebagai contoh fibroblast akan berproliferasi di samping sel tersebut akan memproduksi PGE2 dalam SSP yang memberikan efek demam dan anoreksi, dan pada jaringan tulang dan kartilago akan menyebabkan resorbsi (Subowo, 2009).
maupun dalam bentuk produk mature yang lebih kecil (Abbas, Lichtman ,Pillai, 2007).
Interleukin-1 dianggap sebagai mediator yang sangat penting dalam proses radang. Dalam pengamatan gejala radang secara in vivo terungkap bahwa timbulnya demam merupakan efek neuroendokrin IL-1 karena terangsangnya pusat regulasi panas pada hipotalamus. Telah lama diketahui bahwa mediator yang dihasilkan oleh lekosit yang semula dinamakan pirogen endogen bertanggung jawab dalam induksi produksi PG oleh sel-sel yang terdapat di sekitar pusat regulasi panas di hipotalamus. Efek neuroendokrin lain berlangsung karena produksi cortico releasing factor yang pada gilirannya akan merangsang produksi hormon
ACTH dari hipofise yang akan menginduksi produksi hormon kortikosteroid dari kelenjar adrenal. Hormon kortikosteroid mendorong pelepasan sel-sel netrofil dari sumsum tulang ke dalam peredaran darah yang dibarengi dengan peningkatan hematopoesis menyebabkan perubahan susunan komponen sel darah (Subowo, 2009).
MHC kelas II, IL-1 tidak dapat berfungsi sendiri dalam membangkitkan respon imun melalui aktifasi limfosit T (Subowo, 2009).
Di samping sebagai mediator yang penting dalam proses peradangan IL-1 juga merupakan mediator yang berperan dalam aktifitas imunologik. Pengaruh IL-1 dalam imunitas ini terutama melalui dorongannya terhadap diferensiasi limfosit T yang dapat dipantau melalui perubahan-perubahan marka pada membrannya; dengan demikian IL-1 meningkatkan fungsi limfosit T dan produksi limfokin seperti IL-2, CSF, BCGF (IL-4 dan IL-5), IFN-γ, dan LDCF (Subowo, 2009).
Pada percobaan in vitro, IL-1 memperkuat proliferasi, diferensiasi dan fungsi produksi antibodi oleh limfosit B. Pengaruh IL-1 terhadap limfosit B dapat secara tidak langsung melalui limfosit TН
Efek biologis IL-1 mirip dengan TNF dan tergantung pada jumlah sitokin yang diproduksi. Jika diproduksi dalam konsentrasi rendah, IL-1 berfungsi sebagai mediator inflamasi lokal. Ia akan bekerja pada sel endotel untuk meningkatkan ekspresi molekul permukaan yang memediasi adhesi lekosit seperti ligands terhadap intergrin. Jika diproduksi dalam jumlah lebih besar, IL-1 akan memasuki aliran darah dan menghasilkan efek endokrin. Efek sistemik IL-1 akan menginduksi demam, sintesa plasma protein fase akut oleh hati, dan secara langsung
maupun tidak langsung menstimulasi produksi IL-6, dan produksi netrofil dan platelet oleh sumsum tulang (Abbas, Lichtman, Pillai, 2007).
Banyaknya persamaan aktifitas antara IL-1 dan TNF cukup mengejutkan karena kedua sitokin ini berbeda secara struktural dan memiliki resptor yang berbeda pula. Begitupun, terdapat beberapa perbedaan antara keduanya. Misalnya, IL-1 tidak menginduksi apoptosis dari sel-sel, dan bahkan pada konsentrasi sistemik, IL-1 tidak menyebabkan perubahan patofisiologis pada syok septik (Abbas, Lichtman, Pillai, 2007).
Vedova dan kawan-kawan di Adelaide, Australia menemukan peningkatan kadar serum IL-1β pada penderita CTTH bila dibandingkan dengan kontrol, sedangkan kadar serum IL-18 juga ditemukan meningkat secara signifikan pada pria penderita CTTH. Karena kadar kedua sitokin ini meningkat tanpa adanya infeksi maupun cedera, mereka menduga adanya peran faktor genetik yang bertanggung jawab atas fluktuasi kadar keduanya (Vedova, Cathcart, Dohnalek, Lee, Hutchinson, Immink, et.al., 2013).
Pada Demensia Alzheimer, IL-1 di samping punya peran yang menguntungkan berupa mengakibatkan terjadinya degradasi plak dan rekrutmen fagosit, IL-6 juga memiliki peran yang merugikan berupa sintesis Aβ, fosforilasi protein tau dan neurotoksisitas (Shaftel, Griffin,
O’Banion, 2008). Pada tikus, IL-6 menstimulasi sel ganglion trigeminal primer untuk mensintesa COX-2 dan PGE2 yang akhirnya akan menyebabkan pelepasan CGRP. Pelepasan CGRP ini dimediasi oleh jalur independen oleh COX-2 dan jalur independen melalui aktifasi reseptor 5-HT1B/D (Neeb, Hellen, Boehnke, Hoffmann, Schuh-Hofer, Dimagi, et.al., 2011). Penelitian lain membuktikan bahwa IL-1 13 dan IL-6 menyebabkan sensitisasi nosiseptor trigeminal dan memainkan peranan penting dalam patogenesis migren dengan jalan menurunkan ambang rangsang terhadap stimulus inflamasi lainnya. Berdasarkan hasil penelitian ini, diduga peningkatan kadar IL-1 13 dan IL-6 akan memfasilitasi peningkatan ekspresi protein yang menghasilkan sinyal di dalam sel saraf dan sel glia di dalam ganglion dan Trigeminal Nucleus Caudal, yang akhirnya akan berkontribusi terhadap sensitisasi perifer
2.3.2.2. Interleukin-6 (IL-6).
Interleukin-6 juga telah dihubungkan dengan agregasi amiloid beta dan terjadinya hiperfosforilasi protein tau pada penyakit Alzhemer. Polimorfisme IL-6 berhubungan dengan menurunnya risiko late-onset Alzheimer disease, khususnya pada yang bukan carrier ApoEε4 (Chen dan Smith, 2012). Pada penderita migren telah diketahui bahwa kadar IL-6 meningkat pada saat serangan. Penelitian Yan et.al. menunjukkan bahwa IL-6 memperkuat eksitabilitas saraf afferen duramater sehingga terjadi sensitisasi yang berkontribusi terhadap patogenese nyeri kepala migren (Yan, Melemedjian, Price, Dusson, 2012). Interleukin-6 juga dihubungkan dengan penyakit aterosklerosis dan juga merupakan mediator kunci pada respon inflamasi pada iskemi serebral. Review oleh Tso dan kawan-kawan terhadap 12 publikasi mengenai hubungan IL-6 dan stroke menyimpulkan adanya hasil yang tidak konsisten, diduga akibat kompleksnya fisiologi IL-6 dan beragamnya subtipe stroke (Tso, Merino, Warach, 2007). Kadar serum IL-6 saat masuk rumah sakit juga berhubungan dengan perburukan klinis secara dini pada penderita stroke iskemik tanpa tergantung pada ukuran infark, topografi dan mekanisme terjadinya infark (Vila, Castillo, Da’valos, Chamorro, 2000).
Interleukin-6 juga berperan penting dalam reaktifasi virus sitomegalo pada manusia melalui extracellular signal-regulated kinase-mitogen-activated protein kinase (ERKMAPK). Pada penelitian ex vivo
menunjukkan peningkatan produksi IL-6 oleh sel glia yang terinfeksi virus ensefalomieitis murine. Interleukin-6 mRNA dari sel glia yang terinfeksi meningkatkan hibridisasi terhadap urutan pengkodean IL-6 yang terletak pada kromosom 5 (Rubio, Cerciat, Unkila, Garcia-Segula, Arevalo, 2011). Interleukin-6 juga dilaporkan diduga berperan pada penyakit autoinflamasi. Penyakit ini jarang ditemukan dan ditandai dengan dengan karakteristik berupa terjadinya inflamasi tanpa penyebab yang jelas dan tanpa titer autoantibodi atauu antigen spesifik sel T yang tinggi. Diduga hipersekresi IL-6 di dalam SSP berperan dalam proses patogenesisnya (Salsano, Rizzo, Bedini, Bernard, Dall’Olio, Volorio, et.al., 2013).
(Ridker, Rifai, Stampfer, Hennekens, 2000). Kadar IL-6 dan IL-2 juga ditemukan meningkat secara bermakna pada penderita burning mouth syndrome dibandingkan dengan kontrol dan berkorelasi dengan
keparahan penyakit tersebut (Simˇci´c, Pezelj-Ribari’c, Gr’zi’c, Horvat, Brumini, Muhvi’c-Urek, et.al., 2006). Pada penderita penyakit arteri perifer, kadar IL-6 yang tinggi secara persisten dihubungkan dengan penurunan fungsional yang lebih cepat bila dibandingkan dengan penderita yang kadar IL-6 nya rendah atau fluktuatif (McDermott et.al., 2011) Kadar IL-6 juga ditemukan lebih tinggi pada serum penderita psoriasis aktif dibanding kontrol (Arican, Aral, Sasmaz, Ciragil, 2005).
Interleukin-6 rekombinan manusia telah diketahui dapat meningkatkan jumlah trombosit pada tikus, anjing dan primata normal. Pemberian IL-6 pada penderita kanker ovarium yang menjalani kemoterapi dapat ditoleransi dengan baik dan mempercepat pemulihan jumlah trombosit (D’Hondt, Humblet, Guillaume, Baatout, Chatelain, Berleire, et.al., 1995). Tocilizumab (TCZ) merupakan antibodi monoklonal yang bekerja secara langsung terhadap reseptor IL-6 baik yang dalam bentuk terlarut maupun yang terikat pada membran. Di Jepang obat ini sudah digunakan pada penyakit Castleman, artritis rematoid dan artritis juvenil idiopatik (Alonso dan Bilbao, 2009). Selain perannya pada berbagai proses inflamasi, IL-6 juga berperan pada penyakit neoplastik. Neumann et.al. meneliti kadar serum IL-6 pada anjing dengan berbagai penyakit hati
membedakan tumor hati primer atau sekunder (Neumann, Kaup, Scheulen, 2012).
2.4. Sitokin dan Otak
Penelitian terhadap sitokin dilakukan oleh berbagai disiplin ilmu termasuk penelitian yang mencari hubungan antara sitokin dengan SSP. Dari penelitian-penelitian tersebut muncul 2 pertanyaan mendasar yaitu : 1. Bagaimana sitokin memodulasi fungsi SSP ? ; dan 2. Apakah peranan sitokin pada patogenesis penyakit-penyakit sistem saraf ? . Penelitian menunjukkan bahwa sitokin dapat mempengaruhi fungsi SSP misalnya mempengaruhi fungsi saraf otonom yang dikontrol SSP, neuroendokrin dan respons tingkah laku (Quan dan Herkerham, 2002). Dua sitokin proinflamasi, TNF-α dan IL-1 berperan memodulasi perilaku otak organisme normal. Kedua sitokin ini juga terlibat dalam plastisitas sinaptik, transmisi neural dan Ca21 signaling (Vitkovic, Bockaert, Jacque, 2000).
Telah diketahui bahwa sitokin dapat mempengaruhi fungsi saraf pusat dengan berbagai cara dan ekspresi sitokin juga ditemukan pada kasus-kasus infeksi dan cedera otak. Juga ditemukan beberapa bukti keterlibatan sitokin dalam induksi dan modulasi penyakit neurologis mulai Alzheimer disease hingga chronic fatique syndrome (Quan dan Herkerham, 2002).
semuanya diatur oleh SSP. Sehingga disimpulkan sitokin yang diinduksi selama respon imun akan memodulasi fungsi SSP untuk memperoleh mekanisme fisiologis, behavior dan endokrin untuk melawan infeksi. Injeksi berbagai sitokin secara sistemik atau langsung ke dalam ventrikel serebral akan mengaktifasi hipotalamus-pituitary adrenal (HPA) aksis, menimbulkan demam dan prolonged slow wave sleep, berkurangnya intake makanan/minuman, dan penurunan motilititas. Sitokin yang paling sering diuji disini adalah IL-1 (Quan dan Herkerham, 2002).
area tersebut ; 2. Sitokin akan menimbulkan reaksi berantai untuk mencapai sirkuit neural yang lebih jauh (Quan dan Herkerham, 2002).
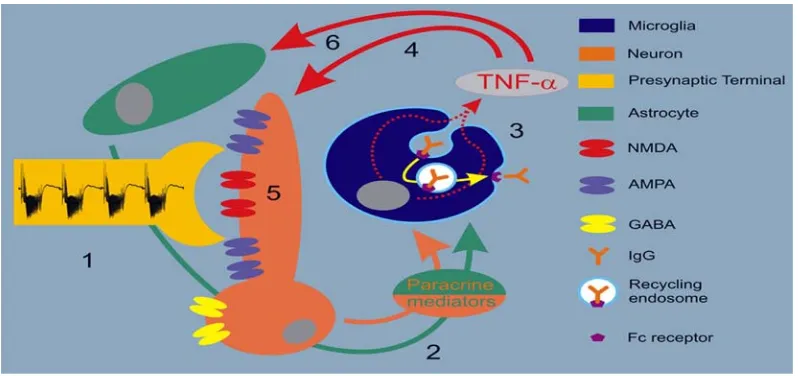
Peran TNF-α pada aktifitas neuroproteksi dapat dilihat pada gambar 8. Secara skematis prosesnya meliputi : 1. Penguatan aktifitas neuron secara fisiologis ; 2. Proses nutritif yang dimulai dengan pelepasan mediator parakrin neuronal termasuk fosfat berenergi tinggi, glutamat, potassium dan khususnya prostaglandin, yang dapat memperkuat ; 3. Endositosis yang dihubungkan dengan produksi TNF-α oleh mikroglia. Astrosit juga berperan dalam proses pelepasan mediator parakrin yang mengaktifasi mikroglia ini ; 4. TNF-α yang dilepaskan mikroglia selanjutnya memicu peningkatan aktifitas neuronal dengan jalan ; 5. Meningkatkan ekspresi reseptor NMDA dan AMPA serta menurunnya ekspresi reseptor GABA dan ; 6. Pada saat yang sama, TNF-α dari mikroglia juga mempengaruhi astrosit (Kraig, Mitchell, Christie-Pope, Kunkler, White, Tang et.al., 2010).
Gambar 8 . Schematic of neuro-immune initiating signaling of activity- dependent neuroprotection
Dari berbagai penelitian disimpulkan bahwa sel-sel non-neuronal adalah sumber sitokin utama di otak. Namun ada kesimpulan yang berbeda dimana setelah penyuntikan sistem imun perifer maka sel endotelial pada sawar darah otak akan mengaktifasi siklooksigenase 2 (COX-2). Sehingga disimpulkan efek sitokin pada SSP bisa dihambat dengan pemberian COX-2 inhibitor. Interleukin-1 dapat menghambat potensiasi jangka panjang pada neuron di amigdala, dan hipokampus. Sehingga diperkirakan aktifitas sitokin ini akan mempengaruhi fungsi belajar, memori dan emosi (Quan dan Herkerham, 2002).
(IL-1+). Interleukin-1+ ini akan mengatur regulasi protein precursor B-amiloid (BAPP) dan BAPP ini menstimulasi pembentukan IL-1 ( siklus sitokin) yang selanjutnya menjadi kekuatan pengendali patogenesis Demensia Alzheimer (DA). Dari sini berkembanglah pengetahuan bahwa obat anti inflamasi penghambat IL-1 bermanfaat dalam penanganan DA. Peranan TNF-α pada DA juga ada namun tidak sejelas IL-1. Pada wanita muda, kejadian yang tidak nyaman pada masa kanak-kanak dihubungkan dengan migren, khususnya migren kronik dan migren transformasi, dan biomarker vaskuler khususnya biomarker inflamasi termasuk TNF-α dan IL-6 (Tietjen,Khubchandani, Herial, Shah, 2012).
Berbagai macam penelitian in vitro untuk meneliti efek neurotoksisitas IL-1 atau TNF-α pada sel neuron SSP sudah dilakukan dan kesimpulan yang dihasilkan masih sangat ambigu. Untuk sel glia sendiri ternyata yang memiliki efek toksik adalah TNF-α. Tumor Necrosis Factor-α ini toksik terhadap oligodendrosit sehingga timbul kerusakan myelin (kontribusi pada SM dan experimental alleric encephalomyelitis (EAE). Sel glia yang telah teraktifasi akan membentuk zat-zat neurotoksik
(asam quinolic, reactive oxygen intermediates, reactive nitrogen intermediates, glutamate) (Quan dan Herkerham, 2002).
Semakin lama paparannya, maka efeknya akan semakin neurotoksik ; dan 3. Site of action. Interleukin-1 pada striatum dapat merusak neuron kortikostriatal, namun tidak merusak neuron di korteks. Namun penelitian tentang daerah otak yang mana atau jenis sel yang mana yang rentan terhadap sitokin ini masih sangat sedikit (Quan dan Herkerham, 2002).
Pada suatu penelitian dimana Trypanosoma pallidum dimasukkan ke dalam tubuh tikus, parasit ini berdiam di pleksus koroideus dan organ sirkumventrikular di otak. Mereka akan menstimulasi sekresi IL-1 dan TNF-α pada sistem imun perifer. Setelah beberapa lama terjadi apoptosis sel-sel non neuronal di sekitar ventrikel, degenerasi saraf vagus bilateral, traktus olfaktori lateral dan hipokampus bagian rostral dan beberapa daerah lainnya. Efek neurotoksik inii berkaitan dengan paparan kronis antara IL-1 dan TNF-α dengan area otak tersebut. Aktifitas molekul ini bisa mencapai seluruh daerah di otak, umumnya simetris, melalui ruang ekstraselular. Penemuan ini menyimpulkan bahwa : 1. Area otak tertentu lebih rentan terhadap efek neurotoksik sitokin ; 2. Efek neurotoksik tidak hanya mengenai sel neuronal saja namun juga sel non neuronal ; dan 3. Injury pada sel non neuronal bersifat apoptosis, sedangkan pada sel
neuronal bersifat nekrotik (Quan dan Herkerham, 2002).
Walaupun beberapa penelitian melaporkan bahwa mindfulness training dapat mengurangi gejala pada beberapa keadaan nyeri kronis,
2.5 . Sitokin dan Sawar Darah-Otak
Sawar darah-otak (SDO) merupakan pemisah SSP dengan sirkulasi sistemik, oleh karenanya SDO berperan mengontrol microenvirontment dan homeostasis SSP dengan mekanisme kerja yang
mampu untuk memfasilitasi asupan nutrisi, meregulasi keseimbangan ion, dan menjadi barrier yang melindungi dari xenobiotic toksin potensial yang dapat dijumpai di sirkulasi sistemik (Ronaldson dan Davis, 2011).
Sawar darah otak seharusnya menghalangi sitokin berinteraksi dengan SSP. Ada 5 jalur sitokin melewati sawar darah otak, yaitu : 1. Sitokin mengalami transport aktif melewati sawar darah otak ; 2. Sitokin mengaktifkan nervus vagus perifer yang kemudian mengaktifkan target di otak ; 3. Sitokin “bocor” melewati SDO pada organ sirkumventrikular (Circumventricular organs/CVOs) dan mengaktifkan target SSP di daerah ini ; 4. Sitokin menginduksi sel-sel sawar darah otak untuk memproduksi sitokin yang kemudian disekresikan ke parenkim otak ; dan 5. Sitokin dibawa oleh leukosit yang berinfiltrasi melewati sawar darah otak (Quan dan Herkerham, 2002).
Beberapa mekanisme berkaitan dengan sitokin dan SDO : 1. Pengenalan SDO terhadap sitokin dan peptida lainnya yang berhubungan. Sawar darah-otak terdiri dari 3 dimensi, yang terletak diantara otak dan pembuluh darah yang membawa material untuk pertukaran informasi selektif. Sawar darah-otak merupakan tempat regulator dalam respon terhadap sitokin. Sawar darah-otak secara selektif dapat mentranspor beberapa sitokin, berupa IL-1α, IL-1β, IL-1 reseptor antagonis (1ra), IL-6, TNF, leukemia inhibitory factor (LIF), ciliary neurotrophic factor dan berbagai adipokines. Sitokin memainkan peranan penting dalam respon fisiologi terhadap inflamasi dan neuroregenerasi. Fungsi lainnya, SDO dapat membatasi berbagai sitokin yang akan melewati SDO. Transfoming Growth Factor (TGF-α) tertahan di vaskular serebral dan TGF-β tidak bisa memasuki otak, dan sebaliknya Epidermal Growth Factor (EGF) dapat melewati SDO secara cepat. Dalam neuroinflamasi, chemokine CXCL 12, yang terletak di permukaan basolateral SDO, berfungsi dalam mencegah ekstravasasi leukosit ke dalam SSP. ; 2. Reseptor sitokin dan mikrodomain membran endotel. Reseptor sitokin terletak pada membran mikrodomain dan berikatan dengan endositosis dependent maupun yang independent. Endocytic microdomain terdiri dari protein pembungkus yang
dibentuk oleh substansi vasoaktif, termasuk endothelin-1, prostaglandin, leukotrien, dan platelet activating factor. Terdapat signal intraseluler yang berbeda terhadap sitokin yang berbeda. Sawar darah-otak menghasilkan chemokines dan sitokin sebagai respon terhadap cedera dan inflamasi. Bagaimana proses signaling dapat mempengaruhi transitosis ? Meskipun data yang didapatkan masih kurang, namun hal ini jelas bahwa signaling seluler oleh sebuah sitokin dapat memodifikasi sistem transpor antara yang satu dengan yang lainnya. Interaksi signal peptidergic pada SDO diilustrasikan dengan hubungan antara leptin dengan urocortin pada proses aktivasi STAT-1 dan STAT-3. Leptin dapat meningkatkan aktivasi STAT-1 dan STAT-3. Leptin juga mempunyai hubungan dengan α-MSH. α-MSH berikatan dengan reseptor melanocortin (MC-3R) dan MC-4R
Endotelium SDO kaya dengan efflux transporters yang bekerja sebagai barier transpor terhadap obat dan komponen endogen menuju parenkim otak. Pompa aktif efluks yang utama terdiri dari P Glycoprotein (P-gp, ABCB1), breast cancer resisten protein (BCRP, ABCG2) dan multidrug resistance yang berhubungan dengan berbagai protein (MRP, ABCC1-6) termasuk dalam transporter ABCfamily. Adanya transporter ini telah diimplikasikan terhadap obat-obatan seperti antikanker, antivirus, antibakterial, antiepilepsi dan analgesik. P-gp terdapat pada bagian luminal vaskular, astrocytic end feet bagian abluminal SDO, mikroglia dari parenkim otak dan endotel pleksus koroidalis. Pada saat terjadi inflamasi, berbagai sitokin seperti TNF, IL-1β dan IL-6 dapat mengubah aktifitas fungsional dan efflux transporters. Dapat disimpulkan bahwa sitokin dapat meningkatkan modulasi efflux drug transporters yang bersifat dose and time dependent.(Pan, Stone, Hsuchou, Manda, Zhang, Kasti, et.al., 2011).
Ada beberapa reseptor, kanal ion, influx/efflux protein transpor yang mencolok pada sel endotel otak yang secara fungsional sama dengan yang dijumpai pada jaringan lain namun dengan kapasitas dan kecepatan transpor yang berbeda seperti d-glucose transporter, l-amino acid carrier, Na+/K+ ATPase. Komponen yang kecil, nonionik dan bersifat lipid-soluble dapat masuk ke SSP dengan mekanisme difusi pasif yang
diatur oleh protein transpor endogen seperti ATP-binding cassette (ABC) transporter (berperan dalam translokasi opioid dan metabolitnya), solute
carrier (SLC) transporter yang terdapat di endotel SDO. Selain itu,
seperti organic ion transporting polypeptides (OATP), organic ion transporters, nucleoside transporters dan peptide transporters juga
berperan dalam memfasilitasi penyebaran obat menembus SDO (Ronaldson dan Davis, 2011).
Nyeri (sebagai respon inflamasi mengakibatkan perubahan permeabilitas SDO yang dapat mengubah komposisi protein di tight-junction) dapat meningkatkan permeabilitias paraselular dari SDO dan
berhubungan dengan delivery obat ke SSP. Terbukanya rute paraselular menyebabkan peningkatan uptake beberapa obat ke SSP, misalnya agonis reseptor μ opioid seperti kodein. Kemampuan obat untuk
menembus endotel SDO dan mencapai konsentrasi efektif dalam SSP tergantung pada banyak mekanisme transport, seperti uptake ke otak via influx transporter dan keluar dari otak melalui efflux transporter yang harus seimbang (Ronaldson dan Davis, 2011).
permeabilitias. TGF-ß/ALK5 dapat meregulasi permeabilitas SDO dengan mengubah struktur kompleks protein tight-junction SDO dan dengan meningkatkan ekspresi transporter influx. TGF-ß/ALK5 merupakan target farmakologis yang potensial yang dapat digunakan untuk mengoptimalkan delivery obat ke SSP (Ronaldson dan Davis, 2011).
2.6. Amitriptilin
Anti depresan merupakan obat yang paling sering digunakan pada TTH kronik. Amitriptilin terbukti lebih baik dari plasebo pada kebanyakan uji klinis walaupun uji klinis terbesar menunjukkan hasil sebaliknya.
(Ferna´ndez-de-las-Pen˜as dan Schoenen, 2009
;
Tfelt-Hansen, 2010).Amitriptilin juga merupakan obat pilihan pertama untuk terapi profilaksis TTH kronik walaupun efektifitasnya sering terbatas akibat efek sampingnya (Bendtsen, Evers, Linde, Mitsikostas, Sandrini, Schoenen, 2010). Boz dkk membandingkan efektifitas amitriptilin dengan sertraline (penghambat selektif reuptake serotonin) sebagai terapi profilaksis penderita TTH kronik tanpa depresi. Kedua obat ini terbukti efektif untuk terapi TTH kronik tanpa depresi, namun Amitriptilin lebih efektif bila dibandingkan dengan sertraline (Boz, Altunayoglu, Velioglu, Ozmenoglu, 2003).
berkurangnya pikiran morbid. Obat ini tidak menimbulkan euforia pada orang normal (Santoso dan Wiria, 1995).
Amitriptilin juga telah diketahui memiliki efek analgetik. Apakah efek analgesik berhubungan dengan aktifitasnya dalam memperbaiki mood atau oleh karena aksi farmakologis (atau keduanya) masih belum diketahui (Bryson dan Wilde, 1996). Data dari 41 penelitian menunjukkan antidepresan trisiklik merupakan analgesik yang efektif. Amitriptilin merupakan obat yang paling sering diteliti. Ditemukan bukti yang konsisten bahwa antidepresan trisiklik bersifat analgesik pada neuropati diabetik dan neuralgia post herpetik, dan menunjukkan efikasi pada nyeri sentral dan nyeri post-stroke. Kondisi lain dimana antidepresan trisiklik bermanfaat sebagai analgetik, meliputi nyeri kepala tipe tegang, migren dan nyeri oro-fasial kronik (Lynch, 2001).
Practice Group (EBPG) melalui Cochrane Database of Systematic
Reviews, Cochrane Library’s Health Technology, Assessment Database,
BIOSIS, Embase, dan Memline menunjukkan bukti bahwa antidepresan
trisiklik, termasuk Amitriptilin, bermanfaat pada penatalaksanaan nyeri kronik (Noertjojo, Martin, Dunn, 2010). Pada penderita nyeri lengan persisten akibat penggunaan lengan yang berlebihan, walaupun tidak mengurangi intensitas nyeri secara signifikan, Amitriptilin dosis rendah terbukti meningkatkan fungsi lengan dan memperbaiki keadaan umum secara signifikan (Goldman, Stason, Park, Kim, Mudgal, Davis, et.al., 2010). Amitriptilin dapat menginduksi atau bahkan dapat meningkatkan jumlah periodic limb movements (PLM) saat tidur pada orang sehat¸ sehingga harus mempertimbangkan adanya PLM saat menggunakannya untuk penderita gangguan tidur (Goerke, Rodenbeck, Cohrs, Kunz, 2013).
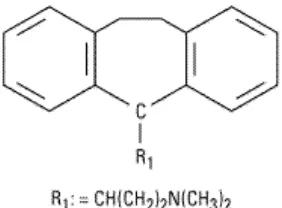
Gambar 9. Struktur Kimia Amitriptilin Dikutip dari : McEvoy (2004)
Amitriptilin bekerja terutama sebagai penghambat ambilan kembali serotonin (serotonin re-uptake inhibitor) dan norepinefrin dengan aksi yang kuat pada transporter serotonin dan efek yang moderat pada transporter norepinefrin. Selain itu, Amitriptilin berfungsi sebagai antagonis reseptor 5-HT2, 5-HT3, 5-HT6, 5-HT7, α1-adrenergik, H1, H2, H4, dan mAch, dan agonis reseptor α1. Amitriptilin juga menghambat kanal
natrium, kalium dan kalsium (Tatsumi, Groshan, Blakely, Richelson,1997; Punke dan Friederich, 2007).
Amitriptilin hidroklorida diabsorbsi cepat dari saluran cerna dan dari parenteral. Konsentrasi puncak plasma terjadi dalam 2-12 jam setelah pemberian oral atau intramuskular (pemberian parenteral tidak lagi tersedia di Amerika Serikat). Amitriptilin dan metabolit aktifnya (nortriptilin) didistribusikan ke kelenjar susu, dengan konsentrasi yang hampir sama atau sedikit lebih besar dibandingkan dalam serum ibu hamil. Waktu paruh plasma Amitriptilin berkisar dari 10-50 jam. Obat ini dimetabolisasi melalui pathway yang sama dengan antidepresan trisiklik yang lain; nortriptilin,
Gambar 10. Diagram skematik menggambarkan beberapa tempat kerja potensial antidepressan.
Dikutip dari : Katzung (2006)
Interaksi farmakokinetik obat yang mungkin terjadi adalah antara inhibitor-inhibitor poten P450 2D5, paroxetin, fluoxetine, dan obat-obat yang tergantung pada pathway ini untuk clearance-nya (misalnya : desipramin, nortriptilin, flecainide). Interaksi obat yang signifikan secara klinis sangat jarang, hanya dijumpai beberapa laporan kasus setelah pemakaian kumulatif lebih dari 50 juta penderita yang menggunakan obat ini (Katzung, 2006).
2.7. Deksketoprofen
Deksketoprofen trometamol adalah garam dekstrorotator enantiomer dari ketoprofen yang larut dalam air. Ketoprofen racemic digunakan sebagai agen analgesik dan anti-inflamasi, dan merupakan salah satu inhibitor sintesis prostaglandin paling kuat secara in vitro. Efek ini berhubungan dengan (S)-(+)-enantiomer (Deksketoprofen), sementara (R)-(-)-enantiomer sama sekali tidak memiliki aktifitas tersebut. Ketoprofen racemic (campuran kimiawi obat yang mengandung jumlah yang sama
dari bentuk dekstrorotator dan levorotator) menunjukkan sedikit stereoselektifitas dalam farmakokinetiknya. Bioavaibilitas oral relatif dari Deksketoprofen (12,5 mg dan 25 mg) serupa dengan ketoprofen racemic (25 dan 50 mg). Deksketoprofen trometamol diberikan dalam bentuk tablet, diabsorbsi dengan cepat, dengan waktu ke konsentrasi maksimum plasma (tmax) antara 0,25-0,75 jam (Barbanoj, Antonijoan, Gich, 2001).
urine, dan tidak ada obat yang dieliminasi tanpa diubah. Pada dosis diatas 7 mg, Deksketoprofen superior secara signifikan dibandingkan dengan plasebo pada penderita dengan nyeri sedang dan berat. Hubungan dosis-respons antara 12,5 mg dan 25 mg dapat dilihat dari kurva time-effects, superioritas dosis 25 mg lebih merupakan hasil dari perpanjangan durasi aksi dibandingkan dengan peningkatan dalam efek analgesik puncak. Plateau dalam aktifitas analgesik dari Deksketoprofen trometamol pada
dosis 25 mg dijumpai. Waktu hingga muncul pengurangan nyeri tampak lebih pendek pada penderita yang diterapi dengan Deksketoprofen trometamol. Obat ini dapat ditoleransi dengan baik (Barbanoj, Antonijoan, Gich, 2001).
Deksketoprofen trometamol 25 mg tiga kali sehari per oral terbukti sama efektifnya dengan diklofenak tiga kali 50 mg per hari untuk pengobatan nyeri akibat osteoartritis lutut (Srikanth, Harshad, Shivamurthy,Niveditha, 2012). Obat ini juga lebih efektif dibanding parasetamol dan metamizol untuk mengurangi nyeri akut pasca operasi telinga, hidung dan tenggorokan (Karaman, Cukurova, Demirhan, Gonullu, Altunbas, 2010). Review sistematik terhadap 35 penelitian mengenai nyeri akut dan kronik menyimpulkan bahwa Deksketoprofen paling tidak sama efektifnya dengan obat anti inflamasi non steroid dan kombinasi parasetamol/opioid lainnya (Moore dan Barden, 2008).
trisiklik antidepresan yang telah banyak diteliti manfaatnya pada TTH kronik dan efektif sebagai terapi preventif TTH kronik. Penelitian ini bertujuan untuk mengetahui apakah Amitriptilin juga bermanfaat sebagai terapi kuratif. Deksketoprofen dalam bentuk ketoprofen juga telah diteliti dan efektif pada TTH akut Penelitian ini bertujuan untuk melihat apakah Deksketoprofen juga efektif pada TTH kronik. Efektifitas kedua obat ini secara klinis dibandingkan dengan menggunakan parameter perubahan pada skala intensitas nyeri NRS. Juga dibandingkan pengaruh kedua obat terhadap kadar TNF-α, IL-1 dan IL-6 serum dengan melakukan pengukuran kadar TNF-α, IL-1 dan IL-6 serum, sebelum dan sesudah pemberian Amitriptilin atau Deksketoprofen. Diharapkan Amitriptilin maupun Deksketoprofen akan menurunkan intensitas nyeri dan kadar TNF-α, IL-1 dan IL-6 serum pada penderita TTH kronik.