PRAKTIK KERJA LAPANGAN
DI LABORATORIUM TLM
SMK KESEHATAN BHAKTI KENCANA SUBANG
Diajukan untuk memenuhi salah satu syarat
mengikuti Ujian Akhir Diploma III
Sekolah Tinggi Analis Bakti Asih
Disusun Oleh:
Tas’a Hafizhatil Ummah
1511E2060
Laporan PKL ini telah disahkan pada : 25 Agustus 2017
Menyetujui
Ka. Program Studi TLM SMK Kes. Bhakti Kencana
Subang,
Pembimbing Teknis PKL Lab SMK Kes. Bhakti Kencana
Subang,
Dewi Yayuningsih, S.Si., MARS Astuti Wulandari Tantular, S.Si
Mengetahui
Direktur Sekolah Tinggi Analis Bakti Asih
Bandung,
Pembimbing PKL Sekolah Tinggi Analis Bakti Asih
Bandung,
i
Puji dan Syukur kami panjatkan kehadirat Allah S.W.T serta shalawat dan salam
semoga dilimpahkan kepada junjujngan Nabi Besar Muhammad S.A.W, karena atas rahmat
dan Karunia-Nya kami dapat menyelesaikan kegiatan praktik kerja lapangan dengan lancar.
Laporan praktik Kerja Lapangan ini dibuat untuk memenuhi salah satu syarat
mengikuti ujian Diploma III Sekolah Tinggi Analis Bakti Asih, yang pada dasarnya merupakan
kewajiban yang harus diikuti oleh seluruh mahasiswa khususnya di jurusan Analis Kesehatan.
Pada penulisan laporan ini, penulis menyadari akan kesulitan-kesuliatan baik dalam
praktik lapangan maupun pada penyusunan laporan. Tetapi berkat bimbingan, bantuan serta
usaha keras kami dengan penuh keridhoan Allah, akhirnya laporan ini dapat terselesaikan
sebagaimana mestinya.
Dalam kesempatan ini penulis menyampaikan ucapan terimakasih yang sebesar-besarnya
kepada:
1. Ibu Dewi Yayuningsih, S.Si., MARS selaku Kepala Program Studi TLM SMK Kes.
Bhakti Kencana Subang yang telah mengizinkan kami melakukan praktik kerja
lapangan di tempat beliau.
2. Ibu Astuti Wulandari Tantular, S.Si selaku pembimbing teknis di Laboratorium TLM
SMK Kes. Bhakti Kencana Subang
3. Ibu Rani Handriani, S.Si selaku Kepala program studi Diploma III Analis Kesehatan
sekaligus pembimbing PKL yang telah banyak membantu dalam penyusunan laporan
ii
5. Semua rekan-rekan kami yang telah memberikan bantuan maupun dukungan moril
yang mempercepat penyelesaian laporan ini, yang mana tidak bisa kami sebutkan
namanya satu-persatu
Semoga Allah yang maha pengasih memberikan balasan atas segala kebaikan.
Sebagai akhir kata, penulis sangat menyadari laporan praktik kerja inidustri ini masih
banyak kekurangannya. Dengan demikian segala kritik dan saran yang bersifat membangun
akan kami terima denga senang hati.
Bandung, 25 Agustus 2017
iii LEMBAR PENGESAHAN
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR BAGAN ... viii
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN ... 1
1.1 Pengertian dan Tujuan PKL ... 1
1.1.1 Pengertian PKL ... 1
1.1.2 Tujuan PKL ... 1
1.2 Tempat dan Waktu PKL ... 2
1.2.1 Tempat ... 2
1.2.2 Waktu ... 2
BAB II MANAJEMEN LABORATORIUM ... 3
2.1 Profil Laboratorium ... 3
2.1.1 Tata letak Laboratorium ... 4
2.1.2 Sarana dan Prasarana ... 5
2.1.3 Visi dan Misi SMK Kesehatan Bhati Kencana Subang ... 6
iv
2.3 Pemantauan Laboratorium ... 8
2.3.1 Pemantapan Mutu Internal ... 8
2.3.2 Pemantapan Mutu Eksternal ... 8
BAB III KEGIATAN PRAKTEK KERJA LAPANGAN ... 9
3.1 Kegiatan Teknis ... 9
3.1.1 Bahan Pemeriksaan ... 9
3.1.2 Jenis Pemeriksaan Yang Dilakukan ... 10
3.2 Sampling ... 11
3.2.1 Persiapan Sampling ... 11
3.2.2 Pengambilan Bahan Pemeriksaan ... 13
3.3 Prosedur Pemeriksaan ... 16
3.3.1 Hematologi ... 16
3.3.2 Hemostatis... 26
3.3.3 Imunologi ... 30
3.3.4 Klinik Rutin ... 41
3.3.5 Kimia Klinik ... 53
3.3.6 Mikrobiologi ... 67
3.3.7 Parasitologi ... 76
3.4 Pencatatan dan Evaluasi ... 79
3.4.1 Jurnal Praktikum ... 79
3.4.2 Print Out Hasil ... 80
v
4.1.1 Pencatatan data awal ... 81
4.1.2 Pelaporan... 82
4.1.3 Pengarsipan ... 82
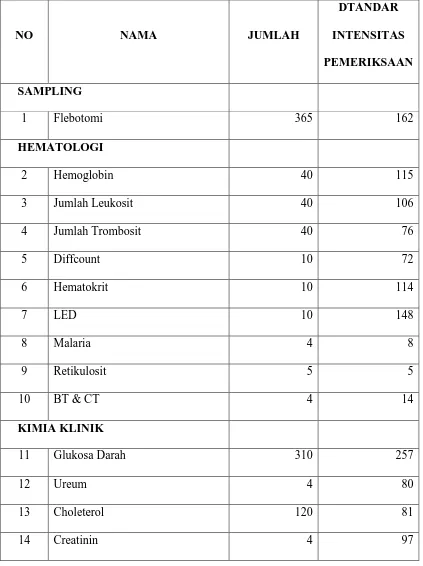
4.2 Intensitas Pemeriksaan Laboratorium ... 83
4.3 Pengelolaan Li mbah Laboratorium ... 85
4.3.1 Limbah Domestik ... 85
4.3.2 Limbah Cair ... 85
4.3.3 Limbah Infeksius dan B3 ... 85
BAB V KESIMPULAN DAN SARAN ... 86
5.1 Kesimpulan ... 86
vi
Tabel 3.1 Bahan Pemeriksaan Laboratorium ... 9
Tabel 3.2 Jenis Pemeriksaan Yang Dilakukan Di Lab TLM ... 10
Tabel 4.1 Pengarsipan ... 82
vii
Gambar 2.1 Denah SMK Kes. Bhakti Kencana Subang ... 4
viii
Bagan 2.1 Alur Kerja Di Lab TLM ... 7
Bagan 4.1 Praktikum Harian ... 81
Bagan 4.2 Ujian Praktikum ... 81
ix Lampiran 1 Contoh Penulisan Jurnal Praktikum
Lampiran 2 Formulir Permintaan Pemeriksaan Laboratorium
Lampiran 3 Hasil Pemeriksaan Laboratorium
Lampiran 4 Hasil Pemeriksaan Mikrobiologi
Lampiran 5 Contoh Soal Ujian Praktikum
Lampiran 6 Daftar Hadir Praktikum
Lampiran 7 Daftar Hadir Pembimbing
Lampiran 8 Daftar Nilai Praktikum
Lampiran 9 Berita Acara Praktikum
1
PENDAHULUAN
1.1Pengertian dan Tujuan PKL
1.1.1 Pengertian PKL
Praktik Kerja Lapangan atau yang biasa di sebut dengan PKL adalah salah satu bentuk
emplementasi secara sistematis dan sinkron antara program pendidikan di sekolah dengan
program penguasaan keahlian yang diperoleh melalui kegiatan kerja secara langsung
didunia kerja untuk mencapai tingkat keahlian tertentu.
Disamping dunia usaha, Praktik Kerja Lapangan ( PKL ) Dapat memberikan
keuntungan pada pelaksanaan itu sendiri yaitu sekolah, karena keahlian yang tidak
diajarkan di sekolahan bias didapat didunia usaha, sehingga dengan adanya Praktik Kerja
Lapangan ( PKL ) dapat meningkatkan mutu dan relevensi Pendidikan Menengah Atas
yang dapat diarahkan untuk mengembangkan suatu system yang mantap antara dunia
pendidikan dan dunia usaha.
.
1.1.2 Tujuan PKL
1.1.2.1Tujuan Umum
Tujuan umum dilaksanakannya Praktik Kerja Lapangan ( PKL ) yang diwujudkan
dalam kerja disuatu perusahaan. Selain sebagai salah satu syarat tugas akhir Praktik
Kerja Lapangan ( PKL ),Praktik Kerja Lapangan ( PKL ) juga sebagai kegiatan Pelajar
untuk mencari pengalaman kerja sebelum memasuki dunia kerja yang sesungguhnya,
yang tercermin dalam Pendidikan Nasional yang berdasarkan Pancasila yang bertujuan
2
manusia yang dapat membangun dirinya sendiri serta bertanggung jawab atas
Pembangunan Bangsa dan Negara dalam pencapaian perekonomian meningkat dan
kehidupan yang makmur.
1.1.2.2Tujuan Khusus
Adapun tujuan khusus diadakan pelaksanakan Praktik Kerja Lapangan ( PKL ) antara lain :
a) Untuk memperkenalkan pelajar pada dunia usaha.
b) Menumbuhkan dan meningkatkan sikap profosional yang diperlukan pelajar untuk memasuki dunia usaha.
c) Meningkatkan daya kreasi dan produktifitas tehadap pelajar sebagai persiapan dalam menghadapi atau memasuki dunia usaha yang sesungguhnya.
d) Meluaskan wawasan dan pandangan pelajar terhadap jenis-jenis pekerjaan pada tempat dimana pelajar melaksanakan Praktik Kerja Lapangan (PKL).
1.2Tempat dan Waktu PKL
1.2.1 Tempat
Tempat PKL dilaksanakan di Laboratorium TLM SMK Kesehatan Bhakti
Kencana Subang.
1.2.2 Waktu
3
MANAJEMEN LABORATORIUM
2.1 Profil Laboratorium
SMK Kesehatan Bhakti Kencana Subang merupakan salah satu institusi pendidikan
dibawah naungan Yayasan Adhiguna Kencana Bandung yang berkecimpung di dunia
pendidikan ilmu kesehatan.
Institusi ini berlokasi di Jalan Ki Hajar Dewantara nomor 15 A Subang dan memiliki 3
kompetensi keahlian diantaranya; Keperawatan, Farmasi dan Teknologi Laboratorium
Medik (TLM).
Laboratorium TLM SMK Kesehatan Bhakti Kencana Subang merupakan salah satu
sarana praktikum bagi pelajar SMK Kesehatan Bhakti Kencana Subang Khususnya bagi
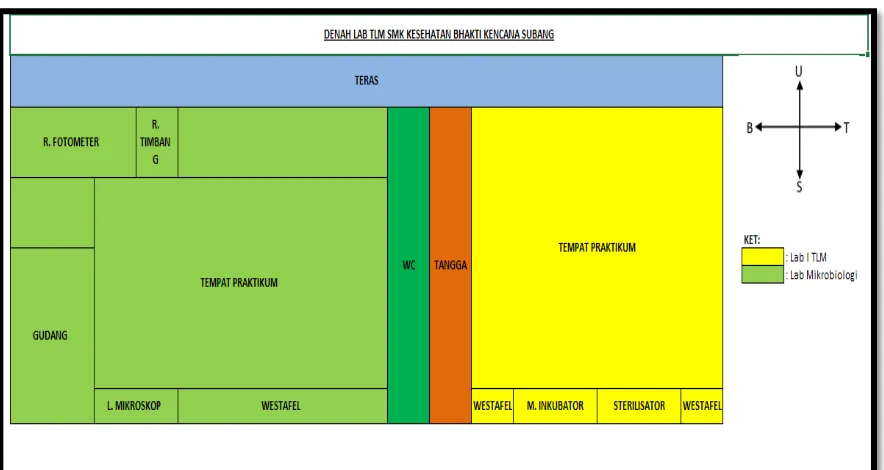
2.1.1 Tata letak Laboratorium
Gambar 2.1 Denah SMK Kes. Bhakti Kencana Subang
2.1.2 Sarana dan Prasarana
Sarana paktikum TLM terdiri dari 2 laboratorium utama yaitu:
2.1.2.1 Laboratorium Serbaguna
Laboratorium ini berfungsi untuk melaksanaan praktikum hematologi, kimia klinik
dan Serologi. Fasilitas di laboratorium ini diantaranya:
a) Gudang
Sebagai tempat penyimpanan peralatan dan bahan-bahan yang akan digunakan
praktikum.
b) Ruang Fotometer
Tempat khusus untuk melakukan analisis menggunakan spektrofotometer, terdiri
dari satu buah meja beton dan satu buah spektrofotometer.
c) Ruang Timbang
Tempat khusus untuk melakukan penimbangan, terdiri dari satu buah meja beton
dan satu buah timangan analitik.
d) Lemari Mikroskop
Tempat khusus penyimpanan mikroskop yang berupa lemari dengan pengatur
kelembapan yang berisi 25 buah mikroskop cahaya.
e) Westafel
Westafel sepanjang tempat praktikum dengan 8 buah keran mengalir dan 4 buah
bak khusus pewarnaan.
f) Tempat Praktikum
Terdiri dari 8 buah meja praktikum semi permanen dengan lemari dan laci-laci
2.1.2.2 Laboratorium Mikrobiologi
Laboratorium ini berfungsi untuk melaksanakan praktikum parasitologi, mikologi dan
bakteriologi. Fasilitas di laboratorium ini diantaranya:
a) Meja inkubator
Sebagai tempat untuk menginkubasi biakan sampel, terdiri dari satu buah meja
beton dan satu buah inkubator.
b) Meja Sterilisator
Sebagai tempat mensterilisasi alat maupun media yang akan digunakan, terdiri dari
satu buah meja beton, satu buah autoklaf dan satu buah oven.
c) Westafel
Terletak di dua sisi laboratorium, masing-masing terdiri dari dua buah keran
mengalir denga satu buah bak pewarnaan.
d) Tempat Praktikum
Terdiri dari 6 buah meja beton dan tempat duduk.
2.1.3 Visi dan Misi SMK Kesehatan Bhati Kencana Subang
2.1.3.1 Visi
Menjadi SMK yang unggul dan kompeten dalam memenuhi kebutuhan dan kepuasan
pelanggan.
2.1.3.2 Misi
a) Menjadi pendidik dan tenaga kependidikan yang jujur, terbuka dan penyayang,
b) Menjadi institusi pendidikan yang dikelola secara jujur, terbuka, mandiri, dan
professional, serta berkembang secara berkelanjutan.
c) Menjadi rumah bagi pendidik, tenaga kependidikan, dan peserta didik untuk
menumbuh kembangkan kecerdasan spiritual, emosional, sosial dan intelektual
secara berkelanjutan.
d) Memberi pelayanan prima untuk mencapai kepuasan pelanggan secara
berkelanjutan.
e) Menjadikan pelajar SMK yang berakhlak mulia, mandiri, berilmu, dan memiliki
keunggulan sehingga mampu menjalankan profesinya secara bertanggung jawab.
2.1.4 Visi dan Misi Program Studi ATLM
2.2 Alur Kerja Laboratorium
Ada beberapa perbedaan alur kerja di laboratorium TLM SMK Kes. Bhakti Kencana
Subang. Perbedaan ini berdasarkan jenis praktikum yang dilakukan. Di bawah ini alur kerja
yang dilakukan secara umum,
Bagan 2.1 Alur kerja di lab TLM
1. Pembimbing menentukan materi praktikum sesuai KI dan
KD
2. Responsi cara kerja oleh pembimbing
2.3 Pemantauan Laboratorium
2.3.1 Pemantapan Mutu Internal
Pemantapan mutu internal (PMI) dilakukan dengan cara melakuan kalibrasi dan
pembuatan chart quality control pada parameter uji, melakukan pengujian presisi dan
akurasi dan pengecekan tanggal kadaluarsa reagen.
2.3.2 Pemantapan Mutu Eksternal
Pemantapan mutu eksternal dilakukan oleh pihak ke-tiga yang telah membuat MOU
9
KEGIATAN PRAKTEK KERJA LAPANGAN
3.1 Kegiatan Teknis
3.1.1 Bahan Pemeriksaan
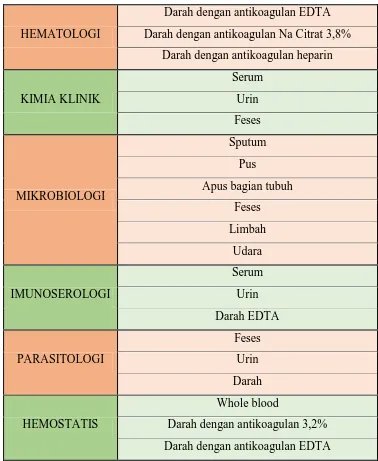
Tabel 3.1 Bahan pemerikasaan Laboratorium
HEMATOLOGI
Darah dengan antikoagulan EDTA
Darah dengan antikoagulan Na Citrat 3,8%
Darah dengan antikoagulan heparin
KIMIA KLINIK
Darah dengan antikoagulan 3,2%
3.1.2 Jenis Pemeriksaan Yang Dilakukan
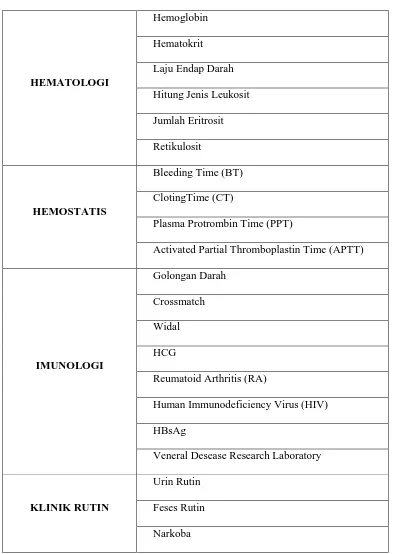
Tabel 3.2 Jenis pemeriksaan yang dilakukan di lab TLM
HEMATOLOGI
Plasma Protrombin Time (PPT)
Activated Partial Thromboplastin Time (APTT)
IMUNOLOGI
Human Immunodeficiency Virus (HIV) HBsAg
Veneral Desease Research Laboratory
KLINIK RUTIN
Lanjutan Tabel 3.2 Jenis pemeriksaan yang dilakukan di lab TLM
b) Nama pasien lengkap
c) Jenis kelamin, Usia
d) Alamat, No telp, No Hp
e) Dokter yang meminta
f) Tanggal / Jam pengambilan
g) Jenis tes
h) Nam a pengambil bahan
i) No MR
j) Ruang
k) Persiapan Punksi
l) Pilih Tabung vacum yang sesuai
m) Beri label pada tabung
n) Persiapkan alat dan bahan sebelum punksi
o) Prosedur Higiene
p) Cuci Tangan
q) Gunakan sarung Tangan
r) Strategi Komunikasi s) Mengucapkan salam
t) Melakukan pendekatan secara profesional
u) Melakukan wawancara utk konfirmasi data pasien secara singkat dan lengkap
v) Memberi penjelasan tentang tujuan dan proses pengambilan bahan pemeriksaan
w) Memberi penyuluhan kesehatan x) Mengucapkan terimakasih.
a) Dalam keadaan tenang, rileks dan kooperatif
b) Diberi motivasi : sakit sedikit, proses cepat
c) Apakah perlu puasa
3.2.1.3 Posisi Pasien
a) Duduk atau berbaring dengan nyaman
b) Pada posisi duduk lengan diletakkan di atas meja atau tempat tidur, dapat menggunakan bantal untuk memberikan posisi nyaman
c) Pada posisi berbaring lengan diulurkan lurus dari bahu sampai pergelangan tangan
d) Idealnya posisi pasien saat pengambilan sampel darah harus dicatat
e) Perbedaan posisi dapat mempengaruhi hasil 3.2.1.4Pemilihan daerah Punksi Vena
a) Vena yang tepat umtuk pengambilan darah :
b) vena mediana cubiti (terbaik)
c) vena cephalica
d) vena basilica
e) (besar, elastis, bentuk lurus dan rangsang sakit kurang)
f) Vena pada ekstremitas bawah tidak dianjurkan karena sering menimbulkan komplikasi
3.2.2 Pengambilan Bahan Pemeriksaan
3.2.2.1 Flebotomi Kapiler
a) Desinfektasi permukaan jari yang akan dilakukan tusukan
b) Siapkan alat autolanset, pasang lanset steril pada posisi yang tepat, tutup
c) Sesuai ukuran kedalaman tusukan dengan cara memutar holder ukuran
e) Arahkan lubang autolanset ke daerah tusukan, tempelkan pada kulit yang akan
ditusuk
f) Tekan tombol penusuk sampai terdengar bunyi “click”
g) Lanset akan menusuk
3.2.2.2. Flebotomi Vena Metode Open System
a) Alat-alat yang diperlukan disiapkan diatas meja.
b) Keadaan pasien diperiksa, diusahakan pasien tenang begitu pula petugas (Phlebotomis). c) Ditentukan vena yang akan ditusuk, pada orang gemuk atau untuk vena yang tidak terlihat
dibantu dengan palpasi
d) Daerah vena yang akan ditusuk diperhatikan dengan seksama terhadap adanya peradangan, dermatitis atau bekas luka, karena mempengaruhi hasil pemeriksaan. e) Tempat penusukan didesinfeksi dengan Alkohol 70 % dan dibiarkan kering
f) Tourniquet dipasang pada lengan atas (bagian proximal lengan) 6 – 7 cm dari lipatan tangan.
g) Tegakkan kulit diatas vena dengan jari-jari tangan kiri supaya vena tidak bergerak h) Dengan lubang jarum menghadap keatas, kulit ditusuk dengan sudut 45o – 60o sampai
ujung jarum masuk lumen vena yang ditandai dengan berkurangnya tekanan dan masuknya darah keujung semprit.
i) Holder ditarik perlahan-lahan sampai volume darah yang diinginkan.
j) Torniquet dilepas, kapas diletakkan diatas jarum dan ditekan sedikit dengan jari kiri, lalu jarum ditarik.
k) Pasien diinstruksikan untuk menekan kapas selama 1 – 2 menit dan setelah itu bekas luka tusukan diberi plester hansaplast
3.2.2.3 Flebotomi Vena Metode Close System
a) Persiapkan tabung dan peralatan
b) Cuci tangan dan gunakan sarung tangan
c) Pasang tourniquet untuk mencari situs tusukan
d) Lepas tourniquet
e) Bersihkan situs tusukan dengan alkohol 70% dalam lingkarang konsentris
bergerak keluar dan biarkan kering
f) Rakit peralatan sambil menunggu alkohol mongering. Pasang jarum multisampel
pada holder
g) Ulangi pemasangan tourniquet jangan sampai menyentuh situs steril
h) Renggangkan kulit dengan ibu jari sampai 2 inci di bawah situs
i) Masukan jarum kedalam pembuluh darah dengan sudut 15-30˚ dengan bevel
samapai merasa tekanannya berkurang
j) Ketika darah mengalir pada jarum masukan tabung denga menekannya
menggunakan ibu jari sementara jari telunjuk dan jari tengah menahan holder
agar posisi jarum tidak berubah
k) Ketika darah telah mengalir ke tabung, lepaskan tourniquet
l) Dengan hati-hati keluarkan tabung ketika darah berhenti mengalir kedalamnya.
Segera homogenkan tabung jika berisi antikoagulan secara perlahan. Masukan
tabung berikutnya bila diperlukan multi sampel
m) Tutupi situs tusukan dengan kasa bersih. Tarik jarum keluar dan tekan perlahan
agar darah tidak mengalir
3.3 Prosedur Pemeriksaan
3.3.1 Hematologi
Hematologi adalah ilmu yang mempelajari tentang darah. Pemeriksaan hematologi adalah
pemeriksaan yang bertujuan untuk mengetahui kelainan dari kuantitas dan kualitas sel darah
merah, sel darah putih dan trombosit serta menguji perubahan yang terjadi pada plasma yang
terutama berperan pada proses pembekuan darah
Berikut adalah pemeriksaan hematologi yang dilakukan di Lab TLM SMK Kes. Bhakti
Kencana Subang:
a. Hemoglobin
1) Metode Sahli
Metode
Sahli
Tujuan
Menentukan kadar hemoglobine dalam darah sampel, menggunakan metode Sahli.
Prinsip
Hemoglobin oleh asam klorida 0,1N diubah menjadi asam hematin yang warnanya
coklat tua. Dengan air suling warna ini diencerkan sampai warnanya sama dengan
warna standar pada hemometer. Kadar Hb dibaca pada tabung sahli (tabung
pengencer).
Prosedur
a) Masukkan kira-kira 5 tetes hcl 0,1 N ke dalam tabung pengencer hemometer (sp
tanda 2)
b) Isaplah darah kapiler dengan pipet hemoglobine sampai garis tanda 20ul
d) Catatlah waktunya dan segeralah alirkan darah dari pipet ke dalam dasar tabung
yang berisi HCL tadi. Hati-hati jangan sampai terjadi gelembung udara
e) Angkatlah pipet itu sedikit, lalu isap HCL yang jernih ke dalam pipet 2 atau 3
kali untuk membersihkan darah yang masih tertinggal dalam pipet (melakukan
pembilasan)
f) Campurlah isi tabung tersebut supaya darah dan asam bersenyawa; warna
campuran menjadi coklat tua
g) Tambahkan air setetes demi setetes, tiap kali diaduk dengan batang pengaduk
yang tersedia. Persamaan warna campuran dan standar warna harus dicapai
dalam 3-5 menit setelah saat darah dan hcl dicampur. Pada saat melakukan
penyamaan warna, putarlah tabung agar pada saat pengamatan garis-garis
tabung berada di belakang (tidak terlihat)
h) Bacalah kadar hemoglobine dengan satuan gram atau per 100 ml darah/dl/%
2) Metode Sianmethemoglobin
Metode
Sianmethemoglobine
Tujuan
Menentukan kadar hemoglobine dalam darah sampel, menggunakan metode
Sianmethemoglobine (cara Drabkins)
Prinsip
Hemoglobine + K3(FeCN)6 Methemoglobine
(Darah dengan penambahan kalium ferrisianida akan membentuk methemoglobine,
dimana ferrisianida akan mengubah ion Fe dari bentuk ferro (Fe+2) menjadi ferri
(Fe+3). Kemudian methemoglobine yang terbentuk dengan kalium sianida akan
membentuk Sianmethemoglobine. Intensitas warna larutan yang terbentuk dibasa
pada photometer dengan panjang gelombang 546 nm.
Prosedur
a) Masukkan 5,0 ml larutan Drabkins ke dalam tabung reaksi
b) Lakukan pungtie kapiler, usaplah dengan kapas kering darah yang pertama
keluar
c) Isap darah berikutnya menggunakan pipet 20 ul
d) Bersihkan darah yang berada di ujung luar pipet menggunakan tissue kering
e) Masukkan darah ke dalam larutan Drabkins, lakukan pembilasan pada pipet
f) Campurlah darah dengan larutan Drabkins sampai homogen, dengan cara
memutar tabung dan jagalah agar tidak sampai timbul gelembung
g) Biarkan selama 1-2 menit
h) Bacalah dalam photometer pada gelombang 540 nm, gunakan larutan Drabkins
sebagai larutan blanko
i) Kadar hemoglobine ditentukan dari perbandingan absorbance antara larutan
blanko, standar dan sampel, yang dapat terbaca langsung pada alat photometer
b. Hematokrit
Metode
Tujuan
Menentukan nilai hematokrit darah
Prinsip
Darah dengan antikoagulan isotonic dalam tabung diputar selama 30 menit dengan
kecepatan 3000 rpm sehingga eritrosit dipadatkan membuat kolom dibagian bawah dari
tabung. Tingginya kolom mencerminkan nilai hematokrit.
Prosedur
1) Lakukan pungtie kapiler
2) Isap darah dengan tabung mikrokapiler, darah akan mengalir dengan sendirinya ke
dalam tabung, isi sampai + ¾ bagian mikrokapiler
3) Tutup mikrokapiler bagian atas yang tidak dialiri darah dengan menekan telunjuk
diatasnya
4) Tutup bagian bawah yang berisi darah dengan cristoseal dengan cara menekannya
5) Masukkan dalam sentrifuge secara berlawanan dengan mikrokapiler lainnya
6) Putar dengan kecepatan 3000 rpm selama 5 menit
7) Setelah sentrifugasi selesai, ukur tinggi eritrosit dengan menggunakan mistar khusus
hematocrit
c. Laju Endap darah
Metode
Tabung Westergren
Tujuan
Prinsip
Mengukur kemampuan sedimentasi eritrosit dalam satuan waktu tertentu
Prosedur
1) Lakukan pungtie vena dengan disposible syringe. Isaplah darah sampai 1,6 ml
2) Kemudian isap kembali Natrium Citrat 3,8% sebanyak 0,4 ml, sehingga total
campuran menjadi 2,0 ml.
3) Campur hati-hati dengan membolak balikkan disposible syringe.
4) Masukkan campuran kedalam tabung.
5) Isap campuran terse
6) but dengan tabung westergen sampai garis bertanda 0 mm, kemudian pasang
tabung pada rak secara tegak lurus.
7) Biarkan selama 60 menit.
8) Bacalah tinggi lapisan plasma dengan milimeter dan laporkan angka tersebut
sebagai nilai LED
d. Hitung Jenis Leukosit
Metode
Manual different Cell Count (pewarnaan giemsa)
Tujuan
Mengidentifikasi jenis-jenis sel leukosit, dilaporkan per 100 sel leukosit
Prinsip
Pemeriksaan jumlah relatif / prosentase (%) dari masing-masing jenis sel leukosit.
Prosedur
1) Pembuatan Preparat
a) Lakukan pungtie vena dengan disposible syringe. Isaplah darah sampai 1,6 ml
b) Kemudian isap kembali Natrium Citrat 3,8% sebanyak 0,4 ml, sehingga total
campuran menjadi 2,0 ml.
c) Campur hati-hati dengan membolak balikkan disposible syringe.
d) Masukkan campuran kedalam tabung.
e) Isap campuran tersebut dengan tabung westergen sampai garis bertanda 0 mm,
kemudian pasang tabung pada rak secara tegak lurus.
f) Biarkan selama 60 menit.
g) Bacalah tinggi lapisan plasma dengan milimeter dan laporkan angka tersebut
sebagai nilai LED
2) Pewarnaan Preparat
a) Letakkan sediaan yang akan dipulas di atas rak tempat memulas dengan
lapisan darah menghadap ke atas.
b) Lakukan fiksasi (perekatan); dengan mencelupkan ke dalam larutan methanol
sehingga seluruh sediaan terbasahi oleh methanol. Biarkan selama 5 menit
atau lebih hingga sediaan kering.
c) Letakkan sediaan di atas rak tempat memulas, teteskan 3-5 tetes larutan
giemsa secara merata di atas sediaan apus. Biarkan selama 15-20 menit.
d) Bilas dengan air mengalir secara perlahan.
e) Letakkan sediaan dalam sikap vertikal dan biarkan mengering di udara
3) Pembacaan Preparat
a) Letakkan preparat pada meja objek mikroskop,
b) Arahkan lensa obyektif pada perbesaran 10x, temukan lapang pandang
c) Teteskan oil immersi pada sediaan
d) Pindahkan lensa obyektif ke perbesaran 100x
e) Hitung jenis leukosit, dimulai dari bagian yang paling tipis dimana sel-sel
berpencar satu-satu dan eritrosit tidak menggumpal/bergerombol
f) Hitung leukosit sampai 100 sel, dengan arah pembacaan menuju ke bagian
yang lebih tebal dan satu arah (tidak bolak-balik
e. Hitung Jumlah Eritrosit
Metode
Hayem (manual)
Tujuan
Menentukan jumlah eritrosit dalam darah sampel, yang dikonversi dalam per-mm3
darah
Prinsip
Sel-sel eritrosit akan terlihat lebih jelas, sementara sel-sel lain tidak begitu jelas atau
bahkan menghilang dengan penambahan larutan hayem.
Prosedur
1) Mengisi Pipet Eritrosit
a) Lakukan pungtie kapiler
b) Isap darah dengan pipet Thoma sampai tanda 0,5
d) Masukan ujung pipet dalam larutan hayem sambil menahan darah pada garis
tanda tadi. Pipet dipegang dengan sudut 45 derajat dan larutan hayem diisap
perlahan-lahan sampai garis tanda 101. Hati-hati jangan sampai terjadi
gelembung udara
e) Angkat pipet dari larutan, tutup pipet dengan jari
f) Campur sampai homogen kira-kira 3 menit, dengan cara memutar pergelangan
tangan
g) Letakkan secara horizontal, lalu siapkan bilik hitung untuk menghitung
2) Mengisi Kamar Hitung
a) Letakkan kamar hitung yang bersih diatas meja mendatar, tutup dengan kaca
penutup sampai rapat
b) Kocok sebentar, buang 2-3 tetes pertama, masukan sisa cairan dalam pipet
sampai merata
c) Biarkan selama 2-3 menit, lalu hitung jumlah eritrosit/mm3
3) Menghitung Jumlah Sel
Prinsip perhitungan jumlah sel darah:
Ʃ leukosit = jumlah sel yang dihitung x pengenceran
volume bilik hitung
f. Hitung Jumlah Trombosit
Metode
Tujuan
Menentukan jumlah trombosit dalam darah sampel, yang dikonversi dalam per-mm3
darah
Prinsip
Sel-sel trombosit akan terlihat lebih jelas, sementara sel-sel lain tidak begitu jelas atau
bahkan menghilang dengan penambahan larutan ammonium oksalat 1%.
Prosedur
1) Mengisi Pipet Eritrosit
a) Lakukan pungtie kapiler
b) Isap darah dengan pipet Thoma sampai tanda “1”
c) Hapus kelebihan darah yang melekat pada ujung pipet
d) Masukan ujung pipet dalam larutan amonium aksalat 1% sambil menahan darah
pada garis tanda tadi. Pipet dipegang dengan sudut 45 derajat dan larutan hayem
diisap perlahan-lahan sampai garis tanda 101. Hati-hati jangan sampai terjadi
gelembung udara
e) Angkat pipet dari larutan, tutup pipet dengan jari
f) Campur sampai homogen kira-kira 3 menit, dengan cara memutar pergelangan
tangan
g) Letakkan secara horizontal, lalu siapkan bilik hitung untuk menghitung
2) Mengisi Kamar Hitung
a) Letakkan kamar hitung yang bersih diatas meja mendatar, tutup dengan kaca
penutup sampai rapat
b) Kocok sebentar, buang 2-3 tetes pertama, masukan sisa cairan dalam pipet
c) Biarkan selama 2-3 menit, lalu hitung jumlah eritrosit/mm3
3) Menghitung Jumlah Sel
Prinsip perhitungan jumlah sel darah:
Ʃ leukosit = jumlah sel yang dihitung x pengenceran
volume bilik hitung
g. Hitung Jumlah Retikulosit
Metode
Supravital staining
Tujuan
Menghitung jumlah retikulosit dalam darah
Prinsip
Ke dalm darah dimana sel-sel darah dalam keadaan hidup ditambahkan larutan BCB
selam beberapa menit. Kemudian dibuat sediaan apus tipis dan dihitung sel-sel
retikulosit secara mikroskopik. Prosentase retikulosit ditentukan terhadap sejumlah
eritrosit.
Prosedur
1) masukkan 3 tetes larutan pewarnaan ke dalam tabung reaksi
2) tambahkan 3 tetes darah spesimen, homogenkan (darah : larutan perwanaan / 1:1)
3) biarkan campur dalam suhu kamar 15 - 30 menit atau inkubasi 37 derajat celcius
selama 10 menit terjadi perwanaan supravital
4) campur dan homogenkan
6) kemudian amatilah di bawah mikroskop dengan perbesaran 100x , retikulosit
terlihat berwarna abu - abu sampai kebiru - biruan
7) catat retikulosit % eritrosit sampai julah keduannya mencapai 1000 sel
8) persentase retikulosit di nyatakan dalam % atau promil
3.3.2 Hemostatis
Hemostatis adalah kemampuan alami untuk menghentikan perdarahan pada lokasi luka
oleh spasme pembuluh darah, adhesi trombosit dan keterlibatan aktif faktor koagulasi,
adanya koordinasi dari endotel pembuluh darah, agregasi trombosit dan aktivasi jalur
koagulasi. Fungsi utama mekanisme koagulasi adalah menjaga keenceran darah (blood
fluidity) sehingga darah dapat mengalir dalam sirkulasi dengan baik, serta membentuk
thrombus sementara atau hemostatic thrombus pada dinding pembuluh darahyang
mengalami kerusakan (vascular injury).
Adapun pemeriksaan hemostatis yang dilakukan di Lab TLM SMK Kes. Bhakti Kencana
Subang sebagai berikut::
a. Bleeding Time
Metode
Cara Duke
Tujuan
Mengukur waktu perdarahan sejak dibuat perdarahan buatan sampai tidak terjadi lagi
perdarahan
Prinsip
Setelah darah keluar, maka setiap tetesan darah diisap dengan kertas saring setiap 30
Prosedur
1) Bersihkan cuping telinga dengan alkohol 70%
2) Tusuk dengan lanset (kedalaman sekitar 2-3 mm)
3) Tetesan darah yang keluar isap dengan kertas saring setiap 30 detik sampai tidak
tersisa.
4) Hitung jumlah tetesan, kalikan dengan 30 detik
5) Perhitungan: jumlah tetesan x 30 detik = ....menit
b. Cloting Time
Metode
Lee and White
Tujuan
Mengukur waktu pembekuan, sejak darah keluar dari vena sampai terbentuknya bekuan
darah
Prinsip
Bila darah dikeluarkan dari pembuluh darah danditempatkan dalam tabung reaksi, maka
akan timbul pembekuan. (karena adanya kontak dengan dinding gelas yang diikuti
dengan reaksi pembekuan)
Prosedur
1) Ambil 3 ml darah vena dan begitu masuk kedalam jarum syringe stop watch
dijalankan
3) Masukkan 1 ml darah ke tabung I, 1 ml ke tabung II, dan 1 ml darah ke tabung III
4) Lihat terjadinya pembekuan pada tabung ke I setiap 30 detik
5) Bila sudah terjadi bekuan pada tabung I, lanjutkan pemeriksaan ke tabung II
6) Bila sudah terjadi bekuan pada tabung II, lanjutkan pemeriksaan ke tabung III
7) Matikan stop watch pada saat terlihat adanya bekuan pada tabung III
c. Plasma Protrombin Time (PPT)
Metode
Quick Test
Tujuan
Penetapan waktu pembentukan protrombin plasma untuk menguji faktor ekstrinsik
Prinsip
Suatu sediaan Tromboplastin yang kuat (Aceton dehydrated Rabbit Brain)
ditambahkan plasma yang didapat dari darah citrat. Campuran tersebut diinkubasi pada
suhu 37º C dan kemudian direcalcifikasi dengan penambahan larutan CaCl2dan dicatat
waktu pembukan plasma.
Prosedur
1) Pembuatan Plasma
a) Kedalam tabung sentrifuge masukkan 0,5 ml Na. Citrat 3,8 %.
b) Darah vena 4,5 ml masukkan ke dalam tabung yang berisi Na, Citrat tadi dan
campur baik-baik.
c) Putar pada sentrifuge selama 20 menit pada 3000 rpm
d) Pisahkan plasma yang terjadi, masukkan kedalam tabung dan kalau plasma
2) Pembuatan Larutan Tromboplastine
a) Masukkan 5 ml larutan NaCl 0,9 % dalam tabung lalu ditambah dengan 1 ampul
Brain Thromboplastine.
b) Larutan siap digunakan untuk pemeriksaan.
3) Pemeriksaan PPT
a) Masukkan tabung reaksi 10 x 200 mm ke dalam waterbath.
b) Masukkan 0,1 ml plasma kedalam tabung tadi dan tunggu sampai plasma
bersuhu 37ºC.
c) Tambahkan 0,1 ml Thromboplastine dan campur.
d) Kepada campuran tadi tambahkan larutan CaCl2 0,25 M. Jalankan Stop Watch
tepat pada waktu larutan CaCl2 tercampur dengan plasma.
e) Biarkan selama 10 detik, kemudian dicoba apakah sudah ada fibrin dengan
memancinnya berkali-kali dengan kaitan logam / ose.
f) Hentikan stop watch pada saat terdapat benang fibrin. Lamanya waktu
terbentuknya benang fibrin disebut Masa Protrombin plasma.
d. Activated Partial Thromboplastin Time (APTT)
Metode
Quick Test
Tujuan
Penetapan waktu activated partial thromboplastin time, APTT) Untuk menguji fungsi
thrombosit dan faktor VIII dan faktor IX (hemofilia)
Prinsip
Reagent APTT akan beraksi dengan faktor VIII dan faktor IX pada suhu 37º C pada
Prosedur
1) Pembuatan Plasma 1 : 9
a) Dipipet 0,2 ml Na. Citrate 3,8 % dimasukkan ke dalam tabung.
b) Darah yang ada dalam spuit dimasukkan kedalam tabung yang berisi Na.citrate
3,8 % sebanyak 1,8 ml.
c) Dicampur dengan cara membolak-balik tabung.
d) Diputar selama 5 menit pada 1500 rpm dengan sentrifuge.
e) Plasma yang terjadi dipisahkan dan dimasukkan kedalam tabung reaksi.
2) Pemeriksaan APTT
a) Reagent APTT dan larutan CaCl2 0,25 M dimasukkan waterbath 37º C selama
5 menit.
b) Dipipet 0,1 ml plasma dan dimasukkan kedalam tabung reaksi.
c) Ditambah 0,1 ml reagent APTT dan dikocok. Lalu dimasukkan kedalam
waterbath 37O C selama 3-5 menit.
d) Ditambah 0,1 ml CaCl2 0,25 M dan stop watch dijalankan.
e) Lalu didiankan dalam waterbath 37ºC selama 20-35 detikkemudian diangkat
dan digoyang.
f) Dipancing dengan Ose sampai terjadi pembekuan pada plasma dengan
terbentuk benang-benang fibrin dan stopwatch dihentikan.
3.3.3 Imunologi
Imunologi adalah suatu cabang yang luas dari ilmu biomedis yang mencakup kajian
mengenai semua aspek sistem imun(kekebalan) pada semua organisme. Imunologi antara
malafungsi sistem imun pada gangguan imunologi (penyakit
autoimun, hipersensitivitas, defisiensi imun, penolakan allograft); karakteristik fisik,
kimiawi, dan fisiologis komponen-komponen sistem imun in vitro, in situ, dan in vivo.
Imunologi memiliki berbagai penerapan pada berbagai disiplin ilmu dan karenanya dipecah
menjadi beberapa subdisiplin.
Pemeriksaan imunologi yang dilakukan di SMK Kes. Bhakti Kencana Subang sebagai
berikut
a. Golongan Darah
Metode
Sistem ABO dengan cara slide (kartu golongan darah)
Tujuan
Menentukan golongan darah sampel berdasarkan sistem ABO
Prinsip
Antigen (agglutinogen) dalam darah ditambahkan dengan antibodi (antiserum) dalam
reagen akan terbentuk aglutinasi
Prosedur
1) Bersihkan ujung jari yang akan ditusuk dengan kapas alkohol 70%;
2) Biarkan kering beberapa saat;
3) Tusuk hati-hati dengan menggunakan lanset;
4) Pijat perlahan dan hati-hati
5) Teteskan pada slide/kolom kartu golongan darah.
6) Letak slide / kartu golongan darah di atas permukaan rata;
7) Teteskan 1 tetes darah pada ke-4 kolom kartu yang tersedia;
8) Kolom 1 tambahkan monoclonal anti-A;
10)Kolom 3 tambahkan monoclonal anti-AB;
11)Kolom 4 tambahkan l anti-Rhesus;
12)Campurkan dengan hati-hati dengan menggunakan batang pengaduk;
13)Lihat terjadinya aglutinasi pada masing-masing kolom;
14)Lakukan penilaian hasil pemeriksaan
b. Cross Match
Fase I
I : Mayor : darah donor di test dengan serum resipien
II : minor : darah resipien di test dengan serum donor
Serum/plasma = 2 tetes
Suspensi sel 5% = 1 tetes
Putar 1000 rpm selama 1 menit
Positif : aglutinasi/hemolisis = inkompatibel
Negatif : tidak ada aglutinasi/tidak hemolisis
Lanjutkan ke fase II
Fase II
Tambah masing-masing 2 tetes bovine albumin 22% kemudian kocok.
Inkubasi 37OC selama 15 menit
Putar 1000 rpm selama 1 menit
Positif = Inkompatibel
Fase III
Cuci dengan saline 3 kali, buang supernatan
Tambahkan 2 tetes serum coombs kemudian kocok
Putar 1000 rpm selama 1 menit
Positif = Inkompatibel
Negatif = Kompatibel dan lakukan tes validitas
c. Widal
1) Cara Slide
Metode
Slide aglutinasi
Tujuan
Uji serologi di gunakan untuk membantu menegakkan diagnose demam tifoid
dengan mendeteksi anti bodi spesifik terhadap komponen anti gen Salmonella
typhi maupun mendeteksi antigen itu sendiri.
Prinsip
adanya antibody salmonella typhi dan salmonella paratyphi dalam serum sampel
akan bereaksi dengan antigen yang terdapat dalam reagen widal. Reaksi dengan
adanya aglutinasi.
Prosedur
S.typhi
Campur hingga homogen masing lubang
Goyang dengan rotator selama 2 menit
Lihat ada/tidaknya aglutinasi
2) Cara Tabung
Medtode
Tujuan
Uji serologi di gunakan untuk membantu menegakkan diagnose demam tifoid
dengan mendeteksi anti bodi spesifik terhadap komponen anti gen Salmonella
typhi maupun mendeteksi antigen itu sendiri.
Prinsip
Adanya antibody salmonella typhi dan salmonella paratyphi dalam serum sampel
akan bereaksi dengan antigen yang terdapat dalam reagen widal. Reaksi dengan
adanya aglutinasi melalui proses pengenceran bertingkat, sehingga dapat
dilaporkan secara kuantitatif.
Prosedur
Siapkan 7 buah tabung reaksi pada rak tabung
Masukkan pada masing-masing tabung, sbb:
1mL 1mL 1mL 1mL 1mL 1mL 1mL
1 2 3 4 5 6 7
NaCl 0,9% 1,9mL 1,9mL 1,9mL 1,9mL 1,9mL 1,9mL 1,9mL
Serum 0,1mL
Campur hingga homogen
Dari setiap tabung dipipet 5 µ L
Tambahkan masing-masing 25 µL antigen salmonellla
Campurkan dengan rotator
Dilihat aglutiniasi setelah 1 menit dan digoyang
d. HCG
1) Kualitatif
Metode
Immunokromatografi (Test Strip)
Tujuan
Mengidentifikasi kehamilan melalui test serologi
Prinsip
Reaksi antara HCG dalam urine dengan anti HCG yang dilekatkan berupa garis
membran tertentu akan membentuk garis berwarna baik pada kontrol maupun tes.
Bila sampel tidak mengandung HCG hanya terbentuk satu garis kontrol berwarna
saja.
Prosedur
a) Tempat wadah sampel urine di atas meja kerja mendatar
b) Celupkan carik HCG ke dalam urine sampai tanda batas biru (jangan melebihi
batas)
c) Diamkan selama 3-5 menit
2) Kuantitatif
Metode
Kuantitatif
Tujuan
Untuk mengetahui urine mengandung hormone HCG, dengan menggunakan metode
aglutinasi langsung dan aglutinasi tidak langsung.
Prinsip
Aglutinasi langsung :
Urine yang mengandung HCG ditambahkan anti HCG lateks akan menghasilkan
aglutinasi
Aglutinasi tidak langsung :
Urine yang mengandung HCG ditambah anti HCG dan HCG lateks tidak akan
menghasilkan aglutinasi
Prosedur
a) Siapkan reagensia sampai suhu kamar
b) Teteskan 1 tetes suspense urin dengan pipet yang tersedia
c) Ditambah 1 tetes antigen HCG kemudian di homogenkan
d) Goyang selama 2 menit
e) Baca hasil
e. Reumatoid Arthritis
Metode
RA secara kualitatif
Tujuan
Prinsip
Jika di dalam serum terdapat RA akan terjadi aglutinasi
Prosedur
1) Siapkan reagen dalam suhu kamar
2) Teteskan 1 tetes serum pada black slide
3) Ditambahakan 1 tetes reagen lateks
4) Dihomogenkan selama 2 menit
5) Baca hasilnya
f. HIV
Metode
Immunokromatografi
Tujuan
Mengidentifikasi keberadaan virus HIV atau antibody HIV dalam serum
Prinsip
Imunokromatografi dengan prinsip serum/plasma yang diteteskan pada bantalan
sample bereaksi dengan partikel yang telah dilapisi dengan anti HBs (antibody).
Campuran ini selanjutnya akan bergerak sepanjang strip membrane untuk berikatan
dengan antibody spesifik pada daerah tes (T), sehingga akan menghasilkan warna.
Prosedur
1) Disiapkan alat dan bahan yang akan digunakan
2) Dimasukkan 3 tetes serum pada sumur sampel
3) Ditambahkan 1 tetes larutan buffer
4) Diamkan selama beberapa menit
g. HBsAg
Metode
Imunokromatografi (Rapid Test)
Tujuan
Mengidentifikasi antigen hepatitis B secara kualitatif dalam darah sampel
Prinsip
Imunokromatografi dengan prinsip serum/plasma yang diteteskan pada bantalan
sample bereaksi dengan partikel yang telah dilapis dengan anti HBs (antibody).
Campuran ini selanjutnya akan bergerak sepanjang strip membrane untuk berikatan
dengan antibody spesifik pada daerah tes (T), sehingga akan menghasilkan garis warna.
Prosedur
1) Alat tes dilepaskan dari tutupnya ( untuk mendapatkan hasil yang baik sebaiknya
tes dilakukan dalam waktu 1 jam.
2) Tempatkan alat tes pada permukaan datar dan bersih. Pipet tetes dipegang secara
vertical lalu diteteskan 3 tetes serum/plasma (+100 ul) kedalam sumur specimen (S)
alat tes. Hindarkan adanya gelembung udara
3) Tunggu sampai garis merah muncul pada alat tes (C/T). Hasil sebaiknya dibaca
dalam waktu 15 menit
h. VDRL
Metode
Tujuan
Mengidentifikasi terjadi penularan penyakit seksual terutama yang disebabkan oleh
kuman syfilis melalui dalam darah sampel
Prinsip
Pada penderita sifilis akan terbentuk antibody yang terjadi sebagai reaksi terhadap
bahan-bahan yang dilepaskan karena kerusakan sel.
Cara kerja control positif
Prosedur
1) Cara Teteskan control positif di atas slide sebanyak 1 tetes
2) Tambahkan tambahkan antigen 1 tetes lalu aduk
3) Goyang menggunakan rotator selama 8 menit dengan kecepatan 100 rpm
4) Amati terjadinya aglutinasi
kerja sampel
1) Teteskan serum diatas slide sebanyak 50 µl
2) Tambahkan antigen 1 tetes lalu aduk
3) Goyang dengan menggunakan rotator selama 8 menit dengan kecepatan 100 rpm
5) Amati terjadinya aglutinasi
4) Bila positif lanjutkan ke test kwantitatif
Cara kerja control positif
1) Teteskan control positif di atas slide sebanyak 1 tetes
2) Tambahkan tambahkan antigen 1 tetes lalu aduk
3) Goyang menggunakan rotator selama 8 menit dengan kecepatan 100 rpm
3.3.4 Klinik Rutin
Pemeriksaan klinik rutin digunakan sebagai screening awal untuk membantu menegakkan
diagnosa sebelum pemeriksaan spesifik dilakukan.
Adapun pemeriksaan klinik rutin yang dilakukan di lab TLM SMK Kes. Bhakti Kencana
Subang sebagai berikut
a. Urin Rutin
1) Makroskopis
Metode
Organoleptis
Tujuan
Mengidentifikasi sifat-sifat fisik urine
Prinsip
Pemeriksaan fisik urine berdasarkan pengamatan penginderaan
Prosedur
Warna
a) Masukkan urine segar ke dalam tabung reaksi
b) Amati warna urine dengan pencahayaan yang terang
Bau
a) Masukkan urine segar ke dalam tabung reaksi
b) Miringkan dan kipas-kipaskan tangan pada permukaan cairan urine
c) Cium bau yang muncul
Kekeruhan
a) Masukkan urine segar ke dalam tabung reaksi
pH
a) Masukkan urine segar ke dalam tabung reaksi
b) Celupkan carik pH universal ke dalam urine, tiriskan
c) Amati adanya perubahan warna pada carik pH tersebut
d) Bandingkan warna carik pH terhadap warna standar pH
Berat Jenis
a) Masukkan urine segar ke dalam labu urinometer sebanyak ¾ bagian
b) Catat suhu tera urinometer
c) Amatai skala pada urinometer
d) Ukur suhu urine dengan termometer
e) Masukkan urinometer ke dalamnya, putar
f) Amati miniscus cairan pada skala beberapa saat urinometer berada di tengah
cairan
g) Hitung berat jenis urine sebenarnya
2) Mikroskopis
Metode
Mikroskopis
Tujuan
Mengidentifikasi unsur-unsur patologis urine
Prinsip
urine mengandung elemen – elemen sisa hasil metabolisme didalam tubuh, elemen
tersebut ada yang secara normal dikeluarkan secara bersama – sama urine tetapi ada
dari urine dengan jalan dicentrifuge. Elemen akan mengendap dan endapan dilihat
dibawah mikroskop
Prosedur
Kocok urine dalam wadah penampung sampai homogen
a) Pindahkan urine ke dalam tabung sentrifuge sebanyak 5-7 mL
b) Sentrifugasi urine selama 5 menit dengan kecepatan 2000rpm
c) Angkat tabung dari sentrifuge, tuangkan supernatan urine dan sisakan bagian
endapan sekitar 0,5 mL
d) Kocok sedimen agar homogen
e) Tambahkan larutan pewarna sebanyak 2 tetes
f) Ambil dengan pipet tetes, teteskan pada objek glass, tutup dengan cover glass
g) Amati sedimen dibawah mikroskop dengan perbesaran obyektif 10x untuk
silinder, epithel dan kristal abnormal, obyektif 40x untuk eritrosit, leukosit,
kristal normal, bakteri, jamur, trichomonas, sperma, dll
3) Glukosa Urin
Metode
Benedict (uji reduksi urine)
Tujuan
Mengidentifikasi glukosa dalam urine secara semi kuantitatif
Prinsip
Glukosa dalam urine akan mereduksi CuSO4 dalam suasana basa kuat dan panas
membentuk Cu2O yang mengendap dan berwarna kuning sampai merah bata
Prosedur
a) Pipet 5 ml larutan Benedict dengan pipet ukur / gelas ukur
b) Masukkan ke dalam tabung reaksi
c) Tambahkan 8-10 tetes sampel urine ke dalam larutan tersebut
d) Kocok sampai homogen
e) Panaskan diatas api bunsen secara hati-hati sampai mendidih
f) Angkat dan letakkan dalam rak tabung reaksi
g) Biarkan agak dingin, amati warna endapan yang terbentuk
4) Protein Urin
Metode
Bang
Tujuan
Mengidentifikasi protein dalam sampel urine secara semi kuantitatif
Prinsip
Protein dalam urine akan membentuk kekeruhan atau gumpalan berwarna putih oleh
asam mendekati isoeletrik protein dibantu dengan pemanasan, sehingga terbentuk
kekeruhan, butiran, kepingan atau gumpalan sesuai dengan banyaknya kandungan
protein dalam urine.
Prosedur
a) Pipet 5 ml urine, masukkan ke dalam tabung reaksi
b) Tambahkan 0,5 ml reagen Bang ke dalam urine tersebut
c) Kocok hingga homogen
d) Panaskan di atas api bunsen dengan hati-hati, sampai mendidih
5) Bilirubin Urin
Metode
Harrison
Tujuan
Memeriksa ada tidaknya bilirubin dalam urine sampel yang diukur secara kualitatif
Prinsip
Barium Chlorida (BaCl2) bereaksi dengan sulfat yang ada dalam urine membentuk
endapan Barium Sulphat (BaSO4), bilirubin akan menempel pada molekul ini. FeCl2
yang ditambahkan akan mengoksidasi bilirubin menjadi biliverdin yang berwarna
hijau dan billicyanin yang berwarna biru.
Prosedur
a) Pipet 5 ml urine dan masukkan ke dalam tabung reaksi
b) Tambahkan 5 ml larutan Barium Clorida (BaCl2) 5%
c) Kocok sampai homogen
d) Saring sampai didapatkan presipitat (endapan)
e) Presipitat yang ada pada kertas saring biarkan sampaikan kering
f) Teteskan 1 tetes reagen Fouchet pada presipitat
g) Amati adanya biru kehijauan pada presipitat menunjukkan hasil yang positif
6) Benda Keton
Metode
Tujuan
Memeriksa ada tidaknya benda-benda keton dalam urine sampel yang diukur secara
kualitatif
Prinsip
Natrium Nitroprusid (oksidator kuat) akan bereaksi dengan asam asetoasetat dan
aseton dalam suasana basa dan akan membentuk senyawa yang berwarna ungu.
Prosedur
a) Pipet 5 ml urine dan masukkan ke dalam tabung reaksi
b) Tambahkan sekitar 1 gram Rothera (seujung spatel)
c) Kocok sampai homogen
d) Tambahkan perlahan-lahan 1 – 2 ml larutan NH4OH pekat melalui dinding
tabung yang dimiringkan
e) Tegakkan tabung dan biarkan selama 5 menit
f) Amati adanya cincin berwarna ungu diantara dua lapisan menunjukkan hasil
pemeriksaan yang positif
7) Carik Celup
Metode
Carik celup (reaksi enzimatik)
Tujuan
Mengidentifikasi sifat-sifat fisika dan kimia urine menggunakan metode automatic
Prinsip
Glukosa
Prinsip : D-Glukosa dioksidasi menjadi D-Glikonolakton. dengan adanya
peroksidase akan mengoksidasi indikator membentuk warna hijau.
Bilirubin
Prinsip : Bilirubin dengan garam diazonium yang stabil (2,6
diklorobenzen-diazonium fluorobat) dalam suasana asam akan membentuk warna merah violet.
Keton
Prinsip : Na-nitroprusid (oksidator kuat) bereaksi dengan asam aceto acetate atau
aseton dalam suasana basa akan membentuk senyawa berwarna ungu.
Berat Jenis / BJ
Prinsip : Brom thymol blue bereaksi dengan methyl, vinyl, ether maleic acid sodium
salt yang berada di dalam urin dengan berat jenis > / 6,5.
Darah / Blood
Prinsip : Hemoglobin merubah H2O2 menjadi H2O dan On, On akan bereaksi dengan
reagen benzedin yang menghasilkan warna hijau biru
pH
Prinsip : Indicator Methyl red dan Bromthymol blue, memungkinkan perubahan
warna yang jelas, dari orange, hijau menjadi biru pada pH 5-9.
Protein
Prinsip : 3, 3', 5, 5' tetraklorofenol-3,4,5,6 tetra bromosulfoftalein dalam suatu
system buffer yang mempertahankan pH konstan, bereaksi dengan protein akan
Urobilinogen
Prinsip : Urobilinogen bereaksi dengan p-dietilamino benzaldehid dalam suasana
asam akan membentuk senyawa berwarna merah.
Nitrit
Prinsip : Sulfanilamid aromatic 3-hidroksi-1,2,3,4 tetrahidrobenzokuinolin dan asam
tartrat, bila bereaksi dengan nitrit menghasilkan zat warna azo, intensitas warna
azo/merah tersebut menjadi ukuran konsentrasi nitrit dalam urin.
Leukosit
Prinsip : Indoksil asam karbonat ester yang tidak berwarna diuraikan oleh esterase
(granulosit) menghasilkan indoksil bebas bereaksi dengan garam diazonium
membentuk senyawa berwarna violet
Prosedur
a) Masukkan sampel urine ke dalam tabung reaksi sampai 2/3 tabung reaksi
b) Masukkan carik celup ke dalam urine sampai seluruh kotak isap dalam strip
terendam urine
c) Kelebihan urin pada bagian belakang carik dihilangkan dengan cara menyimpan
carik tersebut pada kertas agar menyerap urin dibagian tersebut
d) Peganglah carik secara horizontal dan banding kan dengan standar warna yang
terdapat pada label wadah carik dan catat hasilnya dengan waktu seperti yang
b. Feses Rutin
1) Makroskopis
Metode
manual
Tujuan
Mengidentifikasi sifat-sifat fisik faeces
Prinsip
Pengamatan sifat makrokopis faeces melalui proses penginderaan.
Prosedur
Warna
a) Amati warna faeces dalam wadah tersebut
b) Catat hasil pengamatan
Bau
a) Kibaskan tangan pada permukaan wadah
b) Catat bau yang ada
Konsistensi
a) Kibaskan tangan pada permukaan wadah
b) Catat bau yang ada
Lendir
a) Angkat sedikit faeces dengan lidi/pnegaduk
b) Amati apakah terdapat lendir pada feces
c) Catat hasil pengamatan
Darah
a) Angkat sedikit faeces dengan lidi/pnegaduk
c) Catat hasil pengamatan
Parasit
a) Amati sampel faeces apakah terdapat parasit/cacing
b) Catat hasil pengamatan
2) Mikroskopis
Metode
manual
Tujuan
Mengidentifikasi sifat-sifat fisik faeces dan bagian-bagian mikroskopis dalam faeces
Prinsip
Pengamatan bagian-bagian faeces melalui pengamatan mikroskopis.
Prosedur
a) Siapkan 4 objek glass
b) Tetesi masing-masing 1 tetes zat warna eosin, lugol, sudan III dan asam asetat
glasial pada permukaan objek glass
c) Ambil seujung lidi, campurkan dengan masing-masing tetesan zat warna
tersebut
d) Aduk sampai menjadi suspensi yang rata dan tipis
e) Tutup suspensi dengan cover glass
f) Amati masing-masing sediaan dengan perbesaran 100x; untuk pengamatan
lemak, serat tumbuhan, karbohidrat dan kristal
g) Lanjutkan dengan perbesaran 400x untuk pengamatan telur cacing, sel eritrosit
dan leukosit, sel epithel, makrofage, amoeba dan sel ragi
3) Darah Samar
Metode
Benzidine
Tujuan
Mengidentifikasi darah yang tercampur di dalam faeces
Prinsip
Haemoglobine sebagai peroksidase akan menguraikan H2O2 menjadi H2O dan On.
On yang terbentuk akan mengoksidasi benzidine membentuk warna biru.
Prosedur
a) Buat emulsi faeces dengan aquadest atau larutan garam fisiologis sebanyak 10
mL, panaskan hingga mendidih
b) Saring emulsi yang masih panas dan biarkan filtrat sampai menjadi dingin
kembali
c) Ke dalam tabung reaksi lain, masukkan serbuk benzidine basa seujung spatula
d) Tambahkan dengan hati-hati asam asetat glasial sebanayak 3 mL
e) Kocok hingga benzidine larut
f) Tambahkan 2 mL filtrat faeces yang telah dingin aduk
g) Tambahkan 1 mL larutan H2O2 3%, aduk
h) Hasil dibaca dalam waktu 5 menit (jangan lebih)
4) Stercobilin
Metode
Tujuan
Mengidentifikasi stercobilin dalam sampel faeces
Prinsip
Stercobilin dengan HgCl2 bila dibiarkan akan menjadi berwarna merah
Prosedur
a) Masukkan 1 spatula faeces ke dalam cawan
b) Tambahkan HgCl2 jenuh, campurkan
c) Panaskan
d) Amati ada tidaknya stercobilin
c. Narkoba
Metode
Immunokromatografi
Tujuan
Untuk mengetahui ada tidaknya narkoba pada sampel urine
Prinsip
Pada strip mengandung konjugat grugs IgG anti narkoba, dimana urine yang
mengandung narkoba (AMP/THC/MOR) akan bereaksi dengan konjugat, dan hasil
positif ditandai dengan terbentuknya garis merah pada control, hasil negative terbentuk
garis merah pada control dan test.
Prosedur
1) Tempat wadah sampel urine di atas meja kerja mendatar
2) Celupkan strip Narkoba ke dalam urine, jangan melebihi batas S
3) Diamkan selama 1 menit
3.3.5 Kimia Klinik
Pemeriksaan Kimia Klinik merupakan salah satu pemeriksaan yang sering dilakukan oleh
petugas laboratorium khususnya yakni analis kesehatan maupun analis medik. Pemeriksaan
kimia klinik sering diminta oleh para dokter untuk mendiagnosa suatu penyakit yang ada
pada pasien.
Berikut pemeriksaan kimia klinik yang dilakukan di lab TLM SMK Kesehatan Bhakti
Kencana Subang
a. Protein Total
Metode
Biuret
Tujuan
Mengukur kadar protein dalam sampel darah
Prinsip
Ikatan peptida dalam suasana basa akan membentuk senyawa kompleks yang berwarna
ungu dengan adanya pereaksi biuret, intensitas warna yang terjadi setara dengan kadar
protein total dalam sampel dan diukur dengan menggunakan Fotometer pada panjang
gelombang 546 nm.
Prosedur
Blanko Standar Sampel
standar - 20 Μl -
Serum - - 20 L
larutan kerja 1.000 L 1.000 L 1.000 L
2) Inkubasi selama 10 menit pada suhu 20 -25OC
3) Ukur blanko, standar dan sampel pada 546 nm
4) Warna stabil sampai 60 menit
b. Albumin
Metode
BCG (Brom Cresol Green)
Tujuan
Mengukur konsentrasi albumin dalam sampel serum
Prinsip
Albumin dengan BCG pada suasana pH 4n2 dan buffer sitrat akan membentuk
kompleks berwarna hijau-biru. Intensitas warna yang terjadi sebanding dengan
konsentrasi albumin dalam sampel, yang diukur pada 578 nm.
Prosedur
Blanko Standar Sampel
standar - 10 L -
Serum - - 10 L
larutan kerja 1.000 L 1.000 L 1.000 L
1) Campur sampai homogen
2) Inkubasi selama 3 menit pada suhu 20 -25OC
c. Glukosa Darah
Metode
GOD-PAP (Glukosa Oksidase Para Amino Phenazone)
Tujuan
Mengukur kadar glukosa puasa (8-10 jam) dan kadar glukosa 2 jam setelah makan
Prinsip
Glukosa dioksidasi oleh enzim glukosa oksidase (GOD) membentuk asam glukonat dan
hidrogen peroksida. Hidrogen peroksida yang terbentuk bereaksi dengan phenol dan
4-amino phenazone dengan bantuan enzim peroksidase menghasilkan kinonimin yang
berwarna merah muda dan dapat diukur dengan photometer pada 546 nm. Intensitas
warna yang terbentuk setara dengan kadar glukosa darah yang terdapat dalam sampel.
Reaksi:
GOD
Glukosa asam glukonat + 4 H2O2
peroksidase
2 H2O2 + phenol + 4-amino phenazone kinonimin + 4 H2O
(merah muda)
Prosedur
Blanko Standar Sampel
standar - 10 L -
Serum - - 10 L
1) Campur sampai homogen
2) Inkubasi selama 20 menit pada suhu 20 -25OC
3) Ukur blanko, standar dan sampel pada 546 nm
d. Kolesterol Total
Metode
CHOD-PAP
Tujuan
Mengukur kadar cholesterol dalam sampel darah
Prinsip
Ester cholesterol dengan adanya enzim cholesterol esterase diubah menjadi cholestrol
dan asam amino bebas. Cholesterol yang terbentuk dioksidasi dengan bantuan
cholestrol oksidase membentuk cholestenon dan H2O2. H2O2 yang terjadi bereaksi
dengan phenol dan dengan bantuan peroksidase membentuk kinonimin yang bewarna
merah muda.
Ester cholesterol cholesterol + asam lemak bebas
Cholesterol oksidase
Cholesterol + O2 cholesten-3,4-on + H2O2
peroksidase
Prosedur
Blanko Standar Sampel
standar - 10 L -
Serum - - 10 L
larutan kerja 1.000 L 1.000 L 1.000 L
1) Campur sampai homogen
2) Inkubasi selama 10 menit pada suhu 20 -25OC
3) Ukur blanko, standar dan sampel pada 546 nm
e. Trigliserida
Metode
GPO-PAP
Tujuan
Mengukur kadar trigliserida dalam sampel darah
Prinsip
Trigliserida dengan adanya enzim lipoprotein lipase (LPL) diubah menjadi gliserol dan
asam amino bebas. Gliserol yang terbentuk direaksikan dengan ATP dan bantuan enzim
glisero kinase membentuk gliserol-3-phosphat dan ADP. Gliserol-3-phosphat
dioksidasi dengan bantuan enzim gliserolphosphat oksidase menjadi dihidroksi aseton
phosphat dan H2O2. H2O2 yang terjadi akan dioksidasi klorophenol dan 4-amino
antipirin dengan bantuan enzim peroksidase membentuk kinonimin yang berwarna
merah muda. Intensitas warna merah muda sebanding dengan konsentrasi trigliserida
Reaksi:
LPL
Trigliserida gliserol + asam lemak bebas
GK
Gliserol + ATP gliserol-3-phosphat + ADP
GPO
gliserol-3-phosphat + O2 dihidroksi aseton phosphat +
H2O2
POD
2H2O2 + phenol + 4-aminoantipirin kinonimin + 4 HCl + 4 H2O
(merah muda)
Prosedur
Blanko Standar Sampel
standar - 10 L -
Serum - - 10 L
larutan kerja 1.000 L 1.000 L 1.000 L
1) Campur sampai homogen
2) Inkubasi selama 10 menit pada suhu 20 -25OC
3) Ukur blanko, standar dan sampel pada 546 nm
f. HDL
Metode
CHOD-PAP
Tujuan
Prinsip
LDL dan VLDL diendapkan oleh polianion dan Magnesium klorida, setelah dilakukan
sentrifugasi, HDL tetap berada dalam larutan. HDL-cholesterol ditentukan dengan
metode CHOD-PAP.
Prosedur
1) Serum atau plasma 200 uL
2) Larutan pengendap 500 uL
3) campur, biarkan selama 10 menit pada suhu kamar, sentrifuge selama 10 menit
4000 rpm, atau 2 menit 12.000 rpm
4) Pipet ke dalam tabung, sebagai berikut:
Blanko Reagen Sampel
Supernatan 100 L -
Aquabidest - 100 L
Reagen cholestero 1.000 L 1.000 L
5) Campur sampai homogen
6) Inkubasi selama 10 menit pada suhu 37OC
7) Baca absorban sampel terhadap blanko reagen pada 546 nm
g. LDL
Metode
CHOD-PAP
Tujuan
Prosedur
Mengukur kadar ureum dalam sampel darah
Prinsip
Urease menghidrolisis urea menjadi ion amonium dan karbondioksida. Ion amonium
selanjutnya akan membentuk senyawa yang berwarna dengan salisilat dan klorida.
Intensitas warna yang terbentuk setara dengan kadar urea dalam sampel, yang diukur
pada 578 nm.
Campur sampai homogen
Inkubasi selama 4 menit pada suhu kamar
Campur, inkubasi selama 8 menit pada temperatur kamar, baca absorbans sampel dan
standar terhadap blanko reagen pada 578 nm
i. Kreatinin
Metode
Jaffe Reaction (fixed time)
Tujuan
Mengukur kadar kreatinine dalam sampel darah
Prinsip
Kreatinine akan bereaksi dengan asam pikrat dalam suasana alkali membentuk
kompleks yang berwarna kuning jingga, dengan salisilat dan klorida. Intensitas warna
yang terbentuk sesuai dengan kadar kreatinine dalam sampel, diukur pada 4λ0 nm.
Prosedur
Blanko Standar Sampel
Aquadest 10 L - -
Standar - 10 L -
Serum - - 10 L
Pereaksi 1.000 L 1.000 L 1.000 L
1) Campur sampai homogen
2) Inkubasi selama 2 menit pada suhu kamar
3) Baca absorbans standar dan sampel (A1) terhadap blanko pada 4λ0 nm, tepat 5
menit
j. Asam Urat
Metode
Uricase
Tujuan
Mengukur kadar asam urat dalam sampel darah
Prinsip
Dengan adanya uricase, asam urat diubah menjadi allantoin dan peroksidase.
Selanjutnya dengan bantuan enzim peroksidase, peroksida akan bereaksi dengan
kromogen dan 4-aminoantipirin membentuk senyawa yang berwarna merah muda.
Intensitas warna yang terbentuk sebanding dengan kadar asam urat dalam sampel yang
dapat diukur pada 546 nm.
Reaksi:
uricase
Asam urat alantoin + peroksida
peroksidase
Peroksida + kromogen + amino antipirin kinonimin
Prosedur
Blanko Standar Sampel
Aquadest - - -
Standar - 20 L -
Serum - - 20 L
1) Campur sampai homogeny
2) Inkubasi selama 5 menit pada suhu kamar
3) Baca absorbans standar dan sampel (A1) terhadap blanko pada 546 nm, warna
stabil selama 30 menit
k. Bilirubin Total
Metode
Metode fotometrik modifikasi Jendrassik/Grof
Tujuan
Untuk mengetahui kadar Bilirubin Direct (D) dan Bilirubin Total (T)
Prinsip
Bilirubin bereaksi dengan Diazolyzed Sulphanilic Acid (DSA) membentuk larutan azo
berwarna merah. Absorbansi warna yang terbentuk pada ʎ 546 nm sesuai dengan kadar
bilirubin dalam sampel. Bilirubin glucoronida yang larut dalam air bereaksi langsung
(direct) dengan DSA sedangkan bilirubin yang terikat pada albumin bereaksi tak
langsung (indirect) dengan DSA dengan adanya acellerator. Total bilirubin = bilirubin
direct + bilirubin indirect.
Prosedur
1) Persiapan Sampel
Blanko Sampel
Reagen total nitrit - 40 l
Reagen total bilirubin 1000 l 1000 l
Campur, inkubasi selama 5 menit