7 BAB II TINJAUAN TEORI 2.1. Telaah Pustaka 2.1.1. Timus A. Anatomi Timus.
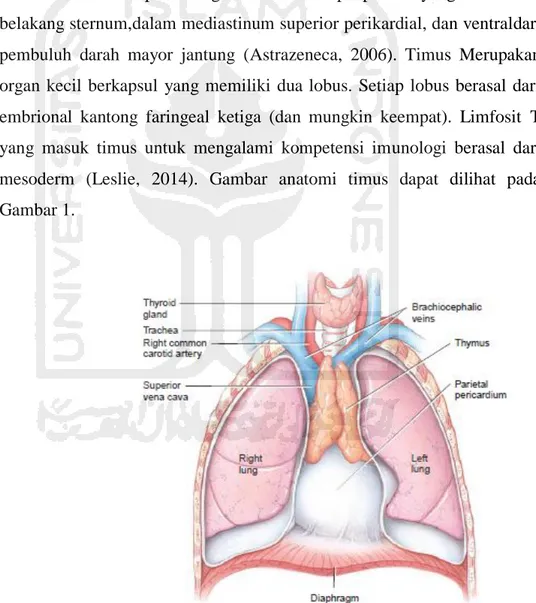
Timus merupakan organ bilateral limpoepitelial yang terletak di belakang sternum,dalam mediastinum superior perikardial, dan ventraldari pembuluh darah mayor jantung (Astrazeneca, 2006). Timus Merupakan organ kecil berkapsul yang memiliki dua lobus. Setiap lobus berasal dari embrional kantong faringeal ketiga (dan mungkin keempat). Limfosit T yang masuk timus untuk mengalami kompetensi imunologi berasal dari mesoderm (Leslie, 2014). Gambar anatomi timus dapat dilihat pada Gambar 1.
Gambar 1. Anatomi Timus pada orang dewasa (Tortora & derickson, 2011)
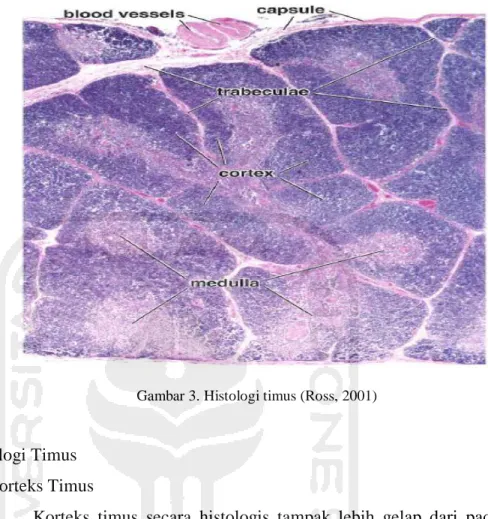
Timus terdiri dari dua lobus yang dibungkus oleh kapsul yang terdiri atas jaringan ikat kolagen padat dan tidak teratur. Perluasan kapsul yang disebut trabekula yang membentuk septa menembus kedalam parenkim lobus dan membagi lobus menjadi lobulus yang inkomplet dengan kontinuitas antara korteks dan medula lobulus yang berdekatan, trabekula terdiri atas serat-serat kolagen dengan sedikit serat elastin dan septa interlobular meluas menyusup dari simpai sampai ke medula dan memisah-misahkan lobulus satu terhadap lainnya (Mescher, 2012). Setiap lobulus memiliki daerah tepi yang gelap dan dikenal sebagai korteks dan bagian pusat yang terang disebut medula (Gambar 2 dan 3) (Tortora, 2011).
Gambar 3. Histologi timus (Ross, 2001)
B. Histologi Timus 1. Korteks Timus
Korteks timus secara histologis tampak lebih gelap dari pada medula karena keberadaan sejumlah besar limfosit T (timosit). Sel T yang inkompeten secara imunologis meninggalkan sumsum tulang dan bermigrasi ke perifer korteks timus kemudian membelah dengan mitosis, tempat mereka mengalami proliferasi yang ekstensif dan diarahkan menjadi sel T yang imunokompeten. Selain limfosit, korteks mengandung makrofag dan sel retikulem epitel. Pada manusia dipercaya bahwa sel retikulum epitelial berasal dari endoderm kantung faring ketiga (dan mungkin keempat). Terdapat tiga tipe sel retikulum epitelial dalam korteks timus:
Sel tipe I memisahkan korteks dari kapsul jaringan ikat dan trabekula dan mengelilingi unsur vaskular dalam korteks. Sel ini membentuk zonula okludens/ tight junction satu sama lain, mengisolasi korteks timus secara menyeluruh dari bagian tubuh lain..
Sel tipe II terletak pada daerah korteks pertengahan (midcortex).
Sel ini mempunyai prosesus panjang lebar seperti lembaran yang membentuk taut desmosom satu sama lain. Prosesus membentuk sitoretikulum yang membagi korteks timus menjadi kompartemen berukuran kecil yang berisi limfosit.
Sel tipe III terletak pada korteks bagian dalam dan pada perbatasan dengan medula. Sel ini membentuk zonula okludens satu sama lainnya dan juga dengan sel retikulum epitelial di medula sehingga mengisolasi korteks dari medula.
Ketiga tipe sel retikulum epitelial mengisolasi korteks timus secara sempurna, sehingga mencegah sel T yang sedang berkembag berhubungan dengan antigen asing. Sel tipe II dan III serta sel interdigitas turunan dari sumsum tulang (APC) juga menyajikan antigen diri sendiri, molekul major histocompability complex I (MHC I), dan molekul major histocompability complex II (MHC II) kepada sel T yang sedang berkembang.
T cell receptor (TCR) limfosit T yang sedang berkembang mengenali protein diri sendiri, atau molukel CD4 atau CD8 nya tidak dapat mengenali molekul major histocompability complex I (MHC I) atau MHC II, akan mengalami apoptosis sebelum meninggalkan korteks. 98% sel T yang berkembang akan mati atau apoptosis dalam korteks dan kemudian difagositosis oleh makrofag, yang juga disebut sebagai makrofag yang dapat diwarnai (tinjibel/tingible body macrophage).
Sel yang bertahan hidup masuk ke medula timus sebagai limfosit T naive, dan dari sana (atau dari daerah pertemuan kortikumedular) sel tersebut didistribusikan ke organ limfoid sekunder melalui sistem vaskular (Leslie, 2014).
2. Medula Timus
Medula timus terwarnai jauh lebih pucat daripada korteks karena populasi limfosit tidak padat dan karena mengandung sejumlah besar sel retikulum epitelial yang berasal dari endotel. Terdapat tiga tipe sel retikulum epitelial pada medula:
Sel tipe IV berhubungan erat dengan sel tipe III pada korteks dan membantu pembentukan perbatasan kortikomedular. Sel tipe V membentuk sitoretikulum medula.
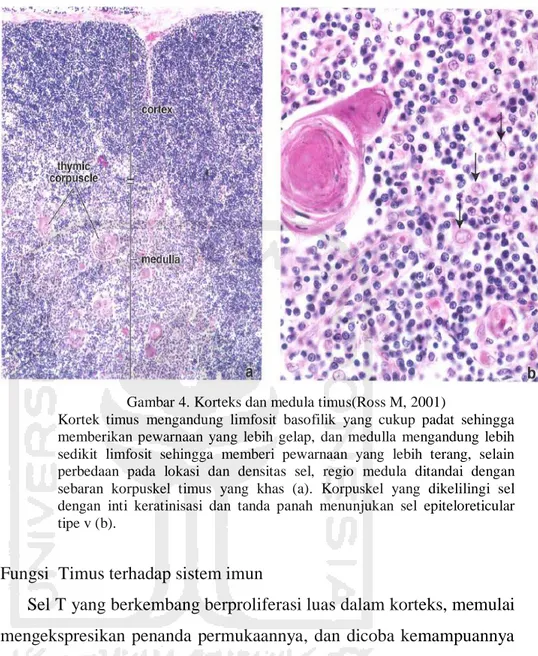
Sel tipe VI menyusun sebagian besar gambaran medula timus. Sel pucat berukuran besar ini menyatu sama lain, membentuk korpuskula hassalyang merupakan ciri khas dari daerah medula. Jumlahnya meningkat seiring pertambahan usia, selama masa penghancuran timosit dan selama involusi. Korpuskula hassalmengandung sel retikular epitelial pipih yang tersusun konsentris dan dipenuhi filamen keratin dan menjadi terkalsifikasi. Fungsi korpuskula hassalyang khas pada manusia belum dipastikan (Leslie, 2014). Gambaran Histologi timus korteks dan medula timus dapat dilihat pada Gambar 4.
Gambar 4. Korteks dan medula timus(Ross M, 2001)
Kortek timus mengandung limfosit basofilik yang cukup padat sehingga memberikan pewarnaan yang lebih gelap, dan medulla mengandung lebih sedikit limfosit sehingga memberi pewarnaan yang lebih terang, selain perbedaan pada lokasi dan densitas sel, regio medula ditandai dengan sebaran korpuskel timus yang khas (a). Korpuskel yang dikelilingi sel dengan inti keratinisasi dan tanda panah menunjukan sel epiteloreticular tipe v (b).
3. Fungsi Timus terhadap sistem imun
Sel T yang berkembang berproliferasi luas dalam korteks, memulai mengekspresikan penanda permukaannya, dan dicoba kemampuannya untuk mengenali molekul MHC diri sendiri dan epitop diri sendiri. Sel T yang tidak dapat mengenali molekul MHC-I diri sendiri dan molekul MHC-II diri sendiri dihancurkan secara apoptosis. Kemudian, limfosit T yang TCR-nya direncanakan untuk melawan makromolekul diri sendiri juga dihancurkan. Tahap edukasi timus dapat dilihat pada Gambar 7.
Gambar 5. Tahap edukasi timus (Ross M, 2001)
Selama kehidupan fetal, timus berpopulasikan sel stem lympoid potensial yang berasal dari sum-sum tulang dan kemudian berkembang menjadi sel T imunokompeten yang disebut edukasi sel timus. Proses ini ditandai dengan ekspresi dan delesi antigen permukaan CD spesifik.
stem sel memasuki medula melalui venula postkapiler dan kemudian bermigrasi ke lobus timus perifer, sel akan mengekspresikan molekul CD4 dan CD7 pada permukaan sel yang menandakan tahap awal deferensiasi (double stage), diikuti dengan ekspresi molekul CD1 yang menandakan tahap pertengahan deferensiasi sel T. Saat proses maturasi, sel mengekspresikan TCRs, CD3, dan kedua molekul CD4 dan CD8 (double positive stage). Kemudian sel ini dipresentasikan dengan antigen diri sendiri dan asing oleh sel epitelioretikular tipe II dan III, jika limfosit mengenali “self” molekul MHC dan “self” antigen asing maka akan bertahan (positive selection), jika tidak sel akan mati. Sel yang melalui tes seleksi positif
meninggalkan korteks dan masuk kembali ke medula, disini sel mengalami proses seleksi lainnya, sel yang mengenali “diri” antigen dan menunjukan molekul MHC (negative selection). Sel yang bertahan akan menjadi limfosit TCD8+ sitotoksik (dengan kehilangan CD4 dan mempertahankan CD8) atau limfosit T helper CD4+ (dengan kehilangan CD8 dan mempertahankan CD4) stage ini disebut dengan
single positive stage. Sekarang sel meninggalkan timus dari medula ke sirkulasi darah. Proses edukasi sel timus ini didukung oleh sekresi substansia dari sel epitelioretikular yang meliputi; interleukin, colony stimulating factor, interleukin gama, timotin dan timopoetin (Ross, 2001).
Sel retikulum epitelial timus memproduksi setidaknya empat hormon yang penting untuk pematangan sel T. Hormon tersebut bersifat parakrin yang beraksi jarak pendek, akan tetapi sebagian hormon tersebut diduga juga dilepaskan ke dalam aliran darah. Keempat hormon ini ialah timosin, timopoietin, timulin, dan faktor humoral timus, dan hormon ini memfasilitasi proliferasi sel T dan ekspresi penanda permukaannya. Hormon dari luar timus terutama dari gonad dan hipofisis, tiroid dan suprarenal, mempengaruhi pematangan sel T. Efek yang paling poten disebabkan oleh adrenokortikosteroid yang menurunkan jumlah sel T dalam korteks timus, tiroksin yang merangsal sel retikulum epitelial korteks untuk meningkatkan produksi timulin dan somatotropin yang mempromosikan perkembangan sel T pada korteks timus (Victor, 2010).
4. Timus pada orang tua
Timus merupakan salah satu organ yang kehilangan fungsi dengan peningkatan usia berhubungan dengan penggantian lingkungan dengan jaringan adiposa. Timus mengalami perubahan dramatis pada saat penuaan yaitu terjadi peningkatan progresif adiposit di parenkim, septa, korteks, dan medula timus dengan hilangnya epitelial, zona timic lympopoietic T, dan penurunan sel progenitor timosit.
Ukuran maksimal timus terjadi pada masa pubertas kemudian timus akan mengalami atrofi atau involusi, ditandai dengan karakteristik infiltrasi kelenjar oleh jaringan fibrous dan lemak serta berkurangnya masa seluler. Sentrum germinativum jumlahnya berkurang dan menjadi fibrotik serta kalsifikasi atau disebut dengan korpuskel hasall.
sel epitelial timus akan mengalami transisi menjadi fibroblas melalui proses epitelial mesenkimal transisi (EMT) (Hyunwon et al., 2009) sehingga akan meningkatkan pembentukan korpuskula hassal yang terbentuk dari sel-sel retikular epitelial gepeng (sel epitelial tipe VI) yang mengalami fibrotik, keratinisasi dan terkalsifikasi pada medula timus (Leslie, 2014; Mescher 2012).
2.1.2. Puasa
A. Pengertian Puasa
Puasa (Restriksi kalori) atau pembatasan diet merupakan metode pembatasan jumlah makanan yang dikonsumsi. Trepanowski et al., (2011) menjelaskan bahwa restriksi diet adalah pengurangan jumlah kalori yang masuk ke tubuh (sekitar 20-40% dari intake harian yang biasa dikonsumsi) dengan tetap menjaga kecukupan nutrisi yang dibutuhkan oleh tubuh. Metode restriksi diet sendiri bermacam-macam, antara lain:
alternate-day fasting, yaitu satu hari mengkonsumsi makanan tanpa pembatasan (kadang-kadang justru diberikan dua kali lipat intake
biasanya) dan satu hari penuh makanan dikurangi (Trepanowski et al., 2011). Cara yang lain adalah hewan coba dipuasakan (tidak diberi makanan apapun) selama beberapa jam. Lama berpuasa pun berbeda-beda (Hiragane and Ono, 2003).
Puasa (intermitten fasting) adalah intervensi diet yang sering digunakan sebagai alternatif untuk pembatasan kalori dan ditandai dengan siklus bergantian atau selang-seling antara makan ad libitum dan puasa (Chausse et al., 2015).
B. Manfaat Puasa
Manfaat puasa atau intermitten fasting telah banyak diteliti, beberapa penelitian telah meneliti beberapa manfaat puasa diantaranya;
a. Detoksifikasi
Puasa meningkatkan produksi substansia antioksidan dan anti inflamasi yang bermanfaat mencegah kanker, anti aging dan proteksi terhadap berbagai penyakit yang disebabkan oleh spesies oksigen reaktif dan inflamasi (He wen et al., 2013).
b. Menambah jumlah sel darah putih dan meningkatkan sistem imun Profesor Valter Longo, peneliti Gerontology dan Biological sciences di university of california mengatakan bahwa puasa akan memberikan perintah pada sel-sel induk (hematopoietic stem cell)
untuk terus memproduksi sel leukosit dan membangun regenerasi sistem imun secara menyeluruh. Selain itu tubuh juga akan mampu menyingkirkan bagian-bagian dari sistem yang mungkin rusak atau tua, atau yang tidak efisien. Ketika lapar, sistem tubuh akan mencoba untuk menghemat energi. Dan salah satu yang dapat dilakukan adalah dengan mendaur ulang banyak sel-sel imun yang tidak diperlukan (Adam et al., 2014).
Puasa menyebabkan peningkatan faktor orexigenik seperti NPY, AGRP, dan ghrelin dan mengurangi hormon anorexigenik seperti leptin pada tikus. Ghrelin potensial menghambat pelepasan sitokin
proinflamasi dari sel T, monosit, dan sel endotelial dan meningkatkan tymopoesis. Selain itu puasa dapat mengurangi jumlah adiposit di timus, meningkatkan jumlah sel T naive, dan mencegah kehilangan timus epitelial sel (TEC) di korteks dan di medulla serta mereduksi fibroblas (Hyunwon et al., 2009).
Pembatasan diet meningkatkan Hormon ghrelin yang berguna untuk mengatur fungsi kekebalan tubuh, mengurangi sitokin proinflamasi dan meningkatkan thymopoiesis selama penuaan.
Retriksi diet juga meningkatkan adenosine monophospate (AMP) yang mengaktivasi activated protein kinase (AMPK). AMPK menghambat NF-ĸB yang meningkatkan transkripsi sitokin proinflamasi sehingga AMPK memegang kunci dalam mengurangi respon peradangan. Retriksi diet terbukti pula memperpanjang usia pada berbagai model eksperimental karena retriksi diet dapat meminimalkan jumlah adiposit pada organ limfoid (Dixit, 2008). c. Mencegah berbagai penyakit melalui mekanisme sistem imun
Menunda dan mencegah onset penuaan, kanker, dan penyakit autoimun bergantung limfosit-T, dengan cara meningkatkan efek antioksidan dan menumpulkan mutasi subset limfosit-T dan mutasi DNA. Restiksi diet memiliki efek positif dalam meningkatkan sistem imun melalui peningkatan sel limfosit-T (CD4+, CD8+) di spleen, nodus limfatikus mesentrik, darah perifer, timus dan kelenjar ludah. d. Dalam Mattson et al., 2014 intermitten fasting (IF) menyebabkan
adaptasi molekular, metabolik dan fisiologik. Intermitten fasting dapat mencegah berbagai penyakit kanker, penyakit cardiovaskular, diabetes, dan penyakit neurodegeneratif. Berikut empat mekanisme umum intermitten fasting dapat melindungi sel terhadap injury dan penyakit:
1) Respon stress adaptif.
Intermitten energi restriction and fastting (IER)
sistem organ. Intermitten fasting mencegah penurunan enzim antioksidan superoxide distmutase 1 dan enzim katalase di sel hepar tikus dan meningkatkan enzim antioksidan NADH-cytocrom b5 reduktase dan NAD(P)H-quinone oxidoreductase 1 di sel otot. Selain itu IER dapat melindungi neuron terhadap stres oksidatif, metabolik dan proteotoxic pada hewan yang memiliki penyakit neurodegeneratif meliputi penyakit Alzaimer dan parkinson. IER juga dapat melindungi jantung terhadap kerusakan iskemik pada model hewan yang mengalami infark miokard. IER juga meningkatkan produksi faktor trofik yang mendukung kelangsungan hidup neuron, neurogenesis, dan pembentukan serta penguatan sinaps di otak.
2) Bioenergetik.
IER menunjukan perubahan dalam metabolisme energi yang ditandai dengan peningkatan sensitivitas insulin, menurunkan level insulin dan leptin, mobilisasi asam lemak, meningkatan level keton β-hydroxybutyrate yang diketahui memiliki efek menguntungkan pada sel-sel dengan kebutuhan energi tinggi seperti neuron di otak.
Biogenetika otak juga dapat didukung oleh IER, contohnya;
brain-derived neurotrophic factor (BDNF) yang merupakan upregulasi neuron hipokampus dalam menanggapi IER dan
exercise, mengaktifkan faktor transkripsi CREBS yang kemudian menginduksi proliferator-activated receptor gamma coactivator 1-α (PGC-1α) expression dan biogenesis mitokondria yang sangat penting untuk pembentukan sinaps dalam perkembangan neuron hipokampus dan pemeliharaan sinaps dalam hipokampus tikus dewasa.
IER memiliki fungsi menghambat pertumbuhan berbagai tumor, meliputi neuroblastoma, prostat, kanker payudara dan kanker ovarium. Pergeseran ketogenesis mungkin memainkan
peran penting dalam menekan pertumbuhan tumor, karena sel-sel tumor tidak dapat menggunakan keton sebagai sumber energi. 3) Inflamasi.
Semua penyakit mayor, meliputi penyakit kardiovaskular, diabetes, penyakit neurodegeneratif, arthritis, dan kanker melibatkan inflamasi kronis di jaringan yang terkena dan di banyak kasus sistemik. Inflamasi jaringan lokal melibatkan hiperaktivasi makrofag (mikroglia di otak) yang memproduksi sitokin proinflamasi (TNF, IL-1β, IL-6) dan spesies oksigen reaktif.
Overweight dan obesitas meningkatkan peradangan sedangkan IER akan menekan peradangan pada subjek manusia dan model hewan yang sakit. Wanita obesitas yang mengubah pola makan dengan IER menunjukan penurunan TNF dan IL-6 yang signifikan. Pada pasien asma 2 bulan IER mengurangi sirkulasi TNF dan penanda stres oksidatif, dan memperbaiki gejala asma dan resistensi saluran nafas. Puasa dapat mengurangi gejala pada pasien rheumatoid arthritis, dan data dari penelitian hewan menunjukan bahwa patogenesis gangguan autoimun lain juga dapat dinetralkan dengan IER, meliputi multiple sklerosis, lupus eritematosus, dan diabetes tipe 1. Pada tikus stroke, IER menekan peningkatan TNF dan IL-1β pada iskemik cortex serebral dan striatum yang dikaitkan dengan peningkatan outcome
fungsional.
4) Peningkatan Perbaikan dan Menghilangkan Molekul dan Organel yang rusak.
Sel memiliki mekanisme khusus untuk menghilangkan molekul dan organela yang rusak. Salah satu mekanisme melibatkan molekul “tagging” protein yang rusak dengan ubiquitin, yang ditargetkan untuk didegradasi di proteasom.
Dalam mekanisme autofagi, kerusakan dan disfungsi protein, membran dan organela didegradasi di lisosom.
Intake energi dan nutrien (terutama asam amino) memiliki efek terhadap autofagi. Ketika organisme menelan makanan biasa, sel akan menerima pasokan nutrien yang relatif stabil dimana terjadi sintesis protein dan autofagi di tekan. Nutrient-responsive mTOR jalur negatif mengatur autofagi. Sehingga puasa akan menghambat mTOR pathway dan merangsang autofagi pada sel di banyak jaringan seperti hati, ginjal, dan otot rangka. Dengan cara ini puasa “membersihkan” sel molekul dan organel yang rusak.
Pada tikus yang dipelihara pembatasan energi dietnya (intermitten fasting) menunjukan penurunan akumulasi protein polyubiquitinated dibandingkan dengan tikus yang diberi makanan ad libitum.
2.1.3. Obesitas
A. Definisi Obesitas
Obesitas merupakan kondisi kelebihan akumulasi lemak pada jaringan adiposa. Obesitas tidak hanya berupa kondisi dengan jumlah simpanan kelebihan lemak, namun juga distribusi lemak di seluruh tubuh. Distribusi lemak dapat meningkatkan risiko yang berhubungan dengan berbagai macam penyakit degeneratif.
Keadaan kelebihan kalori kronis seperti pada obesitas dapat menyebabkan perubahan faktor metabolik yang juga dapat mempengaruhi kekebalan tubuh dan usia. Peningkatan leptin sirkulasi dan penurunan ghrelin dan adiponektin dapat meningkatkan peradangan, sebaliknya peningkatan ghrelin dan pengurangan faktor anorexigenik pada retriksi diet mengingkatkan fungsi kekebalan tubuh dan memperpanjang usia (Dixit, 2008)
Keadaan kelebihan kalori kronik saat obesitas mengubah faktor metabolik yang dapat mempengaruhi fungsi imun dan masa hidup. dengan meningkatkan kadar leptin dan menurunkan kadar ghrelin dan adiponektin yang menyebabkan peningkatan inflamasi (Dixit, 2008).
Obesitas merusak regenerasi sistem imun khususnya kemampuan timus untuk memproduksi sel-sel imun, menyebabkan involusi timus dan gangguan respon imun dengan mengeluarkan IFN-α, IFN-β dan menurunkan ekspresi TNF-α dan IL-6.
Obesitas merupakan suatu rangkaian yang kompleks, dimana keadaan metabolik, gangguan pada satu organ dan interaksi selular jaringan dapat mempengaruhi fungsi beberapa sistem organ.
Gambar 6. Interaksi adiposa-imun selama obesitas (Dixit, 2008)
Peptida neuroendokrin yaitu sitokin dan kemokin dipercayai bertanggungjawab mengatur keseimbangan energi terhadap fungsi imun. Interaksi neuroendokrin-imun terjadi selama keadaan energi positif kronik yang terjadi saat obesitas. Obesitas berkaitan dengan keadaan imunodefisiensi dan inflamasi kronik yang berkontribusi meningkatkan risiko kematian prematur.
Interaksi langsung antara populasi leukosit dengan jaringan adiposa selama obesitas dan meningkatnya jumlah adiposa saat penuaan lingkungan lympoid merupakan respon adaptif dan respon patologi yang menyebabkan perubahan keseimbangan energi.
Obesitas adalah suatu keadaan ketidak seimbangan antara energi yang masuk dengan energi yang keluar dalam jangka waktu yang lama. Banyaknya konsumsi energi dari makanan yang dicerna melebihi energi yang digunakan untuk metabolisme dan aktivitas sehari-hari. Kelebihan energi ini akan disimpan dalam bentuk lemak dan jaringan lemak sehingga dapat berakibat pertambahan berat badan. Ukuran untuk menentukan seseorang obesitas umumnya dipakai indeks berdasarkan berat badan dalam kilogram dibagi tinggi badan dalam meter kuadrat, disebut dengan indeks massa tubuh (IMT) atau body mass index (BMI) (WHO, 2006).
B. Pengukuran dan Klasifikasi Obesitas
Indeks Massa Tubuh (IMT) merupakan indeks pengukuran sederhana untuk kekurangan berat (underweight), kelebihan berat (overweight), dan kegemukan/obesitas dengan membandingkan berat badan dengan tinggi badan kuadrat. Status nutrisi atau body mass index menggunakan kriteria WHO dan Asia pada Tabel 1.
Tabel 1. Kriteria body mass index (BMI) berdasarkan kriteria cut off point
WHO dan Asia Nutritional status WHO criteria
BMI cut-off Asian criteria BMI cut-off Underweight < 18.5 < 18.5 Normal 18.5 - 24.9 18.5 – 22.9 Overweight ≥ 25 > 23.0 Obese ≥30 23.0 – 24.9
Obese type 1 (Obese) 30.0 – 34.9 25.0 – 29.9 Obese type 2 (Morbid obese) 35.0 – 39.9 > 30.0
. Mengukur lemak tubuh secara langsung sangat sulit dan sebagai pengukur pengganti dipakai body mass index (BMI) atau indeks massa tubuh (IMT) untuk menentukan berat badan lebih dan obesitas pada remaja dan dewasa. IMT merupakan indikator yang paling sering digunakan dan praktis untuk mengukur tingkat populasi berat badan lebih dan obes pada orang dewasa. Untuk penelitian epidemiologi digunakan IMT atau indeks Quetelet, yaitu berat badan dalam kilogram (kg) dibagi tinggi dalam meter kuadrat (m2).
2.2. Kerangka Teori
2.3. Kerangka Konsep
Variabel pengganggu Terkendali a. Subjek penelitian
1) Jenis kelamin 2) Umur subyek 3) Berat badan subyek b. Perawatan subjek penelitian
1) Makanan 2) Minuman 3) Kandang
Variabel Pengganggu tidak Terkendali 1) Kondisi psikologis Variabel Bebas/Independen Puasa Variabel Terikat/Dependen Jumlah korpuskel hasall Obesitas
meningkatkan jumlah adiposit dalam organ limfoid
Sitokin pro-inflamasi Stress oksidatif
Aging pada timus
Jumlah korpuskel hasall meningkat
2.4. Hipotesis
Terdapat perbedaan jumlah korpuskula hassal tikus putih (Rattus norvegicus) galur Wistar obesitas antara yang dipuasakan dan yang tidak dipuasakan.