PENGUKURAN KONSENTRASI UNSUR Fe PADA AIR DARI SISTEM PENYARINGAN AIR DI KAMPUS III UNIVERSITAS SANATA DHARMA
DENGAN METODE SPEKTROFOTOMETER SERAPAN ATOM (SSA)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Sains (S.Si.)
Program Studi Fisika
Oleh :
Christopher Dwi Andana NIM : 003214020
PROGRAM STUDI FISIKA JURUSAN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SANATA DHARMA
YOGYAKARTA 2007
HALAMAN PERSEMBAHAN
Allah akan meninggikan orang-orang yang beriman di antara kamu dan orang-orang yang diberi ilmu pengetahuan beberapa derajat.
( QS : 58 : 11) Sesungguhnya sesudah kesulitan itu ada kemudahan.
(QS : 94 : 5)
Kupersembahkan untuk:
Bapak – Ibuku sebagai tanda hormat dan baktiku, Kakakku yang selalu kusayang,
Almamaterku tercinta
INTISARI
PENGUKURAN KONSENTRASI UNSUR Fe PADA AIR DARI SISTEM PENYARINGAN AIR DI KAMPUS III UNIVERSITAS SANATA DHARMA
DENGAN METODE SPEKTROFOTOMETER SERAPAN ATOM (SSA)
Telah dilakukan penelitian pengukuran konsentrasi unsur Fe dalam air sampel yang berasal dari sistem penyaringan air di kampus III Universitas Sanata Dharma. Pengukuran dilakukan dengan metode Spektrofotometer Serapan Atom (SSA).
Hasil penelitian berdasarkan pengukuran selama 23 minggu, menunjukkan bahwa konsentrasi rata-rata unsur Fe pada sampel 1 (setelah melewati saringan pasir sebelah selatan), sampel 2 (setelah melewati saringan pasir sebelah utara), sampel 3 (instalasi kamar mandi yang berada di hall lantai dasar), sampel 4 (instalasi kamar mandi yang berada di gedung lantai 4 sebelah laboratorium komputer teknik), dan sampel 5 (instalasi kamar mandi yang berada di gedung lantai dasar sebelah laboratorium bahasa) adalah (0.3±0.2) mg/l, (0.5±0.4) mg/l, (0.3±0.2) mg/l, (0.4±0.2) mg/l, dan (0.3±0.1) mg/l. Dari penelitian tersebut, diketahui bahwa terdapat kecenderungan pengurangan konsentrasi unsur Fe pada air sampel setelah melewati alat penyaringan.
ABSTRACT
THE MEASUREMENT OF Fe CONCENTRATION IN THE WATER FROM THE WATER TREATMENT SYSTEM AT CAMPUS III SANATA DHARMA
UNIVERSITY USING ATOMIC ABSORPTION SPECTROPHOTOMETER (AAS)
The research has been conducted to measure the concentration of Fe in the sample of water from the filter system at campus III Sanata Dharma University. The measurement was carried out using Atomic Absorption Spectrophotometer (AAS).
The measurement during 23 weeks showed that the average concentration of Fe in sample 1 (after passing the sand filter in the South), sample 2 (the sand filter in the North), sample 3 (the bathrooms in the basement), sample 4 (the bathrooms in the computer laboratory on the 4th floor), and sample 5 (the bathrooms near the language laboratory in the basement) is respectively (0.3±0.2) mg/l, (0.5±0.4) mg/l, (0.3±0.2) mg/l, (0.4±0.2) mg/l, dan (0.3±0.1) mg/l. The figures showed that the concentration tended to decrease, after passing the water treatment systems.
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat dan karunianya-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “Pengukuran Konsentrasi Unsur Fe pada Air dari Sistem Penyaringan Air di Kampus III Universitas Sanata Dharma dengan Metode Spektrofometer Serapan Atom (SSA)”.
Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains (S.Si.) untuk Program Studi Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sanata Dharma Yogyakarta.
Dengan selesainya penulisan skripsi ini, penulis menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Bapak Ir. Ign. Aris Dwiatmoko, M.Sc., selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sanata Dharma.
2. Bapak Dr. Ign. Edi Santosa, M.Si., selaku dosen pembimbing yang telah memberikan bimbingan, arahan, petunjuk, dan semangat selama penulisan skripsi.
3. Ibu Ir. Sri Agustini Sulandari, M.Si., selaku Ketua Program Studi Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sanata Dharma, sekaligus sebagai dosen penguji.
4. Bapak Dr. Agung Bambang Setyo Utomo, SU., selaku dosen penguji.
5. Seluruh dosen pengajar Program Studi Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sanata Dharma.
6. Mas Bimo, selaku laboran di Pusat Laboratorium Analisis, atas bantuannya dalam pengambilan data.
7. Bapak–ibu penulis atas kasih sayang, doa, dorongan semangat, dan pengorbanannya selama ini.
8. Kartika, yang telah banyak memberikan bantuan, dorongan semangat, dan selalu siap mendampingi penulis.
9. Adet, Triyanto, Iman, Lori, Hari, Ridwan, dan Astri, teman-teman Fisika yang telah setia bertukar pikiran untuk penulisan skripsi ini.
10.Are, Wahyu, Bowo, Sadi, Paul, Dastri, Angga, juga Joko dan Singgih, teman-teman kost yang selalu setia ”mengganggu” selama penulisan skripsi.
11.Semua pihak yang tidak dapat penulis sebutkan satu persatu.
Semoga Allah Yang Maha Pengasih dan Pemurah membalas amal baik tersebut. Penulis menyadari bahwa skripsi ini masih banyak kekurangan dan jauh dari kesempurnaan, sehingga segala kritik dan saran yang bersifat membangun sangat penulis harapkan demi perbaikan skripsi ini. Namun demikian, dengan segala kekurangan yang ada, penulis berharap agar skripsi ini masih dapat diambil manfaatnya, khususnya bagi perkembangan ilmu fisika.
Yogyakarta, 04 April 2007
Penulis
DAFTAR ISI
Halaman HALAMAN JUDUL………...
HALAMAN PERSETUJUAN PEMBIMBING………. HALAMAN PENGESAHAN………. HALAMAN PERSEMBAHAN………. PERNYATAAN KEASLIAN KARYA………. INTISARI...……….. ABSTRACT ………. KATA PENGANTAR...……….. DAFTAR ISI………... DAFTAR TABEL………... DAFTAR GAMBAR……….. DAFTAR LAMPIRAN………... BAB I. PENDAHULUAN……….. A. Latar Belakang……….. B. Rumusan Permasalahan……… C. Batasan Masalah……….... D. Tujuan……… E. Manfaat .………
BAB II. DASAR TEORI………. A. Teori Atom………... B. Hukum Beer-Lambert………... i ii iii iv v vi vii viii x xii xiii xiv 1 1 3 3 3 4 5 5 7 x
C. Spektroskopi Serapan Atom (SSA)………...
D. Sistem Penyaringan Air……….
BAB III. EKSPERIMEN………
A. Alat dan Bahan………..
B. Metode Eksperimen………...
BAB IV. HASIL DAN PEMBAHASAN………...
A. Hasil………..
B. Pembahasan………...
BAB V. KESIMPULAN DAN SARAN………
A. Kesimpulan………... B. Saran……….. DAFTAR PUSTAKA………. LAMPIRAN……… 9 10 12 12 13 16 16 17 21 21 21 22 23 xi
DAFTAR TABEL
Halaman Tabel I. Hubungan absorbansi terhadap konsentrasi larutan standart unsur Fe
(mg/l)... Tabel II. Hasil pengukuran konsentrasi unsur Fe pada air sampel minggu ke-1... Tabel III. Konsentrasi unsur Fe (mg/l) terhadap waktu (minggu) pada sampel 1-5...
16 17 18
DAFTAR LAMPIRAN
Halaman Lampiran A. Konsentrasi Unsur Fe terhadap Waktu Pengambilan Sampel………. A.1. Tabel konsentrasi unsur Fe (mg/l) terhadap waktu (minggu) pada sampel 1-5 A.2. Grafik konsentrasi unsur Fe (mg/l) terhadap waktu (minggu) pada sampel 1-5 Lampiran B. Konsentrasi unsur Fe terhadap Sampel... B.1. Tabel konsentrasi unsur Fe (mg/l) terhadap sampel……….. B.2. Grafik konsentrasi unsur Fe (mg/l) terhadap sampel... Lampiran C. Rincian Pembuatan Larutan Standart Fe... Lampiran D. Material pada Tabung Sand Filter dan Tabung Karbon Aktif……….
23 23 24 26 26 31 38 39 xiv
BAB I PENDAHULUAN
A. Latar Belakang
Air merupakan kebutuhan pokok manusia yang harus terpenuhi dalam kehidupan sehari-hari. Demi keamanan dalam penggunaan, air hendaknya memiliki kualitas yang baik. Air berkualitas baik, salah satunya jika kadar unsur-unsur yang terkandung di dalamnya seperti Fe, Ca, Pb, Ni, dan logam berat lainnya, sesuai dengan batas-batas yang diperbolehkan.
Pada kenyataannya, air yang digunakan manusia baik dari PDAM, sumur pompa, sumur gali, maupun yang lainnya, masih kurang baik kualitasnya. Kepadatan penduduk, tata ruang yang salah, dan tingginya eksploitasi sumber daya air sangat berpengaruh pada kualitas air. Untuk air yang masih kurang baik kualitasnya, tentu saja perlu dilakukan upaya-upaya untuk meningkatkan kualitas, salah satunya dengan menggunakan sistem penyaringan air. Penyaringan air dapat mengurangi kandungan unsur-unsur yang berlebihan dalam air, juga dapat mengurangi kekeruhan [Hammer dan Cliffs, 1986].
Air yang terdapat di kampus III Universitas Sanata Dharma Yogyakarta juga harus diproses lebih dulu dengan alat penyaring sebelum digunakan. Hal ini dilakukan karena menurut hasil analisa air yang pernah dilakukan oleh Tim Pengujian Mutu Air Propinsi DIY pada tahun 2004, diketahui bahwa air yang berada di kampus III Universitas Sanata Dharma mengandung unsur Fe sebesar
2
2,81 mg/l, lebih tinggi dari batas maksimal yang diperbolehkanWHO yaitu 0,3 mg/l.
Kebutuhan air di kampus III Universitas Sanata Dharma dipenuhi dari sumur bor yang berada di belakang Fakultas MIPA dengan kedalaman 40 m dan sumur bor di sebelah selatan Fakultas Teknik dengan kedalaman 18 m. Dari sumur bor air dipompa menuju tempat penyaringan air yang berada di sebelah barat laboratorium Fakultas Farmasi. Bagian alat penyaringan air itu terdiri dari saringan pasir, bak aerasi, sand filter/ penyaringan dengan pasir, karbon aktif, dan bak pengendapan. Setelah melalui proses penyaringan, air kemudian disalurkan ke instalasi-instalasi gedung.
Sampel yang akan diteliti terdiri dari air sebelum dan setelah melewati alat penyaringan. Untuk melihat kerja alat penyaringan air yang berada di kampus III Universitas Sanata Dharma, dilakukan penelitian pengukuran konsentrasi unsur Fe dengan menggunakan metode Spektrofotometer Serapan Atom (SSA). Digunakan metode SSA dalam penelitian ini karena memiliki kemampuan analisa yang cepat dan sensitif [Khopkar, 1990]. Spektrofotometer Serapan Atom (SSA) adalah suatu metode analisis untuk menentukan kadar unsur tertentu dalam sampel berdasarkan serapan atom [Broekaert, 2002]. SSA ini bisa digunakan untuk menentukan sampai enam puluh satu logam seperti Fe, Mg, Ni, Ti, Zn, P dan lain sebagainya.
3
B. Rumusan Masalah
Dengan demikian, dalam penelitian ini dapatlah dirumuskan permasalahannya, yaitu seberapa besar konsentrasi unsur Fe dalam air sampel yang berasal dari sistem penyaringan air di kampus III Universitas Sanata Dharma, terutama konsentrasi unsur Fe pada air sampel setelah melewati alat penyaringan?
C. Batasan Masalah
1. Penelitian untuk mengetahui kerja alat penyaringan air di kampus III Universitas Sanata Dharma hanya dilakukan dengan pengukuran unsur Fe dalam air sampel melalui metode SSA.
2. Air sampel meliputi : sampel 1 (setelah melewati saringan pasir sebelah selatan), sampel 2 (setelah melewati saringan pasir sebelah utara), sampel 3 (instalasi kamar mandi yang berada di hall lantai dasar), sampel 4 (instalasi kamar mandi yang berada di gedung lantai 4 sebelah laboratorium komputer teknik), sampel 5 (instalasi kamar mandi yang berada di gedung lantai dasar sebelah laboratorium bahasa).
D. Tujuan
1. Mengetahui konsentrasi unsur Fe dalam air sampel yang berasal dari sistem penyaringan air di kampus III Universitas Sanata Dharma.
4
E. Manfaat
1. Memberikan informasi kepada pihak-pihak terkait mengenai konsentrasi unsur Fe air sampel dari sistem penyaringan air di kampus III Universitas Sanata Dharma.
2. Agar pihak-pihak terkait dapat mengupayakan alat penyaringan air di kampus III Universitas Sanata Dharma dengan sistem kerja yang lebih baik, sehingga mampu menghasilkan air dengan konsentrasi unsur Fe tidak lebih dari batas maksimal yang diperbolehkan WHO yaitu 0,3 mg/l.
BAB II DASAR TEORI
A. Teori Atom
Pada tahun 1913, seorang fisikawan dari Denmark yaitu Neils Bohr mengemukakan teori tentang struktur atom hidrogen. Atom hidrogen terdiri dari sebuah elektron yang bergerak mengelilingi inti atom pada lintasan-lintasan tertentu dengan jari-jari dan energi tertentu [Chang, 2003], dirumuskan sebagai:
rn = 2 2 2 4 me n oh πε (1) dan nilai energi elektron adalah:
En = - 2 2 2 4 32 o h me ε π 2 1 n (2)
keterangan: rn = jari-jari elektron (m)
En = energi elektron pada lintasan ke n (J) m = massa elektron (9,1x10-31 kg) e = muatan elektron (1,6x10-19 C)
εo = permitivitas ruang hampa (8,854x10-12 C2/N.m2)
ћ = π
2
h
= 1,05x10-34 J.s dengan = tetapan Planck (6,63x10h -34J.s)
n = bilangan bulat positif = 1,2,3,…
Secara umum, jika suatu atom mendapatkan energi dari luar akan menyebabkan elektron di dalam atom bertransisi dari tingkat energi rendah ke tingkat energi yang lebih tinggi, peristiwanya disebut dengan eksitasi [Krane,
1992]. Peristiwa sebaliknya disebut dengan de-eksitasi yaitu transisi elektron dari
6
tingkat energi yang lebih tinggi ke tingkat energi lebih rendah dengan memancarkan energi [Wiyatmo, 2003]. Peristiwa tersebut ditunjukkan pada gambar 1 dan gambar 2.
Gambar 1. Peristiwa eksitasi
Gambar 2. Peristiwa de-eksitasi
Pada proses de-eksitasi atom, besar energi yang dipancarkan merupakan beda energi antara kedua tingkat tersebut [Beiser, 1983], dirumuskan sebagai berikut:
υ
h = E1 – E2 (3)
jadi nilai frekuensi adalah: υ = 3 2 3 4 64 o h me ε π ⎟⎟⎠ ⎞ ⎜⎜ ⎝ ⎛ − 2 1 2 2 1 1 n n (4)
7
λ = υ
c
(5)
maka dengan mensubstitusikan persamaan (4) ke persamaan (5), besarnya panjang gelombang dapat dinyatakan sebagai:
λ = 4 3 2 0 3 64 me c h ε π ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − 2 2 2 1 2 2 2 1 n n n n λ = ∞ R 1 ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − 2 2 2 1 2 2 2 1 n n n n λ 1 = R∞ ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − 2 1 2 2 1 1 n n (6)
keterangan: R∞adalah tetapan Rydberg = 1,097371x10-7 m-1.
Setiap unsur mempunyai tingkat energi atom yang berbeda. Oleh sebab itu, unsur satu dengan unsur yang lain akan mempunyai spektrum atom yang berbeda-beda pula. Perbedaan spektrum atom inilah yang dijadikan dasar untuk menentukan struktur atom dan sifat-sifat penyusunnya.
B. Hukum Beer – Lambert
Sebuah cahaya monokromatik dengan intensitas cahaya awal yang disinarkan pada sebuah atom dalam keadaan dasar (ground state), akan
mengalami pengurangan intensitas cahaya karena adanya serapan oleh atom. Jika intensitas awal cahaya yang dipancarkan adalah Io, dan intensitas cahaya setelah dilewatkan adalah I, maka transmitansi (T) adalah:
T =
Io I
8
Sedangkan absorbansi (A) dapat didefinisikan oleh persamaan sebagai berikut [Skoog, 1985]:
A = - log T = - log
I Io
(8) Hukum Beer-Lambert menjelaskan hubungan antara absorbansi (A) dan konsentrasi (c). Pada dasarnya pengurangan intensitas sebanding dengan konsentrasi c, intensitas (I), dan panjang bahan penyerap d , sebagai: l
-dI = k . I . c . d l (9) keterangan: Io = intensitas cahaya yang masuk
I = intensitas cahaya yang diteruskan
= panjang lintasan interaksi foton dengan atom larutan penyerap l
dI = perubahan intensitas cahaya yang disebabkan oleh penyerapan atom pada panjang lintasan dl
k = konstanta kesebandingan
Dengan mengintegralkan kedua ruas persamaan di atas, didapatkan:
∫
− I Io I dI) ( = k . c .∫
l odl - ln Io I = k . c . l log I Io = 303 , 2 k . c . l log I Io = ε . . c l dengan ε = 303 , 2 k = absorptivitas (10) keterangan: c adalah konsentrasi.9
Berdasarkan persamaan (8) dan persamaan (10), maka nilai absorbansi (A) adalah: A = log
I Io
= ε. l. c (11)
C. Spektrofotometer Serapan Atom (SSA)
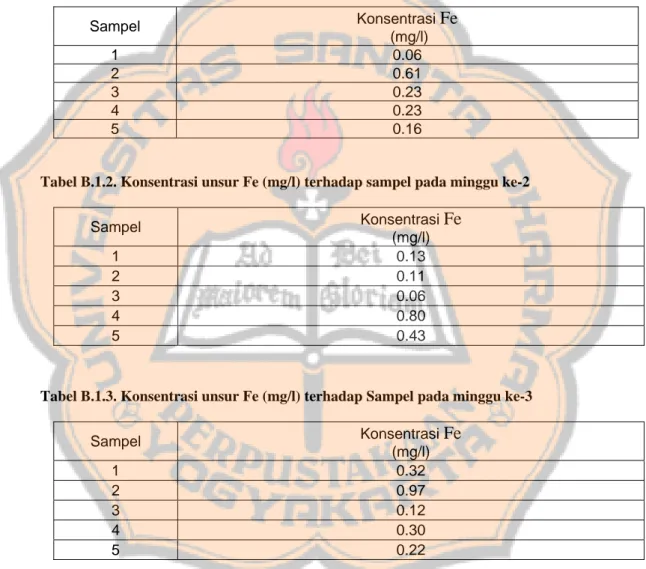
Spektrofotometer serapan atom merupakan metode untuk penentuan kuantitatif logam. Metode ini dapat menentukan unsur-unsur logam seperti arsen, besi, mangan, timbal dan lain sebagainya dengan sangat peka dan selektif . Prinsip kerja spektrofotometer serapan atom ini didasarkan pada serapan cahaya oleh atom-atom pada tingkat dasar. Alat spektrofotometer serapan atom terdiri atas bagian-bagian seperti yang ditunjukkan gambar 3.
Sumber cahaya
Detektor Penampil data
Unit Atomisasi
Monokromator
Gambar 3. Satu unit alat spektrofotometer serapan atom [Price, 1972]
1. Sumber cahaya
Sumber radiasi yang digunakan dalam spektrofotometer serapan atom adalah
hollow cathode lamp (HCL). HCL ini dapat memberikan garis emisi yang
tajam dari suatu unsur spesifik. 2. Unit atomisasi
Pada alat SSA, atomisasi dapat dilakukan dengan dua cara yaitu dengan menggunakan nyala dan tanpa nyala. Biasanya yang sering digunakan yaitu
10
atomisasi dengan menggunakan nyala. Nyala ini dihasilkan dari campuran bahan bakar, gas oksidator dan sampel.
3. Monokromator
Monokromator berfungsi untuk menguraikan radiasi polikromatis menjadi radiasi monokromatis dan memilih panjang gelombang yang sesuai dengan serapan atom-atom bebas pada unit atomisasi (dalam penelitian ini yaitu memilih panjang gelombang yang sesuai dengan serapan atom besi).
4. Detektor
Detektor berfungsi mengubah cahaya menjadi sinyal listrik. Detektor yang biasa digunakan adalah jenis tabung pengganda foton (Photomultiplier Tube).
5. Perekam dan penampil data
Untuk merekam dan menampilkan data dari alat SSA ini dapat digunakan laptop.
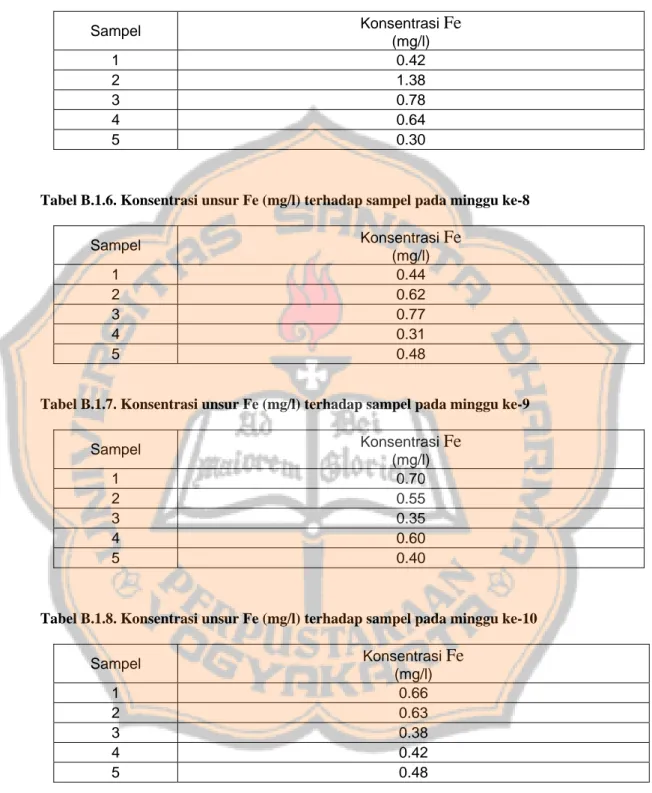
D. Sistem Penyaringan Air
Sumur selatan
Sumur
utara Aerasi Bak
Sand Filter
Carbon Aktif
Bak Penampungan
Gambar 4. Sistem penyaringan air di Kampus III Universitas Sanata Dharma [CV. Jaya Sakti, 2005]
11
Alat penyaringan air di lingkungan kampus III Universitas Sanata Dharma terdiri dari bagian-bagian pokok yaitu saringan pasir, bak aerasi, sand filter, carbon aktif, dan bak penampungan. Saringan pasir dipasang untuk menyaring pasir, lumpur, dan batu-batu kecil yang ikut terangkat saat air dari sumber dipompa. Bak aerasi berfungsi untuk menghilangkan kandungan Fe dalam air [Hammer dan Cliff, 1986]. Cara yang digunakan adalah dengan mengubah besi ferro yang bersifat larut dalam air menjadi tidak terlarut dalam air yaitu dengan
memercikkan air dari atas bak, sehingga air bersentuhan dengan udara. Pada saat itulah akan terjadi proses oksidasi yang akan mengubah besi ferro menjadi besi ferri yang bersifat tidak larut dalam air. Tabung sand filter diisi dengan pasir
kuarsa halus, sedangkan tabung karbon aktif diisi dengan arang aktif berukuran sedang. Adapun bak penampungan berguna untuk menampung air hasil penyaringan.
Alur kerja (jalannya) alat penyaringan air, dimulai dengan memompa air dari sumur bor sebelah selatan dan sumur bor sebelah utara. Air kemudian dialirkan menuju saringan pasir. Setelah mengalami penyaringan, air dari sumur bor sebelah selatan akan langsung menuju bak aerasi, sedangkan untuk air dari sumur bor sebelah utara dialirkan dulu melewati tempat kaporit sebelum menuju bak aerasi. Di dalam bak aerasi, air dari kedua sumur bor akan bercampur. Dari bak aerasi, air kemudian dialirkan menuju tabung sand filter, dan berlanjut ke tabung karbon aktif. Air kemudian ditampung di dalam bak penampungan terlebih dahulu, sebelum didistribusikan lebih lanjut menuju bak-bak penampungan pada gedung-gedung di kampus III Universitas Sanata Dharma.
BAB III EKSPERIMEN
A. Alat dan Bahan 1. Alat-alat:
a. Satu unit SSA IL 451 b. Erlenmeyer c. Gelas ukur d. Labu takar e. Neraca analitik f. Pipet g. Botol plastik h. Laptop 2. Bahan-bahan: a. Aquades
Aquades digunakan sebagai bahan pembuat pelarut. b. HCl 37 %
HCl 37% digunakan untuk membuat pH aquades dan sampel menjadi 1. c. Garam Mohrs ( (NH4)2 SO4FeSO4 6H2O )
Garam Mohrs digunakan sebagai bahan pembuat larutan Fe. d. Kertas pH
Kertas pH digunakan untuk mengukur pH aquades dan sampel.
13
B. Metode Eksperimen 1. Preparasi larutan
a. Pencucian labu takar yang akan digunakan.
Labu takar yang akan digunakan dicuci terlebih dahulu dengan air, kemudian dibilas dengan aquades.
b. Pembuatan pelarut.
Pelarut dibuat dari aquades yang ditetesi dengan HCl 37% hingga pH=1. c. Pembuatan larutan induk Fe
Larutan induk Fe dibuat dengan menimbang garam Mohr terlebih dahulu menggunakan neraca analitik. Besarnya garam Mohr yang ditimbang dihitung dengan rumus sebagai berikut:
B = C x Ar Mr
(12)
keterangan: B = massa senyawa yang diambil C = massa senyawa yang diperoleh
Ar = nomor massa unsur yang akan dibuat larutan Mr = nomor massa senyawa yang akan dilarutkan
Garam Mohr kemudian dimasukkan ke dalam labu takar 100 ml dan ditambahkan aquades pH=1 hingga volumenya 100 ml. Dari proses ini didapatkan larutan induk Fe dengan konsentrasi 393.9 mg/l.
d. Pembuatan larutan standart Fe
Pembuatan larutan standart Fe dengan konsentrasi berbeda didapatkan melalui pengenceran larutan induk Fe. Rumus yang digunakan sebagai dasar pengenceran adalah:
14
c1.V1 = c2.V2 (13)
keterangan: c1 = konsentrasi larutan induk (mg/l) V1 = volume larutan induk yang diambil (l) c2 = konsentrasi larutan yang diinginkan (mg/l) V2 = volume larutan yang dicari (l)
Rincian pembuatan larutan standart Fe dapat dilihat pada Lampiran C. e. Penyaringan sampel
Sampel yang akan diuji terlebih dahulu disaring dengan kertas saring, kemudian ditambahkan HCl 37% untuk mencapai pH=1.
2. Penentuan tempat pengambilan air sampel
Pengambilan air sampel berasal dari: sampel 1 (setelah melewati saringan pasir sebelah selatan), sampel 2 ( setelah melewati saringan pasir sebelah utara), sampel 3 ( instalasi kamar mandi yang berada di hall lantai dasar), sampel 4 (instalasi kamar mandi yang berada di gedung lantai 4 sebelah laboratorium komputer teknik), sampel 5 (instalasi kamar mandi yang berada di gedung lantai dasar sebelah laboratorium bahasa).
3. Pengambilan Data
a. Kalibrasi alat Spektrofotometer Serapan Atom
Sebelum melakukan pengukuran sampel, alat SSA yang akan dipakai harus dikalibrasi terlebih dahulu menggunakan sampel yang tidak mengandung penyerap (blanko) dan sampel larutan standart Fe yang telah dibuat. Dalam proses kalibrasi ini akan didapatkan data intensitas cahaya
15
yang melewati larutan blanko (Io) dan intensitas cahaya yang melewati larutan standart Fe (I).
b. Pengukuran sampel
Sampel yang akan diukur terlebih dahulu diurutkan berdasarkan kejernihan air. Pengukuran sampel dilakukan mulai dari yang paling jernih hingga yang paling keruh. Hasil dari pengukuran sampel ini adalah intensitas cahaya yang melewati blanko (Io) dan intensitas cahaya yang melewati larutan sampel (I).
c. Analisis data
Analisis data yang diperoleh dari proses kalibrasi dan pengukuran sampel, dilakukan dengan menghitung besarnya absorbansi larutan standart Fe dan absorbansi sampel menggunakan rumus sebagai berikut:
A = log I IO
(14)
Setelah mendapatkan absorbansi dari tiap-tiap sampel larutan standart, kemudian dibuat grafik hubungan absorbansi terhadap konsentrasi larutan standart unsur Fe. Dari grafik tersebut akan didapatkan persamaan garis liniernya. Persamaan garis itu digunakan untuk menghitung besarnya konsentrasi sampel yang diuji dengan cara memasukkan nilai-nilai absorbansi sampel ke dalam persamaan garis tersebut.
BAB IV
HASIL DAN PEMBAHASAN A. Hasil
Kalibrasi alat SSA untuk pengukuran sampel dilakukan dengan pengaturan sebagai berikut: HCL Fe; band width 0.3 nm; panjang gelombang 248.3 nm; tegangan PMT 620 volt; lamp current 5 mA; laju acetylen 1.5 l/min; laju udara 13.3 l/min; laju sampel 5 ml/min. Hasil kalibrasi dapat dilihat pada tabel I di bawah ini.
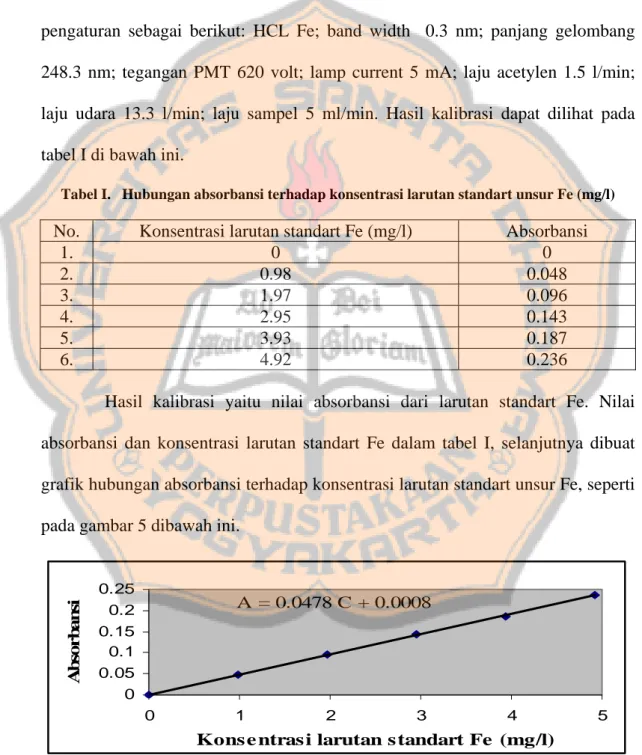
Tabel I. Hubungan absorbansi terhadap konsentrasi larutan standart unsur Fe (mg/l)
No. Konsentrasi larutan standart Fe (mg/l) Absorbansi
1. 0 0 2. 0.98 0.048 3. 1.97 0.096 4. 2.95 0.143 5. 3.93 0.187 6. 4.92 0.236
Hasil kalibrasi yaitu nilai absorbansi dari larutan standart Fe. Nilai absorbansi dan konsentrasi larutan standart Fe dalam tabel I, selanjutnya dibuat grafik hubungan absorbansi terhadap konsentrasi larutan standart unsur Fe, seperti pada gambar 5 dibawah ini.
A = 0.0478 C + 0.0008 0 0.05 0.1 0.15 0.2 0.25 0 1 2 3 4 5
Kons e ntras i larutan s tandart Fe (mg/l)
A b so rb a n si
Gambar 5. Hubungan absorbansi terhadap konsentrasi larutan standart unsur Fe (mg/l)
17
Dari grafik hubungan absorbansi terhadap konsentrasi larutan standart unsur Fe akan didapatkan persamaan garis linier yaitu A = 0.0478 C + 0. 0008. Pada pengukuran sampel akan didapatkan nilai absorbansi, kemudian nilai absorbansi tersebut disubstitusikan kedalam persamaan garis linier A = 0.0478 C + 0. 0008 untuk mendapatkan konsentrasi unsur Fe air sampel. Hasil pengukuran sampel tersebut dapat dilihat pada tabel II dibawah ini:
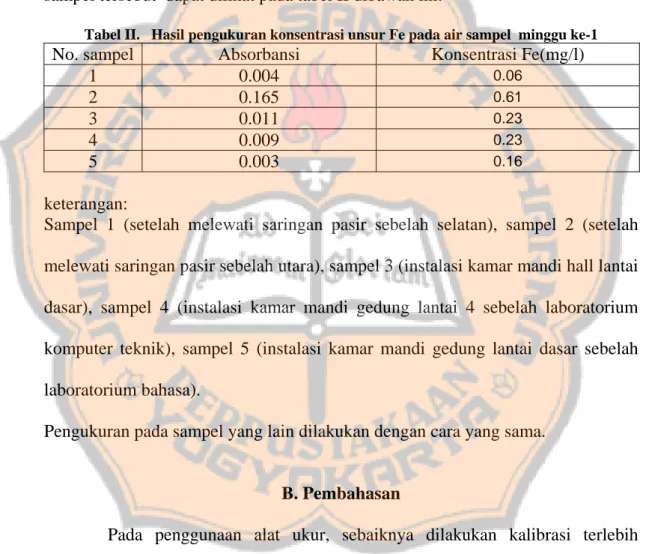
Tabel II. Hasil pengukuran konsentrasi unsur Fe pada air sampel minggu ke-1
No. sampel Absorbansi Konsentrasi Fe(mg/l)
1 0.004 0.06 2 0.165 0.61 3 0.011 0.23 4 0.009 0.23 5 0.003 0.16 keterangan:
Sampel 1 (setelah melewati saringan pasir sebelah selatan), sampel 2 (setelah melewati saringan pasir sebelah utara), sampel 3 (instalasi kamar mandi hall lantai dasar), sampel 4 (instalasi kamar mandi gedung lantai 4 sebelah laboratorium komputer teknik), sampel 5 (instalasi kamar mandi gedung lantai dasar sebelah laboratorium bahasa).
Pengukuran pada sampel yang lain dilakukan dengan cara yang sama. B. Pembahasan
Pada penggunaan alat ukur, sebaiknya dilakukan kalibrasi terlebih dahulu. Hal itu dilakukan karena dalam pengukuran ada faktor-faktor pengganggu, yang tentu saja tidak dikehendaki. Alat SSA yang digunakan untuk pengukuran konsentrasi Fe pada penelitian ini juga dikalibrasi terlebih dahulu, untuk menghindari kesalahan pengukuran akibat pengaruh input pengganggu
18
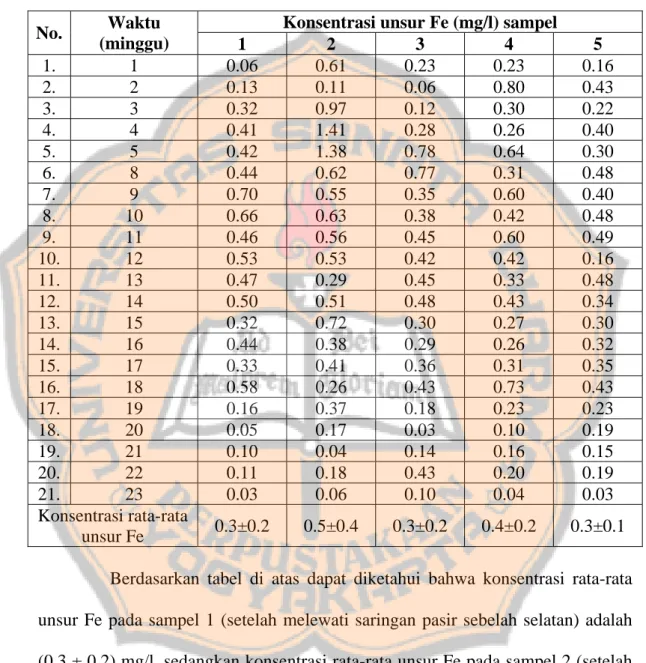
antara lain suhu nyala dan tegangan sumber. Hasil keseluruhan pengukuran konsentrasi unsur Fe pada air sampel dapat dilihat pada tabel III dibawah ini.
Tabel III. Konsentrasi unsur Fe (mg/l) terhadap waktu (minggu) pada sampel 1-5
Konsentrasi unsur Fe (mg/l) sampel No. Waktu (minggu) 1 2 3 4 5 1. 1 0.06 0.61 0.23 0.23 0.16 2. 2 0.13 0.11 0.06 0.80 0.43 3. 3 0.32 0.97 0.12 0.30 0.22 4. 4 0.41 1.41 0.28 0.26 0.40 5. 5 0.42 1.38 0.78 0.64 0.30 6. 8 0.44 0.62 0.77 0.31 0.48 7. 9 0.70 0.55 0.35 0.60 0.40 8. 10 0.66 0.63 0.38 0.42 0.48 9. 11 0.46 0.56 0.45 0.60 0.49 10. 12 0.53 0.53 0.42 0.42 0.16 11. 13 0.47 0.29 0.45 0.33 0.48 12. 14 0.50 0.51 0.48 0.43 0.34 13. 15 0.32 0.72 0.30 0.27 0.30 14. 16 0.44 0.38 0.29 0.26 0.32 15. 17 0.33 0.41 0.36 0.31 0.35 16. 18 0.58 0.26 0.43 0.73 0.43 17. 19 0.16 0.37 0.18 0.23 0.23 18. 20 0.05 0.17 0.03 0.10 0.19 19. 21 0.10 0.04 0.14 0.16 0.15 20. 22 0.11 0.18 0.43 0.20 0.19 21. 23 0.03 0.06 0.10 0.04 0.03 Konsentrasi rata-rata unsur Fe 0.3±0.2 0.5±0.4 0.3±0.2 0.4±0.2 0.3±0.1 Berdasarkan tabel di atas dapat diketahui bahwa konsentrasi rata-rata unsur Fe pada sampel 1 (setelah melewati saringan pasir sebelah selatan) adalah (0.3 ± 0.2) mg/l, sedangkan konsentrasi rata-rata unsur Fe pada sampel 2 (setelah melewati saringan pasir sebelah utara) adalah (0.5 ± 0.4) mg/l. Hasil tersebut menunjukkan bahwa konsentrasi unsur Fe sampel 1 cenderung lebih kecil dibandingkan sampel 2. Hasil sebuah penelitian lain juga menyatakan bahwa semakin dalam sumur maka akan semakin besar pula konsentrasi unsur Fe [Deri,
19
2005]. Konsentrasi sampel 2 cenderung lebih besar daripada sampel 1 karena sumur sebelah utara lebih dalam dibandingkan sumur sebelah selatan
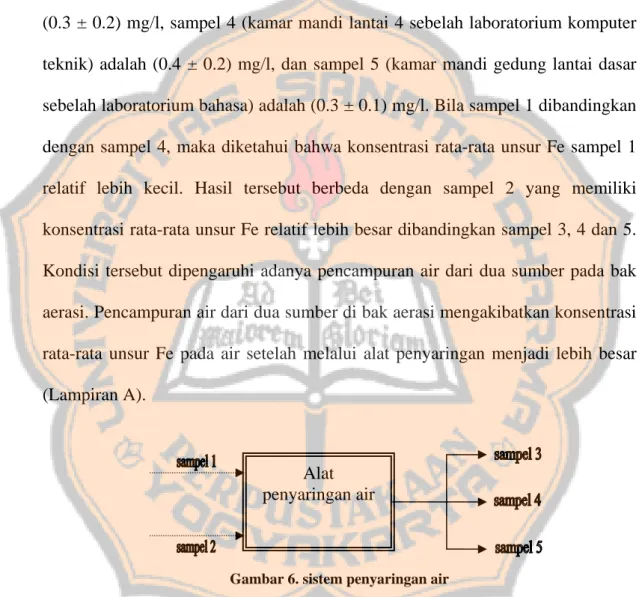
Tabel III di atas juga menunjukkan konsentrasi rata-rata unsur Fe pada sampel 3, 4, dan 5, yaitu pada sampel 3 (kamar mandi hall lantai dasar) adalah (0.3 ± 0.2) mg/l, sampel 4 (kamar mandi lantai 4 sebelah laboratorium komputer teknik) adalah (0.4 ± 0.2) mg/l, dan sampel 5 (kamar mandi gedung lantai dasar sebelah laboratorium bahasa) adalah (0.3 ± 0.1) mg/l. Bila sampel 1 dibandingkan dengan sampel 4, maka diketahui bahwa konsentrasi rata-rata unsur Fe sampel 1 relatif lebih kecil. Hasil tersebut berbeda dengan sampel 2 yang memiliki konsentrasi rata-rata unsur Fe relatif lebih besar dibandingkan sampel 3, 4 dan 5. Kondisi tersebut dipengaruhi adanya pencampuran air dari dua sumber pada bak aerasi. Pencampuran air dari dua sumber di bak aerasi mengakibatkan konsentrasi rata-rata unsur Fe pada air setelah melalui alat penyaringan menjadi lebih besar (Lampiran A).
Alat penyaringan air
Gambar 6. sistem penyaringan air
Pengurangan konsentrasi unsur Fe pada sampel dapat diamati dengan cara membandingkan konsentrasi unsur Fe sampel 1 dan 2 (air sebelum disaring) dengan konsentrasi unsur Fe sampel 3, 4, dan 5 (air setelah penyaringan). Setelah melalui alat penyaringan air, konsentrasi unsur Fe dalam air seharusnya mengalami pengurangan.
20
Berdasarkan gambar D.I dan gambar D.II pada lampiran D, dapat diketahui adanya perbedaan warna antara pasir kuarsa (dalam tabung sand filter) dan arang aktif (dalam tabung karbon aktif) sebelum dan setelah digunakan. Sebelum digunakan pasir kuarsa berwarna coklat, sedangkan setelah digunakan pasir kuarsa berubah menjadi berwarna kekuningan. Arang aktif setelah digunakan ukurannya menjadi lebih kecil daripada sebelum digunakan. Hal tersebut menunjukkan bahwa telah terjadi proses penyaringan.
Dari analisa keseluruhan data pada tabel III, diketahui adanya kecenderungan pengurangan konsentrasi unsur Fe pada sampel 3, 4, dan 5 (air setelah penyaringan).
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Besarnya konsentrasi rata-rata unsur Fe pada sampel 1 (setelah melewati saringan pasir sebelah selatan), sampel 2 (setelah melewati saringan pasir sebelah utara), sampel 3 (instalasi kamar mandi yang berada di hall lantai dasar), sampel 4 (instalasi kamar mandi yang berada di gedung lantai 4 sebelah laboratorium komputer teknik), dan sampel 5 (instalasi kamar mandi yang berada di gedung lantai dasar sebelah laboratorium bahasa) adalah (0.3±0.2) mg/l, (0.5 ± 0.4) mg/l, (0.3 ± 0.2) mg/l, (0.4 ± 0.2) mg/l, dan (0.3±0.1) mg/l.
2. Terdapat kecenderungan pengurangan konsentrasi unsur Fe pada sampel 3, 4, dan 5 (air setelah penyaringan).
B. Saran
Bagi peneliti lain, dapat dilakukan penelitian lebih lanjut untuk mengetahui besarnya konsentrasi unsur Fe pada bagian-bagian alat penyaringan dengan sistem terkontrol.
DAFTAR PUSTAKA
Beiser, A. 1983. Konsep Fisika Modern. Jakarta: Penerbit Erlangga.
Broekaert, J.A.C. 2002. Analytical Atomic Spectrometry With Flames and Plasmas. Germany.
Chang, R. 2003. Kimia Dasar : Konsep-Konsep inti (ed.3). Jakarta: Penerbit Erlangga.
CV. Jaya Sakti. 2005. Gambar Letak Instalasi Aerasi di Universitas Sanata Dharma Kampus III. Yogyakarta.
Deri, I.R.E. 2005. Penggunaan Metode Spektrofotometer Serepan Atom (SSA) untuk Pengukuran Konsentrasi Unsur Besi (Fe) dalam Air Sumur dengan Kedalaman yang Berbeda. Skripsi. Yogyakarta: Universitas Sanata Dharma.
Dinas Pemukiman dan Prasarana Wilayah: Balai Pengujian Kontruksi dan Lingkungan. 2004. Hasil Analisa Air. Yogyakarta.
Hammer, M.J., dan Cliffs, E.W. 1986. Water and Wastewater Technology (ed.2). A Simon & Schuster Company.
Hendarwati, L. 2005. Serapan Atom Fe dan Atom Ca pada Spektrofotometer Serapan Atom Menggunakan Sumber Cahaya Hollow Cathode Lamp Fe. Skripsi. Yogyakarta: Universitas Sanata Dharma.
Khopkar, S. M. 1990. Konsep Dasar Kimia Analitik. Jakarta: UI Press.
Krane, K. 1992. Fisika Modern. Jakarta (Wospakrik, H.J, Penerjemah). Jakarta: Penerbit Universitas Indonesia.
Price, W.J. 1972. Analytical Atomic Absorption Spectrometry. London: Heyden & Son LTD.
Skoog, D.A. 1985. Principles Of Intrumental Analysis (ed.3). Japan. Wiyatmo, Y. 2003. Fisika Modern. Yogyakarta: Penerbit Pustaka Pelajar.
World Health Organization. 1988. Guidelines for Drinking Water Quality (vol.2). Belgium.
LAMPIRAN A
Konsentrasi Unsur Fe terhadap Waktu Pengambilan Sampel
A.1. Tabel konsentrasi unsur Fe (mg/l) terhadap waktu (minggu) pada sampel 1-5
Konsentrasi unsur Fe (mg/l) sampel No. Waktu (minggu) 1 2 3 4 5 1. 1 0.06 0.61 0.23 0.23 0.16 2. 2 0.13 0.11 0.06 0.80 0.43 3. 3 0.32 0.97 0.12 0.30 0.22 4. 4 0.41 1.41 0.28 0.26 0.40 5. 5 0.42 1.38 0.78 0.64 0.30 6. 8 0.44 0.62 0.77 0.31 0.48 7. 9 0.70 0.55 0.35 0.60 0.40 8. 10 0.66 0.63 0.38 0.42 0.48 9. 11 0.46 0.56 0.45 0.60 0.49 10. 12 0.53 0.53 0.42 0.42 0.16 11. 13 0.47 0.29 0.45 0.33 0.48 12. 14 0.50 0.51 0.48 0.43 0.34 13. 15 0.32 0.72 0.30 0.27 0.30 14. 16 0.44 0.38 0.29 0.26 0.32 15. 17 0.33 0.41 0.36 0.31 0.35 16. 18 0.58 0.26 0.43 0.73 0.43 17. 19 0.16 0.37 0.18 0.23 0.23 18. 20 0.05 0.17 0.03 0.10 0.19 19. 21 0.10 0.04 0.14 0.16 0.15 20. 22 0.11 0.18 0.43 0.20 0.19 21. 23 0.03 0.06 0.10 0.04 0.03 Keterangan:
Sampel 1 (setelah melewati saringan pasir sumur sebelah selatan), sampel 2 (setelah melewati saringan pasir sumur sebelah utara), sampel 3 (instalasi kamar mandi hall lantai dasar), sampel 4 (instalasi kamar mandi gedung lantai 4 sebelah laboratorium komputer teknik), sampel 5 (instalasi kamar mandi gedung lantai dasar sebelah laboratorium bahasa).
24
A.2. Grafik konsentrasi unsur Fe (mg/l) terhadap waktu (minggu) pada sampel 1-5
A.2.1. Grafik konsentrasi unsur Fe (mg/l) terhadap waktu (minggu) pada sampel 1 0 0.2 0.4 0.6 0.8 0 5 10 15 20 25 Waktu (minggu) K ons e n tr a s i ( m g/ l)
A.2.2. Grafik konsentrasi unsur Fe (mg/l) terhadap waktu (minggu) pada sampel 2 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 0 5 10 15 20 25 Waktu (minggu) K o n s e n tr a s i ( m g /l)
A.2.3. Grafik konsentrasi unsur Fe (mg/l) terhadap waktu (minggu) pada sampel 3 0 0.2 0.4 0.6 0.8 1 0 5 10 15 20 25 Waktu (minggu) K o n sen tr asi ( m g /l )
25
A.2.4. Grafik konsentrasi unsur Fe (mg/l) terhadap waktu (minggu) pada sampel 4 0 0.2 0.4 0.6 0.8 1 0 5 10 15 20 25 Waktu (minggu) K o n sen tr asi (m g /l )
A.2.5. Grafik konsentrasi unsur Fe (mg/l) terhadap waktu (minggu) pada sampel 5 0 0.1 0.2 0.3 0.4 0.5 0.6 0 5 10 15 20 25 Waktu (minggu) K o n sen tr asi (m g /l )
LAMPIRAN B
Konsentrasi unsur Fe terhadap Sampel
B.1. Tabel konsentrasi unsur Fe (mg/l) terhadap sampel
Tabel B.1.1. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-1
Sampel Konsentrasi Fe (mg/l) 1 0.06 2 0.61 3 0.23 4 0.23 5 0.16
Tabel B.1.2. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-2
Sampel Konsentrasi Fe (mg/l) 1 0.13 2 0.11 3 0.06 4 0.80 5 0.43
Tabel B.1.3. Konsentrasi unsur Fe (mg/l) terhadap Sampel pada minggu ke-3
Sampel Konsentrasi Fe (mg/l) 1 0.32 2 0.97 3 0.12 4 0.30 5 0.22
Tabel B.1.4. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-4
Sampel Konsentrasi Fe (mg/l) 1 0.41 2 1.41 3 0.28 4 0.26 5 0.40 26
27
Tabel B.1.5. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-5
Sampel Konsentrasi Fe (mg/l) 1 0.42 2 1.38 3 0.78 4 0.64 5 0.30
Tabel B.1.6. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-8
Sampel Konsentrasi Fe (mg/l) 1 0.44 2 0.62 3 0.77 4 0.31 5 0.48
Tabel B.1.7. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-9
Sampel Konsentrasi Fe (mg/l) 1 0.70 2 0.55 3 0.35 4 0.60 5 0.40
Tabel B.1.8. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-10
Sampel Konsentrasi Fe (mg/l) 1 0.66 2 0.63 3 0.38 4 0.42 5 0.48
28
Tabel B.1.9. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-11
Sampel Konsentrasi Fe (mg/l) 1 0.46 2 0.56 3 0.45 4 0.60 5 0.49
Tabel B.1.10. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-12
Sampel Konsentrasi Fe (mg/l) 1 0.53 2 0.53 3 0.42 4 0.42 5 0.46
Tabel B.1.11. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-13
Sampel Konsentrasi Fe (mg/l) 1 0.47 2 0.29 3 0.45 4 0.33 5 0.48
Tabel B.1.12. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-14
Sampel Konsentrasi Fe (mg/l) 1 0.50 2 0.51 3 0.48 4 0.43 5 0.34
29
Tabel B.1.13. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-15
Sampel Konsentrasi Fe (mg/l) 1 0.32 2 0.72 3 0.30 4 0.27 5 0.30
Tabel B.1.14. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-16
Sampel Konsentrasi Fe (mg/l) 1 0.44 2 0.38 3 0.29 4 0.26 5 0.32
Tabel B.1.15. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-17
Sampel Konsentrasi Fe (mg/l) 1 0.33 2 0.41 3 0.36 4 0.31 5 0.35
Tabel B.1.16. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-18
Sampel Konsentrasi Fe (mg/l) 1 0.58 2 0.26 3 0.43 4 0.73 5 0.43
Tabel B.1.17. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-19
Sampel Konsentrasi Fe (mg/l) 1 0.16 2 0.37 3 0.18 4 0.23 5 0.23
30
Tabel B.1.18. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-20
Sampel Konsentrasi Fe (mg/l) 1 0.05 2 0.17 3 0.03 4 0.10 5 0.19
Tabel B.1.19. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-21
Sampel Konsentrasi Fe (mg/l) 1 0.06 2 0.04 3 0.14 4 0.16 5 0.15
Tabel B.1.20. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-22
Sampel Konsentrasi Fe (mg/l) 1 0.11 2 0.18 3 0.43 4 0.21 5 0.19
Tabel B.1.21. Konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-23
Sampel Konsentrasi Fe (mg/l) 1 0.03 2 0.06 3 0.10 4 0.04 5 0.03
31
B.2. Grafik konsentrasi unsur Fe (mg/l) terhadap sampel
B.2.1. Grafik konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-1
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.2. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-2
0.0 0.2 0.4 0.6 0.8 1.0 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.3. Grafik konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-3
0 0.2 0.4 0.6 0.8 1 1.2 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
32
B.2.4. Grafik konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-4
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.5. Grafik konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-5
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.6. Grafik konsentrasi unsur Fe (mg/l) terhadap sampel pada minggu ke-8
0 0.2 0.4 0.6 0.8 1 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
33
B.2.7. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-9
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.8. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-10
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.9. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-11
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
34
B.2.10. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-12
0 0.1 0.2 0.3 0.4 0.5 0.6 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.11. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-13
0 0.1 0.2 0.3 0.4 0.5 0.6 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.12. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-14
0 0.1 0.2 0.3 0.4 0.5 0.6 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
35
B.2.13. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-15
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.14. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-16
0 0.1 0.2 0.3 0.4 0.5 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.15. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-17
0 0.1 0.2 0.3 0.4 0.5 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
36
B.2.16. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-18
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.17. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-19
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.18. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-20
0 0.05 0.1 0.15 0.2 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
37
B.2.19. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-21
0 0.05 0.1 0.15 0.2 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.20. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-22
0 0.1 0.2 0.3 0.4 0.5 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
B.2.21. Grafik konsentrasi unsur Fe terhadap sampel pada minggu ke-23
0 0.02 0.04 0.06 0.08 0.1 0.12 0 1 2 3 4 5 6 Sampel K o n sen trasi F e (m g/ l)
LAMPIRAN C
Rincian Pembuatan Larutan Standart Fe
Untuk memudahkan pengukuran, konsentrasi larutan induk Fe sebesar 393.9 mg/l diencerkan terlebih dahulu menjadi 98,48 mg/l. Selanjutnya, larutan standart Fe pada konsentrasi yang berbeda, dibuat sebagai berikut:
− Larutan Fe 0,98 mg/l
larutan Fe 0,98 mg/l diperoleh dari pengenceran 1 ml larutan induk Fe 98,48 mg/l dengan aquades pH=1 hingga volumenya 1 l.
− Larutan Fe 1,97 mg/l
larutan Fe 1,97 mg/l diperoleh dari pengenceran 2 ml larutan induk Fe 98,48 mg/l dengan aquades pH=1 hingga volumenya 1 l.
− Larutan Fe 2,95 mg/l
larutan Fe 2,95 mg/l diperoleh dari pengenceran 3 ml larutan induk Fe 98,48 mg/l dengan aquades pH=1 hingga volumenya 1 l.
− Larutan Fe 3,93 mg/l
larutan Fe 3,93 mg/l diperoleh dari pengenceran 4 ml larutan induk Fe 98,48 mg/l dengan aquades pH=1 hingga volumenya 1 l.
− Larutan Fe 4,92 mg/l
larutan Fe 4,92 mg/l diperoleh dari pengenceran 5 ml larutan induk Fe 98,48 mg/l dengan aquades pH=1 hingga volumenya 1 l.
LAMPIRAN D
Material pada Tabung Sand Filter dan Tabung Karbon Aktif Gambar D.I. Pasir kuarsa sebelum dipakai (a), pasir kuarsa setelah
dipakai (b).
(a) (b)
Gambar D.II. Arang aktif sebelum dipakai (a), arang aktif setelah
dipakai (b).
(a) (b)


![Gambar 3. Satu unit alat spektrofotometer serapan atom [Price, 1972]](https://thumb-ap.123doks.com/thumbv2/123dok/2036400.2689050/22.892.129.770.316.955/gambar-satu-unit-alat-spektrofotometer-serapan-atom-price.webp)
![Gambar 4. Sistem penyaringan air di Kampus III Universitas Sanata Dharma [CV. Jaya Sakti, 2005]](https://thumb-ap.123doks.com/thumbv2/123dok/2036400.2689050/23.892.134.770.355.1046/gambar-sistem-penyaringan-kampus-universitas-sanata-dharma-sakti.webp)