Oleh
Silvya Indah Bunga Rosari Poli A34304058
PROGRAM STUDI HORTIKULTURA
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR 2009
PENGARUH IBA DAN NAA TERHADAP STEK AGLAONEMA VAR. DONNA CARMEN DENGAN PERENDAMAN
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
Oleh
Silvya Indah Bunga Rosari Poli A34304058
PROGRAM STUDI HORTIKULTURA
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR 2009
Judul : PENGARUH IBA DAN NAA TERHADAP STEK AGLAONEMA VAR. DONNA CARMEN DENGAN PERENDAMAN
Nama : Silvya Indah Bunga Rosari Poli
NRP: : A34304058
Program Studi : Hortikultura
Menyetujui, Dosen Pembimbing
Prof. Dr. Ir. Nurhajati Ansori Mattjik, MS NIP. 130 367 074
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr. Ir. Didy Sopandi, M. Agr NIP. 131 124 019
RINGKASAN
SILVYA INDAH BUNGA ROSARI POLI. Pengaruh IBA dan NAA terhadap Stek Aglaonema var Donna Carmen dengan Perendaman. Dibimbing oleh Nurhajati Ansori Mattjik.
Penelitian yang dilakukan bertujuan untuk mempelajari dan menganalisis pengaruh pemberian zat pengatur tumbuh kombinasi IBA dan NAA terhadap pertumbuhan dan pengakaran stek Aglaonema var Donna Carmen dengan perendaman. Penelitian ini dilaksanakan pada bulan Agustus sampai Oktober 2008. Penelitian dilaksanakan di rumah plastik, University Farm, Fakultas Pertanian, Institut Pertanian Bogor.
Rancangan percobaan yang digunakan yaitu rancangan acak lengkap (RAL) satu faktor yaitu faktor kombinasi konsentrasi IBA dan NAA. Penelitian ini terdiri atas 12 perlakuan yaitu 0 ppm NAA +0 ppm IBA sebagai kontrol (P1), 0 ppm NAA + 0.5 ppm IBA (P2), 0 ppm NAA + 1 ppm IBA (P3), 0 ppm NAA + 1.5 ppm IBA (P4), 0.5 ppm NAA + 0 ppm IBA (P5), 0.5 ppm NAA + 0.5 ppm IBA (P6), 0.5 ppm NAA + 1 ppm IBA (P7), 0.5 ppm NAA + 1.5 ppm IBA (P8), 1 ppm NAA + 0 ppm IBA (P9), 1 ppm NAA + 0.5 ppm IBA (P10), 1 ppm NAA + 1 ppm IBA (P11), 1 ppm NAA + 1.5 ppm IBA (P12).
Hasil penelitian menunjukkan bahwa waktu tumbuh akar berpengaruh sangat nyata dan perlakuan dengan waktu tumbuh tercepat adalah pada perlakuan 0 ppm NAA + 1.5 ppm IBA (P4) dengan waktu 1.5 MST (Minggu Setelah Tanam). Pada peubah jumlah daun, panjang daun, dan lebar daun memberikan pengaruh yang tidak berbeda nyata. Peubah panjang akar berbeda sangat nyata pada 1 MST dan 2 MST tetapi dari 3 MST sampai 12 MST tidak berbeda nyata. Perlakuan 0 ppm NAA + 1 ppm IBA mampu mendorong pertumbuhan akar terpanjang (6.8 cm). Pada peubah jumlah akar berbeda sangat nyata pada 1 MST dan 2 MST, berbeda nyata pada 3 dan 4 MST, sedangkan untuk 5-12MST tidak berbeda nyata. Perlakuan 0 ppm NAA + 1.5 ppm IBA hanya mampu meningkatkan pertumbuhan akar pada 1 MST karena dari 2-12 MST perlakuan ini tidak berbeda nyata dengan kontrol.
Penulis dilahirkan di Surabaya tanggal 21 Juni 1985 dan merupakan anak ketiga dari 4 bersaudara. Jenjang pendidikan penulis yaitu TKK Santa Clara Surabaya pada tahun 1990-1991, SMPK Santo Yosef Surabaya pada tahun 1998-2001 dan SMAN 17 Surabaya pada tahun 1998-2001-2004.
Penulis diterima di Institut Pertanian Bogor pada tahun 2004 dan masuk ke dalam Program Studi Hortikultura melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Selama menjalankan aktivitas sebagai mahasiswa penulis mengikuti organisasi dan kegiatan kampus yaitu Agrifarma (Herbal Club), Himasurya Plus (Himpunan Mahasiswa Surabaya Sidoarjo Gresik dan Mojokerto) dan sebagai penerima hibah dalam Program Kreativitas Mahasiswa (PKM) dengan topik “Meraih Peluang Bisnis Tanaman Hias dengan Kultur Jaringan Skala Rumah Tangga” yang didanai oleh DIKTI.
Selama menempuh studi SMP dan SMA penulis aktif dalam berbagai kegiatan OSIS. Pada tahun 2003 pernah menjadi ketua LDKS (Latihan Dasar Kepemimpinan Siswa) dalam rangka regenerasi pengurus OSIS SMAN 17 Surabaya. Penulis juga aktif dalam kegiatan olahraga, pada tahun 2002 pernah terpilih sebagai wakil Surabaya untuk tim bola voli tingkat nasional. Pada saat yang sama juga pernah menjadi juara 2 bola voli tingkat SMA se-Surabaya pada DIES Natalis Universitas Airlangga Surabaya. Pada tahun 2005 juga pernah menjadi juara 2 Olimpiade IPB sebagai wakil dari TPB. Penulis juga berinisiatif melakukan magang sebagai tambahan wawasan di bidang pertanian diantaranya yaitu magang di Saung Mirwan Nursery (nursery tanaman hias dan sayuran) selama 2 bulan, magang di Agropromo Nursery (nursery tanaman hias dan bibit buah-buahan) selama 1 bulan, dan magang di Mandiri Jaya Flora Nursery (nursery tanaman hias) selama 2 bulan.
KATA PENGANTAR
Puji syukur kehadirat Tuhan Yang Maha Esa yang telah melimpahkan kasih dan anugerahNya sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Penulisan skripsi ini merupakan tugas akhir dan salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada program studi Hortikultura, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Dengan terselesaikannya penulisan skripsi ini, penulis mengucapkan terima kasih kepada:
1. Prof. Dr. Ir. Nurhajati Ansori Mattjik, MS selaku dosen pembimbing skripsi yang telah memberikan bimbingan, pengarahan dan saran. 2. Dr. Ir. Darda Efendi, MS selaku dosen pembimbing akademik. 3. PT YETTA atas kepercayaan dan kerja samanya selama penelitian. 4. Keluarga tercinta (Papa, Mama, Mas Nunus, Mas Wawan, dan Lia) yang
selalu memberikan semangat, kasih sayang, perhatian, doa dan dukungan. 5. Keluarga di Kediri (Bapak, Ibu, Mak Yah, Mbok, Mas Dodik, Kak Luluk)
yang terus memberi semangat, perhatian, motivasi, doa dan dukungan. 6. Keluarga di Bogor (Om Wolter, Tante Hok, Om Acong, Tante Syenny,
Tante Yayah, Tante Iwah) yang sabar membimbing dan menyemangati. 7. Seluruh teman-teman kampus yang telah memberikan inspirasi dan
dukungan (Putri, Dyah, Prima, Rima, Kak Rahmat, Santi, Lena).
8. Seluruh teman-teman Youth di Bogor dan Surabaya yang telah menjadi sahabat penulis (Ko Baru, Yohanes, Mey, Rico, Renit, Irfan, Prianto, Mas Sius, Elisa, Dewi, Agus, Yusuf, Hari, Samuel).
Penulis berharap skripsi ini dapat memberikan manfaat bagi perkembangan ilmu pengetahuan khususnya di bidang pertanian. Penulis menerima saran dan kritik yang membangun karena penulis sadar masih banyak kekurangan dalam penulisan skripsi ini.
Bogor, 7 September 2009 Penulis
Halaman PENDAHULUAN Latar Belakang... 1 Tujuan ... 3 Hipotesis... 3 TINJAUAN PUSTAKA Botani Umum... 4 Syarat Tumbuh... 4 Perbanyakan Tanaman... 6
Zat Pengatur Tumbuh... 8
BAHAN DAN METODE Waktu dan Tempat... 12
Bahan dan Alat... 12
Metode Penelitian... 12
Pelaksanaan... 13
Pengamatan... 14
HASIL DAN PEMBAHASAN Keadaan Umum... 15
Hasil... 16
Pembahasan... 23
KESIMPULAN DAN SARAN Kesimpulan... 28
Saran... 28
DAFTAR PUSTAKA... 29
DAFTAR TABEL
Nomor Halaman
Teks
1. Rekapitulasi Sidik Ragam Tanaman Aglaonema var Donna
Carmen pada berbagai Peubah Pengamatan... 16
2. Waktu Tumbuh Akar Aglaonema var Donna Carmen pada berbagai Perlakuan... 18
3. Jumlah Akar Aglaonema var Donna Carmen pada berbagai Perlakuan... 19
4. Panjang Akar Aglaonema var Donna Carmen pada berbagai Perlakuan... 20
Lampiran 1 Sidik Ragam Waktu Tumbuh... 31
2. Sidik Ragam Jumlah Akar... 31
3. Sidik Ragam Panjang Akar... 32
4. Sidik Ragam Jumlah Daun... 33
5. Sidik Ragam Panjang Daun... 34
Nomor Halaman
Teks
1. Aglaonema var Donna Carmen yang banyak ditemui di pasaran... 1
2. Tahap-tahap Pelaksanaan Penelitian... 14
3. a. Stek Aglaonema var Donna Carmen di Lokasi Penelitian... 15
b. Akar Stek Aglaonema var Donna Carmen umur 12 MST... 15
4. Aglaonema var Donna Carmen pada Berbagai Perlakuan umur 12 MST ... 17
5. Jumlah Daun Aglaonema var Donna Carmen pada berbagai perlakuan umur 12 MST... 21
6. Panjang Daun Aglaonema var Donna Carmen pada berbagai perlakuan umur 12 MST... 21
7. Lebar Daun Aglaonema var Donna Carmen pada berbagai perlakuan umur 12 MST... 21
PENDAHULUAN
Latar BelakangSalah satu trend tanaman hias yang sangat digemari masyarakat adalah Aglaonema. Sisi menarik dari Aglaonema sebenarnya bukan dari bunganya, namun daunnya yang semarak dengan corak aneka warna sehingga Aglaonema dijuluki dengan “ratu daun”. Tanaman ini sangat cocok diletakkan sebagai penghias teras, tanaman indoor (tanaman hias ruangan), table plant (diletakan di atas meja) atau ditanam di lahan yang teduh. Tono (2002) menyatakan bahwa tanaman hias daun yang paling disukai untuk menghias ruangan berturut-turut adalah Aglaonema, Dieffenbachia, Dracaena dan jenis-jenis Palem. Aglaonema juga tahan dalam ruangan ber-AChingga satu bulan.
Aglaonema dikenal dengan nama Chinese evergreen karena tanaman ini beberapa abad yang lalu lebih banyak dikembangkan di Cina kemudian dikenalkan ke Eropa dan Amerika. Swthinbank (1991) menyatakan bahwa Aglaonema memiliki harga jual yang tinggi namun bagi para penggemar tanaman hias, bukan suatu masalah jika harus mengeluarkan uang hanya untuk membeli Aglaonema. Aglaonema ada yang spesies dan ada juga yang hibrida/silangan. Ciri utama Aglaonema spesies adalah warna daun dominan hijau dan kombinasi hijau putih sedangkan Aglaonema hibrida/silangan memiliki daun lebih berwarna-warni
Gambar 1. Aglaonema var Donna Carmen yang banyak ditemui di Pasaran
Greg Hambali, pemulia tanaman asli Indonesia, telah mengembangkan Aglaonema hibrida antara lain Pride of Sumatra dan Donna Carmen. Donna Carmen adalah hasil persilangan antara A. brevispathum sebagai induk jantan pembawa warna merah dengan A. commutatum sebagai induk betina. Asal nama Donna Carmen diambil dari nama penjual nasi di Costa Marques - Brazil, tempat
dimana Greg Hambali singgah untuk makan selama ekspedisinya.
Dalam klasifikasi penamaan ilmiah, Aglaonema masih satu family dengan Anthurium, Spathipyllum, Philodendron dan Dieffenbachia yaitu family talas-talasan. Aglaonema menjadi tanaman yang sangat populer karena munculnya hibrida-hibrida baru. Harga Aglaonema tidak kalah bersaing dengan tanaman hias lainnya yaitu bisa mencapai ratusan ribu per lembar daunnya. Semakin mahal harga tanaman Aglaonema semakin bagus pula warna, pola dan keunikannya (Bicknell and Seddon, 1994).
Sebenarnya Aglaonema bukan tanaman baru, dulu orang mengenal dengan sebutan Sri Rejeki. Konon orang yang menanam tanaman ini dan tumbuh subur akan mendapatkan banyak rejeki. Terlepas dari mitos pembawa hoki, Aglaonema kini makin banyak diminati oleh para kolektor tanaman hias. Aglaonema sudah ada di Indonesia sejak lama, terbukti dengan ditemukannya Aglaonema novoguineense Engl, dan Aglaonema simplex BL di Kebun Raya Bogor pada tahun 1920 (Anonim a, 2008).
Menanam Aglaonema sebenarnya tidak sulit karena tanaman ini mudah dirawat. Banyak cara bisa dilakukan, seperti cara vegetatif (stek batang, pemisahan rumpun/anakan) dan generatif (penyemaian biji). Stek batang dan pemisahan anakan merupakan cara yang paling mudah dilakukan. Untuk stek batang, pilih batang yang tidak terlalu tua tapi juga tidak terlalu muda, potong dengan menyisakan dua mata tunas. Tanam dalam media pasir halus dan siram secara teratur. Setelah satu bulan biasanya batang sudah berakar dan daun mulai muncul.
Acquaah (2004) menyatakan bahwa penggunaan zat pengatur tumbuh sangat berpengaruh terhadap tanaman. Salah satu jenis zat pengatur tumbuh adalah auksin. Auksin ada yang sintetik (IBA dan NAA) dan alami (IAA). Salah satu fungsi auksin adalah untuk inisiasi akar. Hasil penelitian Kana (1993) menyatakan bahwa respon panjang akar, berat kering akar dan volume akar tertinggi pada tanaman kedelai diperoleh pada pemberian konsentrasi IBA 400 ppm dengan metode semprot.
3
Tujuan
Penelitian ini bertujuan untuk mempelajari pengaruh pemberian zat pengatur kombinasi IBA dan NAA terhadap pengakaran stek Aglaonema var Donna Carmen dengan perendaman.
Hipotesis
Pemberian kombinasi zat pengatur tumbuh IBA dan NAA pada konsentrasi tertentu akan menghasilkan pengakaran stek yang baik dari Aglaonema var Donna Carmen melalui metode perendaman.
TINJAUAN PUSTAKA
Botani UmumAglaonema berasal dari bahasa Yunani dari kata aglaos (terang, mengkilap, atau cemerlang) dan nema/nematos (benang), dengan demikian Aglaonema dapat bermakna energi pembawa terang. Pemberi nama Aglaonema adalah Heinrich Wilhelm Scott seorang peneliti Botani kelahiran Brunn, Morovia Cekoslovakia (Anonim b, 2008).
Tanaman Aglaonema termasuk tanaman monokotil, berakar serabut, berbatang sukulen, berdaun menyirip serta memiliki pembuluh pengangkut berupa xilem dan floem yang tersusun secara acak. Akar dapat menentukan kondisi tanaman. Jika akar berwarna putih maka tanaman dalam keadaan sehat, bila berwarna coklat menandakan tanaman sakit. Pada akar tumbuh rambut akar, makin banyak rambut akar makin cepat pertumbuhannya. Ruas batang yang terendam tanah, jika kondisi optimumnya terpenuhi, maka akan keluar tunas-tunas baru (Rochmin dan Harjadi, 1973).
Bunga keluar dari ketiak daun dan berwarna putih yang ditopang oleh batang. Bunga termasuk uniseksual yaitu bagian bunga betina dan jantan terdapat dalam satu bunga. Organ produksinya mempunyai waktu matang yang berbeda. Oleh karena itu terjadi penyerbukan silang yang kadangkala memerlukan bantuan manusia. Buah hasil penyerbukan akan matang pada umur 8 bulan. Kini berbagai macam Aglaonema hibrida telah dikembangkan dengan penampilan tanaman yang sangat menarik dengan bermacam-macam warna, bentuk, dan ukuran daun.
Syarat Tumbuh
Macdonald (1973) menyatakan bahwa Aglaonema berasal dari negara Asia beriklim tropis terutama Asia Tenggara seperti Filipina, Indonesia, Malaysia, Thailand, Laos, Vietnam, Brunai Darussalam, Myanmar, dan Bangladesh lalu tanaman ini menyebar ke Cina, Florida, dan Amerika. Tanaman ini hidup di hutan hujan tropis yang teduh. Syarat-syarat tumbuh Aglaonema meliputi ketinggian, suhu, kelembaban, cahaya, keasaman, dan porositas. Media tanam untuk Aglaonema sebaiknya memiliki aerasi yang baik. Hasil penelitian Diputra (2006)
5
menunjukkan bahwa media campuran tanah, pukan ayam, dan pasir memberikan hasil terbaik bagi pertambahan daun dan jumlah anakan Aglaonema var Donna Carmen.
Ketinggian. Aglaonema yang bertekstur tebal, corak daun terang, dan sosok kokoh dapat tumbuh di dataran sedang maupun rendah. Di dataran rendah daun lebih cepat tumbuh sekitar 25-30 hari sedangkan di dataran sedang bisa sampai 35 hari.
Suhu. Aglaonema dapat tumbuh baik pada suhu antara 24-30°C di siang hari dan 18-24°C di malam hari. Suhu yang terlalu rendah menyebabkan kekurangan fosfor dan merangsang produksi klorofil sehingga dapat menutup warna merah pada daun. Suhu terlalu tinggi membuat daun menjadi pucat.
Kelembaban.Aglaonema akan tumbuh dengan baik pada kelembaban 50-75%. Kelembaban di bawah 50% menyebabkan daun cepat kering dan layu. Kelembaban di atas 75% menyebabkan tumbuh cendawan pada media tanam.
Cahaya. Aglaonema yang terlalu banyak terkena sinar matahari akan menyebabkan daun terbakar dan menguning lalu coklat kehitaman. Bila lokasi penanaman di dataran sedang sebaiknya menggunakan shading net 75% agar hanya 25% cahaya yang masuk. Di dataran rendah dianjurkan menggunakan shading net 80-85%.
Keasaman. Tingkat keasaman mempengaruhi daya serap akar terhadap hara. Aglaonema tumbuh dengan baik pada pH 7 atau disebut pH netral. Unsur-unsur zat hara tersedia secara optimal pada media tanam bila tingkat keasaman (pH) berkisar 6-7. Tingkat keasaman yang rendah dapat merusak sel-sel akar karena kandungan mangan yang berlebihan. Kondisi asam juga memicu jumlah alumunium yang berlebihan sehingga menghambat penyerapan fosfor oleh akar. Sedangkan bila pH tinggi (basa), beberapa jenis cendawan lebih mudah muncul sehingga mengganggu pertumbuhan. Bila pH rendah gunakan kalsit atau dolomit. Bila pH tinggi, turunkan dengan menggunakan belerang.
Porositas. Porositas mempengaruhi kelembaban media tanam. Tingkat porositas media yang diperlukan tanaman tergantung pada ketinggian daerah dan kelembaban udara. Pada dataran rendah yang curah hujan rendah dan panas, media tanam sebaiknya yang bisa menahan air sehingga media tidak kering. Pada
dataran tinggi yang umumnya sering hujan, gunakan media dengan porositas tinggi.
Pertumbuhan tanaman juga tidak terlepas dari peran unsur makro terutama untuk fungsi perakaran. Unsur makro tanaman yaitu N, P, K, Ca, S dan Mg. Nitrogen berfungsi untuk pembentukan atau pertumbuhan bagian vegetatif tanaman, seperti daun, batang dan akar serta meningkatkan mutu tanaman penghasil daun-daunan. Fungsi fosfor adalah merangsang pertumbuhan akar, khususnya akar benih/tanaman muda. Fungsi kalium adalah meningkatkan daya tahan tanaman terhadap kekeringan dan penyakit.
Perbanyakan Tanaman
Perbanyakan Aglaonema dapat dilakukan secara generatif maupun vegetatif. Menurut McMahon et al. (2007) stek batang biasa digunakan untuk pembiakan tanaman herbaceous seperti Coleus, Carnation dan Aglaonema karena mudah berakar. Pertumbuhan akar pada stek batang tergantung dari spesies dan kultivar. Menurut Wudianto (1996) stek adalah salah satu teknik pembiakan vegetatif dengan cara memisahkan organ akar, batang atau daun dari tanaman induknya dengan tujuan agar bagian tersebut membentuk tanaman yang baru. Soerianegara dan Djamhuri (1979) menambahkan bahwa stek merupakan pembiakan tanaman dengan menggunakan bagian vegetatif tanaman yang dipisahkan dari pohon induknya dimana pada kondisi yang menguntungkan untuk beregenerasi akan berkembang menjadi tanaman yang sempurna.
Stek terbagi atas stek akar, batang, dan daun. Stek batang terdiri atas
hardwood, semi hardwood, softwood, dan herbaceous stek. Faktor-faktor yang mempengaruhi pertumbuhan stek adalah kondisi fisiologis tanaman induk (stock plant), umur tanaman induk, jenis bahan stek, waktu pengambilan stek, zat pengatur tumbuh (ZPT), adanya tunas dan daun, umur bahan stek, dan kondisi lingkungan (Dawson and King, 1994)
Kondisi Fisiologis Tanaman Induk (Stock Plant). Kandungan nutrisi dari stock plant memiliki pengaruh yang kuat pada proses pembentukan akar dan tunas stek yang bahannya diambil dari bagian tanaman tertentu. Kadar nitrogen yang rendah dan kadar karbohidrat yang tinggi pada stock plant cenderung
7
memberi kesempatan kepada stek membentuk perakaran baru.
Umur Tanaman Induk. Hartman et al. (1990) menyatakan bahwa pada tanaman yang mudah diperbanyak melalui stek, pengaruh umur dari stock plant
yang digunakan sebagai bahan stek tidak memberikan pengaruh yang besar. Tetapi pada tanaman yang tergolong sulit dibiakkan melalui stek, faktor umur menjadi sangat penting. Smits dan Yasman (1986) menambahkan bahwa pada umumnya stek batang dan stek akar yang diambil dari bahan tanaman muda akan berakar lebih cepat dibanding bahan tanaman tua. Umur bahan stek sangat menentukan terhadap keberhasilan stek yang dibuat.
Jenis Bahan Stek.Bagian tanaman yang muda dan subur dapat digunakan sebagai bahan stek, karena bagian ini mempunyai jaringan yang belum terdiferensiasi sehingga memudahkan terjadinya diferensiasi primordia akar, serta mempunyai tunas yang sudah atau siap terbentuk (Weaver, 1972).
Waktu Pengambilan Stek. Perbanyakan deciduous species secara
hardwood stek, pengambilan stek sebaiknya dilakukan selama periode dorman. Sedangkan pada kayu lunak berdaun lebat (leafy softwood) dan semi hardwood, stek sebaiknya disiapkan selama periode tumbuh (growing season) menggunakan bagian sukulen ataupun yang dewasa. Jenis evergreen daun lebar atau daun sempit memiliki satu atau lebih masa pertumbuhan yang menggelora pada tahun yang bersangkutan dan stek dapat diperoleh dalam waktu yang bervariasi yang berhubungan dengan masa-masa pertumbuhan menggelora tersebut. (Hartman et al., 1990).
Adanya Tunas dan Daun. Tunas diperlukan untuk mendorong terjadinya perakaran stek, pembentukan akar tidak akan terjadi bila seluruh tunas dihilangkan atau dalam keadaan dorman. Tunas berperan sebagai sumber auksin, terutama bila tunas tersebut mulai tumbuh. Baik auksin yang dihasilkan oleh tunas maupun daun, bersama-sama dengan rooting cofactor akan bergerak ke bawah atau basipetaldan menumpuk di dasar stek (Hartman and Kester, 1983).
Penggunaan zat Pengatur Tumbuh (ZPT). Stek dapat diberi perlakuan-perlakuan yang salah satunya adalah dengan memberi perlakuan-perlakuan Zat Pengatur Tumbuh (ZPT) yang dapat memicu pertumbuhan tanaman. Ada beberapa golongan ZPT seperti sitokinin, auksin, dan giberelin. Auksin telah diketahui
memberi respon yang besar terhadap pembentukan akar. Macdonald (1973), melaporkan bahwa untuk pemakaian secara umum dalam rangka merangsang perakaran stek batang tanaman, IAA, IBA dan NAA dapat direkomendasikan. Smits dan Yasman (1988), juga mengemukakan proses pemberian hormon pada stek memegang peranan sangat penting untuk keberhasilan stek.
Umur Bahan Stek. Stek yang diambil dari tanaman yang berumur lebih muda akan lebih mudah berakar dibanding dengan dari tanaman yang lebih tua. Tetapi bila stek tanaman tersebut sangat muda dan lunak, maka proses transpirasi akan berlangsung dengan cepat, sehingga stek menjadi lemah dan akhirnya mati (Rochmin dan Harjadi, 1973).
Kondisi Lingkungan. Air, temperatur, sinar/cahaya, dan media perakaran mempengaruhi pertumbuhan stek. Media untuk stek yang ideal adalah media dengan porositas yang cukup agar diperoleh aerasi yang baik dengan kapasitas menahan air yang tinggi, drainase baik dan bebas dari bahaya fungi serta bakteri. Rahardja dan Wiryanta (2003), menyebutkan bahwa media perakaran dimana kondisi aerasi dan drainasenya jelek akan menurunkan daya hidup.
Zat Pengatur Tumbuh
Hormon adalah senyawa tertentu yang disintesis di bagian tertentu dari tanaman dan ditransportasikan ke jaringan target dimana senyawa tersebut menunjukkan pengaruhnya. Hormon tanaman adalah senyawa-senyawa organik tanaman yang diberikan dalam konsentrasi rendah bertujuan untuk mempengaruhi proses-proses fisiologis. Hormon tanaman pada umumnya dikenal dengan nama zat pengatur tumbuh tanaman. Menurut Audus (1953) zat pengatur tumbuh adalah senyawa organik bukan nutrisi yang dalam konsentrasi rendah (<1mM) dan berfungsi untuk mendorong, menghambat, atau secara kualitatif mengubah pertumbuhan dan perkembangan tanaman. Pada saat ini dikenal 6 kelompok zat pengatur tumbuhan yaitu auksin, sitokinin, giberelin, asam absisik (ABA), etilen, dan retardan.
Auksin alami/endogen berasal dari tanaman itu sendiri, contoh : IAA (Indole-3-acetic acid). IAA disintesiskan dari triptofan di primordia daun, daun muda, dan biji yang sedang berkembang. Translokasi di dalam tanaman terjadi
9
melalui floem. Auksin sintetik/eksogen berasal dari luar tanaman, contoh : IBA (Indole-3-butyric acid) dan NAA (Naphtalene acetic acid).
Menurut Weaver (1972) IBA mempunyai aktivitas auksin yang lemah, zat kimia bersifat stabil dan tetap berada pada daerah tempat pemberian perlakuan, translokasinya berlangsung lebih lambat sehingga bahan aktifnya akan tertahan didekat tempat aplikasinya. Sedangkan NAA memiliki sifat yang lebih racun daripada IBA dan penggunaan konsentrasi yang terlalu tinggi harus dihindari karena dapat menyebabkan pelukaan pada tanaman. Hasil penelitian Darliah et al.
menunjukkan bahwa pemberian IBA dengan lama perendaman 5 detik dan konsentrasi 1000 ppm adalah yang terbaik untuk meningkatkan panjang akar stek mawar sedangkan konsentrasi IBA yang terbaik untuk meningkatkan jumlah akar adalah 2000 ppm.
Menurut Wattimena (1988) fungsi auksin adalah mendorong perpanjangan sel, pembelahan sel, differensiasi jaringan xilem dan floem, penghambatan mata tunas samping, absisi (pengguguran daun), aktivitas kambium, dan pembentukan akar. Selang konsentrasi auksin untuk pembesaran sel-sel pada batang menjadi penghambat pada pembesaran sel-sel akar. Auksin mempunyai pengaruh besar terhadap pembentukan akar stek. Selang konsentrasi yang mendorong pembesaran sel-sel pada akar adalah sangat rendah. Auksin pada konsentrasi tinggi dapat menghambat pembesaran sel-sel akar. Davies and Joiner (1978) menyatakan bahwa perlakuan IBA yang terbaik yaitu perendaman dengan konsentrasi 1000 -1500 ppm untuk stek daun muda dan 2000 - 3000 ppm untuk daun tua pada tanaman Ficus pumika.
Dewasa ini IBA dan NAA masih digunakan secara luas untuk pengakaran stek batang. Persentase pengakaran tertinggi pada Rosa canina adalah IBA 4000 ppm dan pada Rosa dumalis adalah IBA 2000 ppm (Ercisli, 2004). Pada tahun 1930-an diteliti bahwa auksin alami (IAA) mampu menstimulasi inisiasi akar pada stek batang. Seiring berkembangnya ilmu pengetahuan, ternyata daya kerja IBA dan NAA lebih efektif dibandingkan IAA. Konsentrasi optimum auksin untuk merangsang pertumbuhan akar bervariasi tergantung spesies tetapi berkisar antara 2000 - 10000 ppm.
pembelahan inisial akar pertama tergantung pada auksin endogen maupun yang diaplikasikan dari luar. Hasil penelitian Purwani (2003) menunjukkan bahwa taraf konsentrasi BAP 5 ppm dan NAA 0,5 ppm memiliki rata-rata tertinggi terhadap jumlah akar tunas aksilar pada tanaman anggrek Vandasp. secara in vitro.
Peran auksin dalam proses perkembangan akar melibatkan dua tahap. Tahap pertama yaitu stadia inisiasi akar, dimana meristem dibentuk termasuk dediferensiasi, inisial akar, dan pembentukan primordia akar. Stadia inisiasi akar ada 2 jenis yaitu stadia aktif auksin (sekurang-kurangnya selama 4 hari, dimana auksin harus disuplai terus-menerus untuk pembentukan akar) dan stadia auksin in
aktif (penambahan auksin pada stadia ini tidak begitu mempengaruhi pembentukan akar). Tahap kedua adalah stadia pemanjangan primordia akar. Ujung akar tumbuh keluar melalui korteks kemudian muncul dari epidermis batang, pada stadia ini tidak ada respon terhadap aplikasi auksin (Wattimena, 1991).
Menurut Weaver (1972) zat pengatur tumbuh dapat menstimulasi perakaran spesies tanaman yang mudah berakar tetapi mungkin juga tidak dapat menginduksi spesies tanaman yang sulit berakar. Jika stek dapat dengan mudah berakar tanpa perlakuan zat pengatur tumbuh maka tidak dibutuhkan perlakuan tambahan. Sebagian besar tanaman hias seperti chrysanthemum, Aglaonema, Geranium, Carnation, Begonia, dan Poinsettia memiliki respon yang baik terhadap perlakuan zat pengatur tumbuh.
Faktor-faktor yang mempengaruhi aktivitas dari auksin sintetik adalah : (1) kesanggupan senyawa tersebut untuk dapat menembus kutikula/epidermis yang berlilin; (2) sifat translokasi di dalam tanaman; (3) pengubahan auksin menjadi senyawa yang tidak aktif di dalam tanaman (destruktif/pengikatan); (4) berinteraksi dengan hormon tumbuh lainnya; (5) spesies tanaman; (6) fase pertumbuhan; (7) lingkungan (suhu, radiasi dan kelembaban). Hasil penelitian Silalahi (2007) menunjukkan bahwa tingkat kesensitifan tanaman terhadap auksin berpengaruh terhadap pertumbuhan tanaman. Tanaman Aglaonema termasuk peka terhadap auksin.
Menurut Weaver (1972) ada 3 cara aplikasi zat pengatur tumbuh yang sering digunakan yaitu : (1) commercial powder preparation (pasta); (2) dilute
11
solution soaking method (perendaman); (3) cocentrated solution dip method
(pencelupan cepat). Aplikasi auksin dalam bentuk tepung dan penyemprotan juga dapat dilakukan. Konsentrasi yang digunakan pada pencelupan cepat adalah 500 – 10000 ppm, pangkal batang dicelupkan dalam larutan zat pengatur tumbuh selama 5 detik. Konsentrasi untuk perendaman adalah 20 – 200 ppm, pangkal batang direndam dalam larutan selama 24 jam. Pencelupan dan perendaman menggunakan bahan pelarut alkohol. Konsentrasi untuk pasta adalah 200 – 1000 ppm untuk stek berbatang lunak sedangkan stek berbatang keras membutuhkan konsentrasi lima kali lebih tinggi.
Avery dan Johnson (1947) menyatakan bahwa metode perendaman dilakukan dengan cara merendam stek selama kira-kira 24 jam pada kedalaman 1 inchi dengan konsentrasi zat pengatur tumbuh 10 – 100 ppm. Menurut Leopold (1963) biasanya konsentrasi auksin yang digunakan berkisar antara 25 – 100 ppm, sedangkan menurut Arteca (1996) pada umumnya konsentrasi auksin yang digunakan berkisar 20 ppm untuk spesies yang mudah berakar dan 200 ppm untuk spesies yang sulit berakar.
Cara aplikasi zat pengatur tumbuh tanaman melalui perendaman adalah metode praktis yang paling awal ditemukan dan sampai sekarang masih dipandang paling efektif. Pada stek yang berkayu lembut (softwood, herbaceous) jumlah larutan yang diabsorbsi akan tergantung pada jumlah air yang diabsorbsi. Menurut Audus (1953) metode perendaman sangat sesuai digunakan untuk tanaman herbaceous supaya terhindar dari keracunan pada tanaman.
Stoutemyer (1954) menyatakan bahwa akar hasil aplikasi zat pengatur tumbuh bersifat sama seperti akar yang diproduksi secara normal tanpa aplikasi zat pengatur tumbuh namun kualitas dan susunan akar pada batang dapat beragam sesuai dengan konsentrasi dan kandungan zat pengatur tumbuh yang diberikan. Weaver (1972) menambahkan bahwa senyawa yang berbeda mempunyai pengaruh yang berbeda terhadap kuantitas dan kualitas perakaran yang diinduksi.
BAHAN DAN METODE
Waktu dan TempatPenelitian ini dilaksanakan pada bulan Agustus sampai Oktober 2008 di Rumah Plastik,University Farm,Institut Pertanian Bogor.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah stek tanaman Aglaonema var Donna Carmen yang panjang batangnya 5-6 cm dan tidak berakar serta memiliki 4-5 helai daun. Bahan yang digunakan untuk perlakuan adalah zat pengatur tumbuh IBA, NAA, aquades dan pupuk lengkap Grow More.
Alat-alat yang digunakan adalah botol air mineral (besar), stereoform, polybag, timbangan analitik, gelas ukur, gelas piala, sudip, pisau stek, mistar, dan alat penunjang lainnya.
Metode
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap satu faktor yaitu faktor kombinasi konsentrasi IBA dan NAA yang terdiri atas 12 perlakuan yaitu :
1. 0 ppm NAA + 0 ppm IBA (kontrol) 2. 0 ppm NAA + 0.5 ppm IBA 3. 0 ppm NAA + 1 ppm IBA 4. 0 ppm NAA + 1.5 ppm IBA 5. 0.5 ppm NAA + 0 ppm IBA 6. 0.5 ppm NAA + 0.5 ppm IBA 7. 0.5 ppm NAA + 1 ppm IBA 8. 0.5 ppm NAA + 1.5 ppm IBA 9. 1 ppm NAA + 0 ppm IBA 10. 1 ppm NAA + 0.5 ppm IBA 11. 1 ppm NAA + 1 ppm IBA 12. 1 ppm NAA + 1.5 ppm IBA
13
Setiap taraf konsentrasi/perlakuan terdiri atas 10 ulangan. sehingga total terdapat 120 satuan percobaan. Analisis statistik yang digunakan yaitu sidik ragam dengan model rancangan acak lengkap sebagai berikut:
Yijk = µ + Ai + Eijk Keterangan:
Yijk = Nilai pengamatan (respon) µ = Nilai rata-rata sesungguhnya Ai = Pengaruh perlakuan ke A Eijk = Galat percobaan
Apabila hasil sidik ragam berbeda nyata pada taraf 5% maka akan diuji lanjut menggunakan Duncan Multiple Range Test (DMRT).
Pelaksanaan 1. Persiapan bahan tanam stek
Batang stek dipotong lurus kemudian dibersihkan
Dicuci dan dibilas dengan air sebanyak 2 kali 2. Persiapan tempat larutan dan tanaman
Botol air mineral ukuran besar dipotong. bentuk seperti gelas
Stereoform dipotong dan dibentuk melingkar. ukuran disesuaikan 3. Pembuatan larutan stok terlebih dahulu. Setelah itu baru diambil sesuai
sesuai perlakuan 4. Proses perendaman
Larutan perlakuan dituang ke dalam botol
Botol ditutup dengan stereoform
Batang tanaman dimasukkan ke dalam botol yang sudah berisi larutan tadi melalui lubang stereoform sampai terendam
Botol dimasukkan ke dalam polybag
Gambar 2. Tahap-tahap Pelaksanaan Penelitian Pengamatan
Peubah-peubah yang diamati meliputi :
1. Pertama kali tumbuh akar. Peubah ini diamati setiap minggu.
2. Jumlah akar. Pengamatan dilakukan terhadap semua akar yang muncul dengan panjang minimum 2 mm. Peubah ini diamati setiap minggu.
3. Panjang akar. diukur dari pangkal perakaran hingga ujung akar yang terpanjang. Peubah ini diamati setiap 1 minggu sekali.
4. Persentase stek hidup. Stek hidup tidak menunjukkan gejala busuk atau kering. Peubah ini diamati di akhir percobaan.
Data diambil dengan rumus :
Persentase stek hidup = (jumlah stek hidup : total jumlah stek) x 100% 5. Persentase stek berakar. Stek ditandai dengan munculnya akar dengan
panjang minimum 2 mm. Peubah ini diamati di akhir percobaan. Data diambil dengan rumus :
Persentase stek berakar = (jumlah stek yang berakar : total jumlah stek) x 100%
6. Panjang daun terpanjang (diamati pada akhir percobaan) 7. Lebar daun terlebar (diamati pada akhir percobaan) 8. Jumlah daun (diamati pada akhir percobaan)
15
HASIL DAN PEMBAHASAN
Keadaan UmumDaya tumbuh stek batang tanaman Aglaonema var Donna Carmen termasuk sangat baik karena persentase stek yang bertahan hidup dan mampu menghasilkan akar adalah sebesar 100%. Tidak didapati tanaman yang menunjukkan gejala busuk atau kering. Pertumbuhan yang optimal ini didapatkan karena faktor lingkungan yang sangat mendukung. Adanya naungan plastik mengurangi intensitas cahaya matahari yang terlalu tinggi. Selain itu tegaknya daun Aglaonema merupakan mekanisme pertahanan diri agar cahaya yang menimpa daun tidak terlalu banyak. Pada saat penelitian, curah hujan juga cukup tinggi sehingga kelembaban tanaman dapat terjaga untuk menghindari penguapan yang terlalu tinggi. Penggunaan pupuk Grow More dan air aquades yang steril juga membantu pertumbuhan tanaman.
(a) (b)
Gambar 3. Stek Aglaonema var Donna Carmen di Lokasi Penelitian (a); Akar Stek Aglaonema var Donna Carmen Umur 12 MST (b).
Kondisi cuaca dan iklim saat penelitian mendukung pertumbuhan tanaman Aglaonema. Dramaga terletak pada elevasi setinggi 250 m di atas permukaan laut dan berlokasi antara 6.33 Lintang Selatan dan 106.45 Bujur Timur. Temperatur udara rata-rata adalah sebesar 25.8°C. Kelembaban udara rata-rata adalah sebesar 81.7% curah hujan rata-rata 272.2 mm/bulan (Sumber : Badan Meteorologi dan Geofisika. Dramaga. Bogor). Aglaonema dapat tumbuh baik pada suhu antara 24-30 oC di siang hari dan 18-24 oC di malam hari. Kelembaban udara di Dramaga
tumbuh cendawan pada media tanam. Namun tanaman Aglaonema termasuk memiliki daya tahan yang cukup baik sehingga meski tumbuh cendawan di sekitar media tapi tidak menginfeksi tanaman.
HASIL
Presentase Stek Hidup dan Berakar
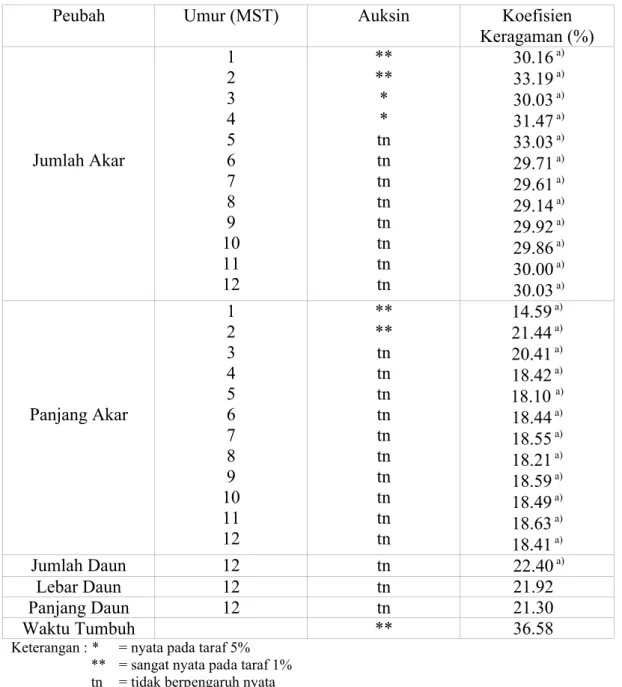
Tabel 1. Rekapitulasi Sidik Ragam Tanaman Aglaonema var Donna Carmen pada berbagai Peubah Pengamatan
Peubah Umur (MST) Auksin Koefisien
Keragaman (%) Jumlah Akar 1 2 3 4 5 6 7 8 9 10 11 12 ** ** * * tn tn tn tn tn tn tn tn 30.16a) 33.19a) 30.03a) 31.47a) 33.03a) 29.71a) 29.61a) 29.14a) 29.92a) 29.86a) 30.00a) 30.03a) Panjang Akar 1 2 3 4 5 6 7 8 9 10 11 12 ** ** tn tn tn tn tn tn tn tn tn tn 14.59a) 21.44a) 20.41a) 18.42a) 18.10 a) 18.44a) 18.55a) 18.21a) 18.59a) 18.49a) 18.63a) 18.41a) Jumlah Daun 12 tn 22.40a) Lebar Daun 12 tn 21.92 Panjang Daun 12 tn 21.30 Waktu Tumbuh ** 36.58 Keterangan : * = nyata pada taraf 5%
** = sangat nyata pada taraf 1% tn = tidak berpengaruh nyata
17
Presentase stek hidup = Jumlah stek hidup x 100% = 120 x 100% = 100% Total jumlah stek 120
Persentase stek berakar = Jumlah stek berakar x 100% = 120 x 100% = 100% Total jumlah stek 120
Gambar 4. Aglaonema var Donna Carmen pada berbagai Perlakuan Umur 12 MST
Presentase stek Aglaonema var Donna Carmen yang hidup dan memiliki akar secara keseluruhan sangat baik yaitu sebesar 100%. Tidak ada stek yang mengalami kematian sampai pada akhir pengamatan, selain itu yang mengalami gejala kebusukan dan kering juga tidak didapati pada semua tanaman percobaan. Berdasarkan hasil rekapitulasi sidik ragam (Tabel 1) Aglaonema var Donna Carmen sangat responsif terhadap aplikasi auksin eksogen terhadap peubah jumlah akar dan panjang akar yaitu pada saat 1 dan 2 MST (Minggu Setelah Tanam).
Hasil analisis ragam menunjukkan bahwa IBA dan NAA berpengaruh sangat nyata terhadap waktu tumbuh akar stek batang Aglaonema var Donna Carmen. Secara keseluruhan penambahan IBA dan NAA memberikan pengaruh yang tidak nyata terhadap peubah jumlah dan panjang akar. Namun pengaruh yang sangat nyata terhadap jumlah dan panjang akar stek batang Aglaonema var Donna Carmen tampak pada saat 1 dan 2 MST. Bahkan pada 3 dan 4 MST juga masih menunjukkan pengaruh yang nyata terhadap peubah jumlah akar.
Sedangkan untuk peubah jumlah, lebar, dan panjang daun, pemberian IBA dan NAA tidak menunjukkan pengaruh nyata.
Waktu Tumbuh Akar
Waktu tumbuh akar diamati setiap minggu yaitu pada 1–12 MST. Hasil analisa menunjukkan bahwa IBA dan NAA berpengaruh nyata terhadap waktu tumbuh akar (Tabel 1). Menurut Arteca (1996) aplikasi auksin dapat mempercepat inisiasi akar tanaman. Dapat terlihat jelas bahwa tanaman yang diberi perlakuan auksin dengan yang tidak diberi auksin terdapat perbedaan yang signifikan karena yang diberi auksin insiasi akarnya lebih cepat yaitu pada 1.5 MST yang diperlihatkan dengan perlakuan 0 ppm NAA + 1.5 ppm IBA.
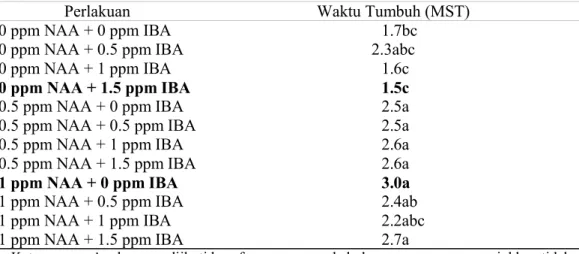
Tabel 2. Waktu Tumbuh Akar Aglaonema var Donna Carmen pada berbagai Perlakuan
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan DMRT pada taraf 5%.
Perlakuan 0 ppm NAA + 1,5 ppm IBA berbeda nyata dengan perlakuan-perlakuan yang lain namun tidak berbeda nyata dengan perlakuan-perlakuan 0 ppm NAA + 1 ppm IBA dan perlakuan kontrol. Perlakuan 0 ppm NAA + 1,5 ppm IBA memberikan hasil terbaik dengan waktu tumbuh akar tercepat (1,5 MST). Perlakuan yang paling lama mendorong munculnya akar pertama kali adalah 1 ppm NAA + 0 ppm IBA pada 3 MST. Wuryaningsih et al, (2000) melaporkan bahwa zat pengatur tumbuh IBA dengan dosis 200 - 300 ppm dengan perendaman selama 1 jam, memberikan rata-rata keberhasilan perbanyakan bibit pada 4
Perlakuan Waktu Tumbuh (MST)
0 ppm NAA + 0 ppm IBA 1.7bc
0 ppm NAA + 0.5 ppm IBA 2.3abc
0 ppm NAA + 1 ppm IBA 1.6c
0 ppm NAA + 1.5 ppm IBA 1.5c
0.5 ppm NAA + 0 ppm IBA 2.5a 0.5 ppm NAA + 0.5 ppm IBA 2.5a 0.5 ppm NAA + 1 ppm IBA 2.6a 0.5 ppm NAA + 1.5 ppm IBA 2.6a
1 ppm NAA + 0 ppm IBA 3.0a
1 ppm NAA + 0.5 ppm IBA 2.4ab 1 ppm NAA + 1 ppm IBA 2.2abc 1 ppm NAA + 1.5 ppm IBA 2.7a
19
kultivar melati yaitu 91.25% - 93.13%.
Jumlah Akar
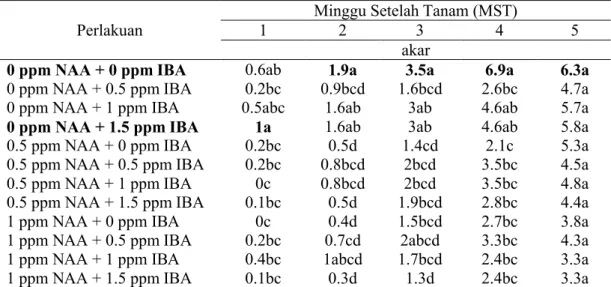
Jumlah akar dihitung terhadap semua akar yang muncul dengan panjang minimum 2 mm dan diamati setiap minggu. Hasil analisis ragam memperlihatkan bahwa IBA dan NAA berpengaruh sangat nyata pada 1 dan 2 MST bahkan masih memberikan pengaruh nyata pada 3 dan 4 MST terhadap jumlah akar stek batang Aglaonema var Donna Carmen. Pada 1 MST perlakuan 0 ppm NAA + 1,5 ppm IBA tidak berbeda nyata dengan perlakuan 0 ppm NAA + 1 ppm IBA dan kontrol namun berbeda sangat nyata dengan perlakuan-perlakuan yang lain terhadap peubah jumlah akar. Sedangkan pada minggu ke-2 hingga ke-4 justru sebaliknya, perlakuan kontrol menunjukkan pengaruh yang sangat nyata terhadap perlakuan 0 ppm NAA + 1,5 ppm IBA dan perlakuan 0 ppm NAA + 1 ppm IBA. Baik perlakuan kontrol, perlakuan 0 ppm NAA + 1,5 ppm IBA maupun perlakuan 0 ppm NAA + 1 ppm IBA, ketiga perlakuan ini tidak berbeda nyata terhadap perlakuan-perlakuan yang lainnya.
Tabel 3. Pengaruh Perlakuan Pemberian Konsentrasi IBA dan NAA terhadap Jumlah Akar Aglaonema var Donna Carmen
Minggu Setelah Tanam (MST)
Perlakuan 1 2 3 4 5
akar
0 ppm NAA + 0 ppm IBA 0.6ab 1.9a 3.5a 6.9a 6.3a
0 ppm NAA + 0.5 ppm IBA 0.2bc 0.9bcd 1.6bcd 2.6bc 4.7a
0 ppm NAA + 1 ppm IBA 0.5abc 1.6ab 3ab 4.6ab 5.7a
0 ppm NAA + 1.5 ppm IBA 1a 1.6ab 3ab 4.6ab 5.8a
0.5 ppm NAA + 0 ppm IBA 0.2bc 0.5d 1.4cd 2.1c 5.3a
0.5 ppm NAA + 0.5 ppm IBA 0.2bc 0.8bcd 2bcd 3.5bc 4.5a
0.5 ppm NAA + 1 ppm IBA 0c 0.8bcd 2bcd 3.5bc 4.8a
0.5 ppm NAA + 1.5 ppm IBA 0.1bc 0.5d 1.9bcd 2.8bc 4.4a
1 ppm NAA + 0 ppm IBA 0c 0.4d 1.5bcd 2.7bc 3.8a
1 ppm NAA + 0.5 ppm IBA 0.2bc 0.7cd 2abcd 3.3bc 4.3a
1 ppm NAA + 1 ppm IBA 0.4bc 1abcd 1.7bcd 2.4bc 3.3a
1 ppm NAA + 1.5 ppm IBA 0.1bc 0.3d 1.3d 2.4bc 3.3a
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan DMRT pada taraf 5 %.
Pada pengamatan terakhir (12 MST) perlakuan yang paling banyak menghasilkan akar adalah 0,5 ppm NAA + 1 ppm IBA yaitu sebanyak 17,4 akar sedangkan jumlah akar yang paling sedikit adalah perlakuan 1 ppm NAA + 1,5
ppm IBA (9,3 akar). Pertumbuhan jumlah akar stek batang Aglaonema var Donna Carmen untuk semua perlakuan mengalami peningkatan setiap minggu. Rata-rata jumlah akar yang dihasilkan pada akhir percobaan adalah sebanyak 13,7 akar.
Panjang Akar
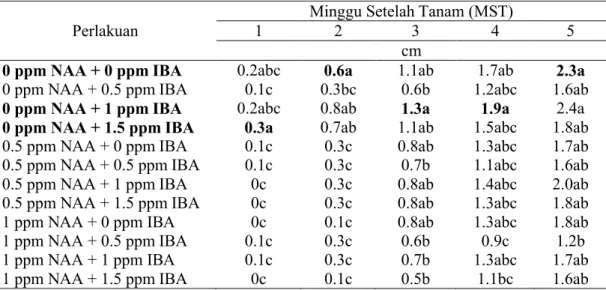
Panjang akar diukur dari pangkal perakaran hingga ujung akar yang terpanjang. Peubah ini juga diamati setiap minggu. Berdasarkan uji DMRT diketahui bahwa pada 1 MST perlakuan 0 ppm NAA + 1.5 ppm IBA tidak berbeda nyata terhadap perlakuan kontrol dan 0 ppm NAA + 1 ppm IBA, dan hal ini berlanjut hingga 2 MST. Namun pada 3-4 MST secara keseluruhan menunjukkan bahwa tidak ada perbedaan yang nyata antara perlakuan kontrol maupun yang diberi penambahan auksin NAA dan IBA, demikian juga untuk minggu ke-5 hingga pada akhir percobaan. Pada akhir pengamatan perlakuan 0 ppm NAA + 1 ppm IBA juga menghasilkan akar terpanjang (6,8 cm). Perlakuan 1 ppm NAA + 0,5 ppm IBA menghasilkan akar terpendek (4,2 cm). Rata-rata panjang akar yang dihasilkan untuk semua perlakuan pada akhir percobaan adalah sebesar 5,3 cm.
Tabel 4. Pengaruh Perlakuan Pemberian Konsentrasi IBA dan NAA terhadap Panjang Akar Aglaonema var Donna Carmen
Minggu Setelah Tanam (MST)
Perlakuan 1 2 3 4 5
cm
0 ppm NAA + 0 ppm IBA 0.2abc 0.6a 1.1ab 1.7ab 2.3a
0 ppm NAA + 0.5 ppm IBA 0.1c 0.3bc 0.6b 1.2abc 1.6ab
0 ppm NAA + 1 ppm IBA 0.2abc 0.8ab 1.3a 1.9a 2.4a
0 ppm NAA + 1.5 ppm IBA 0.3a 0.7ab 1.1ab 1.5abc 1.8ab
0.5 ppm NAA + 0 ppm IBA 0.1c 0.3c 0.8ab 1.3abc 1.7ab
0.5 ppm NAA + 0.5 ppm IBA 0.1c 0.3c 0.7b 1.1abc 1.6ab
0.5 ppm NAA + 1 ppm IBA 0c 0.3c 0.8ab 1.4abc 2.0ab
0.5 ppm NAA + 1.5 ppm IBA 0c 0.3c 0.8ab 1.3abc 1.8ab
1 ppm NAA + 0 ppm IBA 0c 0.1c 0.8ab 1.3abc 1.8ab
1 ppm NAA + 0.5 ppm IBA 0.1c 0.3c 0.6b 0.9c 1.2b
1 ppm NAA + 1 ppm IBA 0.1c 0.3c 0.7b 1.3abc 1.7ab
1 ppm NAA + 1.5 ppm IBA 0c 0.1c 0.5b 1.1bc 1.6ab
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan DMRT pada taraf 5 %.
21
Jumlah, Panjang, Lebar, Penampilan, dan Warna Daun
Pengamatan peubah jumlah, panjang, lebar, penampilan, dan warna daun diamati pada akhir percobaan yaitu pada umur 12 MST, bertujuan untuk mengetahui pengaruh auksin terhadap pertumbuhan vegetatif tanaman secara keseluruhan. Hal ini terlihat dari peubah jumlah daun, lebar daun, dan panjang daun yang tidak menunjukkan pengaruh nyata terhadap pertumbuhan Aglaonema.
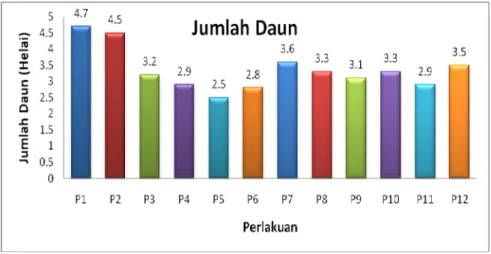
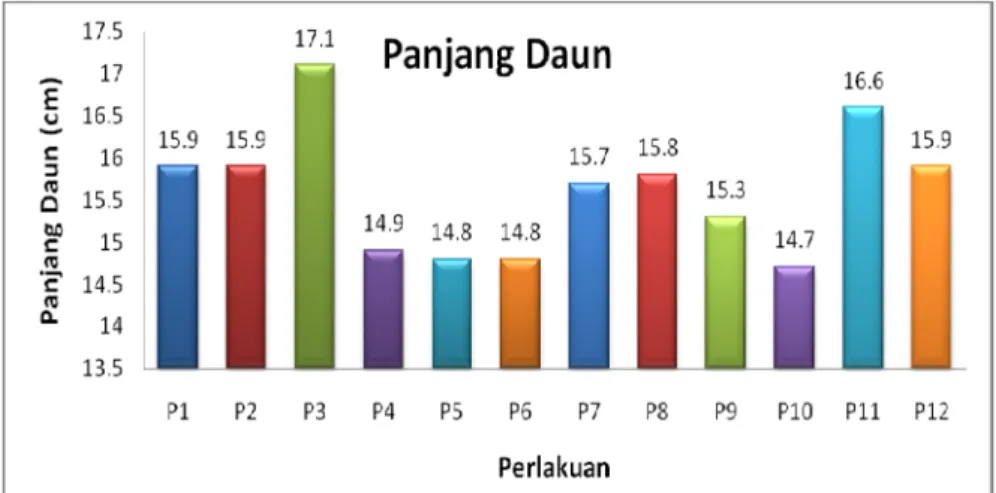
Penampilan dan warna daun menggunakan data kualitatif. Penampilan daun ada yang cerah dan agak cerah. Hampir sebagian besar tanaman berpenampilan cerah. Untuk warna daun ada yang hijau kemerahan dan hijau kekuningan namun sebagian besar tanaman daunnya berwarna hijau kemerahan. Penampilan cerah dan warna daun yang hijau kemerahan menunjukkan tingkat kehidupan tanaman yang sangat baik. Berdasarkan diagram di bawah ini diketahui bahwa jumlah daun tertinggi yaitu pada perlakuan kontrol sebanyak 4,7 helai. Panjang daun terpanjang yaitu pada perlakuan 0 ppm NAA + 1 ppm IBA (17,1 cm). Lebar daun terlebar adalah pada perlakuan kontrol sebesar 8,1 cm.
Gambar 5. Jumlah Daun Aglaonema var Donna Carmen pada berbagai Perlakuan Umur 12 MST
Gambar 6. Panjang Daun Aglaonema var Donna Carmen pada berbagai Perlakuan Umur 12 MST
Gambar 7. Lebar Daun Aglaonema var Donna Carmen pada berbagai Perlakuan Umur 12 MST
23
PEMBAHASAN
Presentase Stek Hidup dan Berakar
Persentase stek hidup dan berakar diamati mulai dari awal penelitian yaitu 1 MST sampai dengan pada saat akhir percobaan yaitu 12 MST. Baik persentase stek hidup maupun yang berakar menunjukkan nilai yang seragam (100%). Seluruh stek pada percobaan ini hidup dan memiliki akar. Tidak ditemukan gejala kekeringan ataupun busuk pada seluruh bagian tanaman. Keadaan ini diduga disebabkan oleh kondisi suhu dan kelembaban yang optimum. Menurut Edmon et al. (1964), suhu udara yang rendah dan kelembaban udara yang tinggi menyebabkan laju transpirasi berkurang, turgiditas sel terlindungi, stomata terbuka dan CO2 akan lebih banyak terdifusi ke dalam daun, sehingga akan mempercepat terbentuknya karbohidrat dan hormon yang diperlukan untuk pembentukan akar sehingga akar lebih cepat terbentuk.
Andriance dan Brinson (1955) menerangkan bahwa kelembaban udara yang tinggi sangat berguna untuk mencegah kekeringan sebelum stek berakar terutama untuk stek herbaceous, stek berbatang lunak, dan stek daun, sebaiknya selalu mendekati 100% selama beberapa hari setelah tanam. Venkataramani (1963) menyarankan bahwa ada beberapa cara untuk mempertahankan kelembaban tersebut yaitu dengan memakai tutup kaca, tenda plastik, atau kain putih diatas bak stek. Kelembaban yang tinggi dapat dipertahankan dengan memakai tenda plastik pada percobaan ini.
Waktu Tumbuh Akar
Berdasar statistik, kombinasi 0 ppm NAA + 1.5 ppm IBA tidak berbeda nyata dengan kombinasi 0 ppm NAA + 1 ppm IBA. Namun berdasarkan nilai, perlakuan yang mendorong tumbuhnya akar dengan waktu paling cepat adalah kombinasi 0 ppm NAA + 1.5 ppm IBA yaitu 1.5 MST (tidak sampai 2 minggu). Perlakuan ini juga berpengaruh nyata terhadap kontrol. Kombinasi 1 ppm NAA + 0 ppm IBA merupakan perlakuan yang paling lama mendorong pertumbuhan akar yaitu selama 3 MST (hampir 1 bulan). Di sini terlihat bahwa kombinasi NAA dan IBA tidak selalu mempercepat waktu tumbuh akar, sebagai contoh pada perlakuan
0.5 ppm NAA + 0.5 ppm IBA waktu akar pertama kali muncul cukup lama yaitu pada umur 2.5 MST.
Begitu juga pemberian konsentrasi NAA dan IBA yang semakin banyak belum tentu mendorong pertumbuhan akar, sebagai contoh pada perlakuan 1 ppm NAA + 1.5 ppm IBA inisiasi akar terjadi pada umur 2.7 MST. Waktu tumbuh akar 2.5 MST dan 2.7 MST hampir menyamai waktu tumbuh akar yang paling lama. Hasil penelitian pada beberapa stek tanaman herba lain menunjukkan bahwa aplikasi IBA pada konsentrasi berlebihan bisa menghambat pertumbuhan tunas dan akar. Seperti pada stek Peperomia caperata, pemberian 0.8 ppm IBA dapat memacu pertumbuhan tunas dan akar. Namun pada konsentrasi 20 dan 100 ppm IBA, pertumbuhan tunas dan akar justru terhambat (Sympson and Chin. 1980).
Movchan (1971) menemukan hal yang serupa, dimana pemberian IBA pada konsentrasi yang berlebihan juga menghambat pertumbuhan akar pada stek krisan. Shin dan Lee (1980) menyarankan pemberian 0.5 hingga 10 ppm IBA agar dapat diperoleh pertumbuhan akar stek krisan yang memuaskan. Seperti pada penelitian ini yang menggunakan konsentrasi IBA dan NAA antara 0 – 1.5 ppm.
Selain itu, aplikasi auksin pada anggota famili Araceae lainnya, yaitu 25 ppm IAA pada Dieffenbachia picta dan 20 ppm IBA pada Philodendron ternyata mampu menghasilkan pembentukan akar terbaik pada masing-masing stek tanaman tersebut (Avery and Johnson, 1947).
Dalam kaitannya dengan pertumbuhan akar, Thimann (1969) berpendapat bahwa konsentrasi auksin yang tepat sangat diperlukan agar auksin dapat bereaksi dengan enzim dan menimbulkan respon pertumbuhan akar. Konsentrasi auksin yang berlebihan justru akan menimbulkan ketidakseimbangan kombinasi auksin dengan enzim sehingga menghambat pertumbuhan akar. Menurut Widiastoety dan Soebijanto (1988) aplikasi 50 dan 100 ppm IBA pada stek batang kembang sepatu (Hibiscus rosa sinensisL.) menghasilkan presentase stek berakar tertinggi.
Jumlah Akar
Berdasarkan statistik maupun nilai, pada 1 MST terlihat bahwa kombinasi 0 ppm NAA + 1.5 ppm IBA memberikan pengaruh nyata terhadap kontrol. Namun pada minggu ke-2 hingga minggu ke-4 justru sebaliknya, perlakuan
25
kontrol berbeda sangat nyata terhadap kombinasi 0 ppm NAA +1.5 ppm IBA. Untuk 5-12 MST, perlakuan yang diberikan penambahan kombinasi IBA dan NAA tidak berbeda nyata dengan kontrol. Hasil penelitian Dini Susanti (2003) menunjukkan bahwa perlakuan IBA 300 ppm dengan lama perendaman 2 jam adalah yang terbaik bagi jumlah akar stek tanaman anyelir.
Penambahan zat pengatur tumbuh pada konsentrasi yang tepat mampu mempercepat tumbuhnya akar. Stek yang perakarannya lebih dahulu terbentuk tentunya mempunyai akar yang lebih panjang. Proses pembentukan akar dimulai dari sekelompok sel meristem yang secara terus-menerus membelah dan membentuk sekelompok sel kecil (primordia akar) yang terus-menerus berkembang, kemudian akan membentuk ujung akar dan bertambah panjang (Arteca, 1996).
Pada percobaan ini, zat pengatur tumbuh IBA memberikan nilai jumlah akar yang lebih tinggi dibanding dengan kombinasi IBA dan NAA. Terlihat pada Tabel 3, perlakuan 1 ppm IBA tunggal atau 1.5 ppm IBA tunggal tidak berbeda nyata dengan kontrol yang menghasilkan akar terbanyak. Leopold (1963) menjelaskan bahwa pengaruh pemberian suatu konsentrasi zat pengatur tumbuh berbeda-beda untuk setiap jenis tanaman, bahkan berbeda pula antar varietas dalam suatu spesies. Lebih lanjut Leopold (1963) menambahkan bahwa keefektifan penggunaan zat pengatur tumbuh sangat dipengaruhi oleh faktor lingkungan selain itu juga faktor fisiologi tanaman itu sendiri, seperti macam stek, posisi awal stek pada tanaman induk dan lain-lain.
Panjang Akar
Pada minggu pertama, kombinasi 0 ppm NAA + 1 ppm IBA memberikan pengaruh yang sangat nyata terhadap kontrol. Lebih lanjut lagi pada minggu ke-2 sampai ke-4 perlakuan ini masih memberikan pengaruh nyata terhadap kontrol. Namun pada minggu ke-5 hingga akhir pengamatan, perlakuan yang mendapat penambahan IBA dan NAA tidak memberikan pengaruh nyata terhadap kontrol. Menurut Rochmin dan Harjadi (1973) pembentukan akar terjadi karena adanya translokasi auksin ke bagian dasar stek oleh kofaktor perakaran (rooting cofactor). Zat-zat tersebut akan mengumpul pada bagian dasar stek dan akan menstimulir
pembentukan kalus, dan kemudian akan terbentuk akar adventif. Akar adventif tersebut berasal dari 2 sumber yaitu : jaringan kalus dan akar morfologi (primordia akar). Auksin merupakan zat pengatur tumbuh yang bisa merangsang pembentukan akar adventif tersebut.
Peubah panjang akar diamati setiap minggu selama 12 minggu berturut-turut. Secara keseluruhan dari 1 MST sampai dengan 12 MST, perlakuan 1 ppm IBA tunggal berbeda nyata dengan perlakuan lainnya namun pada beberapa minggu setelah tanam, perlakuan ini juga tidak berbeda nyata dengan kontrol (Tabel 2). Zat pengatur tumbuh IBA memiliki selang konsentrasi nontoksik yang lebar dan aman jika digunakan pada berbagai spesies tanaman (Hartman and Kester. 1983). Aplikasi IBA akan menghasilkan sistem akar yang kuat dan berserabut.
Menurut Widiastoety dan Soebijanto (1988), pada stek batang kembang sepatu (Hibiscus rosa sinensis L.) pemberian 100 ppm IBA cenderung menghasilkan ukuran akar terpanjang. Seperti pada percobaan ini 1 ppm IBA cenderung lebih meningkatkan ukuran panjang akar daripada 1.5 ppm IBA. Weaver (1972) menambahkan biasanya akar akan muncul pada bagian paling bawah stek, tetapi kadangkala apabila konsentrasi auksin yang diaplikasikan cukup tinggi maka akar akan muncul pada bagian yang jauh lebih tinggi dari dasar stek.
Jumlah, Panjang, Lebar, Penampilan, dan Warna Daun
Jumlah daun yang tertinggi diperlihatkan pada perlakuan kontrol yaitu sebanyak 4.7 helai. Panjang daun terpanjang yaitu pada perlakuan 0 ppm NAA + 1 ppm IBA (17.1 cm). Lebar daun terlebar adalah pada perlakuan kontrol sebesar 8.1 cm. Untuk penampilan dan warna daun baik yang kontrol maupun yang diberi perlakuan sama-sama berpenampilan cerah dan berwarna hijau kemerahan.
Daun merupakan salah satu organ tanaman yang sangat penting terutama untuk fotosintesis supaya tanaman dapat menghasilkan makanan dan mengalami pertumbuhan yang optimum. Daun pada stek berpengaruh terhadap pemulihan batang yang luka dan pembentukan akar. Semakin bertambah jumlah daun. ukuran panjang serta lebar daun maka semakin besar pengaruhnya terhadap pertumbuhan tanaman. Semakin sehat penampilan daun dan semakin cerah warna
27
daunnya maka semakin sehat pula tanaman tersebut.
Pengamatan peubah jumlah, panjang, lebar, penampilan, dan warna daun diamati pada saat akhir percobaan yaitu pada 12 MST. Pertumbuhan jumlah daun stek Aglaonema var Donna Carmen rata-rata mengalami penambahan 2-3 daun per tanaman. Bentuk daunnya pun belum sepenuhnya membuka, ada yang masih dalam keadaan setengah kuncup. Panjang dan lebar daun rata-rata bertambah 1-2 cm per tanaman. Penampilan daun ada yang cerah dan agak cerah. Yang cerah bentuknya segar sedangkan yang agak cerah agak kusam. Warna daun ada yang hijau kemerahan dan hijau kuning. Namun sebagian besar stek Aglaonema var Donna Carmen memiliki penampilan cerah dan berwarna hijau kemerahan.
KESIMPULAN DAN SARAN
Kesimpulan1. Auksin lebih responsif terhadap pertumbuhan akar daripada tajuknya 2. Kandungan auksin endogen Aglaonema var Donna Carmen cukup tinggi
terlihat dari perlakuan kontrol yang mampu meningkatkan pertumbuhan akar tanpa penggunaan auksin sama sekali
3. Waktu inisiasi akar paling cepat adalah 1.5 MST
4. Perlakuan yang terbaik untuk mempercepat waktu inisiasi akar adalah dengan konsentrasi 0 ppm NAA + 1.5 ppm IBA
5. Peningkatan jumlah akar dan panjang akar stek Aglaonema var Donna Carmen lebih efisien jika tanpa menggunakan aplikasi auksin
Saran
Perlu dilakukan penelitian selanjutnya dengan faktor lama perendaman dan metode aplikasi auksin yang lainnya seperti pasta atau bubuk.
29
DAFTAR PUSTAKA
Acquaah. G. 2004. Horticulture Principles and Practices. Revisi ke 3. Pearson Education. Inc.. New Jersey. 822 hal.
Adriance. L. J. 1953. Plant Growth Substances. Intersci. Publ.. Inc.. New York. 465p.
Anonim a. 2008. http://ayomenanam.wordpress.com. Kondisi dan Media Tanam Aglaonema. 20 Februari 2008.
Anonim b. 2008. http://groups.yahoo.com/group/Aglaonema/. Aglaonema. 20 Februari 2008.
Arteca. Richard N. 1996. Plant Growth Substances. Principles and Applications. The Pennsylvania State University. Chapman and Hall. New York. 332p. Audus. L. J. 1953. Plant Growth Substance. Intersci. Publ.. Inc.. New York. 465p. Avery. G. S. and E. B. Johnson. 1947. Hormone and Horticulture. McGraw-Hill
Book Co.. Inc.. New York. 326p.
Bicknell. A. and Seddon. G. 1994. The House Plant Doctor. Chancellor Press. London. 159p.
Darliah. T. Danakusuma. Sunarjatin. dan K. Iwan. 1994. Pengaruh Lamanya Perendaman dan Konsentrasi IBA terhadap Pertumbuhan Vegetatif Setek Mawar (Rosa multiflora). Buletin Penelitian Tanaman Hias dan Pengembangan Hortikultura Cipanas Indonesia. 2(2): hal43-49.
Davies. Jr. F. T and J. N. Joiner. 1978. Adventitions Root Formation in Three Cutting Type of Ficus pumika L. Combined Procedings of the International Plant Propagator Society. 28:p306-317.
Dawson. I. A. and King. R. W. 1994. Propagation of some Woody Australian Plants from Cuttings. Vol 34. Australian Journal of Experimental Agriculture. Australia. p1225-1231.
Diputra. M.H. 2006. Pengaruh Media Tanam dan Pupuk Daun terhadap Pertumbuhan dan Perkembangan Tanaman Hias Aglaonema var Donna Carmen. Skripsi. Program Sarjana. Institut Pertanian Bogor. Bogor. 39hal. Edmon. J. B.. A. M. Senn. and F. A. Andrews. 1964. Fundamental of
Horticulture. Mc-Graw Hill Book Co.. New York. 476p.
Ercisli. 2004. Exogenous IBA and Inoculation with Agrobacterium rubi Stimulate Adventitious Root Formation n Hardwood Stem Cuttings of Two Rose Genotipes. Vol 30 no 3. Hort Science Journal. p40-45.
Hartman. H. T. and D.E. Kester. 1983. Plant Propagation Principles and Practice Hall. Inc.. New Jersey. 538p.
Hartman. H. T.. D.E. Kester. and Jr. F. T. Davies. 1990. Plant Propagation Principles and Practitice. Fifth Editions. Prentice - Hall International. Inc. London. 130p.
Kana. Y. R. 1993. Pengaruh Konsentrasi dan Metode Pemberian IBA terhadap Pertumbuhan dan Hasil Tanaman Kedelai (Glycine max L. Merr). Tesis. Program Pasca Program. Institut Pertanian Bogor. Bogor. 50hal.
Leopold. A. C. 1963. Auxin and Plant Growth. Univ. California Press. Berkeley. Los Angeles. 343p.
Macdonald. B. 1973. Practical Woody Plant Propagation for Nursery Growers. Vol 1. B. T. Batsford. London. 120p.
McMahon. M.J.. A. M. Kofranek. V. E. Rubatzky. 2007. Hartmann’s Plant Science Growth. Development. and Utilization of Cultivated Plants. Edisi ke 4. Pearsen Prentice Hall. Ohio. 123p.
Movchan. L. T. 1979. Water Exchange in Isolated Leaves and Growth Regulator. Hort. Abstr. 49 (12):811.
Purwani. R. 2003. Pengaruh BAP dan NAA terhadap Pertumbuhan dan Perkembangan Vanda sp. dalam Kultur in vitro. Skripsi. Program Sarjana. Institut Pertanian Bogor. Bogor. 40hal.
Rahardja. P. C. dan Wiryanta. W. 2003. Aneka Cara Perbanyakan Tanaman PT. Agromedia Pustaka. 78hal.
Rochmin. K. dan S. S. Harjadi. 1973. Pembiakan Vegetatif. Departemen Budidaya Pertanian Fakultas Pertanian IPB. Bogor. 72hal. (tidak dipublikasikan)
Shin. H. J. and J. M. Lee. 1980. Effect of Propagation Method and Growth Regulator on the Rooting of Chrysanthemum Cuttings. Hort. Abstr. 50 (6):369
Silalahi. N. A. D. R. 2007. Respon Kombinasi IBA dan NAA terhadap Pertumbuhan Akar Tanaman Gaharu (Aquilaria malaccensis Lamk.) secara
in vitrodan Aklimatisasinya. Skripsi. Departemen Konservasi Sumber Daya Hutan dan Ekowisata. Fakultas Kehutanan. Institut Pertanian Bogor. Bogor. 47hal.
Smits. W. T. M. dan I. Yasman. 1986. Pedoman Sistem Cabutan Bibit Dipterocarpaceae. Tenaga Ahli Departemen Kehutanan. Agricultural University Wageningen. Penerbit Asosiai Panel Kayu Indonesia. 12hal.
31
Soerianegara. I. dan E. Djamhuri. 1979. Pemuliaan Pohon Hutan. Departemen Manajemen Hutan. Fakultas Kehutanan. Institut Pertanian Bogor. Bogor. 125 hal.
Susanti. D. 2003. Pengaruh Zat Pengatur Tumbuh NAA dan IBA serta Lama Perendaman terhadap Perakaran Stek Anyelir (Dianthus caryophyllus L.). Skripsi. Program Sarjana. Institut Pertanian Bogor. Bogor. 39hal.
Stoutemyer. V. T. 1954. Encouragement of Roots by Plant Regulators. p. 44 – 61. John Wiley and Sons Inc.. New York. Chapman and Hall Ltd.. London. 269p.
Swithinbank. A. 1991. Gardeners’World. Book of House Plants. BBC Books. London. 127p.
Sympson. R. L. and Chin. 1980. Interaction PCIBA and IBA on Root and Bud Formation of Peperomia caperata. Hortscience 15 (3) : p309-310.
Thimann. K. V. 1969. The Auxins dalam The Physiology of Plant Growth and Development. M. B. Wilkins (ed). Tata Mc. Graw-Hill Publ. Co. Ltd. New Delhi. hal20-22.
Tono. 2002. Analisis Preferensi Konsumen Terhadap Atribut Tanaman Hias dalam Ruangan (Indoor Plants) di Kota Bogor. Skripsi. Jurusan Ilmu-ilmu Sosial Ekonomi Pertanian. Fakultas Pertanian. Institut Pertanian Bogor. Bogor. 131 hal.
Venkataramani. 1963. The Principles of Tea Clonal Selection and Propagation and some Practical Consideration in Clonal Planting. IPASI Bull 22 : p9-12. Wattimena. G. A. 1991. Bioteknologi Tanaman. Pusat Antar Universitas
Bioteknologi IPB. Bogor. 455hal.
Wattimena. G. A. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas dan Lembaga Informasi IPB. Bogor. 145hal.
Weaver. J. R. 1972. Plant Growth Substance in Agriculture. University of California. Davis. W. H. Freeman and Co.. San Fransisco. 594p.
Wudianto. R. 1996. Membuat Stek. Cangkok. dan Okulasi. Penebar Swadaya. Jakarta. 172hal.
Wuryaningsih.S.. Satsiyati dan S. Andyantoro. 2000. Pengaruh Kultivar. IBA. dan Bahan Setek pada Perbanyakan Melati. Jurnal Agrotropika. V (2) :26 – 30.