Prosiding Kimia FMIPA
SK SK-091304
ISOLASI α-AMILASE TERMOSTABIL DARI BAKTERI TERMOFILIK
Bacillus stearothermophilus
Sarah*, Surya Rosa Putra1, Herdayanto Sulistyo Putro1
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Abstrak
α-Amilase termostabil mempunyai aplikasi komersil dan industri yang dapat dihasilkan dalam jumlah besar dan aktivitas enzim yang tinggi dengan biaya produksi yang ekonomis. α-Amilase memiliki kemampuan menghidrolisis α-1,4-glikosidik dari pati. Tujuan penelitian ini adalah untuk menghasilkan α-amilase dari B. stearothermophilus dan menentukan aktivitas spesifiknya. Penelitian ini dilakukan beberapa tahap, yaitu penentuan kurva pertumbuhan, produksi α-amilase, dan pemurnian α-amilase dengan pengendapan ammonium sulfat. Pengujian aktivitas α-amilase dapat dilakukan dengan mengukur zona bening pada metode pewarnaan iodin dan gula reduksi pada metode DNS, sedangkan kadar protein diuji dengan menggunakan metode Bradford. Kemampuan B. stearothermophilus dalam menghidrolisis pati ditunjukkan dengan adanya zona bening setelah ditambahkan iodin dengan diameter inti pusat (dalam) sebesar 3 mm dan diameter luar sebesar 9 mm. Aktivitas spesifik α-amilase sebelum dan setelah pemurnian α-amilase dengan pengendapan ammonium sulfat yang dihasilkan pada penelitian ini masing –masing sebesar 61,35 dan 85,72 Unit/mg protein.
Kata Kunci : Bacillus stearothermophilus, α-Amilase Termostabil, Termofilik
Abstract
Thermostable α-amilase has application of commercial and industry which can be produced in high quantity and high activity of enzyme by economical cost production. α-Amilase has the capability to hydrolize of α-1,4-glicosidic from starch. Purpose of this experiment is to produce α-amilase from B. stearothermophilus and determine its specific activity. This experiment has several treatment, that is determining of B. stearothermophilus’s growth curve, production of α-amylase, and purification of the α-amylase enzyme with precipitation of ammonium sulfate. The examination of α -amylase activity can be done with measuring halo zone in iodine color method and reducing sugar of DNS method, while the protein assay was examined using Bradford method. The ability of B. stearothermophilus to hydrolize starch was indicated by halo zone after addition of iodine solution with 3 mm inner diameter and 9 outer diameter. The specific activity of α-amylase before and after purification of ammonium sulfate precipitation which producted in this experiments was 61,35 and 85,72 Unit/mg protein.
Keywords : Bacillus stearothermophil, Thermostable α-Amylase, Thermophilic
1. Pendahuluan
Masyarakat Indonesia sudah sejak lama memanfatkan mikroorganisme untuk menghasilkan barang bernilai ekonomi, misalnya: fermentasi tempe, tape, dan ragi untuk minuman beralkohol. Mikroorganisme juga merupakan sumber enzim yang paling banyak digunakan dibandingkan dengan tanaman dan hewan. Hampir semua proses dalam sel hidup membutuhkan enzim untuk mempercepat reaksi karena enzim merupakan biokatalis reaksi kimia.
Industri enzim telah berkembang pesat dan menempati posisi penting dalam bidang industri. Kesadaran masyarakat terhadap masalah lingkungan yang semakin tinggi serta adanya tekanan dari para ahli dan pecinta lingkungan menjadikan teknologi enzim sebagai salah satu alternatif untuk menggantikan berbagai proses kimiawi dalam bidang industri. Salah satu enzim yang paling banyak diproduksi dan digunakan
adalah amilase. Amilase merupakan enzim yang menghidrolisa molekul pati untuk menghasilkan produk bervariasi, salah satunya yaitu dekstrin (Chung, et al., 1997; Windish dan Mhatre, 1965). Enzim ini memiliki peranan penting pada aplikasi industri dan bioteknologi dalam makanan, tekstil, dan industri kertas (Pandey et
al., 2000). α-Amilase termostabil telah mempunyai
aplikasi komersil dalam proses pati, makanan, dan produksi gula (Leveque, et al., 2000), industri tekstil (Pedersen, et al., 1999), dan proses deterjen (Hewitt dan Solomons, 1996; Lin, et al., 1998). Untuk aplikasi industri diperlukan α-amilase yang dapat diproduksi dalam jumlah besar dan aktivitas yang tinggi dengan biaya produksi yang ekonomis. Diharapkan nantinya Indonesia dapat memenuhi kebutuhan akan enzim dalam negeri sendiri, sehingga dapat menurunkan biaya produksi produk-produk olahan pati dengan enzim. Amilase termofilik disukai untuk aplikasi praktis sejak hidrolisis pati diketahui untuk mempercepat laju pada temperatur tinggi dan menghasilkan banyak produk penting dengan berbagai sifat kimia dan fisika yang berbeda untuk makanan dan industri (Khire, 1994).
Proses produksi α-amilase yang memiliki sifat termostabil dapat diperoleh dari mikroorganisme
* Corresponding author Phone : +6281231033385 e-mail: sarah_manis32@yahoo.com
1 Alamat sekarang : Jurusan Kimia, Fakultas MIPA, Institut Teknologi Sepuluh Nopember, Surabaya. e-mail: srputra@chem.its.ac.id
hsputro@chem.its.ac.id
Prosiding Kimia FMIPA
termofilik (Leveque et al., 2000). Keuntungan utama dari penggunaan mikroorganisme termofilik adalah untuk memperoleh enzim α-amilase dengan protein yang tahan panas. Sehingga mikroorganisme ini dapat dimanfaatkan di dalam bidang industri yang menggunakan suhu tinggi. Namun kebanyakan α-amilase komersial dihasilkan dari bakteri Bacillus licheniformis, B. amyloliquefaciens, dan
B. stearothermophilus (Uhling, 1998). Pada penelitian
sebelumnya, protein diperoleh dari enzim α-amilase digunakan media LB (Luria Bertani) yang mengandung ion kalsium dengan metode sentrifugasi pada ±10.000 rpm, akan tetapi peralatan (centrifuge) yang dapat digunakan dengan metode ini sangatlah terbatas. Selain itu media LB yang digunakan juga relatif mahal, sehingga pada penelitian ini dilakukan proses pemisahan protein dari α-amilase termostabil pada 2.000 rpm dengan menggunakan media yang lebih sederhana yaitu media NB (Nutrien Broth).
2. Bahan dan Metode 2.1 Pembuatan Media
Media yang digunakan untuk biakan bakteri ada dua jenis, yaitu NA sebagai media padat (media agar miring) dan NB sebagai media cair. Media padat dibuat dengan cara melarutkan NA sebanyak 2,8 g dalam 100 mL aquades. Larutan dipanaskan sambil diaduk supaya bubuk NA dapat larut sempurna. Setelah larut, media ini dimasukkan ke dalam tabung reaksi dan ditutup rapat (sebagai penutup digunakan kapas berlemak yang dibungkus kasa). Sedangkan pembuatan media cair dilakukan dengan cara melarutkan 13 g NB dalam 1 L aquades. Setelah larut, media ini dimasukkan ke erlenmeyer dan ditutup rapat (sebagai penutup digunakan kapas berlemak yang dibungkus kasa steril). Selanjutnya masing-masing media tersebut disterilkan dengan menggunakan autoclave pada 121°C selama 15 menit. Media cair disimpan di lemari es dan media padat diinkubasi di dalam incubator sampai padat. Media produksi α-amilase dibuat dengan metode yang sama namun dengan penambahan larutan pati sebagai substrat.
2.2 Uji Sterilisasi Bakteri
Media yang digunakan untuk sterilisasi bakteri ada dua jenis, yaitu NA sebagai media padat (media cawan petri) dan NB sebagai media cair. Media cair dibuat dengan cara melarutkan NB sebanyak 1,3 g dalam 100 mL aquades disterilkan dengan menggunakan autoclave pada 121°C selama 15 menit. Setelah disterilkan, media didinginkan sampai suhu kamar. Isolat Bacillus
stearothermophilus diambil 1 ose dan dimasukkan dalam
100 mL media cair kemudian diinkubasi dalam shaking
incubator pada 120 rpm dan temperatur 45°C sampai keruh. Media padat dibuat dengan cara melarutkan NA sebanyak 1,4 g dalam 50 mL aquades. Larutan dipanaskan sambil diaduk supaya bubuk NA dapat larut sempurna. Setelah larut, media disterilkan dengan menggunakan autoclave pada 121°C selama 15 menit. Media padat didiamkan sampai suhu 45°C kemudian dituang dalam cawan petri dan ditambah 50 µL biomassa dengan merata. Media cawan petri diinkubasi di dalam
incubator sampai tumbuh bakteri. Jika diperoleh bentuk
kultur yang sama, maka kultur B. stearothermophilus dapat digunakan untuk perlakuan selanjutnya.
2.3 Regenerasi B. stearothermophilus pada Media Padat dan Penentuan Kurva Pertumbuhan
Regenerasi pada media padat dilakukan dengan mengambil 1 ose dari isolat Bacillus stearothermophilus yang sudah dimurnikan kemudian digoreskan pada media cawan petri dan hal yang sama dilakukan untuk media agar miring. Inokulum diinkubasi pada suhu kamar selama 24 jam. Kultur awal diambil 1 ose dan dimasukkan dalam 10 mL media cair kemudian diinkubasi dalam shaking incubator pada 120 rpm dan temperatur 45°C selama 24 jam. Inokulum selanjutnya dipindahkan ke dalam 90 mL media cair dan diinkubasi kembali pada kondisi yang sama dan diukur OD (Optical
Density) tiap 1 jam. Pertumbuhan B. stearothermophilus
diamati menggunakan spektrofotometer pada panjang gelombang (λ) 600 nm dengan blanko media NB yang tidak ditumbuhkan bakteri. Data yang didapatkan adalah OD yang diplotkan terhadap waktu pengecekan jumlah bakteri. Hal ini dilakukan untuk menentukan fase log dari
B. stearothermophilus sehingga dapat diketahui waktu
optimum untuk produksi enzim α-amilase.
2.4 Produksi Enzim α-Amilase dan Sel Kering
Produksi enzim α-amilase dan sel kering digunakan media sederhana yaitu media NB tanpa penambahan ion Ca2+. Sebelum menginokulasi isolat B. stearothermophilus, harus dibuat terlebih dahulu starter
dari media produksi yakni media NB yang mengandung pati 1% (w/v). Starter dibuat dengan mengambil koloni dari kultur yang telah diremajakan, diambil satu ose kemudian diinokulasi ke dalam 10 mL media produksi. Sel bakteri ini diinkubasi dalam shaking incubator 120 rpm pada suhu 45°C selama 7 jam (sesuai dengan fase
log yang diperoleh pada penentuan kurva pertumbuhan).
Inokulum selanjutnya dipindahkan ke dalam 990 mL media produksi secara aseptik dan diinkubasi kembali pada kondisi yang sama dan diukur OD tiap 1 jam. Larutan enzim diperoleh dengan cara memisahkan supernatan (yang mengandung enzim) dari media produksi menggunakan sentrifugasi pada kecepatan 2000 rpm selama 20 menit sebanyak 4 kali. Supernatan (yang mengandung enzim) dipekatkan dengan freeze drying sampai volume ±10 mL, sedangkan biomassanya dikeringkan dengan liofilisasi pada suhu -87°C selama 24 jam kemudian ditimbang massanya.
Prosedur pada produksi sel kering dilakukan dengan prosedur yang sama dengan produksi α-amilase namun tanpa penambahan pati dan diinkubasi selama 10 jam (pada awal fase stasioner), di mana pada fase ini sel bakteri berada dalam jumlah besar. Sel kering diperoleh setelah dilakukan liofilisasi pada suhu -87°C selama 24 jam dan ditimbang massanya.
2.5 Penentuan Kandungan Protein 2.5.1 Pembuatan Kurva Standar BSA
Kurva standar BSA dibuat dari larutan stok BSA 2000 ppm (di buat dari 100 mg BSA dilarutkan dalam 25 mL aquades dan diaduk perlahan-lahan,kemudian diencerkan sampai 50 mL). Konsentrasi standar BSA yang digunakan untuk penentuan konsentrasi protein adalah 100, 200, 300, 400, 500, 600, 700, dan 800 ppm. Larutan dengan variasi konsentrasi tersebut diambil dari larutan stok sebanyak 0,5; 1; 1,5; 2; 2,5 ; 3; 3,5; dan 4 mL kemudian diencerkan dengan aquades sampai 10 mL. Sampel sebanyak 7 mL yang berisi larutan BSA pada berbagai konsentrasi direaksikan dengan 3 mL reagen
Prosiding Kimia FMIPA
menit. Setelah itu, sampel diukur absorbansinya pada λ 595 nm dan kurva dibuat antara konsentrasi larutan BSA (C) terhadap absorbansi (A). Persamaan garis yang diperoleh dapat digunakan pada perhitungan kandungan protein enzim α-amilase. Sebagai blanko digunakan aquabides.
2.5.2 Penentuan Konsentrasi Protein
Kadar protein ditentukan dengan metode Bradford (1976) dan digunakan BSA (Bovine Serum Albumin) sebagai protein standar (Snyder dan Desborou, 1978; Beaumont et al, 1990; Najavi et al., 2005). Enzim diambil sebanyak 1 mL kemudian diencerkan dengan aquades ke dalam labu ukur 10 mL. Enzim hasil pengenceran diambil sebanyak 7 mL dan ditambahkan 3 mL reagen Bradford lalu divortex kemudian diinkubasi selama 5 menit. Larutan diukur absorbansinya dengan spectrophotometer pada λ 595 nm. Data absorbansi yang diperoleh dikonversikan pada persamaan garis dari kurva standar BSA yang telah dibuat sehingga diperoleh konsentrasi kandungan protein enzim α-amilase.
2.6 Pemurnian α-Amilase dengan Pengendapan Ammonium Sulfat
Enzim diendapkan dari Supernatan dengan penambahan sejumlah tertentu garam ammonium sulfat sampai tingkat kejenuhan 40% (lampiran G) ditambahkan sedikit demi sedikit ke dalam 10 mL supernatan pada suhu 2-4°C sambil diaduk dengan pengaduk magnetik. Larutan disimpan di lemari es selama 24 jam (Tigue et al., 1995; Burhan et al., 2003). Endapan diperoleh kembali dengan sentrifugasi pada kecepatan 2000 rpm selama 20 menit sebanyak 4 kali, kemudian endapannya dilarutkan dengan 4 mL buffer fosfat pH 6 kemudian dihitung kandungan protein dan diuji aktivitasnya.
2.7 Pembuatan Kurva Standar Glukosa
2.7.1 Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang maksimum (λmaks)
dilakukan dengan menggunakan larutan standar glukosa dan ditambah dengan reagen DNS kemudian ditentukan absorbansinya menggunakan spektrofotometer. Dalam penelitian ini digunakan larutan stok glukosa 2 M (dibuat dari 36 g glukosa dilarutkan dalam 100 mL aquades) kemudian diambil sebanyak 1 mL dan ditambahkan 1,5 mL reagen DNS, diinkubasi pada 100°C selama 10 menit dan kemudian didinginkan pada suhu ruang selama 20 menit. Larutan standar glukosa diukur absorbansinya pada λ 500-560 nm dengan interval 5 nm sebanyak tiga kali untuk masing masing panjang gelombang sehingga diperoleh λmaks yang digunakan untuk pengukuran
selanjutnya. Sebagai blanko digunakan aquabides. Kurva dibuat antara λ sebagai absis terhadap absorbansi sebagai ordinat.
2.7.2 Penentuan Kurva Standar Glukosa
Kurva standar glukosa dibuat dari larutan stok glukosa 2 M. Konsentrasi yang digunakan adalah 0,2; 0,4; 0,6; 0,8; dan 1 M. Larutan dengan variasi konsentrasi tersebut diambil dari larutan stok sebanyak 1, 2, 3, 4, dan 5 mL, kemudian diencerkan dengan aquades sampai 10 mL. Sampel sebanyak 1 mL yang berisi larutan glukosa pada berbagai konsentrasi direaksikan dengan 1,5 mL reagen DNS, diinkubasi pada 100°C selama 10 menit dan kemudian didinginkan pada suhu ruang selama 20 menit. Setelah itu sampel diukur
absorbansinya pada λ 540 nm. Sebagai blanko digunakan buffer fosfat pH 6. Konsentrasi glukosa ditentukan berdasarkan absorbansi larutan sampel yang dikonversikan pada kurva standar.
2.8 Uji Aktivitas α-Amilase 2.8.1 Uji Kualitatif
Kultur yang sudah diremajakan digores menggunakan ose, dipindahkan ke dalam media NA yang mengandung pati 1% secara aseptik dan disimpan pada 45°C selama 24 jam. Setelah itu, larutan KI/I2
dituangkan ke dalam media hingga merata atau Uji kualitatif α-amilase dapat juga diperlakukan seperti uji kemurnian bakteri namun kultur yang digunakan adalah kultur yang sudah diremajakan, kemudian larutan KI/I2
dituangkan ke dalam media hingga merata. Aktivitas α-amilase ditunjukkan dengan adanya warna halo zone saat ditambahkan KI/I2, kemudian diukur diameter pada
daerah halo zone. Sebagai kontrol, digunakan media yang mengandung pati dan tidak ditumbuhi bakteri.
2.8.2 Uji Kuantitatif
Aktivitas
enzim α-amilase secara kuantitatif dapat ditentukan dengan menggunakan metode DNS (Bernfeld,1955) pada pengukuran λ 540 nm (Miller, 1959). Ke dalam sampel dan kontrol (1 mL) ditambahkan 1,5 mL reagen DNS. Campuran dihomogenisasi dengan vortex dan diinkubasi pada 100°C selama 10 menit. Setelah itu, campuran didinginkan pada suhu ruang selama 20 menit dan diukur absorbansinya pada panjang gelombang 545 nm. Sampel disiapkan dengan mereaksikan 500 µL enzim dengan 500 µL substrat pati 1% (w/v) dalam 0,1 M buffer fosfat pH 6 dan divortex untuk menghomogenkan larutan, kemudian diinkubasi pada temperatur 40°C selama 10 menit. Glukosa sebagai standar, enzim yang telah diinaktivasi (100°C selama 10 menit) digunakan sebagai kontrol, dan buffer fosfat pH 6 sebagai blanko. Aktivitas α-Amilase dinyatakan dalam unit, di mana satu unit enzim didefinisikan sebagai jumlah enzim yang dibutuhkan untuk menghasilkan 1,0 µmol gula pereduksi per menit di bawah kondisi pengujian.3. Hasil dan Pembahasan
3.1 Sterilisasi Bakteri Bacillus Stearothermophilus
Kultur yang tumbuh untuk sterilisasi isolat B.
stearothermophilus bentuknya sama antara kultur yang
satu dengan kultur yang lain. Hal ini menunjukkan bahwa isolat B. stearothermophilus tidak terkontaminasi oleh bakteri lain, sehingga kultur tersebut dapat digunakan untuk regenerasi pada media padat.
3.2 Penentuan Kurva Pertumbuhan
Pertumbuhan pada bakteri didefinisikan sebagai pertambahan berat (jumlah) sel karena berat sel relatif sama dengan siklus sel (Purwoko, 2007). Pertumbuhan kultur terjadi dalam beberapa tahap, yaitu fase lag, fase
log, fase stasioner, dan fase kematian. Pertumbuhan
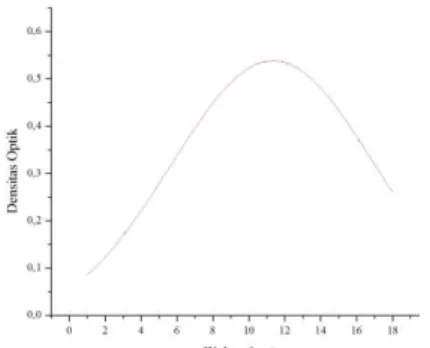
bakteri yang ditentukan dengan pengukuran OD dapat diterjemahkan ke dalam jumlah bakteri (biomassa) seperti yang pernah dilakukan oleh Kambourova et al., (1995). Pengukuran OD dari B. stearothermophilus menghasilkan kurva pertumbuhan bakteri seperti pada gambar 3.1.
Prosiding Kimia FMIPA
Gambar 3.1 Grafik Kurva Pertumbuhan
B. stearothermophilus Metode Turbidimetri
Dari data kurva tersebut dapat diketahui bahwa fase eksponensial (fase logaritmik) B. stearothermophilus mulai jam ke-2 sampai jam ke-10. Hasil ini sesuai dengan penelitian sebelumnya yang pernah dilakukan oleh Xiao et al., (2006), kurva pertumbuhan B.
stearothermophilus pada sampel yang berbeda memiliki
fase log yang sama yakni dari jam 2 sampai jam ke-10.
3.3 Produksi Enzim α-Amilase dan Sel kering
Produksi α-amilase dilakukan dengan menambahkan pati 1% (w/v) ke dalam media produksi sebagai substrat untuk menghasilkan α-amilase. Penambahan pati bertujuan untuk menginduksi α-amilase sehingga diharapkan α-amilase yang dihasilkan maksimal karena pati juga merupakan sebagai makronutrien yang penting untuk pertumbuhan sel (Brock et al., 1994; Gupta et al., 2003). Supernatan yang diperoleh dari panen produksi berjumlah 932 mL dan menjadi 18 mL setelah dipekatkan dengan freeze drying. Larutan enzim tersebut dipekatkan dengan freeze drying karena protein tidak dapat dipekatkan dengan penguapan pada suhu tinggi dan semua materi biologis hasil freeze drying biasanya stabil untuk waktu yang lama (Boyer, 1993). Sel kering yang diperoleh dalam 1 L media NB adalah sebesar 0,29 g dan sel kering yang diperoleh dalam 1 L media NB yang mengandung pati 1% adalah sebesar 0,82 g. Kambourova
et al., (1995) melaporkan bahwa B. stearothermophilus
menghasilkan sel kering sebanyak 0,9 g dalam 1 L media cair yang mengandung pati, sehingga hasil yang didapat setara dengan yang pernah dilakukan oleh Kambourova
et al., (1995).
3.4 Uji Aktivitas α-Amilase 3.4.1 Uji Kualitatif
Pewarnaan iodin merupakan salah satu metode untuk mendeteksi aktivitas α-amilase dan berfungsi sebagai reagen pendeteksi adanya amilase. Zona bening yang terbentuk memiliki diameter, yaitu diameter inti pusat (dalam) sebesar 3 mm dan diameter luar sebesar 9 mm. Hasil ini hampir mendekati hasil yang didapat oleh Arikan (2008) yang menghasilkan 8 mm zona diameter medium agar pati. Akan tetapi, Fernández et al. (1998) melaporkan bahwa dalam penelitiannya menghasilkan 0.7 mm diameter inti dan 1.5 mm diameter luar. Diameter yang didapat lebih besar daripada diameter yang dihasilkan oleh Fernández et al., (1998). Hal ini disebabkan strain yang digunakan dalam penelitian ini berbeda dengan yang digunakan oleh Fernández et al., (1998).
Gambar 3.3 Uji Kualitatif α-Amilase a) Media NA (1% pati) tidak ditumbuhi B.
stearothermophilus b) Media NA (1% pati) ditumbuhi
biomassa B. stearothermophilus
3.4.2 Uji Kuantitatif
Penentuan konsentrasi protein dilakukan dengan metode Bradford. Sedangkan aktivitas α-amilase secara kuantitatif ditentukan dengan menggunakan metode DNS. Aktivitas enzim merupakan salah satu parameter yang harus dikontrol selama pemurnian supaya dapat diperoleh informasi tentang aktivitas spesifik enzim, di mana aktivitas spesifik adalah unit enzim per mg protein. Nilai aktivitas spesifik ini dapat digunakan sebagai ukuran besarnya kemurnian enzim hasil isolasi. Tabel 3.1 Pemurnian dan Aktivitas Enzim α-Amilase
Dari tabel 3.1 dapat dilihat bahwa Enzim α-amilase yang didapat dari hasil freeze drying (18 mL) dan pemurnian α-amilase dengan pengendapan (NH4)2SO4 (40%) (4,8 mL), memiliki aktifitas
masing-masing sebesar 5886,0 dan 3139,2 Unit sehingga diperoleh aktifitas spesifik masing-masing 61,35 dan 85,72 U/mg protein. Tingkat kemurnian yang diperoleh adalah sebanyak 1,4 kali. Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang dibutuhkan untuk menghasilkan 1,0 µmol gula pereduksi per menit di bawah kondisi pengujian. Hasil yang didapat tidak sebanding dengan yang pernah dilakukan oleh Catherine
et al., (1996) pada penelitiannya yang menghasilkan
aktivitas spesifik α-Amilase sebesar 171,4 U/mg ((NH4)2SO4 40%) dalam pemurnian α-amilase dari B. flavothermus. Hal ini disebabkan bakteri yang digunakan
dalam penelitian ini spesiesnya berbeda dengan yang digunakan oleh Catherine et al., (1996).
4. Kesimpulan
Kesimpulan yang diperoleh dari penelitian ini adalah
B. stearothermophilus mempunyai fase log selama 10
jam dan dapat bekerja pada suhu 45°C. Sel kering yang diperoleh dalam 1 L media NB yang mengandung pati adalah sebesar 0,82 g. Hasil pengujian aktivitas enzim menunjukkan bahwa enzim α-amilase dapat dilakukan dengan mengukur zona bening Diameter zona bening pada B. stearothermophilus yaitu diameter inti pusat (dalam) sebesar 3 mm dan diameter luar sebesar 9 mm. Enzim α-amilase yang diperoleh dari B. stearothermophilus memiliki aktivitas enzim sebelum
dan sesudah pemurnian yaitu sebesar 5886,0 dan 3139,2 unit, sehingga Aktivitas spesifik enzim α-amilase
Prosiding Kimia FMIPA
sebelum dan sesudah pemurnian yaitu sebesar 61,35 dan 85,72 U/mg protein.
5. Ucapan Terimakasih
1. Prof. Dr. Surya Rosa Putra, MS atas dukungan, bimbingan, dan motivasi yang diberikan
2. Herdayanto Sulistyo Putro, S, Si, M, Si atas dukungan, bimbingan dan motivasi yang diberikan 3. Umi, Abah, dan keluarga atas kasih sayang,
dukungan, dan doanya
4. Dra. Yulfi Zetra, MS selaku dosen wali
Daftar Pustaka
Arikan, B., (2008), Highly Thermostable, Thermophilic,
Alkaline, SDS and Chelator Resistant Amylase from a Thermophilic Bacillus sp. Isolate A3-15,
Bioresource Technology, 99: 3071-3076
Beaumont, F., Jouvec, H., M., Gagnon, J., Gaillard, J., and Pelmont, J., (1990), Purification and Properties
of a Catalase from Potato Tubers (Solanum tuberosum L), J. Plant Science, 72: 19-26
Bernfeld, P., (1955), Amylases α- and β-Methods, Enzymology 1: 149-158
Boyer, R.F., (1993), Modern Experimental Biochemistry, 2nd Edition, The Benjamin/Cummings Pub., Co.,
Inc., California, p.42-210
Brock, T. D., Madigan, M. T., Martinko, J. M. (1994),
Biology of Microorganisms, Prentice-Hall International Inc., London, 7
Burhan, A., Nisa, U., Gokhan, C., Omer, C., Ashabil, A., & Osman, G, (2003), Enzymatic Properties of a
Novel Thermophilic, Alkaline and Chelator Resistant Amylase from an Alkalophilic Bacillus sp. Isolate ANT-6, Process Biochemistry, 38: 1397–
1403
Catherine, T. K., Declan, J. B., William, M. F., (1997),
Purification and Characterization of the α-Amylase of Bacillus flavothermus, Enzyme and Microbial
Technology, 20: 340-343
Chung, A. P., Rainey, F., Nobre, M. F., Burghardt, J., da Costa, M. S., (1997), Meiothermus Cerbereus sp.
Nov., a New Slightly Tthermophilic Species with High Levels of 3-Hydroxy Fatty Acids, Int. J. Syst.
Bacteriol, 47: 1225–1230
Fernández, P. S., Periago, P. M., Salmerón, M. C., Martínez, A., (1998), Predictive Model to Describe
The Combined Effect of pH and NaCl on Apparent Heat Resistance of Bacillus stearothermophilus,
International Journal of Food Microbiology 44: 21– 30
Gupta, R., Gigras, P., Mohapatra, H., Goswami, V.K., Chauhan, B., (2003), Microbial α-Amylases: a
Biotechnological Perspective, Process Biochem.,
38: 1599-1616
Kambourova, M. S., Manolov, R. J., dan Emanuilova, E. I., (1995), Immobilization of Bacillus
stearothermophilus Cells by Entrapment in Various Matrices, Process Biochemistry, Vol. 30, No. 2, pp.
141-144
Khire, J. M., (1994), Production of Moderately
Halophilic Amylase by Newly Isolated Micrococcus sp. 4 from a Salt-Pan, Lett. Appl. Microbiol, 19:
210–212
Leveque, E., Janecek, S., Haye, B., dan Belarbi, A., (2000), Thermophilic Archaeal Amylolytic Enzymes, Enzyme dan Microbial Technology, 26: 3–14 Lin, L. L., Chyau, C. C., dan Hsu, W. H., (1998),
Production and Properties of a Raw-Starch-Degrading Amylase from Thermophilic and Alkaliphilic Bacillus sp. TS-23, Biotechnology and
Applied Biochemistry, 28: 61–68
Miller, G. L., (1959), Use of Dinitrosalicylic Acid
Reagent for Determination of Reducing Sugar,
Anal. Chem. 31: 426–428
Najafi, Mohsen F., Kembhavi, A., (2005), One Step
Purification and Characterization of an Extracellular α-Amylase from Marine Vibrio sp.,
Enzyme and Microbial Technology, 36: 535 -539 Pandey, A., Nigam, P., Soccol, C. R., Soccol, V. T.,
Sing, D., dan Mohan, R., (2000), Advances in
Microbial Amylases, Biotechnology and Applied
Biochemistry, 31: 135–152
Pedersen, S., Hendriksen, H. V., dan Bisgard-Frantzen, H., (1999), A Process for Textile Warp Sizing Using
Enzymatically Modified Starches, Patent Application WO 99/35325
Purwoko, T., (2007), Fisiologi Mikroba, PT. Bumi Aksara, Jakarta
Snyder, J., and Desborou, S., (1978), Rapid Estimation of
Potato Tuber Total Protein with Coomassie Brilliant Blue G-250, Theo. Appl. Genet., 52:
135-139
Tigue, M. A., Kelly, C. T., Doyle, E. M., dan Fogarty, W. M, (1995), The Alkaline Amylase of the
Alkalophilic Bacillus sp. IMD 370, Enzyme and
Microbial Technology, 17: 570-573
Uhling, H., (1998 ), Industrial Enzymes and Their
Applications, Translated and update by Elfried M.
Linsmaier-bednar, Ph.D. New York
Windish, W. W., Mhatre, N. S., (1965), Microbial
Amylases, In W. U. Wayne (Ed.), Advances in
applied microbiology (Vol. 7, pp. 273-304), Academic Press, New York
Xiao, D. C., Jin-Ah Yoo, Matthew T. H., (2006), The
Influence of Milk Composition on the Growth of Bacillus stearothermophilus, Journal of Food