PENDAHULUAN
Tepung gandum utuh kini mulai dikenal dan diminari oleh sebagian besar
masyarakat
Indonesia karena dinilai lebih kaya nutrisinya daripada tepung terigu.
Tepung gandum utuh berbeda dari tepung terigu karena tepung gandum utuh diperoleh
dari hasil penepungan semua bagian gandum, yaitu
bran
,
germ
, dan
endosperm
(Nursantiyah, 2009; Muoma, 2013)
.
Di Indonesia sendiri terdapat beberapa varietas
gandum yang berhasil ditanam dan dibudidayakan, salah satunya adalah gandum
varietas DWR-162 atau Dewata (Simanjuntak, 2002). Gandum ini ditanam di Getasan
Kabupaten Semarang. Semakin berkembangnya budidaya tanaman gandum maka
membuka potensi pengembangan produk pangan berbasis tepung gandum utuh lokal
tersebut.
Mi adalah pangan olahan basah yang digemari oleh masyarakat Indonesia, terbukti
dengan adanya peningkatan konsumsi produk makanan berbahan dasar terigu sebesar
0,2% setiap tahunnya sejak tahun 1990 hingga 2004 (Survei Sosial Ekonomi Pertanian,
2004). Mi mentah harus memiliki kadar gizi yang sesuai dengan Standar Nasional
Indonesia (SNI) No. 01-2987-1992.
Gandum utuh memiliki indeks glikemik 55-69 (Brand-Miller, 2003 ; Foster-Powell
1995). Pangan bernilai glikemik rendah sangat disarankan untuk penderita diabetes,
karena karbohidrat di dalamnya tidak langsung dikonversi menjadi gula darah (Praptini,
2011). Oleh karena itu olahan pangan dari tepung gandum utuh dapat menjadi alternatif
pangan bagi penderita diabetes.
Indeks glikemik sangat dipengaruhi oleh kadar amilosa dan daya cerna pati pada
makanan. Makanan yang kandungan amilosanya tinggi berhubungan dengan kadar gula
darah yang rendah (Frei dkk., 2003). Kandungan amilosa pada tepung dipengaruhi oleh
ukuran dan bentuk biji, bentuk kristal, tingkat polimerisasi dan komponen tepung. Hal
tersebut juga sangat berpengaruh pada daya cerna pati (Noda dkk.,
2008). Daya cerna
pati merupakan parameter yang menunjukkan kemampuan pati untuk dapat dicerna dan
diserap dalam tubuh. Daya cerna pati sangat dipengaruhi oleh berbagai faktor, seperti
kadar amilosa, amilopektin, protein, lemak, serat, proses pengolahan dan lain-lain
(Ratnaningsih, 2010).
enzim amilase (Shin dkk., 2004). Pati resisten dikategorikan sebagai bagian dari serat
pangan. Menurut Sajilata (2006) pati resisten memiliki efek fisiologis yang bermanfaat
bagi kesehatan seperti pencegahan kanker kolon, memiliki efek hipoglikemik, berperan
sebagai prebiotik, memiliki efek hipokolesterolemik, menghambat akumulasi lemak.
Dengan demikian , pati resisten dapat dimanfaatkan untuk pembuatan pangan
fungsional. Kandungan pati resisten dalam makanan dapat diklasifikasikan sebagai
berikut : sangat rendah(<1%), rendah (1-2,5%), sedang (2,5-5%), tinggi (5-15%) dan
sangat tinggi (>15%) (Goni dkk., 1996)
.
Tujuan dari penelitian ini adalah :
1.
Menentukan kandungan amilosa, daya cerna pati, serat kasar, dan pati resisten,
pada mi gandum utuh.
2.
Menentukan indeks glikemik mi gandum utuh.
3.
Menentukan kadar gizi, meliputi kadar air, abu, lemak, protein terlarut, serta
karbohidrat mi gandum utuh yang disukai.
METODA PENELITIAN
Bahan dan piranti
Bahan utama yang digunakan adalah tepung gandum utuh varietas Dewata yang
diperoleh dari Fakultas Pertanian, Universitas Kristen Satya Wacana. Tepung dibuat
dari hasil penggilingan biji gandum utuh menggunakan mesin penggiling dengan
mesh
0,4 mm. Bahan kimia yang digunakan adalah HCl, NaH
2PO
4.2H
2O, Na
2HPO
4.12H
2O,
CuSO4.5H2O, K2SO4 KI, NaKTartart, petroleum eter, H2SO4 98%, anthrone,
I2, KI,
glukosa standar, amilosa standar, maltosa standar, bahan-bahan tersebut adalah
grade
pro analyse
, E-Merck, Jerman. Selain itu, NaOH, etanol, dan KOH dengan tingkat
teknis, E-Merck, Jerman, DNSA (asam dinitrosalisilat) (BDH, UK),
enzim α
-amilase
dan enzim protease dari buah
crude
(Fakultas Teknologi Pertanian, UGM, Indonesia),
enzim amiloglukosidase (SIGMA A-9913, Jerman), dan akuades (Kotterman 1033,
Jerman).
timbangan analitik digital (OHAUS PA114, USA), peralatan gelas (Pyrex, USA dan
Herma, Cina), dan alat pengukur gula darah (Easy Touch GU, Taiwan).
Metode
Pembuatan Mi Gandum Utuh
Pembuatan mi pada penelitian ini menggunakan tepung gandum utuh yang
disubstitusikan pada tepung terigu sebesar 10%, 20%, 30%, 40% dan 50%. Sebagai
kontrol adalah mi tanpa substitusi tepung gandum utuh (0%).
Tabel 1. Formulasi Mi
Bahan Formulasi mi dengan penambahan tepung gandum utuh
0% 10% 20% 30% 40% 50%
Tepung terigu (g) 500 450 400 350 300 250
Tepung gandum utuh (g) 0 50 100 150 200 250
Telur (butir) 1 1 1 1 1 1
Garam (g) 3 3 3 3 3 3
Soda kue (g) 0,5 0,5 0,5 0,5 0,5 0,5
Pengukuran Kadar Serat Kasar (Sudarmadji, 1985)
Sampel dihaluskan, ditimbang 0,2 g bahan kering dan bebas lemaknya. Kemudian
ditambahkan 200 mL larutan H2SO4 2,5% lalu ditutup dengan pendingin balik dan
didihkan selama 30 menit. Suspensi disaring dan residu dicuci dengan akuades
mendidih. Residu dipindahkan secara kuantitatif dari kertas saring ke erlenmeyer dan
sisanya dicuci dengan 200 mL larutan NaOH 2,5% sampai semua residu dimasukkan ke
dalam erlenmeyer, tutup dengan pendingin balik dan dididihkan selama 30 menit.
Setelah itu, disaring dengan kertas saring kering yang diketahui beratnya sambil dicuci
dengan larutan K2SO4 10%. Residu dicuci dengan akuades mendidih dan 15 mL alkohol
95%. Kemudian kertas saring dikeringkan pada 110
oC sampai berat konstan. Setelah itu
didinginkan dalam desikator dan ditimbang.
Pengukuran Kadar Amilosa (Apriyantono dkk.,
1989 dalam Gustiar 2009)
dan ditambah akuades sampai tanda tera. Larutan amilosa standar ini sebagai larutan
stok. Larutan dipipet 1, 2, 3, 4, dan 5 mL dan dipindahkan masing-masing ke dalam
labu takar 100 mL. Ke dalam masing-masing labu takar tersebut kemudian ditambahkan
0,2; 0,4; 0,6; 0,8; dan 1,0 mL larutan asetat 1 M. Ditambahkan 2 mL larutan iod ke
dalam labu, ditera dengan akuades dan dihomogenkan. Larutan dibiarkan 20 menit dan
diukur absorbansinya pada panjang gelombang 625 nm.
Sebanyak 100 mg sampel pati ditambahkan 1 mL etanol 95% dan 9 mL NaOH 1 M
ke dalam tabung reaksi. Tabung reaksi dipanaskan pada suhu 95
oC sampai terbentuk
gel. Setelah didinginkan, larutan gel pati dipindahkan ke dalam labu takar 100 mL
secara kuantitatif dan ditambahkan akuades sampai tanda tera dan dihomogenkan.
Dipipet 5 mL larutan pati kemudian dipindahkan ke dalam labu takar 100 mL. Ke dalam
labu, ditambah 1 mL larutan asam asetat 1 M dan 2 mL larutan iod, lalu ditera dengan
air destilata. Larutan dibiarkan selama 20 menit dan diukur absorbansinya pada panjang
gelombang 625 nm.
keterangan : 30% = jumlah amilosa dalam 100 % pati
Daya Cerna Pati (Muchtadi dkk.,
1992)
mL larutan maltosa standar 0.5 mg/mL yang ditepatkan menjadi 1 mL dengan air
destilata.
faktor konversi = 0,95
Pengukuran Kadar Pati Resisten (AOAC 1995 yang dikombinasikan dengan
AOAC 1985 dalam Gustiar, 2009)
Sampel ditimbang 0,5 g dan dilarutkan dalam 25 mL buffer fosfat 0,08 M (pH 6,0)
lalu ditutup
aluminium foil
. Larutan ditambah 0,2 mL enzim α
-amilase dan diinkubasi
pada suhu 95
oC selama 30 menit dengan diaduk lembut. Setelah didinginkan sampai
suhu ruang, pH larutan diatur hingga 4,5 dengan HCl 0,275 M dan ditambahkan 30 μL
enzim amiloglukosidase (10 mg/mL buffer fosfat pH 6.0) lalu diinkubasi dengan
penangas air bergoyang pada suhu 60
oC selama 30 menit. Setelah didinginkan sampai
suhu ruang, pH campuran diatur menjadi 7,5 dengan menambahkan larutan NaOH
0,325 M, lalu ditambah 50 μL enzim protease (40 mg protease/50 mL buffer fosfat pH
6,0) dan campuran diinkubasi dalam penangas air bergoyang pada suhu 60
oC selama 30
menit. Larutan disentrifuse 3000 rpm selama 10 menit dan diambil bagian peletnya.
Pelet dicuci dua kali dengan etanol 80% dan akuades dan ditambah 1 mL akuades.
Larutan dipanaskan pada suhu 100
oC selama 20 menit sambil dikocok halus. Larutan
ditambah 1 mL KOH 4 M kemudian diaduk selama 30 menit pada suhu ruang. Larutan
ditambah 1 mL buffer asetat 0,4 M pH 4,75 lalu ditambah HCl 2 M sampai pH 4,75.
Setelah itu, ditambahkan 60 μL amiloglukosidase (
10 mg/mL buffer asetat 0,4 M pH
4,75) dan diinkubasi dalam penangas air bergoyang suhu 60
oC selama 30 menit lalu
disentrifuse 3500 rpm selama 30 menit. Kemudian supernatan diambil dan ditepatkan
menjadi 10 mL (larutan stok).
Kadar gula diukur dengan metode anthrone. 1 mL larutan stok dipipetkan ke labu
ukur 100 mL dan ditepatkan dengan akuades.
Larutan stok sampel yang telah
diencerkan sebanyak 1 mL dimasukkan ke dalam tabung reaksi bertutup, lalu
ditambahkan dengan 5 mL pereaksi Anthrone 0,1%. Sebagai standar adalah larutan
glukosa murni 0,2 mg/mL sebanyak 0,0; 0,2; 0,4; 0,6; 0,8; dan 1,0 mL yang
masing-masing kemudian ditepatkan menjadi 1 mL dengan akuades. Tabung ditutup dan
faktor konversi = 0,9
Uji Organoleptik (Soekarto, 1985)
Pengujian organoleptik yang dilakukan meliputi warna, aroma, rasa, dan tekstur mi
gandum utuh dengan skala hedonis sebagai berikut 1= sangat tidak suka, 2= tidak suka,
3= agak suka, 4= suka, 5= sangat suka. Penilaian dilakukan kepada 30 orang panelis.
Kadar Air Metode Gravimetri (AOAC 1995)
Cawan kosong dikeringkan dalam oven selama 15 menit, lalu didinginkan dalam
desikator, dan ditimbang. Sebanyak 1 g sampel mi gandum utuh yang disukai ditimbang
dengan tepat dalam cawan yang telah diketahui bobot kosong tersebut, lalu dikeringkan
dalam oven pengering suhu 105
oC selama 6 jam. Cawan dengan isinya kemudian
didinginkan dalam desikator, dan ditimbang. Pengeringan dilakukan kembali hingga
diperoleh berat konstan.
Kadar Abu Metode Gravimetri (AOAC 1995)
Cawan porselen dipanaskan dalam oven selama 15 menit, lalu didinginkan dalam
desikator dan ditimbang. Sebanyak 1 g sampel dimasukkan dalam cawan porselen dan
ditimbang, lalu diabukan dalam tanur bersuhu 550
oC sampai berwarna putih. Setelah itu
didinginkan dalam desikator dan ditimbang.
Kadar Lemak Metode Soxhlet (AOAC 1995)
Sisa pelarut dalam labu lemak dihilangkan dengan dipanaskan dalam oven, lalu
ditimbang.
Kadar Protein Terlarut Metode Biuret (AOAC, 1995)
Reagen biuret diibuat dengan melarutkan 0,15 g CuSO4.5H2O dan 0,6 NaKTartart
dalam labu ukur 50 mL. Larutan ditambah 30 mL NaOH 10% dan digenapkan dengan
akuades dalam labu ukur 100 mL.
Kurva standart dibuat dari larutan protein standar
bovine serum albumine
(BSA)
dengan konsentrasi 10 mg/mL. Larutan standar tersebut disiapkan satu seri dengan
konsentrasi 1, 2, 3, 4, 5, 6, 7, 8, 9, dan 10 mg/mL dalam 1 mL. Larutan diaduk dan
dihomogenisasi selama 30 menit pada suhu ruang. Absorbansi larutan diukur pada
panjang gelombang 550 nm.
Sebanyak 0,25-0,5 g sampel dilarutkan dalam 15 mL akuades dan dipusingkan
selama 15 menit. 5 mL supernatan diambil dan ditambah 1 mL NaOH 1 M dan
dipanaskan dengan penangas air suhu 90
oC. Larutan didinginkan hingga mencapai suhu
ruang dan diambil 1 mL lalu ditambah 4 mL reagen biuret dan diinkubasi selama 30
menit pada suhu ruang. Absorbansi diukur dengan spektrofotometer pada panjang
gelombang 550 nm.
Kadar Karbohidrat Total Metode Anthrone (Apriyantono,
1989 yang dimodifikasi
dalam Gustiar, 2009)
Hidrolisis karbohidrat dengan asam
Penentuan total karbohidrat dengan metode Anthrone
Larutan stok dipipet 1 mL dan dipindahkan ke dalam labu takar 100 mL. Sebanyak
1 mL larutan dimasukkan ke dalam tabung reaksi bertutup dan ditambahkan dengan 5
mL pereaksi Anthrone 0,1%. Sebagai kurva standar digunakan larutan glukosa standar
0,2 mg/mL sebanyak 0,0; 0,2; 0,4; 0,6; 0,8; dan 1,0 mL yang ditepatkan menjadi 1 mL
dengan akuades. Tabung ditutup dan diinkubasi pada suhu 100
oC selama 12 menit.
Larutan segera didinginkan dengan air mengalir, lalu dibaca absorbansinya pada
panjang gelombang 630 nm.
faktor konversi = 0,9
Uji Indeks Glikemik (El, 1999 yang dimodifikasi dalam Gustiar, 2009)
Makanan
yang akan ditentukan nilai indeks glikemiknya dianalisis proksimat untuk
mengetahui jumlah makanan yang harus dikonsumsi oleh panelis, yaitu setara dengan
50 g kandungan karbohidrat. Setiap porsi sampel yang akan ditentukan nilai indeks
glikemiknya diberikan kepada panelis yang telah menjalani puasa penuh (kecuali air)
selama 10 jam. Panelis yang digunakan adalah individu sehat, tidak menderita diabetes,
dan memiliki IMT (indeks masa tubuh) normal (18-25). Panelis yang digunakan
berjumlah 10 orang (3 pria dan 7 wanita). Selama dua jam pasca pemberian asupan mi
gandum utuh yang disukai, sampel darah
sebanyak 20 μL (
finger-prick cappilary blood
samples method
) diambil setiap 30 menit selama 2 jam untuk diukur kadar glukosanya.
Pada waktu berlainan, hal yang sama dilakukan dengan memberikan 50 g glukosa
standar (sebagai pangan acuan) kepada panelis. Kadar gula darah (pada setiap waktu
pengambilan sampel) diplotkan pada dua sumbu waktu (X) dan kadar gula (Y). Indeks
glikemik ditentukan dengan membandingkan luas daerah di bawah kurva antara pangan
yang diukur IG-nya dengan pangan acuan.
Analisis Data
utuh. Pengujian rataan antar perlakuan menggunakan uji Beda Nyata Jujur (BNJ)
dengan tingkat kebermaknaan 5% (Steel dan Torrie, 1980). Analisis deskriptif dengan 3
kali ulangan dilakukan untuk parameter kadar air, abu, lemak, protein terlarut, dan
karbohidrat mi gandum utuh yang disukai panelis.
HASIL DAN PEMBAHASAN
Amilosa dan Daya Cerna Pati
Pati merupakan bentuk homopolimer dari glukosa dengan
ikatan α
-glikosidik. Pati
terdiri atas dua polimer yang berbeda, yaitu polimer yang lurus (amilosa) dan polimer
bercabang (amilopektin) (Muchtadi dkk.,
2006).
Amilosa adalah homopolimer lurus α-D-glukosa yang dihubungkan oleh ikatan α-(1,4) dan bersifat larut dalam air panas.
Kandungan amilosa dalam bahan pangan berpati digolongkan menjadi empat kelompok
yaitu kadar amilosa sangat rendah < 10%, kadar amilosa rendah 10-20%, dan kadar
amilosa sedang 20-24%, dan kadar amilosa tinggi > 25% (Aliawati 2003). Pangan yang
mengandung kadar amilosa tinggi memiliki aktivitas hipoglikemik yang tinggi.
Daya cerna pati adalah tingkat kemudahan suatu jenis pati untuk dapatdihidrolisis oleh
enzim pemecah pati menjadi unit-unit yang lebih kecil. Dalam metode ini sampel
dihidrolisis oleh enzim α-amilase menjadi unit-unit sederhana seperti maltosa. Kandungan
maltosa sampel ditentukan berdasarkan kurva standar maltosa (Gustiar, 2009).
Kadar amilosa dan daya cerna pati pada mi sangat berkaitan. Peningkatan kadar
amilosa diiringi dengan penurunan daya cerna pati pada mi (
Tabel 2.).
Tabel 2. Kadar Amilosa dan Daya Cerna Pati (%bk±SD) Mi Gandum Utuh
PARAMETER Tepung terigu
Tepung gandum
Mi gandum utuh dengan % subtitusi
W
0 10 20 30 40 50
Kadar amilosa 27,70 ± 2,70 31,08 ± 2,70 26,39 ± 1,87a 27,35 ± 1,47a 27,09 ± 2,61a 28,23 ± 1,28a 29,16 ± 2,86ab 33,48 ± 2,85c 3,23 Daya cerna pati 9,19 ± 1,42 8,07 ± 0,97 14,09 ± 1,49bc 12,29 ± 0,70b 10,88 ± 2,02ab 11,32 ± 0,96ab 9,53 ± 0,61a 8,48 ± 0,49a 1,87
dari pati garut sebesar 18,66% (bk). Hasil ini penelitian Gustiar (2009) berbeda jauh
dengan hasil peneliti, karena dimungkinkan adanya perbedaan jenis tepung terigu yang
digunakan dan perbedaan biji gandum yang digunakan pada masing-masing tepung
terigu.
Amilosa dipengaruhi dengan tingkat gelatinisasi dan proses pengolahan, dimana
pada pangan olahan kering kadar amilosa lebih tinggi daripada pangan olahan basah.
Pada hasil penelitian didapatkan kadar amilosa mi 26,39-33,48% (bk) berbeda dengan
penelitian Mariati (2001) yang menyebutkan bahwa cookies pati garut memiliki amilosa
24,81-27,82%. Hal ini dikarenakan adanya perbedaan dalam metode, dimana proses
gelatinisasi pada penelitian Mariati (2001) hanya selama 10 menit, sedangkan pada hasil
peneliti lama waktu gelatinisasi selama 20 menit. Mi diolah secara basah sehingga
proses gelatinisasinya berjalan lebih cepat dan mempengaruhi jumlah pati yang larut.
Hal ini menyebabkan struktur gel pati terutama amilosa akan melemah karena
diabsorbsi oleh air. Ikatan yang lemah memudahkan air masuk ke dalam granula
sehingga amilosa larut dalam air (Suardi, 2002).
Dalam pengukuran daya cerna pati digunakan enzim α
-amilase. Enzim ini dapat
memecah sampel pati melalui proses hidrolisis, menjadi unit sederhana seperti maltosa
(Gustiar, 2009). Daya cerna pati pada mi gandum utuh adalah 8,48-14,09% (bk). Karena
nilai daya cerna tepung gandum lebih rendah 1,12% dibandingkan dengan tepung terigu
(
Tabel 2
), maka semakin besar jumlah tepung gandum utuh yang ditambahkan,
seyogyanya semakin rendah daya cerna pati. Hal ini sesuai dengan hasil pengukuran
yang menunjukkan bahwa pada subtitusi gandum utuh 40% mulai terjadi penurunan
daya cerna pati secara sangat signifikan, dari 14,84%% (tanpa subtitusi gandum utuh)
menjadi 10,03%s. Menurut Willet dkk. (2002), karbohidrat yang diserap secara lambat
akan menghasilkan puncak kadar glukosa darah yang rendah dan berpotensi dalam
mengendalikan daya cerna pati yang dipengaruhi oleh komposisi amilosa. Hal ini
seiring dengan kadar amilosa pada pangan olahan yang juga meningkat dengan adanya
penambahan tepung gandum utuh.
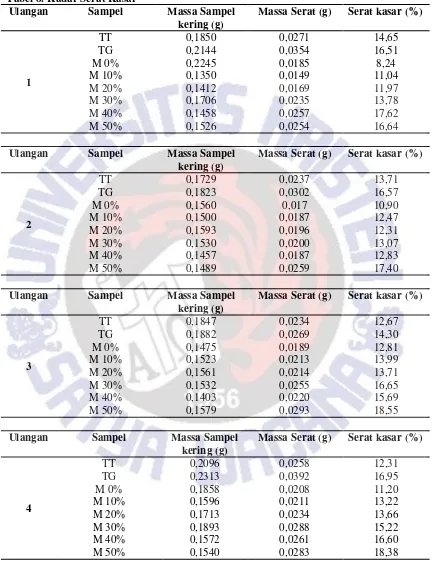
Peningkatan Kadar Serat Kasar dan Pati Resisten
fruktan, dan pati resisten. Secara umum gandum mengandung lebih banyak serat tak
larut seperti lignin, selulosa, dan hemiselulosa (Tala, 2009).
Oleh karena pati resisten adalah bagian serat pangan maka keduanya memiliki
keterkaitan. Kadar serat kasar dan pati resisten dalam mi gandum utuh mengalami
peningkatan seiring dengan meningkatnya subtitusi tepung gandum utuh dalam
pembuatan mi. Kadar serat kasar dan pati resisten dalam mi dapat dilihat pada
Tabel 3
.
Tabel 3. Kadar Serat Kasar dan Pati Resisten (%bk±SD) Mi Gandum Utuh
PARAMETER Tepung terigu
Tepung gandum
Kadar subtitusi gandum utuh (%)
W
0 10 20 30 40 50
Serat kasar 13,33 ± 1,06
16,08 ± 1,21
11,37 ± 0,98a
12,57 ± 1,30a
12,89 ± 0,92a
14,66 ± 1,61b
16,38 ± 0,95c
17,71 ± 0,91c
1,57
Pati resisten 2,48 ± 0,35
5,07 ± 0,18
1,83 ± 0,14a
1,96 ± 0,16a
2,03 ± 0,13a
2,91 ± 0,13b
4,30 ± 0,15c
4,55 ± 0,32d
0,27
Mi gandum utuh mengalami peningkatan kadar serat kasar dan pati resisten mulai
dari penambahan tepung gandum utuh 30%. Hal ini dikarenakan tepung gandum utuh
sendiri kadar seratnya lebih tinggi 2,75% dibanding tepung terigu.
Kadar Gizi Mi Gandum Utuh
Penentuan kadar gizi dilakukan dengan menguji mi secara organoleptik terlebih
dahulu untuk menentukan mi yang akan diukur nilai indeks glikemiknya dan
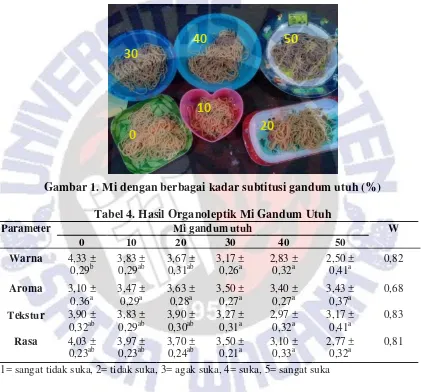
dibandingkan dengan mi terigu (kontrol). Produk mi gandum utuh dapat dilihat pada
Gambar 1.
Hasil organoleptik pada mi gandum utuh dapat dilihat pada
Tabel 4
.
Gambar 1. Mi dengan berbagai kadar subtitusi gandum utuh (%)
Tabel 4. Hasil Organoleptik Mi Gandum Utuh
Parameter Mi gandum utuh W
0 10 20 30 40 50
Warna 4,33 ± 0,29b 3,83 ± 0,29ab 3,67 ± 0,31ab 3,17 ± 0,26a 2,83 ± 0,32a 2,50 ± 0,41a 0,82
Aroma 3,10 ± 0,36a 3,47 ± 0,29a 3,63 ± 0,28a 3,50 ± 0,27a 3,40 ± 0,27a 3,43 ± 0,37a 0,68 Tekstur 3,90 ±
0,32ab 3,83 ± 0,29ab 3,90 ± 0,30ab 3,27 ± 0,31a 2,97 ± 0,32a 3,17 ± 0,41a 0,83 Rasa 4,03 ±
0,23ab 3,97 ± 0,23ab 3,70 ± 0,24ab 3,50 ± 0,21a 3,10 ± 0,33a 2,77 ± 0,32a 0,81 1= sangat tidak suka, 2= tidak suka, 3= agak suka, 4= suka, 5= sangat suka
Menurut Meilgaard dkk
.
(1999), warna merupakan salah satu atribut penampilan pada
suatu produk yang sering kali menentukan tingkat penerimaan konsumen terhadap
produk tersebut secara keseluruhan. Semakin besar penambahan tepung gandum utuh,
warna mi yang putih kekuningan (kontrol) akan semakin kecoklatan. Dari hasil
organoleptik warna yang paling disukai adalah mi tanpa subtitusi gandum utuh dengan
skor 4,33 ± 0,29 diikuti oleh mi dengan subtitusi gandum utuh sebesar 10% dan 20% dengan
skor masing-masing 3,83 ± 0,29 dan 3,67
± 0,31. Berdasarkan analisisnya, dalam0
10
20
30
parameter aroma tidak ada perbedaan nyata dengan selang kepercayaan 95% untuk
semua mi, dengan skor berkisar 3,10 ± 0,36 - 3,63 ± 0,2856, yang menunjukkan bahwa
penambahan tepung gandum utuh tidak mempengaruhi aroma pada mi. Setser (1995)
menyatakan bahwa tekstur merupakan parameter kritis selain penampakan dan aroma,
terhadap penerimaan keseluruhan dari produk makanan
. Mi dengan subtitusi gandum utuh rendah 0-20%, cenderung lebih untuk disukai oleh panelis dengan skor 3,90± 0,32
; 3,83±
0,2995; dan 3,90± 0,30 secara berurutan
.Rasa mi untuk semua kadar subtitusi
gandum utuh tidak berbeda nyata pada selang kepercayaan 95%, namun skor tertinggi
secara matematis adalah mi dengan konsentrasi 20% (3,97 ± 0,23). Hal ini
menunjukkan bahwa dengan penambahan tepung gandum utuh tidak mempengaruhi
rasa pada mi. Dari keempat parameter tersebut, dapat ditentukan bahwa mi gandum
utuh yang disukai adalah mi dengan penambahan tepung gandum utuh 10% dan 20%.
Berdasarkan hal tersebut, untuk pengukuran nilai indeks glikemik dan kadar gizi
selanjutnya akan menggunakan sampel mi gandum utuh 20% yang akan dibandingkan
dengan mi tanpa subtitusi gandum utuh 0% sebagai kontrol.
Mi gandum utuh yang dibuat memiliki kadar gizi yang lebih tinggi daripada mi
terigu. Perbedaan ini terlihat dengan adanya perbedaan kadar gizi pada tepung gandum
utuh dan terigu yang digunakan sebagai bahan dasar pembuatan mi. Baik tepung dan mi
gandum utuh kadar gizinya dibandingkan dengan Standar Nasional Indonesia (SNI) No.
3751 : 2009 dan No. 01-2987-1992. Kadar gizi tersebut dapat dilihat pada
Tabel 5
.
Tabel 5. Kadar Gizi Tepung dan Mi Gandum Utuh
PARAMETER SNI
TEPUNG
SNI
MI GANDUM UTUH TERIGU GANDUM
UTUH
0 % 20 %
AIR (%) < 14,5 14,62 ± 0,61 9,37 ± 0,73 20-35 27,26 ± 0,51 27,69 ± 1,25 ABU (%) < 7 0,85 ± 0,31 2,14 ± 0,11 < 3 1,33 ± 0,19 2,69 ± 0,21 LEMAK (%) 2,06 ± 0,18 1,36 ± 0,26 3,05 ± 1,02 2,78 ± 0,61 PROTEIN
TERLARUT(%) > 7 12,91 ± 1,98 18,01 ± 1,43 > 10 12,45 ± 0,10 14,49 ± 0,36 KARBOHIDRAT
(%) 52,93 ± 1,25 65,93 ± 0,31 56,59 ± 2,70 62,12 ± 3,22
yang tinggi (Fitriyanto, 2009). Jika kadar gizi tepung dan mi gandum utuh dibandingkan
dengan SNI
. 3751 : 2009 tentang tepung dan 01-2987-1992 tentang mi
(Tabel 5), maka terbukti bahwatepung dan mi gandum utuh tersebut memenuhi standar mutu yang
ditentukan, sehingga layak untuk dikonsumsi.
Nilai Indeks Glikemik Mi Gandum Utuh
Mi yang akan dianalisis indeks glikemik harus dianalisis proksimat terlebih dahulu
untuk mengetahui jumlah mi yang harus dikonsumsi oleh relawan atau panelis dalam uji
indeks glikemik, yaitu setara dengan 50 gram kandungan karbohidrat termasuk
polisakarida non pati (El 1999). Kadar karbohidrat mi terigu tanpa penambahan gandum
utuh diperoleh sebesar 56,59%, sehingga jumlah sampel yang harus ditimbang adalah
sebesar 88 g. Untuk mi gandum utuh 20%, diperoleh kadar karbohidrat sebesar 62,12%,
maka jumlah sampel yang harus ditimbang adalah sebesar 80 g.
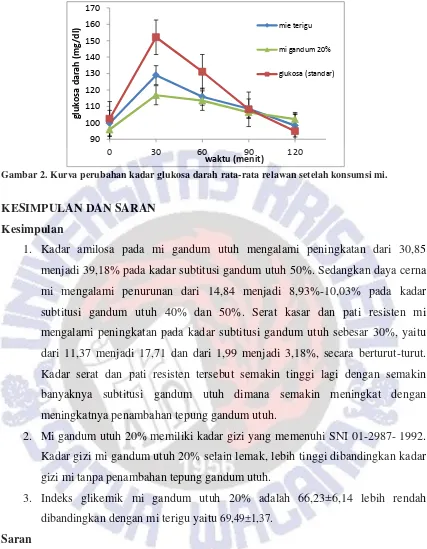
Nilai indeks glikemik pada mi gandum utuh lebih kecil dibandingkan dengan
indeks glikemik pada mi tanpa penambahan tepung gandum utuh. Nilai indeks glikemik
dapat dihitung melalui area di bawah kurva perubahan kadar glukosa darah. Kurva
perubahan kadar glukosa darah setelah mengkonsumsi mi terigu dan mi gandum utuh
ditunjukkan pada
Gambar 2
dan
Gambar 3
.
Gambar 2. Kurva perubahan kadar glukosa darah rata-rata relawan setelah konsumsi mi.
KESIMPULAN DAN SARAN
Kesimpulan
1.
Kadar amilosa pada mi gandum utuh mengalami peningkatan dari 30,85
menjadi 39,18% pada kadar subtitusi gandum utuh 50%. Sedangkan daya cerna
mi mengalami penurunan dari 14,84 menjadi 8,93%-10,03% pada kadar
subtitusi gandum utuh 40% dan 50%. Serat kasar dan pati resisten mi
mengalami peningkatan pada kadar subtitusi gandum utuh sebesar 30%, yaitu
dari 11,37 menjadi 17,71 dan dari 1,99 menjadi 3,18%, secara berturut-turut.
Kadar serat dan pati resisten tersebut semakin tinggi lagi dengan semakin
banyaknya subtitusi gandum utuh dimana semakin meningkat dengan
meningkatnya penambahan tepung gandum utuh.
2.
Mi gandum utuh 20% memiliki kadar gizi yang memenuhi SNI 01-2987- 1992.
Kadar gizi mi gandum utuh 20% selain lemak, lebih tinggi dibandingkan kadar
gizi mi tanpa penambahan tepung gandum utuh.
3.
Indeks glikemik mi gandum utuh 20% adalah 66,23±6,14 lebih rendah
dibandingkan dengan mi terigu yaitu 69,49±1,37.
Saran
Penambahan konsentrasi tepung gandum utuh perlu ditingkatkan lagi untuk
mencapai nilai indeks glikemik yang lebih rendah, namun produk tetap disukai. Metode
pengukuran kadar serat kasar perlu dioptimalkan lebih lanjut, karena berdasarkan
validasi yang dilakukan hanya mencapai 82,69%. Selain itu perlu dilakukan pengukuran
kadar serat pangan. Serat pangan berbeda dengan serat kasar, serat kasar adalah
komponen sisa hasil hidrolisis suatu bahan pangan dengan asam dan basa kuat sehingga
kehilangan selulosa 50% dan hemiselulosa 85%, sedangkan serat pangan masih
90 100 110 120 130 140 150 160 170
0 30 60 90 120
g
lu
kosa
d
a
ra
h
(m
g
/d
l)
waktu (menit)
mie terigu
mi gandum 20%
mengandung komponen yang hilang tadi (Tensiska, 2008). Serat pangan dapat diukur
dengan metode enzimatik (AOAC, 1995) menggunakan enzim α
-amilase, pepsin, dan
enzim pankreatin untuk memperkuat nilai pati resisten.
UCAPAN TERIMA KASIH
Atas terlaksananya penelitian ini, penulis mengucapkan terima kasih kepada Ir.
Djoko Murdono, M. P selaku sponsor dalam penelitian ini
.
DAFTAR PUSTAKA
Aliawati G. 2003. Teknik analisis kadar amilosa dalam beras. Buletin Teknik Pertanian. 8 (2) : 82-84.
AOAC, Official Methods of Analysis of the Associaion Analytical Chemist. Inc, Washington D.C., 1995.
AOAC, Official Methods of Analysis of the Associaion Analytical Chemist. Inc, Washington D.C., 1985.
Badan Standarisasi Nasional, SNI 01-2987-1992 tentang Mi Basah. Jakarta, 1992
Behall, K.M. and J. Hallfrisch. 2002. Plasma glucoce and insulin reduction after consumption of bread varying in amylose content. Eur. J. Clin. Nutr. 56(9):913-920.
Brand-Miller J, Hayne S, Petocz P, dan Colagiuri S. 2003. Low-glycemic index diets in the management of diabetes: A meta-analysis of randomized controlled trials. Diabetes Care, 26, 2261–2267.
Carreira, M.C., F.M. Lajolo, and E.W. de Menezes. 2004. Glycemic index: effect of food storage under low temperature. Brazilian Archives of Biology and Technology 47(4):569. Erwidodo, H.P, Saliem, E. Ariningsih, Pengkajian Diversifikasi Konsumsi Pangan Utama di
Indonesia, Laporan Hasil Penelitian, Pusat Penelitian Sosial Ekonomi Pertanian, Badan Litbang Pertanian : Bogor, 2004
Foster-Powell K dan Miller B. 1995. International tables of glicemic index. American Journal of Clinical Nutrition. 62 : 871s-893s.
Frei, M., Siddhuraju, P. and Becker, K. 2003. Studies on the in vitro starch digestibility and the glycemic index of six different indigenous rice cultivars from the Philippines. Food Chemistry 83 : 395-402.
Goni, I., L.G Diz, E. Manas, and F.S Calixto, “Analysis of Resistant Starch : a Method for Foods and Food products,” Journal Food Chem, vol. 56, no.4, pp. 445-449, 1996.
Gustiar, Haris. 2009. Sifat Fisiko-Kimia dan Indeks Glikemik Produk Cookies Berbahan Baku Pati Garut (Maranta arundinacea L.) Termodifikasi. Bogor : IPB.
Idris, S. 1994. Metode Pengujian Bahan Pangan Sensoris. Fakultas Peternakan. Universitas Brawijaya. Malang.
Leach, H. W, Gelatinization of Starch, In : Goldsworth, R (Eds). Abundant of Plant Varieties, New York : World Wide Inc, 1965
Ludwig DS. 2000. Dietary glycemic index and obesity. J Nutr Supl 130: 280S- 283S
Muchtadi D, Palupi NS, dan Astawan M. 1992. Metode Kimia, Biokimia, dan Biologi dalam Evaluasi Nilai Gizi. Pusat Antar Universitas Pangan dan Gizi.IPB, Bogor.
Muoma, Ike. 2013. Whole Grain Vs Whole Wheat Vs Whole Meal Vs GranaryRefined Bread? Which is best? What to choose?. URL www.iketrainer.co.uk/articles/breads . Diakses pada 15 September 2013.
Noda, T., Takigawa, S., Matsuura-Endo, C., Suzuki, T., Hashimoto, N., Kottearachchi, N.S., Yamauchi, H. and Zaidul, I.S.M. 2008. Factors affecting the digestibility of raw and gelatinized potato starches. Food Chemistry 110 : 465-470
Nursantiyah. 2009. Gambaran Umum Industri Tepung Terigu di Indonesia dan Ketentuan Pajak Pertambahan Nilai Terkait. Jakarta : UI.
Praptini, P.E. 2011. Menu 30 Hari dan Resep untuk Diabetes. Jakarta : PT. Gramedia Pustaka Umum
Pratiwi R. 2008. Modifikasi Pati Garut (Marantha arundinacea) dengan Perlakuan Siklus Pemanasan Suhu Tinggi-Pendinginan (Autoclaving- Cooling Cycling) untuk Menghasilkan Pati Resisten Tipe III. Skripsi. Fakultas Teknologi Pertanian. IPB, Bogor.
Pusat Penelitian dan Pengembangan Sosial Ekonomi Pertanian. 2003. Trend Konsumsi Pangan Produk Gandum di Indonesia. Warta Penelitian dan Pengembangan Pertanian Indonesia , 25, hal. 11-12.
Raben, A., A. Tagliabue, N.J. Christensen, J. Madsen, J.U. Holst, and A. Astrup. 1994. Resistant starch : the effecton postpradial glycemia, hormonal response, and satiety. Am. J. Clin. Nutr. 60: 544-551
Ratnaningsih. 2010. Pembuatan Tepung Komposit dari Jagung, Ubikayu, Ubijalar dan Terigu (Lokal dan Impor) untuk Produk Mi. Bogor : Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian.
Richana, Nur dan Widyaningru,. 2009. Penggunaan Tepung dan Pasta dari Beberapa Varietas Ubi Jalar sebagai Bahan Baku Mi. Bogor : Balai Penelitian dan Pengembangan Pascapanen Pertanian. Journal Pascapanen 6 (1) hal : 43-53.
Rimbawan dan A. Siagian. 2004. Indeks glikemik pangan. Penebar Swadaya. Jakarta
Sajilata MG, Rekha SS, Puspha RK., “Resistant starch” –a review., Journal Comprehensive review in food science and food safety, 2006
Schulz, A.G.M., J. M. M Van Amelsvoort, and A.C Beynen, “Dietary Native Resistant Starch
but Not Retrograded Resistant Starch Raises Magnesium and Calcium Absorption in Rats,”
Journal Nutrition, vol.123, pp.1724-1731
Shin S, Byun J, Park KW, and Moon TW, “Effect of partical acid and heat moisture treatment
of formation of resistant tuber starch,” Journal Ceral Chemistry, vol.81, no.2, pp. 194-198, 2004
Simanjutak, B.H. 2002. Prospek Pengembangan Gandum (Triticum aestivum L) di Indonesia. Salatiga : Universitas Kristen Satya Wacana.
Soto R.A., Acevedo E., Feria J., Villalobos R., Perez L.A., “Resistant starch made from banana
starch by autoclaving and debranching,” Journal starch, vol. 56, pp. 495-499, 2004
Steel, R.G.D and Torrie, J.H, Principles and Procedure of Statistics : A Biometrical Approach 2nd ed. McGraw-Hill, New York, 1980.
Suardi, Suarni, A. Prabowo. 2002. Prosesing Sorgum sebagai Bahan Pangan. Sulawesi Selatan : Seminar Nasional Balai Pengkajian Pertanian
Lampiran 1 Keterangan :
TT : Tepung Terigu, TG : Tepung Gandum Utuh, M : Mi
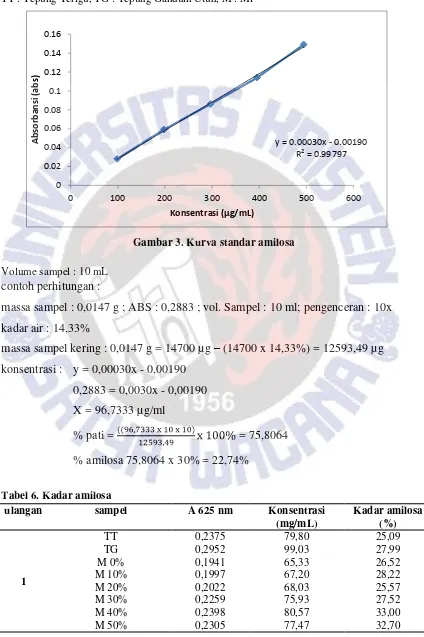
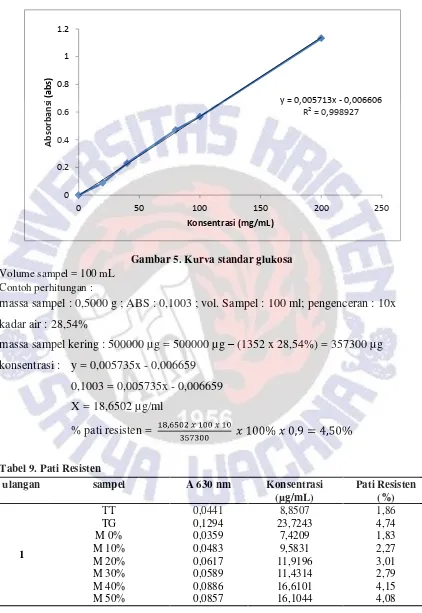
Gambar 3. Kurva standar amilosa
Volume sampel : 10 mL
contoh perhitungan :
massa sampel : 0,0147 g ; ABS : 0,2883 ; vol. Sampel : 10 ml; pengenceran : 10x
kadar air : 14,33%
massa sampel kering : 0,0147 g = 14700 µg
–
(14700 x 14,33%) = 12593,49 µg
konsentrasi : y = 0,00030x - 0,00190
0,2883 = 0,0030x - 0,00190
X = 96,7333 µg/ml
% pati =
= 75,8064
% amilosa 75,8064 x 30% = 22,74%
Tabel 6. Kadar amilosa
ulangan sampel A 625 nm Konsentrasi
(mg/mL)
Kadar amilosa (%)
1
TT 0,2375 79,80 25,09
TG 0,2952 99,03 27,99
M 0% 0,1941 65,33 26,52
M 10% 0,1997 67,20 28,22
M 20% 0,2022 68,03 25,57
M 30% 0,2259 75,93 27,52
M 40% 0,2398 80,57 33,00
M 50% 0,2305 77,47 32,70
y = 0.00030x - 0.00190 R² = 0.99797
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16
0 100 200 300 400 500 600
A
b
so
rb
a
n
si
(a
b
s)
ulangan sampel A 625 nm Konsentrasi (mg/mL)
Kadar amilosa (%)
2
TT 0,2958 99,2333 20,80
TG 0,3278 109,9001 23,87
M 0% 0,2356 79,1667 20,27
M 10% 0,2297 77,2022 18,57
M 20% 0,2566 86,1667 30,23
M 30% 0,2590 86,9667 24,60
M 40% 0,2771 93,0000 27,49
M 50% 0,3178 106,5667 36,69
ulangan sampel A 625 nm Konsentrasi
(mg/mL)
Kadar amilosa (%)
3
TT 0,2883 96,7333 25,96
TG 0,3281 110 29,02
M 0% 0,2457 82,5333 24,17
M 10% 0,2388 80,2333 26,48
M 20% 0,2622 88,0333 25,46
M 30% 0,2376 79,8333 28,74
M 40% 0,3021 101,3333 26,63
M 50% 0,3048 102,2333 30,89
ulangan sampel A 625 nm Konsentrasi
(mg/mL)
Kadar amilosa (%)
4
TT 0,2883 96,7333 22,74
TG 0,3281 110,0021 25,37
M 0% 0,2517 84,5333 26,92
M 10% 0,2354 79,1000 25,79
M 20% 0,2402 80,7000 27,12
M 30% 0,2755 92,4667 26,88
M 40% 0,3263 109,4000 29,50
Lampiran 2
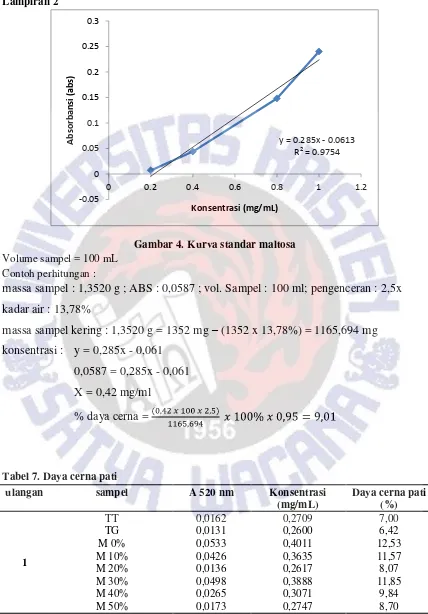
Gambar 4. Kurva standar maltosa Volume sampel = 100 mL
Contoh perhitungan :
massa sampel : 1,3520 g ; ABS : 0,0587 ; vol. Sampel : 100 ml; pengenceran : 2,5x
kadar air : 13,78%
massa sampel kering : 1,3520 g = 1352 mg
–
(1352 x 13,78%) = 1165,694 mg
konsentrasi : y = 0,285x - 0,061
0,0587 = 0,285x - 0,061
X = 0,42 mg/ml
% daya cerna =
Tabel 7. Daya cerna pati
ulangan sampel A 520 nm Konsentrasi
(mg/mL)
Daya cerna pati (%)
1
TT 0,0162 0,2709 7,00
TG 0,0131 0,2600 6,42
M 0% 0,0533 0,4011 12,53
M 10% 0,0426 0,3635 11,57
M 20% 0,0136 0,2617 8,07
M 30% 0,0498 0,3888 11,85
M 40% 0,0265 0,3071 9,84
M 50% 0,0173 0,2747 8,70
y = 0.285x - 0.0613 R² = 0.9754
-0.05 0 0.05 0.1 0.15 0.2 0.25 0.3
0 0.2 0.4 0.6 0.8 1 1.2
A
b
so
rb
a
n
si
(a
b
s)
ulangan sampel A 520 nm Konsentrasi (mg/mL)
Daya cerna pati (%)
2
TT 0,0655 0,4438 8,63
TG 0,0455 0,3737 9,11
M 0% 0,0742 0,4744 15,86
M 10% 0,0616 0,4302 12,92
M 20% 0,0523 0,3975 12,43
M 30% 0,0648 0,4414 12,20
M 40% 0,0281 0,3126 9,44
M 50% 0,0154 0,2681 8,75
ulangan sampel A 520 nm Konsentrasi
(mg/mL)
Daya cerna pati (%)
3
TT 0,0578 0,4168 10,24
TG 0,0512 0,3937 7,91
M 0% 0,0675 0,4509 14,44
M 10% 0,0659 0,4453 12,79
M 20% 0,0679 0,4524 11,32
M 30% 0,0558 0,4098 10,16
M 40% 0,0283 0,3133 10,08
M 50% 0,0187 0,2796 8,69
ulangan sampel A 520 nm Konsentrasi
(mg/mL)
Daya cerna pati (%)
4
TT 0,0587 0,4200 8,56
TG 0,0468 0,3782 7,69
M 0% 0,0622 0,4323 13,55
M 10% 0,0593 0,4221 11,88
M 20% 0,0585 0,4193 11,68
M 30% 0,0421 0,3617 11,06
M 40% 0,0253 0,3028 8,76
Lampiran 3
Tabel 8. Kadar Serat Kasar
Ulangan Sampel Massa Sampel
kering (g)
Massa Serat (g) Serat kasar (%)
1
TT 0,1850 0,0271 14,65
TG 0,2144 0,0354 16,51
M 0% 0,2245 0,0185 8,24
M 10% 0,1350 0,0149 11,04
M 20% 0,1412 0,0169 11,97
M 30% 0,1706 0,0235 13,78
M 40% 0,1458 0,0257 17,62
M 50% 0,1526 0,0254 16,64
Ulangan Sampel Massa Sampel
kering (g)
Massa Serat (g) Serat kasar (%)
2
TT 0,1729 0,0237 13,71
TG 0,1823 0,0302 16,57
M 0% 0,1560 0,017 10,90
M 10% 0,1500 0,0187 12,47
M 20% 0,1593 0,0196 12,31
M 30% 0,1530 0,0200 13,07
M 40% 0,1457 0,0187 12,83
M 50% 0,1489 0,0259 17,40
Ulangan Sampel Massa Sampel
kering (g)
Massa Serat (g) Serat kasar (%)
3
TT 0,1847 0,0234 12,67
TG 0,1882 0,0269 14,30
M 0% 0,1475 0,0189 12,81
M 10% 0,1523 0,0213 13,99
M 20% 0,1561 0,0214 13,71
M 30% 0,1532 0,0255 16,65
M 40% 0,1403 0,0220 15,69
M 50% 0,1579 0,0293 18,55
Ulangan Sampel Massa Sampel
kering (g)
Massa Serat (g) Serat kasar (%)
4
TT 0,2096 0,0258 12,31
TG 0,2313 0,0392 16,95
M 0% 0,1858 0,0208 11,20
M 10% 0,1596 0,0211 13,22
M 20% 0,1713 0,0234 13,66
M 30% 0,1893 0,0288 15,22
M 40% 0,1572 0,0261 16,60
Lampiran 4
Gambar 5. Kurva standar glukosa Volume sampel = 100 mL
Contoh perhitungan :
massa sampel : 0,5000 g ; ABS : 0,1003 ; vol. Sampel : 100 ml; pengenceran : 10x
kadar air : 28,54%
massa sampel kering : 500000 µg = 500000 µg
–
(1352 x 28,54%) = 357300 µg
konsentrasi : y = 0,005735x - 0,006659
0,1003 = 0,005735x - 0,006659
X = 18,6502 µg/ml
% pati resisten =
Tabel 9. Pati Resisten
ulangan sampel A 630 nm Konsentrasi
(µg/mL)
Pati Resisten (%)
1
TT 0,0441 8,8507 1,86
TG 0,1294 23,7243 4,74
M 0% 0,0359 7,4209 1,83
M 10% 0,0483 9,5831 2,27
M 20% 0,0617 11,9196 3,01
M 30% 0,0589 11,4314 2,79
M 40% 0,0886 16,6101 4,15
M 50% 0,0857 16,1044 4,08
y = 0,005713x - 0,006606 R² = 0,998927
0 0.2 0.4 0.6 0.8 1 1.2
0 50 100 150 200 250
A
b
so
rb
a
n
si
(a
b
s)
ulangan sampel A 630 nm Konsentrasi (µg/mL)
Pati Resisten (%)
2
TT 0,0583 11,3268 2,38
TG 0,1205 22,1724 4,36
M 0% 0,0295 6,3050 1,57
M 10% 0,0387 7,9092 2,00
M 20% 0,0403 8,1881 2,06
M 30% 0,0672 12,8786 3,08
M 40% 0,0865 16,2439 4,23
M 50% 0,0975 18,1620 4,64
ulangan sampel A 630 nm Konsentrasi
(µg/mL)
Pati Resisten (%)
3
TT 0,0547 10,6990 2,12
TG 0,1021 18,9641 3,71
M 0% 0,0316 6,6711 1,64
M 10% 0,0375 7,6999 1,91
M 20% 0,0418 8,4497 2,05
M 30% 0,0581 11,2919 2,82
M 40% 0,0931 17,3948 4,46
M 50% 0,1025 19,0338 4,80
ulangan sampel A 630 nm Konsentrasi
(µg/mL)
Pati Resisten (%)
4
TT 0,0638 12,2858 2,58
TG 0,1280 23,4802 4,67
M 0% 0,0351 7,2814 1,95
M 10% 0,0397 8,0835 2,15
M 20% 0,0416 8,4148 2,17
M 30% 0,0579 11,2570 2,95
M 40% 0,0882 16,5404 4,20
Lampiran 5
Tabel 10. Kadar air
Sampel Kadar air (%bb)
UL 1 UL 2 UL 3
TT 14,27 14,26 15,32 14,62
TG 8,53 9,85 9,74 9,37
M 0% 27,8 27,18 26,79 27,26
M 20% 28,44 28,83 25,81 27,69
Tabel 11. Kadar abu
Ulangan Sampel Massa sampel kering
(g)
Massa abu (g) Kadar abu (%bk)
1
TT 0,4255 0,0040 0,94
TG 0,9374 0,0200 2,13
M 0% 0,4482 0,0068 1,52
M 20% 0,8866 0,0259 2,92
2
TT 0,4194 0,0046 1,10
TG 0,9249 0,0208 2,25
M 0% 0,4728 0,0063 1,33
M 20% 0,9824 0,0246 2,50
3
TT 0,4325 0,0022 0,51
TG 0,8902 0,0181 2,03
M 0% 0,4426 0,0050 1,13
M 20% 0,8860 0,0235 2,65
Tabel 12. Kadar lemak
Ulangan Sampel Massa sampel kering
(g)
Massa lemak (g)
Kadar lemak (%bk)
1
TT 4,2865 0,0811 1,89
TG 4,5735 0,0699 1,53
M 0% 3,6100 0,1144 3,17
M 20% 3,5694 0,1078 3,02
2
TT 4,287 0,0874 2,04
TG 4,506515 0,0675 1,50
M 0% 3,630128 0,1096 3,02
M 20% 3,5585 0,0843 2,37
3
TT 4,234 0,0953 2,25
TG 4,513 0,0483 1,07
M 0% 3,655142 0,1086 2,97
Lampiran 6
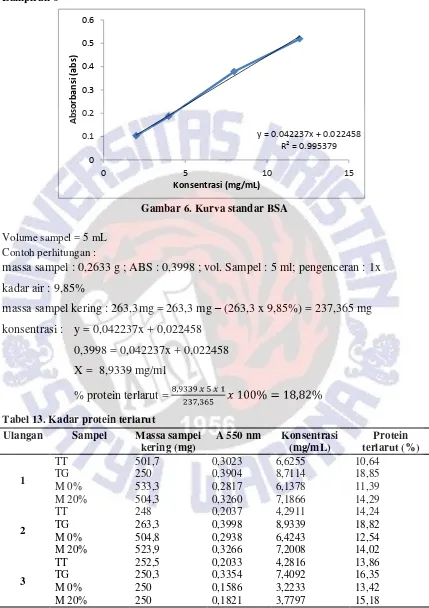
Gambar 6. Kurva standar BSA
Volume sampel = 5 mL Contoh perhitungan :
massa sampel : 0,2633 g ; ABS : 0,3998 ; vol. Sampel : 5 ml; pengenceran : 1x
kadar air : 9,85%
massa sampel kering : 263,3mg = 263,3 mg
–
(263,3 x 9,85%) = 237,365 mg
konsentrasi : y = 0,042237x + 0,022458
0,3998 = 0,042237x + 0,022458
X = 8,9339 mg/ml
% protein terlarut =
Tabel 13. Kadar protein terlarutUlangan Sampel Massa sampel
kering (mg)
A 550 nm Konsentrasi (mg/mL)
Protein terlarut (%)
1
TT 501,7 0,3023 6,6255 10,64
TG 250 0,3904 8,7114 18,85
M 0% 533,3 0,2817 6,1378 11,39
M 20% 504,3 0,3260 7,1866 14,29
2
TT 248 0,2037 4,2911 14,24
TG 263,3 0,3998 8,9339 18,82
M 0% 504,8 0,2938 6,4243 12,54
M 20% 523,9 0,3266 7,2008 14,02
3
TT 252,5 0,2033 4,2816 13,86
TG 250,3 0,3354 7,4092 16,35
M 0% 250 0,1586 3,2233 13,42
M 20% 250 0,1821 3,7797 15,18
y = 0.042237x + 0.022458 R² = 0.995379 0
0.1 0.2 0.3 0.4 0.5 0.6
0 5 10 15
A
b
so
rb
a
n
si
(a
b
s)
Lampiran 7
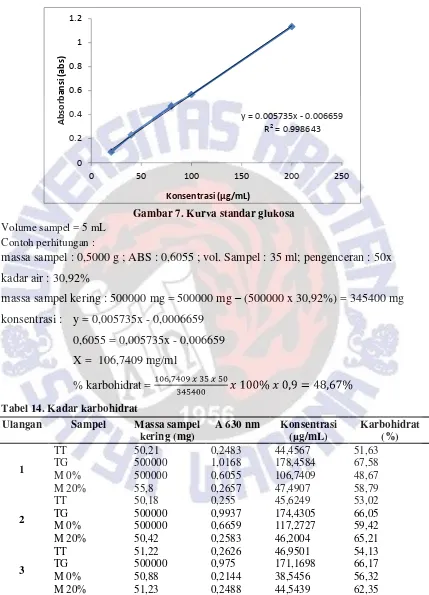
Gambar 7. Kurva standar glukosa Volume sampel = 5 mL
Contoh perhitungan :
massa sampel : 0,5000 g ; ABS : 0,6055 ; vol. Sampel : 35 ml; pengenceran : 50x
kadar air : 30,92%
massa sampel kering : 500000 mg = 500000 mg
–
(500000 x 30,92%) = 345400 mg
konsentrasi : y = 0,005735x - 0,0006659
0,6055 = 0,005735x - 0,006659
X = 106,7409 mg/ml
% karbohidrat =
Tabel 14. Kadar karbohidratUlangan Sampel Massa sampel
kering (mg)
A 630 nm Konsentrasi (µg/mL)
Karbohidrat (%)
1
TT 50,21 0,2483 44,4567 51,63
TG 500000 1,0168 178,4584 67,58
M 0% 500000 0,6055 106,7409 48,67
M 20% 55,8 0,2657 47,4907 58,79
2
TT 50,18 0,255 45,6249 53,02
TG 500000 0,9937 174,4305 66,05
M 0% 500000 0,6659 117,2727 59,42
M 20% 50,42 0,2583 46,2004 65,21
3
TT 51,22 0,2626 46,9501 54,13
TG 500000 0,975 171,1698 66,17
M 0% 50,88 0,2144 38,5456 56,32
M 20% 51,23 0,2488 44,5439 62,35
y = 0.005735x - 0.006659 R² = 0.998643
0 0.2 0.4 0.6 0.8 1 1.2
0 50 100 150 200 250
A
b
so
rb
a
n
si
(a
b
s)
Lampiran 8 Indeks Glikemik
Tabel 15. Respon glukosa darah glukosa (standar)
panelis waktu (menit) Luas di
bawah kurva
0 30 60 90 120
1 100 165 132 110 97 15165
2 116 188 163 124 96 17430
3 119 167 129 105 94 15225
4 100 155 114 110 99 14355
5 103 140 122 116 98 14355
6 94 128 153 117 102 14880
7 108 147 125 106 108 14580
8 93 137 124 92 84 13245
9 100 142 128 102 82 13890
10 91 152 121 100 89 13890
rata-rata
102,4 152,1 131,1 108,2 94,9 14701,5
Daerah di bawah kurva masing-masing panelis = luas trapesium Contoh perhitungan :
Luas area di bawah kurva glukosa luas trapesium =
65,87
Tabel 16. Respon glukosa darah mi terigu
panelis waktu (menit) Luas di
bawah kurva
IG
0 30 60 90 120
1 98 121 115 107 110 9990 65,88
2 115 140 135 132 124 11715 67,21
3 103 134 118 103 98 10110 66,40
4 106 108 125 116 106 10290 71,68
5 102 138 117 97 88 9885 68,86
6 95 141 102 106 87 9495 63,81
7 102 127 113 104 97 9840 67,49
8 95 127 113 102 91 9615 72,59
9 92 126 112 103 95 9600 69,11
10 89 128 109 116 87 9570 68,90
rata-rata
Tabel 17. Respon glukosa darah mi gandum
panelis waktu (menit) Luas di
bawah kurva
IG
0 30 60 90 120
1 95 107 104 100 98 9120 65,88
2 114 142 135 119 121 11490 67,64
3 108 118 115 110 103 10035 67,98
4 104 124 125 110 102 10350 69,91
5 103 115 120 106 100 9960 71,06
6 69 114 109 104 102 9105 67,74
7 98 115 110 109 103 9675 68,93
8 91 113 107 102 100 9300 74,18
9 94 110 105 103 95 9180 70,63
10 83 110 105 101 98 9030 70,95
2
and starch component also influence starch digestibility (Noda et al, 2008). Starch
digestibility is parameters that show starch’s ability to digest in body. Starch digestibility
influenced many factor, there are amylose, amylopectin, protein, fat, fiber, and processing. This goal of this research to determine amylose content and starch digestibility from processed food of whole wheat flour and determine the glycemic score.
RESEARCH METHOD
This research is performed in Chemistry’s Laboratory, Science and Mathematics
Department, Satya Wacana Christian University (SWCU), Salatiga, Indonesia. Materials and instrument
The main material is whole wheat flour Dewata’s variety from Agricultural Department
SWCU. Chemical reagent that used is I2, KI, NaOH, standard glucose, ethanol, standard
amylose, DNSA (dinitrosalysilic acid), NaHPO4, Na2HPO4, standard maltose (E-Merck grade
pro analysis, Germany), α-amylase enzyme (Agricultural Techonology, UGM, Indonesia), and distilled water.
The instrument are water content measurement (OHAUS, USA), incubator (WTB binder, Germany), spectrophotometer (Optizen 2120 UV, Korea), waterbath (Memmert, Germany), digital analytic balance (OHAUS, USA), glucose blood test (Easy Touch GU, Taiwan), and glassware (pyrex, USA).
Method
Produce whole wheat wet noodle
[image:31.595.81.513.276.642.2]Producing wet noodle in this research use whole wheat flour that substituted with wheat flour 10 %, 20%, 30%, 40% and 50%. As a control is wet noodle without substitution of whole wheat flour.
Table 1. Formulation of wet noodle
Material Substitution of whole wheat flour
0% 10% 20% 30% 40% 50%
Wheat flour (g) 500 450 400 350 300 250
Whole wheat flour (g) 0 50 100 150 200 250
Egg 1 1 1 1 1 1
Salt (g) 3 3 3 3 3 3
Baking powder (g) 0.5 0.5 0.5 0.5 0.5 0.5
Produce whole wheat cookies
Producing cookies in this research use whole wheat flour that substituted with wheat flour 10 %, 20%, 30%, 40% and 50%. As a control is wet noodle without substitution of whole wheat flour.
Table 2. Formulation of cookies
Material Substitution of whole wheat flour
0% 10% 20% 30% 40% 50%
Wheat flour (g) 100 90 80 70 60 50
Whole wheat flour (g) 0 10 20 30 40 50
Sugar (g) 30 30 30 30 30 30
Butter (g) 50 50 50 50 50 50
Amylose Content (Apriyantono et al. 1989 in Gustiar 2009) Amylose standard curve
3
iod reagent (0.2 g I2 and 2 g KI dissolved in 100 mL water ) and add water until 100 mL. Wait
for 20 minute, and measure the absorbance using spectrophotometer with wavelength 625 nm. Sample analysis
100 mg sample entered to capped test tube. add 1 mL ethanol 95% and 9 mL NaOH 1 M. The tube be heat in waterbath 95oC for 10 minute. Starch gel poured carefully to 100 mL flask and add distilated water. Pipetted 5 mL starch solution and poured to 100 mL flask. Add 1.0 mL acetat 1 M and 2 mL iod reagent and add water until 100 mL. Wait for 20 minute, and measure the absorbance using spectrophotometer with wavelength 625 nm
Starch digestibility (Muchtadi et al. 1992)
1 g sample entered to 250 mL erlenmeyer and add 100 mL water, cover it with aluminum foil and heated in waterbath until the temperature is 90oC while stirring. Cooled the sample and pipetted 2 mL from this solution to capped test tube, add 3 mL water and 5 mL buffer phosphat 0.1 M pH 7.0. Every sample make twice, the one as blank. Incubate the capped test tube with 37oC for 15 minute. Add incubated solution with 5 mL α-amylase enzyme (1 mg/mL in buffer phosphat pH 7.0) for sample and 5 mL buffer phosphat 0.1 M pH 7.0 for blank. Incubate again for 30 minute. 1 mL result solution from incubating poured to covered test tube that contain 2 mL DNSA. Heat the solution for 12 minute in boiled water and cooled with flow water and 10 mL water. The absorbance can measure in wavelength 520 nm. Standard curve made from
DNS’s treatment to 0.0, 0.2, 0.4, 0.6, 0.8, and 1.0 mL standard maltose 0.5 mg/mL.
Acceptance test (Idris, 1994)
Acceptance test examination is examination of color, flavor, taste, and texture of food production. The score use line scale. The valuation will do by 30 panelist. The product that wil examination is whole wheat noodle and cookies and wheat noodle and cookies. After that use data analysis with t-Test.
Glycemic score examination (El, 1999 modificate in Gustiar, 2009)
The food that will determine the glycemic score must analyzed as proximate to determine total food that will be consumpt by panelist (contain 50 g carbohydrate). Panelists must do fasting for 10 hours. Panelists that used is 10 human that health with normal BMI (Body Mass Index). 2 hours after consumed the product, the blood will test every 30 minute to measure the glucose blood. For standard, the food product change with standard glucose. Glucose blood (every 30 minute) plotted to 2 X and Y axis. X is time and Y is glucose blood.
Data Analysis
Data were analyzed with Randomized Complete Block Design (RCBD) with 6 treatments and 4 repetitions. The treatment was concentration of substitution of whole wheat flour. The block was time analysis. Tukey HSD 5% was applied to determine the significant differences between treatments (Steel and Torrie, 1980).
RESULT AND DISCUSSION Amylose Content
Starch is homopolymer form from glucose with α-glycosidic bond. Starch consist of two different polymers, there are straight compound (amylose) and branched compound (amylopectin) (Muchtadi et al. 2006). Amylose is sraight homopolymer α-D-glukosa that
4
Amylose content of whole wheat noodle is 28-33% and cookies 30-34%. Amylose in cookies is higher than noodle. Although the different is not too high, that is appropriate with
Carreira’s research (2004) that amylose influence by gelatinization level and processed food that dry processed food has higher amylose that wet processed food. Because wet processed food has fast gelatinization process, so influence total soluable starch. It cause structure of starch gel will weakened by absorbed of water. The weak bond make water easily enter the granule so amylose will soluble in water (Suardi, 2002).
Starch Digestibility
According to Willet et al. (2002), slow absorbed carbohydrate will produce low glucose blood and potential to manage starch digestibility that be affected by amylose composition. This
[image:33.595.67.551.183.408.2]measurement using enzymatic method, the enzyme is α-amylase. Using this enzyme because they can split sample through hydrolysis process to be their smaller unit, such as maltose (Gustiar, 2009). Maltose is sugar that can be absorbed in intestinal. To determine starch digestibility, do the measurement of maltose. Starch digestibility of whole wheat noodle is 10-12% (db) and cookies is 6-11% (db). More adding of whole wheat flour so the starch digestibility is lower. That is appropriate with amylose content in processed food. Amylose content and their composition is have effect to starch digestibility (Indrasari,2008).
Table 3. Comparing starch digestibility in noodle and cookies Substitution of whole
wheat flour (%)
Starch digestibility % (b/b) noodle Cookies
0 12,37±4,1879
a
8,59±6,3398 a 10 10,92±2,8339
a
6,67±4,2290 a 20 11,82±3,1440
a
6,69±2,9090 a 30 12,34±2,1894
a
8,50±2,7142 a 40 13,15±3,4117
a
7,50±5,1617 a 50 12,38±3,0790
a
11,32±5,2222 ab Fig 1. Relation between amylose content and
[image:33.595.90.544.230.711.2]substitution of whole wheat flour in noodle
Fig 2. Relation between amylose content and substitution of whole wheat flour in cookies 20 25 30 35 40 45 50
0.0 20.0 40.0 60.0
am
ylose
(%
d
b)
substitution of whole wheat flour (%db)
0 10 20 30 40 50 60
0.0 20.0 40.0 60.0
am yl os e (% d b)
substitution of whole wheat flour (%db)
[image:33.595.132.453.528.715.2]5
From this result, starch digestibility for wet processed food (noodle) is bigger than dry processed food (cookies). That is appropriate with amylose content of dry processed food is higher so the starch digestibility of cookies will be lower. Food processing is affect to starch digestibility (Noda et al, 2008).
[image:34.595.68.555.92.323.2]Acceptance test
Table 4. Acceptance test of whole wheat noodle
Parameter Subtitution of whole wheat flour (%)
0 10 20 30 40 50
Color 4.33 ± 0.2919 b
3.83 ± 0.2869 b
3.67 ± 0.3111 ab
3.17 ± 0.2658 a
2.83 ± 0.3248 a
2.50 ± 0.4139 a Flavor 3.10 ± 0.3583
a
3.47 ± 0.2898 a
3.63 ± 0.2856 a
3.50 ± 0.2730 a
3.40 ± 0.2703 a
3.43 ± 0.3757 a Texture 3.90 ± 0.3154
ab
3.83 ± 0.2955 ab
3.90 ± 0.2998 ab
3.27 ± 0.3090 a
2.97 ± 0.3175 a
3.17 ± 0.4053 a Taste 4.03 ± 0.2296
ab
3.97 ± 0.2296 ab
3,70 ± 0.2432 ab
3.50 ± 0.2137 a
3.10 ± 0.3303 a
2.77 ± 0.3205 a 1 : really don’t like; 2 : don’t like; 3 : neutral; 4 : like; 5 : really like
Table 5. Acceptance test of whole wheat cookies
Parameter Subtitution of whole wheat flour (%)
0 10 20 30 40 50
Color 4.2000 ± 0.2842 a
3.5333 ±0.3059 a
4.0333 ± 0.2076 a
3.4333 ± 0.3114 a
3.0333 ± 0.2497 a
3.0333 ± 0.3600 a Flavor 3.6333 ±0.3175
a
3.4667 ± 0.3059 a
3.8667 ± 0.3059 a
3.5000 ± 0.2471 a
3.6000 ± 0.2703 a
3.7000 ±0.3556 a Texture 3.9333 ± 0.3242
ab
3.2667 ± 0.2762 a
4.0667 ± 0.2582 ab
3.7667 ± 0.2889 b
3.3000 ± 0.2622 a
3.7667 ± 0.3351 b Taste 3.7667 ± 0.3492
a
3.7667 ± 0.2535 a
3.6333 ± 0.2682 a
3.7000 ± 0.3134 a
3.5000 ± 0.2547 a
3.9667 ± 0.3600 ab 1 : really don’t like; 2 : don’t like; 3 : neutral; 4 : like; 5 : really like
From this result, noodle that can accept with panelists is noodle with 10 and 20% substitution of wheat flour. For cookies is 20% substitution of wheat flour.
Glycemic Score
Glycemic score is leveling of food based on the effect with glucose blood. Food that can increase glucose blood faster has high glycemic score (Miller et al. 1992 in Rimbawan and
Fig 3.. Relation of between starch digestibility and substitution of whole wehat flour in noodle
Fig 4. Relation of between starch digestibility and substitution of whole wehat flour in cookies 8 9 10 11 12 13 14 15 16 17
0.0 10.0 20.0 30.0 40.0 50.0 60.0
star ch d igest ib il ity (% db )
substitution of whole wheat flour (%db)
0 5 10 15 20
0.0 10.0 20.0 30.0 40.0 50.0 60.0
star ch d igest ib il ity (% db )
substitution of whole wheat flour (%db)
[image:34.595.80.529.352.655.2]6
Siagian 2004). Glycemic score is unique nature, that’s influence by their material, processing, and characteristic (composition and biochemistry nature) (Miller, 1992).
Table 6. Average result of glucose blood response
Sample Time (minute) Area under
curve IG
0 30 60 90 120
Glucose 102,4 152,1 131,1 108,2 94,9 29403 100 Whole wheat noodle 0% 99,7 129 115,9 108,6 98,3 20397 69,49 Whole wheat noodle 20% 95,9 116,8 113,5 106,4 102,2 19449 66,23 Whole wheat cookies 0% 93,1 115,8 109,7 99,4 91,1 15273 52,11 Whole wheat cookies 0% 95,5 104,6 101,1 96,6 89,6 14622 49,94
Comparing the area under curve from control and acceptance wet and dry processed food with glucose (standard), glycemic score can be obtained.
Glycemic score of whole wheat noodle 0% and 20% are 69.49±1.37 and 66.23±6.14. And glycemic score of whole wheat cookies 0% and 20% are 52.11±2.07 and 49.94±1.90. Glycemic score of whole wheat noodle is in average level (55-69) and cookies in low level (<55).
CONCLUSION AND SUGGESTION
Amylose contents of whole wheat noodle and cookies were in the range of 28.48-32.2% and 29.4-33.25%, respectively. Starch digestibilities of whole wheat noodle and cookies were in the range of 10.92-13.15% and 6.67-11.32%, respectively. Through the acceptance test whole wheat noodle and cookies that can accept is with 20% substitution. Glycemic score of whole wheat noodle was in average level, 66.23±6.14, while the glycemic score of cookies was in low level, 49.94±1.90.
Suggestion for the next research is substitution of whole wheat be expected more than 20% so can get lower glycemis score, but must remains to be accept by people.
REFERENCES
Behall, K.M. and J. Hallfrisch. 2002. Plasma glucose and insulin reduction after consumption of bread varying in amylose content. Eur. J. Clin. Nutr. 56(9):913-920.
Brand-Miller J, Hayne S, Petocz P, and Colagiuri S. 2003. Low-glycemic index diets in the management of diabetes: A meta-analysis of randomized controlled trials. Diabetes Care, 26, 2261–2267.
90 95 100 105 110 115 120 125 130 135
0 30 60 90 120
glu cose bl ood ( m g/d l) time (minute) 90 95 100 105 110 115 120
0 30 60 90 120
[image:35.595.81.558.109.510.2]glu cose bl ood ( m g/d l) time (minute)
Fig 5. Glucose blood response to noodle Fig 6. Glucose blood response to cookies
Whole wheat noodle 20% Whole wheat noodle 0%
7
Carreira, M.C., F.M. Lajolo, and E.W. de Menezes. 2004. Glycemic index: effect of food storage under low temperature. Brazilian Archives of Biology and Technology 47(4):569.
Foster-Powell K and Miller B. 1995. International tables of glicemic index. American Journal of Clinical Nutrition. 62 : 871s-893s.
Frei, M., Siddhuraju, P. and Becker, K. 2003. Studies on the in vitro starch digestibility and the glycemic index of six different indigenous rice cultivars from the Philippines. Food Chemistry 83 : 395-402.
Gustiar, Haris. 2009. Sifat Fisiko-Kimia and Indeks Glikemik Produk Cookies Berbahan Baku Pati Garut (Maranta arundinacea L.) Termodifikasi. Bogor : IPB.
Idris, S. 1994. Metode Pengujian Bahan Pangan Sensoris. Fakultas Peternakan. Universitas Brawijaya. Malang.
Ludwig DS. 2000. Dietary glycemic index and obesity. J Nutr Supl 130: 280S- 283S
Muchtadi D, Palupi NS, and Astawan M. 1992. Metode Kimia, Biokimia, and Biologi dalam Evaluasi Nilai Gizi. Pusat Antar Universitas Pangan and Gizi.IPB, Bogor.
Muoma, Ike. 2013. Whole Grain Vs Whole Wheat Vs Whole Meal Vs GranaryRefined Bread? Which is best? What to choose?. URL www.iketrainer.co.uk/articles/breads . Diakses pada 15 September 2013.
Noda, T., Takigawa, S., Matsuura-Endo, C., Suzuki, T., Hashimoto, N., Kottearachchi, N.S., Yamauchi, H. and Zaidul, I.S.M. 2008. Factors affecting the digestibility of raw and gelatinized potato starches. Food Chemistry 110 : 465-470
Nursantiyah. 2009. Gambaran Umum Industri Tepung Terigu di Indonesia and Ketentuan Pajak Pertambahan Nilai Terkait. Jakarta : UI.
Praptini, P.E. 2011. Menu 30 Hari and Resep untuk Diabetes. Jakarta : PT. Gramedia Pustaka Umum
Pusat Penelitian and Pengembangan Sosial Ekonomi Pertanian. 2003. Trend Konsumsi Pangan Produk Gandum di Indonesia. Warta Penelitian and Pengembangan Pertanian Indonesia , 25, hal. 11-12.
Ratnaningsih. 2010. Pembuatan Tepung Komposit dari Jagung, Ubikayu, Ubijalar and Terigu (Lokal and Impor) untuk Produk Mi. Bogor : Balai Besar Penelitian and Pengembangan Pascapanen Pertanian.
Rimbawan and A. Siagian. 2004. Indeks glikemik pangan. Penebar Swadaya. Jakarta
Simanjutak, B.H. 2002. Prospek Pengembangan Gandum (Triticum aestivum L) di Indonesia. Salatiga : Universitas Kristen Satya Wacana.
tentang Mi Basah [9]. Tujuan dari penelitian ini adalah menentukan pati resisten pada mi gandum utuh dan menentukan kadar gizi pada mi, meliputi kadar air, kadar abu, lemak, protein terlarut dan karbohidrat. BAHAN DAN METODE
Bahan
Bahan utama yang digunakan tepung gandum utuh varietas Dewata dengan ukuran mesh 0,4 mm didapat dari Fakultas Pertanian UKSW. Bahan-bahan kimia yang digunakan adalah NaOH, HCl, etanol, NaH2PO4.2H2O, Na2HPO4.12H2O,
CuSO4.7H2O, KI, NaKTartart, petroleum
eter, H2SO4 98%, anthrone, glukosa murni
(E-Merck grade pro analysis, Jerman), enzim α-amilase, enzim protease dari buah crude (Fakultas Teknologi Pertanian, UGM, Indonesia), enzim amiloglukosidase (SIGMA A-9913, Jerman), dan akuades. Piranti yang digunakan antara lain moisture
analyser (OHAUS MB25, USA), inkubator
(WTB binder, Jerman), spektrofotometer (Optizen 2120 UV, Korea), penangas air (Memmert, Jerman), tanur (Ney Vulcan
A-550, USA), timbangan analitik digital
(OHAUS PA114, USA), dan peralatan gelas (Pyrex, USA dan Herma, Cina).Metode
Pembuatan Mi Basah Gandum Utuh (Pentadini dkk, 2014) [10]
Pembuatan mi basah pada penelitian ini menggunakan tepung gandum utuh yang disubstitusikan pada tepung terigu sebesar 10%, 20%, 30%, 40% dan 50%. Sebagai kontrol adalah mi basah tanpa substitusi tepung gandum utuh.
Tabel 1. Formulasi Mi Basah Bahan Penambahan tepung gandum utuh (%)
0 10 20 30 40 50 Tepung
terigu (g) 500 450 400 350 300 250 Tepung
gandum utuh (g)
0 50 100 150 200 250
Telur
(butir) 1 1 1 1 1 1
Garam (g) 3 3 3 3 3 3
Soda kue
(g) 0,5 0,5 0,5 0,5 0,5 0,5
Kadar Pati Resisten (AOAC 1995 yang dikombinasikan dengan AOAC 1985 dalam Gustiar, 2009) [11], [12], [13]
0,5 g sampel dilarutkan dengan 25 mL buffer fosfat 0,08 M (pH 6,0) dalam gelas piala 250 mL, lalu ditutup aluminium foil. Larutan ditambah 0,2 mL enzim α-amilase dan diinkubasi dalam penangas air suhu 95oC selama 30 menit dengan diaduk lembut setiap 5 menit sekali. Setelah didinginkan sampai suhu ruang, pH larutan diatur hingga 4,5 dengan 5 mL larutan HCl 0,275 M dan
ditambahkan 30 μL enzim amiloglukosidase (10 mg/mL buffer fosfat pH 6.0) dan diinkubasi dengan penangas air bergoyang dengan suhu 60oC selama 30 menit. Setelah didinginkan sampai suhu ruang, pH campuran diatur menjadi 7,5 dengan menambahkan 5 mL larutan NaOH 0,325 M, ditambahkan 50 μL enzim protease (40 mg protease/50 mL buffer fosfat pH 6,0) dan campuran diinkubasi dalam penangas air bergoyang pada suhu 60oC selama 30 menit. Setelah inkubasi selesai, larutan disentrifuse 3000 rpm selama 10 menit dan diambil bagian peletnya. Kemudian pelet dicuci dua kali dengan etanol 80% dan akuades. Supernatan dibuang lalu ditambah 1 mL akuades. Kemudian dimasukkan ke dalam penangas air suhu 100oC selama 20 menit sambil dikocok halus. Setelah itu, ditambah 1 mL KOH 4 M kemudian diaduk selama 30 menit pada suhu ruang. Kemudian ditambah 1 mL buffer asetat pH 4,75 0.4 M, lalu ditambah 1,5 mL HCl 2 M (atau sampai pH 4,75), kemudian elektroda dicuci dengan 1,5 mL buffer asetat 0,1 M pH 4,75. Setelah itu,
ditambahkan 60 μL amiloglukosidase (10 mg/mL buffer asetat 0,4 M pH 4,75). Kemudian dimasukkan ke dalam penangas air bergoyang suhu 60oC selama 30 menit lalu disentrifu