MATERI DAN METODE
Penelitian Lapang
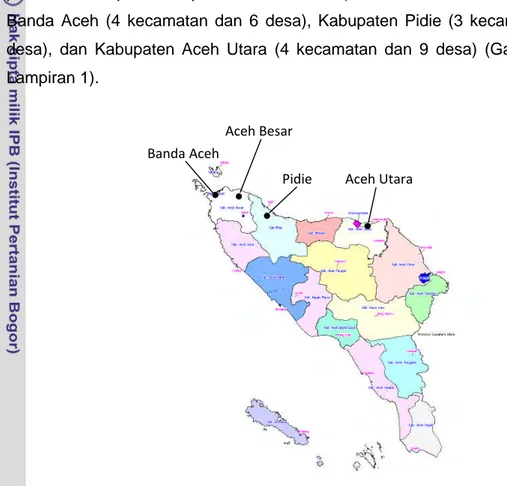
Waktu dan Tempat PenelitianPenelitian lapang untuk koleksi data fenotipik dilakukan di Provinsi Nanggroe Aceh Darussalam pada bulan Pebruari sampai Juni 2005. Lokasi penelitian meliputi Kabupaten Aceh Besar (5 kecamatan dan 6 desa), Kota Banda Aceh (4 kecamatan dan 6 desa), Kabupaten Pidie (3 kecamatan dan 4 desa), dan Kabupaten Aceh Utara (4 kecamatan dan 9 desa) (Gambar 2 dan Lampiran 1).
Gambar 2 Lokasi pengambilan sampel data fenotipik sapi Aceh
Materi Penelitian
Penelitian ini menggunakan sapi Aceh yang merupakan sapi lokal yang hidup di Provinsi Nanggroe Aceh Darussalam. Penentuan sampel sapi secara klaster sampling, yaitu pertama menentukan kelompok kecamatan dan selanjutnya menentukan kelompok desa. Sebanyak 100 ekor sapi jantan dan betina diambil dari masing-masing lokasi (kabupaten atau kota), sehingga diperoleh keseluruhan sampel adalah 400 ekor (131 ekor jantan dan 269 ekor betina).
Aceh Utara Pidie
Aceh Besar Banda Aceh
Peralatan yang Digunakan
Peralatan penelitian yang digunakan yaitu tongkat ukur ketelitian 0,1 cm (FHK stainless steel buatan Australia); pita ukur ketelitian 0,1 cm (Gordas buatan Australia); jangka sorong stainless steel buatan Jerman, kamera digital Samsung Digimax 3.2 pixel, dan tali sabut pengikat sapi.
Pengambilan Sampel Data Kuantitatif dan Kualitatif
Pengumpulan data fenotipik dilakukan bersamaan dengan pengambilan sampel darah. Koleksi data dimulai dengan pencatatan jenis kelamin dan umur sapi serta nama pemiliknya. Umur sapi penelitian ditentukan berdasarkan hasil wawancara dengan pemiliknya dan hasil pengamatan terhadap pergantian dan pergesekan gigi seri. Sapi dengan gigi seri belum berganti dikode I0 (berumur kurang dari atau sama dengan satu tahun) tidak digunakan dalam penelitian ini, dikodekan I2, I4, I6dan I8masing-masing adalah sapi yang berumur 1-1,5; 2-2,5; 3-3,5; dan 4-6 tahun. Selanjutnya sapi-sapi dengan kode masing-masing dimasukkan dalam kelompok umur 1, 2, 3 dan 4 tahun.
Bagian-bagian permukaan tubuh yang diukur yaitu (Gambar 3) (1) lingkar dada (Li_Da), diukur melingkar tepat di belakang scapula, dengan menggunakan pita ukur dalam cm; (2) lebar dada (Le_Da), diukur antara tuberositas humeri sinister dan dexter, dengan menggunakan tongkat ukur dalam cm; (3) dalam dada (Da_Da), diukur dari bagian tertinggi pundak sampai dasar dada, dengan menggunakan tongkat ukur dalam cm; (4) tinggi pundak (Ti_Pu), diukur dari bagian tertinggi pundak melalui belakang scapula tegak lurus ke tanah, dengan menggunakan tongkat ukur dalam cm; (5) tinggi pinggul (Ti_Pi), diukur dari bagian tertinggi pinggul secara tegak lurus ke tanah, dengan menggunakan tongkat ukur dalam cm; (6) lebar pinggul (Le_Pi), diukur jarak lebar antara kedua sendi pinggul dengan menggunakan tongkat ukur dalam cm; (7) panjang badan (Pa_Ba), diukur dari tuber ischii sampai dengan tuberositas humeri, dengan menggunakan tongkat ukur dalam cm; (8) lingkar paha (Li_Pa), diukur pada pangkal paha melalui vastus lateralis, dengan menggunakan pita ukur dalam cm; (9) panjang ekor (Pa_Ek), diukur pada pangkal sampai ujung ekor, dengan menggunakan tongkat ukur dalam cm; (10) lebar ekor (Le_Ek), diukur pada bagian ekor yang terlebar, dengan menggunakan jangka sorong dalam cm; (11) panjang kepala (Pa_Ke), diukur pada posisi tengah kepala di antara dua tanduk sampai ke bagian mulut menghitam, menggunakan pita ukur dalam cm; (12)
lebar kepala (Le_Ke), diukur jarak kedua sisi tulang pipi, dengan menggunakan pita ukur dalam cm; dan (13) panjang tanduk (Pa_Ta), diukur pada pangkal tanduk sampai ujung tanduk mengikuti arah pertumbuhan tanduk dengan menggunakan pita ukur dalam cm (Otsuka et al. 1980; Diwyanto 1982; Mansjoer 1993).
Gambar 3 Sketsa bagian-bagian permukaan tubuh sapi Aceh yang diukur
Terdapat kesulitan dalam melakukan penimbangan ternak di lokasi penelitian, sehingga untuk menduga bobot badan sapi Aceh digunakan rumus Johnson yang dikemukakan oleh Abubakar dan Harmadji (1980) dalam uji kesesuaiannya dalam dugaan bobot badan sapi Peranakan Ongole. Rumus tersebut ialah W = LG2/300 (W = berat badan dalam pound, L = panjang badan dalam inch, G = lingkar dada dalam inch). Selanjutnya dijabarkan menjadi: BB = LG2/10804 (BB = bobot badan dalam kilogram, L= panjang badan dalam cm, G = lingkar dada dalam cm).
Sifat-sifat fenotipe kualitatif yang diamati yaitu warna, pola warna tubuh, bentuk pertumbuhan tanduk, garis muka dan punggung sapi yang dikelompokkan menurut lokasi, umur dan jenis kelamin. Pengamatan bentuk tanduk dengan cara mengamati arah pertumbuhannya berawal dari kepala sampai ujung tanduk. Setiap individu dicatat arah pertumbuhannya dan dibuat sketsa dari pertumbuhan tanduk tersebut.
Analisis Data
Pengolahan data menggunakan program Minitab versi 14.13 (Moore 2004) dan tabulasi data sheet Excel. Analisis data ditabulasikan menurut lokasi sampel, kelompok umur dan jenis kelamin berbeda. Karakterisasi ukuran-ukuran tubuh dilakukan dengan penghitungan nilai rataan (x ), simpangan baku (s) dan
koefisien keragaman (KK) dari setiap sifat yang diamati seperti petunjuk Steel dan Torrie (1995). Model persamaannya :
ix
n
x
n i i
1 ; s =1
)
(
2
n
x
x
i i ; dan KK (%) =
100% x sKeterangan xi adalah ukuran ke-i dari sifat x, n adalah jumlah sampel yang diperoleh dari populasi.
Pengujian rataan ukuran-ukuran tubuh antara sapi jantan dan betina digunakan analisis sidik ragam general linear model dengan hanya memasukkan faktor jenis kelamin. Pengolahan data dilanjutkan dengan pengujian terhadap warna, pola warna tubuh, bentuk pertumbuhan tanduk, garis muka dan punggung sapi ditampilkan secara deskriptif.
Penelitian Laboratorium
Daerah D-loop DNA Mitokondria
Waktu dan Tempat Penelitian
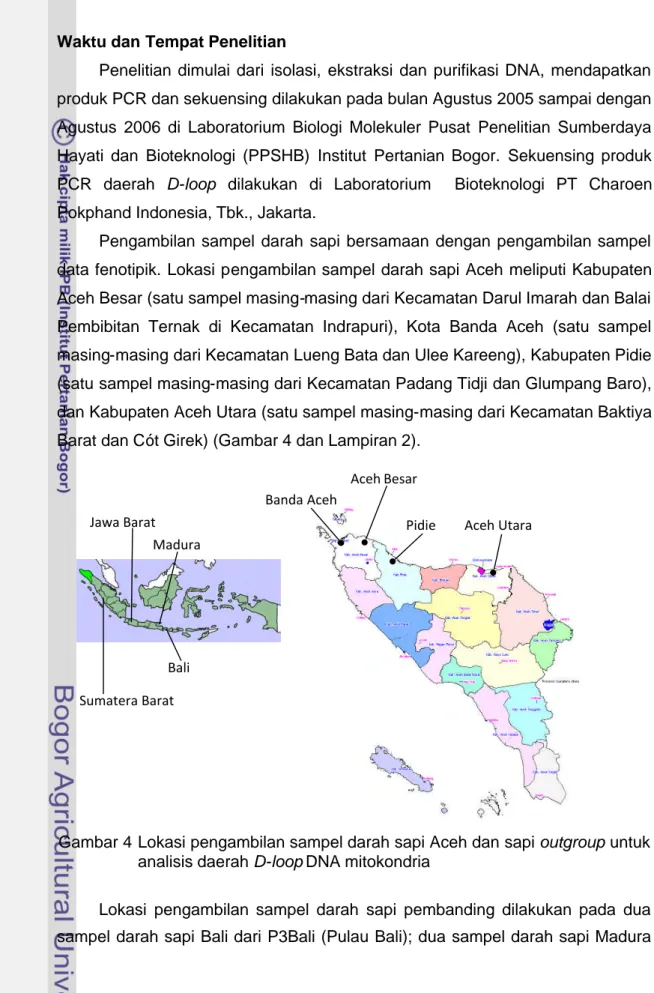
Penelitian dimulai dari isolasi, ekstraksi dan purifikasi DNA, mendapatkan produk PCR dan sekuensing dilakukan pada bulan Agustus 2005 sampai dengan Agustus 2006 di Laboratorium Biologi Molekuler Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) Institut Pertanian Bogor. Sekuensing produk PCR daerah D-loop dilakukan di Laboratorium Bioteknologi PT Charoen Pokphand Indonesia, Tbk., Jakarta.
Pengambilan sampel darah sapi bersamaan dengan pengambilan sampel data fenotipik. Lokasi pengambilan sampel darah sapi Aceh meliputi Kabupaten Aceh Besar (satu sampel masing-masing dari Kecamatan Darul Imarah dan Balai Pembibitan Ternak di Kecamatan Indrapuri), Kota Banda Aceh (satu sampel masing-masing dari Kecamatan Lueng Bata dan Ulee Kareeng), Kabupaten Pidie (satu sampel masing-masing dari Kecamatan Padang Tidji dan Glumpang Baro), dan Kabupaten Aceh Utara (satu sampel masing-masing dari Kecamatan Baktiya Barat dan Cót Girek) (Gambar 4 dan Lampiran 2).
Gambar 4 Lokasi pengambilan sampel darah sapi Aceh dan sapi outgroup untuk analisis daerah D-loop DNA mitokondria
Lokasi pengambilan sampel darah sapi pembanding dilakukan pada dua sampel darah sapi Bali dari P3Bali (Pulau Bali); dua sampel darah sapi Madura
Aceh Besar Sumatera Barat Jawa Barat Bali Madura Aceh Utara Pidie Banda Aceh
dari Desa Kambingan Timur, Kecamatan Saronggi, Kabupaten Sumenep, Pulau Madura; satu sampel darah sapi PO dari Laboratorium Ternak Potong dan Kerja, Fakultas Peternakan, Institut Pertanian Bogor; dan dua sampel darah sapi Pesisir dari Desa Sungai Liku, Kecamatan Ranah Pasir, Kabupaten Pesisir Selatan, Sumatera Barat (Gambar 4 dan Lampiran 2).
Pelaksanaan Pengambilan Sampel Darah
Pengambilan sampel darah sapi dilakukan dengan menggunakan venojact (none) 5 ml pada vena jugularis dan dimasukkan ke dalam tabung centrifuge 14 ml yang berisi alkohol absolut sebagai pengawet dengan perbandingan 1:1. Semua tabung berisi sampel darah disimpan pada suhu kamar dan dibawa ke Laboratorium Biologi Molekuler Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), Institut Pertanian Bogor dengan cara dimasukkan ke dalam kotak es (ice box).
Bahan-bahan dan Peralatan
Bahan-bahan pereaksi untuk isolasi DNA, yaitu lysis buffer, digestion buffer, rinse buffer, larutan phenol, larutan chloroform Iso Amyl Alcohol (CIAA), etanol absolut, etanol 70%, larutan TE 1x, larutan TBE 10x. Bahan-bahan untuk visualisasi DNA hasil isolasi dan produk PCR, yaitu agarose standar, larutan TBE 1x, dan pewarna ethidium bromide.
Peralatan yang digunakan adalah venojact (none) 5 ml, ice box, centrifuge tube 14 ml, mikropipet P10, P20, P200, P1000 Gilson (France) beserta pipet tipnya, microtube eppendorf 1.5 dan 0.2, gelas ukur, erlenmeyer dan gelas piala.
Peralatan elektronik digunakan mikrosentrifus (Eppendorf Centrifuge 5415 C); tungku pemanas (Sybron Thermolyne Nuova II Hot plate); vortex (Maxi Mix Thermolyne 37600 Mixer); waterbath (Grand Incubator); kamera pengamatan Mitsubishi video Copy Processor model P91E CB dilengkapi monitor (UVI Tec); vacuum dryer (Centri Vap Concentrator, Labconco); magnetic stirrer (Mg 78); electronic balance (AD HX 100); perangkat Submarine Electrophoresis; voltage/current regulator (Kayaki PS100); dan Mesin PCR Parkin Elmer 2400.
Perancangan Primer Daerah D-loop DNA Mitokondria
Daerah D-loop DNA mitokondria diamplifikasi dengan menggunakan primer BIDL-F 5’-ACC CCC AAA GCT GAA GTT CT-3’ dan BIDL-R 5’-GTG CCT TGC
TTT GGG TTA AG-3’, dengan panjang produk 980 bp. Primer tersebut didesain menggunakan software Primer3 (http://www-genome.wi.mit.edu/cgi-bin/ primer/ primer3_www.cgi) pada sekuens D-loop DNA mitokondria Bos indicus (sapi Nellore) GenBank yang diakses bebas di internet (Nomor Akses AY126697, Miretti et al. 2002) pada alamat
http://www.ncbi.nlm.nih.gov/
.Tabel 1 Urutan basa dan suhu penempelan primer untuk mengamplifikasi daerah D-loop sapi penelitian
Primer Sekuens Suhu annealing Panjang produk BIDL-F
BIDL-R
5’ACCCCCAAAGCTGAAGTTCT3’
5’GTGCCTTGCTTTGGGTTAAG3’ 59
oC 980 bp
Isolasi dan Purifikasi DNA Total
Ekstraksi dan purifikasi DNA total dilakukan menurut metode Sambrook et al. (1989) yang dikembangkan Duryadi (1997), yaitu purifikasi total genom DNA dengan standar fenol, kloroform, iso amil alkohol (Chol-IAA) dan diikuti dengan presipitasi etanol absolut.
Tahap pertama dilakukan pencucian sampel darah menggunakan larutan low TE dengan pengulangan tiga kali. Sampel darah beralkohol diambil 250 µl dan dikeringkan, dimasukkan ke dalam eppendorf 1,5 ml dan ditambahkan 500 µl larutan low TE, selanjutnya divortex sampai merata dan disentrifus 3.000 rpm selama 2 menit. Larutan bagian atas dibuang secara dipipet dan diulangi lagi penambahan low TE. Selanjutnya, endapan divortex merata, divacum selama 10 menit sampai kering.
Tahap selanjutnya yaitu sampel yang telah kering ditambahkan 500 µl larutan lysis buffer (Sukrosa 0,32 M, Triton X-100 1% w/v, MgCl2 5 mM, 1 mM Tris-HCl pH 7,4) dan digerus dengan menggunakan tongkat kaca selama 3 menit. Setelah halus, divortex merata, disentrifugasi 6.500 rpm selama 1 menit. Supernatan dibuang, endapannya ditambahkan 200 µl larutan rinse buffer (75 mM NaCl, 50 mM Titriplex III/EDTA ph 8,0). Divortex kembali sampai merata dan ditambahkan 500 µl larutan digestion buffer ([STES : NaCl 200 mM, Tris-HCl pH 9,0 50 mM, EDTA pH 8,0 100 mM, SDS 1% mg/ml, Proteinase K 0,5 mg/ml, RNAse 0,1 mg/ml)], enzim: proteinase K 0,5 mg/ml, 25 µl RNAse atau 40 mg/ml jika STES 9.750 ml). Divortex sesaat hingga homogen dan diinkubasi pada suhu 55oC selama semalam (±16 jam).
Lanjutan proses isolasi DNA, disiapkan tiga eppendorf baru yang ditandai sama. Sampel yang telah diinkubasi dibagi dua bagian dengan volume sama (satu bagian dimasukkan ke tube baru) secara dipipet, kemudian ke dalam masing-masing tabung ditambahkan 500 µl larutan fenol. Selanjutnya divortex sampai homogen dan digoyang 20 menit serta disentrifugasi 13.000 rpm selama 3 menit. Lapisan bagian atas yang bersih diambil dengan pipet dan dimasukkan ke eppendorf baru (dari dua eppendorf dengan sampel sama dijadikan satu kembali) dan ditambah 500 µl larutan CIAA (CHCl3dan iso amil alkohol 1:1) serta
digoyang 20 menit dan disentrifugasi 13.000 rpm selama 3 menit. Lapisan bagian atas yang lebih bersih dimasukkan ke eppendorf baru secara dipipet hingga volumenya ±500 µl, kemudian ditambahkan 1.000 µl (dua kali volume) etanol absolut dan dimiringkan 5-6 kali serta disimpan dalam freezer selama 30 menit. Selanjutnya disentrifugasi 13.000 rpm selama 5 menit, dilanjutkan dengan pembuangan alkohol dan dicuci dengan penambahan 400 µl alkohol 70%. Setelah disentrifugasi pada 13.000 rpm selama 3 menit, alkohol dibuang dan tepung berwarna putih (DNA) pada dasar eppendorf dikeringkan dengan arah tutupnya ke bawah. Apabila DNA telah kering, maka ditambahkan 50 µl larutan TE (10 mM Tris-HCl pH 8,0, 1 mM EDTA pH 8,0). Sesudah itu divortex sampai homogen, disentrifugasi pada 13.000 rpm selama ±4 detik dan diinkubasi pada 37oC selama 15 menit serta disimpan dalam freezer sampai saat digunakan.
Elektroforesis untuk Visualisasi DNA Hasil Isolasi
Disiapkan gel, yaitu agarose 0,6 g ditambah larutan 1xTBE 50 ml dan 50 ml aquades steril. Setelah campuran tersebut dipanaskan sampai mendidih, suhu diturunkan dengan cara pengadukan menggunakan stirrer dan ditambahkan 2,5 µl ethidium bromide. Selanjutnya larutan tersebut dituang ke dalam bak cetakan gel (baki) dan dipasang sisir pembuat sumur pada dudukannya. Setelah 45 menit, sisir dilepas perlahan-lahan dan gel ditempatkan di dalam bak alat elektroforesis dan dituang 1x buffer TBE ke dalam bak hingga sekitar 1 mm di atas permukaan gel. Sumur gel siap digunakan (maksimal 12 sumur).
Tergantung jumlah sampel dan kapasitas sumur, diambil 1 µl loading dye dengan pipetor dan dicampur merata dengan 5 µl sampel DNA uji di atas plastik cling, dimasukkan ke dalam sumur gel. Apabila sumur-sumur telah terisi dengan DNA-DNA uji, maka perangkat elektroforesis ditutup dan dihidupkan aliran listrik
pada tegangan 90 volt selama 30 menit. Pengamatan DNA dilakukan melalui video copy processor model P91E CB, monitor LCD, UVI Tec. Apabila pita-pita DNA pada gel terlihat tebal dan bersih, maka DNA tersebut tergolong bebas kontaminasi dan berkualitas baik.
Amplifikasi Daerah D-loop DNA Mitokondria
Daerah D-loop diamplifikasi melalui Polymerase Chain Reaction (PCR). Setiap reaksi PCR dibuat volume larutan 50 µl dengan komposisi 5 µl 10x buffer PCR; 2,5 µl MgCl2 (25 mM); 1 µl dNTP (40 mM); 0,25 µl Taq Polymerase (5
unit/µl) (Promega PCR Core System I no.cat.M7660, Madison, WI, USA); 1 µl primer F (20 picomol/ µl); 1 µl primer R (20 picomol/µl) (Amersham); 1-3 µl DNA total sebagai DNA cetakan (17,44-413,51 ng/µl); dH2O (Invitrogen) sampai volume 50 µl. Pencampuran selalu dilakukan penambahan akhir Taq DNA Polymerase.
Kondisi PCR untuk mengamplifikasi produk PCR adalah, pra PCR: denaturasi 94oC selama 2 menit; PCR: 94oC denaturasi 30 detik, 59oC annealing 45 detik dan 72oC elongasi 1 menit sebanyak 35 siklus; dan post PCR: ekstensi 72oC selama 5 menit dan terakhir 4oC suhu penyimpanan.
Kualitas produk PCR diketahui dengan cara dimigrasikan pada gel agarose 1,2% dalam buffer 1xTBE tegangan 90 volt selama 45 menit. Pengamatan dilakukan dengan bantuan video copy processor model P91E CB, monitor LCD, UVI Tec, setelah diwarnai dengan ethidium bromide. Penunjuk ukuran produk PCR digunakan penanda standar 100 bp DNA leader.
Penentuan Sekuens Nukleotida
Penentuan sekuens nukleotida daerah D-loop dilakukan di Laboratorium Molekuler DNA PT Charoen Pokphand Indonesia, Tbk. Tabung eppendorf berisi produk PCR dibawa ke Laboratorium tersebut dalam kondisi dingin dengan memasukkannya ke dalam kotak es berpendingin ice pack.
Sampel produk PCR dimurnikan dengan menggunakan QIA-Quick PCR Purification Kit (Qiagen). Sampel produk PCR yang telah dipurifikasi diukur konsentrasinya menggunakan spektrofotometer (UV-VIS Spectrophotometer-Shimizu) pada =260 nm. Selanjutnya dipergunakan sebagai template untuk reaksi penentuan runutan nukleotida.
Produk PCR diamplifikasi dengan menggunakan BigDye Terminator v.3.1 Cycle Sequencing Kit (Applied Biosystems, USA) dalam mesin PCR. Peng-gunaan primer dan siklus sekuensing sama seperti untuk PCR normal. Kondisi untuk reaksi penentuan sekuens adalah denaturasi 94oC selama 2 menit; selanjutnya denaturasi 94oC selama 30 detik, 59oC annealing 45 detik, dan 72oC elongasi 1 menit sebanyak 35 siklus; dan diakhiri ekstensi 72oC selama 5 menit. Kelebihan dari bahan reaksi BigDye Terminator dan primer dibuang dari produk siklus sekuensing berdasarkan petunjuk penggunaan pada ABI Prism 3100-Avant Genetic Analyzer, yaitu dengan tahapan: sebanyak 20 µl produk, ditambahkan 5 µl EDTA 125 mM dan 60 µl alkohol absolut. Tabung digoyang-goyangkan beberapa kali, diinkubasi pada suhu kamar selama 15 menit. Selan-jutnya, disentrifugasi 6000 rpm pada suhu 4oC selama 30 menit. Supernatan dibuang dan ditambahkan 60 µl alkohol 70%, disentrifugasi 4500 rpm pada suhu 4oC selama 15 menit dan supernatan dibuang. Pada tahap berikut diulangi penambahan alkohol 70% sebanyak 60 µl dan disentrifugasi 4500 rpm pada suhu 4oC selama 15 menit. Tabung dikeringkan dalam alat penguapan selama 2 menit dan ditambahkan 10 µl Hi-di Formamide. Selanjutnya didenaturasi pada suhu 95oC selama 4 menit dan segera ditempatkan di atas es selama 5 menit.
Analisis sekuensing DNA menggunakan ABI Prism 3100-Avant Genetic Analyzer. Sebanyak 10 µl produk-produk PCR yang telah dipurifikasi dan didenaturasi dalam siklus sekuensing dimasukkan ke dalam satu plate yang mempunyai 96 sumur. Dibuat plate rekaman di dalam program software koleksi sekuensing. Mesin sekunser dijalankan sampai electropherogram menunjukkan bahwa semua fragmen DNA mengalir sepanjang kapiler array dan dideteksi dengan pendeteksi laser. Electropherogram akan muncul dan kini tersedia bagi analisis bioinforrnatika.
Analisis Data
Pensejajaran runutan basa nukleotida D-loop dilakukan dengan menggunakan software Squint Alignment Editor versi 1.02 dari situs Bioinformatics Institute pada alamat www.Bioinformatics.org.nz dan software program MEGA versi 4.0 Beta Release (Tamura et al. 2007). Hasil analisis program MEGA diperoleh matriks jarak genetik (D) 2 parameter Kimura berdasarkan persamaan basa nukleotida, dan pohon filogeni digunakan metode bootstrapped Neighbor-Joining dengan 1000 kali pengulangan.
DNA Mikrosatelit
Waktu dan Tempat Penelitian
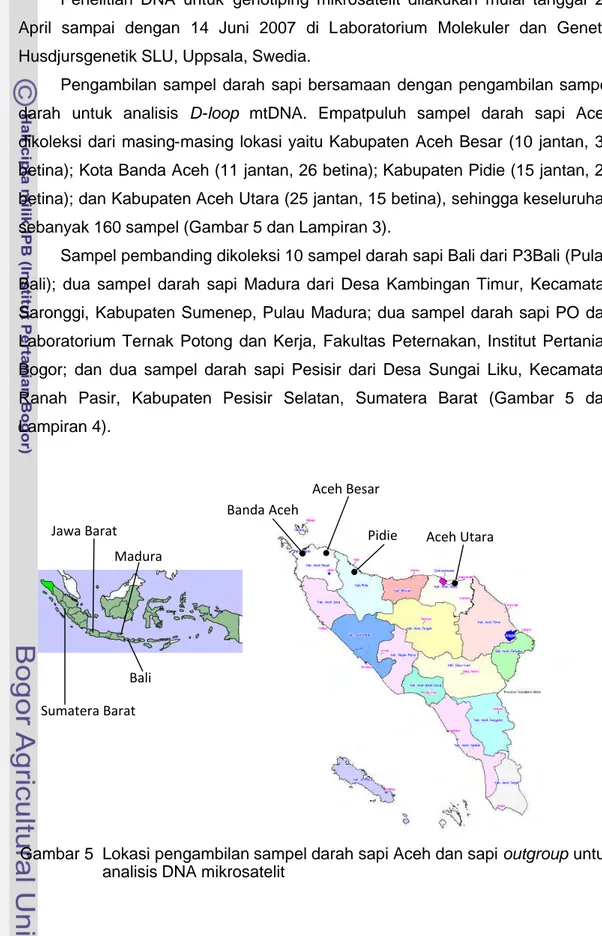
Penelitian DNA untuk genotiping mikrosatelit dilakukan mulai tanggal 24 April sampai dengan 14 Juni 2007 di Laboratorium Molekuler dan Genetik Husdjursgenetik SLU, Uppsala, Swedia.
Pengambilan sampel darah sapi bersamaan dengan pengambilan sampel darah untuk analisis D-loop mtDNA. Empatpuluh sampel darah sapi Aceh dikoleksi dari masing-masing lokasi yaitu Kabupaten Aceh Besar (10 jantan, 30 betina); Kota Banda Aceh (11 jantan, 26 betina); Kabupaten Pidie (15 jantan, 25 betina); dan Kabupaten Aceh Utara (25 jantan, 15 betina), sehingga keseluruhan sebanyak 160 sampel (Gambar 5 dan Lampiran 3).
Sampel pembanding dikoleksi 10 sampel darah sapi Bali dari P3Bali (Pulau Bali); dua sampel darah sapi Madura dari Desa Kambingan Timur, Kecamatan Saronggi, Kabupaten Sumenep, Pulau Madura; dua sampel darah sapi PO dari Laboratorium Ternak Potong dan Kerja, Fakultas Peternakan, Institut Pertanian Bogor; dan dua sampel darah sapi Pesisir dari Desa Sungai Liku, Kecamatan Ranah Pasir, Kabupaten Pesisir Selatan, Sumatera Barat (Gambar 5 dan Lampiran 4).
Gambar 5 Lokasi pengambilan sampel darah sapi Aceh dan sapi outgroup untuk analisis DNA mikrosatelit
Sumatera Barat Jawa Barat Bali Madura Aceh Utara Pidie Banda Aceh Aceh Besar
Isolasi, ekstraksi dan purifikasi DNA total dilakukan bersamaan pada saat isolasi DNA total untuk analisis daerah D-loop DNA mitokondria di Laboratorium Biologi Molekuler Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), Institut Pertanian Bogor.
Pelaksanaan Pengambilan Sampel Darah
Pengambilan sampel darah sapi dilakukan dengan menggunakan venojact (none) 5 ml pada vena jugularis dan dimasukkan ke dalam tabung centrifuge 14 ml yang berisi alkohol absolut sebagai pengawet dengan perbandingan 1:1. Semua tabung berisi sampel darah disimpan pada suhu kamar dan dibawa ke Laboratorium Biologi Molekuler Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), Institut Pertanian Bogor dengan cara dimasukkan ke dalam kotak es (ice box).
Bahan-bahan dan Peralatan
Bahan pereaksi untuk PCR digunakan dari Applied Biosystems, Taq polymerase Gold, Buffer tanpa MgCl2, 20 mM dNTP, 20 mM MgCl2, primer M13
oligo (20 mM M13 FAM, 20 mM M13 PET, 20 mM M13 NED, 20 mM M13 VIC), 20 µM primer F dan R.
Mesin untuk menghitung konsentrasi DNA digunakan NanoDrop ND 1000 Spectrophotometer. Mesin PCR digunakan GeneAmp PCR System 9700 Applied Biosystems. Mesin genotiping mikrosatelit digunakan ABI Applied Biosystems HITACHI 3100 Genetic Analyzer dan mesin untuk denaturasi produk PCR sebelum masuk mesin genotiping digunakan DNA Engine Gradient Cycler, MJ Research PTC 200 Peltier Thermal Cycler.
Primer Mikrosatelit
Penelitian ini menggunakan 16 lokus mikrosatelit sebagai penanda molekul. Penanda-penanda dipilih berdasarkan yang direkomendasikan dalam Bishop et al. (1994), Vaiman et al. (1994) dan Sodhi et al. (2006) karena dapat menunjukkan polimorfisme pada sapi. Polimorfisme masing-masing lokus mikrosatelit diungkapkan dengan menggunakan sepasang primer mikrosatelit sapi. Primer mikrosatelit tersebut adalah BM1818, INRA005, CSRM60, BM2113, HEL5, HEL9, HEL13, INRA63, INRA35, HEL1, ETH225, ETH10, CSSM66, BM1824, ILSTS006 dan ILSTS005 (Lampiran 15).
Amplifikasi Lokus Mikrosatelit
Mikrosatelit diamplifikasi melalui Polymerase Chain Reaction (PCR). Setiap reaksi PCR dibuat volume 10 µl dengan komposisi reaksi PCR mengandung 1 µl 1x buffer PCR; 1 µl MgCl2(20 mM); 0,2 µl dNTP (20 mM); 0,1 µl primer F (20
µM); 0,5 µl primer R (20 µM); 0,5 µl primer M13 oligo (FAM, VIC, PET atau NED); 0,2 µl Taq Polymerase (0,25 U) (ABI Applied Biosystems); 4,5 µl dH2O; dan 2 µl
DNA (5 ng/µl). Pencampuran selalu dilakukan penambahan akhir Taq DNA Polymerase.
Langkah denaturasi pada suhu 95oC selama 10 menit dilanjutkan dengan 14 siklus langkah denaturasi pada suhu 95oC selama 30 detik, 30 detik annealing 65-52 oC (-1oC/siklus) hingga tercapai temperatur primer yang optimal ‘touchdown cycle profile’, dan langkah elongasi pada suhu 72oC selama 30 detik. Amplifikasi terakhir terdiri atas 30 siklus langkah denaturasi pada suhu 95oC selama 30 detik; 30 detik annealing pada suhu primer optimal 52oC; 30 detik elongasi pada suhu 72oC kemudian dilanjutkan dengan 7 menit langkah ekstensi akhir pada suhu 72oC dan suhu penyimpanan 4oC.
Elektroforesis Produk PCR
Disiapkan plate yang mempunyai 96 sumur dan dimasukkan 12 µl dari campuran 25 µl LIZ Size Standard 500 bp dan 1200 µl Hi-di Formamide (tergantung jumlah sampel) pada setiap sumur. Produk PCR 1 µl masing-masing sampel dimasukkan ke dalam sumur yang telah berisi campuran LIZ Size Standard dan Hi-di Formamide (12 µl). Plate ditutup dengan grey rubber-lid dan didenaturasi pada suhu 95 oC selama 4 menit. Plate kemudian diapit dengan tray spesifik hitam pada bagian bawah dan tray spesifik putih pada bagian atas yang akan ditempatkan di dalam mesin ABI 3100. Ada dua tempat yang dapat ditempatkan di dalam mesin tersebut. Software mesin dijalankan sebelum dihidupkan mesin. Apabila semua fitur program menunjukkan tanda hijau, maka dapat dimulai impor sample sheet untuk Plate Manager sebagai tempat muncul electropherogram. Plate sampel dimasukkan, yaitu ditempatkan di dalam mesin pada posisi A, dan apabila ada dua plate maka plate terakhir pada posisi B. Selanjutnya mesin siap dijalankan selama ±4 jam dan mesin akan menunjukkan tanda completed jika proses genotiping telah selesai.
Hasil elektroforesis mesin ABI dapat dilihat dan dianalisis dengan software GeneMapper versi 4.0 setelah melalui proses elektroforesis dalam mesin Applied
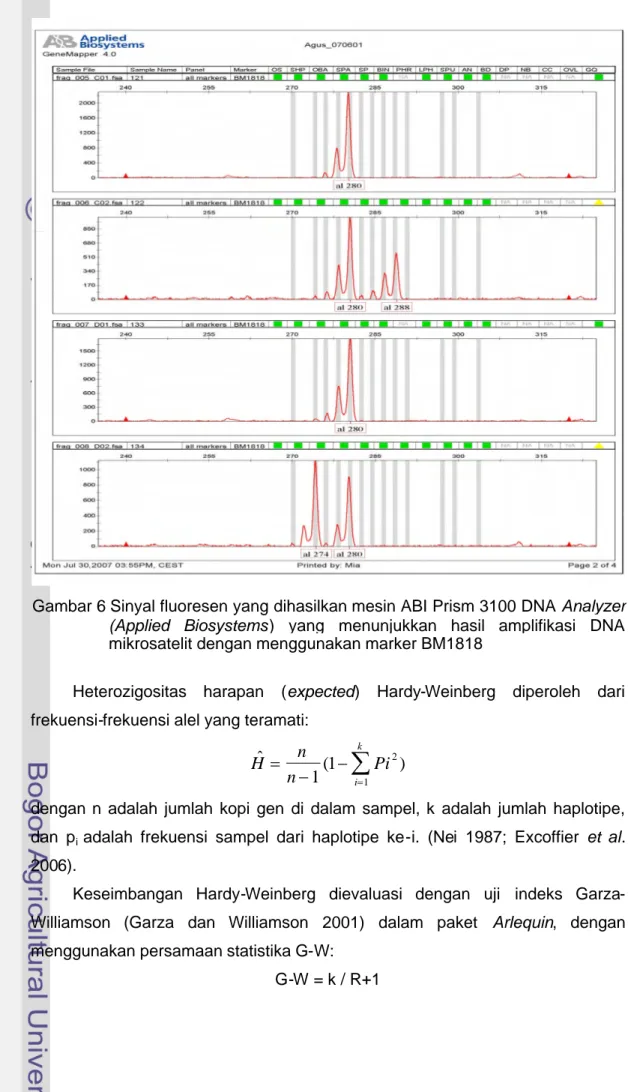
Biosystems HITACHI 3100 Genetic Analyzer dengan ladder LIZ size Standard 500 bp. Software pada layar monitor akan menunjukkan peak dalam bentuk grafik-grafik dengan panjang tertentu dalam base pairs (bp) pada masing-masing sampel, dan ini menunjukkan alel-alel mikrosatelit dalam bentuk ukuran tertentu. Alel homozigot dan heterozigot ditentukan berdasarkan variasi ukuran-ukuran grafik yang ditunjukkan program tersebut. Tampilan grafik yang konsisten satu peak menunjukkan sampel teramplifikasi memiliki satu alel (homozigot), dan sampel yang memiliki dua peak menunjukkan dua alel (heterozigot). Apabila ada tampilan grafik sibuk yang tidak beraturan, ini menandakan hasil yang kosong, dan apabila diperoleh tanda sinyal yang lebih dari dua grafik, maka sampel tersebut tercemar dengan DNA yang lain dan tidak digunakan.
Angka pada ordinat X-axis merupakan ukuran alel dalam pasang basa (basepairs) dan angka pada ordinat Y-axis merupakan sinyal warna (label/dye) yang menunjukkan ketinggian puncak-puncak (peak) yaitu intensitas fluoresen dan menunjukkan konsentrasi hasil amplifikasi (Gambar 6).
Analisis Data
Analisis data alel dilakukan dengan menggunakan software GeneMapper versi 4.0 (Applied Biosystems) dan hasil-hasil yang diperoleh dimasukkan ke dalam tabulasi data sheet Excel. Data yang diperoleh dianalisis dengan menggunakan program Arlequin versi 3.11 (Excoffier et al. 2006) yang didownload pada alamat: http://cmpg.unibe.ch/software/arlequin3 berdasarkan petunjuk Krafsur et al. (2005), dukungan program Minitab versi 4.13 (Moore 2004) dan data sheet Excel 2007. Frekuensi-frekuensi alel, heterozigositas yang dihitung secara langsung dan heterozigositas harapan Hardy-Weinberg dihitung untuk masing-masing penanda sapi penelitian berbasis data frekuensi. Frekuensi alel setiap lokus mikrosatelit dihitung dengan rumus Nei (Nei 1987; Nei dan Kumar 2000).
Heterozigositas hitung (observed) diperoleh dari persamaan berikut: H = 2n(1 x2)/(2n)
i i
dengan xi merupakan jumlah masing-masing heterozigot pada lokus i; n adalah jumlah individu yang teramati.
Gambar 6 Sinyal fluoresen yang dihasilkan mesin ABI Prism 3100 DNA Analyzer (Applied Biosystems) yang menunjukkan hasil amplifikasi DNA mikrosatelit dengan menggunakan marker BM1818
Heterozigositas harapan (expected) Hardy-Weinberg diperoleh dari frekuensi-frekuensi alel yang teramati:
) 1 ( 1 ˆ 1 2
k i Pi n n Hdengan n adalah jumlah kopi gen di dalam sampel, k adalah jumlah haplotipe, dan piadalah frekuensi sampel dari haplotipe ke-i. (Nei 1987; Excoffier et al.
2006).
Keseimbangan Hardy-Weinberg dievaluasi dengan uji indeks Garza-Williamson (Garza dan Garza-Williamson 2001) dalam paket Arlequin, dengan menggunakan persamaan statistika G-W:
dengan k adalah jumlah alel yang terdapat pada lokus dalam populasi sampel dan R adalah selisih ukuran alel maksimum dan minimum. Apabila hasil pengujian antara nilai heterozigositas hitung (observed) dan heterozigositas harapan (expected) menunjukkan nilai P (probabilitas) < 5%, maka berbeda nyata, artinya dalam populasi sudah tidak lagi terjadi keseimbangan Hardy-Weinberg.
Jarak genetik standar Nei (Ds) digunakan rumus Nei (1987) dengan hitungan dari nilai heterozigositas yang diperoleh dari frekuensi-frekuensi alel.
Jyy
Jxx
Jxy
Ds
.
ln
;
r j mj i ijr
x
Jxx
2/
;
r j mj i ijr
y
Jyy
2/
;Jxy
x
y
r
r j mj i ij ij/
dengan Jxx adalah rataan diversitas seluruh lokus dalam populasi x, Jyy adalah rataan diversitas seluruh lokus dalam populasi y, Jxy adalah rataan jumlah hasil kali frekuensi populasi x dan y seluruh lokus, xij adalah frekuensi alel ke-i lokus ke-j populasi x, yij frekuensi alel ke-i lokus ke-j populasi y, i = alel ke-n, mj = jumlah alel lokus ke-j, dan j = lokus ke-n. Perhitungan jarak genetik dilakukan dengan menggunakan Arlequin.
Data matriks jarak genetik hasil Arlequin selanjutnya digunakan untuk membuat pohon filogeni dengan menggunakan metode Neighbor-Joining dalam software program Phylip (phylogeny Inference Package) versi 3.67 dengan aplikasi Neighbor.exe dari petunjuk Felsenstein (2007), hasilnya berbentuk file outtree. Pembacaan dan pengaturan file outtree hasil dari analisis program tersebut digunakan software program MEGA versi 4.0 Beta Release (Tamura et al. 2007) dengan pilihan Root on Midpoint di submenu View, yaitu mengikuti pengaturan secara otomat pada pohon filogeni dari hasil analisis daerah D-loop DNA mitokondria.