64
DAYA HAMBAT RIZOBAKTERI KANDIDAT AGENS BIOKONTROL TERHADAP PERTUMBUHAN KOLONI PATOGEN PHYTOPHTHORA
CAPSICI SECARA IN VITRO
Deterrent Ability of Rhizobacteria As Biocontrol Agent Candidates to Pathogen Phytophthora capsici Colony Growth In Vitro
Syamsuddin dan M. Abduh Ulim
Program Studi Agroteknologi, Fakultas Pertanian Unsyiah, Banda Aceh, Jl Tgk H. Krueng Kalee, 23111. email penulis pertama dan korespondensi: [email protected].
ABSTRACT
The utilization of biocontrol agents as an alternative to synthetic pesticides becomes widespread as the increase of awareness to negative effects of synthetic pesticides. The objectives of this research were to isolate rhizobacteria from tomato plant rhizosphere and to characterize effective rhizobacteria isolates to deter growth of Phytopthora capsici colony. The rhizobacteria was isolated from healthy tomato plant rhizosphere, and then antagonism nature to pathogen was evaluated by double culture method. Deterrent ability of the rhizobacteria was measured based on resistance zone formed due to the presence of the biocontrol agents. Among 57 isolates, 18 were potential for further evaluation. Deterrent ability test of the 18 isolates resulted in 3 isolates which were very promising to be developed as biocontrol agents to control seed borne pathogens. They were RBBM36, RBBM18 and RBBM35.
Keywords: Isolate, biocontrol agents, rhizosphere, resistivity zone
PENDAHULUAN
Salah satu usaha untuk mengeliminasi patogen dan kejadian penyakit pada tanaman dapat dilakukan dengan penggunaan agens pengendali hayati yang berasal dari rizosfer tanaman. Penggunaan agens pengendalian hayati sebagai alternatif penggunaan pestisida kimia semakin banyak dikembangkan sejalan dengan meningkatnya kesadaran terhadap dampak dari pestisida kimia tersebut. Rizobakteri yang berasal dari rizosfer tanaman yang secara biologis telah menyatu dengan ekosistemnya, mempunyai kemampuan secara spesifik untuk menekan berbagai penyakit tanaman (Yamaguchi, 1996).
Rizobakteri, merupakan bakteri saprofit yang hidup pada rizosfer dan mengkolonisasi sistem perakaran tanaman, telah dipelajari sebagai sebagai agens biokontrol untuk mengendalikan penyakit dan pemacu pertumbuhan tanaman (Plant growth Promoting Rhizobacteria) untuk meningkatkan produksi tanaman (Silva et al, 2003). Strain rizobakteri pemacu pertumbuhan tertentu telah digunakan sebagai inoculant biofertilizer (Kennedy et al, 2004).
Beberapa jenis rizobakteri yang saat ini banyak dikembangkan sebagai agens biokontrol diantaranya adalah spesies Pseudomonas, Bacillus, Serratia, Streptomyces, Azospirillum, Agrobacterium, Phyllobacterium, Rhizobium, Enterobacter, Alkaligenes,
65 Burkholderia, Beijerinkia, Klebsiella,
Clostridium Vario-vovax, Xanthomonas dan Arthrobacter (Kim, 1997; De Silva, 2000; Bullied, 2002; Lugtenberg, 2002; Lucy et al, 2004). Peran rizobakteri sebagai agens antagonis dalam menghambat patogen tanaman secara in vitro berhubungan dengan kemampuannya dalam mensintesis metabolit sekunder seperti senyawa antibiotik, siderofor, hidrogen sianida (HCN) dan sintesis berbagai enzim degradasi dinding sel patogen seperti kitinase, 1,3-glukanase, 1,4-1,3-glukanase, selulase, lipase, dan protease, serta produksi l-aminociklopropane -l-carbocylate (ACC) deaminase (Baharum et al, 2003; Huang & Chen, 2004; Gohel et al, 2004; Diby, 2004; Sutariati, 2006).
Busuk phytophthora termasuk salah satu penyakit yang mengakibatkan kehilangan hasil tomat di seluruh dunia. Sementara pengendalian penyakit ini masih sulit dikendalikan karena belum tersedianya varietas yang resisten, dan patogen dapat terbawa benih dan tular tanah, serta metode pengendaliannya masih terbatas. Benih telah dilaporkan merupakan salah satu sumber inokulum patogen phytophthora pada tanaman tomat (Erwin & Ribeiro, 1996; Roberts et al, 2000; Louws et al, 2002).
Sejauh ini pengendalian penyakit busuk phytophthora pada tomat dilakukan secara kimiawi dengan menggunakan fungisida metalaxyl, mefenoxam atau berbagai fungisida lainnya. Pengendalian secara biologis dengan memaanfatkan rizobakteri yang diisolasi dari rizosfer tanaman masih belum banyak dilaporkan. Walaupun banyak hasil penelitian telah dilaporkan bahwa penggunaan agens biokontrol secara efektif mengendalikan berbagai penyakit pada beberapa komoditas tanaman. Tetapi pada tanaman tomat,
khususnya untuk pengendalian patogen P. capsici yang menginfeksi tanaman tomat masih belum banyak informasinya. Oleh karena itu perlu diisolasi dan dikarakterisasi kemampuannya untuk mengetahui daya hambat pertumbuhan koloni berbagai patogen tanaman tomat. Evaluasi daya hambat rizobakteri secara in vitro merupakan langkah awal untuk mengetahui efektivitasnya sebagai agens biokontrol.
Penelitian ini bertujuan untuk mengidentifikasi dan isolasi rizobakteri sebagai kandidat agens biokontrol yang berasal dari daerah rizosfer tanaman tomat sehat diantara tanaman tomat yang terinfeksi patogen P.capsici. Penelitian juga bertujuan untuk mengevaluasi daya hambat rizobakteri yang diperoleh terhadap pertumbuhan koloni P. capsici.
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Ilmu dan Teknologi Benih dan Laboratorium Hama Penyakit Program Studi Agroteknologi Fakultas Pertanian Unsyiah. Di samping itu penelitian ini juga dilaksanakan di Laboratorium Hama Penyakit BALITTRO Cimanggu Bogor. Penelitian dilaksanakan mulai bulan April 2011 sampai bulan Desember 2011.
Isolasi P. capsici dari Lapangan
Inokulum P. capsici diperoleh dengan cara diisolasi langsung dari tanaman tomat yang menunjukkan gejala infeksi P. capsici seperti terdapat busuk pada pangkal batang, akar berwarna cokelat dan daunnya telah mengalami kelayuan. Proses isolasi dilakukan dengan cara jaringan tanaman yang sakit permukaannya terlebih dahulu disterilisasi dengan etanol 70% selama 10 detik, kemudian
66
dibilas dengan air steril. Potongan kecil jaringan tanaman ukuran 10 x 15 mm dari daerah lesio diambil dan ditempatkan pada cawan petri yang berisi media water agar (WA). Selanjutnya diinkubasi pada suhu 23-25 oC dengan penyinaran sinar NUV. Setelah 2 hari inkubasi dilakukan pengamatan, apabila telah menunjukkan P. capsici muncul segera dipindahkan ke media V8, hal ini untuk mempercepat pertumbuhan koloni dan terbentuknya spora. Identifikasi dilakukan berdasarkan pengamatan makroskopik karakteristik koloni yang berasal dari hifa tunggal media water agar dan morfologi sporangium (Erwin & Ribeiro, 1996). Selanjutnya dilakukan pemurnian dengan menghasilkan zoospora tunggal untuk mendapatkan isolat P. capsici murni yang digunakan untuk penelitian.
Isolasi Rizobakteri dari Lapangan
Isolasi dilakukan untuk mendapatkan isolat bakteri non-patogenik dari spesies Pseudomonas spp.. Bacillus spp. dan Serratia spp, yang berpotensi sebagai agens biokontrol. Rizobakteri diisolasi dari rizosfer tanaman tomat sehat diantara tanaman tomat terserang busuk phytophthora. Isolasi dilakukan di daerah pertanaman tomat petani desa Hakim Tunggul Atas Kecamatan Simpang Tiga Kabupaten Bener Meriah, Provinsi Aceh.
Sebanyak 10 g tanah yang berada di sekitar perakaran serta yang melekat di permukaan akar, diambil dari beberapa tanaman, kemudian dicampur dan diaduk sampai homogen. Komposit contoh tanah sebanyak 10 g disuspensikan dalam 90 ml air aquades steril, dan dilakukan pengenceran hingga tingkat pengenceran 10-7, 10-8, dan 10-9. Suspensi tanah sebanyak 0.1 ml dituang dan diaduk ke dalam media
King's B yang ditambah cyclohexamide 50 mg/1, ampicillin 50 mg/1, dan chloram-phenicol 12.5 mg/1 untuk isolasi bakteri P. fluorescens (Schaad et al, 2001). Untuk mengisolasi rizobakteri dari kelompok Serratia spp. suspensi tanah sebanyak 0,1 ml dituang ke dalam media King's B dengan antibiotik tetracycline 100 mg/l dan ampicillin 500 mg/1 (Press et al, 2001). Isolasi Bacillus spp. dilakukan dengan cara suspensi tanah dipanaskan sampai suhu 80 0C selama 30 menit di dalam penangas air lalu dituangkan ke dalam media tryptic soy agar (TSA) dengan konsentrasi 0,1 (v/v). Kultur bakteri yang diperoleh diinkubasi dalam ruang bersuhu 27 oC selama 48 jam. Setiap koloni yang tumbuh diisolasi dan dibuat biakan murninya. Rizobakteri yang berpotensi sebagai agens biokontrol diidentifikasi menggunakan prosedur uji standar dengan metode yang dikembangkan oleh Schaad et al (2001).
Daya Hambat Rizobakteri terhadap Cendawan Patogen
Uji daya hambat rizobakteri (uji antagonis) terhadap cendawan patogen P. capsici secara in vitro dilakukan untuk menseleksi isolat yang berpotensi sebagai agens biokontrol. Cendawan tersebut merupakan patogen yang menyerang tanaman tomat pada saat pembibitan atau saat penanaman di lapangan. Dalam percobaan ini dilakukan evaluasi terhadap 57 isolat rizobakteri menggunakan metode uji kultur ganda. Potongan medium PDA padat dengan diameter 0.5 cm yang ditumbuhi hifa dari masing-masing cendawan patogen digunakan sebagai inokulum dan diinokulasikan pada cawan petri berisi medium PDA yang masih segar. Potongan inokulum diletakkan dengan jarak 3 cm dari tepi cawan petri dan kultur diinkubasikan dalam ruang bersuhu 26-28 °C selama 7 hari.
Masing-67 masing isolat rizobakteri yang diuji
digoreskan memanjang dengan jarak 3 cm dari tepi cawan petri berlawanan arah dengan letak patogen yang telah ditumbuhkan sebelumnya. Untuk masing-masing isolat rizobakteri dilakukan pengujian dengan pengulangan tiga kali. Pengamatan dilakukan setiap hari terhadap pertumbuhan koloni patogen dan persentase daya hambat rizobakteri (DH) dihitung dengan rumus: R1-R2)/(R1)] x 100 %, Rl = jari-jari pertumbuhan patogen ke arah tepi cawan petri, R2= jari-jari pertumbuhan patogen ke arah rizobakteri. Data daya hambat dianalisis dengan menggunakan program SAS dan perbedaan nilai tengah daya hambat antar perlakuan diuji dengan uji jarak berganda Duncan pada α= 0.05.
HASIL DAN PEMBAHASAN
Hasil isolasi rizobakteri sebagai kandidat agens biokontrol yang dilakukan di daerah rizosfer tanaman tomat sehat, pada pertanaman tomat petani Desa Hakim Tunggul Atas Kecamatan Simpang Tiga Kabupaten Bener Meriah Provinsi Aceh diperoleh 57 isolat rizobakteri. Selanjutnya dilakukan uji antagonis tahap pertama dengan menggunakan media Potato Dextrose Agar (PDA), diperoleh 18 isolat rizobakteri yang berpotensi untuk dilakukan pengujian lebih lanjut. Sebagai contoh beberapa isolat kandidat agens biokontrol hasil isolasi dari daerah rizosfer tanaman tomat dan kemampuan daya hambat terhadap pertumbuhan koloni patogen P. capsici berdasarkan zona hambatan yang terbentuk dapat dilihat pada Tabel 1.
Tabel 1. Daya Hambat berbagai isolat rizobakteri terhadap pertumbuhan koloni cendawan patogen P. capsici
Nomor Isolat Skala Penghambatan Daya Hambat (%) Kontrol - 0.00 RBBM1 ++ 57.33 gh RBBM2 ++ 56.67 h RBBM6 ++ 58.33 fg RBBM8 + 36.33 k RBBM11 ++ 57.33 gh RBBM12 ++ 64.67 d RBBM15 + 18.67 m RBBM16 ++ 57.53 gh RBBM17 ++ 59.33 f RBBM18 +++ 67.33 c RBBM20 + 34.33 l RBBM22 ++ 59.00 f RBBM25 + 64.23 d RBBM28 + 48.33 i RBBM30 ++++ 76.33 b RBBM33 + 41.67 j RBBM35 - 1.67 n RBBM36 ++++ 78.00 a
Keterangan: aktivitas daya hambat sangat tinggi (++++ = >75DH), aktivitas tinggi (+++ = 61-75DH), aktivitas sedang (++ = 51-60DH), aktivitas rendah (+ = <50DH) dan tidak ada aktivitas (-). Dari hasil percobaan ini dipilih yang paling efektif, untuk percobaan berikutnya.
Dari hasil uji antagonis tahap kedua dengan metode uji kultur ganda, diperoleh sejumlah rizobakteri sebagai
kandidat agens biokontrol yang memiliki kemampuan untuk menghambat pertumbuhan koloni
69 cendawan patogen P. capsici isolat
tanaman tomat dengan hasil yang
berbeda-beda tergantung pada isolatnya (Tabel 1, Gambar 1).
Gambar 1. Daya hambat berbagai isolat agens biokontrol terhadap pertumbuhan koloni patogen P. Capsici.
Diantara 18 isolat rizobakteri yang diuji, terdapat 2 isolat dengan kemampuan penghambatan terhadap pertumbuhan koloni patogen cendawan sangat tinggi (>75% DH), yaitu isolat RBBM30 dan RBBM36. Dua isolat rizobakteri dengan kemampuan penghambatan tinggi yaitu isolat rizobakteri RBBM18 (>60% DH), sisanya masing-masing 6 isolat rizobakteri dengan daya penghambatan terhadap pertumbuhan
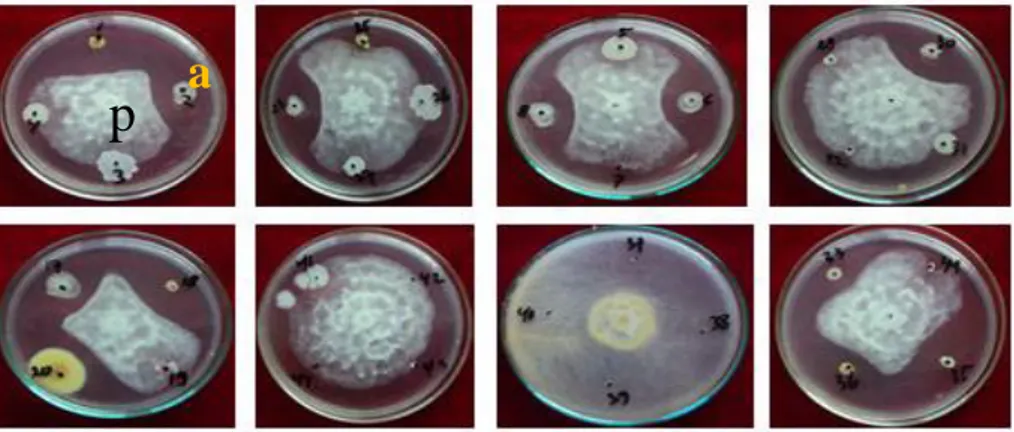
koloni cendawan patogen sedang (>50% DH) dan 7 isolat rizobakteri dengan daya penghambatan rendah serta satu isolat rizobakteri dengan tidak memiliki daya penghambatan sama sekali. Sebagai contoh dapat dilihat hasil uji daya hambat kandidat agens biokontrol terhadap pertumbuhan koloni patogen P. capsici secara in vitro (Gambar 2 dan 3).
Gambar 2. Contoh kemampuan daya hambat beberapa isolat kandidat agens biokontrol terhadap pertumbuhan koloni P. capsici (seleksi tahap awal). p (patogen), a (agens biokontrol).
69 Gambar 3. Contoh kemampuan daya hambat beberapa isolat kandidat agens biokontrol terhadap pertumbuhan koloni P. capsici (uji kultur ganda). (a) agens biokontrol, (p) patogen P. capsici
Kelompok rizobakteri yang memiliki kemampuan daya penghambatan terhadap pertumbuhan koloni cendawan patogen P. capsici sedang, rendah dan tidak memiliki daya hambat sama sekali, sebenarnya juga masih berpotensi untuk dikembangkan sebagai rizobakteri pemacu pertumbuhan. Kelompok rizobakteri ini kemungkinan memiliki berbagai kemampuan lainnya seperti memproduksi senyawa IAA, senyawa siderofor, mereduksi mangan, dan kemampuan melarutkan fosfat. Hasil penelitian Syamsuddin (2009), menemukan bahwa terdapat sejumlah rizobakteri hasil isolasi dari rizosfer tanaman cabai yang menunjukkan kemampuannya untuk menghasilkan IAA, senyawa siderofor, dan kemampuan melarutkan fosfat. Untuk mengetahui kemampuan tersebut perlu dilakukan pengujian lebih lanjut. Dengan demikian meskipun kemampuan antagonis tidak dimiliki akan tetapi kelompok rizobakteri tersebut dapat digunakan sebagai
Plant Growth Promoting Rhizobacteria (PGPR).
Perbedaan efektivitas daya hambat rizobakteri terhadap pertumbuhan koloni patogen P. capsici juga ditemukan pada rizobakteri asal tanaman cabai (Syamsuddin et al, 2007). Perbedaan kemampuan tersebut diduga berhubungan dengan kemampuan isolat dalam mensekresikan senyawa metabolit sekunder yang bersifat antimikrob, seperti antibiotik, hidrogen sianida (HCN) dan sintesis berbagai enzim degradasi dinding sel seperti kitinase, selulase, lipase, dan protease. Senyawa antimikrob yang dihasilkan oleh Bacillus spp. antara lain kanosamine (Milner et al, 1996), zwitermisin (Silo-Suh et al, 1998), iturin (Bernal et al, 2002), mikosubtilins, basilomisin, fengimisin, mikobasilin, mikoserein (Hornby, 1993), dan bacitracin (Awais et al, 2007).
Di samping itu mekanisme penghambatan secara langsung oleh rizobakteri dari kelompok non virulen
70
antara lain dengan menghasilkan antibiotik pioluteorin, pirolnitrin, fenazines, dan fusarisidin (Beatty & Susan, 2002), serta 2,4-diasetil floroglusinol (Dwivedi & Johri, 2003). Hasil uji in vitro menunjukkan dinding sel patogen P. capsici mengalami degradasi oleh enzim 1,3-glukanase, 1,4-glukanase dan lipase yang dihasilkan oleh strain P. flurescen (Diby, 2005). Metabolit volatil HCN yang dihasilkan rizobakteri Pseudomonas spp. menghambat pertumbuhan P. capsici (Diby, 2004) dan HCN yang dihasilkan strain P. flurescens PG01 menghambat pertumbuhan koloni C. capsici (Sutariati, 2006).
Enzim ekstraseluler telah diketahui sebagai salah satu mekanisme rizobakteri dalam menghambat pertumbuhan patogen (Chernin & Chet, 2002). Hasil penelitian Zang et al (2004) melaporkan bahwa enzim ekstraseluler (protease dan selulase) yang disekresikan rizobakteri mampu mendegradasi dinding sel Sclerotium rolfsii sehingga perkembangan patogen tersebut menjadi terganggu. Egamberdiyeva (2005) juga melaporkan enzim ekstraseluler protease dan selulase yang dihasilkan strain Bacillus spp., dan P. aeruginosa bersifat antagonistik terhadap patogen.
SIMPULAN
Hasil isolasi rizobakteri sebagai kandidat agens biokontrol dari rizosfer tanaman tomat diperoleh 57 isolat rizobakteri. Diantara 57 isolat terdapat 18 isolat yang berpotensi untuk dilakukan evaluasi lebih lanjut. Hasil uji antagonis kemampuan 18 isolat rizobakteri terhadap kemampuan menghambat pertumbuhan koloni patogen cendawan P. capsici terdapat sejumlah dua isolat rizobakteri yang
sangat berpotensi untuk dikembangkan sebagai agens biokontrol untuk mengendalikan patogen terbawa benih, yaitu isolat RBBM36, RBBM18 dan RBBM35. Isolat yang
tidak menunjukkan efek
penghambatan terhadap pertumbuhan koloni patogen cendawan P. capsici secara langsung masih juga memungkinkan untuk dapat dikembangkan sebagai rizobakteri pemacu pertumbuhan tanaman (Plant Growth Promoting Rhizobakteri).
UCAPAN TERIMA KASIH
Artikel ini merupakan sebagian dari hasil penelitian Hibah Bersaing 2011 yang didanai Direktorat Jenderal Pendidikan Tinggi, Kementrian Pendidikan Nasional, Sesuai dengan Surat Perjanjian Pelaksanaan Penugasan Penelitian Hibah Bersaing Nomor: 009/SP2H/PL/Dit.Litabmas /IV/2011 tanggal 14 April 2011. Penulis mengucapkan terima kasih kepada Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional. Ucapan yang sama juga penulis sampaikan kepada Ketua Laboratorium Hama Penyakit BALITTRO beserta seluruh stafnya yang telah membantu terlaksananya penelitian ini.
DAFTAR PUSTAKA
Awais, M., Al. Shah, A. Hameed, and F. Hasan. 2007. Isolation, identification and optimization of bacitracin produced by Bacillus sp. Pak.J. Bot. 39(4):1303-1312. Baharum, S.N., A.B. Salleh, C.N.A.
Razak, M. Basri, M.B.A Rahman, and R.N.Z.R.A. Rahman. 2003. Organic solvent tolerant lipase by Pseudomonas sp.strain S5: stability of enzym in organic solvent and physical factors
71 affecting its production. Ann
Microbiol.53:75-83.
Beatty, P.H., and E.J. Susan. 2002. Paenibacillus polymixa produce fusaricidin-type antifungal antibiotics active against Leptosphaeria maculans, the causative agents of blackleg disease of canola. Can Microbiol 48:159-169.
Bernald, G., A. Illanes, L. Ciampil. 2002. Isolation and partial purification of metabolite from a mutant strain of Bacillus sp. with antibiotic activity against plant pathogenic agents. Elect J Biotech 5:12-20.
Bullied, W.J., T.J. Buss, and J.K. Vessey. 2002. Bacillus cereus UW85 inoculation effects on growth, nodulation and N accumulation in grain legumes: Field studies. Can. J. Plant Sci., 82:291-298.
Chernin, L., and L. Chet. 2002. Microbial enzymes in biocontrol of plant pathogens and pests, p. 171-225. In R. G. Burns and R. P. Dick (ed.), Enzymes in the environment: activity, ecology, and applications. Marcel Dekker, New York, N. Y.
De Silva, A., K. Patterson, C. Rothrock, and J. Moore. (2000). Growth promotion of highbush blueberry by fungal and bacterial inoculants.Hort. Sci., 35:1228-1230.
Diby, P. 2004. Phisiological, biochemical and moleculer studies on the root rot (caused by Phytophthora capsici) suppression in black pepper (Piper nigrum L.) by rhizosphere bacteria. [Disertasi]. University Calicut. India.
Diby, P., K.A. Saju, P.J. Jisha, Y.R. Sarma, A. Kumar, and M. Anandaraj. 2005. Mycolitic enzymes produced by
Pseudomo-nas flurescens and Trichoderma spp. agaist Phytophthora capsici, the foot rot pathogen of black pepper (Piper nigrum L.). Divicion of Crop Protection, Indian Institute of Spices Research, Marikkunnu P.O., Calicut, Kerala-673012, India. Dwivedi, D., and B.N. Johri. 2003.
Antifungals from fluorescens pseudomonas: biosyntesis and regulation. Curr Sci 85:1693-1703.
Egamberdiyeva, D. 2005. Biological control of phytopathogenic fungi with antagonistic bateria. Biocontrol of bacterial plant disease, 1st Simposium 2005. Centre of Agroecology, Taskent State University of Agriculture, University str.1, 700140 Tashkent, Uzbekistan.
Erwin, DC., and O.K. Ribeiro. 1996. Phytophthora: Diseses Worldwide. APS Press, St. Paul, Minnesota.
Gohel, V., C. Megha, P. Vyas, and H.S. Chhaptar. 2004. Strain improvment of chitinolityc enzyme producing isolat Pantoea dispersa for inhancing its biocontrol potential against fungal plant pathogens. Ann Microbiol. 54 (3(:770-725.
Hornby, D. 1993. Biological Control of Soil-borne Plant Pathogens. Wallingford, UK: CAB International.
Huang, CJ., C.Y Chen. 2004. Gene cloning and biochemical characterization of chitinase CH from Bacillus cereus 28-9. Ann Microbiol. 54(3(:289-297.
Kennedy, I.R., A.T.M.A. Choudhury, and M.L. Kecskes. 2004. Non-symbiotic bacterial diazotrophs in crop-farming systems: can their potential for plant growth promo-tion be better exploited. Soil Biol. Biochem. 36(8):1229-1244.
72
Kim, D.S., R.J. Cook, and D.M. Weller. 1997. Bacillus sp. L324-92 for biological control of three root diseases of wheat grown with reduced tillage. Phytopathol., 87:551-558.
Louws, F.J., G.j. Holmes, and J.B. Ristaino. 2002. Phytophthora blight of pepper and cucurbits. Vegetable Disease Information Note 27. College of Agriculture and Life Science, Plant Pathology Extension, North Carolina State University: p:1-4.
Lucy M, Reed E, Click BR. 2004. Application of free living plant growth-promoting rhizobacteria. Antonie van Leeuwenhoek 86:1-25.
Lugtenberg, B.J., T.F. Chin-A-Woeng, and G.V. Bloemberg. 2002. Microbe-plant interactions: principles and mechanisms. Antonie van Leeuwenhoek, 81: 373-383.
Milner, J.L., L. Silo-Sub, J.C. Lee, H. He, J. Clardy, and J.
Handelsman. 1996. Production of kanosamine by Bacillus cereus UW85. Appl Environ. Microbiol. 62:3061-3065.
Roberts, P.D., R.J. McGovern, T.A. Kucharek, and D.J. Mitchell. 2000. Vegetable diseases caused by Phytophthora capsici in Florida. Plant Pathology Department, University of Florida, Gainesville.
http//plantpath.ifas.ufl.edu-/faxcpub/FactSheets/Sp159.pdf. [5 September 2005].
Schaad, N.W., J.B. Jones, and W. Chun. 2001. Laboratory Guide for Identification of Plant Patogenic Bacteria. APS Press, The
American Phytopathological Society, St Paul Minnesota. p.270. Silo-Suh, L., E.V. Stabb, S.J. Raffel, and S.J. Handelsman. 1998. Target range of zwittermicin A, and amino polyol antibiotic from Bacillus cereus. Curr Microbiol 37:6-11.
Silva, H.S.A, R.S.R. Romeiro, D. Macagnan, B.A.H. Veira, M.C.B. Pereira, and A. Mounteer. 2004. Rhizobacterial induction of systemic resistance in tomato plant: non-spesific protection and increase in enzym activities. Biol Control 29:288-295.
Sutariati, G.A.K. 2006. Perlakuan benih dengan agens biokontrol untuk pengendalian penyakit antraknosa dan peningkatan hasil serta mutu benih cabai. [Disertasi]. Sekolah Pascasarjana, Institut Pertanian Bogor, Bogor. p.163
Syamsuddin, S. Ilyas, Alfizar, B. Amin. 2007. Pengembangan Biological Seed Treatment untuk Pengendalian Busuk Phytophthora pada Cabai Merah (Capsicum annuum L.). Hibah Bersaing XIV Perguruan Tinggi.
Syamsuddin. 2009. Perlakuan Benih
Secara Hayati untuk
Pengendalian Busuk Phytophthora (Phytophthora capsici Leonian) dan Peningkatan Hasil serta Mutu Benih Cabai Merah (Capsicum annuum L.). Penelitian Disertasi Program Doktor di IPB, Bogor. Yamaguchi, I. 1996. Pesticides of
microbial origin and applications of moleculer biology. Crop protection agensts from nature : natural products and analogues. The Royal Society Chemestry, London, United Kingdom : 27-49.