LAPORAN PRAKTIKUM KIMIA DASAR I PERCOBAAN III
KESETIMBANGAN HASIL KALI KELARUTAN
NAMA : SITI ROHANI NIM : J1D110026 KELOMPOK : 3
ASISTEN : RANDY SAPUTRA
PROGRAM STUDI FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMBUNG MANGKURAT
BANJARBARU 2010
PERCOBAAN III
SIFAT KOLIGATIF LARUTAN
I. TUJUAN PERCOBAAN
Melalui percobaan ini diharapkan mahasiswa dapat memahami pengaruh keberadaan suatu zat terlarut dalam sifat fisis larutan, dan menggunakan penurunan titik didih suatu larutan untuk menentukan massa molekul relatif dari zat terlarut.
II. TINJAUAN PUSTAKA
Kata koligatif berasal dari bahasa latin (colligare) yang berarti berkumpul bersama. Sifat koligatif adalah sifat yang disebabkan hanya oleh kebersamaan (jumlah partikel) - 7,6.10-5 dan bukan oleh ukurannya. Zat terlarut mempengaruhi sifat larutan,
dan besarnya pengaruh itu bergantung pada jumlah partikel tersebut (Syukri,1999). Pada penurunan titik beku, air murni membeku pada temperatur 0 oC air belum
membeku. Pada temperatur itu tekanan uap jenuh larutan lebih dari 1 atm. Agar larutan membeku temperatur larutan harus diturunkan sampai tekanan uap jenuh larutan menjadi 1 atm. dengan titik beku larutan disebut penurunan titik beku (Syukri.
1999).
Selisih antara titik beku dengan titik beku larutan disebut penurunan titik beku.
...(1)
Apabila suatu senyawa nonelekrolit terlarut di dalam pelarut. Sifat-sifat pelarut murni berubah dengan adanya zat terlarut. Sufat-sifat fisika seperti titik didih, titik beku, tekanan uap berbeda dengan pelarut murni. Adanya perubahan ini tergantung pada jumlah partikel-partikel pelarut yang terdapat di dalam larutan. Makin berat larutan, makin rendah titik beku, makin tinggi titik didih. Perubahan hampir sebanding dengan perubahan konsentrasi. Karena fraksi molar zat pelarut x merupakan fungsi linier fraksi zat terlarut X1 maka X + X1 = 1, sehingga ΔTf dapat dinyatakan sebagai
fungsi X1, yaitu :
………(2)
dimana : ΔTf = panas pencairan pelarut (Brady. 1999)
Apabila melarutkan 1 mol zat terlarut ke dalam 1000 gr air, titik beku turun sebesar 1,86 oC. Apabila 2 mol zat terlarut di dalam 100 gram air. Titik beku air turun
2 x 1,86 oC. penurunan titik ini tidak bergantung pada jumlah partikel zat terlarut di
dalam larutan. Tiap pelarut mempunyai tetapan penurunan titik beku molal (Kf) yang tertentu :
……….(3)
Untuk m mol zat terlarut ditambhakan ke dalam 1000 gram zat terlarut, maka larutan mempunyai fraksi molar zat terlarut sebsar :
……….(4)
dimana
M = BM Zat terlarut
Untuk larutan yang sangat encer m ≈ 0, maka :
…………..(5)
Sehingga penurunan titik beku larutan R (To)2 . X1 RTf = ΔTf Mo R To2 Kf = 1000 ΔTf m X1 = 1000/(M + m) Mm X1 = 1000 R (To)2 Mm ΔTf = ΔHf 1000
…..……(6)
Apabila didistribusikan nilai :
…………(7)
Ke dalam persamaan di atas maka didapatkan :
… …………(8)
………(9)
………(10)
…………..(11)
dimana : W1 = berat zat terlarut
M1 = BM zat terlarut
W2 = berat pelarut
M2 = MB Pelarut
Untuk larutan encer, maka W1/M1 <<< W/M dapat dijabarkan terhadap W/M,
sehingga : ………(12) Mo R To Kf = 1000 ΔHf ΔTf = Kf . m Mm X1 = 1000 1000 X1 m = M W1 / M1 X1 = W1 / M1+ W/m W1 . M X1 = W . M1
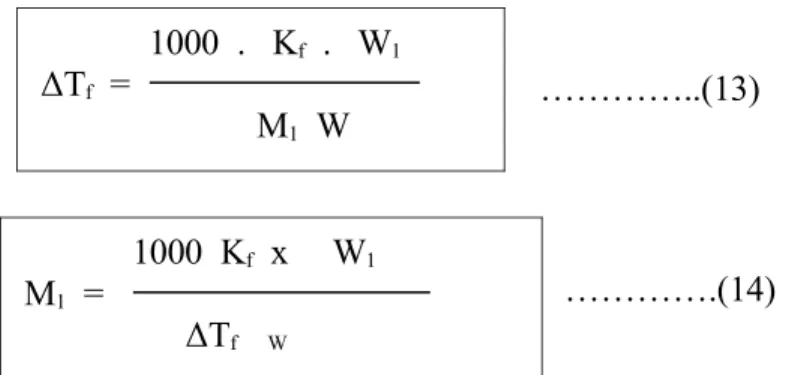
…………..(13)
………….(14)
(Brady. 1999)
Tabel tetapan titik beku molal (Kf)
Pelarut Titik beku (oC) K f (oC) Air Benzena Fenol Naftalena Asam asetat Kamfer Nitrobenzena 0 5,4 39 80 16,5 180 5,6 1,86 5,1 7,3 7 3,82 40 6,9 (Oxtoby. 2001)
Penurunan titik beku, ΔTf . bila kebanyakan larutan encer didinginkan, pelarut
murni terkristalisasi lebih dahulu sebelum ada zat terlarut yang mengkristalisasi suhu dimana kristal-kristal pertama dalam keseimbangan dengan larutan disebut titik bekularutan. Titik beku larutan demikian selalu lebih rendah dari titik beku berbanding lurus dengan banyaknya molekul zat terlarut (atau molnya) di dalam massa tertentu pelarut, jadi penurunan titik beku ΔTf = (titik beku pelarut – titik beku larutan) = Kf .
m dimana m ialah molaritas larutan. Jika persamaan ini berlaku sampai konsentrasi 1 molal, penurunan titik beku larutan 1 molal setiap non elektrolit yang tersebut di dalam pelarut itu ialah Kf yang karena itu dinamakan tetapan titik beku molal (molal
1000 . Kf . W1 ΔTf = M1 W 1000 Kf x W1 M1 = ΔTf W
Freezmapoint consatant) pelarut itu. Nilai numerik Kf adalah khas pelarut itu
masing-masing (Petrucci 1987).
III. ALAT DAN BAHAN A. Alat-alat
Alat yang digunakan dalam percobaan ini meliputi : tabung reaksi besar ; gelas beker besar ( 500 atau 1000 ml) ; pengaduk gelas ; gelas ukur ; neraca analitik ; termometer.
B. Bahan-bahan
Bahan-bahan yang digunakan dalam percobaan ini meliputi : sikloheksana, larutan contoh ; es batu.
IV. PROSEDUR KERJA
Dalam percobaaan ini larutan contoh menggunakan sikloheksana sebagai pelarutnya. Untuk itu pertama-tama ditetapkan titik beku dari sikloheksana sebagai zat pelarut, kemudian dilakukan pengukuran titik beku larutan contoh.
I. Penentuan Titik Beku Pelarut
a. Keringkan semua peralatan gelas yang akan digunakan menggunakan kain atau kertas tisu.
b. Timbang dan catat berat tabung reaksi dalam keadaan kosong dengan menggunakan neraca analitik.
c. Isi tabung reaksi dengan 20 ml sikloheksana. Timbang kembali berat tabung reaksi yang telah berisi sikloheksana. Tutup tabung reaksi dengan mengunakan sumbat.
d. Isi gelas beker besar dengan es batu, hingga ketinggian es abut kira-kira lebih tinggi dibandingkan tinggi larutan dalam tabung reaksi.
e. Masukkan termometer dan pengaduk gelas ke dalam tabung reaksi berisi sikloheksana. Jika memungkinkan, tutup tabung reaksi dengan sumbat yang memiliki lubang.
f. Masukkan tabung reaksi ke dalam gelas beker. Catat suhu awal larutan sebelum tabung reaksi dimasukkan.
g. Aduk perlahan sikloheksana dalam tabung dengan mengunakan pengaduk gelas.
h. Amati perubahan suhu yang terjadi dan catat suhu setiap 10 detik. i. Lakukan pengamatan selama 8 menit.
II. Penentuan Titik Beku Larutan Contoh
a. Keringkan semua peralatan gelas yang akan digunakan menggunakan kain atau kertas tisu.
b. Timbang dan catat berat tabung reaksi dalam keadaan kosong dengan menggunakan neraca analitik.
c. Isi tabung reaksi dengan 20 ml larutan contoh. Timbang kembali berat tabung reaksi yang telah berisi larutan contoh. Tutup tabung reaksi dengan mengunakan sumbat.
d. Isi gelas beker besar dengan es batu, hingga ketinggian es abut kira-kira lebih tinggi dibandingkan tinggi larutan dalam tabung reaksi.
e. Masukkan termometer dan pengaduk gelas ke dalam tabung reaksi berisi larutan contoh. Jika memungkinkan, tutup tabung reaksi dengan sumbat yang memiliki lubang.
f. Masukkan tabung reaksi ke dalam gelas beker. Catat suhu awal larutan sebelum tabung reaksi dimasukkan.
g. Aduk perlahan larutan contoh dalam tabung dengan mengunakan pengaduk gelas.
h. Amati perubahan suhu yang terjadi dan catat suhu setiap 10 detik. i. Lakukan pengamatan selama 8 menit.
V. HASIL DAN PEMBAHASAN A. Hasil dan Perhitungan
1. Hasil
I. Penentuan Titik Beku Pelarut
Massa tabung reaksi kosong : 55,34 gram Volume pelarut murni : 10 ml Massa tabung reksi + larutan : 62,87 gram Massa pelarut murni : 7,53 gram
t (detik) T(º C) t (detik) T(º C) t (detik) T(º C) t (detik) T(º C)
0 30 130 5 250 4,8 370 3,9 10 11 140 5 260 4,8 380 3,9 20 9 150 5 270 4,8 390 3,9 30 8 160 5 280 4,7 400 3,9 40 7 170 5 290 4,7 410 3,8 50 6 180 5 300 4,6 420 3,8
60 6 190 4,9 310 4,5 430 3,5 70 6 200 4,9 320 4,4 440 3 80 5,9 210 4,9 330 4,2 450 3 90 5,5 220 4,9 340 4,2 460 2,8 100 5,3 230 4,9 350 4 470 2,5 120 5 240 4,8 360 4 480 2,5
II. Penentuan Titik Beku Larutan Contoh Massa tabung reaksi kosong : 55,34 gram Volume pelarut murni : 10 ml Massa tabung reksi + larutan : 63,03 gram Massa pelarut murni : 7,69 gram
t (de-tik) T(º C) t (de-tik) T(º C) t (de-tik) T(º C) t (de-tik) T(º C) 0 27 130 3 250 0,5 370 0 10 26 140 2,5 260 0 380 0 20 23 150 2 270 0 390 0 30 19 160 2 280 0 400 0 40 16 170 1,5 290 0 410 0 50 13 180 1 300 0 420 0 60 11 190 1 310 0 430 0 70 9 200 1 320 0 440 -1 80 7 210 1 330 0 450 -1 90 6 220 1 340 0 460 -1 100 5 230 0,5 350 0 470 -1 120 3,9 240 0,5 360 0 480 -1 2. Perhitungan Berdasarkan grafik Sikloheksana y1 = -0,037x + 11,29 y2 = -0,009x + 7,495 0 = -0,028x + 3,795 0,028x = 3,795
x = 135,535 y = 6,275 tf1 larutan contoh : y3 = -0,101x + 19,87 y4 = -0,004x + 1,502 0 = -0,097x + 18,368 0,097x = 18,368 x = 189,361 y= 0,745 tf2 Jadi, ∆tf = tf1-tf2=6,275-0,745=5,53 0C
Penentuan massa molekul relatif (Mr)
Dik: Massa larutan sikloheksana = (g tabung reaksi + sikloheksana) – (g tabung reaksi kosong)
= 62,87 – 55,34 = 7,53
Massa Larutan contoh = (g tabung reaksi + larutan contoh) – (g tabung reaksi kosong)
= 63,03 – 55,34 g =7,69 g Kf sikloheksana = 20,0 0C/molal Tf sikloheksana = 6,2750C Tf larutan contoh = 0,7450C Δ Tf = 5,53 0C
g solute = g larutan contoh - g sikloheksana = 7,69 g – 7,53 g
= 0,16 g Ditanya : Mr zat terlarut dalam larutan contoh? Jawab :
∆T
f = m x Kf 1000 x Mr gr pelarut solute solute 5,53 = 0,16 ×10007,53×20 solute Mr 5,53x7,53= solute Mr 3200 Mrsolute = 3200/41,64 = 76,84 gram/mol B. PEMBAHASANPenurunan titik beku diukur berdasarkan selisih dari titik beku pelarut dengan titik beku larutan. Untuk menentukan titik beku pelarut dalam percobaan ini, pertama-tama menimbang tabung reaksi kosong selanjutnya menimbang tabung reaksi yang telah dimasukkan 10 ml pelarut. Pelarut yang digunakan pada percobaan ini adalah sikloheksana. Setelah itu pelarut dimasukkan ke dalam gelas beker yang telah diisi dengan es batu. Sambil mengaduk perlahan-lahan mencatat perubahan suhu setiap 10 detik selama 8 menit dari pelarut. Dari hasil pengamatan yang telah dilakukan, terdapat 23 perubahan suhu selama 8 menit. Perubahan suhu tersebut digunakan sebagai data untuk membuat kurva antara waktu dan suhu.
Untuk menentukan bobot molekul senyawa pada percobaan ini penurunan titik beku larutan diperlukan dalam perhitungan. Penurunan titik beku larutan diperoleh dari perbedaan titik beku pelarut dan titik beku larutannya. Penurunan titik beku dari suatu larutan (∆Tf) berbanding lurus dengan konsentrasi molal dari larutan (m), hal ini berarti ∆Tf berbanding terbalik dengan BM. Semakin besar nilai dari ∆Tf maka semakin kecil nilai BM. Penurunan titik beku analog dengan peningkatan tiitik didih. Pelarut dalam larutan berada dalam kesetimbangan dengan tekanan tertentu dari uap pelarut. Jika zat terlarut ditambahkan ke dalam larutan, tekanan uap pelarut akan turun dan titik beku juga akan turun.Penurunan titik beku berbanding lurus dengan perubahan tekanan uap. Untuk konsentrasi zat terlarut yang cukup rendah, penurunan titik beku
berkaitan dengan molalitas. Pengukurannya dapat digunakan untuk menentukan massa molar zat yang tidak diketahui.
Besarnya massa molekul yamg didapatkan dari hasil percobaan berbeda dengan massa molekul relatif larutan contoh berdasarkan dari buku referensi yaitu 120 gram/mol, hal ini karenakan es yang digunakan dalam percobaan untuk mendinginkan larutan sudah mencair. Sehingga titik beku yang didapatkan tidak sesuai dengan literatur. Hal ini juga disebabkan oleh ketidakcermatan praktikan dalam melakukan percobaan, terutama dalam proses pengadukkan dan pembacaan
skala temperatur pada termometer yang digunakan dalam percobaan. VI. KESIMPULAN
Kesimpulan yang dapat diambil dari percobaan ini adalah :
1. Sifat koligatif larutan dapat digunakan untuk menentukan massa
molekul relatif dari zat terlarut dengan menggunakan metode penurunan titik beku larutan.
2. Sifat koligatif larutan dipengaruhi oleh jumlah zat terlarut dan jumlah zat pelarutnya.
3. Seiring pertambahan waktu, suhu akan mengalami penurunan dari suhu awal dan jika mencapai penurunan maksimum akan mengalami
pembekuan
4. Mr sikloheksana berdasarkan percobaan sebesar 76,84 gr/mol, Tf
berdasarkan grafik sebesar 5,3°C, dan massa sikloheksana sebesar 7,53 gr.
DAFTAR PUSTAKA
Brady, E. James. 1999. Kimia Universitas Asas dan Struktur. Binarupa Aksara : Jakarta.
Petrucci, Ralph H. 1987. Kimia Dasar Prinsip dan Terapan Modern, jilid 2. Penerbit Erlangga: Jakarta.
S, Syukri. 1999. Kimia Dasar 2. ITB : Bandung.
LAMPIRAN
GRAFIK LAPORAN KIMIA DASAR I KELOMPOK 3