SMA MAARIF NU PANDAAN
TERAKREDITASI 2009
“SIFAT KOLIGATIF LARUTAN”
“SIFAT KOLIGATIF LARUTAN”
MOH. SUWANDI, S.Pt.,M.Pd
SIFAT KOLIGATIF LARUTAN
Merupakan sifat fisis larutan yg tergantung dari banyaknya zat terlarut yg ada dlm larutan, tetapi tdk tergantung pd jenis zat yg dilarutkan
Jadi Sifat Koligatif Larutan dipengaruhi oleh konsentrasi partikelnya
Konsentrasi Larutan
Konsentrasi Molar (M) =
mL x 1000 Mr
gr
larutan liter
ut zat terlar mol
Konsentrasi Molal (M) =
(gr) pelarut massa
x 1000 Mr
gr
pelarut kg
1
ut zat terlar mol
Fraksi mol ( XA ) = nA --- nA + nB
Persentase Berat (%) = 100%
larutan gram
ut zat terlar
gram X
SOAL
1. Hitunglah molalitas larutan yang dibuat dengan melarutkan C2H5OH 24,9 gr dalam air 125 mL
4,33 :
125 x 1000 46
: 24,9
p x 1000 Mr
: gr
molalitas
2. Hitunglah massa HClO4 yang diperlukan untuk membuat suatu larutan 2,52 m dalam air 652 gr
164,3 :
1000
652 x
100,5 x
: 2,52 gr
652 x 1000 100,5
: gr 52
, 2
p x 1000 Mr
: gr
m
3. Suatu larutan mengandung 18,0 gr glukosa ( Mr = 180 ), 24 gr
asam asetat ( Mr = 60 ), dan 81 gr air. Berapakah fraksi mol asam asetat dalam larutan
0,1 180 :
: 18 n
glukosa0,4 60 :
: 24 n
asamasetat4,5 18 :
: 81
n
airBerdasarkan Penelitian Francois Marie Raoult ada 4 sifat koligatif larutan, yaitu :
1. Penurunan Tekanan Uap ( P )
Tekanan uap adalah tekanan yg ditimbulkan pada saat molekul – molekul suatu cairan akan berubah menjadi molekul – molekul uapnya.
P = X
Bx P
0Keterangan :
X
B= fraksi mol terlarut P = penurunan tek. Uap P
0= tek. Uap pelarut murni SIFAT KOLIGATIF
SIFAT KOLIGATIF
LARUTAN NONELEKTROLIT
LARUTAN NONELEKTROLIT
2. Kenaikan Titik Didih ( Tb ) Ingat ketentuan berikut :
a. Suatu pelarut jk di + zat terlarut titik didih akan naik b. Besarnya kenaikan titik didih ~ konsentrasi molal ( m ) c. Tb = titik didih larutan – titik didih pelarut murni
d. Kb = tetapan kenaikan titik didih
T
b= m x K
bb
b
X K
p X 1000 Mr
: gr ΔT
Dengan :
Mr = Mr zat terlarut gr = massa zat terlarut P = massa zat pelarut
3. Penurunan Titik Beku ( Tf ) Ingat ketentuan berikut :
a. Suatu pelarut jk di + zat terlarut titik bekunya akan turun
b. Besarnya penurunan titik beku ~ konsentrasi molal ( m ) c. Tf = titik beku pelarut murni – titik beku larutan
d. K
T
f f= m x K
= tetapan penurunan titik beku ff
f
X K
p X 1000 Mr
: gr ΔT
Dengan :
Mr = Mr zat terlarut gr = massa zat terlarut P = massa zat pelarut
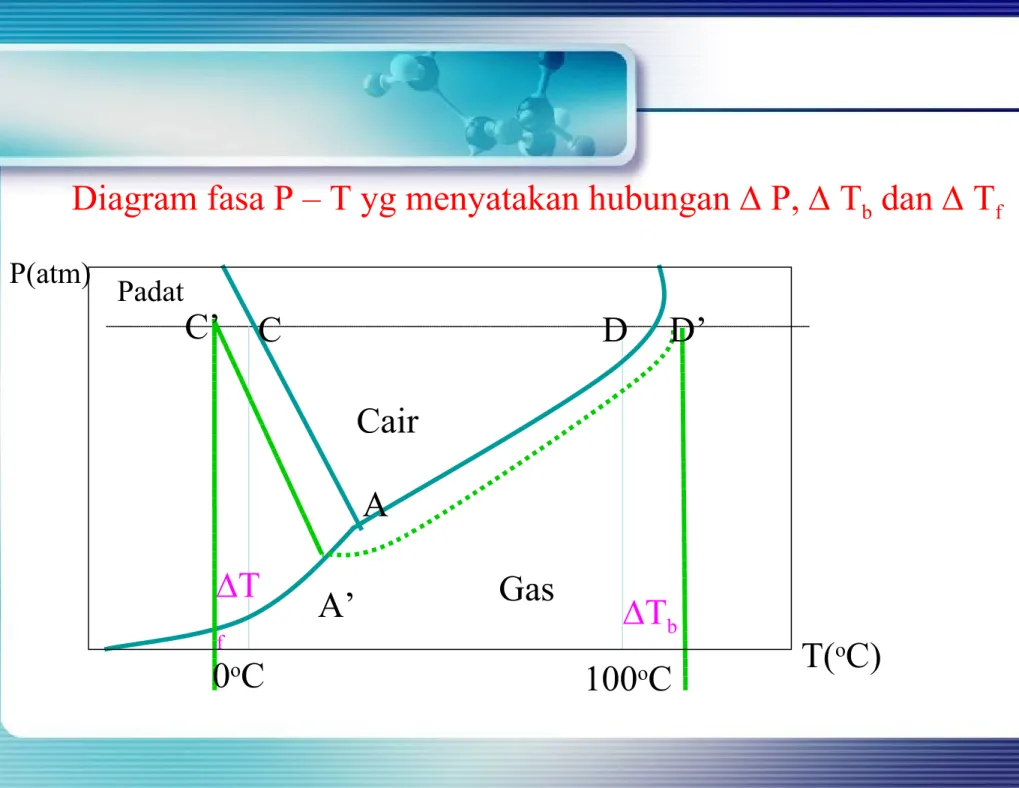
Diagram fasa P – T yg menyatakan hubungan P, Tb dan Tf
Padat
Cair
Gas
C’ C D D’
A’
A
T
f Tb
P(atm)
0oC 100oC T(oC)
4. Tekanan Osmotik ( )
Osmosis adalah proses berpindahnya pelarut dari larutan yg lebih encer ke larutan pekat melalui membran semipermeabel ( hanya dpt dilalui oleh pelarut.
Tekanan osmotik adalah tekanan yg diperlukan utk menghentikan aliran dari pelarut murni ke dlm larutan
Alat yg digunakan utk mengukur besarnya tekanan osmotik adalah osmometer Menurut Van’t Hoff besarnya tekanan osmotik utk larutan encer sebanding dgn konsentrasi molar larutan tsb.
= MRT R um
us x RT
V x 1 Mr : gr π
= tek. Osmotik (atm)
R = tetapan gas ideal ( 0,082)
T = suhu dlm Kelvin ( oC + 273 )
Contoh tekanan osmotik dlm kehidupan sehari – hari
1. Mengalirnya air dan larutan lain dari dlm tanah ke pucuk pepohonan yg tinggi, hal itu disebabkan dlm sel tumbuh – tumbuhan terjadi tekanan osmotik sebesar 40 - 50 atm
2. Larutan infus yg dimasukkan ke dlm tubuh melalui pembuluh darah hrs bersifat isotonis ( tek. Osmotik sama ) dgn sel
darah. Apabila larutan infus bersifat hipertonis ( tek. Osmotik tinggi ) dpt mengakibatkan krenasi, yaitu keluarnya air dari sel darah. Jika itu terjadi maka sel akan menjadi rusak /
mengerut. Apabila infus bersifat hipotonis ( tek. Osmotik
rendah ) dpt mengakibatkan hemolisis, yaitu masuknya air ke sel darah shg sel dpt pecah akibat terjadi penggelembungan sel darah
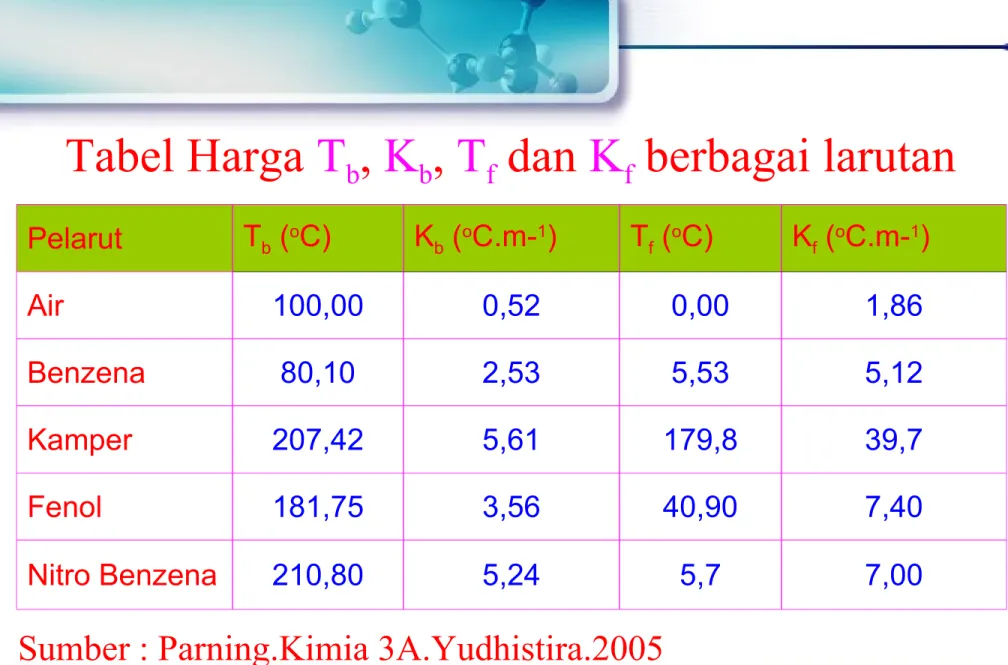
Tabel Harga T
b, K
b, T
fdan K
fberbagai larutan
Pelarut Tb (oC) Kb (oC.m-1) Tf (oC) Kf (oC.m-1)
Air 100,00 0,52 0,00 1,86
Benzena 80,10 2,53 5,53 5,12
Kamper 207,42 5,61 179,8 39,7
Fenol 181,75 3,56 40,90 7,40
Nitro Benzena 210,80 5,24 5,7 7,00
Sumber : Parning.Kimia 3A.Yudhistira.2005
Soal :
1. Sebanyak 12 gr Urea ( Mr = 60 ) dilarutkan dlm 180 gr air pada suhu 25oC. Pd suhu tsb tekanan uap jenuh air adalah 23,76 mmHg. Tentukan perubahan tekanan uap larutan ? Diketahui : - massa urea = 12 gr
- massa air = 180 gr
- ot air = 25oC
- Po = 23,76 mmHg Ditanya : Tekanan uap larutan ?
Jawab :
ΔP = Xair . Po
= 0,98 . 23,76 = 23,294 mmHg
2. Sebanyak 15 gram zat X ( nonelektrolit ) dilarutkan dlm 250 gram air. Larutan ini mendidih pd suhu 100,156oC. Kb air 0,52.
Tentukan massa molekul relatif ( Mr ) senyawa X tsb.
Diketahui : - massa zat X = 15 gr
- massa air = 250 gr - ot lar. mendidih = 100,156oC - Kb air = 0,52 oC/m Ditanya : Mr senyawa X ?
Jawab :
SIFAT KOLIGATIF
LARUTAN ELEKTROLIT
Dari teori ion Svante August Arrhenius dikemukakan bahwa larutan asam, basa ataupun garam termasuk larutan elektrolit.
Larutan elektrolit yaitu larutan yg dapat terionisasi atau terurai menjadi ion – ion.
Dan akibat peruraian itu maka dapat mengakibatkan bertambahnya jumlah partikel
Untuk mengoreksi hukum agar sesuai utk larutan elektrolit, Jacobus
Henricus Van’t Hoff menerangkan bahwa hukum Roult harus dikalikan dengan suatu faktor sebesar ( 1 + ( n – 1 ) ) atau diberi lambang i dan disebut faktor Van’t Hoff
“Attention”
n = jumlah ion
= derajad ionisasi
Jumlah mol zat yg dilarutkan isasi zat terion
mol Jumlah
=
Rumus Sifat Koligatif Larutan Elektrolit : 1. Penurunan Tekanan Uap ( P )
2. Kenaikan Titik Didih ( Tb )
∆P = i . XB . Po
∆P = { 1 + ( n – 1 ) α } . XB . Po
∆Tb = i . m . Kb
∆Tb = { 1 + ( n – 1 ) α } . m . Kb
3. Penurunan Titik Beku ( Tf )
4. Tekanan Osmotik ( )
∆Tf = i . m . Kf
∆Tf = { 1 + ( n – 1 ) α } . m . Kf
= i . M . R . T
= { 1 + ( n – 1 ) α } . M . R . T
Jumlah ion beberapa senyawa Jumlah ion beberapa senyawa
1. CaCl
2Ca
2+2Cl
-n = 3
2. H
2SO
42H
+SO
42-n = 3
3. MgSO
4Mg
2+SO
42-n = 4
4. KCl
K
+Cl
-n = 2
5. Mg(OH)
2Mg
2+2OH
-n = 3
6. FeCl
3Fe
3+3Cl
-n = 4
Faktor Van’t Hoff beberapa larutan Elektrolit
Harga i
Batas teoritis
0,100
molal 0,05
molal 0,01
molal 0,005 molal
NaCl 1,87 1,89 1,93 1,94 2
KCl 1,86 1,88 1,94 1,96 2
MgSO
41,42 1,43 1,62 1,69 2 K
2SO
42,46 2,57 2,77 2,86 3
HCl 1,91 1,92 1,97 1,99 2
H
2SO
42,22 2,32 2,59 2,72 3
SOAL 1
Ibu membuat sayur asem menggunakan garam dapur sebanyak 5,85 gram. Dan menggunakan air sebanyak 4 kg. Jika garam dapur terionisasi sempurna maka : Tentukan : Titik didih larutan
Diketahui : NaCl = 5,85 gr H2O = 4 kg Ditanya : Tb
Jawab :
NaCl = Na+ + Cl- n = 1 + 1
= 2
i = 1 + ( n – 1 ) = 1 + ( 2 – 1 ) 1
= 2
m : 0 , 025
4.000 1.000 58,5 X
: 5,85 m
P 1.000 Mr X
: gr m
C 100,026 :
larutan T
0,026 :
ΔT
0,52 X
0,025 X
2 : ΔT
K . m . i : ΔT
o b
b b
b b
SOAL 2
Rudi melarutkan 17,4 gram K2SO4 ke dalam 250 gram air. Jika Kb air = 0,52oC / molal. Kenaikan titik didih larutan tersebut
adalah ... ( Ar K = 39 ; S = 32 dan O = 16 Diketahui : K2SO4 = 17,4 gr H2O = 250 gr Ditanya : Tb
Jawab :
K2SO4 = 2K+ + SO42- n = 1 + 2
= 3
i = 1 + ( n – 1 ) = 1 + ( 3 – 1 ) 1
= 3
m : 0,4
250 1.000 174 X
: 17,4 m
P 1.000 Mr X
: gr m
C 0,624 :
ΔT
0,52 X
0,4 X
3 : ΔT
K . m . i : ΔT
o b
b
b b