KINERJA IMUNITAS UDANG VANAME Litopenaeus vannamei
DALAM TEKNOLOGI BIOFLOK DAN PROBIOTIK
TERHADAP KOINFEKSI INFECTIOUS MYONECROSIS VIRUS
DAN Vibrio harveyi
TITI NUR CHAYATI
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2012
KINERJA IMUNITAS UDANG VANAME Litopenaeus vannamei
DALAM TEKNOLOGI BIOFLOK DAN PROBIOTIK
TERHADAP KOINFEKSI INFECTIOUS MYONECROSIS VIRUS
DAN Vibrio harveyi
TITI NUR CHAYATI
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi dan Manajemen Perikanan Budidaya
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2012
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
KINERJA IMUNITAS UDANG VANAME Litopenaeus vannamei DALAM TEKNOLOGI BIOFLOK DAN PROBIOTIK TERHADAP KOINFEKSI
INFECTIOUS MYONECROSIS VIRUS DAN Vibrio harveyi
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Desember 2012
TITI NUR CHAYATI C14080025
SKRIPSI
Judul : Kinerja Imunitas Udang Vaname Litopenaeus Vannamei Dalam Teknologi Bioflok dan Probiotik Terhadap Koinfeksi Infectious Myonecrosis Virus dan Vibrio harveyi
Nama : Titi Nur Chayati NIM : C14080025
Menyetujui,
Pembimbing I Pembimbing II
Dr. Widanarni Julie Ekasari, M. Sc
NIP. 19670927 199403 2 001 NIP. 19770725 200501 2 002
Mengetahui,
Ketua Departemen Budidaya Perairan
Dr. Sukenda
NIP. 19671013 199302 1 001
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penelitian dan penulisan skripsi ini dapat diselesaikan dengan baik.Penelitian ini dilaksanakan pada bulan Mei 2012 - Juli 2012 di Laboratorium Kesehatan Ikan. Ungkapan terima kasih yang tulus penulis utarakan kepada:
1. Orang tua tercinta, H. Pudjirin Cholid dan Maryati (Almh), kakak-kakak (Nur Fajrianti dan Nur Zaman) yang selalu memberikan kasih sayang, do’a dan dukungan baik moril maupun materil serta adik-adikku tersayang (Siti Sarah Ameliya dan Muammar Saddam A.) yang senantiasa memberikan semangat 2. Dr. Widanarni selaku dosen pembimbing I dan Julie Ekasari, M.Sc selaku
dosen pembimbing II serta Dr. M. Agus Suprayudi, selaku dosen tamu pada pelaksanaan ujian akhir skripsi atas segala masukan dan dukungannya selama pelaksanaan penelitian dan penyusunan tugas akhir ini
3. Ir. Dadang Shafrudin, selaku dosen Pembimbing Akademik
4. Rahman, M.Si dan para laboran Pak Ranta, Pak Wasjan, Pak Jajang, Kang Abe, Kang Dama, Mba Retno serta para staff pegawai BDP yang telah membantu dalam menunjang penelitian dan penyelesaian tugas akhir ini
5. Teman-teman satu tim bioflok Deasy Angela, Ivan Daniel, Nora Putri dan Dian Utami yang senantiasa memberi semangat dan membantu dalam penyelesaian penelitian dan tugas akhir ini
6. Teman-teman LKI’ers 45: Nurlita, Jeanni, Retno, Wahyu dan Dendi yang telah banyak membantu dan memberi semangat
7. Teman-teman “Rumah Cantik” (Fatima, Sri, Nurlatifa, Kurnia Dwi, Rima dan Aminah), teman-teman “Pondok Sabar“ (Fauzan, Asep, Daus, Aqil dan Taqin), sahabat-sahabat terdekat (Pika, Rosita, Ardina, Ahen, Yadi, Bayu, Sofyan, Adithia, dan Randi) serta teman-teman seperjuangan BDP’45 atas do’a, motivasi dan dukungannya selama ini
Semoga skripsi ini bermanfaat bagi ilmu pengetahuan dan masyarakat.
Bogor, Desember 2012
RIWAYAT HIDUP
Penulis merupakan anak ke-3 dari 5 bersaudara yang dilahirkan di Jakarta, 16 Juli 1990 dari pasangan H. Pudjirin Cholid dan Maryati (Almh). Penulis lulus dari SMA Negeri 60 Jakarta pada tahun 2008. Pada tahun yang sama, penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) pada jurusan Teknologi dan Manajemen Perikanan Budidaya, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis pernah mengikuti praktek kerja lapangan di Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi dan di pembenihan udang vaname PT. Central Pertiwi Bahari (CPB) Rembang, Jawa Tengah. Penulis aktif sebagai pengurus Himpunan Mahasiswa Akuakultur (HIMAKUA) periode 2010/2011 (divisi marketing) dan 2011/2012 (divisi kewirausahaan). Selain itu, penulis juga aktif sebagai asisten praktikum mata kuliah Dasar-dasar Akuakultur tahun ajaran 2010/2011 dan 2011/2012, Dasar-dasar Mikrobiologi tahun ajaran 2010/2011 dan 2011/2012, Mikrobiologi Akuakultur S2 tahun ajaran 2012/2013, Penyakit Organisme Akuatik 2012/2013, Farmakologi dan Penyakit dan Parasit Ikan jenjang D3 tahun ajaran 2012/2013. Penulis pernah mengikuti IPB Goes to Field 2010 bidang perikanan di Desa Dramaga, Bogor. Penulis juga penerima beasiswa PPA tahun 2010-2012, penerima biaya Program Mahasiswa Wirausaha (PMW) IPB 2010, Program Kegiatan Mahasiswa (PKM) bidang penelitian tahun 2010 dan 2012 serta mengikuti PIMNAS (Pekan Ilmiah Mahasiswa Nasional) XXIII di Universitas Saraswati, Bali tahun 2010.
Penulis melakukan penelitian dan menyusun skripsi sebagai salah satu syarat memperoleh gelar sarjana perikanan (S.Pi) dengan judul “Kinerja Imunitas
Udang Vaname Litopenaeus Vannamei Dalam Teknologi Bioflok dan Probiotik Terhadap Koinfeksi Infectious Myonecrosis Virus dan Vibrio harveyi”.
ABSTRAK
TITI NUR CHAYATI. Kinerja Imunitas Udang Vaname Litopenaeus Vannamei
Dalam Teknologi Bioflok dan Probiotik Terhadap Koinfeksi Infectious Myonecrosis Virus dan Vibrio harveyi. Dibimbing oleh WIDANARNI dan JULIE
EKASARI.
Penelitian dilakukan untuk mengkaji kinerja imunitas udang vaname Litopenaeus vannamei dalam teknologi bioflok dengan dan tanpa penambahan probiotik. Perlakuan yang diberikan dalam penelitian ini yaitu penambahan probiotik (Pro), teknologi bioflok (BFT), dan teknologi bioflok dengan penambahan probiotik (Pro+BFT) serta terdapat kontrol (positif dan negatif). Udang vaname ditebar dalam akuarium ukuran 60 cm x 30 cm x 30 cm dengan bobot rata-rata 0,48 ± 0,03 g pada kepadatan 25 ekor/akuarium. Perlakuan diberikan selama 42 hari dan kemudian dilakukan uji tantang koinfeksi IMNV (infectious myonecrosis virus) dan bakteri Vibrio harveyi yang diamati selama 10 hari. Probiotik yang digunakan adalah Vibrio SKT-b.Hasil penelitian menunjukkan adanya peningkatan nilai total haemocyte count (THC), phenoloxydase (PO) dan respiratory burst (RB) pada perlakuan Pro+BFT yang mengindikasikan meningkatnya sistem imun udang dan terlihat dari nilai sintasan perlakuan Pro+BFT setelah uji tantang sebesar 75 % yang lebih tinggi dibandingkan dengan kontrol positif dan perlakuan lain.
Kata kunci: Litopenaeus vannamei, parameter imun udang, teknologi bioflok, probiotik, koinfeksi
ABSTRACT
TITI NUR CHAYATI. Immune Response of Pacific White Shrimp Litopenaeus
vannamei in Biofloc Technology and Probiotic Application to Infectious Myonecrosis Virus and Vibrio harveyi Coinfection. Conducted by WIDANARNI and JULIE EKASARI.
This study aims to evaluate immune performance of Pacific white shrimp Litopenaeus vannamei in BFT system, with probiotic addition. There were 3 treatments in this study, which are probiotic addition (Pro), biofloc system (BFT), and biofloc system with probiotic addition (Pro+BFT), and also controls (positive and negative). Pacific white shrimp with an average body weight of 0.48 ± 0.03 g was stocked at a density of 25 shrimps/tank and cultured for 42 days. Challenge test with coinfection of Infectious Myonecrosis Virus and pathogenic Vibrio harveyi, were given after the culture periode, shrimp mortality was observed for 10 days. The results showed increasing of total haemocyte count (THC), phenoloxydase (PO) dan respiratory burst (RB) on Pro+BFT, which indicate the increase of immune system of the shrimp. The survival after challenge test on Pro+BFT treatment was 75%, which is significantly higher than positive control and other treatments.
Keywords: Litopenaeus vannamei, shrimp immune response, biofloc technology, probiotic, co-infection
viii
DAFTAR ISI
Halaman DAFTAR TABEL ... ix DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi I. PENDAHULUAN... 1II. BAHAN DAN METODE ... 4
2.1 Perlakuan Penelitian ... 4
2.2 Persiapan Wadah dan Hewan Uji ... 4
2.3 Persiapan Bakteri Probiotik ... 5
2.3.1 Pembuatan Mutan Bakteri Probiotik Vibrio SKT-b (RfR) ... 5
2.3.2 Kultur Bakteri SKT-bR... 5
2.4 Pemeliharaan Udang Uji... 5
2.5 Prosedur Penambahan Karbon ... 6
2.6 Prosedur Uji Tantang ... 6
2.7 Parameter Pengamatan ... 7
2.7.1 Parameter Imun ... 7
2.7.5 Sintasan ... 8
2.7.6 Perhitungan Bakteri dalam Usus ... 8
2.7.7 Perhitungan Populasi Bakteri Vibrio SKT-bR Media Pemeliharaan 9
2.7.8 Kualitas Air ... 9
2.8 Analisis Data ... 9
III.HASIL DAN PEMBAHASAN ... 10
3.1 Hasil ... 10
3.1.1 Total Haemocyte Count (THC) ... 10
3.1.2 Aktivitas Phenoloxydase (PO) ... 11
3.1.3 Aktivitas Respiratory Burst (RB) ... 11
3.1.4 Sintasan ... 12
3.1.5 Total Bakteri dalam Usus ... 13
3.1.6 Total Bakteri Vibrio SKT-bR Media Pemeliharaan ... 14
3.1.7 Kualitas Air Media Pemeliharaan selama Perlakuan ... 15
3.2 Pembahasan ... 17
IV.KESIMPULAN ... 22
DAFTAR PUSTAKA ... 23
ix
DAFTAR TABEL
Halaman
1. Perlakuan penelitian kinerja imunitas udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik terhadap koinfeksi IMNV (infectious myonecrosis virus) dan Vibrio harveyi ... 4
2. Kisaran parameter suhu, pH, salinitas, DO (dissolved oxygen), TSS (total suspended solid) dan VSS (volatile suspended solid) media pemeliharaan udang vaname Litopenaeus vannamei dalam teknologi bioflok dengan dan tanpa penambahan probiotik ... 15
x
DAFTAR GAMBAR
Halaman
1. Total haemocyte count (THC) udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik sebelum dan setelah uji tantang selama 10 hari dengan koinfeksi virus IMNV dan bakteri Vibrio harveyi. Huruf yang berbeda pada masing-masing diagram batang menunjukkan perbedaan nyata (P<0,05) ... 10
2. Aktivitas Phenoloxydase (PO) udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik sebelum dan setelah uji tantang koinfeksi dengan virus IMNV dan bakteri Vibrio harveyi. Huruf yang berbeda pada masing-masing diagram batang menunjukkan perbedaan nyata (P<0,05) ... 11
3. Respiratory burst (RB) udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik sebelum dan setelah uji tantang koinfeksi dengan virus IMNV dan bakteri Vibrio harveyi. Huruf yang berbeda pada masing-masing diagram batang menunjukkan perbedaan nyata (P<0,05) .. 12
4. Sintasan udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik setelah uji tantang dengan koinfeksi virus IMNV dan bakteri Vibrio harveyi. Huruf yang berbeda pada masing-masing diagram batang menunjukkan perbedaan nyata (P<0,05) ... 13
5. Total bacteria count (TBC) usus udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik ... 13
6. Total Bakteri Vibrio SKT-bR pada media pemeliharaan udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik pada saat sebelum dan sesudah pemberian probiotik ... 14
7. Nilai TAN (total ammonia nitrogen) media pemeliharaan udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik ... 15 8. Nilai nitrit (NO2-) media pemeliharaan udang vaname Litopenaeus
vannamei dalam teknologi bioflok dan probiotik ... 16 9. Nilai nitrat (NO3-) media pemeliharaan udang vaname Litopenaeus
vannamei dalam teknologi bioflok dengan dan tanpa penambahan probiotik ... 16
xi
DAFTAR LAMPIRAN
Halaman 1. Perhitungan penambahan karbon dalam pemeliharaan udang vaname L.
vannamei dalam teknologi bioflok dan probiotik ... 28 2. Analisis statistik terhadap nilai THC udang vaname L. vannamei setelah
perlakuan (sebelum uji tantang) dengan teknologi bioflok dan probiotik ... 29
3. Analisis statistik terhadap nilai THC udang vaname L. vannamei setelah uji tantang dengan teknologi bioflok dan probiotik ... 29
4. Analisis statistik terhadap aktivitas phenoloxydase (PO) udang vaname L. vannamei setelah perlakuan (sebelum uji tantang) dengan teknologi bioflok dan probiotik ... 30
5. Analisis statistik terhadap nilai PO udang vaname L. vannamei setelah uji tantang dengan teknologi bioflok dan probiotik ... 30
6. Analisis statistik terhadap nilai respiratory burst (RB) udang vaname L. vannamei setelah perlakuan (sebelum uji tantang) dengan teknologi bioflok dan probiotik ... 31
7. Analisis statistik terhadap nilai RB udang vaname L. vannamei setelah uji tantang dengan teknologi bioflok dan probiotik ... 31
8. Analisis statistik terhadap nilai sintasan udang vaname L. vannamei setelah uji tantang dengan teknologi bioflok dan probiotik ... 32
1
I. PENDAHULUAN
Saat ini udang budidaya adalah komoditi yang dikembangkan dalam bidang akukultur serta menjadi kekuatan utama dalam peningkatan perdagangan produk perikanan secara internasional. Pasar utama udang adalah Jepang, Amerika Serikat dan Uni Eropa (UE), dan eksportir terbesar dari udang tambak adalah Thailand, Ekuador, Indonesia, India, Meksiko, Bangladesh, dan Vietnam. Permintaan udang diperkirakan akan meningkat di tahun mendatang (FAO-Fisheries and Aquaculture Department 2012).
Pengembangan budidaya udang semakin membutuhkan strategi untuk meningkatkan sistem produksi, meningkatkan biosecurity dan mengurangi dampak tehadap lingkungan (Avella et al. 2010). Organisme akuatik umumnya membutuhkan protein yang cukup tinggi dalam pakannya. Namun demikian organisme akuatik hanya dapat meretensi protein sekitar 20 - 25% dan selebihnya akan terakumulasi dalam air (Avnimelech 1999). Metabolisme protein oleh organisme akuatik umumnya menghasilkan amoniak sebagai hasil ekskresi. Pada saat yang sama protein dalam feses dan pakan yang tidak termakan akan diuraikan oleh bakteri menjadi produk yang sama. Dengan demikian semakin intensif suatu kegiatan budidaya akan diikuti dengan semakin tingginya konsentrasi senyawa nitrogen terutama amoniak dalam air (Avnimelech 2007).
Akumulasi bahan organik baik yang berasal dari limbah metabolisme, sisa-sisa pakan, dan bahan organik lainnya dapat menyebabkan kualitas air menurun. Akumulasi bahan organik ini dapat berakibat pada timbulnya akumulasi senyawa-senyawa, seperti amoniak, nitrit, nitrat, dan H2S yang pada kisaran tertentu dapat bersifat toksik bagi udang. Penurunan kualitas air juga dapat menjadi stressor bagi munculnya berbagai jenis penyakit pada udang, yang pada akhirnya dapat mengakibatkan kematian massal dan penurunan produksi udang (Yuniasari 2009).
Teknologi bioflok diterapkan sebagai cara untuk meningkatkan biosecurity dan mengurangi dampak terhadap lingkungan (Ballester et al. 2010). Menurut De Schryver et al. (2008) penghilangan nitrogen dari air budidaya dalam teknologi bioflok (BFT) diatur dengan cara penambahan karbon yang seimbang. Molase merupakan salah satu sumber karbon yang dapat digunakan dalam teknologi
2 bioflok. Molase telah banyak digunakan sebagai sumber karbon dalam akuakultur (Crab et al. 2012).
Teknologi bioflok (BFT) telah diaplikasikan dalam kegiatan budidaya udang (Hari et al. 2004). Pergantian air yang terbatas memungkinkan pembudidaya untuk mengurangi, atau bahkan menghilangkan, ancaman infeksi mikroba air tersebut masuk ke dalam media budidaya, mengurangi jumlah nutrisi yang dilepaskan ke lingkungan, untuk mengurangi atau menghilangkan transfer patogen dari wadah budidaya terhadap lingkungan dan tetap menjaga kualitas air yang baik dalam budidaya (Horowitz dan Horowitz 2002).
Pembentukan bioflok oleh bakteri terutama bakteri heterotrof secara umum bertujuan untuk meningkatkan pemanfaatan nutrien, menghindari stress lingkungan dan predasi (De Schryver et al. 2008). Flok bakteri tersusun atas campuran berbagai jenis mikroorganisme (bakteri pembentuk flok, bakteri filamen, fungi), partikel-partikel tersuspensi, berbagai koloid dan polimer organik, berbagai kation dan sel-sel mati (De Schryver et al. 2008).
Penelitian oleh De Schryver dan Verstraete (2009) menunjukkan bahwa bioflok mengandung poly-β-hydroxybutyrate (PHB) berkisar antara 0,9-16 % yang cukup memadai untuk memenuhi kebutuhan ikan akan PHB yang tidak lebih dari 1 %. Poly-β-hydroxybutyrate (PHB) merupakan produk polimer intraselular yang dihasilkan oleh berbagai jenis mikroorganisme sebagai bentuk simpanan energi dan karbon (Defoirdt et al. 2007). Polimer ini diduga mempunyai efek pencegahan dan pengobatan terhadap infeksi Vibrio serta manfaat prebiotik dalam akuakultur (Defoirdt et al. 2007; De Schryver et al. 2008).
Adanya serangan penyakit bakterial maupun viral merupakan permasalahan yang sering dihadapi dalam kegiatan budidaya udang. Penyakit virus IMN (infectious myonecrosis) adalah penyakit terkini yang menyerang udang vaname (Walker dan Winton 2010). Penyakit IMN ditemukan di Brazil tahun 2002 dan menyebabkan dampak kerugian ekonomi yang signifikan (Costa et al. 2009). Wabah IMNV menyebar ke Indonesia dengan gejala klinis mirip dengan wabah di Brazil pada tahun 2006 (Senapin et al. 2007). Vibriosis adalah penyakit bakterial pada udang penaeid, dan Vibrio spp. merupakan agen penyakit ini. Vibriosis juga
3 terlibat sebagai penyebab kematian tinggi dalam udang penaeid juvenil seluruh dunia (Castex et al. 2010).
Banyak kasus patogen tidak hanya menyerang udang sebagai infeksi tunggal. Adanya kejadian koinfeksi yang sudah dilaporkan antara lainkoinfeksi virus dan bakteri pada udang vaname seperti WSSV-Vibrio campbelli serta WSSV - Vibrio harveyi (Phuoc et al. 2009). Koinfeksi antar patogen dapat terjadi karena patogen-patogen tersebut merupakan agen penyebab penyakit dengan inang yang sama yaitu udang penaeid. Hasan (2011) juga melaporkan bahwa koinfeksi antara virus myo (IMNV) dan bakteri Vibrio harveyi menyebabkan mortalitas yang lebih tinggi dibandingkan dengan infeksi tunggal.
Probiotik merupakan mikroba hidup yang mampu memberikan keuntungan bagi inang dengan memodifikasi komunitas mikroba atau berasosiasi dengan inang, memperbaiki nilai nutrisi dan pemanfaatan pakan, memperbaiki respon inang terhadap penyakit dan memperbaiki kualitas lingkungan budidaya (Verschuere et al. 2000). Vibrio SKT-b merupakan salah satu bakteri probiotik yang dapat menekan pertumbuhan Vibrio harveyi dan pada uji tantang in vitro ternyata mampu meningkatkan kelangsungan hidup larva udang windu (Juliantok 2002). Bakteri Vibrio SKT-b telah diidentifikasi sebagai Vibrio alginolyticus (Widanarni et al. 2003). Penambahan probiotik SKT-b (Vibrio alginolyticus) efektif menekan Vibrio harveyi dengan cara kompetisi melalui tempat pelekatan atau sumber nutrisi (Widanarni et al. 2008).
Informasi mengenai penggunaan probiotik dalam teknologi bioflok masih sedikit terutama dalam mengetahui pengaruhnya terhadap respon imun dari organisme akuatik. Oleh karena itu penelitian ini dilakukan untuk mengkaji kinerja imunitas udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik terhadap koinfeksi IMNV (infectious myonecrosis virus) dan Vibrio harveyi.
4
II. BAHAN DAN METODE
2.1 Perlakuan Penelitian
Rancangan penelitian ini adalah rancangan acak lengkap (RAL) dengan 5 perlakuan masing-masing 4 ulangan. Adapun perlakuan yang diberikan dapat dilihat pada Tabel 1.
Tabel 1. Perlakuan penelitian kinerja imunitas udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik terhadap koinfeksi IMNV (infectious myonecrosis virus) dan Vibrio harveyi
Kode Keterangan perlakuan
K- Kontrol Negatif, tanpa penambahan probiotik SKT-b maupun molase, tanpa koinfeksi virus dan bakteri
K+ Kontrol Positif, tanpa penambahan probiotik SKT-b maupun molase, serta dikoinfeksi virus dan bakteri
Pro Probiotik, diberi penambahan probiotik SKT-b serta dikoinfeksi virus dan bakteri
BFT Bioflok, diberi penambahan molase dan dikoinfeksi virus dan bakteri
Pro+BFT Probiotik+Bioflok, diberi penambahan probiotik dan molase, serta dikoinfeksi virus dan bakteri
2.2 Persiapan Wadah dan Hewan Uji
Wadah yang digunakan dalam penelitian ini adalah akuarium dengan ukuran 60 cm x 30 cm x 35 cm. Sebelum digunakan, akuarium dibersihkan terlebih dahulu menggunakan deterjen dan dikeringkan. Kemudian akuarium diisi air laut sebanyak 45 L. Air laut didisinfeksi dengan larutan klorin 30 mg/L dan diaerasi kuat selama 24 jam. Kemudian ditambahkan sodium tiosulfat 15 mg/L untuk menetralkan kandungan klorin dan diaerasi kuat selama minimal 4 jam.
Hewan uji yang digunakan adalah udang vaname Litopenaeus vannamei yang berasal dari Labuan, Banten. Sebelum diberi perlakuan, udang vaname dipelihara selama 30 hari. Udang vaname yang digunakan memiliki bobot rata-rata 0,48 + 0,03 g.
5
2.3 Persiapan Bakteri Probiotik
2.3.1 Pembuatan Mutan Bakteri Probiotik Vibrio SKT-b (RfR)
Bakteri probiotik yang digunakan yaitu Vibrio SKT-b yang merupakan hasil penapisan dari media kultur Skeletonema sp. di lingkungan pembenihan udang windu, Labuan Banten (Widanarni et al. 2003). Bakteri Vibrio SKT-b dibuat resisten terhadap antibiotik rifampisin sebagai penanda molekuler untuk membedakan bakteri yang diinokulasikan dengan bakteri yang sebelumnya telah ada pada media pemeliharaan maupun tubuh udang (Ayuzar 2009). Untuk selanjutnya bakteri SKT-b yang telah resisten rifampisin disebut dengan SKT-bR. Bakteri SKT-bR diperoleh dengan menyebar biakan cair SKT-b pada media TCBS agar yang telah diberi rifampisin 50 µg/mL (Ayuzar 2009). Koloni yang tumbuh kemudian kultur kembali untuk mendapatkan isolat murni SKT-b yang resisten terhadap rifampisin.
2.3.2 Kultur Bakteri SKT-bR
Kultur bakteri probiotik SKT-bR dilakukan pada media SWC yang diinkubasi selama 24 jam pada suhu ruang. Kemudian probiotik diinokulasikan ke dalam media SWC cair dan diletakkan pada water bath shaker selama 24 jam dengan suhu 29-30 0C dengan kecepatan 160 rpm. Setelah 24 jam, didapatkan hasil kultur cair bakteri SKT-bR dengan kepadatan 108 CFU/mL. Kultur cair tersebut digunakan sebagai probiotik yang ditambahkan pada media pemeliharaan dengan kepadatan yang diinginkan yaitu 104 CFU/mL setiap 5 hari sekali (Saputra 2008).
2.4 Pemeliharaan Udang Uji
Udang dipelihara dengan padat tebar 25 ekor/akuarium. Jumlah pakan yang diberikan dengan tingkat pemberian pakan 15 % bobot biomassa dengan frekuensi pemberian pakan 4 kali sehari yaitu pukul 07.00, 11.00, 15.00 dan 20.00. Pemberian molase dilakukan 3 kali sehari 2 jam setelah waktu pemberian pakan. Inokulasi bakteri probiotik dilakukan setiap 5 hari sekali dengan konsentrasi 104 CFU/mL. Pemeliharaan udang dilakukan selama 6 minggu (perlakuan). Selanjutnya udang diuji tantang koinfeksi IMNV dan bakteri Vibrio harveyi dengan pengamatan selama 10 hari. Selama pemeliharaan, dilakukan pergantian
6 air satu kali seminggu sebanyak 50 % untuk perlakuan tanpa penambahan karbon (molase), sedangkan untuk perlakuan penambahan karbon tidak dilakukan pergantian air sama sekali selama pemeliharaan udang.
2.5 Prosedur Penambahan Karbon
Sumber karbon yang digunakan adalah molase dengan persentase kandungan karbon sebesar 44,42 %. Pemberian karbon dengan C/N rasio 10 (Avnimelech 1999). Penambahan molase pada media pemeliharaan sesuai dengan perhitungan yang dilakukan oleh Avnimelech (1999) (Lampiran 1).
2.6 Prosedur Uji Tantang
Uji tantang yang dilakukan adalah koinfeksi virus myo (IMNV) dan bakteri Vibrio harveyi. Udang vaname positif IMNV didapatkan dari Balai Pengembangan Budidaya Air Payau (BPBAP) Situbondo, Jawa Timur yang diekstrak berdasarkan prosedur yang dilakukan Escobedo et al. (2006). Adapun prosedur pembuatan ekstrak IMNV adalah sebagai berikut. Sebanyak 5 ekor udang positif IMNV (bobot rata-rata 10 g) dibersihkan dan dibuang bagian hepatopankreas, usus, dan karapasnya. Kemudian daging udang dicacah hingga halus dan didapatkan hasil cacahan udang positif IMNV dengan volume 10 mL yang dilarutkan dalam PBS sebanyak 100 mL (10x volume daging). Selanjutnya disentrifuse dengan kecepatan 6.500 rpm pada suhu 4 oC selama 20 menit. Supernatan diambil dan dimasukkan dalam mikrotube baru, kemudian disentrifuse dengan kecepatan 13.000 rpm (4 oC) selama 20 menit. Selanjutnya supernatan diambil dan difilter dengan syringe filter berukuran 0,45 µm. Hasil filter itu merupakan stok ekstrak virus IMNV dan disimpan pada suhu -70 oC.
Sebanyak 10 ekor udang uji (masing-masing ulangan) dipilih untuk diinjeksi dengan IMNV pada bagian punggung (antara segmen 3 dan 4) sebanyak 100 µL (Tang et al. 2005). Setelah itu dilakukan infeksi selanjutnya yaitu perendaman dengan bakteri Vibrio harveyi berdasarkan prosedur yang dilakukan Widagdo (2011). Sebelumnya dilakukan kultur cair bakteri Vibrio harveyi pada media SWC dan diinkubasi selama 24 jam pada suhu ruang. Kemudian didapatkan hasil kultur cair bakteri V. harveyi dengan kepadatan awal 108 CFU/mL. Perendaman dilakukan dengan kepadatan bakteri 106 CFU/mL selama 30 menit pada akuarium
7 terpisah dengan kepadatan 10 ekor/L. Setelah dilakukan perendaman, udang uji dikembalikan pada akuarium pemeliharaan. Pengamatan dan pemeliharaan setelah koinfeksi dilakukan selama 10 hari.
2.7 Parameter Pengamatan 2.7.1 Parameter Imun
Parameter imun udang yang diukur terdiri dari total haemocyte count (THC), aktivitas phenoloxydase (PO), dan respiratory burst (RB) yang dilakukan sebelum dan sesudah uji tantang. Sampel darah diambil dari 8 ekor udang tiap perlakuan yang dipilih secara acak. Prosedur pengukuran parameter imun sebagai berikut:
2.7.2 Total Haemocyte Count (THC)
Sebanyak 0,2 mL hemolim udang diambil dengan menggunakan jarum suntik 1 mL yang telah berisi 0,2 mL antikoagulan. Kemudian campuran hemolim-antikoagulan divorteks hingga merata. Campuran hemolim-antikoagulan tersebut kemudian diteteskan pada haemocytometer. Selanjutnya THC langsung dihitung di bawah mikroskop dengan perbesaran 100x.
2.7.3 Aktivitas Phenoloxydase (PO) (Liu dan Chen 2004)
Aktivitas PO haemocyte diukur berdasarkan formasi dopachrome yang dihasilkan oleh L-DOPA (L-dihydroxyphenylalanine). Sebanyak 1 mL campuran hemolim-antikoagulan disentrifuse pada 1.500 rpm selama 10 menit pada temperatur 4 oC. Supernatan dibuang dan pelet disuspensi kembali secara perlahan dengan menambahkan 1 mL larutan cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7) dan disentrifuse kembali (1.500 rpm selama 10 menit pada temperatur 4 oC). Supernatan yang terbentuk dibuang dan ditambahkan 200 µL cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7). Suspensi sel sebanyak 100 µL kemudian diinkubasi dengan 50 µL trypsin (1 mg/mL cacodylate buffer) sebagai aktivator selama 10 menit pada temperatur 25-26 oC. Selanjutnya ditambahkan 50 µL L-DOPA (3 mg/mL cacodylate buffer), didiamkan selama 5 menit dan ditambahkan 800 µL
8 cacodylate buffer. Densitas optikal (OD) diukur dengan menggunakan spektrofotometer pada panjang gelombang 490 nm. Larutan standar mengandung 100 µL suspensi hemosit, 50 µL cacodylate buffer (pengganti trypsin), dan 50 µL L-DOPA. Densitas optikal (OD) dari aktivitas PO dinyatakan sebagai formasi dopachrome dalam 100 µL hemolim.
2.7.4 Respiratory Burst (RB) (Cheng et al. 2004)
Respiratory burst dari hemosit diukur berdasarkan reduksi NBT (nitroblue tetrazolium) sebagai ukuran superoxide anion (O2-). Sebanyak 50 µL campuran hemolim-antikoagulan diinkubasi selama 30 menit dalam suhu ruang. Selanjutnya disentrifuse dengan kecepatan 3.000 rpm selama 20 menit dan supernatan dibuang. Ditambahkan 100 µL NBT dalam larutan HBSS (hank's buffered salt solution dengan konsentrasi 0,3 % dan didiamkan selama 2 jam pada suhu ruang. Kemudian disentrifuse 3.000 rpm selama 10 menit, supernatan dibuang dan ditambahkan 100 µL metanol absolut untuk selanjutnya disentrifuse 3.000 rpm selama 10 menit (supernatan dibuang). Pelet yang terbentuk kemudian dibilas sebanyak 2 kali dengan metanol 70 %. Selanjutnya 120 µL KOH (2M) dan 140 µL DMSO (dimethylsulfoxide) ditambahkan untuk melarutkan pelet. Pelet yang telah larut kemudian dimasukkan ke dalam microplate untuk diukur densitas optikal (OD) menggunakan microplate reader pada panjang gelombang 630 nm. Respiratory burst dinyatakan sebagai reduksi NBT per 10 µL hemolim.
2.7.5 Sintasan
Sintasan atau tingkat kelangsungan hidup udang uji dapat diketahui dari jumlah udang pada akhir perlakuan dibagi dengan jumlah udang awal (Effendi 2004), dirumuskan sebagai berikut :
Sintasan = [Nt/No] x 100 % Keterangan :
No = Jumlah udang pada awal perlakuan (ekor) Nt = Jumlah udang pada akhir perlakuan (ekor)
2.7.6 Perhitungan Bakteri dalam Usus
Perhitungan bakteri pada usus udang dilakukan pada awal pemeliharaan, akhir perlakuan dan akhir pemeliharaan (setelah uji tantang). Dilakukan
9 perhitungan populasi bakteri total dan total bakteri Vibrio SKT-bR. Sampel udang diambil sebanyak 4 ekor dari masing-masing perlakuan yang dipilih secara acak. Udang dibedah dan diambil ususnya, kemudian usus ditimbang dan dimasukkan ke dalam mikrotube steril yang berisi air laut steril 1 mL dan digerus. Dari hasil gerusan usus dalam air laut steril dilakukan pengenceran berseri. Selanjutnya hasil pengenceran berseri disebar pada media SWC agar (sea water complete) pada tingkat pengenceran 10-5, 10-6,dan 10-7 untuk perhitungan bakteri total dalam usus. Perhitungan total bakteri Vibrio SKT-bR tidak dilakukan pengenceran berseri (100) dan langsung disebar pada media TCBS agar (thiosulfate citrate bile-salt sucrose) yang telah diberi rifampisin (50 µg/mL). Perhitungan bakteri dilakukan menggunakan metode hitungan cawan.
2.7.7 Perhitungan Populasi Bakteri Vibrio SKT-bR Media Pemeliharaan
Populasi Vibrio SKT-bR pada media pemeliharaan dengan perlakuan probiotik dilakukan setiap 5 hari sekali selama masa pemeliharaan. Sampel air sebanyak 1 mL diambil wadah pemeliharaan perlakuan Pro dan Pro+BFT sebelum dan setelah dilakukan penambahan probiotik SKT-bR, kemudian dilakukan perhitungan bakteri dengan metode cawan sebar pada media TCBS agar yang diberi rifampisin (50 µg/mL) yang diinkubasi selama 24 jam pada suhu ruang.
2.7.8 Kualitas Air
Pengukuran kualitas air dilakukan dilakukan satu minggu sekali yang meliputi pengukuran suhu, oksigen terlarut (DO), pH, salinitas, total amoniak nitrogen (TAN), nitrat, nitrit, TSS (total suspended solid) dan VSS (volatile suspended solid).
2.8 Analisis Data
Data yang diperoleh dianalisis menggunakan analisis ragam dengan tingkat kepercayaan 95%. Kemudian dilakukan uji lanjut Duncan dengan menggunakan software SPSS 17.0 untuk melihat perbedaan antar perlakuan.
10
III. HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Total Haemocyte Count (THC)
Pengukuran nilai THC dilakukan sebelum dan setelah uji tantang dengan koinfeksi virus IMNV dan bakteri Vibrio harveyi. Hasil pengukuran THC disajikan pada Gambar 1.
Gambar 1. Total haemocyte count (THC) udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik sebelum dan setelah uji tantang selama 10 hari dengan koinfeksi virus IMNV dan bakteri Vibrio harveyi. Huruf yang berbeda pada masing-masing diagram batang menunjukkan perbedaan nyata (P<0,05)
Berdasarkan Gambar 1 dapat diketahui bahwa sebelum dilakukan koinfeksi virus IMNV dan bakteri Vibrio harveyi, nilai THC yang tinggi diperoleh pada perlakuan Pro dan BFT yaitu 27,78 x 106 sel/mL dan 27,57 x 106 sel/mL yang berbeda nyata dengan kontrol (P<0,05; Lampiran 2). Setelah dilakukan koinfeksi virus IMNV dan bakteri Vibrio harveyi, nilai THC semua perlakuan mengalami penurunan. Perlakuan Pro, BFT dan campuran Pro+BFT setelah koinfeksi memiliki nilai THC yang tidak berbeda nyata dengan K-, namun berbeda nyata dengan K+ (P<0,05; Lampiran 3) yang mengalami penurunan nilai THC secara signifikan dari 19,91 x 106 sel/mL menjadi 7,06 x 106 sel/mL.
19,91 19,87 7,06 27,78 18,27 27,57 20,24 24,36 20,86 0,00 5,00 10,00 15,00 20,00 25,00 30,00
Sebelum uji tantang Setelah uji tantang
TH C (x 10 6se l/ m L) K-K+ Pro BFT Pro + BFT a a b b ab b a b b b
11
3.1.2 Aktivitas Phenoloxydase (PO)
Nilai aktivitas PO yang diukur sebelum dan setelah uji tantang dengan koinfeksi virus IMNV dan bakteri Vibrio harveyi disajikan pada Gambar 2.
Gambar 2. Aktivitas phenoloxydase (PO) udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik sebelum dan setelah uji tantang koinfeksi dengan virus IMNV dan bakteri Vibrio harveyi. Huruf yang berbeda pada masing-masing diagram batang menunjukkan perbedaan nyata (P<0,05)
Uji statistik menunjukkan bahwa perlakuan yang diberikan tidak menghasilkan pengaruh yang berbeda nyata pada nilai aktivitas PO sebelum dilakukan koinfeksi dengan virus IMNV dan bakteri Vibrio harveyi (P<0,05; Lampiran 4). Setelah dilakukan koinfeksi dengan virus IMNV dan bakteri Vibrio harveyi, terlihat penurunan nilai PO yang signifikan pada K+ sedangkan semua perlakuan menunjukkan nilai yang meningkat dan berbeda nyata dengan K+ (P<0,05; Lampiran 5).
3.1.3 Aktivitas Respiratory Burst (RB)
Nilai RB sebelum dan setelah uji tantang koinfeksi dengan virus IMNV dan bakteri Vibrio harveyi disajikan pada Gambar 3.
0,459 0,786 0,320 0,500 0,588 0,527 0,595 0,649 0,918 0,000 0,100 0,200 0,300 0,400 0,500 0,600 0,700 0,800 0,900 1,000
Sebelum uji tantang Setelah uji tantang
P O (ab s/ 100 µ l) K-K+ Pro BFT Pro+BFT a a a a a b a ab ab b
12 Gambar 3. Respiratory burst (RB) udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik sebelum dan setelah uji tantang koinfeksi dengan virus IMNV dan bakteri Vibrio harveyi. Huruf yang berbeda pada masing-masing diagram batang menunjukkan perbedaan nyata (P<0,05)
Hasil statistik menunjukkan bahwa sebelum dilakukan koinfeksi virus IMNV dan bakteri Vibrio harveyi diperoleh nilai RB yang tinggi pada perlakuan BFT dan campuran Pro+BFT dengan nilai 1,189 abs/10 µL dan 1,242 abs/10 µL serta berbeda nyata dengan perlakuan kontrol dan Pro (P<0,05; Lampiran 6). Setelah dilakukan koinfeksi virus IMNV dan bakteri Vibrio harveyi, nilai RB semua perlakuan mengalami penurunan. Perlakuan campuran Pro+BFT memiliki nilai yang tetap tinggi yaitu 0,741 abs/10 µL dan tidak berbeda nyata dengan K- serta lebih tinggi dari perlakuan Pro, BFT dan K+ (P<0,05; Lampiran 7).
3.1.4 Sintasan
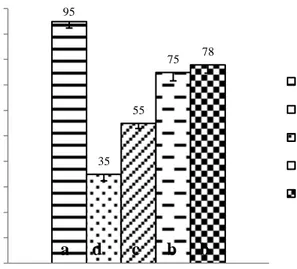
Parameter sintasan diamati setelah dilakukan uji tantang dengan koinfeksi virus IMNV dan bakteri Vibrio harveyi. Hasil yang disajikan pada Gambar 4 menunjukkan bahwa koinfeksi yang dilakukan memberikan pengaruh yang nyata terhadap nilai sintasan tiap perlakuan (P<0,05; Lampiran 8). Pada perlakuan campuran Pro+BFT menghasilkan sintasan yang tinggi yaitu 78 % dan berbeda nyata dengan perlakuan Pro, K+, dan K-, namun tidak berbeda nyata dengan perlakuan BFT yang menghasilkan nilai sintasan sebesar 75 %.
0,682 0,586 0,165 0,752 0,412 1,189 0,439 1,242 0,741 0,000 0,200 0,400 0,600 0,800 1,000 1,200 1,400
Sebelum uji tantang Setelah uji tantang
R B (a b s/ 10 µl ) K-K+ Pro BFT Pro + BFT a a a b b c a b b c
13 Gambar 4. Sintasan udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik setelah uji tantang dengan koinfeksi virus IMNV dan bakteri Vibrio harveyi. Huruf yang berbeda pada masing-masing diagram batang menunjukkan perbedaan nyata (P<0,05)
3.1.5 Total Bakteri dalam Usus
Total bakteri usus yang dihitung pada awal pemeliharaan, akhir perlakuan (sebelum uji tantang) dan akhir pemeliharaan (setelah uji tantang) disajikan pada Gambar 5.
Gambar 5. Total bacteria count (TBC) usus udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik
Dari Gambar 5, terlihat adanya pengaruh penambahan probiotik dan molase terhadap total bakteri dalam usus udang. Jumlah total bakteri pada usus udang
95 35 55 75 78 0 10 20 30 40 50 60 70 80 90 100
Setelah uji tantang
S in tas an (% ) K-K+ Pro BFT Pro + BFT 7,39 8,50 4,50 6,60 8,60 9,08 9,09 10,33 8,94 10,38 0,00 2,00 4,00 6,00 8,00 10,00 12,00 Awal pemeliharaan
Akhir perlakuan Akhir pemeliharaan T ot al bac te ri a c ou n t (l o g C F U /m L) K-K+ Pro BFT Pro+BFT a d c b b
14 cenderung meningkat pada akhir perlakuan (sebelum uji tantang) dan akhir pemeliharaan (setelah uji tantang). Namun terdapat penurunan jumlah total bakteri pada K+. Perlakuan BFT dan campuran Pro+BFT memiliki total bakteri yang lebih tinggi dibandingkan kontrol dan perlakuan penambahan bakteri saja (Pro). Total bakteri pada awal pemeliharaan nilainya berkisar pada 104 CFU/mL, sedangkan total bakteri perlakuan BFT dan campuran Pro+BFT pada akhir pemeliharaan berkisar antara 106 hingga 1010 CFU/mL.
3.1.6 Total Bakteri Vibrio SKT-bR Media Pemeliharaan
Jumlah total bakteri Vibrio SKT-bR dalam media pemeliharaan dihitung setiap 5 hari sekali dengan sampel air yang diambil sebelum dan setelah penambahan probiotik SKT-bR. Hasil perhitungan total bakteri SKT-bR dapat dilihat pada Gambar 6.
Gambar 6. Total Bakteri Vibrio SKT-bR pada media pemeliharaan udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik pada saat sebelum dan sesudah pemberian probiotik
Berdasarkan Gambar 6 terlihat bahwa total bakteri Vibrio SKT-bR pada perlakuan Pro memiliki nilai yang tinggi dibandingkan dengan perlakuan campuran Pro+BFT. Jumlah bakteri SKT-bR hari ke-5 sebelum penambahan probiotik pada perlakuan Pro yaitu mencapai 103 CFU/mL, sedangkan pada perlakuan campuran Pro+BFT hanya berkisar 102 CFU/mL.
0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50 4,00 4,50 5,00 0 5 10 15 20 25 30 35 40 To tal V ibr io S K T -b R(l o g C F U /m L) Hari ke-Pro sebelum Pro sesudah Pro+BFT sebelum Pro+BFT sesudah
15
3.1.7 Kualitas Air Media Pemeliharaan selama Perlakuan
Parameter kualitas air suhu, pH, salinitas, DO, TAN, nitrit, nitrat, TSS dan VSS diukur setiap satu minggu sekali.
3.1.7.1 Suhu, pH, Salinitas, DO, TSS, dan VSS
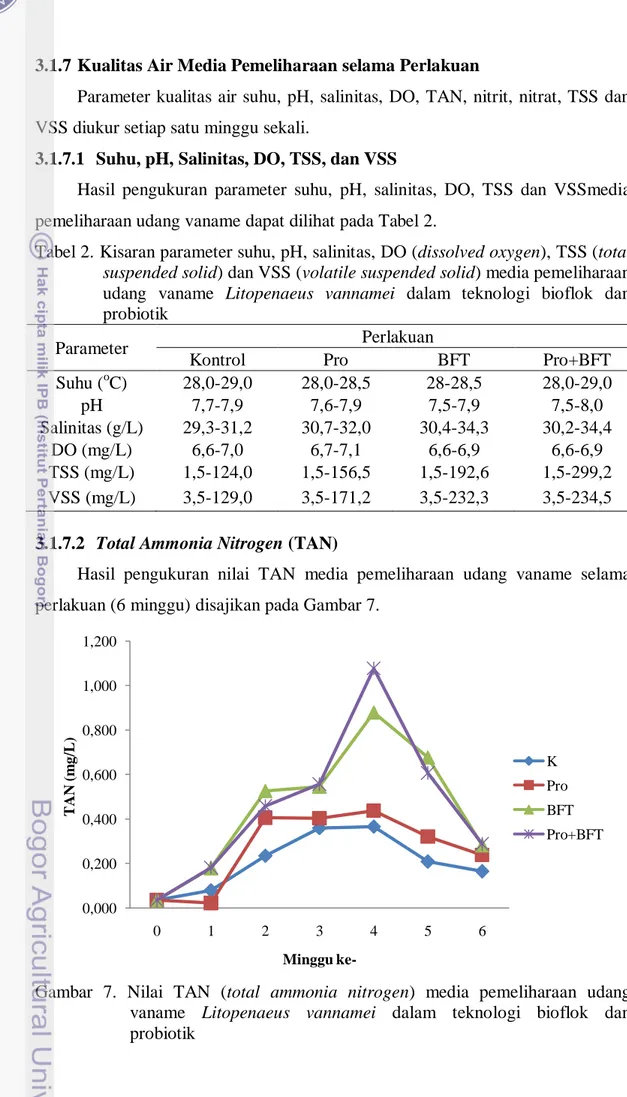
Hasil pengukuran parameter suhu, pH, salinitas, DO, TSS dan VSSmedia pemeliharaan udang vaname dapat dilihat pada Tabel 2.
Tabel 2. Kisaran parameter suhu, pH, salinitas, DO (dissolved oxygen), TSS (total suspended solid) dan VSS (volatile suspended solid) media pemeliharaan udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik
Parameter Perlakuan
Kontrol Pro BFT Pro+BFT
Suhu (oC) 28,0-29,0 28,0-28,5 28-28,5 28,0-29,0 pH 7,7-7,9 7,6-7,9 7,5-7,9 7,5-8,0 Salinitas (g/L) 29,3-31,2 30,7-32,0 30,4-34,3 30,2-34,4 DO (mg/L) 6,6-7,0 6,7-7,1 6,6-6,9 6,6-6,9 TSS (mg/L) 1,5-124,0 1,5-156,5 1,5-192,6 1,5-299,2 VSS (mg/L) 3,5-129,0 3,5-171,2 3,5-232,3 3,5-234,5
3.1.7.2 Total Ammonia Nitrogen (TAN)
Hasil pengukuran nilai TAN media pemeliharaan udang vaname selama perlakuan (6 minggu) disajikan pada Gambar 7.
Gambar 7. Nilai TAN (total ammonia nitrogen) media pemeliharaan udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik 0,000 0,200 0,400 0,600 0,800 1,000 1,200 0 1 2 3 4 5 6 TA N (m g/ L) Minggu ke-K Pro BFT Pro+BFT
16
3.1.7.3 Nitrit (NO2-)
Hasil pengukuran nilai nitrit media pemeliharaan udang vaname selama perlakuan (6 minggu) disajikan pada Gambar 8.
Gambar 8. Nilai nitrit (NO2-) media pemeliharaan udang vaname Litopenaeus vannamei dalam teknologi bioflok dan probiotik
3.1.7.4 Nitrat (NO3-)
Hasil pengukuran nilai nitrat media pemeliharaan udang vaname selama perlakuan (6 minggu) disajikan pada Gambar 9.
Gambar 9. Nilai nitrat (NO3-) media pemeliharaan udang vaname Litopenaeus vannamei dalam teknologi bioflok dengan dan tanpa penambahan probiotik 0,000 0,200 0,400 0,600 0,800 1,000 1,200 1,400 0 1 2 3 4 5 6 N itr it (m g/ L) Minggu ke-K Pro BFT Pro+BFT 0,000 0,200 0,400 0,600 0,800 1,000 1,200 1,400 0 1 2 3 4 5 6 N itr at (m g/ L) Minggu ke-K Pro BFT Pro+BFT
17
3.2 Pembahasan
Hemosit berperan dalam proses fagositosis, enkapsulasi, degranulasi, agregasi nodular terhadap patogen maupun partikel asing, dan produksi serta pelepasan enzim proPO dalam sistem imun krustasea (Sahoo et al. 2008). Hasil pengamatan nilai THC sebelum uji tantang diketahui bahwa ketiga perlakuan yang diberikan dapat meningkatkan total hemosit dari udang vaname L. vannamei. Total hemosit udang sebelum uji tantang menunjukkan nilai yang tinggi dan tidak berbeda nyata antara perlakuan Pro dan BFT serta berbeda signifikan dengan kontrol. Peningkatan total hemosit udang pada perlakuan Pro dan BFT dalam penelitian ini menunjukkan bahwa sistem bioflok dengan penambahan bakteri probiotik SKT-b mampu berperan dalam menstimulasi respon imun udang dibandingkan dengan kontrol. Li et al. (2008) menunjukkan bahwa bakteri probiotik Arthrobacter XE-7 meningkatkan total hemosit udang L. vannamei dibandingkan kontrol sebelum diuji tantang.
Koinfeksi IMNV dan bakteri Vibrio harveyi yang diberikan mempengaruhi nilai total hemosit udang. Setelah dilakukan koinfeksi, nilai total hemosit semua perlakuan menurun. Total hemosit Kontrol Positifmenurun sangat signifikan dan berbeda nyata dengan total hemosit perlakuan lain (Pro, BFT dan Pro+BFT) dimana perlakuan BFT dan campuran Pro+BFT masih lebih tinggi dibandingkan Kontrol Negatif (P<0,05). Hasil penelitian Song et al. (2003) menunjukkan bahwa setelah 3-5 hari diinfeksi dengan taura syndrome virus (TSV), nilai THC L. vannamei berukuran 10-20 g mengalami penurunan sebesar 70 % dibandingkan dengan Kontrol Negatif. Total hemosit yang rendah sangat mempengaruhi kerentanan udang terhadap patogen (Le Moullac et al. 1998). Apabila total hemosit menurun maka dapat terjadi infeksi akut yang menyebabkan kematian (Rodriguez dan Le Moullac 2000), sehingga total hemosit yang tinggi setelah dilakukan uji tantang menunjukkan bahwa peluang terbentuknya sel-sel fagositik dalam mengendalikan serangan organisme patogen tetap tinggi dan dapat meningkatkan sistem imun inang.
Phenoloxydase merupakan suatu enzim yang bertanggung jawab terhadap proses melanisasi pada krustase sebagai respon terhadap penyerang asing (Sritunyalucksana dan Soderhall 2000). Aktivitas PO sebelum uji tantang dengan
18 koinfeksi menunjukkan nilai yang setara pada semua perlakuan dan kontrol. Hal ini mengindikasikan bahwa perlakuan yang diberikan tidak mempengaruhi aktivitas PO sebelum dilakukan uji tantang.
Nilai PO setelah koinfeksi dengan virus IMNV dan bakteri V. harveyi, menunjukkan bahwa Kontrol Positif mengalami penurunan dan berbeda nyata dengan perlakuan Pro, BFT dan campuran Pro+BFT yang justru mengalami peningkatan aktivitas PO. Pada perlakuan campuran Pro+BFT diperoleh nilai yang tinggi yaitu 0,918 abs/100 µL dan tidak berbeda nyata dengan Kontrol Negatif. Hal ini menunjukkan bahwa pemberian probiotik dan bakteri dalam teknologi bioflok bersinergi dalam meningkatkan aktivitas PO udang vaname. Meningkatnya aktivitas PO menyebabkan kemampuan udang vaname untuk mengenali benda asing yang masuk ke dalam tubuh menjadi semakin baik (Cook et al. 2003). Proses ini akan mengurangi benda asing yang masuk ke dalam tubuh sehingga daya tahan udang akan meningkat (Cook et al. 2003). Aktivitas PO terdapat dalam hemolim sebagai pro-enzim inaktif yang disebut proPO. Enzim proPO adalah non-self recognition sistem yang terdapat pada arthropoda dan invertebrata lain. Transformasi proPO menjadi PO melibatkan beberapa reaksi yang dikenal sebagai proPO activating system yang diaktifkan oleh β-glukan, peptidoglikan dan LPS (Sritunyalucksana dan Soderhall 2000). Ketiga bahan tersebut berasal dari dinding sel bakteri non patogenik dan jamur (Smith et al. 2003).
Respiratory burst (RB) merupakan salah satu parameter imun udang berkaitan dengan reaksi fagositosis yang merupakan reaksi yang paling umum dalam pertahanan selular udang. Proses fagositosis dimulai dengan pelekatan (attachment) dan penelanan (ingestion) partikel mikroba ke dalam sel fagosit. Sel fagosit kemudian membentuk vakuola pencernaan (digestive vacuola) yang disebut fagosom (Rodriguez dan Le Moullac 2000). Lisosom (granula dalam sitoplasma fagosit) kemudian menyatu dengan fagosom membentuk fagolisosom. Mikroorganisme selanjutnya dihancurkan dan debris mikroba dikeluarkan dari dalam sel melalui proses egestion. Pemusnahan partikel mikroba yang difagosit melibatkan pelepasan enzim ke dalam fagosom dan produksi ROI (reactive oxygen intermediate) yang kini disebut respiratory burst (Rodriguez dan Le
19 Moullac 2000). Hasil pengamatan RB sebelum dan setelah dilakukan koinfeksi terlihat bahwa perlakuan BFT dan campuran Pro+BFT dapat meningkatkan nilai RB dibandingkan dengan kontrol. Respiratory burst berkaitan dengan mekanisme fagositosis, sehingga semakin tinggi nilai RB maka sistem imun udang diduga menjadi semakin baik (Rodriguez dan Le Moullac 2000).
Peningkatan respon imun udang vaname yang ditunjukkan dengan hasil nilai THC, PO dan RB diduga karena adanya pengaruh dari sistem bioflok yang diterapkan dan adanya penambahan probiotik. Nilai THC, PO dan RB berkaitan dengan pembentukan sel fagosit pada hemolim udang (Rodriguez dan Le Moullac 2000) yang dapat diaktifkan dengan adanya LPS (lipopolisakarida) dalam bakteri (Smith et al. 2003; Sritunyalucksana dan Soderhall 2000). Bioflok terdiri bakteri, alga, partikel anorganik, pemakan bakteri seperti protozoa dan zooplankton yang dapat dimanfaatkan oleh udang (De Schryver et al. 2008). Sehingga dengan masuknya bakteri non patogen ke dalam saluran pencernaan udang, maka dapat mengaktifkan enzim proPO dan meningkatkan aktivitas PO (Sritunyalucksana dan Soderhall 2000).
Peningkatan nilai PO dan RB pada perlakuan Pro+BFT diduga karena semakin banyak bakteri flok dan probiotik SKT-b yang termakan oleh udang. Hal tersebut didukung dengan hasil perhitungan total bakteri dalam usus udang pada perlakuan Pro+BFT menunjukkan jumlah populasi bakteri yang paling tinggi dibandingkan dengan perlakuan lain dan kontrol. Hasil perhitungan total bakteri Vibrio SKT-b dalam media pemeliharaan menunjukkan bahwa bakteri probiotik tersebut mampu berkompetisi dengan bakteri lain yang membentuk flok, dengan demikian probiotik ini berpotensi untuk diterapkan dalam sistem bioflok. Sehingga peningkatan jumlah populasi bakteri total dalam usus udang terjadi karena adanya pengaruh penambahan molase sebagai sumber karbon dan probiotik SKT-b dalam sistem bioflok yang diterapkan. Hasil penelitian Hadi (2006) menunjukkan bahwa total bakteri media pemeliharaan dengan penambahan karbon lebih tinggi dibandingkan dengan kontrol. Oleh karena itu dengan penambahan probiotik SKT-b ke dalam sistem bioflok diduga berkontribusi pada peningkatan populasi bakteri total. Bakteri yang dimanfaatkan udang akan masuk
20 ke dalam tubuh dan meningkatkan respon imun dari udang (De Schryver et al. 2008).
Meningkatnya respon imun udang tersebut dapat mempengaruhi nilai sintasan menjadi lebih tinggi, karena resistensi udang terhadap patogen juga meningkat (Cook et al. 2003). Hal ini didukung dengan nilai sintasan udang pada perlakuan BFT dan Pro+BFT yang lebih tinggi dan berbeda nyata dengan Kontrol Positif setelah dikoinfeksi dengan IMNV dan bakteri patogen Vibrio harveyi. Selain itu, menurut De Schryver et al. (2008) bioflok mengandung poly-β-hydroxibutirat (PHB) yang dapat meningkatkan sistem imun. Hasil penelitian Defoirdt et al. (2007) menunjukkan bahwa PHB dapat melindungi Artemia fransciscana dari serangan bakteri patogen Vibrio campbellii. Probiotik Vibrio SKT-b yang ditambahkan dalam sistem bioflok juga mempengaruhi tingginya nilai sintasan, karena probiotik SKT-b (Vibrio alginolyticus) efektif menekan pertumbuhan Vibrio harveyi dengan cara kompetisi melalui tempat pelekatan atau sumber nutrisi (Widanarni et al. 2008).
Poly-β-hydroxibutirat (PHB) merupakan polimer intraseluler yang dihasilkan oleh berbagai mikroorganisme yang berkaitan dengan sumber karbon dan penyimpanan energi yang dapat meningkatkan sistem imun (Defoirdt et al. 2007). Kandungan PHB dalam bakteri dapat melindungi organisme akuatik dari serangan bakteri patogen (De Schryver et al. 2010). Partikel PHB terdegradasi menjadi β-hydroxibutirat dalam usus udang dan pembentukan asam lemak ini melindungi udang dengan dua cara yaitu, menyediakan energi untuk udang dan menghambat pertumbuhan dari patogen (Defoirdt et al. 2007).
Teknologi bioflok sangat tergantung dari kualitas air media budidaya. Paramater yang mempengaruhinya antara lain adalah intensitas pengadukan (aerasi), suhu, pH, DO, dan sumber karbon organik (De Schryver et al. 2008). Nilai suhu, salinitas, pH dan DO dalam media pemeliharaan masih berada dalam kisaran normal untuk pertumbuhan udang vaname (SNI 2006). Total suspended solid (TSS) merupakan jumlah padatan dan kekeruhan yang terdapat dalam air (Ray et al. 2010). Nilai TSS yang dihasilkan dalam penelitian ini menunjukkan peningkatan seiring dengan masa pemeliharaan. Perlakuan Pro+BFT memiliki nilai TSS yang paling tinggi dibandingkan dengan kontrol dan perlakuan lain
21 yaitu 299,2 mg/L. Kisaran nilai TSS yang dianjurkan dalam teknologi bioflok yaitu 200-1000 mg/L (De Schryver et al. 2008). Volatile suspended solid (VSS) merepresentasikan total suspensi bahan organik di dalm air (Schneider et al. 2006). Hasil penelitian menunjukkan nilai VSS berkisar antara 3,5-234,5 mg/L. Nilai tertinggi VSS diperoleh pada perlakuan campuran Pro+BFT. Tingginya nilai TSS dan VSS tersebut, berkaitan dengan jumlah bakteri total pada perlakuan Pro+BFT yang juga memiliki nilai paling tinggi dibandingkan dengan perlakuan lain. Sekitar 40 % dari bakteri dalam kolom air tambak udang merupakan partikel tersuspensi (Burford et al. 2003).
Nilai rata-rata TAN perlakuan Pro dan kontrol yaitu 0,236 - 0,328 mg/L, sedangkan perlakuan BFT dan campuran Pro+BFT memiliki nilai rata-rata TAN yang lebih tinggi yaitu berkisar 0,516 - 0,529 mg/L. Namun nilai TAN tersebut masih berada dalam kisaran normal yaitu kurang dari 1 mg/L (SNI 2006). Kisaran rata-rata nilai nitrit selama masa pemeliharaan pada semua perlakuan yaitu 0,50 – 0,64 mg/L, sedangkan nilai nitrat berkisar antara 0,78 – 0,87 mg/L. Nilai nitrit dan nitrat yang dihasilkan juga masih dalam kisaran normal untuk pertumbuhan udang vaname. Selama pemeliharaan udang vaname, pergantian air dilakukan pada perlakuan Pro dan kontrol setiap seminggu sekali sebanyak 50 %, sedangkan pada perlakuan dengan sistem bioflok tidak dilakukan pergantian air sama sekali. Teknologi bioflok yang diterapkan dalam penelitian ini cukup efisien digunakan dalam mempertahankan kualitas air tanpa adanya pergantian air, karena nilai setiap parameter kualitas air yang diukur tidak jauh berbeda dengan perlakuan yang dilakukan pergantian air yang semuanya masih berada dalam kisaran normal untuk menunjang pertumbuhan udang vaname.
22
IV. KESIMPULAN
Teknologi bioflok dan probiotik SKT-b dapat meningkatkan kinerja imunitas udang melalui peningkatan nilai THC (total haemocyte count), PO (phenoloxydase) dan RB (respiratory burst) serta memperbaiki resistensi udang vaname Litopenaeus vannamei terhadap koinfeksi IMNV dan bakteri Vibrio harveyi patogen.
23
DAFTAR PUSTAKA
Avella MA, Gioacchini G, Decamp O, Makridis P, Bracciatelli C, Carnevali O. 2010 Application of multi-species of Bacillus in sea bream larviculture. Aquaculture 305: 12–19.
Avnimelech Y. 1999. Carbon/nitrogen ratio as a controlelement in aquaculture systems. Aquaculture 176: 227–235.
Avnimelech Y. 2007. Feeding with microbial flocs by tilapia in minimal discharge bio-flocs technology ponds. Aquaculture 264:140-147.
Ayuzar E. 2008. Mekanisme penghambatan bakteri probiotik terhadap pertumbuhan Vibrio harveyi pada larva udang windu (Penaeus monodon). [Disertasi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Ballester ELC, Abreu PC, Cavalli RO, Emerenciano M, Abreu L, Wasielesky WJ. 2010. Effect of praticaldiets with different protein levelson the performance of Farfantepenaeus paulensis juveniles nursed in a zero exchange suspended microbial flocs intensive system. Aquaculture Nutrition 16: 163–172.
Burford MA, Thompson PJ, McIntosh RP, Bauman RH, Pearson DC. 2003. Nutrient and microbial dynamics in high-intensity, zero exchange shrimp ponds in Belize. Aquaculture 219: 393–411.
Castex M, Lemaire P, Wabete N, Chim L. 2010. Effect of probiotic Pediococcus acidilactici on antioxidant defences and oxidative stress of Litopenaeus stylirostris under Vibrio nigripulchritudo challenge. Fish & Shellfish Immunology 28: 622–631.
Cheng W, Liu CH, Yeh ST, and JC. Chen. 2004. The immune stimulatory effect of sodium alginate on the white shrimp Litopenaeus vannamei and its resistance against Vibrio alginolyticus. Fish and Shellfish Immunology 17: 41-51.
Cook MT, Hayball PJ, Hutchinson W, Nowak BF, Hayball JD. 2003. Administration of a commercial immunostimulant preparation, EcoActiva™ as a feed supplement enhances macrophage respiratory burst and the growthrate of snapper (Pagrus auratus, Sparidae (Bloch and Schneider)) in winter. Fish and Shellfish Imunology 14: 333-345.
Costa AM, Buglione CC, Bezerra FL, Martins PCC, Barracco MA. 2009. Immune assessment of farm-reared Penaeus vannamei shrimp naturally infected by IMNV in NE Brazil. Aquaculture 291:141-146.
Crab R, Defoirdt T, Bossier P, Verstraete W. 2012. Biofloc technology in aquaculture: Beneficial effects and future challenges. Aquaculture 356– 357: 351–356
24 De Schryver P, Crab R, Defoirdt T, Boon N, Verstraete W. 2008. The basics of bioflocs technology: the added value for aquaculture. Aquaculture 277: 125– 137.
De Schryver P, Sinha AK, Baruah K, Verstraete W, Boon N, De Boeck G, Bossier P. 2010. Poly-beta-hydroxybutyrate (PHB) increases growth performance and intestinal bacterial range-weighted richness in juvenile European sea bass, Dicentrarchus labrax. Applied Microbiology and Biotechnology 86: 1535–1541.
De Schryver P, Verstraete W. 2009. Nitrogen removal from aquaculture pond water by heterotrophic nitrogen assimilation in lab-scale sequencing batch reactors. Bioresource Technology 100: 1162–1167.
Defoirdt T, Halet D, Vervaeren H, Boon N, Van de Wiele T, Sorgeloos P, Bossier P, Verstraete W. 2007. The bacterial storage compound of poly-β-hydrobutyrate protects Artemia fransiseana from pathogenic Vibrio campbellii. Environmental Microbiology 9 (2): 445-452.
Effendi I. 2004. Pengantar Akuakultur. Penebar Swadaya, Depok.
Escobedo CM, Bonilla, Audoorn L, Wille M, Alday V, Sanz, Sorgeloos P, Pensaert MB, Nauwynck HJ. 2006. Standardized white spot syndrome virus (WSSV) inoculation procedures for intramuscular or oral routes. Diseases of Aquatic Organisms 68:181-188.
FAO. 2012. Fisheries and Aquaculture topics: Activities - Introduction. Topics Fact Sheets. In: FAO Fisheries and Aquaculture Department [online]. http://www.fao.org/fishery/topic/14884/en [16 September 2012].
Hadi P. 2006. Pengaruh pemberian karbon (sukrosa) dan probiotik terhadap dinamika populasi bakteri dan kualitas air media budidaya udang vaname Litopenaeus vannamei. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Hari B, Madhusoodana K, Varghese JT, Schrama JW, Verdegem MCJ. 2004. Effects of carbohydrate addition on production in extensive shrimp culture sistems. Aquaculture 241: 179-194.
Hasan A. 2011. Koinfeksi infectious myonecrosis virus (IMNV) dan Vibrio harveyi pada udang vaname (Litopenaeus vannamei). [Tesis]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Bogor.
Horowitz S, Horowitz A. 2002. Microbial intervention in aquaculture. In: Lee, C.-S., O’Bryen, P. (Eds.), Proceedings of Microbial Approaches to Aquatic Nutrition within Environmentally Sound Aquaculture Production Systems. The World AquacultureSociety, Baton Rouge, Louisiana, USA, pp. 119– 131.
25 Juliantok E. 2002. Isolasi dan seleksi bakteri Vibrio sp. sebagai biokontrol untuk penyakit kunang-kunang pada larva udang windu Penaeus monodon Fab. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Le Moullac G, Soyez C, Saulnier D, Ansquer D, Avarre JC, and Levy P. 1998. Effect of hypoxic stress on the immune response and the resistance to vibriosis of the shrimp Penaeus stylirostris. Fish Shellfish Immunology 8: 621- 629.
Li CH, Yeh ST, Chen JC. 2008. The immune response of white shrimp Litopenaeus vannamei following Vibrio alginolyticus injection. Fish and Shellfish Immunology 25: 853-860.
Liu CH, Chen JC. 2004. Effect of amoniak on the immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus. Fish and Shellfish Immunology 16: 321-334.
Phuoc LH, Corteel M, Nguyen CT, Nauwynck H, Pensaert M, Alday-Sanz V, Broeck van den W, Sorgeloos P, Bossier P. 2009. Effect of dose and challenge routes of Vibrio spp. on co-infection with white spot syndrome virus in Penaeus vannamei. Aquaculture 290: 61-68.
Ray AJ, Lewis BL, Browdy CL, Leffler JW. 2010. Suspended solid removal to improve shrimp (Litopenaeus vannamei) production and evaluation of plant-based feed in minimal-exchange, superintensive culture systems. Aquaculture 299: 89-98.
Rondriguez J and Le Moullac G. 2000. State of the art of immunological tools and health controlof penaeid shrimp. Aquaculture 191: 109-119.
Sahoo PK, Das A, Mohanty S, Mohanty BK, Pilai BR, Mohanty J. 2008. Dietary β-1,3 glucan improve the immunity and disease resistance of freshwater prawn Macrobrachium rosenbergii challenged with Aeromonas hydrophila. Aquaculture 39: 1574-1578.
Saputra WH. 2008. Pengaruh penambahan molase terhadap kelangsungan hidup dan pertumbuhan larva udang windu Penaeus monodon Fab yang diberi bakteri probiotik Vibrio SKT-b. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Schneider O, Sereti V, Eding EH, Verreth JAJ. 2006. Molasses as C source for heterotropic bacteria production on solid fish waste. Aquaculture 261: 1248.
Senapin S, Phewsaiya K, Briggs M, Flegel TW. 2007. Outbreaks of infectious myonecrosis virus (IMNV) in Indonesia confirmed by genome sequencing and use of an alternative RT-PCR detection method. Aquaculture 266: 32-38.
26 Smith VJ, Janet HB, and Hauton C. 2003. Immunostimulation in crustaceass: dose
it reallyprotect against infection. Fish and Shellfih Immunology 15: 71-90.
SNI [Standar Nasional Indonesia]. 2006. Produksi udang vaname (Litopenaeus vannamei) di tambak dengan teknologi intensif. Badan Standardisasi Nasional.
Song YL, Yu CI, Lien TW, Huang CC, Lin MN. 2003. Haemolymph parameters of pacific white shrimp (Litopenaeus vannamei) infected with taura syndrome virus. Fish and Shellfish Immunology 14: 317-331.
Sritunyalucksana K, Soderhall K. 2000. The proPO and clotting system in crustaceans. Aquaculture 191: 53-69.
Tang KFJ, Pantoja CR, Poulos BT, Redman RM, Lightner DV. 2005. In situhybridization demonstrates that Litopenaeus vannamei, L. stylirostris and Penaeus monodon are susceptible to experimental infection with infectious myonecrosis virus (IMNV). Diseases of Aquatic Organisme
63:261-265.
Verschuere L, Rombaut G, Sorgeloos P, Verstraete W. 2000. Probiotic bacteria as biological control agents in aquaculture. Microbiology and Molecular Reviews (64) 4: 655-671.
Walker PJ, Winton JR. 2010. Emerging viral disease of fish and shrimp. Veterinary Reasearch 41(51): 1-24.
Widagdo P. 2011. Aplikasi probiotik, prebiotik, dan sinbiotik melalui pakan pada udang vaname Litopenaeus vannamei yang diinfeksi bakteri Vibrio harveyi [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Widanarni, Ayuzar E, Sukenda, 2008. Mekanisme penghambatan bakteri probiotik terhadap pertumbuhan Vibrio harveyi pada larva udang windu Penaeus monodon. Jurnal Akuakultur Indonesia 7: 181-190.
Widanarni, Suwanto A, Sukenda, Lay BW. 2003. Potency of Vibrio isolates for biocontrol of vibriosis in tiger shrimp (Penaeus monodon) larvae. Biotropia 20: 11-23.
Yuniasari D. 2009. Pengaruh pemberian bakteri nitrifikasi dan denitrifikasi serta molase dengan C/N rasio berbeda terhadap profil kualitas air, kelangsungan hidup, dan pertumbuhan udang vaname Litopenaeus vannamei. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
28 Lampiran 1. Perhitungan penambahan karbon dalam pemeliharaan udang vaname
L. vannamei dalam teknologi bioflok dan probiotik Pakan Udang
Protein : 40% (400 g/kg pakan), MR Protein : 6,25
N : Protein/6,25 (64 g/kg pakan)
1 kg pakan mengandung 64 gram N :
Dikonsumsi udang : 20%
Menjadi Limbah : 80% (De Schryver et al. 2008)
N limbah : 80 % x 64 gram : 51,2 gram
Jika C/N yang diinginkan adalah 10 : 1, maka :
(C pakan + C yang dibutuhkan) = 10 51,2 g
(C pakan + C yang dibutuhkan) = 10 x 51,2 g
C yang dibutuhkan = (10 x 51,2 g) – C pakan
Rumus : Cd = ( Y x N ) - Cs
Cd : C yang dibutuhkan
Y : C/N ratio yang dikehendaki N : limbah nitrogen
Cs : C Pakan (314,8 g/kg pakan)*
Molase
Kandungan C : 44,42 % *
Kebutuhan molasses : Md = Cd/Cm
29 Lampiran 2. Analisis statistik terhadap nilai THC udang vaname L. vannamei
setelah perlakuan (sebelum uji tantang) dengan teknologi bioflok dan probiotik
ANOVA
THC
Sum of Squares df Mean Square F Sig.
Between Groups 284.183 3 94.728 4.124 .017
Within Groups 551.306 24 22.971
Total 835.488 27
Duncana
Perlakuan N Subset for alpha = 0.05
1 2 K 7 19.9071 Pro + BFT 7 24.3586 24.3586 BFT 7 27.5657 Pro 7 27.7757 Sig. .095 .219
Lampiran 3. Analisis statistik terhadap nilai THC udang vaname L. vannamei setelah uji tantang dengan teknologi bioflok dan probiotik
ANOVA
THC
Sum of Squares df Mean Square F Sig.
Between Groups 957.953 4 239.488 5.983 .002
Within Groups 1000.628 25 40.025
Total 1958.581 29
Duncana
Perlakuan N
Subset for alpha = 0.05
1 2 K+ 6 8.6133 BFT 6 17.9550 Pro 6 18.2733 Pro + BFT 6 20.8650 K- 6 25.9900 Sig. 1.000 .053
30 Lampiran 4. Analisis statistik terhadap aktivitas phenoloxydase (PO) udang vaname L. vannamei setelah perlakuan (sebelum uji tantang) dengan teknologi bioflok dan probiotik
ANOVA
PO
Sum of Squares df Mean Square F Sig.
Between Groups .100 3 .033 1.635 .221
Within Groups .327 16 .020
Total .428 19
Duncana
Perlakuan N Subset for alpha = 0.05 1 K 5 .4588 Pro 5 .4996 BFT 5 .5272 Pro + BFT 5 .6488 Sig. .070
Lampiran 5. Analisis statistik terhadap nilai PO udang vaname L. vannamei setelah uji tantang dengan teknologi bioflok dan probiotik
ANOVA
PO
Sum of Squares df Mean Square F Sig.
Between Groups 1.232 4 .308 2.856 .045
Within Groups 2.695 25 .108
Total 3.927 29
Duncana
Perlakuan N Subset for alpha = 0.05
1 2 K+ 6 .3200 Pro 6 .5878 .5878 BFT 6 .5950 .5950 K- 6 .7857 Pro + BFT 6 .9173 Sig. .182 .123