BAB II
TINJAUAN PUSTAKA
2.1 Minuman Isotonik
Minuman isotonik merupakan minuman yang memiliki osmolaritas yang mirip dengan cairan tubuh (darah), sekitar 280 mOsm/kg H2O. Minuman isotonik
sering juga disebut sebagai sport drinks, carbohydrate-electrolite atau electrolite replacement drinks yang umumnya mengandung air, karbohidrat dan sejumlah kecil mineral (elektrolit) seperti natrium, kalium, klorida dan fosfat (Stofan dan Murray, 2001). Selain itu, juga ditambahkan flavoring agent yang berfungsi dalam memberikan dan memperbaiki cita rasa pada produk serta menambahkan bahan pengawet yang mencegah aktivitas mikroba, kapang, maupun khamir yang dapat menyebabkan kebusukan, fermentasi, pengasaman, maupun dekomposisi dalam bahan pangan (Koswara, 2009).
Menurut Stofan dan Murray (2001), minuman isotonik di formulasi untuk memberikan manfaat yang yang berarti dalam berbagai keadaan, seperti:
1. Merangsang penyerapan cairan dengan cepat 2. Asupan karbohidrat
3. Meningkatkan respon fisiologis 4. Mempercepat rehidrasi
2.2 Cairan dan Elektrolit
Hampir 70% dari tubuh kita adalah terdiri dari cairan. Kebutuhan cairan dan elektrolit adalah suatu proses dinamik karena metabolisme tubuh
membutuhkan perubahan yang tetap dalam berespons terhadap stressor fisiologis dan lingkungan. Dengan kemampuannya yang sangat besar untuk menyesuaikan diri, tubuh mempertahankan keseimbangan biasanya dengan proses-proses fisiologis yang terintegrasi mengakibatkan adanya lingkungan sel yang relatif konstan. Kemampuan tubuh untuk mempertahankan keseimbangan cairan ini dinamakan “homeostasis”. Menurut Wiarto (2013), kekurangan cairan tubuh dapat mengakibatkan hal-hal, seperti:
1. Metabolisme tubuh akan terganggu 2. Urine tidak dapat diproduksi 3. Kurang berkeringat
4. Volume darah berkurang 5. Suhu tubuh akan meningkat 6. Menyebabkan kelelahan
Elektrolit adalah substansi yang berupa ion kation dan anion. Tiga cairan elektrolit yang paling essensial adalah natrium, kalium dan kalsium. Kekurangan elektrolit dapat menimbulkan gejala-gejala yang serius, bahkan dapat menyebabkan pingsan. Faktor-faktor yang mengakibatkan kebutuhan cairan tubuh meningkat yaitu usia, temperatur lingkungan, aktifitas, diet dan sakit (Wiarto, 2013).
2.3 Bahan Tambahan Pangan 2.3.1 Bahan Pengawet
Bahan pengawet adalah bahan tambahan pangan yang dapat mencegah atau menghambat fermentasi, pengasaman atau penguraian dan perusakan lainnya
terhadap pangan yang disebabkan oleh mikroorganisme. Kerusakan tersebut dapat disebabkan oleh fungi, bakteria dan mikroba lainnya (Afrianti, 2010).
Tanpa bahan tambahan pangan, khususnya bahan pengawet maka bahan pangan yang tersedia di pasar atau swalayan akan menjadi kurang menarik, tidak dapat dinikmati secara layak dan tidak awet (Cahyadi, 2012).
Pengawet makanan dibedakan menjadi tiga jenis, yaitu pertama, GRAS (Generally Recognized as Safe), yang biasanya bersifat alami sehingga tidak menimbulkan efek racun pada tubuh. Kedua, pengawet yang ditentukan pemakaiannya oleh ADI (Acceptable Daily Intake), yang disesuaikan dengan batas penggunaan hariannya untuk kesehatan konsumen. Ketiga, zat pengawet yang tidak layak dikonsumi sama sekali (Afrianti, 2010).
Berdasarkan bahan asalnya maka bahan pengawet dibagi menjadi dua jenis, yaitu bahan pengawet organik dan bahan pengawet anorganik (Cahyadi, 2012).
2.3.1.1 Bahan Pengawet Organik
Zat pengawet organik lebih banyak digunakan daripada zat pengawet anorganik karena bahan ini lebih mudah larut. Bahan organik digunakan baik dalam bentuk asam maupun dalam bentuk garamnya. Zat kimia yang sering digunakan sebagai bahan pengawet adalah asam sorbat, asam propionat, asam benzoat, asam asetat dan epoksida (Cahyadi, 2012).
2.3.1.2 Bahan Pengawet Anorganik
Zat pengawet anorganik yang masih sering dipakai adalah sulfit, hidrogen peroksida, nitrat dan nitrit. Sulfit digunakan dalam bentuk gas SO2, garam Na atau
pada proses curing daging untuk memperoleh warna yang baik dan mencegah pertumbuhan mikroba. Selain digunakan pada produk daging, nitrat dan nitrit juga digunakan pada ikan dan keju (Cahyadi, 2012).
2.3.2 Pengatur Keasaman
Pengatur keasaman (asidulan) merupakan senyawa kimia yang bersifat asam dan merupakan salah satu dari bahan tambahan pangan yang sengaja ditambahkan ke dalam pangan dengan berbagai tujuan. Penggunaan pengatur keasaman di dalam pangan, yaitu untuk memperoleh rasa asam yang tajam, sebagai pengontrol pH atau sebagai bahan pengawet (Cahyadi, 2012).
Keadaan yang bersifat asam mudah dicapai dengan penambahan asam. Dari sejumlah pengatur keasaman pada umumnya terdapat delapan jenis asam organik yang lebih sering digunakan untuk memperoleh/ memberikan rasa asam pada bahan pangan, diantaranya adalah asam sitrat, asam asetat, asam laktat, asam fumarat, asam malat, asam suksinat, asam tartrat dan asam fosfat (Cahyadi, 2012).
Menurut Peraturan Menteri Kesehatan Republik Indonesia No.722/Menkes/Per/IX/88 bahwa yang dimaksud dengan pengatur keasaman adalah bahan tambahan pangan yang dapat mengasamkan, menetralkan dan mempertahankan derajat keasaman. Salah satu tujuan utama penambahan asam pada bahan pangan adalah untuk memberikan rasa asam. Unsur yang menyebabkan rasa asam adalah ion H+ atau ion hidrogenium H3O+ (Cahyadi,
2.4 Natrium Benzoat 2.4.1 Sifat Fisikokimia
Menurut Ditjen POM (1995), sifat fisikokimia natrium benzoat adalah sebagai berikut:
Rumus struktur :
Rumus Molekul : C7H5NaO2
Berat Molekul : 144,12
Nama Kimia : Natrium benzoat
Kandungan : Tidak kurang dari 99,5% dan tidak lebih dari 100,5% C7H5NaO2, dihitung terhadap zat anhidrat.
Pemerian : Granul atau serbuk hablur; putih; tidak berbau atau praktis tidak berbau; stabil di udara.
Kelarutan : Mudah larut dalam air; agak sukar larut dalam etanol, dan lebih mudah larut dalam etanol 90%.
2.4.2 Aktivitas
Aktivitas asam benzoat dan garamnya sebagai anti mikroorganisme tergantung pada pH, karena pH sangat menentukan jumlah asam yang terdisosiasi. Pada pH 2,19 asam yang tidak terdisosiasi adalah 99%, pada pH 4,2 asam yang tidak terdisosiasi adalah 50%. Natrium benzoat sebagai anti mikroorganisme berperan dalam menggangu permeabilitas membran sel (Afrianti, 2010). Asam
benzoat dan garamnya (Na dan K) relatif kurang efektif sebagai bahan pengawet pada pH lebih besar, tetapi kerjanya sebagai pengawet akan naik dengan turunnya pH sampai di bawah pH 5 (Cahyadi, 2012). Penggunaan asam benzoat dalam sediaan obat luar sering dikombinasikan dengan asam salisilat yang memiliki kerja fungistatis maupun bakteriostatis (Tan dan Rahardja, 2007).
2.5 Asam Sitrat
2.5.1 Sifat Fisikokimia
Menurut Ditjen POM (1995), sifat fisikokimia asam sitrat adalah sebagai berikut:
Rumus struktur :
Rumus Molekul : C6H8O7
Berat Molekul : 192,12 Nama Kimia : Asam sitrat
Kandungan : Tidak kurang dari 99,5% dan tidak lebih dari 100,5% C6H8O7, dihitung terhadap zat anhidrat.
Pemerian : Hablur bening; tidak berwarna atau serbuk hablur granul sampai halus, putih; tidak berbau atau praktis tidak berbau; rasa sangat asam.
Kelarutan : Sangat mudah larut dalam air; mudah larut dalam etanol, agak sukar larut dalam eter.
2.5.2 Aktivitas
Asam sitrat termasuk dalam kelompok pengasaman jika ditinjau dari fungsi pengatur keasaman (Cahyadi, 2012). Penambahan asam sitrat akan menurunkan pH larutan menjadi pH asam sehingga dapat meningkatkan proporsi asam yang tidak terdisosiasi yang berperan dalam pengawetan (Afrianti, 2010).
2.6 Spektrofotometri Ultraviolet
Spektrofotometer ultraviolet adalah alat yang digunakan dalam pengukuran panjang gelombang dan intensitas sinar ultraviolet yang diabsorpsi oleh sampel. Sinar ultraviolet memiliki energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi (Dachriyanus, 2004).
Radiasi ultraviolet diabsorpsi oleh molekul organik aromatik, molekul yang mengandung elektron-π terkonjugasi dan/ atau atom yang mengandung elektron-n, menyebabkan transisi elektron di orbit terluarnya dari tingkat energi elektron dasar ke tingkat energi tereksitasi lebih tinggi (Satiadarma, 2004).
Bagian molekul yang bertanggung jawab terhadap penyerapan cahaya disebut kromofor dan terdiri atas ikatan rangkap dua atau rangkap tiga, terutama jika ikatan rangkap tersebut terkonjugasi. Semakin panjang ikatan rangkap dua atau rangkap tiga terkonjugasi di dalam molekul, molekul tersebut akan lebih mudah menyerap cahaya (Cairns, 2009). Pada molekul organik dikenal pula istilah auksokrom yang merupakan gugus fungsional yang mempunyai elektron bebas, seperti: -OH, -O, -NH2 dan –OCH3, yang memberikan transisi nπ*. Terikatnya
gugus auksokrom pada gugus kromofor akan mengakibatkan pergeseran pita absorpsi menuju ke panjang gelombang yang lebih besar (pergeseran merah atau
pergeseran batokromik) disertai dengan peningkatan intensitas (efek hiperkromik) (Rohman, 2007).
2.6.1 Hukum Lambert-Beer
Hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan (Rohman, 2007). Menurut Denney dan Sinclair (1991), dalam hukum Lambert-Beer terdapat beberapa pembatasan, yaitu:
1. Larutan yang menyerap cahaya adalah campuran yang homogen 2. Menggunakan sinar monokromatis
3. Rendahnya konsentrasi dari senyawa yang menyerap cahaya
Hukum Lambert-Beer umumnya dikenal dengan persamaan sebagai berikut: A = abc
Dimana: A= absorbansi a = absorptivitas b = tebal kuvet (cm) c = konsentrasi
Absorptivitas (a) merupakan suatu konstanta yang tidak tergantung pada konsentrasi, tebal kuvet dan intensitas radiasi yang mengenai larutan sampel. Absorptivitas tergantung pada suhu, pelarut, struktur molekul dan panjang gelombang radiasi. Satuan a ditentukan oleh satuan b dan c (Rohman, 2007).
2.6.2 Kegunaan Spektrofotometri Ultraviolet
Menurut Dachriyanus (2004), pada umumnya spektrofotometri ultraviolet dalam analisis senyawa organik digunakan untuk:
1. Menentukan jenis kromofor, ikatan rangkap yang terkonjugasi dan auksokrom dari senyawa organik
2. Menjelaskan informasi dari struktur berdasarkan panjang gelombang maksimum suatu senyawa
3. Mampu menganalisis senyawa organik secara kuantitatif dengan menggunakan hukum Lambert-Beer
2.6.2.1 Analisis Kualitatif
Kegunaan spektrofotometri ultraviolet dalam analisis kualitatif sangat terbatas karena rentang daerah radiasi yang relatif sempit hanya dapat mengakomodasi sedikit sekali puncak absorpsi maksimum dan minimum, karena itu identifikasi senyawa yang tidak diketahui tidak memungkinkan untuk dilakukan (Satiadarma, dkk, 2004).
Akan tetapi, jika digabung dengan cara lain seperti spektroskopi inframerah, resonansi magnet inti dan spektroskopi massa, maka dapat digunakan untuk identifikasi atau analisis kualitatif senyawa tersebut (Rohman, 2007).
2.6.2.2 Analisis Kuantitatif
Penggunaan utama spetrofotometri ultraviolet adalah dalam analisis kuantitatif. Apabila dalam alur radiasi spektrofotometer terdapat senyawa yang mengabsorpsi radiasi, maka akan terjadi pengurangan kekuatan radiasi yang mencapai detektor. Parameter kekuatan energi radiasi khas yang diabsorpsi oleh molekul adalah absorbansi (A) yang dalam batas konsentrasi rendah nilainya sebanding dengan banyaknya molekul yang mengabsorpsi radiasi dan merupakan dasar analisis kuantiatif. Penentuan kadar senyawa organik yang mempunyai
struktur kromofor atau mengandung gugus kromofor, serta mengabsorpsi radiasi ultraviolet penggunaanya cukup luas (Satiadarma, dkk, 2004).
Analisis kuantitatif dengan metode spektrofotometri ultraviolet dapat digolongkan menjadi analisis zat tunggal atau analisis satu komponen dan analisis kuantitatif dua macam zat atau lebih (analisis multikomponen).
1. Analisis kuantitatif zat tunggal (analisis satu komponen)
Terdapat dua metode penggunan pengukuran spektofotometri dalam analisis senyawa, yaitu metode penetapan kadar absolut dan komparatif. Metode penetapan kadar komparatif lebih disukai. Pada jenis penetapan kadar ini, larutan standar obat yang akan dianalisis disiapkan, serapan sampel dan standar ditentukan pada kondisi yang sama (Cairns, 2009), dimana menurut Holme dan Hazel (1983), konsentrasi sampel dihitung dengan rumus sebagai berikut:
Ct
Cs At As =
Keterangan: As = Absorbansi baku pembanding At = Absorbansi sampel
Cs = Konsentrasi baku pembanding Ct = Konsentrasi sampel
2. Analisis kuantitatif dua macam zat atau lebih (analisis multikomponen) Analisis dua atau lebih bahan kadang-kadang ditentukan secara simultan dalam sekali pengamatan tanpa dipisahkan. Hal ini didasarkan pada asumsi bahwa absorbansi total dari campuran komponen merupakan jumlah serapan masing-masing komponen tersebut. Menurut Day dan Underwood
(2002), ada tiga kemungkinan analisis campuran dua komponen atau lebih, yaitu:
a. Spektrum tanpa tumpang tindih (overlap)
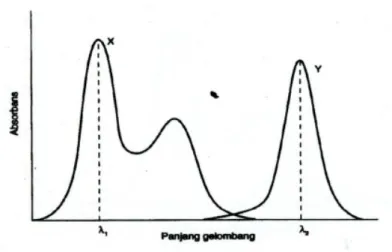
Spektrum tidak saling tumpang tindih memungkinkan untuk menemukan suatu panjang gelombang dimana X menyerap dan Y tidak menyerap, serta panjang gelombang serapan maksimum dimana Y menyerap dan X tidak menyerap (Gambar 1). Komponen X dan Y masing-masing diukur pada λ1 dan λ2.
Gambar 1. Spektrum absorpsi senyawa X dan Y (tidak terjadi
tumpang tindih pada kedua panjang gelombang yang digunakan)
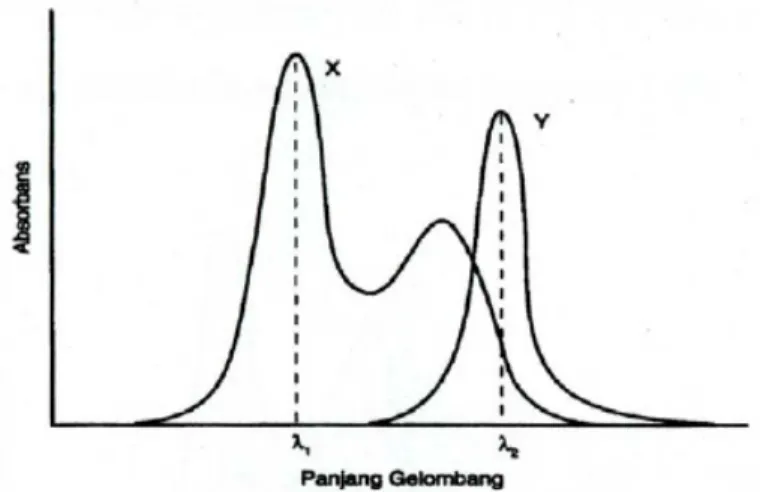
b. Spektrum tumpang tindih satu arah
Spektrum dari X dan Y tumpang tindih satu arah (Gambar 2). Y tidak mengganggu pengukuran X pada λ1 tetapi X menyerap cukup banyak bersama-sama dengan Y pada λ2. Pemecahan masalah ini pada prinsipnya cukup sederhana. Konsentrasi X ditetapkan langsung dari serapan larutan pada λ1. Kemudian serapan yang diberikan oleh konsentrasi X pada λ2 dihitung dari absorptivitas molar X pada λ2
yang sebelumnya telah diketahui. Serapan ini dikurangkan dari serapan terukur larutan pada λ2 sehingga diperoleh serapan yang disebabkan oleh komponen Y. Kemudian konsentrasi Y dapat dihitung dengan cara yang biasa.
Gambar 2. Spektrum absorpsi senyawa X dan Y (tumpang tindih satu
arah; X dapat diukur tanpa gangguan Y, tetapi X mengganggu pada pengukuran langsung dari Y)
c. Spektrum tumpang tindih dua arah
Spektrum dari X dan Y saling tumpang tindih dua arah (Gambar 3), pada keadaan ini tidak ada panjang gelombang serapan maksimum dimana X dan Y menyerap tanpa gangguan. Maka perlu penyelesaian dua persamaan dengan dua variabel yang tidak diketahui. Hal ini karena serapan total dari campuran beberapa komponen merupakan jumlah serapan masing-masing komponen tersebut. Sehingga, konsentrasi X dan Y yang belum diketahui dalam kedua persamaan dapat diukur dengan mudah.
Gambar 3. Spektrum absorpsi senyawa X dan Y (tumpang tindih dua
arah. Tidak ada panjang gelombang dimana masing-masing senyawa dapat diukur tanpa mengalami gangguan oleh yang lainnya)
2.7 Validasi Metode
Validasi adalah suatu tindakan penilaian terhadap parameter tertentu pada prosedur penetapan yang dipakai untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Suatu metode analisis harus divalidasi untuk melakukan verifikasi bahwa parameter-parameter kerjanya cukup mampu untuk mengatasi masalah analisis dan untuk menjamin bahwa metode analisis akurat, spesifik, reprodusibel dan tahan pada kisaran analit yang dianalisis (Rohman, 2007).
Validasi metode analisis dilakukan dengan uji laboratorium, dengan demikian dapat ditunjukkan bahwa karakteristik kinerjanya telah memenuhi persyaratan untuk diterapkan dalam analisis senyawa atau sediaan yang bersangkutan (Satiadarma, dkk, 2004). Parameter analisis yang ditentukan pada
validasi adalah akurasi, presisi, spesifisitas, limit deteksi, limit kuantitasi, kelinieran dan rentang (Rohman, 2007).
Akurasi (kecermatan) adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit sebenarnya. Akurasi dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan dan dapat ditentukan melalui dua cara yaitu metode simulasi (spiked placebo recovery) dan metode penambahan bahan baku (standard addition method). Dalam metode simulasi, sejumlah analit bahan murni (senyawa pembanding kimia) ditambahkan kedalam campuran bahan sediaan farmasi (plasebo), lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar standar yang ditambahkan (kadar sebenarnya). Dalam metode adisi (penambahan bahan baku), sejumlah sampel yang dianalisis ditambah analit dengan konsentrasi tertentu (biasanya 80% sampai 120% dari kadar analit yang diperkirakan), dicampur dan dianalisis kembali. Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya (hasil yang diharapkan). Dalam kedua metode tersebut, persen perolehan kembali dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya (Harmita, 2004):
% Perolehan Kembali = CF- CA
CA* ×100%
Keterangan: CF = Kadar sampel setelah penambahan larutan baku
CA = Kadar sampel sebelum penambahan larutan baku
C A * = Kadar larutan baku yang ditambahkan
Presisi adalah derajat kesesuaian di antara masing-masing hasil uji, jika prosedur analisis ditetapkan berulang kali pada sejumlah cuplikan yang diambil dari satu sampel homogen. Presisi dinyatakan sebagai deviasi standar atau deviasi
standar relatif. Presisi dapat diartikan pula sebagai reprodusibilitas (reproducibility) atau keterulangan (repeatability) dari prosedur analisis pada kondisi kerja normal (Satiadarma, dkk, 2004). Parameter-parameter seperti standar deviasi, simpangan baku relatif dan derajat kepercayaan haruslah dikalkulasi untuk mendapatkan tingkat presisi tertentu. Nilai RSD dinyatakan memenuhi persyaratan jika < 10 - 20% (Ermer dan Miller, 2005).
Simpangan baku relatif (RSD) = ×100%
X SD
Batas deteksi adalah nilai parameter, yaitu konsentrasi analit terendah yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko (Harmita, 2004). Batas deteksi merupakan batas uji yang secara spesifik menyatakan apakah analit yang dianalisis berada di atas atau di bawah nilai tertentu (Rohman, 2007). Menurut Harmita (2004), batas deteksi dapat dihitung dengan rumus sebagai berikut:
Batas deteksi (LOD) =
slope SB x 3
Batas kuantitasi adalah jumlah analit terkecil dalam sampel yang masih dapat diukur dalam kondisi percobaan yang sama dan memenuhi kriteria ceermat dan seksama (Harmita, 2004).
Batas kuantitasi (LOQ) =
slope SB x 10
Kelinieran suatu metode analisis adalah kemampuan untuk menunjukkan bahwa nilai hasil uji langsung atau setelah diolah secara matematika, proporsional dengan konsentrasi analit dalam sampel dalam batas rentang konsentrasi tertentu (Satiadarma, dkk, 2004). Linieritas dapat diukur dengan melakukan pengukuran
tunggal pada konsentrasi yang berbeda-beda. Data yang diperoleh selanjutnya diproses untuk selanjutnya dapat ditentukan nilai kemiringan (slope), intersep dan koefisien korelasinya (Rohman, 2007).