ULANGAN HARIAN
Mata Pelajaran
: KIMIA
Kelas / Semester
: XII
–
IPA / Satu
Kurikulum
: Tingkat Satuan Pendidikan (KTSP)
Alokasi Waktu
: 90 Menit
Jumlah Soal
: 20 Pilihan Ganda (PG) dan 5 Soal
Uraian
Standar Kompetensi : Menerapkan konsep reaksi oksidasi
reduksi dan elektrokimia dalam
kehidupan sehari-hari
(Tugas Mata Kuliah Evaluasi dan Supervisi Pendidikan IPA)
Dosen Pengampu :
Dr. Ani Rusilawati, M.Pd.
Disusun oleh :
SUPRIYANTO
NIM : 0402510082
PROGRAM PASCA SARJANA
PROGRAM STUDI PENDIDIKAN IPA (KIMIA) UNIVERSITAS NEGERI SEMARANG (UNNES)
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 1
Kartu Soal Uraian ... 24
Soal Ulangan Harian ... 29
Rekapitulasi Jawaban Ulangan Harian : Pilihan Ganda ... 34
Hasil Analisis Soal Pilihan Ganda
Reliabilitas Tes ... 38
Kelompok Unggul & Asor... 39
Daya Pembeda ... 42
Tingkat Kesukaran ... 42
Korelasi Skor Butir dengan Skor Total ... 43
Kualitas Pengecoh ... 44
Rekap Analisis Butir ... 44
Rekapitulasi Jawaban Ulangan Harian : Uraian ... 45
Hasil Analisis Soal Uraian
Reliabilitas Tes Soal Uraian ... 48
Kelompok Unggul & Asor Soal Uraian ... 49
Daya Pembeda Soal Uraian ... 50
Tingkat Kesukaran Soal Uraian ... 50
Korelasi Skor Butir dengan Skor Total Soal Uraian ... 51
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 2
Alokasi Waktu : 90 Menit
Jumlah Soal : 20 Pilihan Ganda (PG) dan 5 Soal Uraian
Standar Kompetensi : Menerapkan konsep reaksi oksidasi reduksi dan
elektrokimia dalam kehidupan sehari-hari
Kompetensi Dasar
Materi
Kelas /
Sem
Indikator
Bentuk Soal
Nomor
Soal
1.
Menerapkan konsep reaksi
oksidasi
–
reduksi dalam
sistem
elektrokimia
yang
melibatkan energi listrik dan
kegunaannya
dalam
senyawa, siswa dapat menyebutkan
masing-masing bilangan oksidasinya
Diberikan suatu persamaan reaksi redoks ,
siswa dapat menentukan zat yang bertindak
sebagai oksidator
Diberikan suatu persamaan reaksi redoks ,
siswa dapat menyetarakan persamaan
reaksi tersebut dengan benar
Jika diberikan 5 contoh persamaan reaksi,
siswa dapat menentukan persamaan reaksi
redoks
dapat memilih bagian-bagian sel yang paling
tepat untuk reaksi tersebut
Pilihan Ganda
Pilihan Ganda
6
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 3
reaksi tersebut
Diberikan data potensial reduksi standar,
siswa dapat menuliskan diagram sel / Notasi
sel
Diberikan data potensial reduksi standar,
siswa dapat menentukan persamaan reaksi
yang berlangsung spontan.
Diberikan data potensial reduksi standar,
siswa dapat menentukan reaksi sel yang
menghasilkan beda potensial paling besar.
Pilihan Ganda
Diberikan data E
osel beberapa logam , siswa
dapat memilih logam yang paling baik
digunakan sebagai pelindung korosi
Diberikan empat data percobaan peristiwa
korosi , siswa dapat menentukan faktor yang
menyebabkan terjadinya korosi
2.
Menjelaskan reaksi oksidasi
–
reduksi dalam elektrolisis
Sel Elektrolisis
XII.IPA /
Satu
Siswa dapat menentukan reaksi yang terjadi
pada katoda dari suatu larutan yang
dielektrolisis.
Siswa dapat menentukan reaksi yang terjadi
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 4
Siswa dapat menghitung massa zat yang
dihasilkan di katoda pada suatu proses
elektrolisis , jika parameternya diketahui
Diberikan suatu proses elektrolisis yang
dipasang secara seri, jika parameter salah
satu seri diketahui maka siswa dapat
menghitung mass zat yang dihasilkan pada
seri yang lain
Pilihan Ganda
Pilihan Ganda
19
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 5
Menerapkan konsep reaksi oksidasi reduksi dan elektrokimia dalam kehidupan sehari-hari
Bilangan oksidasi unsur K, Cr, dan O dalam senyawa K
2Cr
2O
7berturut - turut
adalah….
A.
+2 , +12 , -14
B.
+2 , +12 , - 2
C.
+2 , +6 , - 2
D.
+ 1 , +6 , - 2
E.
+1 , +6 , - 1
Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Penyetaraan Reaksi Redoks
Indikator Soal :
Diberikan suatu rumus molekul suatu senyawa, siswa dapat menyebutkan masing-masing bilangan oksidasinya
Buku Sumber : Nomor Soal : 1 Kunci Jawaban : D
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 6
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
Reaksi redoks berikut :
a MnO
2(s) + b PbO
2(s) + 8 HCl
c KMnO
4(aq) + d PbCl
2(s) + e H
2O (l).
Zat oksidator adalah ……..
A.
PbO
2B.
MnO
2C.
HCl
D.
KMnO
4E.
PbCl
2Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Penyetaraan Reaksi Redoks
Indikator Soal :
Diberikan suatu persamaan reaksi
redoks , siswa dapat menentukan zat yang bertindak sebagai oksidator
Buku Sumber : Nomor Soal : 2 Kunci Jawaban : A
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 7
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
Gas klorin dapat dibuat dengan mereaksikan asam klorida pekat dengan KMnO
4
.Dengan
persamaan reaksi :
a KMnO
4(aq) + b HCl (aq)
→
c MnCl
2(aq) + d Cl
2(g) + e KCl(aq) + f H
2O(l)
Nilai a dan d yang tepat adalah ....
A.
2 dan 5
B.
2 dan 1
C.
2 dan 8
D.
2 dan 2
E.
2 dan 16
Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Penyetaraan Reaksi Redoks
Indikator Soal :
Diberikan suatu persamaan reaksi
redoks , siswa dapat menyetarakan persamaan reaksi tersebut dengan benar
Buku Sumber : Nomor Soal : 3 Kunci Jawaban : A
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 8
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
Reaksi redoks berlangsung karena serah terima elektron. Jumlah elektron yang diterima pada
reaksi reduksi sama dengan jumlah elektron yang dibebaskan pada reaksi oksidasi. Diantara
lima reaksi dibawah ini, yang merupakan reaksi redoks adalah ….
A.
MnO
2(s) + 4 HCl (aq)
MnCl
2(aq) + 2 H
2O (l) + Cl
2(g)
B.
NaCl (aq) + H
2O (l)
NaOH (aq) + HCl (aq)
C.
CaSO
4(aq) + 2 NaOH (aq)
Na
2SO
4(aq) + Ca(OH)
2(s)
D.
BaCl
2(aq) + H
2SO
4(aq)
BaSO
4(s) + 2 HCl (aq)
E.
CaCO
3(s) + 2HCl (aq)
CaCl
2(aq) + H
2O (l) + CO
2(g)
Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Penyetaraan Reaksi Redoks
Indikator Soal :
Jika diberikan 5 contoh persamaan
reaksi, siswa dapat menentukan
persamaan reaksi yang tergolong reaksi redoks
Buku Sumber : Nomor Soal : 4 Kunci Jawaban : A
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 9
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
Yang bukan reaksi redoks di bawah ini adalah...
A.
SnCl
2+ I
2+ 2HCl
SnCl
4+ 2HI
B.
H
2+ Cl
2
2HCl
C.
Cu
2O + C
2Cu + CO
D.
CuO + 2HCl
CuCl
2+ H
2O
E.
MnO
2+ 4HCl
MnCl
2+ 2H
2O + Cl
2Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Penyetaraan Reaksi Redoks
Indikator Soal :
Jika diberikan 5 contoh persamaan
reaksi, siswa dapat menentukan
persamaan reaksi yang tergolong reaksi redoks
Buku Sumber : Nomor Soal : 5 Kunci Jawaban : D
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 10
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
Perhatikan rangkaian sel volta sebagai berikut:
Cu
2++ 2 e
Cu E
0= + 0,34 Volt
Ni
2++ 2 e
Ni E
0= - 0,25 Volt
Pernyataan yang tepat adalah ....
A.
Cu sebagai anode
B.
Ni sebagai katode
C.
Cu sebagai katode
D.
Ni mengalami reaksi reduksi
E.
reaksi tidak spontan
Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Sel Volta
Indikator Soal :
Diberikan suatu rangkaian sel volta, siswa dapat memilih bagian-bagian sel yang paling tepat untuk reaksi tersebut
Buku Sumber : Nomor Soal : 6 Kunci Jawaban : C
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 11
Menerapkan konsep reaksi oksidasi reduksi dan elektrokimia dalam kehidupan sehari-hari
Reaksi redoks dapat berlangsung spontan dengan membebaskan energi. Reaksi redoks yang
menghasilkan energi listrik terdapat pada sel Galvani atau sel Volta. Diketahui data potensial
reduksi standar.
Ca
2+(aq) + 2e
Ca (s) E
0= - 2,87 volt
Al
3+(aq) + 3e
Al (s)
E
0= - 1,66 volt
Besarnya harga potensial sel pada reaksi :
3 Ca (s) + 2 Al
3+(aq)
3 Ca
2+(aq) + 2 Al (s) adalah ….
A. + 1,21 volt
B.
–
11,9 volt
C.
–
4,53 volt
D. + 5,26 volt
E. + 11,9 volt
Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Sel Volta
Indikator Soal :
Diberikan data potensial reduksi standar, siswa dapat menentukan harga potensial sel dari persamaan reaksi.
Buku Sumber : Nomor Soal : 7 Kunci Jawaban : A
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 12
Menerapkan konsep reaksi oksidasi reduksi dan elektrokimia dalam kehidupan sehari-hari
Gambar sel volta disamping ini digunakan untuk menjawab soal no 8 dan 9
Diketahui harga potensial reduksi standart berikut:
Mg
2++ 2e
→
Mg E
0= - 2,37 Volt
Zn
2++ 2e
→
Zn
E
0= - 0,76 Volt
Berdasarkan gambar rangkaian sel volta , diagram sel
yang paling tepat adalah . . .
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Sel Volta
Indikator Soal :
Diberikan suatu rangkaian sel volta,
Siswa dapat memilih diagram sel yang paling tepat untuk reaksi tersebut
Siswa dapat menghitung harga potensial sel untuk reaksi tersebut
Buku Sumber : Nomor Soal : 8 Kunci Jawaban : C
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 13
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
Berdasarkan gambar di atas, harga potensial sel adalah . . . .
A.
- 3,14 Volt
B.
–
1,54 Volt
C.
+ 3,94 Volt
D.
+ 1,61 Volt
E.
+ 1,54 Volt
Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Sel Volta
Indikator Soal :
Diberikan suatu rangkaian sel volta,
Siswa dapat memilih diagram sel yang paling tepat untuk reaksi tersebut
Siswa dapat menghitung harga potensial sel untuk reaksi tersebut
Buku Sumber : Nomor Soal : 9 Kunci Jawaban : D
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 14
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
Diketahui :
Cu
2+(aq) + 2e
⇄
Cu (s) E
o= + 0,34 Volt
Cr
3+(aq) + 3e
⇄
Cr (s) E
o= - 0,74 Volt
Diagram sel reaksi tersebut adalah….
A.
Cu
Cu
2+
Cr
3+l Cr
B.
Cu
2+
Cu
3+
Cr
Cu
C.
Cr
3+
Cr
Cu
Cu
2+D.
Cr
Cr
3+
Cu
2+
Cu
E.
Cr
3+Cu
Cr
Cu
2+Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Sel Volta
Indikator Soal :
Diberikan data potensial reduksi standar, siswa dapat menuliskan diagram sel / Notasi sel
Buku Sumber : Nomor Soal : 10 Kunci Jawaban : D
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 15
Menerapkan konsep reaksi oksidasi reduksi dan elektrokimia dalam kehidupan sehari-hari
Diketahui harga potensial reduksi untuk:
Cu
2+(aq) + 2e
→
Cu (s) E
o= + 0,35 volt
I
2(s) + 2e
→
2I
-(aq)
E
o= + 0,54 volt
Fe
3+(aq) + e
→
Fe
2+(aq) E
o= + 0,77 volt
Br
2(l) + e
→
2 Br
-(aq)
E
o= + 1,07 volt
Reaksi berikut yang tidak dapat berlangsung spontan adalah...
A.
Fe
3+(aq) + 2I
-(aq)
→
Fe
2+(aq) + I
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Sel Volta
Indikator Soal :
Diberikan data potensial reduksi standar, siswa dapat menentukan persamaan reaksi
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 16
Menerapkan konsep reaksi oksidasi reduksi dan elektrokimia dalam kehidupan sehari-hari
Diketahui beberapa potensial elektrode standar :
Zn
2+/ Zn =
-
0,76 volt
Pb
2+/ Pb =
-
0,13 volt
Ni
2+/Ni =
-
0,25 volt
Mg
2+/Mg =
-
2,37 volt
Pasangan sel volta yang memberikan harga beda potensial terbesar
adalah….
A.
Zn/ Zn
2+// Pb
2+/Pb
B.
Zn/ Zn
2+// Ni
2+/Ni
C.
Ni/ Ni
2+// Pb
2+/Pb
D.
Mg/ Mg
2+// Pb
2+/Pb
E.
Pb/Pb
2+// Mg
2+/Mg
Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Sel Volta
Indikator Soal :
Diberikan data potensial reduksi standar, siswa dapat menentukan reaksi sel yang menghasilkan beda potensial paling besar.
Buku Sumber : Nomor Soal : 12 Kunci Jawaban : D
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 17
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari Potensial standard(E
o) dari berbagai zat berikut:
1. Fe2+ + 2 e → Fe Eo = -0,44 volt
2. Mg2+ + 2 e → Mg Eo = -2,37 volt
3. Co2+ + 2 e → Co Eo = -0,28 volt
4. Cu2+ + 2 e → Cu Eo = +0,34 volt
5. Ni2+ + 2 e → Ni Eo = -0,25 volt
Logam yang dapat melindungi logam besi adalah…..
A. Magnesium
B. Besi
C. Cobalt
D. Tembaga
E. Nikel
Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Korosi
Indikator Soal :
Diberikan data E0 sel beberapa logam ,
siswa dapat memilih logam yang paling baik digunakan sebagai pelindung korosi
Buku Sumber : Nomor Soal : 13 Kunci Jawaban : A
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 18
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
Diketahui potensial elektrode standar ( Eo ) dari beberapa logam sebagai berikut :
Zn = -0,76 volt Fe = -0,44 volt
Ni = -0,28 volt Sn = -0,14 volt
Cu = +0,34 volt
Logam yang tepat digunakan untuk melindungi besi dari korosi dengan perlindungan katode
adalah ...
A.
Fe
B.
Ni
C.
Sn
D.
Cu
E.
Zn
Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Korosi
Indikator Soal :
Diberikan data E0 sel beberapa logam ,
siswa dapat memilih logam yang paling baik digunakan sebagai pelindung korosi
Buku Sumber : Nomor Soal : 14 Kunci Jawaban : E
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 19
Menerapkan konsep reaksi oksidasi reduksi dan elektrokimia dalam kehidupan sehari-hari
Dari hasil percobaan tentang korosi besi sebagai berikut:
Berdasarkan percobaan diatas, korosi besi
memerlukan….
A.
Oksigen
B.
Oksigen dan air
C.
Air
D.
Oksigen dan minyak
E.
Oksigen dan kalsium klorida
Kompetensi Dasar :
Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi :
Korosi
Indikator Soal :
Diberikan empat data percobaan
peristiwa korosi , siswa dapat
menentukan faktor yang menyebabkan terjadinya korosi
Buku Sumber : Nomor Soal : 15 Kunci Jawaban : B
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 20
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
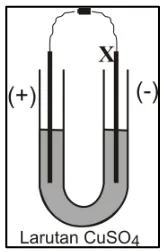
Proses elektrolisis merupakan reaksi redoks yang tidak
spontan, dan memerlukan energi. Energi yang digunakan
pada proses elektrolisis berasal dari arus listrik searah.
Jika yang dielektrolisis larutan CuSO
4seperti terlihat pada
gambar, maka reaksi yang berlangsung pada elektroda X
adalah….
Siswa dapat menentukan reaksi yang terjadi pada katoda dari suatu larutan
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 21
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
Elektrolisis zat manakah yang menghasilkan gas hidrogen di anoda?
A.
NH
3(l)
B.
Na
2SO
4(aq)
C.
NaH (l)
D.
HCl (aq)
E.
KHSO
4(aq)
Kompetensi Dasar :
Menjelaskan reaksi oksidasi – reduksi dalam elektrolisis
Materi :
Sel Elektrolisis
Indikator Soal :
Siswa dapat menentukan reaksi yang terjadi pada anoda dari suatu larutan yang dielektrolisis.
Buku Sumber : Nomor Soal : 17 Kunci Jawaban : C
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 22
Menerapkan konsep reaksi oksidasi reduksi dan elektrokimia dalam kehidupan sehari-hari
Sebanyak 1 liter larutan NiCl
21 M dielektrolisis menggunakan elektroda karbon dengan arus sebesar
10 ampere selama 30 menit. Massa Nikel yang mengendap di katoda adalah … (
Ar Ni=59 )
Menerapkan hukum Faraday untuk elektrolisis larutan elektrolit
Materi :
Hukum Faraday
Indikator Soal :
Siswa dapat menghitung massa zat yang dihasilkan di katoda pada suatu proses elektrolisis , jika parameternya diketahui
Buku Sumber : Nomor Soal : 18 Kunci Jawaban : E
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 23
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
Arus sebesr 40 ampere dilewatkan ke dalam larutan tembaga (II) sulfat selama 965 detik, volume
gas terbentuk diukur pada keadaan suhu 25
oC, dan tekanan
1 atmosfir adalah…
(R = 0,082
L/atm
oK)
A.
2,44 liter
B.
9,77 liter
C.
2,24 liter
D.
4,89 liter
E.
8,86 liter
Kompetensi Dasar :
Menerapkan hukum Faraday untuk elektrolisis larutan elektrolit
Materi :
Hukum Faraday
Indikator Soal :
Siswa dapat menghitung volume zat yang dihasilkan di katoda pada suatu proses elektrolisis , jika parameternya diketahui
Buku Sumber : Nomor Soal : 19 Kunci Jawaban : B
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 24
Menerapkan konsep reaksi oksidasi reduksi
dan elektrokimia dalam kehidupan sehari-hari
Sejumlah arus listrik dipasang seri dalam 2 jenis larutan
dalam wadah yang berbeda, seperti gambar disamping.
Jika dalam wadah 1 dihasilkan 54 gram perak (Ar Ag = 108
dan Ar Cu = 63,5 ) maka massa Cu dalam wadah 2
dihasilkan adalah …gram
A.
31,75
B.
15,90
C.
54,00
D.
91,84
E.
183,68
Kompetensi Dasar :
Menerapkan hukum Faraday untuk elektrolisis larutan elektrolit
Materi :
Hukum Faraday
Indikator Soal :
Diberikan suatu proses elektrolisis yang dipasang secara seri, jika parameter salah satu seri diketahui maka siswa
dapat menghitung mass zat yang
dihasilkan pada seri yang lain
Buku Sumber : Nomor Soal : 20 Kunci Jawaban : B
Keterangan Soal
Digunakan Untuk
Tanggal Dipakai
Jumlah Siswa
Tingkat Kesukaran
Daya Pembeda
Proporsi Jawaban Pada Pilihan
Keterangan
A B C D E OMIT
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 25
kehidupan sehari-hari
Kompetensi Dasar : Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi : Penyetaraan Reaksi Redoks
Indikator : Diberikan suatu rumus molekul suatu senyawa, siswa dapat menyebutkan masing-masing bilangan oksidasinya
Rumusan Butir Soal No. SOAL : 21
Determine the oxidation number of each element in the following compounds. Oxidation Numbers for each Element
a. SnCl4 Sn Cl
Digunakan Jumlah Siswa
Tingkat
Pedoman Penskoran Soal Uraian
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 26
kehidupan sehari-hari
Kompetensi Dasar : Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi : Penyetaraan Reaksi Redoks
Indikator : Diberikan suatu persamaan reaksi redoks , siswa dapat menyetarakan persamaan reaksi tersebut dengan benar
Rumusan Butir Soal No. SOAL : 22
Reaksi redoks berikut:
Tentukan Harga koefisien reaksi a, b, c, d, e
Digunakan Untuk
Tanggal
Digunakan Jumlah Siswa
Tingkat
Pedoman Penskoran Soal Uraian
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 27
kehidupan sehari-hari
Kompetensi Dasar : Menerapkan konsep reaksi oksidasi – reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Materi : Sel Volta
Indikator : Diberikan data potensial reduksi standar dan suatu notasi sel, siswa dapat : Menuliskan persamaan reaksinya dan Menentukan harga potensial sel dari persamaan reaksi.
Rumusan Butir Soal No. SOAL : 23
Diketahui potensial reduksi: Au3+ + 3e- Au Jika diketahui notasi atau diagram selnya:
(1).(Fe|Fe2+) || (Pb|Pb2+) (2).(Cr|Cr3+) || (Rb|Rb+) (3).(Cu|Cu+) || (Al|Al3+) Pertanyaannya :
a. Sebutkan mana yang oksidasi dan mana yang reduksi b. Tuliskan persamaan reaksinya
c. Tentukan potensial selnya Digunakan
Untuk
Tanggal
Digunakan Jumlah Siswa
Tingkat
Pedoman Penskoran Soal Uraian
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 28
kehidupan sehari-hari
Kompetensi Dasar : Menjelaskan reaksi oksidasi – reduksi dalam elektrolisis Materi : Reaksi Elektrolisis
Indikator : Siswa dapat menuliskan reaksi elektrolisis yang terjadi di anoda dan katoda
Rumusan Butir Soal No. SOAL : 24
Tuliskan reaksi elektrolisis pada
a.
Lelehan NaCl dengan elektroda C
b.
Larutan KI dengan elektroda Pt
Digunakan Untuk
Tanggal
Digunakan Jumlah Siswa
Tingkat
Pedoman Penskoran Soal Uraian
No Kunci Jawaban Skor
24.
a. Elektrolisis Lelehan NaCl dengan elektroda C
Reaksi : NaCl(l)
Na
+(l) + Cl
-(l)
b. Elektrolisis Larutan KI dengan elektroda Pt
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 29
kehidupan sehari-hari
Kompetensi Dasar : Menerapkan hukum Faraday untuk elektrolisis larutan elektrolit
Materi : Hukum Faraday
Indikator : Diberikan suatu larutan untuk dielektrolisis, siswa dapat: Menuliskan reaksi yang terjadi pada anoda dan Menghitung massa yang terjadi di katoda
Rumusan Butir Soal No. SOAL : 25
Elektolisis larutan CuBr
21 M dengan kedua elektrodanya dari karbon, arus
yang dialirkan = 10 ampere selama 10 menit
a. Tuliskan reaksi yang terjadi di anoda
b. Hitung berapa massa endapan yang terjadi di katoda (Ar Cu = 63,5)
Digunakan Untuk
Tanggal
Digunakan Jumlah Siswa
Tingkat Kesukaran
Daya
Pembeda Keterangan
Ulangan
Harian 24 Sept 2010 74 74,38% 6,25% Mudah
Pedoman Penskoran Soal Uraian
No Kunci Jawaban Skor
25.
Reaksi : CuBr
2
Cu
2++ 2Br
-a. Anoda (oksidasi (+)) : 2Br
-
Br
2
+ 2e
katoda (reduksi (-))
: Cu
2++ 2e
Cu
b. diketahui i = 10 ampere, waktu (t) = 10 menit = 600 detik
�
=
�
�
�
�
�
��
=
�
�
�
�
,
=
,
�
����
2
6
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 30
PETUNJUK UMUM :
1. Mulailah dengan membaca “ Bismillahirrahmanirrahiim”.
2. Tulislah terlebih dahulu nama Anda pada lember jawab yang telah disediakan. 3. Periksa dan bacalah soal-soal sebelum anda menjawabnya.
4. Dahulukan soal-soal yang dianggap mudah.
5. Periksalah pekerjaan anda sebelum diserahkan kepada Pengawas. 6. Akhiri dengan membaca “Alhamdulillahi Robbil „Alamiin”
PILIHAN GANDA
Zat oksidator adalah ……..
A. PbO2
4. Reaksi redoks berlangsung karena serah terima elektron. Jumlah elektron yang diterima pada reaksi reduksi sama dengan jumlah elektron yang dibebaskan pada reaksi oksidasi. Diantara
lima reaksi dibawah ini, yang merupakan reaksi redoks adalah ….
A. MnO2 (s) + 4 HCl (aq) MnCl2 (aq) + 2 H2O (l) + Cl2 (g) B. NaCl (aq) + H2O (l) NaOH (aq) + HCl (aq)
C. CaSO4 (aq) + 2 NaOH (aq) Na2SO4 (aq) + Ca(OH)2 (s) D. BaCl2 (aq) + H2SO4 (aq) BaSO4 (s) + 2 HCl (aq) E. CaCO3 (s) + 2HCl (aq) CaCl2 (aq) + H2O (l) + CO2 (g)
5. Yang bukan reaksi redoks di bawah ini adalah... A. SnCl2 + I2 + 2HCl
SnCl4 + 2HIB. H2 + Cl2
2HCl C. Cu2O + C
2Cu + CO D. CuO + 2HCl
CuCl2 + H2OTugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 31
E. reaksi tidak spontan
7. Reaksi redoks dapat berlangsung spontan dengan membebaskan energi. Reaksi redoks yang menghasilkan energi listrik terdapat pada sel Galvani atau sel Volta. Diketahui data potensial reduksi standar.
Ca2+ (aq) + 2e Ca (s) E
0 = - 2,87 volt Al3+ (aq) + 3e Al (s) E
0 = - 1,66 volt Besarnya harga potensial sel pada reaksi :
3 Ca (s) + 2 Al3+ (aq) 3 Ca2+(aq) + 2 Al (s) adalah …. A. + 1,21 volt
B. – 11,9 volt C. – 4,53 volt D. + 5,26 volt E. + 11,9 volt
Gambar sel volta berikut untuk digunakan untuk menjawab soal no 8 dan 9
Diketahui harga potensial reduksi standart berikut: Mg2+ + 2e → Mg E0 = - 2,37 Volt
Zn2+ + 2e → Zn E0 = - 0,76 Volt
8. Berdasarkan gambar rangkaian sel volta , diagram sel yang paling tepat adalah . . . A. Zn | Zn2+ ║ Mg2+ | Mg
B. Zn2+ | Zn ║ Mg2+ | Mg C. Mg | Mg2+ ║ Zn2+ | Zn D. Mg2+ | Mg ║ Zn | Zn2+ E. Zn | Zn2+ ║ Mg | Mg2+
9. Berdasarkan gambar di atas, harga potensial sel adalah . . . . A. - 3,14 Volt
B. – 1,54 Volt C. + 3,94 Volt D. + 1,61 Volt E. + 1,54 Volt
10.Diketahui :
Cu2+(aq) + 2e d Cu (s) Eo = + 0,34 Volt Cr3+(aq) + 3e d Cr (s) Eo = - 0,74 Volt
Diagram sel reaksi tersebut adalah….
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 32
13.Potensial standard(Eo) dari berbagai zat berikut: (1).Fe2+ + 2 e → Fe Eo = -0,44 volt (2).Mg2+ + 2 e → Mg Eo = -2,37 volt (3).Co2+ + 2 e → Co Eo = -0,28 volt (4).Cu2+ + 2 e → Cu Eo = +0,34 volt (5).Ni2+ + 2 e → Ni Eo = -0,25 volt
Logam yang dapat melindungi logam besi adalah…..
A. Magnesium B. Besi
C. Cobalt D. Tembaga E. Nikel
14.Diketahui potensial elektrode standar ( Eo ) dari beberapa logam sebagai berikut : Zn = -0,76 volt
Fe = -0,44 volt Ni = -0,28 volt Sn = -0,14 volt Cu = +0,34 volt
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 33
C. 2H2O (l) 4H (aq) + O2 + 4e
D. 2 SO42- (aq) + 2H2O (l) H2SO4 (aq) + 4e- + O2 (g) E. Cu2+ (aq) + 2e- Cu (s)
17.Elektrolisis zat manakah yang menghasilkan gas hidrogen di anoda? A. NH3 (l)
dalam wadah 2 dihasilkan adalah …gram
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 34
22.Reaksi redoks berikut: Cr2O72- + a H
+
+ b NO2 -→ c Cr 3+
+ d NO3- + e H2O Tentukan Harga koefisien reaksi a, b, c, d, e
23.Diketahui potensial reduksi:
Half-reaction E (Volts)
Jika diketahui notasi sel sebagai berikut : (1).(Fe|Fe2+) || (Pb|Pb2+)
(2).(Cr|Cr3+) || (Rb|Rb+) (3).(Cu|Cu+) || (Al|Al3+) Pertanyaannya :
a. Tuliskan reaksi oksidasi dan reduksi b. Tuliskan persamaan reaksinya c. Tentukan potensial selnya
24.Tuliskan reaksi elektrolisis pada
a. Lelehan NaCl dengan elektroda C b. Larutan KI dengan elektroda Pt
25.Elektolisis larutan CuBr2 1 M dengan kedua elektrodanya dari karbon, arus yang dialirkan = 10 ampere selama 10 menit
a. Tuliskan reaksi yang terjadi di anoda
b. Hitung berapa massa endapan yang terjadi di katoda (Ar Cu = 63,5)
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 36
b. Elektrolisis Larutan KI dengan elektroda Pt
Reaksi : KI (aq)
d
K
+(aq) + I
-(aq)
Katoda (Reduksi (-)) : 2H
2O + 2e
d
2OH
-+ H
2(g)2
Anoda (oksidasi (+)) : 2I
-d
I
2
(s) + 2e2
--- +
2H
2O + 2I
-d
2OH
-+ H
2
(g) + I
2(s)2
25.
Reaksi : CuBr
2d
Cu
2++ 2Br
-a. Anoda (oksidasi (+)) : 2Br
-d
Br
2
+ 2e
2
katoda (reduksi (-)) : Cu
2++ 2e
d
Cu
b. diketahui i = 10 ampere, waktu (t) = 10 menit = 600 detik
�
=
����
�
��
=
� �
�
�
,
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 34
Kelas / Program Studi : XII / IPA
Kurikulum : Tingkat Satuan Pendidikan (KTSP)
Alokasi Waktu : 90 Menit
Jumlah Soal : 20 Pilihan Ganda (PG) dan 5 Soal Uraian
Standar Kompetensi : Menerapkan konsep reaksi oksidasi reduksi dan
elektrokimia dalam kehidupan sehari-hari
No
Absen Nama Siswa JK
NOMOR SOAL DAN KUNCI JAWABAN
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
D A A A D C A C D D B D A E B E C E B B
1 ADELIA GITA PRISTANTI P D A A A D A D C D D B D A E C E C B B A
2 AJENG WENINGTYAS PURWITANINGSIH P D B A A D C A B D D B B A E B E C C C D
3 ANDINY KHILSA FATMA SARI P D A A A D C A C D D A D A C D A C E B E
4 AULIYA WILDANA POETRA L D A A A D C A C D D B D A D B E C C B B
5 CLARA OLIVIA ALVIONTINA P D A A E C C A C D D B B B E B E C E C E
6 DIDO ALFIAN RAHMAFEBBY L D A A A D C A C D C A B A E B E C C B E
7 EMI TRISNAWATI P D A A A D C A C D D B B A E B E C C E E
8 EPI PITDAH LESTARI P D A A A D C A C D D B D A E B E D C C B
9 ERNI WIDYANINGSIH P D A A A D C A D D D C D A C B E C C B D
10 EZWIN FITRIA ELDANA MAGHFIROH P D A A A D C A C D A C D A C D E E A B E
11 FAISHAL FALIH HERLAMBANG L D A A A D C A C D D B D D B B A C E B A
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 35
14 FATHIN HISBUL WATHON L D A A E E C A B C D B D D E C E C C C B
15 HAPSARI TITI MUMPUNI P D C A A D C A B D D B B A E C E C C B B
16 HASIM L D A D A D C A C C D B B C E D D C B B C
17 IBNATAN HANIFAN HASHIFAH P D A A A E C A C C A B D A E C C E B E C
18 IIS RIYANI P D A A A D C A C D D B D A E B E D A B B
19 KHAIRAWATI P D A A A D C A C D D B B A E B E C C B B
20 KHUSNUL HIDAYAH P D A D A A C A B D D B D A E B E B B C B
21 LAILY ANGGRAENI P D E A E A C A C D C D D A B B B C E C E
22 MEI DWI ASTUTI P D B A A D C A C C D D B A E C B C B E A
23 NINDA LUCY FITMAYA P D A A E D B C C D B A C B E A E E C B D
24 NORMAN ADDIN HUSEIN L D A A E E C A C B D B D C B B E E C C E
25 NYI GALUH RAHMA GITA P D A A A D C A C C D B B A B B C C C C E
26 OKTARIA CAHYA NINGRUM P D A A E A C A C D D A D D A B C A C B A
27 PANDU GALIH SANJAYA L D A A A D C B C D D C B A E B E C E A A
28 PANGESTI MUTIA ANJANI P D B A A A C B B B D C D D E B B B C A B
29 QORI RIADINTA L D A E E E C B C B D B C A B B E E C B B
30 RAHMAT ARI WIDODO L D A A A D C A C D D E D A E B C B B A C
31 RIZKA WIDYA P D B A A B C E C D B B B A C E C C E C E
32 SEPTIANDRA DWI RACHMANSYAH RIZEL L D B A E E C E C D B B B D D B E C C C A
33 SISKA LUSIANA P D A A A D C A C D D B B A E B E E C B D
34 SRI NURAWANAH P D A A A D C A A D D A D B D B D A E A B
Tugas Evaluasi dan Supervisi Pendidikan IPA Pascasarjana UNNES 2010 Page 36
37 ANGGRAENI PUTRI PERTIWI P D B A E C C A C D D B D A C C E C B A E
38 ANNAS CATUR IMMAMUDDIN L D A A A D C B D D D B B B D E C D A C E
39 ARDITYA ALVIEN RAYENDRA L D A A A D A A B D D C B A B C D C E B E
40 ARUM NUR JANNAH P D A A E A C A B D D B D D E C C C C C B
41 DHETA ERNILIA PUSPITA P D A A E D C A C D C E B B E D A E B C B
42 DIANA WIDHI PERMATASARI P D C A A D C A C D B B D B B B C A E C D
43 DIMAS DIKY PUTRA L D B A A D C A B D A B D A E B C C C B A
44 DITA SONIA P D A A E C C B C C D B D B E B B D E B D
45 ENDAH MELATI DEWI P D A A A D C A C D B B D A E B E C E B D
46 ERMA WIDYA PANGESTIKA P D A A A D C A A D E B D A E B E C B C D
47 ETA AGUSTIANA P D A E B D C A C D E D C A D B A C B C D
48 FAHMI HIDAYAT L D A A E D C E C B D C B B D A B A B B B
49 FAJAR HARIYANTO L D A A A D C A C D B C B A E D E C E B B
50 GIGIH PRATAMA AJI L D A A A D C A C D B B B A E D E C E B E
51 GIYANTI P D B A A D C B C C D B D D E B C C B C A
52 HARNING SEKAR AGENG P D A A E C C B C E B B D B D D C C E B B
53 HIDAYAH HISHAM SALEH SALIM P D C A A D C A B D E B B D E B E C E C B
54 HILLDA AYU KUSUMANINGRUM P D A A A D C A B D D B B A E E C E C B D
55 IKA DESI HARNINDITA P D A A A D E A C D D B D A E C B E E B B
56 ISNIYATI P D A A A D C A C D D B B A E B E A E C B
57 KENDHY SADEWA L D B A A D E A C E D B D A E E C D E C A