TESIS
PEMELIHARAAN STATUS TERANESTESI DENGAN KOMBINASI XILASIN-KETAMIN
SECARA SUBKUTAN PADA ANJING
I MADE INDRAYADNYA SWARAYANA
PROGRAM PASCASARJANA UNIVERSITAS UDAYANA
DENPASAR 2015
!
PEMELIHARAAN STATUS TERANESTESI DENGAN KOMBINASI XILASIN-KETAMIN
SECARA SUBKUTAN PADA ANJING
I MADE INDRAYADNYA SWARAYANA NIM 1292361011
PROGRAM PASCASARJANA UNIVERSITAS UDAYANA
DENPASAR
2015
iv!
PEMELIHARAAN STATUS TERANESTESI DENGAN KOMBINASI XILASIN-KETAMIN
SECARA SUBKUTAN PADA ANJING
Tesis untuk Memperoleh Gelar Magister pada Program Magister, Program Studi Kedokteran Hewan Program Pascasarjana
Universitas Udayana
I MADE INDRAYADNYA SWARAYANA NIM 1292361011
PROGRAM MAGISTER
PROGRAM STUDI KEDOKTERAN HEWAN PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA DENPASAR
2015
ii!
TANGGAL, 20 APRIL 2015
Pembimbing I, Pembimbing II,
Dr. drh I Gusti Ngurah Sudisma, M.Si Dr. drh. I Nyoman Suartha, M.Si NIP 19690130 199702 1 002 NIP 19680301 199403 1 002
Mengetahui,
Ketua Program Kedokteran Hewan Direktur Program Pascasarjana Program Pascasarjana Universitas Udayana Universitas Udayana
Prof. Dr. drh. I Ketut Puja, M.Kes Prof. Dr. dr. A. A. Raka Sudewi, Sp. S(K) NIP. 19621231 198903 1 315 NIP. 19590215 198510 2 001
iv!
Tesis ini telah diuji pada tanggal : 20 April 2015
Panitia Penguji Tesis Berdasarkan SK Rektor
Universitas Udayana,No. 1161a/UN.14.4/HK/2015, Tanggal 17 April 2015
Ketua : Dr. Drh. I Gusti Ngurah Sudisma, M.Si
Anggota :
1. Dr.drh. I Nyoman Suartha, M.Si 2. Dr.drh. I Ketut Anom Dada, MS
3. Prof. Dr.drh. Ida Bagus Komang Ardana, M.Kes 4. Prof. Dr.drh. I Ketut Puja, M.Kes
Saya yang bertanda tangan dibawah ini:
Nama : I Made Indrayadnya Swarayana
NIM : 1292361011
Program Studi : Kedokteran Hewan
Judul Tesis : Pemeliharaan Status Teranestesi dengan Kombinasi Xilasin- Ketamin Secara Subkutan pada Anjing
Dengan ini menyatakan bahwa karya ilmiah tesis ini bebas plagiat.
Apabila dikemudian hari terbukti plagiat dalam karya ilmiah ini, maka saya bersedia menerima sanksi sesuai Peraturan Mendiknas RI No. 17 Tahun 2010 dan Peraturan Perundang-undangan yang berlaku.
Denpasar, 20 April 2015 Yang membuat pernyataan,
I Made Indrayadnya Swarayana
iv!
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Mataram pada tanggal 26 Mei 1990 dan merupakan anak kedua dari dua bersaudara dari pasangan Bapak Ir. I Gede Mandysastra, M.Si dan Ibu Ir. Ni Luh Gde Seriani. Penulis berkewarganeragaraan Indonesia dan beragama Hindu.
Pendidikan yang pernah ditempuh yaitu Taman Kanak-kanak di TK Dharma Wanita Cakranegara pada tahun 1994 dan tamat tahun 1996. Kemudian melanjutkan pendidikan di Sekolah Dasar Negeri 8 Cakranegara pada tahun 1996 dan tamat pada tahun 2002. Lalu melanjutkan pendidikan di Sekolah Menengah Pertama Negeri 2 Mataram pada tahun 2002 dan tamat pada tahun 2005. Pendidikan Menengah Atas ditempuh di Sekolah Menengah Atas Negeri 3 Mataram pada tahun 2005 dan tamat pada tahun 2008. Melalui jalur PMDK pada tahun 2008, penulis diterima di Fakultas Kedokteran Hewan Universitas Udayana, Bali. Menyelesaikan pendidikan Sarjana Kedokteran Hewan (SKH) pada tahun 2012 dan pendidikan Profesi Dokter Hewan pada tahun 2013. Pada tahun 2012 penulis menempuh Pendidikan Program Magister Program Studi Kedokteran Hewan Program Pasca Sarjana Universitas Udayana.
vi!
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa yang telah memberikan rahmat-Nya sehingga penulisan tesis ini dapat diselesaikan. Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada Dr.
drh I Gusti Ngurah Sudisma, M.Si. selaku pembimbing I yang dengan penuh perhatian telah memberikan dorongan, semangat, bimbingan dan saran selama penulis mengikuti Program Magister, khususnya dalam penyelesaian tesis ini. Terima kasih yang sebesar-besarnya pula penulis sampaikan kepada Dr. drh. I Nyoman Suartha, M.Si. selaku Pembimbing II yang penuh perhatian dan kesabaran telah memberikan bimbingan dan saran kepada penulis.
Ucapan yang sama ditujukan kepada Rektor Universitas Udayana, Prof. Dr.
dr. I Ketut Suastika SpPD. (KEMD) atas kesempatan dan fasilitas yang diberikan kepada penulis untuk mengikuti dan menyelesaikan pendidikan Program Magister di Universitas Udayana. Ucapan terima kasih juga ditujukan kepada Direktur Program Pascasarjana Universitas Udayana Prof. Dr. dr. A.A. Raka Sudewi, Sp.S(K). Terima kasih penulis sampaikan kepada Prof. Dr. drh. I Ketut Puja, M.Kes selaku Ketua Program Studi S2 Kedokteran Hewan Program Pascasarjana Universitas Udayana dan juga sebagai penguji tesis, atas kesempatan yang diberikan untuk belajar di Program Studi yang dipimpinnya dan kesediaannya menjadi penguji. Ucapan terima kasih yang sebesar-besarnya juga penulis sampaikan kepada para penguji tesis
iv!
lainnya, yaitu Bapak Dr.drh. I Ketut Anom Dada, MS dan Bapak Prof. Dr.drh. Ida Bagus Komang Ardana, M.Kes yang telah memberikan masukan, saran dan sanggahan sehingga tesis ini dapat terwujud seperti ini. Ucapan terima kasih yang tulus juga penulis sampaikan kepada para dosen yang telah membimbing penulis dalam mengikuti pendidikan Program Magister pada Program Studi Kedokteran Hewan Program Pascasarjana Univesitas Udayana.
Ucapan terima kasih yang tulus penulis sampaikan kepada Kedua orang tua tercinta, Bapak Ir. I Gede Mandysastra, M.Si dan Ibu Ir. Ni Luh Gede Seriani, saudara penulis I Wayan Aditya Swardiana S.Kom, M.Kom dengan doa dan penuh kesabaran telah memberikan semangat dan dorongan moral dan material sehingga penulis dapat menyelesaikan pendidikan
Pada kesempatan ini secara khusus penulis menyampaikan ucapan terima kasih kepada Kepala Rumah Sakit Hewan Udayana Denpasar yang telah mengijinkan untuk melaksanakan penelitian. Ratna Bayuningsih Permitosari, Rosni Lumban Gaol dan Adrin Ma’ruf yang telah membantu dalam penelitian ini.
Terima kasih juga kepada Keluarga besar angkatan 2008 FKH Udayana yang tidak dapat saya sebutkan namanya satu-persatu yang telah memberikan doa, telah banyak membantu, memberikan semangat dan saran kepada penulis.
Semoga Tuhan Yang Maha Esa selalu melimpahkan anugrah-Nya kepada semua pihak yang telah membantu pelaksanaan dan penyelesaian Tesis ini, serta kepada penulis dan keluarga.
viii!
XILASIN-KETAMIN SECARA SUBKUTAN PADA ANJING
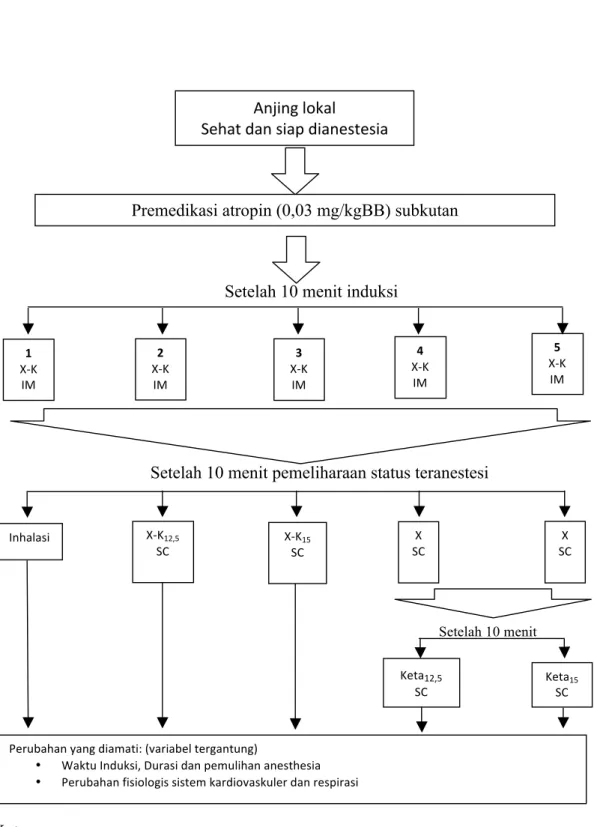
Penelitian ini bertujuan untuk mendapatkan metode alternatif anestesi inhalasi. Metode yang lebih murah, praktis dan memiliki waktu induksi cepat adalah dengan metode parenteral atau injeksi secara subkutan. Dua puluh lima ekor anjing lokal jantan dengan berat 10-15 kg dengan usia ± 1 tahun dibagi menjadi lima perlakuan dan masing-masing lima ekor sebagai ulangan.
Seluruh perlakuan menggunakan premedikasi atropin (0,03 mg/kgBB) disuntikan subkutan, 10 menit kemudian dilakukan induksi intramuscular dengan kombinasi xilasin (2mg/KgBB) dan ketamin (12,5mg/KgBB). Perlakuan 1 pemeliharaan status teranestesi menggunakan inhalasi isofluran, Perlakuan 2 pemeliharaan anestesi menggunakan kombinasi xilasin (2mg/KgBB) dan ketamin (12,5mg/KgBB) secara subkutan, Perlakuan 3 pemeliharaan status teranestesi menggunakan kombinasi xilasin (2mg/KgBB) dan ketamin (15mg/KgBB) secara subkutan, Perlakuan 4 pemeliharaan status teranestesi menggunakan xilasin (2mg/KgBB) dilanjutkan dengan ketamin (12,5mg/KgBB) secara subkutan , dan Perlakuan 5 pemeliharaan status teranestesi menggunakan xilasin (2mg/KgBB) dilanjutkan dengan ketamin(15mg/KgBB) secara subkutan. Dilakukan pencatatan waktu induksi, durasi dan waktu pemulihan, serta pengamatan menggunakan alat fisiograf yang diamati setiap 10 menit hingga anjing tersadar untuk merekam nilai respirasi, saturasi oksigen, suhu rektal, frekuensi denyut jantung dan elektrokardiogram.
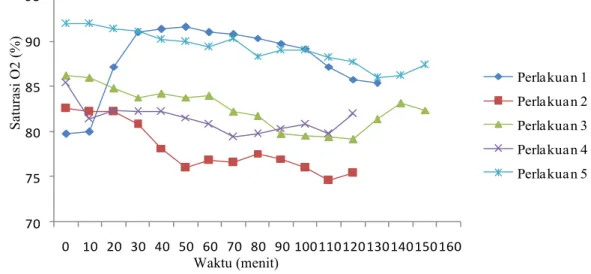
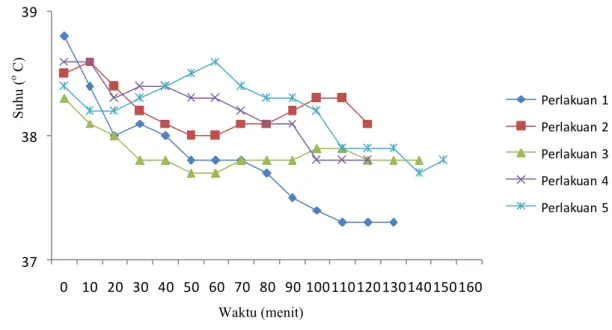
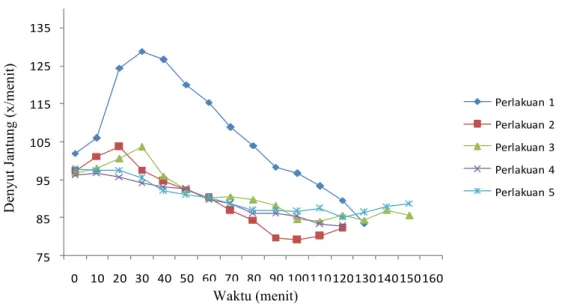
Hasil penelitian dengan perlakuan 5 menghasilkan pemeliharaan status teranestesi yang baik, karena menghasilkan waktu induksi yang cepat 10.8menit, dan durasi waktu anestesi yang panjang yaitu 145 menit. Perlakuan AXK-X-K15 menghasilkan pengaruh perubahan lebih rendah terhadap respirasi, nilai saturasi oksigen, suhu rektal, nilai frekuensi denyut jantung, dan nilai elektrokardiogram (EKG) pada bentangan stabil dibandingkan kelompok kombinasi yang lain, sehingga perlakuan 5, dapat menjadi alternatif pengganti anestesi inhalasi.
Kata kunci: Anestesi, Xilasin, Ketamine HCl, Anjing
!
iv!
ABSTRACT
SUBCUTANEOUS INJECTION OF XYLZINE AND KETAMINE COMBINATIONS FOR MAINTENANCE OF ANESTHESIA IN DOGS
The purpose of this research is to find out an alternative method for inhalational anesthesia. The research use twenty five local male dogs aged about ±1 year old and weigh 10-15 kgs each as research subjects. These twenty five dogs are divided into five groups consisting of five dogs each and each group is given different treatments.
The entire treatments are using premedicated atropin (0,03 mg/kgBB) injected subcutaneously, and after 10 minutes the subject is intramuscularly inducted with xylazine ( 2 mg/kgBB) and ketamine (12,5 mg/kbBB) combination. To maintain anestethia status, each dogs group is given different treatment. Group 1 is given isofluran inhalation, group 2 is given xylazine (2 mg/kgBB) and ketamine (12,5 mg/kgBB) combination by subcutaneous injection, group 3 is given xylazine (2 mg/kgBB) and ketamine (15 mg/kgBB) combination by subcutaneous injection, group 4 is given xylazine (2 mg/kgBB) and ketamine (12,5 mg/kgBB) consecutively by subcutaneous injection, and group 5 group is given xylazine (2 mg/kgBB) and ketamine (15 mg/kgBB) consecutively by subcutaneous injection. The induction time, duration, recovery time, and fisiograph, is being observed every 10 minutes until the subject is awakened which its respiration value, oxygen saturation, rectal temperature, heart beat frequency, and electrocardiogram will also recorded.
The result of 5th group treatment produced good anesthetized status maintenance. The dogs group given this treatment have rapid induction time (10,8 minutes) and long anesthetized status duration (145 minutes). Group 5 treatment also produce lower changes in respiration, oxygen saturation value, rectal temperature, heart beat frequency value, and electrocardiogram value if compared to other treatments. This result shows that 5th group treatment can be an alternative to replace inhalational anesthesia.
Keywords: Anesthesia, Xilasin, Ketamine HCl, Dogs
x!
Pemeliharaan Status Teranestesi Dengan Kombinasi Xilasin-Ketamin Secara Subkutan
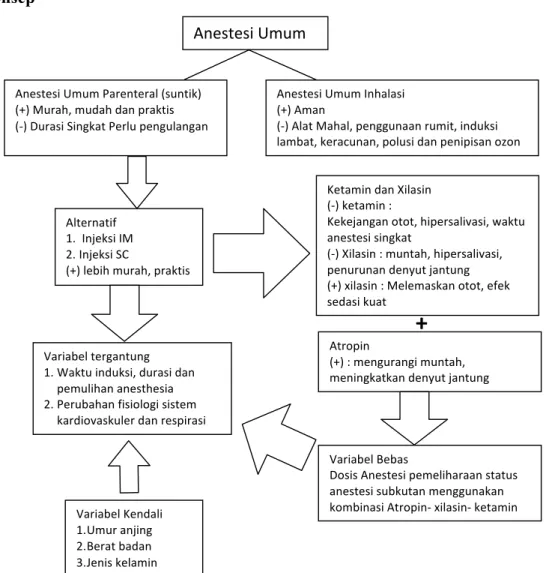
Anestesi merupakan tahapan yang paling penting dalam tindakan pembedahan, karena tindakan pembedahan belum dapat dilakukan bila anestesi belum diberikan. Anestesi umum inhalasi dipandang paling baik digunakan pada anjing saat ini. Anestesi umum inhalasi dipandang aman, namun memerlukan perangkat yang rumit, mahal, dan mempunyai waktu induksi yang relatif lambat serta tidak praktis untuk penanganan hewan di lapangan, mudah menguap, bersifat iritasi pada sistem respirasi, beberapa anestetikum bila dicampur dengan oksigen mudah terbakar dan meledak, efek samping lain yang ditimbulkan adalah delirium, mual, takikardia, aritmia jantung, depresi pernafasan dan menyebabkan polusi terhadap individu yang berada di ruangan operasi. Suatu metode alternatif yang aman dibandingkan efek samping anestesi inhalasi sangat diperlukan.
Metode yang lebih murah, praktis dan memiliki waktu induksi cepat adalah dengan metode parenteral atau injeksi. Penelitian ini bertujuan mendapatkan kombinasi anestesi Atropin-Xilasin-Ketamin dan pengulangan kombinasi Xilasin- ketamin secara subkutan sebagai alternatif pengganti anestesi umum inhalasi dengan dosis yang aman, nyaman, rasional, mudah dan praktis pada anjing serta mendapatkan data respon fisiologis anjing selama dalam kondisi teranestesi. Dua puluh lima ekor anjing lokal jantan dengan berat 10-15 kg dengan usia minimal 1 tahun dibagi menjadi lima kelompok perlakuan dan masing-masing lima ekor sebagai ulangan.
Lima kelompok perlakuan diberikan premedikasi atropin (0,03 mg/kgBB) secara subkutan, 10 menit kemudian dilakukan induksi intramuscular dengan kombinasi xilasin (2mg/KgBB)–ketamin (12,5mg/KgBB). Perlakuan 1 setelah induksi 10 menit kemudian dilakukan pemeliharaan status teranestesi menggunakan metode inhalasi dengan isofluran (1-2%). Perlakuan 2 10 menit setelah induksi dilakukan pemeliharaan status teranestesi secara subkutan dengan kombinasi Xilasin (2 mg/KgBB–Ketamin (12,5 mg/KgBB). Perlakuan 3 10 menit setelah induksi dilakukan pemeliharaan status teranestesi secara subkutan dengan kombinasi Xilasin(2 mg/KgBB)–Ketamin ( 15 mg/KgBB). Perlakuan 4 10 menit setelah induksi dilakukan pemeliharaan status teranestesi secara subkutan dengan Xilasin (2
iv!
mg/KgBB), 10 menit kemudian dilanjutkan dengan Ketamin (12,5 mg/KgBB) secara subkutan. Perlakuan 5 10 menit setelah induksi dilakukan pemeliharaan status teranestesi secara subkutan degan Xilasin (2 mg/KgBB) 10 menit kemudian dilanjutkan dengan Ketamin (15mg/KgBB) subkutan. Dilakukan pengamatan menggunakan alat fisiograf yang diamati setiap 10 menit hingga anjing tersadar untuk merekam nilai respirasi, saturasi oksigen, suhu rektal, frekuensi denyut jantung dan elektrokardiogram.
Hasil penelitian menunjukan perlakuan perlakuan 5 menghasilkan status pemeliharaan anestesi secara subkutan yang baik, karena menghasilkan waktu induksi yang cepat, dan durasi waktu anestesi yang panjang yaitu 145 menit. Namun waktu pemulihan menghasilkan waktu yang lama. Serta menghasilkan pengaruh perubahan lebih rendah terhadap respirasi, nilai saturasi oksigen, suhu rectal, kestabilan nilai frekuensi denyut jantung, dan nilai elektrokardiogram (EKG) pada bentangan stabil dibandingkan kelompok kombinasi yang lain. Perlakuan 5 dapat digunakan sebagai pilihan alternatif pengganti anestesi inhalasi.
xii!
LEMBAR PERSETUJUAN !...!! iii
PENETAPAN PANITIA PENGUJI ... iv SURAT PERNYATAAN BEBAS PLAGIAT ... v
RIWAYAT HIDUP ... vi
UCAPAN TERIMA KASIH ... vii
ABSTRAK!...!! ix ABSTACT!...!! x
RINGKASAN ... xi
DAFTAR ISI ... xiii
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xviii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 4
1.3 Tujuan Penelitian ... 4
1.4 Manfaat Penelitian ... 5
BAB II KAJIAN PUSTAKA ... 6
2.1 Anestesi ... 6
2.1.1 Klasifikasi Anestesi ... 7
2.1.2 Anestesi Lokal ... 8
2.1.3 Anestesi Regional ... 9
2.1.4 Anestesi Umum ... 11
2.2 Ketamin HCl ... 15
2.3 Xilasin ... 17
xiv
2.4 Atropin ... 18
2.5 Tahapan Anestesi Umum ... 19
2.6 Perubahan Aspek Fisiologi dalam Anestesi ... 22
2.6.1 Sistem Kardiovaskuler ... 24
2.6.2 Suhu Rektal ... 27
2.7 Pemantauan Anestesi ... 39
BAB III KERANGKA BERPIKIR,KONSEP, DAN HIPOTESIS PENELITIAN ... 32
3.1 Kerangka Berpikir ... 32
3.2 Konsep ... 33
3.3 Hipotesis ... 34
BAB IV METODE PENELITIAN ... 35
4.1 Rancangan Penelitian ... 35
4.2 Lokasi dan Waktu Penelitian ... 38
4.3 Penentuan Sumber Data ... 38
4.4 Variabel Penelitian ... 38
4.5 Definisi operasional variabel ... 38
4.6 Bahan Penelitian ... 39
4.7 Alat Penelitian ... 39
4.8 Prosedur Penelitian ... 39
4.9.1 Parameter ... 39
4.9.1.1 Pengukuran Waktu Anestesi ... 40
4.9.1.2 Pengukuran Respirasi ... 40
4.9.1.3 Pengukuran Elektrokardiogram (EKG) ... 40
4.9.1.4 Pengukuran Suhu Rektal ... 41
4.9.2 Protokol dan Pelaksanaan Penelitian ... 41
4.10 Analisis Data ... 42
BAB V HASIL ... 43
5.1 Waktu Anestesi ... 43
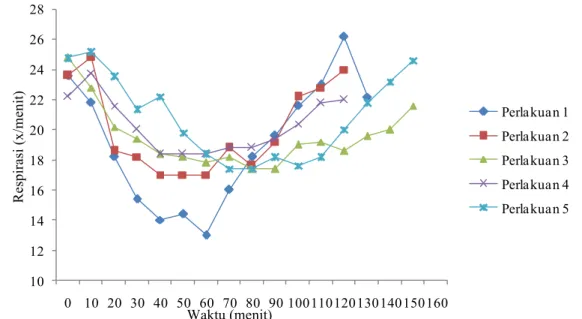
5.2 Respirasi ... 45
4.6 Elektrokardiogram ... 51
4.7.1.1 Amplitude gelombang P ... 51
4.7.1.2 Amplitude gelombang R ... 52
4.7.1.3 Interval PR ... 52
4.7.1.4 Komplek QRS ... 53
4.7.1.5 Interval QT ... 53
BAB VI PEMBAHASAN ... 55
BAB VII SIMPULAN DAN SARAN ... 62
DAFTAR PUSTAKA ... 63
LAMPIRAN ... 67
xvi
DAFTAR TABEL
Halaman 2.6 Perubahan fisiologi yang diperiksa selama periode anestesi ... 23 2.6.1 Kriteria elektrokardiogram (EKG) pada anjing ... 27 5.1 Nilai rata-rata ± simpangan baku waktu induksi, durasi dan waktu
pemulihan pemeliharaan status teranestesi dengan Xilasin-Ketamin
secara subkutan pada anjing... 44
4.1 Rancangan Penelitian ... 37 5.2 Perubahan rata-rata respirasi selama pemberian induksi anestesi
dan pemeliharaan status anestesi secara subkutan pada anjing……….. 45 5.3 Perubahan rata-rata nilai saturasi oksigen selama pemberian induksi
anestesi dan pemeliharaan status anestesi secara subkutan pada anjing.. 47 5.4 Perubahan rata-rata suhu rektal selama pemberian induksi anestesi
dan pemeliharaan status anestesi secara subkutan pada anjing... 48 5.5 Perubahan rata-rata denyut jantung selama pemberian induksi anestesi
dan pemeliharaan status anestesi secara subkutan pada anjing... 49
xviii
DAFTAR LAMPIRAN
Halaman Lampiran 1 Nilai rata-rata ± simpangan baku (rata-rata ± SD) respirasi,
saturasi oksigen, dan suhu rektal selama pemberian induksi dan pemeliharaan status teranastesi dengan Xilasin-Ketamin
secara subkutan pada anjing. ………... 67 Lampiran 2 Nilai rata-rata ± simpangan baku (rata-rata ± SD) denyut
jantung, elektrokardiogram gelombang P dan gelombang R selama pemberian induksi dan pemeliharaan status teranastesi dengan Xilasin-Ketamin secara subkutan pada
anjing. ………...………... 68 Lampiran 3 Nilai rata-rata ± simpangan baku (rata-rata ± SD)
elektrokardiogram interval PR, Kompleks QRS dan Interval QT selama pemberian induksi dan pemeliharaan status teranastesi dengan Xilasin-Ketamin secara subkutan pada
anjing. ………...……… 69
BAB I PENDAHULUAN
1.1 Latar Belakang
Perkembangan dunia pembedahan di dunia kedokteran hewan tidak lepas dari peran anestesi. Anestesi merupakan tahapan yang paling penting dalam tindakan pembedahan, karena tindakan pembedahan belum dapat dilakukan bila anestesi belum diberikan (Pretto, 2002). Pemilihan anestesi yang ideal untuk menghasilkan analgesi, sedasi, relaksasi, unconsciousness, keamanan dan kenyamanan untuk sistem vital, ekonomis dan mudah dalam aplikasi (Fossum 1997).
Anestesi umum yang digunakan pada hewan saat ini diperoleh melalui penggunaan obat-obatan secara injeksi dan atau inhalasi (McKelvey dan Hollingshead 2003). Anestesi umum yang dipandang paling baik digunakan pada anjing saat ini adalah anestesi umum inhalasi. Anestesi umum inhalasi dipandang aman, namun memerlukan perangkat yang rumit, mahal, dan mempunyai waktu induksi yang relatif lambat serta tidak praktis untuk penanganan hewan di lapangan.
Anestetikum inhalasi mudah menguap, bersifat iritasi pada sistem respirasi, beberapa anestetikum bila dicampur dengan oksigen mudah terbakar dan meledak, efek samping lain yang ditimbulkan adalah delirium, mual, takikardia, aritmia jantung, depresi pernafasan dan menyebabkan polusi terhadap individu yang berada di ruangan operasi. Individu yang terpapar anestesi inhalasi subklinis dapat mengalami gangguan hati (Ernawati, 2006). Anestesi inhalasi, seperti gas nitrogen oksida dan
2"
"
anestesi yang diuapkan dengan halogen mengakibatkan pencemaran lingkungan dan penipisan lapisan ozon (Amadasun dan Edomwonyi, 2005).
Metode alternatif anestesi pada hewan terutama pada anjing diperlukan untuk mengurangi efek samping yang timbul. Metode yang lebih murah, praktis dan memiliki waktu induksi cepat adalah dengan metode parenteral atau injeksi. Metode anestesi umum injeksi menghasilkan waktu induksi yang cepat namun durasi yang singkat dan tidak stabil. Untuk tindakan pembedahan yang memerlukan waktu yang lama, pemberian anestesi umum injeksi harus diulang-ulang karena tindakan pembedahan belum selasai tetapi durasi anestesi tidak cukup untuk pemeliharaan status teranestesi yang lebih lama. Metode alternatif anestesi umum yang paling memungkinkan digunakan pada anjing adalah metode anestesi secara intramuscular dan pemeliharaan status teranestesi secara subkutan. Induksi anestesi yang cepat menggunakan induksi secara intramuscular (IM) dan pemeliharan status teranestesi digunakan melalui subkutan. Pemberian injeksi secara subkutan memungkinkan penyerapan obat lebih lama sehingga dapat memberikan status pemeliharaan teranestesi dengan durasi yang lebih lama.
Pemberian anestesi secara Subkutan (SC) memiliki banyak kelebihan diantaranya pengaplikasian obat ke tubuh anjing lebih aman karena pemberian secara SC beresiko paling kecil membuat kondisi trauma pasien daripada injeksi melalui intramuskular, pendistribusian obat anestesi kedalam tubuh melalui injeksi SC lebih lambat daripada pemberian secara intramuskular ataupun intravena sehingga
pengaruh anestesi lebih lama untuk pemeliharaan status teranestesi dan aman dalam penanganan darurat apabila terjadi kesalahan pemberian dosis anestesi.
Anestesikum injeksi yang paling baik digunakan pada anjing adalah ketamin.
Keuntungan menggunakan ketaminyaitu ekonomis, mudah dalam pemberian, induksinya cepat begitu juga pemulihannya, mempunyai pengaruh relaksasi otot yang baik dan jarang menimbulkan komplikasi klinis (Benson et al., 1985). Penggunaan anestesi umum ketamin secara tunggal pada anjing menimbulkan kekejangan otot dan hipersalivasi serta kerja anestesi yang sangat pendek. Ketamin juga meningkatkan temperatur tubuh, peningkatan denyut jantung, tekanan darah arteri dan peningkatan tekanan intra ocular. Dengan kekurangan ketamin diperlukan agen premedikasi kombinasi dengan golongan α2-adrenoceptor (xilasin). Penggunaan xilasin pada anjing akan menyebabkan terjadinya muntah dan penurunan denyut jantung beberapa menit setelah pemberian xilasin. Pemberian atropin secara bersamaan sebagai premedikasi, dapat menurunkan pengaruh hipersalivasi dan bradikardi dari xilasin.
Diperlukan penelitian menggunakan kombinasi atropin-xilasin-ketamin pada anjing untuk menghasilkan pemeliharaan status teranestesi yang lebih lama dengan metode kombinasi injeksi secara Intramuskular (IM) dan Subkutan (SC). Induksi anestesi yang lebih cepat dihasilkan melalui injeksi melalui Intramuskular (IM) dan pemeliharaan status teranestesi dihasilkan melalui injeksi secara Subkutan (SC).
Penelitian ini diharapkan mendapat hasil sejauh mana keamanan kombinasi anestesi atropin-xilasin-ketamin yang diinjeksi secara berulang melalui subkutan sehingga dapat memperoleh kombinasi anestesi yang aman, nyaman, murah, mudah dan praktis
4"
"
digunakan untuk melakukan pembedahan dalam jangka waktu yang lebih lama serta dalam penggunaan dilapangan dapat menjadi pertimbangan utama sebagai alternatif anestesi inhalasi pada anjing.
1.2 Rumusan Masalah
1. Berapa dosis optimal penggunaan kombinasi atropin-xilasin-ketamin diberikan secara subkutan untuk pemeliharaan status teranestesi?
2. Bagaimana pengaruh respon fisiologis tubuh anjing selama dalam kodisi teranestesi dengan penggunaan kombinasi Atropin-Xilasin-Ketamin diberikan secara subkutan?
1.3 Tujuan Penelitian
1. Mendapatkan kombinasi dan dosis anestesi Atropin-Xilasin-Ketamin dan pengulangan kombinasi Xilasin-ketamin secara subkutan sebagai alternatif pengganti anestesi umum inhalasi dengan dosis yang aman, nyaman, rasional, mudah dan praktis pada anjing.
2. Mendapatkan data respon fisiologis anjing selama dalam kondisi teranestesi dengan pemberian kombinasi Atropin-Xilasin-Ketamin dan pengulangan kombinasi Xilasin-ketamin secara subkutan.
1.4 Manfaat Penelitian
Penggunaan anestesi kombinasi Xilasin-Ketamin secara injeksi subkutan aman, nyaman, praktis, efisien dan ekonomis untuk pemeliharaan status teranestesi terutama bila digunakan di lapangan yang dapat menjadikan sebagai alternatif anestesi inhalasi pada anjing.
6"
"
"
BAB II
KAJIAN PUSTAKA
2.1 Anestesi
Anestesi adalah pemberian obat dengan tujuan untuk menghilangkan nyeri pembedahan. Sedangkan Analgesia adalah tindakan pemberian obat untuk menghilangkan nyeri tanpa menghilangkan kesadaran pasien (Latief, dkk, 2001).
Tahap awal dari anestesi umum adalah induksi anestesi yang dapat dilakukan dengan penyuntikan agen induksi secara intramuskular, intra nasal, intravena ataupun dengan agen inhalasi. Idealnya induksi harus berjalan dengan lembut dan cepat, ditandai dengan hilangnya kesadaran. Keadaan ini dinilai dengan tidak adanya respon suara dan hilangnya reflek bulu mata dan hemodinamik tetap stabil (Morgan, Mikhail, 2002)
Anestesi umum yang ideal harus memenuhi tiga syarat mutlak, yaitu sedasi, analgesi, dan relaksasi.
Guedel (1920) membagi anestesi umum dalam 4 stadium yaitu:
• Stadium I (Analgesia) adalah stadium induksi, Stadium ini dimulai dari saat pemberian obat anestesi sampai hilangnya kesadaran." Stadium ini ditandai dengan pola nafas yang lambat, teratur dari diafragma dan otot intercostal, masih terdapat refleks bulu mata.
• Stadium II (Delinum) adalah stadium eksitasi, Stadium ini dimulai dari hilangnya kesadaran sampai permulaan stadium pembedahan. Stadium ini
"
"
ditandai dengan eksitasi, tidak sadar, pola nafas tidak teratur, pupil mulai dilatasi, masih terdapat refleks bulu mata, terdapat resiko spasme laring, muntah sampai aritmia.
• Stadium III (Pembedahan) adalah stadium anestesi, Stadium ini ditandai dengan teraturnya pernapasan sampai pernapasan spontan hilang.
• Stadium IV (Paralisis medula oblongata) adalah stadium overdosis, Stadium ini ditandai dengan melemahnya pernapasan perut dibanding dengan stadium III. Jika mengalami stadium ini maka harus segera memberikan antidota pada hewan tersebut.
2.1.1 Klasifikasi Anestesi
Keadaan teranestesi dapat dihasilkan secara kimia dengan obat-obatan dan secara fisik melalui penekanan sensori pada syaraf. Obat-obatan anestetika umumnya diklasifikasikan berdasarkan rute penggunaannya, yaitu: 1). Topikal misalnya melalui kutaneus atau membrana mukosa; 2). Injeksi seperti intravena, subkutan, intramuskular, dan intraperitoneal; 3). Gastrointestinal secara oral atau rektal; dan 4).
Respirasi atau inhalasi melalui saluran nafas (Tranquilli et al. 2007).
Anestetetikum juga dapat diklasifikasikan berdasarkan daerah atau luasan pada tubuh yang dipengaruhinya, yaitu : 1). Anestesi lokal, terbatas pada tempat penggunaan dengan pemberian secara topikal, spray, salep atau tetes, dan infiltrasi.
2). Anestesi regional, mempengaruhi pada daerah atau regio tertentu dengan
8"
"
pemberian secara perineural, epidural, dan intratekal atau subaraknoid. 3). Anestesi umum, mempengaruhi seluruh sistem tubuh secara umum dengan pemberian secara injeksi, inhalasi, atau gabungan (balanced anaesthesia) (Adams 2001; McKelvey dan Hollingshead 2003).
2.1.2 Anestesi Lokal
Anestetikum lokal adalah suatu bahan kimia yang mampu menghambat konduksi syaraf perifer tanpa menimbulkan kerusakan permanen pada syaraf tersebut.
Mekanisme kerja anestetikum lokal dengan cara menghambat (blok) saluran ion sodium (Na) pada syaraf perifer, konduksi atau aksi potensial pada syaraf terhambat sehingga respon nyeri secara lokal hilang. Anestetikum lokal mencegah proses depolarisasi membran syaraf secara lokal melalui penghambatan saluran ion Na, sehingga membran akson tidak dapat bereaksi dengan neurotransmitter acetilkolin dan membran akan tetap dalam keadaan semipermiabel serta tidak terjadi perubahan potensial. Keadaan tersebut menyebabkan aliran inpuls yang melewati syaraf berhenti, sehingga semua rangsangan tidak sampai ke SSP. Sifat hambatan syaraf umumnya bersifat lokal, selektif, dan tergantung pada dosis atau jumlah obat yang diberikan (Tranquilli et al. 2007; Miller 2010).
Sifat sifat yang harus dimiliki oleh obat anestetikum lokal adalah poten, artinya efektif dalam dosis rendah, daya penetrasinya baik, mula kerjanya cepat, masa kerjanya lama, toksisitas sistemik rendah, tidak mengiritasi jaringan, pengaruhnya reversibel, dan mudah dikeluarkan dari tubuh (Adams 2001; Tranquilli et al. 2007).
Penggunaan anestetikum lokal bisa dilakukan dengan meneteskan pada permukaan daerah yang akan dianestesi (surface aflication), dengan melakukan injeksi secara sub-kutan pada daerah yang akan dianestesi (subdermal, intradermal), serta dengan melakukan pemblokiran pada daerah tertentu (field block anestesi). Anestetikum yang sering digunakan sebagai anestetikum lokal adalah procaine HCI 2% - 4%, Lidocaine 0,5 - 2%, Lidocaine 4%, Tetracaine, bupivacaine 0,25% atau 0,5%, Dibucain, Pehacaine, Lidonest, dan Chlor buthanol dengan dosis pemberian secukupnya (Quantum statis, QS). Lidocaine dan bupivacaine dapat diencerkan dengan larutan salin (bukan air) untuk menurunkan konsentrasinya. Bupivacaine mempunyai onset lebih lambat (20 menit) dan durasi lebih panjang (6 jam) dibandingkan lidocaine (onset lebih cepat dan durasi 1-2 jam) (Adams 2001; Sudisma 2006; Tranquilli et al.
2007).
2.1.3 Anestesi Regional
Anestesi regional adalah tindakan menghilangnya nyeri yang dilakukan dengan cara menyuntikkan anestetikum lokal pada lokasi syaraf yang menginervasi regio atau daerah tertentu sehingga menyebabkan hambatan konduksi inpuls yang reversibel. Anestetikum regional dapat menghilangkan rasa nyeri pada suatu daerah atau regio tertentu secera reversibel tanpa disertai hilangnya kesadaran. Mekanisme kerja dan jenis anestetikum yang digunakan sama dengan anestetikum lokal, tetapi daerah atau luasan pada tubuh yang dipengaruhi adalah daerah atau regio tertentu.
Anestesi regional dibedakan berdasarkan rute pemberiannya, yaitu secara epidural,
10"
"
spinal atau intrathekal atau subaraknoid, dan blok pleksus brakhialis (Adams 2001;
McKelvey dan Hollingshead 2003).
Anestesi epidural dihasilkan dengan cara menginjeksikan anestetikum lokal diantara duramater dan periosteum dari canalis spinalis (epidural space).
Anestetikum tidak langsung mengenai medula spinalis, sehingga efek anestesi terjadi setelah 15-20 menit pemberian. Anestesi epidural menghambat sensasi dan kontrol motorik daerah abdominal, pelvis, ekor, dan kaki belakang. Anestesi ini biasanya digunakan untuk laparotomi, amputasi ekor, urethrostomi, pembedahan cesar, pembedahan daerah pelvis, dan amputasi daeran kaki belakang. Pada hewan kecil dilakukan antara tulang lumbar terakhir dan tulang sakral 1. Sedangkan pada hewan besar dilakukan antara tulang coccigia 1 dan 2. Anestetikum yang digunakan sama dengan anestetikum lokal, seperti lidocaine 2%, bupivacain 0,5%, ropivacain 0,75%
atau mepivacaine 2% dengan dosis pemberian 1ml/5kg BB. Lidocain menghasilkan durasi sekitar 1-2 jam dan bupivacain sekitar 6 jam (McKelvey dan Hollingshead 2003).
Spinal atau intrathekal atau subaraknoid anestesi sama dengan anestesi epidural tetapi dilakukan melalui duramater dan subaraknoid dimana jarum menembus duramater dan subaraknoid sehingga anestetikum masuk ke dalam dan langsung mengenai syaraf spinal, menghasilkan anestesi yang segera dan lebih cepat.
Anestesi ini mengakibatkan resiko berontak dan rasa sakit yang memerlukan kesembuhan lebih lama. Anestetikum yang digunakan sama dengan anestetikum lokal. Sedangkan blok pleksus brakhialis adalah anestesi regional dengan cara
menyuntikkan anestetikum lokal di daerah perjalanan fleksus brakhialis yang menginervasi daerah kaki depan (Adams 2001; McKelvey dan Hollingshead 2003;
Sudisma 2006; Tranquilli et al. 2007).
2.1.4 Anestesi Umum
Anestesi umum adalah keadaan hilangnya nyeri di seluruh tubuh dan hilangnya kesadaran yang bersifat sementara yang dihasilkan melalui penekanan sistem syaraf pusat karena adanya induksi secara farmakologi atau penekanan sensori pada syaraf. Agen anestesi umum bekerja dengan cara menekan sistem syaraf pusat (SSP) secara reversibel (Adams 2001). Anestesi umum merupakan kondisi yang dikendalikan dengan ketidaksadaran reversibel dan diperoleh melalui penggunaan obat-obatan secara injeksi dan atau inhalasi yang ditandai dengan hilangnya respon rasa nyeri (analgesia), hilangnya ingatan (amnesia), hilangnya respon terhadap rangsangan atau refleks dan hilangnya gerak spontan (immobility), serta hilangnya kesadaran (unconsciousness) (McKelvey dan Hollingshead 2003).
Mekanisme kerja anestesi umum pada tingkat seluler belum diketahui secara pasti, tetapi dapat dihipotetiskan mempengaruhi sistem otak karena hilangnya kesadaran, mempengaruhi batang otak karena hilangnya kemampuan bergerak, dan mempengaruhi kortek serebral karena terjadi perubahan listrik pada otak. Anestesi umum akan melewati beberapa tahapan dan tahapan tersebut tergantung pada dosis yang digunakan. Tahapan teranestesi umum secara ideal dimulai dari keadaan terjaga atau sadar kemudian terjadi kelemahan dan mengantuk (sedasi), hilangnya respon nyeri (analgesia), tidak bergerak dan relaksasi (immobility), tidak sadar
12"
"
(unconsciousness), koma, dan kematian atau dosis berlebih (Tranquilli et al. 2007;
Miller 2010).
Anestesi umum yang baik dan ideal harus memenuhi kriteria : tiga komponen anestesi atau trias anestesi (sedasi, analgesi, dan relaksasi), penekanan refleks, ketidaksadaran, aman untuk sistem vital (sirkulasi dan respirasi), mudah diaplikasikan dan ekonomis. Dengan demikian, tujuan utama dilakukan anestesi umum adalah upaya untuk menciptakan kondisi sedasi, analgesi, relaksasi, dan penekanan refleks yang optimal dan adekuat untuk dilakukan tindakan dan prosedur diagnostik atau pembedahan tanpa menimbulkan gangguan hemodinamik, respiratorik, dan metabolik yang dapat mengancam (Wolfensohn dan Lloyd 2000;
Adams 2001; Tranquilli et al. 2007; Miller 2010).
Agen anestesi umum dapat digunakan melalui injeksi, inhalasi, atau melalui gabungan secara injeksi dan inhalasi. Anestetikum dapat digabungkan atau dikombinasikan antara beberapa anestetikum atau dengan zat lain sebagai preanestetikum dalam sebuah teknik yang disebut balanced anesthesia untuk mendapatkan efek anestesi yang diinginkan dengan efek samping minimal.
Anestetika umum inhalasi yang sering digunakan pada hewan adalah halotan, isofluran, sevofluran, desfluran, dietil eter, nitrous oksida dan xenon. Anestetika umum yang diberikan secara injeksi meliputi barbiturat (tiopental, metoheksital, dan pentobarbital), cyclohexamin (ketamin, tiletamin), etomidat, dan propofol (McKelvey dan Hollingshead 2003; Garcia et al. 2010).
Anestesi umum inhalasi merupakan salah satu metode anestesi umum yang dilakukan dengan cara memberikan agen anestesi yang berupa gas dan atau cairan yang mudah menguap melalui alat anestesi langsung ke udara inspirasi. Mekanisme kerja anestesi umum inhalasi sangat rumit dan sampai saat ini masih merupakan misteri, karena pemberian anestetikum inhalasi melalui pernapasan menuju organ sasaran yang jauh adalah suatu hal yang unik. Hiperventilasi akan menaikkan ambilan anestetikum dalam alveolus dan hipoventilasi akan menurunkan ambilan alveolus.
Kelarutan zat inhalasi dalam darah adalah faktor utama yang penting dalam menentukan induksi dan pemulihan anestesi inhalasi. Induksi dan pemulihan akan berlangsung cepat pada zat yang tidak larut dan lambat pada zat yang larut. Kadar alveolus minimal atau minimum alveolar cencentration (MAC) adalah kadar minimal zat anestesi dalam alveolus pada tekanan satu atmosfir yang diperlukan untuk mencegah gerakan pada 50% pasien yang dilakukan rangsangan insisi standar.
Immobilisasi tercapai pada 95% pasien apabila kadar anestetikum dinaikkan di atas 30% nilai MAC. Dalam keadaan seimbang, tekanan parsial anestetikum dalam alveoli sama dengan tekanan zat dalam darah dan otak tempat kerja anestetikum (Latief et al.
2007; McKelvey dan Hollingshead 2003).
Anestetika umum inhalasi yang pertama kali dikenal dan digunakan untuk membantu pembedahan adalah N2O. Kemudian menyusul, eter, kloroform, etil klorida, halotan, metoksifluran, enfluran, isofluran, desfluran, sevofluran, dan xenon.
Anestetika umum inhalasi yang umum digunakan saat ini adalah N2O, halotan,
14"
"
enfluran, isofluran, desfluran, sevofluran, dan xenon. Obat obat anestesi yang lain ditinggalkan, karena efek sampingnya yang tidak dikehendaki. Misalnya, eter mudah terbakar dan meledak, menyebabkan sekresi bronkus berlebihan, mual dan muntah, kerusakan hati, dan baunya yang sangat merangsang. Kloroform menyebabkan aritmia dan kerusakan hati. Metoksifluran menyebabkan kerusakan hati, toksik terhadap ginjal, dan mudah terbakar (Latief et al. 2007; McKelvey dan Hollingshead 2003; Tranquilli et al. 2007).
Isofluran merupakan halogenasi eter dan secara kimia sangat mirip dengan metoksifluran dan sevofluran. Rentang keamanan isofluran lebih lebar dibandingkan halotan dan metoksifluran, sehingga sangat umum digunakan pada hewan terutama anjing dan kuda walaupun dengan harga yang lebih mahal. Penggunaaan isofluran pada dosis anestesi atau subanestesi menurunkan metabolisme otak terhadap oksigen, tetapi akan meningkatkan aliran darah di otak dan tekanan intrakranial, sehingga menjadi pilihan pada pembedahan otak. Pengaruh terhadap jantung dan curah jantung (cardiac output) sangat minimal, sehingga dapat digunakan pada pasien dengan kelainan jantung. Potensi isofluran lebih kecil dibandingkan halotan karena mempunyai nilai MAC lebih tinggi dibandingkan halotan. Pemeliharaan anestesi dengan isofluran biasanya digunakan konsentrasi 1,5 – 2,5 % isofluran dalam oksigen (Latief et al. 2007; McKelvey dan Hollingshead 2003).
Anestesi umum injeksi merupakan metode anestesi umum yang dilakukan dengan cara menyuntikkan agen anestesi langsung melalui muskulus atau pembuluh darah vena. Anestesi injeksi biasanya digunakan untuk induksi pada hewan kecil
maupun pada hewan besar dan dapat juga digunakan untuk pemeliharaan anestesi.
Anestetika injeksi yang baik memiliki sifat-sifat tidak mengiritasi jaringan, tidak menimbulkan rasa nyeri pada saat diinjeksikan, cepat diabsorsi, waktu induksi, durasi, dan masa pulih dari anestesi berjalan mulus, tidak ada tremor otot, memiliki indeks terapeutik tinggi, tidak bersifat toksik, mempunyai pengaruh minimal terhadap organ tubuh terutama saluran pernapasan dan kardiovaskular, cepat dimetabolisme, tidak bersifat akumulatif, dapat dikombinasikan dengan obat lain seperti relaksan otot, analgesik, dan sudah diketahui antidotanya. Beberapa anestetika injeksi yang sering digunakan pada hewan adalah golongan barbiturat seperti thiopental sodium, methoheksital, dan pentobarbital. Golongan lainnya yang juga sering digunakan pada hewan adalah golongan cycloheksamin (ketamin dan tiletamin), etomidat, dan propofol. (Brander et al. 1991; McKelvey dan Hollingshead 2003).
2.2 Ketamin HCl
Ketamin HCl adalah anestetikum golongan phencyclidine (PCP) dengan rumus 2-(0-chlorophenyl)-2-(methylamino)-cyclohexanone hydrochloride, golongan nonbarbiturat, dan termasuk dissosiatif anestesi, yaitu pada dosis rendah sebagai preanestesi dan pada dosis lebih tinggi sebagai anestesi umum. Ketamin HCl merupakan larutan tidak berwarna, stabil pada suhu kamar dan mempunyai tingkat keamanan lebar (Sulistia 1987; Adams 2001).
Ketamin HCl mempunyai sifat menghilangkan rasa sakit yang kuat serta reaksi anestesinya tidak menyebabkan ngantuk (Pathak et al.1982; Kul et al. 2001).
16"
"
Ketamin menghasilkan pengaruh anestesi melalui mekanisme yang bekerja pada reseptor N methyl D aspartate (NMDA). Ketamin diklasifikasikan sebagai antagonis reseptor NMDA, pada daerah tempat kerja PCP. Afinitas ketamin sangat tinggi pada reseptor NMDA, sehingga menghasilkan pengaruh analgesik yang sangat kuat (Stawicki 2007). Sebagai antagonis NMDA, ketamin menghambat refleks nosiseptik spinal, yaitu menghambat konduksi rasa nyeri ke talamus dan daerah kortek.
Penghambatan reseptor NMDA dengan dosis ketamin yang rendah akan menghasilkan pengaruh analgesik yang baik (Intelisano et al. 2008).
Ketamin juga menyebabkan gangguan fungsi pada beberapa tempat di otak seperti pada talamus dan kortek serebral menjadi tertekan. Ketamin juga memperpanjang kerja GABA (gamma amino butyric acid), suatu neurotransmiter penghambat di otak dengan cara menghambat pengikatannya di ujung syaraf (Cullen 1997). Reseptor GABA dapat merubah permiabilitas ion Cl-dan dapat menyebabkan pelepasan norepineprin pada syaraf simpatik (Adams 2001; Rudolph dan Antkowiak 2004). Pengaruh klinis yang ditimbulkan ketamin sangat bervariasi seperti : analgesia, anestesi, halusinasi, neurotoksisitas, hipertensi arterial, dan bronkodilatasi.
Ketamin juga menimbulkan agitasi (kehilangan orientasi, gelisah, dan menangis) yang sering disebut penomena emergence delirium (Stawicki 2007).
Adams (2001) menyebutkan bahwa aktivitas ketamin dapat secara langsung menstimulasi pusat adrenergik dan secara tidak langsung menghambat pengambilan (uptake) catecholamine terutama norepineprin.
2.3 Xilasin
Xilasin adalah salah satu golongan alpha2-adrenoceptor stimulant atau alpha- 2 adrenergic receptor agonist. Alpha-2 agonist seperti xilasin dan medetomidin adalah preanestetikum yang sering digunakan pada anjing dan kucing untuk menghasilkan sedasi, analgesi, dan pelemas otot. Golongan alpha-2 agonist yang lain seperti romifidin sering digunakan pada kuda, tetapi tidak direkomendasikan untuk anjing dan kucing (Lemke 2004). Xilasin HCl mempunyai rumus kimia 2(2,6- dimethylphenylamino)-4H-5,6-dihydro 1,3-thiazine hydrochloride. (Booth et al.
1995; Brander et al. 1991; Bishop 1996).
Xilasin menyebabkan tertekannya sistem syaraf pusat, bermula dari sedasi, kemudian dengan dosis yang lebih tinggi menyebabkan hypnosis, tidak sadar dan akhirnya keadaan teranestesi. Pada sistem pernafasan, xilasin menekan pusat pernafasan. Xilasin juga menyebabkan relaksasi otot yang bagus melalui imbibisi transmisi intraneural impuls pada SSP. Penggunaan xilasin pada anjing menghasilkan efek samping merangsang muntah tetapi dapat mengosongkan lambung pada anjing diberi makan sebelum dianestesi. Xilasin biasa digunakan pada kucing, anjing dan kuda sebagai agen sedatif untuk keperluan pembedahan minor dan untuk menguasai hewan atau handling. Penggunaaan xilasin dengan dosis yang lebih tinggi bukan saja untuk sedasi dan analgesi, tetapi juga menghasilkan immobilisasi.
Xilasin bisa digunakan sendiri atau dikombinasikan dengan obat lain seperti benzodiazepin atau opioid untuk menghasilkan sedasi. Xilasin juga dapat dikombinasikan dengan anestesi injeksi seperti ketamin, tiopental, dan propofol atau
18"
"
anestesi inhalasi seperti halotan dan isofluran untuk menghasilkan anestesi yang lebih baik (Lemke 2004). Xilasin biasanya digunakan sebagai preanestesi, tetapi pada anjing akan menyebabkan muntah sehingga bersifat kontra-indikasi untuk hewan yang menderita obstruksi gastro-intestinal. Waktu induksi dari suatu agen anestesi bisa dikurangi sampai 50-75% dengan pemberian preanestesi xilasin untuk menghindari overdosis (Bishop 1996).
2.4 Atropin
Atropin adalah prototipe agen menghambat muskarinik atau antimuskarinik dan merupakan ekstrak alkaloid dari tumbuhan belladona yang termasuk famili potato (Adams 2001). Atropin dan derivat alamiahnya adalah ester alkaloid ammonium tersier asam tropat (Katzung 1992). Secara kimia, molekul atropin terdiri dari dua komponen yang berikatan melalui ikatan ester. Atropin merupakan antimuskarinik, digunakan untuk mengurangi salivasi dan sekresi bronkial dan melindungi serta mencegah kejadian aritmia disebabkan prosedur atau sifat obat-obat anestesi. Sebagai preanestesi, atropin diindikasikan pada anjing untuk mencegah sejumlah saliva yang dapat menghalangi jalan nafas. Atropin dan hyoscin tidak direkombinasikan untuk preanestesi pada kuda karena dapat menyebabkan eksitasi dan medriasis. Atropin mencegah efek samping muskarinik dari antikolinesterase, yang digunakan untuk mengembalikan pengaruh non-depolarisasi obat-obat neuromuskular blok. Atropin adalah obat yang paling umum untuk digunakan sebagai antimuskarinik untuk
pengobatan bradikardia. Penggunaan atropin pada anjing adalah 30–100 mikrograms/Kg BB (Bishop 1996).
Dosis atropin sulfa sebagai preanestetikum 0,02-0,04 mg/kgBB intramuskular atau subkutan (Plumb 1991). Atropin biasa digunakan sebagai preanestetik pada anjing dengan dosis 0,02-0,04mg/kg secara subkutan, intramuskular, maupun secara intravena (McKelvey dan Hollingshead 2003). Pemakaian atropin sulfas dosis tinggi berakibat peningkatan frekuensi jantung dan tonus vagal perifer dan sentral. Kejadian disarithmia jantung dan takhikardi pada pemberian atropin sulfas pernah dilaporkan pada anjing (Lumb dan Jones 1996).
2.5 Tahapan Anestesi Umum
Tahapan anestesi sangat penting untuk diketahui terutama dalam menentukan tahapan terbaik untuk melakukan pembedahan, memelihara tahapan tersebut sampai batas waktu tertentu, dan mencegah terjadinya kelebihan dosis anestetikum. Tahapan anestesi dapat dibagi dalam beberapa langkah, yaitu: preanestesi, induksi, pemeliharaan, dan pemulihan (McKelvey dan Hollingshead 2003).
Tahap preanestesi merupakan tahapan yang dilakukan segera sebelum dilakukan anestesi, dimana data tentang pasien dikumpulkan, pasien dipuasakan, serta dilakukan pemberian preanestetikum. Induksi adalah proses dimana hewan akan melewati tahap sadar yang normal atau conscious menuju tahap tidak sadar atau unconscious. Agen induksi dapat diberikan secara injeksi atau inhalasi. Apabila agen induksi diberikan secara injeksi maka akan diikuti dengan intubasi endotracheal tube
20"
"
untuk pemberian anestetikum inhalasi atau gas menggunakan mesin anestesi. Waktu minimum periode induksi biasanya 10 menit apabila diberikan secara intramuskular (IM) dan sekitar 20 menit apabila diberikan secara subkutan (SC). Tahap induksi ditandai dengan gerakan tidak terkoordinasi, gelisah dan diikuti dengan relaksasi yang cepat serta kehilangan kesadaran. Idealnya, keadaan gelisah dan tidak tenang dihindarkan pada tahap induksi, karena menyebabkan terjadinya aritmia jantung.
Preanestesi dan induksi anestesi dapat diberikan secara bersamaan, seperti pemberian acepromazin, atropin, dan ketamin dicampur dalam satu alat suntik dan diberikan secara intravena (IV) pada anjing. (Adams 2001; McKelvey dan Hollingshead 2003;
Tranquilli et al. 2007).
Selanjutnya hewan akan memasuki tahap pemeliharaan status teranestesi.
Pada tahap pemeliharaan ini, status teranestesi akan terjaga selama masa tertentu dan pada tahap inilah pembedahan atau prosedur medis dapat dilakukan. Tahap pemeliharaan dapat dilihat dari tanda-tanda hilangnya rasa sakit atau analgesia, relaksasi otot rangka, berhenti bergerak, dilanjutkan dengan hilangnya refleks palpebral, spingter ani longgar, serta respirasi dan kardiovaskuler tertekan secara ringan. Begitu mulai memasuki tahap pemeliharaan, respirasi kembali teratur dan gerakan tanpa sengaja anggota tubuh berhenti. Bola mata akan bergerak menuju ventral, pupil mengalami konstriksi, dan respon pupil sangat ringan. Refleks menelan sangat tertekan sehingga endotracheal tube sangat mudah dimasukkan, refleks palpebral mulai hilang, dan kesadaran mulai hilang. Anestesi semakin dalam sehingga sangat nyata menekan sirkulasi dan respirasi. Pada anjing dan kucing,
kecepatan respirasi kurang dari 12 kali per menit dan respirasi semakin dangkal.
Denyut jantung sangan rendah dan pulsus sangat menurun karena terjadi penurunan seluruh tekanan darah. Nilai CRT akan meningkat menjadi 2 atau 3 detik. Semua refleks tertekan secara total dan terjadi relaksasi otot secara sempurna serta refleks rahang bawah sangat kendor. Apabila anestesi dilanjutkan lebih dalam, pasien akan menunjukkan respirasi dan kardiovaskuler lebih tertekan dan pada keadaan dosis anestetikum berlebih akan menyebabkan respirasi dan jantung berhenti. Dengan demikian, pada tahap pemeliharaan sangat diperlukan pemantauan dan pengawasan status teranestesi terhadap sistim kardiovaskuler dan respirasi (McKelvey dan Hollingshead 2003; Tranquilli et al. 2007 ).
Ketika tahap pemeliharaan berakhir, hewan memasuki tahap pemulihan yang menunjukkan konsentrasi anestetikum di dalam otak mulai menurun. Metode atau mekanisme bagaimana anestetikum dikeluarkan dari otak dan sistem sirkulasi adalah bervariasi tergantung pada anestetikum yang digunakan. Sebagian besar anestetikum injeksi dikeluarkan dari darah melalui hati dan dimetabolisme oleh enzim di hati dan metabolitnya dikeluarkan melalui sistem urinari. Pada hewan kucing, ketamin tidak mengalami metabolisme dan dikeluarkan langsung tanpa perubahan melalui ginjal.
Kadar anestetikum golongan tiobarbiturat di dalam otak dapat dengan cepat menurun karena dengan cepat disebarkan ke jaringan terutama otot dan lemak, sehingga hewan akan sadar dan terbangun dengan cepat mendahului ekskresi anestetikum dari dalam tubuh hewan. Anestetikum golongan inhalasi akan dikeluarkan dari tubuh pasien melalui sistem respirasi, molekul anestetikum akan keluar dari otak memasuki
22"
"
peredaran darah, alveoli paru-paru, dan akhirnya dikeluarkan melalui nafas. Tanda tanda adanya aktivitas refleks, ketegangan otot, sensitivitas terhadap nyeri pada periode pemulihan dinyatakan sebagai kesadaran kembali (McKelvey dan Hollingshead 2003).
Durasi atau lama waktu kerja anestetikum dan kualitas anestesi dapat dilihat dari pengamatan perubahan fisiologis selama stadium teranestesi. Dikenal dua waktu induksi pada durasi anestesi. Waktu induksi 1 adalah waktu antara anestetikum diinjeksikan sampai keadaan hewan tidak dapat berdiri. Waktu induksi 2 adalah waktu antara anestetikum diinjeksikan sampai keadaan hewan tidak ada refleks pedal atau hewan sudah tidak merasakan sakit (stadium operasi). Durasi adalah waktu ketika hewan memasuki stadium operasi sampai hewan sadar kembali dan merasakan sakit jika daerah disekitar bantalan jari ditekan. Waktu siuman atau recovery adalah waktu antara ketika hewan memiliki kemampuan merasakan nyeri bila syaraf disekitar jari kaki ditekan atau mengeluarkan suara sampai hewan memiliki kemampuan untuk duduk sternal, berdiri atau jalan (Moens dan Fargetton 1990;
Verstegen dan Petcho 1993; McKelvey dan Hollingshead 2003).
2.6 Perubahan Aspek Fisiologi dalam Anestesi
Pengamatan aspek fisiologi untuk pengawasan suatu anestesi dapat dikatakan sempurna apabila seluruh perubahan aspek fisiologi dapat diamati, tetapi perubahan aspek fisiologi pada sistem kardiovaskuler, respirasi dan suhu tubuh merupakan parameter yang terpenting diamati selama periode anestesi (Adams 2001, Flecknell,
1987). Kunci efektifitas anestesi dan tingkat keamanan selama periode anestesi adalah dilakukannya pengawasan dan pemantauan (monitoring) anestesi yang baik.
Pemeriksaan cepat dan seksama selama periode anestesi dilakukan terhadap kedalaman anestesi, kardiovaskuler dan respirasi, oksigenasi, dan variabel yang lain, seperti disajikan pada Tabel 2.6
Tabel 2.6 Perubahan fisiologi yang diperiksa selama periode anestesi
• Respirasi : kecepatan, kedalaman, dan sifat (gerak kantong reservoir dan gerakan dada).
• Warna membrana mukosa dan capillary refill time (CRT).
• Denyut jantung
• Pulsus : kecepatan dan kekuatan
• Ketegangan rahang, posisi bola mata, dan aktivitas refleks palpebral.
• Oksigenasi (kecepatan aliran dan tekanan)
• Temperatur tubuh pasien
Sumber: McKelvey dan Hollingshead 2003
Tanda-tanda vital dan refleks harus diperiksa selama hewan teranestesi. Tanda vital menunjukkan variabel yang mengindikasikan mekanisme respon keseimbangan (homeostasis) hewan terhadap anestesi, seperti denyut jantung, kecepatan respirasi, capillary refill time (CRT), dan temperatur. Tanda vital bagi pasien menandakan kemampuan pasien untuk mempertahankan fungsi respirasi dan sirkulasi selama teranestesi. Tanda vital dapat diamati dengan indera (sentuhan, pendengaran, atau penglihatan) atau menggunakan alat seperti mesin EKG atau oximeter. Tanda vital yang harus diperiksa selama teranestesi adalah denyut dan ritme jantung, pulsus,
24"
"
CRT, warna membrana mukosa, kehilangan darah, kecepatan dan kedalaman respirasi, dan temperatur. Tanda vital lain yang juga diperiksa adalah oksigenasi, CO2, EKG, dan tekanan darah. Sedangkan refleks adalah reaksi tidak sengaja dari hewan terhadap rangsangan seperti ditusuk atau dipukul. Refleks memberikan informasi terhadap kedalaman anestesi tetapi tidak berhubungan dengan keamanan anestesi atau mekanisme homeostasis pasien (McKelvey dan Hollingshead 2003).
2.6.1 Sistem Kardiovaskeler
Sistem kardiovaskuler adalah suatu sistem dalam tubuh yang terdiri dari jantung, pembuluh darah dan darah. Fungsi utama sistem kardiovaskuler adalah sebagai sistem sirkulasi atau alat transport. Sirkulasi darah akan mengangkut substansi penting untuk kesehatan dan kehidupan, seperti oksigen (O
2) dan nutrisi yang diperlukan oleh setiap sel dalam tubuh. Darah juga membawa karbondioksida (CO2 ) dan hasil sisa metabolisme tubuh dari tiap-tiap sel dan mengirimnya ke paru- paru, hati, atau ginjal sebagai tempat untuk pengeluaran (Cunningham 2002). Jantung berfungsi sebagai pompa yang melakukan tekanan terhadap darah untuk menimbulkan tekanan yang diperlukan agar darah dapat mengalir ke jaringan.
Pembuluh darah berfungsi sebagai saluran untuk mengarahkan dan mendistribusikan darah dari jantung ke semua bagian tubuh dan mengembalikan ke jantung (Sherwood 2001, Cunningham 2002).
Denyut jantung adalah hitungan berapa kali jantung berdenyut dalam satu menit. Pengamatan frekuensi denyut jantung dapat menggambarkan kualitas fungsi kardiovaskuler yang bertugas mengangkut O 2 dan nutrien ke seluruh jaringan tubuh, membawa limbah metabolisme dan mempertahankan homeostasis seluler.
Pengamatan frekuensi denyut jantung dapat dihitung secara auskultasi dengan mempergunakan stetoskop yang diletakkan tepat di atas apeks jantung di rongga dada sebelah kiri, atau dapat pula dengan merasakan pulsus hewan pada pembuluh darah arteri femoralis atau brachialis. Selain itu, pengukuran frekuensi denyut jantung 2, EKG, dan tekanan darah. Sedangkan refleks adalah reaksi tidak sengaja dari hewan terhadap rangsangan seperti ditusuk atau dipukul. Refleks memberikan informasi terhadap kedalaman anestesi tetapi tidak berhubungan dengan keamanan anestesi atau mekanisme homeostasis pasien (McKelvey dan Hollingshead 2003). dapat juga dilakukan dengan elektrokardiogram (EKG) (Cunningham 2002, Nelson 2003).
Denyut jantung minimal yang masih aman pada anjing teranestesi adalah 60 kali/menit. Denyut jantung yang lebih rendah menandakan kedalaman anestesi yang berlebihan atau ada gangguan. Denyut jantung yang umum pada hewan yang teranestesi adalah 60-120 kali per menit (anjing sehat 60-180x/menit). Penurunan denyut jantung pada kondisi teranestesi adalah normal, akibat adanya pengaruh sebagian besar anestetikum yang dapat menekan denyut jantung dan fungsi miokardiak. Hanya beberapa atestetika yang dapat meningkatkan denyut jantung seperti atropine, ketamine, dan tiletamin (McKelvey dan Hollingshead 2003).
26"
"
Selama dalam keadaan teranestesi, jantung dapat diamati dengan elektrokardiograf untuk melihat gambaran elektrokardiogram. Elektrokardiogram (EKG) adalah suatu rekaman keadaan yang menggambarkan konduksi listrik jantung.
Rekaman konduksi listrik jantung sangat umum digunakan secara klinis untuk mendiagnosa disfungsi listrik jantung. Depolarisasi atrial, depolarisasi ventrikel, dan repolarisasi ventrikel akan menyebabkan depleksi voltase yang khas dalam bentuk gelombang pada elektrokardiogram. Alat elektrokardiograf dapat digunakan untuk melihat gambaran elektrokardiogram dan denyut jantung (Cunningham 2002).
Selain EKG, tekanan darah juga dapat mempengaruhi terjadinya gangguan pada sistem kardiovaskuler. Tekanan darah arteri sangat dipengaruhi oleh cardiac output dan tahanan total perifer, denyut jantung, serta stroke volume. Peningkatan stroke volume atau cardiac output akan meningkatkan tekanan darah. Peningkatan tahanan perifer juga akan mempengaruhi peningkatan tekanan darah. Jadi penurunan denyut jantung, stroke volume atau tahanan perifer secara sendiri-sendiri atau dikombinasikan akan menurunkan tekanan darah arteri (Muir et al. 2000;
Cunningham 2002 ). Nilai normal denyut jantung, elektrokardiogram, dan tekanan darah arteri pada anjing disajikan pada Tabel 2.6.1
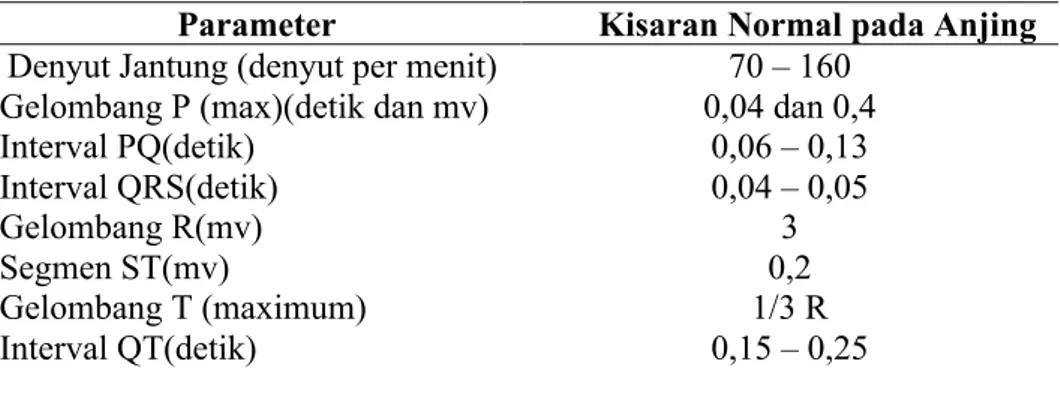
Tabel 2.6.1 Kriteria elektrokardiogram (EKG) normal pada anjing
Parameter Kisaran Normal pada Anjing Denyut Jantung (denyut per menit) 70 – 160
Gelombang P (max)(detik dan mv) 0,04 dan 0,4
Interval PQ(detik) 0,06 – 0,13
Interval QRS(detik) 0,04 – 0,05
Gelombang R(mv) 3
Segmen ST(mv) 0,2
Gelombang T (maximum) 1/3 R
Interval QT(detik) 0,15 – 0,25
Sumber : Nelson 2003 2.6.2 Suhu Rektal
Suhu rektal adalah variabel fisiologis yang paling sederhana dan mudah untuk diamati selama anestesi. Suhu rektal adalah parameter paling sederhana untuk diamati perubahannya dengan menggunakan alat fisiograf. Panas dalam tubuh berasal dari hasil metabolisme di dalam tubuh dan dari luar tubuh. Pada saat energi makanan dicerna, panas akan dihasilklan dari keseluruhan tahap proses metabolisme di dalam tubuh. Energi yang terdapat didalam makanan dirubah dalam bentuk panas, yang disebarkan ke lingkungan dan dipancarkan keseluruh permukaan.
Hewan akan melawan panas dari lingkungan bila suhu disekitarnya lebih besar dari suhu tubuh dan bila terpapar oleh radiasi panas. Hal yang sama juga terjadi jika hewan terpapar sinar matahari langsung atau berada dekat dengan benda padat yang lebih hangat dari pada suhu tubuhnya. Panas tubuh akan hilang menuju lingkungan sekitar melalui pemancaran dari permukaan tubuh menuju objek yang lebih dingin. Pemancaran panas terjadi melalui pergerakan udara atau air yang
28"
"
menjadi lebih hangat oleh tubuh, melalui penguapan sekresi respirasi, keringat atau saliva dan melalui penghantaran pada permukaan yang lebih dingin karena tubuh hewan bersentuhan. Panas juga hilang melalui urin dan feses. Banyak sumber panas dari metabolisme dalam tubuh, seperti hati, jantung, dan otot berada jauh dari kulit sebagai tempat pelepasan atau kehilangan panas, sehingga diperlukan pemindahan panas. Jaringan tubuh adalah penghantar panas yang tidak baik, sehingga panas dipindahkan terutama oleh pergerakan di dalam sirkulasi. Jantung dan pembuluh darah akan memegang peranan yang sangat penting untuk pemindahan panas di dalam tubuh (Cunningham 2002).
Salah satu penyebab hilangnya panas tubuh pada hewan selama teranestesi adalah penempatan hewan diatas meja operasi stainles steel dan ruangan operasi yang menggunakan pendingin ruangan atau air-conditioning dengan pengaturan suhu yang sangat rendah. Periode anestesi lama lebih dari 30 menit juga dapat menyebabkan penurunan suhu tubuh (Warren 1983; Muir et al. 2000).
Abnormalitas termoregulasi yang menyebabkan penurunan suhu tubuh selama hewan teranestesi disebabkan oleh kehilangan panas akibat produksi yang menurun, penekanan pada susunan syaraf pusat, terjadi vasodilatasi, penurunan produksi panas oleh aktivitas otot, penyuntikan cairan dengan suhu rendah, dan kapasitas tubuh yang terbuka terhadap kontak lingkungan (Muir et al. 2000). Perubahan suhu pada hewan yang teranestesi masih diperkenankan apabila masih berada pada batas-batas nilai normal. Suhu normal pada anjing adalah 37,5-39,2 oC (McKelvey dan Hollingshead
2003). C menyebabkan tujuh kali lipat peningkatan pada peredaran darah di kulit, penurunan temperatur pusat menyebabkan vasokonstriksi dan menggigil. Pengaruh reseptor pusat adalah duapuluh kali lipat lebih besar dari pada pengaruh reseptor perifer (Cunningham 2002; Nelson 2003).
2.7 Pemantauan Anestesi
Pemberian anestetikum yang kurang atau tidak mencukupi menyebabkan pasien akan tetap merasakan nyeri, masih dalam keadaan sadar, masih adanya refleks dan masih ada pergerakan. Apabila dosis anestetikum yang diberikan dalam keadaan cukup atau berlebihan, mengancam terjadinya kematian. Guna mencegah dua kejadian yang ekstrim tersebut, harus dilakukan pemantauan yang baik selama teranestesi. Pemantauan dilakukan terhadap fungsi respirasi, fungsi sirkulasi, dan temperatur tubuh serta tetap mempertahankan kedalaman anestesi (McKelvey dan Hollingshead 2003).
Kedalaman anestesi tidak dapat diberikan batasan yang tegas seperti terjaga, tertidur, maupun meninggal. Tetapi secara umum berdasarkan pengalaman, dapat digambarkan bahwa anestesi mempunyai empat tahap (4 stages) dimana tahap 3 (tahap anestesi untuk pembedahan) dibagi dalam 4 plane. Sedangkan pada binatang mempunyai banyak spesies, biasanya digunakan balanced anesthetic dengan kombinasi beberapa obat sehingga tahap-tahap anestesi tidak menjadi jelas. Anestesi pada hewan memerlukan pengawasan yang lebih sering dan lebih teliti untuk mengetahui tercapainya kedalaman anestesi, sehingga kedalaman anestesi tetap dapat
30"
"
diawasi serta dipertahankan, dan tidak berpengaruh buruk terhadap sistem vital.
Lebih dari satu tanda harus digunakan untuk mengetahui kedalaman anestesi, karena kedalaman anestesi tidak dapat ditentukan hanya dari satu tanda saja. Selama teranestesi harus tetap terjaga penyediaan oksigen yang cukup ke jaringan dan terbuangnya karbondioksida hasil respirasi. Jumlah oksigen yang cukup menuju jaringan sangat tergantung pada beberapa faktor seperti cardiac output, nilai saturasi aoksigen, dan Hb (McKelvey dan Hollingshead 2003; Tranquilli et al. 2007).Pada kondisi teranestesi, sistem fisiologi hewan akan mengalami penurunan terutama cardiac output dan penurunan efisiensi paru-paru (saturasi arteri), sehingga akan menyebabkan penurunan ketersediaaan O2 ke jaringan dan ditambah dengan kondisi sakit dapat menyebabkan hipoksia serta kematian.
Penggunaaan anestesi harus tetap mempertahankan kedalaman anestesi tetapi tetap juga menjaga agar tidak terjadi gangguan pada sistem kardiovaskuler dan respirasinya. Dua hal tersebut dapat dijaga hanya dengan memperhatikan refleks dan mengawasi tanda-tanda vital hewan. Refleks pedal, menjepit ekor dan telinga dapat digunakan untuk melihat bahwa anestesi sudah dalam dan anestesi tahap pembedahan sudah tercapai, tetapi tidak dapat digunakan untuk memantau bahwa anestesi terlalu dalam dan sudah membahayakan. Pada keadaan tahap anestesi yang terlalu dalam, hewan dapat dalam keadaan bahaya terhadap gagalnya respirasi dan kardiovaskuler.
Tanda-tanda vital pada aktivitas kardiovaskuler dan respirasi yang menunjukkan kegagalan atau bahaya harus diamati dengan baik seperti mata terbuka, nafas sangat
lambat dan dangkal, nafas sangat dalam, warna membrana mukosa membiru, dan tekanan darah yang sangat menurun (Wolfensohn dan Lloyd 2000; McKelvey dan Hollingshead 2003).
32"
"
BAB III
KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN
3.1 Kerangka Berpikir
Anestesi merupakan tahapan yang paling penting dalam tindakan pembedahan, karena tindakan pembedahan belum dapat dilakukan bila anestesi belum diberikan (Pretto, 2002). Anestesi memiliki resiko yang jauh lebih besar dari prosedur tindakan pembedahan karena nyawa pasien yang dianestesi dapat terancam.
Untuk pemilihan anestesi yang ideal dibutuhkan dalam menghasilkan sifat analgesi, sedasi, relaksasi, unconsciousness, keamanan dan kenyamanan untuk sistem vital, ekonomis dan mudah dalam aplikasi baik di lapangan ataupun di ruang operasi.
Sampai saat ini anestesi yang memenuhi kriteria yang ideal belum ada (Fossum 1997).
Anestetikum yang ideal harus memenuhi kriteria anestesi, yaitu sedasi, analgesi, relaksasi, ketidak sadaran, aman untuk sistem vital tubuh, ekonomis, dan mudah diaplikasikan. Anestesi umum secara parenteral merupakan anestesi yang lebih ekonomis dan praktis untuk penanganan hewan di lapangan, tetapi menghasilkan anestesi yang kurang stabil dan sering memerlukan penambahan dosis jika tindakan medis memerlukan waktu yang lebih lama. Pemberian secara subkutan memiliki waktu penyerapan obat yang agak lambat sehingga diharapkan untuk dalam menambah waktu teranestesi, aman dan meliki kestabilan fisiologis tubuh pasien saat teranestesi.
"
"
"
32"