AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL DAGING BUAH LABU KUNING (Cucurbita moschata D.) DENGAN METODE
PEMERANGKAPAN ABTS SKRIPSI
OLEH:
ANDANI DWI LUKITA NIM 171501104
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL DAGING BUAH LABU KUNING (Cucurbita moschata D.) DENGAN METODE
PEMERANGKAPAN ABTS SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
OLEH:
ANDANI DWI LUKITA NIM 171501104
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
iv
KATA PENGANTAR
Puji dan syukur kehadirat Allah yang Maha Kuasa yang telah melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Aktivitas Antioksidan Ekstrak Etanol Daging Buah Labu Kuning (Cucurbita moschata D.) dengan Metode Pemerangkapan ABTS”. Skripsi ini diajuka nsebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Buah Labu kuning (Cucurbita moschata D.) merupakan suatu jenis tanaman sayuran menjalar dari famili Cucurbitaceae dan merupakan sayuran penting karena nilai nutrisinya dan manfaat kesehatannya. Buah Labu kuning kaya akan sumber karetonoid dan memiliki senyawa flavonoid turunan dari senyawa fenolik yang keduanya dapat berpotensi sebagai antioksidan. Tujuan penelitian ini adalah untuk mengetahui aktivitas antioksidan dari buah labu kuning (Cucurbita moschata D.) dengan menggunakan ekstrak etanol terhadap radikal bebas ABTS.
Pada kesempatan ini, penulis menyampaikan terimakasih yang sebesar- besarnya kepada Ibu Khairunnisa, S.Si., M.Pharm., Ph.D., Apt. selaku Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan bantuan dan fasilitas selama masa pendidikan. Bapak Prof. Dr. Ginda Haro, M.Sc., Apt., selaku pembimbing saya yang telah membimbing saya selama penelitian hingga selesainya skripsi ini. Ibu Suwarti Aris, M.Si., Apt dan Ibu Henny Sri Wahyuni, S.Farm., M.Si., Apt., selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan skripsi ini. (Alm) Bapak Drs.
Suryanto, M.Si., Apt dan Ibu Poppy Anjelisa Hasibuan, S.Si., M.Si., Apt., selaku penasehat akademik yang selalu memberi bimbingan, perhatian dan motivasi
v
kepada penulis selama masa perkuliahan. Bapak dan Ibu Dosen Staf Pengajar Fakultas Farmasi Universitas Sumatera Utara yang telah mendidik selama masa perkuliahan serta seluruh Staf Administrasi Fakultas Farmasi Universitas Sumatera Utara.
Penulis juga mengucapkan terima kasih dan penghargaan yang tulus kepada kedua orangtua, Ayahanda Bayu Hendro Sukmono, S.Sos. dan Ibunda Sri Widyaningsih, Amd. titi Winarti, abang Mahendra Gerry Pramudito, S.IP., adik Witnu Bayu Widyanto, serta pakde Siswoko yang telah memberikan cinta dan kasih sayang, do’a, semangat, dorongan dan pengorbanan baik moril maupun materil kepada penulis selama ini.
Terimakasih juga penulis ucapkan kepada Asyifa, Fitrie, Audrey, Kiki, Mellita, Sarah, teman seperdopingan, Asisten Laboratorium Kimia Farmasi Kuantitatif dan Laboran Kak Putri, serta sahabat-sahabat stambuk 2017 Fakultas Farmasi USU atas dukungan dan motivasi yang diberikan kepada penulis selama ini, hingga akhirnya penulis dapat menyelesaikan skripsi ini.
Penulis menyadari bahwa masih banyak kekurangan yang terdapat dalam skripsi ini. Untuk itu, penulis mengharapkan kritik dan saran yang membangun dari semua pihak guna perbaikan skripsi ini. Akhir kata, penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan, terkhusus dalam bidang farmasi.
Medan, 10 Juni 2021 Penulis,
Andani Dwi Lukita NIM 171501104
vii
AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL DAGING BUAH LABU KUNING (Cucurbita moschata D.) DENGAN METODE
PEMERANGKAPAN ABTS
ABSTRAK
Latar Belakang: Buah Labu kuning (Cucurbita moschata D) merupakan suatu jenis tanaman dari famili Cucurbitaceae dan merupakan sayuran penting karena nilai nutrisi dan manfaat kesehatannya. Daging Buah Labu kuning kaya akan sumber karetonoid dan memiliki senyawa flavonoid turunan dari senyawa fenolik yang keduanya dapat berpotensi sebagai antioksidan.
Tujuan: Tujuan dari penelitian ini adalah untuk mengetahui aktivitas antioksidan dari ekstrak etanol daging buah labu kuning (Cucurbita moschata D.) dengan metode pemerangkapan ABTS (2,2’-azino-bis(3-ethylbenz-thiazoline-6-sulfonic acid).
Metode: Serbuk simplisia dikarakterisasi dan diskrining, kemudian selanjutnya diekstraksi dengan Metode Maserasi menggunakan pelarut etanol 96%. Maserat yang diperoleh dipekatkan dengan rotary evaporator hingga didapatkan ekstrak kental. Pengujian aktivitas antioksidan dilakukan dengan menggunakan Metode ABTS (2,2’-azino-bis(3-ethylbenz-thiazoline-6-sulfonic acid) sebagai radikal bebas dengan mengukur absorbansi pada panjang gelombang 734 nm menggunakan alat Spektrofotometer UV-Vis. Kemampuan antioksidan diukur sebagai penurunan absorbansi larutan ABTS setelah penambahan ekstrak dengan konsentrasi yang berbeda.
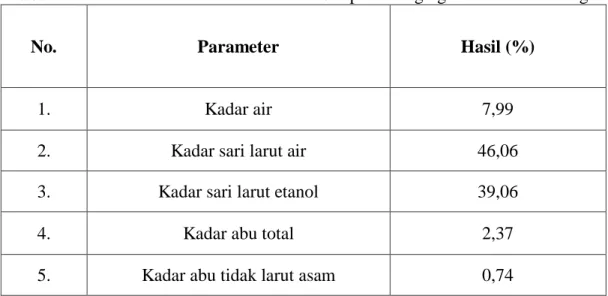
Hasil: Hasil skrining fitokimia dari simplisia buah labu kuning mengandung alkaloid, flavonoid dan glikosida. Hasil karakteristik simplisia diperoleh : kadar air 7,99% ; kadar sari larut air 46,06%; kadar sari larut etanol 39,065% ; kadar abu total 2,37% ; kadar abu tidak larut asam 0,74%. Hasil pengukuran aktivitas antioksidan pada metode ABTS (2,2’-azino-bis(3-ethylbenz-thiazoline-6-sulfonic acid) menunjukkan bahwa ekstrak etanol buah labu kuning memiliki aktivitas antioksidan dalam kategori sedang dengan nilai IC50 (Inhibitory Concentration) sebesar 175,672 μg/mL dan sebagai pembanding adalah trolox dengan nilai IC50
(Inhibitory Concentration) sebesar 33,177 μg/mL.
Kesimpulan: Hasil penelitian dapat disimpulkan bahwa ekstrak etanol daging buah labu kuning memiliki aktivitas antioksidan dengan kategori sedang.
Kata kunci: ABTS, antioksidan, Cucurbita moschata D., nilai IC50,
spektrofotometer UV-Vis.
viii
ANTIOXIDANT ACTIVITY OF THE ETHANOL EXTRACT OF PUMPKIN (Cucurbuta moschata D.) FLESH BY USING
ABTS TRAPPING METHOD
ABSTRACT
Background: Pumpkin (Cucurbita moschata Duch) is a type of plant that spreads from the Cucurbitaceae family and is an important vegetable due to its nutritional value and health benefits. Pumpkin flesh is a rich source of karetonoid and has flavonoid compounds derived from phenolic, both of which can be potential as antioxidants.
Objective: The purpose of this research was to determine the antioxidant activity of the ethanol extract of pumpkin (Cucurbita moschata D.) flesh by the ABTS (2,2'- azino-bis (3-ethylbenz-thiazoline-6-sulfonic acid) trapping method.
Method: The simplicia was characterized and screened phytochemically, The extracts was obtained by maceration method using ethanol 96% as a solvent and concentrated using rotary evaporator. Antioxidant activity of extracts were then tested using ABTS (2,2'-azino-bis (3-ethylbenz-thiazoline-6-sulfonic acid) assay at wavelength of 734 nm an using a UV-Vis Spectrophotometer. The antioxidant ability was measured as a decrease in absorbance of ABTS solution after the addition of each extract with different concentrations.
Result: The results of phytochemical screening of pumpkin simplicia contained chemical compounds such as alkaloids, flavonoids and glycosides. The characterization obtained: water content of 7.99%; water-soluble extract 46.06%;
ethanol-soluble extract 39.06%; total ash 2.37%; acid insoluble ash 0.74%. The results of measuring antioxidant activity in the ABTS (2,2'-azino-bis (3-ethylbenz- thiazoline-6-sulfonic acid) method showed that the ethanol extract of pumpkin had antioxidant activity in the moderate category with an IC50 (Inhibitory Concentration) value of 175.672 μg / mL and as a comparison is trolox with IC50
(Inhibitory Concentration) value of 33.177 μg / mL.
Conclusion: It showed that the ethanol extract of pumpkin flesh had moderate antioxidant activity.
Keywords: ABTS, antioxidants, Cucurbita moschata D., IC50 value, UV-Vis spectrophotometer
ix
DAFTAR ISI
HALAMAN JUDUL ... i
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
SURAT PERNYATAAN ORISINALITAS ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR GAMBAR DALAM LAMPIRAN ... xiv
DAFTAR LAMPIRAN ...xv
BAB I PENDAHULUAN ...1
1.1 Latar Belakang ...1
1.2 Perumusan Masalah ...4
1.3 Hipotesis ...5
1.4 Tujuan Penelitian ...5
1.5 Manfaat Penelitian ...5
1.6 Kerangka Pikir ...6
BAB II TINJAUAN PUSTAKA ...7
2.1 Uraian Tumbuhan ...7
2.1.1 Sistematika Tumbuhan ...7
2.1.2 Nama Lain ...7
2.1.3 Morfologi Tumbuhan...7
2.1.4 Khasiat Tumbuhan ...8
2.1.5 Kandungan Kimia ...8
2.2 Simplisia, Ekstrak dan Ekstraksi ...9
2.2.1 Simplisia ...9
2.2.2 Ekstrak ...9
2.2.3 Ekstraksi ...10
2.3 Radikal Bebas ...12
2.3.1 Definisi ...12
2.3.2 Mekanisme kerja ...14
2.4 Antioksidan ...16
2.4.1 Penggolongan antioksidan ...16
2.4.2 Sumber-sumber antioksidan ...17
2.5 Metode Pengujian Antioksidan ...20
2.6 Metode ABTS (2,2 Azinobis (3-ethylbenothiazoline) 6-Sulfonic Acid) ...20
2.7 Spektrofotometri UV-Visibel ...22
2.8 Trolox-C ...23
BAB III METODE PENELITIAN...24
3.1 Jenis Penelitian ...24
3.2 Alat ...24
3.3 Bahan ...24
3.4 Penyiapan Bahan Tanaman ...25
3.4.1 Pengumpulan Bahan Tanaman ...25
3.4.2 Identifikasi Tanaman ...25
x
3.4.3 Pengolahan Bahan Tanaman...25
3.5 Pembuatan Pereaksi ...26
3.5.1 Pereaksi Asam Klorida 2 N ...26
3.5.2 Pereaksi Asam Sulfat 2N ...26
3.5.3 Pereaksi Besi (III) Klorida 1% ...26
3.5.4 Pereaksi Bourchardat ...26
3.5.5 Pereaksi Dragendorf ...26
3.5.6 Pereaksi Liebermann-Burchard ...26
3.5.7 Pereaksi Mayer ...27
3.5.8 Pereaksi Molisch ...27
3.5.9 Timbal (III) Asetat 0,4 M ...27
3.5.10 ABTS (2,2’Azino-bis(3-etilbenzotiazolin sulfonat)) ...27
3.5.11 Kalium Persulfat (K2S2O8) ...27
3.5.12 PBS pH 7,4 (Phosphate Buffer Saline) ...27
3.6 Pemeriksaan Karakteristik Simplisia ...28
3.6.1 Pemeriksaan Makroskopik ...28
3.6.2 Pemeriksaan Mikroskopik ...28
3.6.3 Penetapan Kadar Air ...28
3.6.4 Penetapan Kadar Sari Larut Air ...29
3.6.5 Penetapan Kadar Sari Larut Etanol...29
3.6.6 Penetapan Kadar Abu Total ...30
3.6.7 Penetapan Kadar Abu Tidak Larut Dalam Asam ...30
3.7 Skrining Fitokimia ...30
3.7.1 Pemeriksaan Alkaloida ...30
3.7.2 Pemeriksaan Flavonoida ...31
3.7.3 Pemeriksaan Glikosida ...31
3.7.4 Pemeriksaan Saponin ...31
3.7.5 Pemeriksaan Tanin ...32
3.7.6 Pemeriksaan Steroid/Triterpenoid ...32
3.8 Prosedur Kerja ...32
3.8.1 Pembuatan Ekstrak Daging Buah Labu Kuning ...32
3.9 Pengujian Kemampuan Aktivitas Antioksidan ...33
3.9.1 Prinsip Metode Pemerangkapan ABTS ...33
3.9.2 Pembuatan Larutan Blanko ABTS ...33
3.9.3 Pembuatan Larutan Induk Trolox ...33
3.9.4 Pengukuran Panjang Gelombang Serapan Maksimum...34
3.9.5 Pengukuran Aktivitas Antioksidan ...34
3.9.6 Analisis Nilai IC50 ...35
BAB IV HASIL DAN PEMBAHASAN ...36
4.1 Hasil Identifikasi Tumbuhan ...36
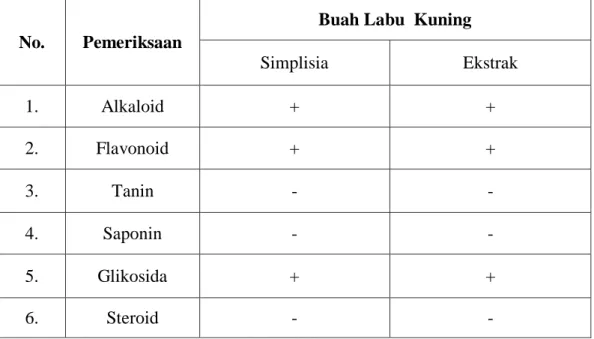
4.2 Hasil Skrining Fitokimia ...36
4.3 Hasil Pemeriksaan Karakterisasi Simplisia Buah Labu Kuning ...37
4.3.1. Hasil Pemeriksaan Makroskopik ...37
4.3.2. Hasil Pemeriksaan Mikroskopik ...38
4.3.3. Karakteristik Simplisia ...38
4.4 Hasil Ekstraksi Serbuk Buah Labu Kuning ...40
4.5 Hasil Pemeriksaan Karakterisasi Ekstrak Buah Labu Kuning ...40
xi
4.6 Hasil Aktivitas Antioksidan Ekstrak Daging Buah Labu Kuning dengan
Menggunakan Metode ABTS ...41
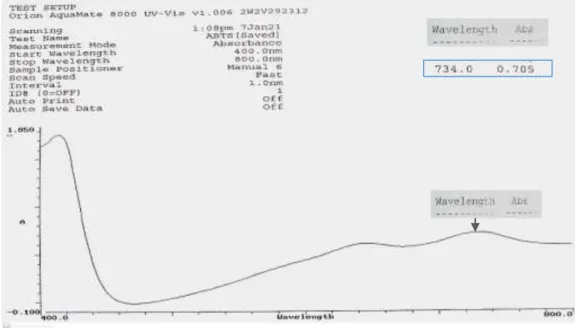
4.6.1 Hasil Penentuan Panjang Gelombang Serapan Maksimum ( λ maks) ...41
4.6.2 Hasil Penentuan Operating Time ...42
4.7 Hasil Analisis Aktivitas Antioksidan pada Ekstrak Etanol Daging Buah Labu Kuning dan Trolox dengan Metode ABTS ...43
4.8 Hasil Analisis Nilai IC50 dari Ekstrak Etanol Daging Buah Labu Kuning dan Trolox Metode ABTS ...45
BAB V KESIMPULAN DAN SARAN ...47
5.1 Kesimpulan ...47
5.2 Saran ...47
DAFTAR PUSTAKA ...48
LAMPIRAN ...51
xii
DAFTAR TABEL
4.1 Hasil Skrining Fitokimia Simplisia dan Ekstrak Etanol Buah Labu Kuning .. 37
4.2 Hasil Pemeriksaan Karakteristik Simplisia Buah Labu Kuning ... 39
4.3 Hasil Pemeriksaan Karakteristik Ekstrak Etanol Buah Labu Kuning ... 42
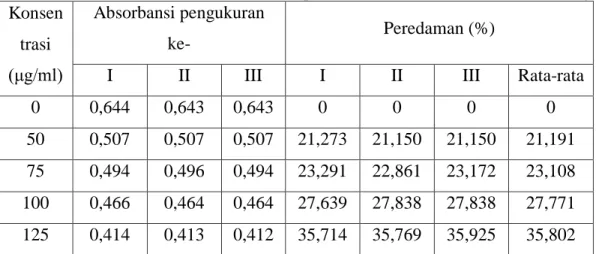
4.4 Nilai Persen Peredaman ABTS pada Ekstrak Etanol Buah Labu Kuning ... 44
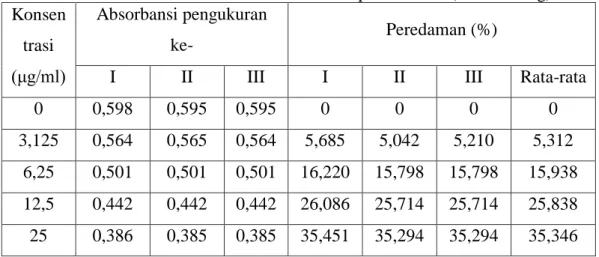
4.5 Nilai Persen Peredaman ABTS pada Trolox (Pembanding) ... 45
4.6 Hasil Persamaan Regresi dan Nilai IC50 dari Sampel Uji dan Pembanding Metode ABTS ... 46
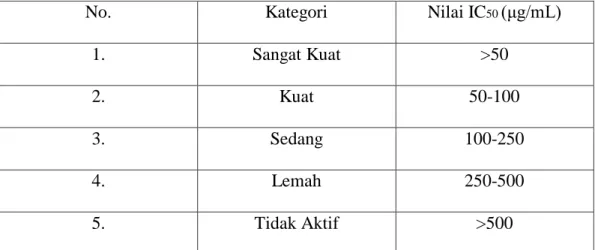
4.7 Kategori Nilai IC50 Sebagai Antioksidan ... 47
xiii
DAFTAR GAMBAR
1.1 Skema Kerangka Pikir Penelitian ... 6
2.1 Reaksi Pembentukan Radikal Bebas dari ABTS ... 22
2.2 Trolox-C ... 24
4.1 Panjang Gelombang Serapan Maksimum ABTS dalam PBS pH 7,4 ... 43
xiv
DAFTAR GAMBAR DALAM LAMPIRAN
1. Rotary Evaporator ... 53
2. Spektrofotometry UV-Vis ... 53
3. Hasil Makroskopik Buah Labu Kuning ... 54
4. Hasil Makroskopik Simplisia Kering Buah Labu Kuning ... 54
5. Hasil Mikroskopik Simplisia Buah Labu Kuning ... 55
xv
DAFTAR LAMPIRAN
1. Surat Hasil Identifikasi Tumbuhan... 52
2. Gambar Alat ... 53
3. Gambar Makroskopik Buah Labu Kuning ... 54
4. Gambar Makroskopik Buah Labu Kuning ... 54
5. Gambar Mikroskopik Buah Labu Kuning ... 55
6. Hasil Rendemen Ekstrak Daging Buah Labu Kuning ... 56
7. Bagan Kerja Penelitian ... 57
8. Perhitungan Pemeriksaan Karakterisasi Simplisia Buah Labu Kuning ... 60
9. Perhitungan Karakterisasi Ekstrak Buah Labu Kuning ... 65
10. Hasil Penentuan Waktu Kerja (Operating Time) Uji Antioksidan Metode ABTS ... 68
11. Hasil Uji Aktivitas Antioksidan ... 69
12. Perhitungan Nilai IC50 ... 76
1
BAB I PENDAHULUAN
1.1 Latar Belakang
Radikal bebas merupakan suatu molekul yang memiliki elektron tidak berpasangan dalam orbital terluarnya sehingga sangat reaktif. Radikal ini cenderung mengadakan reaksi berantai yang apabila terjadi didalam tubuh akan dapat menimbulkan kerusakan-kerusakan yang berlanjut dan terus menerus. Jumlah radikal bebas dapat mengalami peningkatan yang diakibatkan karena faktor stress, radiasi, asap rokok, dan polusi lingkungan (Wardaningsih, dkk., 2011). Tingginya radikal bebas dalam tubuh dapat memicu munculnya berbagai penyakit degeneratif.
Oleh sebab itu, tubuh kita memerlukan suatu substansi penting, yakni antioksidan yang dapat membantu melindungi tubuh dari serangan radikal bebas dan meredam dampak negatifnya (Winarsi, 2007).
Mengkonsumsi antioksidan dapat menurunkan penyakit degeneratif, seperti osteoporosis, kardiovaskular, kanker, dan lain- lain. Selain itu, konsumsi makanan dan minuman yang mengandung antioksidan juga dapat meningkatkan sistem imun dalam tubuh serta menghambat timbulnya penyakit akibat penuaan (Winarsi, 2007).
Antioksidan adalah suatu atom atau molekul pemberi elektron yang dapat meredam dampak negatif radikal bebas. Antioksidan mampu menetralkan radikal bebas atau bahan yang dapat mencegah sistem biologi tubuh dari efek yang merugikan yang timbul dari proses ataupun reaksi yang menyebabkan oksidasi yang berlebihan (Septiani dkk., 2018).
Mekanisme kerja senyawa antioksidan salah satunya yaitu dengan cara mendonorkan atom hidrogen atau proton kepada senyawa radikal. Hal ini
2
menjadikan senyawa radikal berubah sifat dari yang tidak stabil menjadi lebih stabil. Antioksidan sintesis yang selama ini sering digunakan oleh masyarakat yaitu Butil Hidroksi Anisol (BHA) dan Butil Hidroksil Toluen (BHT). Namun pada penggunaannya, obat ini menimbulkan efek samping seperti dapat merusak paru- paru dan hati serta bersifat karsinogenik. Hal ini menjadikan penelitian mengenai senyawa antioksidan yang berasal dari sumber alam seperti tumbuhan yang lebih aman sangat diperlukan (Fitriana dkk., 2015).
Sumber antioksidan alami adalah tumbuhan yang umumnya mengandung senyawa fenolik yang banyak tersebar di seluruh bagian tumbuhan baik di kayu, biji, daun, buah, akar, bunga maupun serbuk sari. Senyawa fenolik atau polifenolik dapat berupa golongan flavonoid. Kemampuan flavonoid sebagai antioksidan telah banyak diteliti, dimana flavonoid memiliki kemampuan untuk mereduksi radikal bebas dan juga sebagai anti radikal bebas (Zuhra dkk., 2008). Antioksidan secara alami bisa didapatkan dari makanan. Beberapa contoh makanan sumber antioksidan antara lain: wortel, brokoli, sayur hijau, bayam, labu, hati, kentang, telur, aprikot, mangga, susu dan ikan (Sayuti, 2015).
Labu kuning termasuk dalam keluarga Cucurbitaceae, tanaman ini tumbuh tidak hanya sebagai tanaman pangan tapi juga untuk makanan hewani. Labu kuning (Cucurbita moschata) merupakan sayuran penting karena nilai nutrisinya dan manfaat kesehatannya. Tanaman ini kaya akan sumber karotenoid, fenolat, flavonoid polisakarida, garam mineral, dan vitamin yang semuanya bermanfaat bagi kesehatan (Aukkanit dan Sirichokworrakit, 2017). Buah labu kuning mengandung senyawa karotenoid misalnya senyawa beta karoten yang dapat berperan sebagai anti oksidan dan antifotooksidasi yang dapat menghambat proses oksidasi didalam tubuh manusia (Gumolung, 2013). Betakaroten merupakan salah
3
satu provitamin A yang berperan sebagai antioksidan dengan cara memperlambat fase inisiasi radikal bebas. Pemberian betakaroten dalam jumlah banyak dapat memenuhi kebutuhan vitamin A dan selebihnya tetap sebagai betakaroten yang berfungsi sebagai antioksidan (Silalahi, 2006).
Senyawa fenolik terutama flavonoid juga banyak ditemukan pada buah labu kuning. Berdasarkan penelitian yang telah dilakukan oleh Adlhani (2014), bahwa buah labu kuning menunjukkan hasil positif untuk golongan senyawa flavonoid.
Senyawa fenolik mempunyai struktur dan sifat yang khas, yaitu memiliki satu atau lebih gugus hidroksil yang terikat pada satu atau lebih cincin aromatik benzena, sehingga senyawa ini dapat teroksidasi. Kemampuannya membentuk radikal fenoksi yang stabil pada proses oksidasi, menyebabkan senyawa ini banyak digunakan sebagai antioksidan (Matheos et all, 2014).
Pengujian antioksidan mempunyai beberapa metode yaitu xanthine oxidase inhibitory activity, β carotene linoleic acid ,1,1-diphenyl-2-picrylhydrazyl (DPPH) scavenging activity, reducimg power, dan ABTS (2,2 Azinobis (3- ethylbenothiazoline) 6-Sulfonic Acid) (Rosidah dkk., 2008). Pengujian aktivitas antioksidan dalam penelitian ini menggunakan metode ABTS. Metode ABTS dapat digunakan untuk mengukur aktivitas antioksidan yang bersifat hidrophilik maupun lipophilik dalam ekstrak makanan dan cairan. Metode peredaman radikal bebas ABTS merupakan metode pengujian untuk mengukur jumlah radikal bebas yang dapat ditangkal oleh antioksidan yang dikenal dengan aktivitas antioksidan. Selain memiliki sensitivitas yang cukup tinggi, kelebihan ABTS dibandingkan dengan metode lain yaitu pengujiannya yang sederhana, efektif, cepat, dan mudah diulang.
Metode ABTS dapat digunakan untuk mengetahui konsentrasi antioksidan yang mampu menghambat radikal bebas sebanyak 50% (IC50) (Sherlawaty, 2016).
4
Prinsip uji ABTS adalah penghilangan warna kation ABTS untuk mengukur kapasitas antioksidan yang langsung bereaksi dengan kation radikal ABTS dengan penambahan natrium persulfat. ABTS mempunyai karakteristik warna biru-hijau, yang bila tereduksi oleh antioksidan akan berubah menjadi bentuk nonradikal, dari berwarna menjadi tidak berwarna. Kemampuan aktivitas antioksidan secara spektrofotometer pada panjang gelombang 734 nm (Martysiak dkk., 2011).
Berdasarkan uraian di atas menunjukan bahwa labu kuning memiliki potensial yang sangat besar sebagai sumber senyawa yang berperan sebagai antioksidan alami seperti senyawa beta karoten dan fenolik, maka penulis melakukan penelitian untuk mengetahui aktivitas antioksidan dari ekstrak etanol daging buah labu kuning (Cucurbita moschata D.) dengan menggunakan metode pemerangkapan radikal bebas ABTS (2,2’-azino-bis(3-ethylbenz-thiazoline-6- sulfonic acid).
1.2 Perumusan Masalah
Berdasarkan uraian di atas maka perumusan masalah pada penelitian ini adalah sebagai berikut:
a. Apakah ekstrak etanol daging buah labu kuning (Cucurbita moschata D.) memiliki aktivitas antioksidan dengan menggunakan metode pemerangkapan ABTS?
b. Berapa nilai 𝐼𝐶50 dari ekstrak etanol daging buah labu kuning (Cucurbita moschata D.) terhadap ABTS?
5 1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis penelitian adalah sebagai berikut :
a. Ekstrak etanol daging buah labu kuning (Cucurbita moschata D.) memiliki aktivitas antioksidan dengan menggunakan metode pemerangkapan ABTS.
b. Ekstrak etanol daging buah labu kuning (Cucurbita moschata D.) memiliki nilai 𝐼𝐶50 terhadap ABTS dengan nilai tertentu.
1.4 Tujuan Penelitian
Adapun tujuan penelitian adalah sebagai berikut :
a. Untuk mengetahui adanya aktivitas antioksidan dari ekstrak etanol daging buah labu kuning (Cucurbita moschata D.) dengan menggunakan metode pemerangkapan ABTS.
b. Untuk mengetahui nilai 𝐼𝐶50 dari ekstrak etanol daging buah labu kuning (Cucurbita moschata D.) terhadap ABTS.
1.5 Manfaat Penelitian
Manfaat penelitian ini adalah untuk memberikan informasi kepada masyarakat bahwa labu kuning mengandung senyawa antioksidan yang berfungsi sebagai anti radikal bebas sehingga labu kuning dapat dimanfaatkan sebagai makanan fungsional yang berguna bagi kesehatan tubuh.
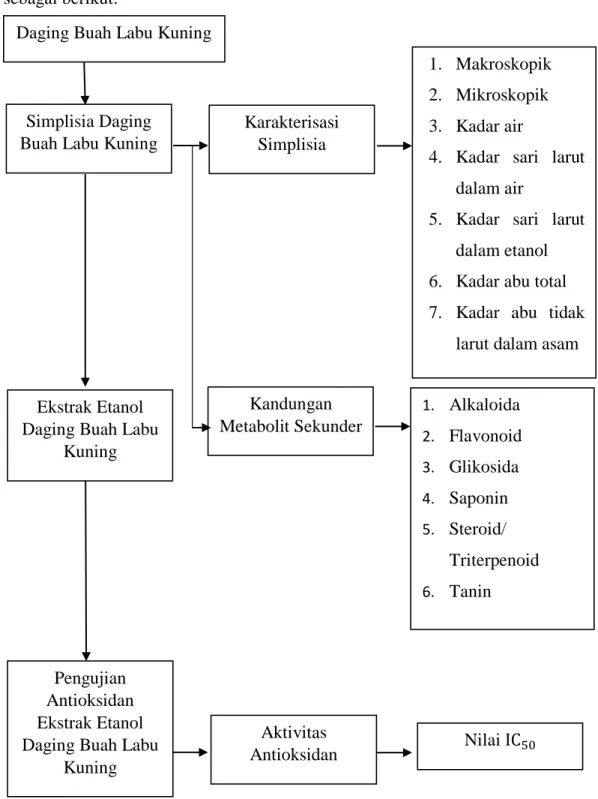
6 1.6 Kerangka Pikir
Penelitian Penelitian ini dilaksanakan berdasarkan kerangka pikir penelitian sebagai berikut:
Variabel bebas Variabel terikat Parameter
Gambar 1.1 Skema Kerangka Pikir Penelitian Simplisia Daging
Buah Labu Kuning
Karakterisasi Simplisia
1. Makroskopik 2. Mikroskopik 3. Kadar air
4. Kadar sari larut dalam air
5. Kadar sari larut dalam etanol 6. Kadar abu total 7. Kadar abu tidak
larut dalam asam
Kandungan Metabolit Sekunder
1. Alkaloida 2. Flavonoid 3. Glikosida 4. Saponin 5. Steroid/
Triterpenoid 6. Tanin
Ekstrak Etanol Daging Buah Labu
Kuning
Pengujian Antioksidan Ekstrak Etanol Daging Buah Labu
Kuning
Aktivitas
Antioksidan Nilai IC50
Daging Buah Labu Kuning
7
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan 2.1.1 Klasifikasi Tumbuhan
Menurut Herbarium Medanese (MEDA) (2020), sistematika tumbuhan buah labu kuning diklasifikasikan sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledoneae Ordo : Cucurbitales Family : Cucurbitaceae Genus : Cucurbita
Species : Cucurbita moschata (Duchesne.) Duchesne ex Poir.
2.1.2 Nama Lain
Labu mempunyai nama lain yaitu Cucurbita moschata (nama ilmiah), pumkin atau winter squash, squash pumkin (nama inggris), labu parang, labu
ambon, labu merah, labu kastela, waluh (nama Indonesia) (Smith, 2002).
2.1.3 Morfologi Tumbuhan
Labu kuning (Cucurbita maxima Duch) merupakan suatu jenis tanaman sayuran menjalar dari famili Cucurbitaceae, yang tergolong dalam jenis tanaman semusim yang setelah berbuah akan langsung mati. Batang labu kuning menjalar cukup kuat, bercabang banyak, berbulu agak tajam, dengan panjang batang yang mencapai 5 - 10 m. Daun labu kuning berwarna hijau keabu - abuan, lebar dengan garis tengah mencapai 20 cm, menyirip, ujung agak runcing, tulang daun tampak
8
jelas, berbulu agak halus dan agak lembek sehingga bila terkena sinar matahari akan menjadi layu. Letak daun labu kuning ini berselang - seling antar batang dengan panjang tangkai daun 15 - 20 cm (Krissetiana, 1995).
Buah labu kuning berbentuk bulat pipih, lonjong atau panjang dengan banyak alur (15-30 alur). Ukuran pertumbuhannya cepat sekali, mencapai 350 g perhari. Buahnya besar dan warnanya bervariasi (buah muda berwarna hijau, sedangkan yang lebih tua berwarna kuning pucat). Daging buah tebalnya sekitar 3 cm dan rasanya agak manis. Bobot buah rata-rata 3-5 kg. Untuk labu ukuran besar, beratnya ada yang mencapai 20 kg per buah. Buah labu kuning mempunyai kulit yang sangat tebal dan keras, sehingga dapat bertindak sebagai penghalang laju respirasi, keluarnya air melalui proses penguapan, maupun masuknya udara penyebab proses oksidasi. Hal tersebutlah yang menyebabkan labu kuning relatif awet dibanding buah-buahan lainnya. Daya awet dapat mencapai enam bulan atau lebih, tergantung pada cara penyimpanannya. Namun buah yang telah dibelah harus segera diolah karena akan sangat mudah rusak (Nuraini, 2011).
2.1.4 Khasiat Tumbuhan
Manfaat labu untuk kesehatan diantaranya terapi untuk menyembuhkan radang, pengobatan ginjal, demam, dan pengobatan diare. Labu kuning juga dapat mengurangi risiko penyakit jantung koroner, kadar glukosa darah dan kadar kolesterol serum. Selain itu, mencegah stres oksidatif dan meningkatkan kekebalan karena aktivitas antioksidannya (Murkovic, dkk., 2002; Nurwahida, 2018).
2.1.5 Kandungan Kimia
Labu kuning (Cucurbita moschata) merupakan sayuran buah yang tidak mengandung lemak jenuh dan kaya akan kalori, serat makanan, antioksidan, mineral, dan vitamin. Senyawa fenolik (flavonoid, asam fenolik), mineral (terutama
9
kalium), vitamin (termasuk b-karoten, vitamin A, vitamin B2, a-tokoferol, vitamin C, dan vitamin E), protein dan karbohidrat, tanaman sayuran ini sangat penting dalam memberikan manfaat kesehatan manusia (Enneb, dkk., 2020; Nurwahida, 2018). Labu kuning mengandung energi 29 kkal, air 91,20 g, protein 1,10 g, lemak 0,30 g, karbohidrat 6,60 g, kalsium 45,00 mg, fosfor 64 ,00 mg, besi 1,40 mg, vitamin A 180,00 SI, vitamin B1 0.08 mg, vitamin C 52 mg (Sudarto, 2008).
Kandungan gizi labu kuning dikenal kaya akan karetonoid uang berfungsi sebagai antioksi dan beta karoten yang mempunyai aktivitas biologis sebagai provitamin-A dan berfungsi sebagai antioksidan. Labu kuning mengandung karetonoid yang tinggi mencapai 160 mg/100 gr. Pigmen warna kuning, merah dan oranye berfungsi sebagai prekursor vitamin A dan antioksidan (Amanati, 2019).
2.2 Simplisia, Ekstrak dan Ekstraksi 2.2.1 Simplisia
Simplisia merupakan bahan yang berasal dari alam yang dapat digunakan sebagai obat dimana bahan alam tersebut belum diolah dan masih berupa bahan yang telah dikeringkan. Simplisia dapat dibedakan menjadi 3 yaitu simplisia nabati, simplisia hewani, dan simplisia pelikan (mineral). Simplisia nabati merupakan simplisia berupa tumbuhan utuh, bagian tumbuhan ataupun eksudat tumbuhan.
Eksudat adalah isi sel dari tumbuhan yang secara spontan keluar dari tumbuhan atau isi sel yang dengan cara tertentu dipisahkan dari tumbuhannya dan belum berupa senyawa kimia murni (Ditjen POM, 2000).
2.2.2 Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dari simplisia nabati atau
10
simplisia hewani dengan cara ekstraksi senyawa aktif yang menggunakan pelarut yang sesuai, kemudian hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Depkes RI, 1995).
Ekstrak cair adalah sediaan dari simplisia nabati yang mengandung etanol sebagai pelarut atau sebagai pengawet. Jika tidak dinyatakan lain pada masing- masing monografi tiap mL ekstrak mengandung senyawa aktif dari 1 g simplisia yang memenuhi syarat. Ekstrak cair yang cenderung membentuk endapan dapat didiamkan dan disaring atau bagian yang bening dienap tuangkan (dekantasi).
Ekstrak cair dapat dibuat dari ekstrak yang sesuai (Ditjen POM, 2000).
2.2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang larut menggunakan pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan kedalam golongan minyak atsiri, alkaloid, flavonoid, dan lain-lain. Tujuan dari ekstraksi adalah untuk menarik semua zat aktif dan komponen kimia yang terdapat dalam simplisia (Ditjen POM, 2000).
Proses ekstraksi pada dasarnya adalah proses perpindahan massa dari komponen zat padat yang terdapat pada simplisia ke dalam pelarut organik yang digunakan. Pelarut organik akan menembus dinding sel dan selanjutnya akan masuk ke dalam rongga sel tumbuhan yang mengandung zat aktif. Zat aktif akan terlarut dalam pelarut organik. Ekstraksi dapat dilakukan dengan berbagai metode dan cara yang sesuai dengan sifat dan tujuan ekstraksi (Marjoni, 2016).
Menurut Ditjen POM (2000) menyatakan beberapa metode ekstraksi yang
11
sering digunakan dalam berbagai penelitian antara lain, yaitu:
a. Cara dingin
Metode ekstraksi secara dingin yang bertujuan untuk mengekstrak senyawa- senyawa yang terdapat dalam simplisisa yang tidak tahan terhadap panas. Ekstraksi secara dingin dapat dilakukan dengan beberapa cara berikut ini :
1. Maserasi, merupakan proses penyarian simplisia dengan cara perendaman menggunakan pelarut dengan sesekali pengadukan pada temperatur ruangan (kamar). Secara teknologi termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi pada keseimbangan. Maserasi yang dilakukan pengadukan secara terus menerus disebut maserasi kinetik sedangkan yang dilakukan penambahan ulang pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi.
2. Perkolasi, merupakan proses penyarian simplisia dengan pelarut yang selalu baru sampai terjadi penyarian sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur kamar. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/
penampungan ekstrak), terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bertahan.
b. Cara Panas
1. Refluks, merupakan ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
2. Sokletasi, merupakan ekstraksi menggunakan pelarut yang selalu baru yang umumnya di lakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
12
3. Digesti, merupakan proses maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar) yaitu secara umum di lakukan pada temperatur 40-50ºC.
4. Infusa, merupakan ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96- 98ºC selama waktu tertentu (15-20 menit).
5. Dekoktasi, merupakan proses infus pada waktu yang lebih lama ≥ 30 menit dan temperatur sampai titik didih air.
2.3 Radikal Bebas 2.3.1 Definisi
Radikal bebas adalah sekelompok bahan kimia baik berupa atom maupun molekul yang memiliki elektron tidak berpasangan pada lapisan luarnya atau kehilangan elektron, sehingga apabila dua radikal bebas bertemu, mereka bisa memakai bersama elektron tidak berpasangan membentuk ikatan kovalen. Dapat dikatakan, radikal bebas bersifat tidak stabil dan selalu berusaha mengambil elektron dari molekul di sekitarnya, sehingga radikal bebas bersifat toksik terhadap molekul biologi/sel. Radikal bebas dapat mengganggu produksi DNA, lapisan lipid pada dinding sel, produksi prostaglandin, dan protein lain seperti enzim yang terdapat dalam tubuh (Werdhasari, 2014).
Radikal bebas bertendensi kuat memperoleh elektron dari atom lain, sehingga atom lain yang kekurangan satu elektron ini menjadi radikal bebas pula yang disebut radikal bebas sekunder. Proses ini terjadi berantai sehingga menyebabkan kerusakan biologik seperti disfungsi sel yang diikuti inflamasi dan akhirnya menjadi penyakit degeneratif (Kosasih, dkk., 2004).
13
Radikal bebas yang mengambil elektron dari Deoxyribonucleic Acid (DNA) dapat menyebabkan perubahan struktur DNA sehingga timbullah sel-sel mutan. Bila mutasi ini terjadi berlangsung lama dapat menjadi kanker. Radikal bebas juga berperan dalam proses menua, dimana reaksi inisiasi radikal bebas di mitokondria menyebabkan diproduksinya Reactive Oxygen Species (ROS) yang bersifat reaktif. Radikal bebas dapat dihasilkan dari hasil metabolisme tubuh dan faktor eksternal seperti asap rokok, hasil penyinaran ultra violet, zat kimiawi dalam makanan dan polutan lain (Werdhasari, 2014).
Senyawa ini sangat reaktif dan dengan mudah menjurus ke reaksi yang tidak terkontrol menghasilkan ikatan silang (cross-link) pada DNA, protein, lipida atau kerusakan oksidatif pada gugus fungsional yang penting pada biomolekul. Radikal bebas juga terlibat dan berperan dalam patologi dari berbagai penyakit degeneratif, yakni diabetes, kanker, aterosklerosis, rematik, jantung koroner, katarak dan penyakit degenerasi saraf seperti parkinson (Silalahi, 2006).
Golongan senyawa oksigen reaktif antara lain adalah hidroksil (OH-), superoksida (O2-), peroksida (RO2-), asam hipoklorit (HOCl) dan hidrogen peroksida (H2O2) (Ionita, 2005).
Radikal bebas yang ada ditubuh manusia berasal dari 2 sumber : a. Sumber endogen
Sumber yang berasal dari proses metabolik yang normal dari tubuh manusia, lebih dari 90% oksigen diproduksi dari proses metabolik tubuh yaitu melalui proses oksidasi makanan dalam menghasilkan tenaga di mitokondria yang dikenal sebagai electron transport chain yang akan memproduksikan radikal bebas superoxide anion (O2-), sel darah putih seperti neutrophil secara khusus memproduksikan radikal bebas yang digunakan dalam pertahanan untuk menghancurkan patogen yang
14
menyerang, radikal bebas yang terbentuk sebagai perantara dan diperlukan reaksi enzimatis, reaksi yang melibatkan besi dan logam lain, olahraga dengan latihan yang lebih lama dan lebih intensif, oksigen akan lebih banyak dikonsumsi.
Sementara oksigen adalah mutlak penting untuk produksi energi, tetapi akhirnya akan membentuk radikal bebas (Ramadhan, 2015).
b. Sumber eksogen
Sumber radikal eksogen bagi tubuh manusia dapat berupa pencemaran udara, penipisan ozon, sumber radiasi, bahan kimia, toksin, asap rokok, mikroorganisme yang patologik, sinar ultraviolet, sebagian obat seperti anastesi, dan peptisida serta pelarut yang digunakan industri merupakan sumber eksogen radikal bebas (Ramadhan, 2015).
2.3.2 Mekanisme kerja
Menurut Sayuti (2015), mekanisme kerja radikal bebas dalam tubuh terjadi melalui beberapa tahapan, diantaranya inisiasi, propagasi dan terminasi.
a. Tahap inisiasi
Pada tahap ini radikal bebas mulai terbentuk yang diproduksi oleh beberapa proses. Suhu tinggi, proses ekstrusi dan tekanan pada proses pemotongan bahan polimer dapat menghasilkan radikal alkil. Setelah oksidasi dimulai, menyebabkan konsentrasi hidroperoksida menjadi besar. Dekomposisi hidroperoksida menjadi sumber utama inisiator radikal. Penyerapan sinar UV menghasilkan radikal yang disebabkan oleh hidroperoksida dan senyawa karbonil. Kebanyakan degradasi polimer disebabkan oleh penyerapan cahaya ultra violet dari autoksidasi radikal.
Substrat oksidatif dapat bereaksi secara lansung dengan oksigen khususnya pada temperatur tinggi sehingga menghasilkan radikal.
15
RH Radikal bebas mis: R, ROO, RO, HO ROOH RO* + OH*
2 ROOH RO* + ROO* + H2O ROOR 2 RO*
Pada tahap inisiasi, asam lemak (RH) bereaksi dengan oksigen triplet, sehingga dalam proses reaksi tersebut akan membentuk radikal asam lemak (R*) dan radikal peroksida (HOO*) dengan inisiator cahaya atau panas.
b. Tahap Propagasi
Tahap propagasi merupakan awal pemanjangan rantai radikal atau reaksi, dimana radikal-radikal bebas akan diubah menjadi radikal-radikal yang lain. Pada tahap ini terjadi oksigenasi radikal lemak (R*) yang membentuk radikal peroksida (ROO*). Proses oksigenasi sangat cepat dengan afinitas mendekati nol, sehingga konsentrasi radikal peroksida yang terbentuk jauh lebih besar. Konsentrasi R*
dalam sistem makanan, dimana oksidasi berada kemudian radikal peroksida yang terbentuk, akan bereaksi dengan asam lemak lain dan membentuk hidroperoksida dan radikal lemak baru (R’*).
Reaksi propagasi dapat terjadi beberapa kali sebelum terjadi pemutusan oleh radikal peroksi ke non radikal. Dekomposisi homolitik hidroperoksida dihasilkan oleh reaksi propagasi sehingga meningkatkan tingkat inisiasi oleh produksi radikal.
R* + 3O2 ROO*
ROO* + RH ROOH + R*
c. Tahap Terminasi
Tahap terminasi yaitu senyawa radikal bereaksi dengan radikal lain atau dengan penangkap radikal, sehingga potensi propagasinya rendah.
R* + R’* RR
16 R* + ROO* ROOR
ROO* + ROO* ROOR + O2
Pada tahap terminasi, akan terbentuk spesies non radikal karena radikal bebas yang bereaksi satu sama lain. Sedangkan hidroperoksida akan terdekomposisi menjadi produk alkohol, asam keton, dan substrat lain yang lebih stabil.
2.4 Antioksidan
Antioksidan adalah senyawa yang mampu menangkal atau meredam efek negatif oksidan dalam tubuh, bekerja dengan cara mendonorkan satu elektronnya kepada senyawa yang bersifat oksidan sehingga aktivitas senyawa oksidan tersebut dapat dihambat. Antioksidan bermanfaat dalam mencegah kerusakan oksidatif yang disebabkan radikal bebas dan ROS sehingga mencegah terjadinya berbagai macam penyakit seperti penyakit kardiovaskuler, jantung koroner, kanker dan penuaan dini. Penambahan antioksidan ke dalam formulasi makanan, juga efektif mengurangi oksidasi lemak yang menyebabkan ketengikan, toksisitas dan destruksi biomolekul yang ada dalam makanan (Ramadhan, 2015).
2.4.1 Penggolongan antioksidan
Menurut Santoso (2016), antioksidan dapat dibagi menjadi dua golongan, yaitu (1) antioksidan primer (primary antioxidants) atau disebut juga antioksidan pemutus rantai (chain-breaking antioxidants) dan (2) antioksidan sekunder (secondary atau preventive antioxidants). Antioksidan primer bereaksi dengan radikal lipid dan mengonversikannya menjadi produk-produk yang lebih stabil.
Antioksidan sekunder adalah antioksidan yang mencegah atau mengurangi laju reaksi inisiasi dengan berbagai mekanisme.
17 a. Antioksidan primer
Suatu molekul dapat berperan sebagai antioksidan primer hanya jika molekul ini mampu mendonasikan atom hidrogen secara cepat pada radikal lipid dan jika radikal yang dihasilkan dari antioksidan itu lebih stabil daripada radikal lipid, atau dikonversikan menjadi produk-produk lain yang stabil. Pengaruh konsentrasi antioksidan terhadap laju autoksidasi tergantung pada beberapa faktor, termasuk struktur kimianya, kondisi oksidasi, dan sampel yang sedang dioksidasi.
Sering aktivitas antioksidan dan antioksidan fenolik hilang pada konsentrasi yang tinggi dan bahkan menjadi prooksidan.
b. Antioksidan sekunder
Senyawa-senyawa yang mencegah laju autoksidasi lipid dengan proses selain menghentikan (interrupting) rantai autoksidasi dengan mengonversi radikal bebas menjadi produk-produk yang lebih stabil disebut antioksidan sekunder.
Antioksidan-antioksidan ini dapat bekerja dengan berbagai mekanisme termasuk senyawa-senyawa yang mengikat ion-ion logam yang merupakan prooksidan, menangkap oksigen, mendekomposisi hidroperoksida menjadi species non-radikal, menyerap radiasi UV atau menginaktifkan singlet oxygen (Santoso, 2016).
2.4.2 Sumber-sumber antioksidan a. Antioksidan alami
Antioksidan alami pada sayuran dan biji-bijian, seperti vitamin E, vitamin C, beta karoten, dan senyawa fenolik memiliki kemampuan untuk mengurangi kerusakan oksidatif yang terkait dengan banyak penyakit termasuk kanker, penyakit kardiovaskular, penyakit defisiensi imun dan penuaan (Santoso, 2016).
Ekstrak kasar (crude extract) dan isolat murni dari berbegai jenis tumbuhan yang telah diteliti sebelumnya dilaporkan memiliki sifat antioksidan. Begitu banyak
18
peneliti yang fokus pada antioksidan alami.. Tanaman yang mengandung fenolat dan flavonoid telah dilaporkan memiliki sifat antioksidan kuat (Gurav, dkk., 2007).
1. Senyawa fenolat
Aktivitas antioksidan fenolat terutama disebabkan oleh sifat redoksnya, yang memungkinkan mereka bertindak sebagai agen pereduksi, donor hidrogen, peminat oksigen singlet dan chelators logam (Stanojevic, dkk., 2009). Senyawa fenol sendiri pada dasarnya tidak aktif sebagai antioksidan, tetapi substitusi gugus- gugus alkil pada posisi 2, 4, dan 6 meningkatkan densitas elektron pada gugus hidroksil dengan pengaruh induktif dan karenanya meningkatkan reaktivitasnya dengan radikal lipid. Substitusi pada posisi 4 dengan gugus etil atau n-butil daripada gugus metil meningkatkan aktivitas antioksidan senyawa-senyawa fenolik, tetapi rantai alkil yang lebih panjang atau bercabang menurunkan aktivitasnya. Walaupun demikian, adanya substituen yang sangat banyak dalam posisi 2, 6 juga menurunkan laju reaksi fenol dengan radikal lipid. Steric effect demikian melawan stabilisasi radikal yang telah meningkat dan kedua efek ini harus dipertimbangkan dalam mengevaluasi aktivitas keseluruhan antioksidan. Masuknya gugus hidroksil kedua ke dalam posisi 2 atau 4 dari suatu senyawa fenol meningkatkan aktivitas antioksidan (Santoso, 2016).
2. Flavonoid
Flavonoid terdiri dari struktur dasar 2-fenil-benzo-α-piran atau inti flavan di mana dua cincin benzen dihubungkan oleh cincin piran yang mengandung oksigen.
Flavonoid dibagi atas flavonol, flavon, flavan, dan isoflavon. Senyawa flavonoid seperti kuersetin, morin miresitin, kaempferol, asam tanat, dan asam elagat merupakan antioksidan kuat yang dapat melindungi makanan dari kerusakan oksidatif (Silalahi, 2006).
19
Senyawa flavonoid merupakan salah satu senyawa polifenol yang mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6 - C3 - C6, yaitu dua cincin aromatik yang dihubungkan oleh satuan 3 karbon yang dapat atau tidak dapat membentuk cincin ketiga (Markham, 1988).
Flavonoid mempunyai sifat antioksidan yang berperan sebagai penangkap radikal bebas karena mengandung gugus hidroksil. Karena bersifat reduktor, flavonoid dapat bertindak sebagai donor hidrogen terhadap radikal bebas.
Flavonoid dapat membentuk kompleks (kelat) dengan ion logam transisi, misalnya besi, alumunium, sehingga tidak lagi bertindak sebagai prooksidan. Dengan demikian, oksidasi dapat dicegah (Silalahi, 2006).
Sekitar 2% dari seluruh karbon yang difotosintesis oleh tumbuhan menjadi flavonoid atau senyawa yang berkaitan erat dengannya, sehingga flavonoid merupakan salah satu golongan fenol alam terbesar. Lebih lanjut disebutkan bahwa sebenarnya flavonoid terdapat dalam semua tumbuhan hijau, sehingga pastilah ditemukan pula pada setiap telaah ekstrak tumbuhan (Markham, 1988).
b. Antioksidan Sintetik
Adalah antioksidan yang merupakan hasil dari reaksi kimia. Beberapa contoh antioksidan sintetik yang diijinkan penggunaannya untuk makanan dan penggunaannya telah sering digunakan, yaitu butil hidroksi anisol (BHA), butil hidroksi toluen (BHT), propil galat, terbutil hidroksi quinon (TBHQ), dan tokoferol. Antioksidan-antioksidan tersebut merupakan antioksidan alami yang telah diproduksi secara sintetis untuk tujuan komersial (Ramadhan, 2015).
20 2.5 Metode Pengujian Antioksidan
Antioksidan dapat menghambat atau memperlambat oksidasi melalui dua jalur yaitu (1) melalui pemerangkapan radikal bebas (free radical scavenging) (2) tanpa melibatkan penangkalan radikal bebas melalui pegikatan logam, menangkap oksigen, merubah hidroperoksida menjadi spesies nonradikal, menyerap sinar ultraviolet dan mendeaktifasi oksigen singlet (Rohman, 2016).
Pengujian aktivitas antioksidan dari ekstrak atau sampel uji secara in-vitro dapat dilakukan dengan berbagai macam metode, meliputi : (1) ORAC method (Oxygen Radical Absorbance Capacity method); (2) TRAP method (total Radical- Trapping Antioxidant Parameter method); (3) TEAC method (Trolox Equivalent Antioxidant Capacity method); (4) PRSC method (Peroxyl Radical Scavenging Capacity method); (5) DPPH (2,2- diphenylpicrylhydrazyl); (6) TOSC method (Total Oxyradical Scavenging Capacity method); (7) FRAP method (Ferric Reducing / Antioxidant Power method) (Mermelstein, 2007).
Perkiraan aktivitas antioksidan bergantung kepada sistem pengujiannya.
Spesifitas dan sensitifitas satu metode saja tidak dapat menguji seluruh senyawa fenol yang terdapat pada ekstrak. Aktivitas antioksidan membutuhkan kombinasi pengujian lebih dari satu (Sun dan Ho, 2005).
2.6 Metode ABTS (2,2 Azinobis (3-ethylbenothiazoline) 6-Sulfonic Acid) ABTS adalah suatu radikal dengan pusat nitrogen yang mempunyai karakteristik warna biru-hijau, yang bila tereduksi oleh antioksidan akan berubah menjadi bentuk nonradikal, dari berwarna menjadi tidak berwarna. Kemampuan aktivitas antioksidan diukur secara spektrofotometer pada panjang gelombang 734 nm (Setiawan dkk., 2018).
21
Menurut Rohman (2016), metode ABTS atau sering disebut juga dengan TEAC (Trolox equivalent antioxidant capacity) merupakan metode untuk mengukur kapasitas antioksidan dalam menurunkan warna ABTS+ dengan dua cara yaitu :
a. Memotong inisiasi oksidasi
Metode ABTS dengan versi ini menggunakan metmioglobin-𝐻2𝑂2 untuk menghasilkan radikal-radikal hidroksil yang mengoksidasi ABTS menjadi radikal bebasnya yang memiliki warna. Metode dalam versi ini tersedia di pasaran dalam bentuk kits, meskipun demikian reaksi ini memberi persepsi yang ambigu hal ini dikarenakan antioksidan dapat bereaksi dengan radikal OH, metmioglobin dan ABTS+ menyebabkan overestimasi aktivitas antioksidan.
b. Mereaksikan secara langsung dengan ABTS+
Pada Versi ini, ABTS+ dihasilkan langsung dengan mereaksikan kalium persulfat sebagai agen pengoksidasi terhadap ABTS dengan hasil yang tinggi.
Antioksidan selanjutnya bereasi dengan ABTS+ dan warna radikal ABTS+ akan berkurang sesuai dengan reaksi berikut:
22
Gambar 2.1 Reaksi pembentukan radikal bebas dari ABTS dengan kalium persulfat menjadi ABTS+ dan reaksi pemerangkapan radikal bebas oleh antioksidan menjadi ABTS stabil kembali (Oliveira, dkk., 2014).
2.7 Spektrofotometri UV-Visibel
Spektrofotometri adalah metode yang digunakan untuk menganalisis suatu senyawa. Alat yang digunakan disebut spektrofotometer, terdiri dari spektrometer dan fotometer. Spektrometer ialah alat yang menghasilkan sinar dari spektrum dan panjang gelombang tertentu, sedangkan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diserap. Spektrofotometer adalah alat yang digunakan untuk mengukur energi secara relative jika energi tersebut ditransmisikan, direfleksikan atau diemisikan sebagai fungsi panjang gelombang.
Teknik yang sering digunakan meliputi spektroskopi serapan ultraviolet, cahaya tampak, inframerah, dan serapan atom. Teknik-teknik ini dibedakan berdasarkan jangkauan panjang gelombang dalam menganalisis karakteristik suatu senyawa (Muchlisyam dan Pardede, 2017).
Data spektrofotometri UV-Vis diperlukan dalam elusidasi struktur suatu senyawa. Kegunaan spektrofotometer ini terletak pada kemampuannya mengukur jumlah ikatan rangkap atau konjugasi aromatik dalam suatu molekul. Informasi yang dapat diperoleh dari alat ini yakni salah satunya berupa panjang gelombang maksimum suatu senyawa. Panjang gelombang cahaya ultraviolet adalah 200-400 nm sedangkan sinar tampak adalah 400 nm (ungu) ke 750 nm (merah) (Gandjar dan Rohman, 2007).
Menurut Dachriyanus (2004) beberapa kegunaan penggunaan spektrofotometri ultraviolet adalah : a. Menentukan jenis kromofor, ikatan rangkap
23
yang terkonjugasi dan auksokrom dari senyawa organik, b. Menjelaskan informasi dari struktur berdasarkan panjang gelombang maksimum suatu senyawa, c. Analisis kuantitatif senyawa organik menggunakan hukum Lambert-Beer.
Penentuan Panjang gelombang maksimum ditentukan dengan menggunakan larutan ABTS absorbansi 0,70 ± 0,02 pada 734 nm pada suhu 30ºC (Rosidah dkk., 2008).
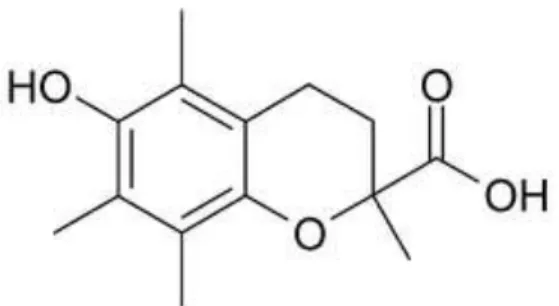
2.8 Trolox-C
Trolox-C (6-hydroxy-2,5,7,8-tetramethyl chroman-2-carboxylic acid) merupakan antioksidan sintetik yang strukturnya mirip dengan ∝-tokoferol, kecuali diganti rantai sisi hidrokarbonnya dengan gugus karboksilat. Trolox-C berupa bahan padat tidak berwarna, tidak berbau atau berasa, larut dalam air, dan sedikit larut dalam lemak. Stabil selama 2 bulan pada suhu kmar dan 45º C. Trolox dapat digunakan sebagai pembanding dalam uji aktivitas antioksidan pada metode ABTS atau sering disebut juga dengan TEAC (Trolox equivalent antioxidant capacity) (Santoso, 2016). Troloks mempunyai aktivitas antioksidan yang lebih tinggi dibandingkan α-tokoferol, BHA, serta BHT (Belitz 1999). Troloks sering dipergunakan sebagai standar dalam pengukuran antioksidan (Widyastuti, 2010).
Gambar 2.2 Trolox-C (Santoso, 2016).
24 BAB III
METODE PENELITIAN
3.1 Jenis Penelitian
Penelitian ini dilakukan dengan metode eksperimental, meliputi pengumpulan bahan tumbuhan, pembuatan simplisia, karakterisasi dan skrining fitokimia simplisia, pembuatan ekstrak etanol dari buah labu kuning, dan pemeriksaan pengujian aktivitas antioksidan dengan metode ABTS (2,2’-azino- bis(3-ethylbenz-thiazoline-6-sulfonic acid) dengan menggunakan alat spektrofotometer UV-Visibel.
3.2 Alat
Alat-alat yang digunakan terdiri dari rotary evaporator (Stuart), neraca analitis (Vibra), oven (Memmert), cawan penguap, penangas air, kaca objek, lemari pengering, gelas beker, blender (Phillip), labu tentukur 25 ml; 50 ml, pipet volume 5 ml, pipet volume 1 ml, mat pipet 1 ml, mat pipet 5 ml, mikro pipet, pipet tetes, corong, krus porselin, mikroskop, spektrofotometer UV-Vis (Shimadzu UV-1800).
3.3 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah daging buah labu kuning (Cucurbita moschata D.). Pelarut yang digunakan adalah n-heksan, etil asetat, etanol, trolox, ABTS, PBS (Phosfat Buffer Saline), K2S2O8 (Kalium persufat), α-naftol, amil alkohol, asam asetat anhidrida, asam klorida pekat, asam nitrat, asam sulfat pekat, besi (III) klorida, benzene, bismuth (III) nitrat, iodida, isopropanol, kalium iodida, kloroform, kristal kloral hidrat, natrium hidroksida,
25
raksa (II) klorida, serbuk magnesium, timbal (II) asetat, toluene , aquadest, metanol p.a. Gambar buah labu kuning dapat dilihat pada lampiran 3 halaman 51.
3.4 Penyiapan Bahan Tanaman
Penyiapan bahan tanaman meliputi pengumpulan bahan tanaman, identifikasi tanaman, dan pengolahan bahan tanaman.
3.4.1 Pengumpulan Bahan Tanaman
Pengumpulan bahan tanaman dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Bahan tumbuhan yang digunakan adalah daging buah labu kuning yang diambil dari Pasaraya MMTC, Jl. Pancing Medan, Kenanga Baru, Kecamatan Percut Sei Tuan, Kabupaten Deli Serdang, Sumatera Utara.
3.4.2 Identifikasi Tanaman
Identifikasi tanaman dilakukan di Herbarium Medanense, Laboratorium Herbarium Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara.
3.4.3 Pengolahan Bahan Tanaman
Bahan yang digunakan adalah daging buah labu kuning (Cucurbita moschata.D.). Daging buah labu kuning dikumpulkan, dibersihkan dari pengotor,
dikupas kulit buah, dicuci, ditiriskan, diangin-anginkan, dipotong-potong dengan ketebalan 2-3 mm kemudian ditimbang sebagai berat basah. Selanjutnya dikeringkan dalam lemari pengering pada temperatur ±40𝑜C sampai daging buah kering, kemudian di timbang sebagai berat kering. Simplisisa yang telah kering diblender, kemudian diayak dengan ayakan mesh 20 agar menjadi serbuk kasar.
Lalu, serbuk kasar simplisia labu kuning ditimbang dan dihitung sebagai berat
26
kering. Kemudian dimasukkan ke dalam wadah dan diberi silika gel. Bagan pembuatan simplisia dapat dilihat pada lampiran 6 halaman 53.
3.5 Pembuatan Pereaksi 3.5.1 Pereaksi Asam Klorida 2 N
Sebanyak 17 mL asam klorida pekat diencerkan dengan air suling sampai 100 mL (Depkes, 1995).
3.5.2 Pereaksi Asam Sulfat 2N
Sebanyak 5,5 mL asam sulfat pekat diencerkan dengan air suling hingga diperoleh 100 mL (Depkes, 1995).
3.5.3 Pereaksi Besi (III) Klorida 1%
Sebanyak 1 g besi (III) klo rida dilarutkan dalam air suling sampai 100 mL (Depkes, 1995).
3.5.4 Pereaksi Bourchardat
Sebanyak 4 g kalium iodida dilarutkan dalam air suling secukupnya kemudian ditambahkan 2 g iodida sedikit demi sedikit cukupkan dengan air suling sampai 100 mL (Depkes, 1995).
3.5.5 Pereaksi Dragendorff
Sebanyak 0,8 g bismut nitrat dilarutkan dalam asam nitrat pekat 20 mL kemudian dicampurkan dengan larutan kalium iodida sebanyak 27,2 g dalam 50 mL air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih diambil dan diencerkan dengan air suling secukupnya hingga 100 mL (Depkes, 1995).
3.5.6 Pereaksi Liebermann-Burchard
Campur secara perlahan 5 mL asam asetat anhidrit dengan 5 mL asam sulfat pekat tambahkan etanl hingga 50 mL (Depkes, 1995).
27 3.5.7 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida, kemudian dilarutkan dalam air suling hingga 60 mL. Ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10 mL air suling. Larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 mL (Depkes, 1995).
3.5.8 Pereaksi Molisch
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N hingga 100 mL (Depkes, 1995).
3.5.9 Timbal (III) Asetat 0,4 M
Timbal (II) asetat sebanyak 15,17 g dilarutkan dalam air suling bebas CO2 hingga 100 mL (Depkes, 1995).
3.5.10 ABTS (2,2’Azino-bis(3-etilbenzotiazolin) 6-sulfonic acid)
ABTS 7 mM sebanyak 18 mg dilarutkan dalam aqua deionisasi hingga 5 mL.
3.5.11 Kalium Persulfat (K2S2O8)
Kalium persulfat 2,45 mM sebanyak 14 mg dilarutkan dalam aqua deionisasi hingga 20 mL.
3.5.12 Phosphate Buffer Saline ( PBS ) pH 7,4
Sebanyak 8 g Natrium klorida, 0,2 g Kalium klorida, 1,42 g Natrium hidrogen fosfat, 0,24 Kalium dihidrogen fosfat dilarutkan dalam aquadest sampai 1 Liter.
28 3.6 Pemeriksaan Karakteristik Simplisia
3.6.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati morfologi simplisia daging buah labu kuning dengan cara memperhatikan warna, bentuk, dan tekstur sampel.
3.6.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik terhadap serbuk simplisia daging buah labu kuning dilakukan dengan cara menaburkan simplisia di atas gelas preparat yang telah diteteskan dengan larutan kloralhidrat dan ditutup dengan gelas penutup kemudian dilihat di bawah mikroskop.
3.6.3 Penetapan Kadar Air
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi toluen).
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam.
Destilasi dihentikan dan dibiarkan dingin selama 30 menit. Kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml, lalu ke dalam labu tersebut dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama. Labu dipanaskan hati – hati selama 15 menit. Pada saat toluen mendidih, setelah itu kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Saat semua air terdestilasi, setelah itu dibilasi bagian dalam pendingin dengan toluen.
Destilasi dilanjutkan selama 5 menit kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai
29
dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
3.6.4 Penetapan Kadar Sari Larut Air
Penetapan kadar sari larut dalam air dilakukan terhadap serbuk simplisia buah labu kuning untuk mengetahui kadar senyawa-senyawa larut dalam air yang terdapat pada serbuk simplisia buah labu kuning.
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam, kemudian disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata, yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.6.5 Penetapan Kadar Sari Larut Etanol
Penetapan kadar sari larut dalam etanol dilakukan terhadap serbuk simplisia buah labu kuning untuk mengetahui kadar senyawa-senyawa larut dalam pelarut etanol yang terdapat pada serbuk simplisia buah labu kuning.
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi selama 24 jam dalam 100 ml etanol 95% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata, yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 95% dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen
30 POM, 1995).
3.6.6 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 600oC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.6.7 Penetapan Kadar Abu Tidak Larut Dalam Asam
Senyawa-senyawa mineral hasil pemijaran yang telah diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring dipijarkan sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang dikeringkan di udara (Depkes RI, 1995).
3.7 Skrining Fitokimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan alkaloida, flavonoida, glikosida, saponin, tanin dan steroid/triterpenoid.
3.7.1 Pemeriksaan Alkaloida
Sebanyak 0,5 g serbuk simplisia ditimbang, kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat dipakai untuk tes alkaloid.
Diambil 3 tabung reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan 0,5 ml filtrat. Pada tabung:
a. Ditambahkan 2 tetes pereaksi Bouchardat
31 b. Ditambahkan 2 tetes pereaksi Dragendorff
c. Ditambahkan 2 tetes pereaksi Mayer (Ditjen POM, 1989).
3.7.2 Pemeriksaan Flavonoida
Sebanyak 10 g simplisia ditambahkan 10 mL air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 mL filtrat ditambahkan 0,1 g serbuk magnesium dan 1 mL asam klorida pekat dan 2 mL amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.7.3 Pemeriksaan Glikosida
Serbuk simplisia ditimbang sebanyak 3 g, kemudian disari dengan 30 ml campuran 7 bagian volume etanol 96% dan 3 bagian volum air suling ditambah dengan 10 ml asam sulfat 2N. Direfluks selama 30 menit, lalu didinginkan dan disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, lalu dikocok selama 5 menit dan disaring. Filtrat disari dengan 20 ml campuran 3 bagian kloroform dan 2 isopropanol dilakukan berulang sebanyak tiga kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC.Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut, yaitu 0,1 ml larutan percobaan dimasukkan ke dalam tabung reaksi, diuapkan di penangas air. Sisa dilarutkan dalam 2 ml air suling dan 5 tetes pereaksi Molish, 32 kemudian secara perlahan ditambahkan 2 ml asam sulfat pekat. Glikosida positif jika terbentuk cincin ungu (Ditjen POM, 1979).
3.7.4 Pemeriksaan Saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam tabung reaksi dan ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, timbul busa yang mantap tidak kurang dari 10
32
menit setinggi 1- 10 cm. Ditambahkan 1 tetes larutan asam klorida 2N, bila buih tidak hilang menunjukkan adanya saponin (Ditjen POM, 1979).
3.7.5 Pemeriksaan Tanin
Serbuk simplisia ditimbang sebanyak 0,5 g sampel disari dengan 10 ml air suling, disaring lalu filtratnya diencerkan dengan air suling sampai tidak berwarna.
Filtrat yang diperoleh, diambil 2 ml larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida.Terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Ditjen POM, 1979).
3.7.6 Pemeriksaan Steroid/Triterpenoid
Sebanyak 1 g sampel dimaserasi dengan n-heksan selama 2 jam, lalu disaring.Filtrat diuapkan dalam cawan penguap, pada sisa ditambahkan 2 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat.Timbul warna biru atau hijau menunjukkan adanya steroid dan timbul warna merah, pink atau ungu menunjukkan adanya triterpenoid (Farnsworth, 1966).
3.8 Prosedur Kerja
3.8.1 Pembuatan Ekstrak Daging Buah Labu Kuning
Serbuk simplisia buah labu kuning diekstraksi dengan cara maserasi dengan menggunakan etanol 96%.
Cara pembuatan: sebanyak 500 g serbuk simplisia dimasukkan kedalam bejana, tuangi dengan 3750 ml etanol 96%, ditutup dan dibiarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, kemudian disaring. Cuci ampas dengan etanol 96% sebanyak 1250 ml, pindahkan ke dalam wadah tertutup, biarkan di tempat sejuk, terlindung dari cahaya selama 2 hari, lalu disaring dan gabungkan dengan hasil perendaman yang pertama. Kemudian, filtratnya dipekatkan pada suhu 40⁰C
33
dengan menggunakan rotary evaporator hingga diperoleh ekstrak kental (Anief, 2008).
3.9 Pengujian Kemampuan Aktivitas Antioksidan 3.9.1 Prinsip Metode Pemerangkapan ABTS
Kemampuan sampel uji dalam meredam proses oksidasi ABTS (2,2’Azinobis( 3-etilbenzotiazolin sulfonat) sebagai radikal bebas dalam larutan
metanol (sehingga terjadi perubahan warna dari biru kehijauan menjadi putih) dengan nilai IC50 (konsentrasi sampel uji yang mampu meredam radikal bebas sebesar 50%) digunakan sebagai parameter untuk menentukan aktivitas antioksidan sampel (Yu, 2002).
3.9.2 Pembuatan Larutan Blanko ABTS
a. Larutan stok ABTS : 5 mL larutan ABTS ditambahkan 5 mL larutan kalium persulfat, diinkubasi dalam ruang gelap suhu 22-24OC selama 12-16 jam sebelum digunakan, dihasilkan ABTS dengan warna biru gelap.
b. Larutan ABTS : Ditimbang 18 mg ABTS (7 mM) dilarutkan kedalam aqua deionisasi dalam labu tentukur 5 mL
c. Larutan K2S2O8 : Ditimbang 14 mg kalium persulfat (2,45 mM) dilarutkan kedalam aqua deionisasi dalam botol sampai 20 mL (Rosidah dkk., 2008).
3.9.3 Pembuatan Larutan Induk Trolox
Sebanyak 10 mg serbuk trolox ditimbang, dimasukkan ke dalam labu tentukur 10 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 μg/ml ).
34
3.9.4 Pengukuran Panjang Gelombang Serapan Maksimum
Larutan stok ABTS dipipet sebanyak 1 mL dan dicukupkan volumenya sampai 25 mL dengan PBS pH 7,4 dalam labu tentukur. Larutan ini kemudian diukur pada panjang gelombang 734 nm dengan absorbansi 0,7 ± 0,02 (Rosidah dkk., 2008).
3.9.5 Pengukuran Aktivitas Antioksidan
a. Pengukuran Aktivitas Penghambatan Radikal Bebas ABTS Dengan Larutan Uji
Larutan stok sampel 1000 μg/ml dengan masing-masing konsentrasi dengan konsentrasi 50 µg/mL; 75 µg/mL;100 µg/mL; 125 µg/mL atau dipipet sebanyak 0,25 mL; 0,375 mL; 0,5 mL; 0,625 mL ke dalam labu tentukur 5 mL. Kemudian di ad kan volumenya sampai batas dengan metanol p.a. Dari masing-masing konsentrasi, dipipet sebanyak 0,1 mL larutan ekstrak ditambah 2 mL larutan stok ABTS. Selanjutnya larutan diinkubasi selama 6 menit dan diukur serapan dengan spektrofotometri UV-Vis pada panjang gelombang 734 nm. Besarnya daya antioksidan dihitung dengan rumus :
Daya Antioksidan = Abs.Blanko − Abs.Sampel
Abs.Blanko x100 %
b. Pengukuran Aktivitas Penghambatan Radikal Bebas ABTS Dengan Pembanding Trolox
Larutan stok trolox 1000 μg/ml dengan masing-masing konsentrasi 3,125 μg/ml, 6,25 μg/ml, 12,5 μg/ml, dan 25 μg/ml atau dipipet masing-masing sebanyak 0,015625 mL; 0,03125 mL; 0,0625 mL; 0,125 mL kedalam labu tentukur 5 mL.
Kemudian di ad kan volumenya sampai batas dengan metanol p.a. Dari masing- masing konsentrasi, dipipet sebanyak 0,1 mL larutan ditambah 2 mL larutan stok