HASIL SURVEYLANS PENYAKIT AVIAN INFLUENZA
DI KALIMANTAN TAHUN 2011
Anna Januar Fiqri 1, Wiwin Sri Utami 2, Arif Supriyadi 3, Sulaxono Hadi 4, Esti Widwi Astuti 5
ABSTRAK
Sejak tahun 2004 munculnya kasus penyakit Avian Influenza pertama kali di wilayah Kalimantan, BPPV Regional V Banjarbaru terus melakukan kegiatan surveilans secara aktif untuk mengetahui kejadian penyakit yang terjadi di lapangan. Pada tahun 2011 surveilans kembali dilakukan dengan melaksanakan pengambilan sampel di 4 provinsi yaitu Kalimantan Selatan, Kalimantan Barat, Kalimantan Timur dan Kalimantan Tengah. Sampel yang diambil adalah swab kloaka/trachea dan serum darah pada unggas industri maupun unggas liar. Jumlah sampel serum yang diambil pada tahun 2011 sebanyak 4629 dan sampel swab kloaka sebanyak 2426 sampel.
Berdasarkan hasil pengujian dengan menggunakan metode diagnosa HA/HI dan metode Real Time RT-PCR diketahui bahwa virus Avian Influenza masih beredar di wilayah Kalimantan. Diperlukan komitmen yang tinggi dari instansi terkait, pelaku industri peternakan dan masyarakat untuk mengendalikan dan memberantas penyakit ini sehingga terwujud Kalimantan yang bebas dari penyakit Avian Influenza.
Key words : Avian Influenza, HA/HI, RT PCR
PENDAHULUAN
Virus Avian Influenza AI (flu burung) merupakan virus influenza jenis tipe A yang beradaptasi di dalam tubuh unggas. Virus AI memegang peranan penting dalam proses penyebaran penyakit patogen di kalangan industri unggas dunia. Salah satu wabah (outbreak) yang diketahui dunia pertama kali adalah wabah HPAI (High Pathogenic Avian Influenza) yang terjadi di benua Eropa pada tahun 1870-an. Sejak tahun 1955 setelah pertama kali virus flu burung pertama kali diketahui, telah terjadi 24 outbreak di kalangan industri unggas dunia.(Spackman,2008)
Salah satu strain virus HPAI yang dikenal oleh masyarakat dunia adalah virus HPAI H5N1 Asia, yang pertama kali diketahui pada tahun 1997 di Asia Tenggara. Tahun 2004 kejadian kasus Avian Influenza di Asia semakin meningkat seiring dilaporkannya kejadian infeksi flu burung pada manusia. Sejak tahun 2006 kasus penyakit Avian Influenza semakin menyebar dari benua Asia, Afrika dan Eropa sampai dengan United Kingdom (UK).(Spackman, 2008)(Hinrich,2010)
Virus Avian Influenza merupakan salah satu pathogen penting yang menyebar di dunia saat ini. Virus ini bisa beradaptasi di berbagai macam host. Unggas yang menjadi host dari virus inipun tidak hanya terbatas pada unggas domestik atau unggas industri, tetapi berdasarkan hasil surveilans dan penelitian para ahli, virus ini juga terdapat pada bebek
ataupun jenis unggas liar lainnya. Oleh karena itu fokus para ahli di dunia sekarang mulai merambah pada peranan unggas liar terhadap penyebaran penyakit Avian Influ-enza.(Spackman,2008)
Virus Avian Influenza adalah virus jenis Influenza tipe A dimana unggas adalah host (induk semang)nya dan beradaptasi di dalam tubuhnya. Virus influenza Tipe A termasuk dalam famili Orthomyxoviridae memiliki amplop dengan bentuk pleiomorphic berukuran antara 80-120 nm. Strain virus influenzsa Tipe A diklasifikasikan berdasarkan subtipe serologik dari susunan primer protein permukaan virus yaitu haemaglutinin (HA) dan neuraminidase (NA). Haemaglutinin (HA) memiliki 16 subtipe (H1-H16) dan 9 subtipe N (N1-N9). Subtipe H dan N dapat membentuk berbagai macam kombinasi, diperkirakan ada 144 kombinasi yang bisa terjadi dan telah ditemukan di di spesies alami yang ada di dunia. Walaupun mungkin ada beberapa kombinasi yang lebih sering muncul dibandingkan dengan kombinasi H dan N lainnya.(Russel,2008)
Walaupun host natural dari virus Avian Influenza adalah unggas air tapi virus ini telah beradaptasi pada tubuh unggas lainnya dan mamalia. Virus AI telah secara garis besar dibagi menjadi Low Pthogenic Avian Influenza (LPAI) dan High Pathogenic Avian Influenza (HPAI). OIE telah mengklasifikasikan virus AI berdasarkan susunan protein HA pada virus Avian Influenza. Secara biologis perbedaan antara HPAI dan LPAI terletak pada infeksi sistemik yang terjadi pada tubuh hewan. LPAI cenderung mengakibatkan infeksi yang terlokalisasi hanya pada saluran respiratori.(Spackman,2008)
Gejala Klinis Penyakit Avian Influenza pada Unggas
Pada unggas jenis ayam dan kalkun, infeksi virus Avian Influenza mengakibatkan gejala subklinis pada saluran pernafasan. Tetapi kejadian di lapangan juga menunjukkan adanya reaksi pada kulit dan penurunan dari produksi telur. Melalui pengamatan di lapangan, LPAI juga dapat mengakibatkan kematian pada unggas meskipun kejadiannya rendah dan biasanya hal ini juga diakibatkan oleh adanya infeksi seperti bak-teri.(Spackman,2008)
Virus Avian Influenza baik HPAI maupun LPAI secara normal tidak mengakibatkan penyakit atau menunjukkan gejala klinis yang jelas pada unggas host alaminya yaitu unggas liar seperti bebek dan unggas air. Tetapi berdasarkan hasil penelitian kejadian kasus penyakit Avian Influenza di Asia, pada tahun 2001 beberapa isolat H5N1 membuktikan dapat menyebabkan kematian pada bebek dan unggas air. Sampai saat ini para ahli masih melakukan penelitian mengenai adanya virus Avian Influenza yang ada di unggas liar, apakah ini terjadi karena adanya kontak dgn unggas domestik/burung domestik yang terinfeksi atau memang hal ini sudah menjadi endemis di kalangan populasi unggas liar tertentu.(Brown,2008).
Deteksi dan diagnosis penyakit Avian Influenza pada unggas liar, unggas ternak, burung liar dan spesies lainnya merupakan titik kritis yang penting agar kita dapat mengetahui kondisi virus Avian Influenza yang beredar di lapangan. Karakterisasi dari virus yang ada di lapangan memegang peranan penting untuk mengetahui keadaan ekologi dan biologis dari virus tersebut.(Spackman,2008). Sejak tahun 2004 setelah kejadian penyakit Avian Influenza pertama kali di Kalimantan, BPPV Regional V Banjarbaru secara reguler melaksanakan kegiatan surveilans penyakit ini. Kegiatan surveilans penyakit Avian Influenza bertujuan untuk mengumpulkan sebanyak-banyaknya informasi mengenai keberadaan penyakit tersebut di wilayah Kalimantan. Selain itu sampel dari berbagai daerah di Kalimantan secara rutin dikirim oleh para kolega di daerah khususnya Dinas Pertanian dan Peternakan setempat seiring dengan maraknya kasus AI yang terjadi di wilayah mereka.
MATERI DAN METODE
Materi
Materi yang digunakan untuk pengujian penyakit Avian Influenza antara lain adalah sampel dari swab kloaka,trachea unggas dan serum darah unggas. sampel didapat dari 4 wilayah kerja yang ada di lungkup kerja BPPV Regional V Banjarbaru, baik melalui pelayanan aktif maupun pelayanan pasif yaitu sampel kiriman dari Dinas Pertanian dan Peternakan di daerah. Dalam pelayanan aktif proses pengambilan sampel di lapangan dilakukan dengan menggunakan alat spuit 3 cc untuk pengambilan serum darah AI dan transport media berupa BD cell transport media untuk mempertahankan kondisi virus yang diambil dari lapangan.
Metode
Real Time RT-PCR
Metode ini bertujuan untuk menangkap materi/susunan protein spesifik yang ada pada setiap jenis virus melalui proses amplifikasi RNA virus dalam hal ini virus Avian Influenza sehingga dapat diketahui apakah unggas tersebut terinfeksi oleh virus AI. Dalam hal ini metode spesifik yang digunakan adalah Real Time RT-PCR. Produk PCR dalam Real Time RT-PCR divisualisasikan melalui probe fluorogenik atau nucleic acid binding dye. Swab kloaka dan trachea dilakukan pengujian dengan metode Real Time RT-PCR. Alat yang digunakan adalah mesin RT-PCR, mikropipet, mikrotube, tips, rak, biosafety cabinet, gloves dan lain-lain. Bahan yang digunakan antara lain adalah primer spesifik untuk influenza tipe A dan subtipe H5, probe, bahan untuk ekstraksi, master mix, mikrotube, mikroplate dan lain-lain. Semua sampel diperiksa dengan menggunakan metode RT-PCR (Reverse Transcriptase Polymerase Chain Reaction).
Sampel diekstraksi terlebih dahulu dengan menggunakan Pure Link Viral RNA/DNA Mini Kit dari invitrogen, kit yang digunakan untuk proses ektraksi bisa berbagai jenis merk tergantung dengan kebutuhan dan ketersediaan kit yang ada. Ekstraksi dilakukan untuk mendapatkan protein virus murni tanpa adanya campuran/kontaminasi dari bahan lainnya. Setelah melalui proses ektraksi, protein virus (RNA/DNA virus) yang didapat kemudian dicampur dengan master mix serta probe yang telah ditentukan desainnya untuk spesifik virus AI jenis tipe A dan subtipe H5. Proses terakhir adalah memasukkan campuran master mix dan protein virus ke dalam mesin Real Time RT-PCR untuk dilakukakan proses denaturasi, annealing dan ekstensi oleh mesin PCR(Suarez,2008). Sinyal akan dibaca oleh komputer sehingga mengeluarkan hasil berupa grafik dan nilai positif negatif dalam bentuk nilai Ct value, semakin rendah Ct value yang didapat maka semakin tinggi nilai positif mengandung virus Avian Influenza.
HA/HI Tes
Uji HA untuk mendeteksi agen penyakit yang mempunyai sifat mengaglutinasi sel darah merah unggas seperti virus AI, ND, Infectious bronchitis dan Egg Drop Syndrome. Apabila virus Avian Influenza berada dalam konsentrasi yang tinggi akan terjadi reaksi aglutinasi dan erithrosit akan membentuk gambaran diffuse.
Bahan yang digunakan antara lain adalah antikoagulan (alsever’s, acid citrose dextrose), PBS, antigen virus AI, NaCl,kontrol positif dan negatif, red blood cells (RBC) dan lain-lain. Alat yang digunakan antara lain : mikropipet dgn berbagai ukuran, mikroplate V bottom dan U bottom, timer dan lain-lain.
Bahan-bahan utama yang diperlukan harus dipersiapkan terlebih dahulu, yaitu RBC 10%, RBC 1%. Kemudian sampel serum dipisahkan terlebih dahulu dari darah agar benar-benar tidak tercampur dan diinaktivasi terlebih dahulu terutama serum yang berasal dari itik, ayam kampung dan burung liar lainnya (Killian,2008) Selanjutnya dilakukan uji HA dengan pengenceran serum, PBS dan sel darah merah 10%. Hasil dari uji HA yaitu antigen 4 HA unit digunakan untuk pengujian HI. Hasil pengujian HI kemudian dibaca secara kasat mata. Serum, plasma, yolksac dinyatakan positif jika mempunyai titer 24. Nilai ini dibaca pada lubang terakhir yang tidak ditemukan adanya lisis sel darah merah.
HASIL DAN PEMBAHASAN
Hasil
Tabel 1. Hasil pengujian serologis di Kalimantan Barat
Provinsi Kabupaten Kecamatan Hewan Jumlah Sampel
Hasil Uji HA/HI AI Positif Negatif
Kalimantan
Barat Kapuas Hulu Putussibau Selatan Ayam 164 1 163
Kapuas Hulu Putussibau Utara Ayam 31 31
Kayong Utara Sukadana Ayam 33 1 32
Ketapang Benua Kayong Ayam 249 249
Kota Pontianak Pontianak kota Ayam buras 7 7
Kota Pontianak Pontianak Utara Ayam buras 2 2
Singkawang Singkawang Tengah Ayam buras/broiler 138 3 135
Singkawang Singkawang Utara Ayam buras/broiler 206 26 180
Kubu Raya Sungai Ambawang Ayam broiler 60 53 7
Kubu Raya Sungai Kakap Ayam broiler 166 3 163
Landak Ngabang Ayam Buras 22 22
Pontianak Mempawah Hilir Ayam Buras 104 104
Pontianak Sungai Kunyit
Ayam layer,
buras,puyuh 314 141 173
Sambas Pemangkat Ayam buras 57 4 53
Sintang Kelam Permai Ayam broiler 122 122
Total Kalimantan Barat 1675 232 1443
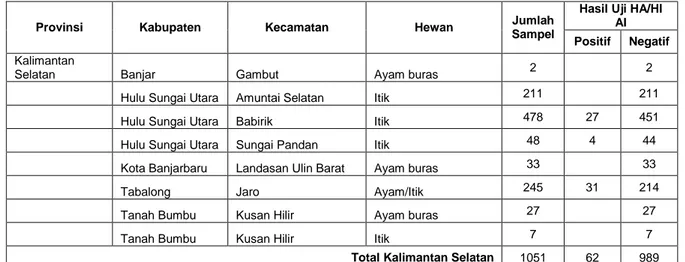
Tabel 2. Hasil pengujian Serologis di Kalimantan Selatan
Provinsi Kabupaten Kecamatan Hewan Jumlah
Sampel
Hasil Uji HA/HI AI Positif Negatif
Kalimantan
Selatan Banjar Gambut Ayam buras 2 2
Hulu Sungai Utara Amuntai Selatan Itik 211 211
Hulu Sungai Utara Babirik Itik 478 27 451
Hulu Sungai Utara Sungai Pandan Itik 48 4 44
Kota Banjarbaru Landasan Ulin Barat Ayam buras 33 33
Tabalong Jaro Ayam/Itik 245 31 214
Tanah Bumbu Kusan Hilir Ayam buras 27 27
Tanah Bumbu Kusan Hilir Itik 7 7
Total Kalimantan Selatan 1051 62 989
Tabel 3. Hasil pengujian Serologis di Kalimantan Tengah
Provinsi Kabupaten Kecamatan Hewan Jumlah
Sampel
Hasil Uji HA/HI AI Positif Negatif
Kalimantan
Tengah Barito Timur Dusun Timur Ayam 171 74 97
Gunung Mas Kuala Kurun Ayam buras 60 60
Kapuas Kapuas Hilir Ayam buras 17 5 12
Kapuas Selat Tengah Ayam buras 15 6 9
Tabel 4. Hasil pengujian Serologis di Kalimantan Timur
Provinsi Kabupaten Kecamatan Hewan Jumlah
Sampel
Hasil Uji HA/HI AI
Positif Negatif
Kalimantan
Timur Kota Balikpapan Balikpapan Ayam buras 65 1 64
Kota Balikpapan Balikpapan Barat Ayam buras 118 25 93
Bontang Bontang Selatan Itik 17 17
Bontang Bontang Selatan Ayam Buras 74 5 69
Bontang Bontang Utara Ayam buras 83 83
Kota Samarinda Pinang
Ayam buras,
broiler 76 10 66
Samarinda Samarinda ilir Ayam buras 50 50
Samarinda Samarinda Utara Ayam buras 132 11 121
Kutai barat Barong Tongkok Ayam/Itik 43 19 24
Kutai Barat Sekolaq barat Ayam buras 135 1 134
Kutai Kertanegara Anggana Ayam buras 92 92
Kutai Kertanegara Tenggarong Ayam 59 29 30
Kutai Kertanegara
Tenggarong
Seberang Ayam/itik 106 39 67
Kutai Timur Sangata Selatan Ayam/itik 131 131
Kutai Timur Sangata Utara Ayam buras 67 6 61
Paser Long Ikir Ayam buras 104 3 101
Paser Paser Balengkong Ayam buras 94 94
Penajam Paser
Utara Babulu Ayam buras 95 95
Penajam Paser
Utara Penajam Ayam buras 99 1 98
Total Kalimantan Timur 1640 150 1490
Jumlah sampel serum yang diambil melalui pelayanan aktif di wilayah Kalimantan adalah 4629 sampel
.
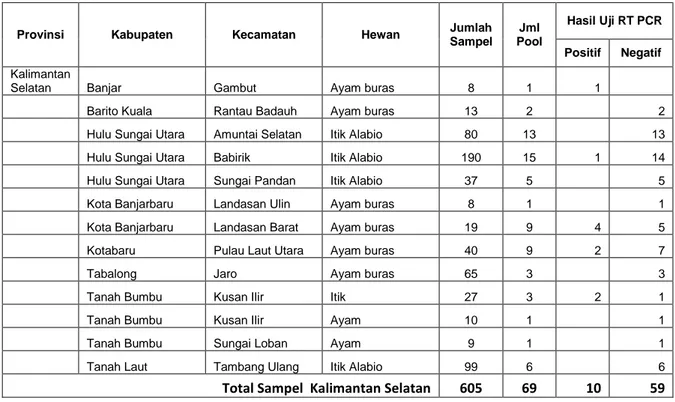
Tabel 5. Hasil pengujian RT PCR di Kalimantan Selatan
Provinsi Kabupaten Kecamatan Hewan Jumlah Sampel Pool Jml
Hasil Uji RT PCR Positif Negatif
Kalimantan
Selatan Banjar Gambut Ayam buras 8 1 1
Barito Kuala Rantau Badauh Ayam buras 13 2 2
Hulu Sungai Utara Amuntai Selatan Itik Alabio 80 13 13
Hulu Sungai Utara Babirik Itik Alabio 190 15 1 14
Hulu Sungai Utara Sungai Pandan Itik Alabio 37 5 5
Kota Banjarbaru Landasan Ulin Ayam buras 8 1 1
Kota Banjarbaru Landasan Barat Ayam buras 19 9 4 5
Kotabaru Pulau Laut Utara Ayam buras 40 9 2 7
Tabalong Jaro Ayam buras 65 3 3
Tanah Bumbu Kusan Ilir Itik 27 3 2 1
Tanah Bumbu Kusan Ilir Ayam 10 1 1
Tanah Bumbu Sungai Loban Ayam 9 1 1
Tanah Laut Tambang Ulang Itik Alabio 99 6 6
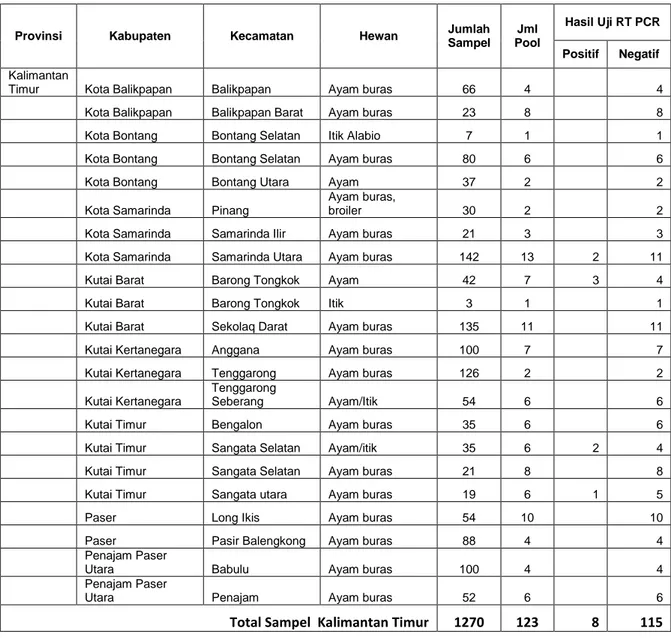
Tabel 6. Hasil pengujian RT PCR di Kalimantan Timur
Provinsi Kabupaten Kecamatan Hewan Jumlah Sampel Pool Jml
Hasil Uji RT PCR Positif Negatif
Kalimantan
Timur Kota Balikpapan Balikpapan Ayam buras 66 4 4
Kota Balikpapan Balikpapan Barat Ayam buras 23 8 8
Kota Bontang Bontang Selatan Itik Alabio 7 1 1
Kota Bontang Bontang Selatan Ayam buras 80 6 6
Kota Bontang Bontang Utara Ayam 37 2 2
Kota Samarinda Pinang
Ayam buras,
broiler 30 2 2
Kota Samarinda Samarinda Ilir Ayam buras 21 3 3
Kota Samarinda Samarinda Utara Ayam buras 142 13 2 11
Kutai Barat Barong Tongkok Ayam 42 7 3 4
Kutai Barat Barong Tongkok Itik 3 1 1
Kutai Barat Sekolaq Darat Ayam buras 135 11 11
Kutai Kertanegara Anggana Ayam buras 100 7 7
Kutai Kertanegara Tenggarong Ayam buras 126 2 2
Kutai Kertanegara
Tenggarong
Seberang Ayam/Itik 54 6 6
Kutai Timur Bengalon Ayam buras 35 6 6
Kutai Timur Sangata Selatan Ayam/itik 35 6 2 4
Kutai Timur Sangata Selatan Ayam buras 21 8 8
Kutai Timur Sangata utara Ayam buras 19 6 1 5
Paser Long Ikis Ayam buras 54 10 10
Paser Pasir Balengkong Ayam buras 88 4 4
Penajam Paser Utara Babulu Ayam buras 100 4 4
Penajam Paser
Utara Penajam Ayam buras 52 6 6
Total Sampel Kalimantan Timur 1270 123 8 115 Tabel 7. Hasil pengujian RT PCR di Kalimantan Barat
Provinsi Kabupaten Kecamatan Hewan Jumlah Sampel h Pool Jumla
Hasil Uji RT PCR Positif Negatif
Kalimantan
Barat Kota Singkawang
Singkawang
Selatan Ayam buras 10 1 1
Kota Singkawang Singkawang Utara Ayam buras 27 12 2 10
Kota Singkawang Singkawang Utara Ayam broiler 31 3 3
Kota Singkawang Singkawang Utara
Ayam buras,
broiler 21 6 6
Pontianak Mempawah Hilir Ayam buras 44 6 6
Pontianak Sungai Kunyit Ayam buras, Itik 123 8 8
Sambas Pemangkat Ayam buras, 16 3 1 2
Sambas Selakau Ayam buras 19 4 4
Total Sampel Kalimantan Barat 291 43 4 39
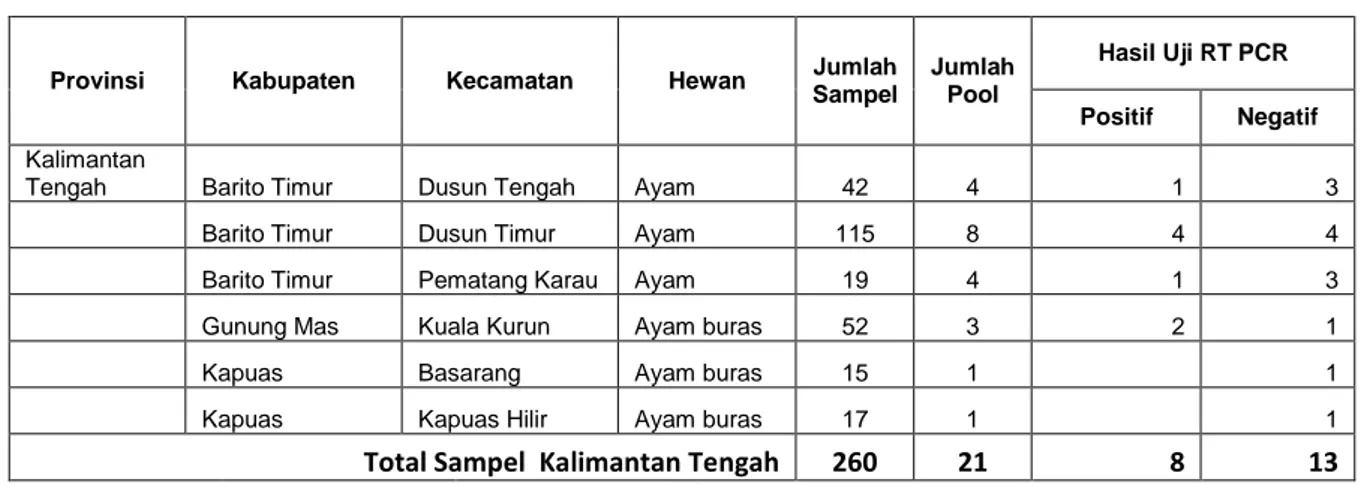
Tabel 8. Hasil pengujian RT PCR di Kalimantan Tengah
Provinsi Kabupaten Kecamatan Hewan Sampel Jumlah Jumlah Pool
Hasil Uji RT PCR
Positif Negatif
Kalimantan
Tengah Barito Timur Dusun Tengah Ayam 42 4 1 3
Barito Timur Dusun Timur Ayam 115 8 4 4
Barito Timur Pematang Karau Ayam 19 4 1 3
Gunung Mas Kuala Kurun Ayam buras 52 3 2 1
Kapuas Basarang Ayam buras 15 1 1
Kapuas Kapuas Hilir Ayam buras 17 1 1
Total Sampel Kalimantan Tengah 260 21 8 13
Catatan :
Jumlah pool yang ada berdasarkan pool yang dilakukan kembali di laboratorium setelah pool sampel yang didapatkan dari lapangan.
PEMBAHASAN
Sejak tahun 2004 seiring pertama kali diketahui adanya wabah Avian Influenza di Kalimantan maka BPPV Regional V Banjarbaru semakin waspada terhadap kejadian tersebut dan melakukan berbagai upaya untuk terus memantau kasus yang terjadi di lapangan. Salah satu cara yang ditempuh adalah dengan melakukan survey secara aktif di seluruh wilayah kerja yang ada di Kalimantan yaitu Kalimantan Barat, Kalimantan Timur, Kalimantan Selatan dan Kalimantan Tengah.
Sampel yang diambil ada 2 macam yaitu sampel serum darah unggas serta swab kloaka/trachea pada unggas. Studi para ahli menunjukkan bahwa virus AI umumnya melakukan replikasi di saluran respirasi dan gastrointestinal. Swab yang diambil dari kedua saluran tersebut dapat digunakan untuk mendeteksi adanya virus melalui berbagai metode diagnosa dalam hal ini yang digunakan adalah metode Real Time RT-PCR dan metode isolasi virus. Metode diagnosa lain yang digunakan untuk surveilans ini adalah metode HA/HI tes dimana metode ini bertujuan untuk mengetahui adanya titer antibodi terhadap virus AI di dalam tubuh hewan tersebut baik antibodi yang didapat melalui proses vaksinasi maupun antibodi yang diperoleh melalui infeksi alam
Seluruh sampel diambil sesuai dengan kaidah pengambilan sampel yang biasanya dilakukan di lapangan. Baik pada saat pengambilan sampel maupun saat penyimpanan sampel sampai pada saat diagnosa. Sampel swab disimpan dalam transport media untuk mempertahankan kondisi virus dengan harapan virus masih dalam keadaan baik dan hidup sehingga bisa dilakukan diagnosa lainnya seperti inokulasi virus pada telur ayam bertunas. Sedangkan sampel serum juga harus disimpan dalam keadaan dingin setelah dipisahkan dari plasma darah agar dapat mendapatkan hasil diagnosa yang akurat.
Berdasarkan hasil dari pelayanan aktif dan diagnosa laboratorium maka didapat bahwa sampel serum yang berhasil diambil sejumlah 4629 sampel serum unggas yang berasal dari berbagai jenis unggas di Kalimantan yaitu ayam (layer, broiler, buras), itik/mentok, burung puyuh serta burung belibis. 529 sampel (11.43%) diantaranya menunjukkan hasil positif terhadap titer antibodi virus Avian Influenza H5N1. Ada beberapa hal yang masih harus dijadikan bahan catatan di dalam hasil diagnosa yaitu adanya seropositif tinggi dan seropositif rendah. Secara umum hasil diagnosa uji HA/HI harusnya hanya dibagi menjadi 2 yaitu seropositif dan seronegatif. Hasil seropositif dinyatakan apabila berdarkan uji HI menunjukkan angka di atas 24. Sehingga dirasa perlu dilakukan penyamaan persepsi lebih lanjut mengenai hasil dari uji HA/HI tersebut diantara BPPV maupun Balai Besar Veteriner yang ada.
Titer antibodi yang terbaca pada uji HA/HI tes bisa didapat dari berbagai macam cara seperti melalui proses vaksinasi dan infeksi alamiah. Untuk antibodi yang didapat melalui proses vaksinasi juga tergantung pada jenis unggas yang diperiksa. Umumnya unggas yang mendapatkan vaksinasi adalah unggas industri seperti ayam layer serta broiler. Apabila antibodi terbaca pada unggas selain untuk industri maka perlu dilakukan kajian atau dilacak lebih lanjut mengapa titer antibodi dapat timbul pada hewan tersebut, apakah memang pernah divaksin ataukah di daerah tersebut pernah terjadi kasus infeksi virus Avian Influenza.
Pengumpulan data juga dilakukan terhadap hasil pemeriksaan virus AI dengan metode Real Time RT-PCR. Dari 2426 sampel (256 pool) yang diuji ditemukan hasil yang positif sebanyak 30 pool sampel (11.72%) terhadap virus ini. Penyebarannya juga merata di seluruh wilayah Kalimantan, yaitu Kalimantan Barat, Kalimantan Timur, Kalimantan Selatan dan Kalimantan Selatan. Kondisi ini cukup memprihatinkan karena didapati bahwa keberadaan virus masih cukup dominan. Hasil pemeriksaan menjadi acuan untuk dapat melakukan kajian lebih lanjut, keperluan informasi untuk dapat melakukan langkah-langkah pengendalian serta pembebasan virus Avian Influenza di wilayah Kalimantan.
Pemeriksaan sampel dengan menggunakan Real Time RT-PCR dikenal akurat dan memiliki spesifisitas serta sensitifitas yang tinggi. Tetapi walau begitu masih perlu diperhatikan tata cara pengambilan sampel yang benar di lapangan serta media yang digunakan harus dipastikan dalam keadaan baik dan tidak melewati masa kadaluwarsa pemakaian media tersebut agar hasil diagnosa yang didapat benar-benar akurat.
Isolasi virus dilakukan apabila hasil dari Real Time RT-PCR menunjukkan hasil yang positif. Ini bertujuan untuk mendapatkan virus Avian Influenza yang murni sehingga dapat dilakukan penelitian lebih lanjut tentang jenis virus serta pembuatan antisera/antigen spesifik terhadap virus tersebut.
KESIMPULAN DAN SARAN
Berdasarkan hasil pelayanan aktif tahun 2011 ditemukan masih beredarnya virus Avian Influenza di wilayah Kalimantan. Hasil ini diperlukan untuk dapat menentukan langkah-langkah konkrit dalam hal pemberantasan virus Avian Influenza. Walaupun disadari betul bahwa hal itu tidaklah mudah karena harus melibatkan seluruh unsur yang ada, baik itu BPPV, dinas peternakan, karantina, pelaku industri peternakan dan masyarakat di wilayah Kalimantan. Sejak tahun 2008 terlihat peningkatan upaya di seluruh dunia untuk memberantas penyakit AI. Upaya yang dilakukakan antara lain adalah perbaikan biosekuriti dan pemantapan kebijakan-kebijakan politis yang mendukung program pemberantasan AI. Walau demikian sampai saat ini diperlukan komitmen yang tinggi juga dana yang tidak sedikit untuk dapat mewujudkan Kalimantan bebas Avian Influenza secara nyata.
Dari segi surveilans sendiri masih ada beberapa hal yang perlu diperhatikan, diantaranya adalah pengumpulan data sampel yang masih mengalami kekurangan baik dari segi jumlah maupun keakuratan data yang ada. Hal ini disebabkan antara lain akibat ketidak telitian petugas pengambil sampel, pencatat sampel, penghitungan sampel. Semua informasi yang didapat perlu dituangkan dalam bentuk yang akurat disertai jumlah yang sesuai, jenis hewan dan anamnesa atau riwayat dari hewan tersebut baik riwayat vaksinasi maupun riwayat kejadian di lapangan.
Media pengambilan sampel serta penyimpanan sampel juga harus terus menerus diperhatikan untuk menghindari adanya sampel yang tidak layak diperiksa. Untuk hasil diagnosa persamaan persepsi harus ditegakkan, terutama hasil serologis. Adanya serologis positif rendah maupun serologis positif tinggi dapat membingungkan hasil yang sebenarnya. Hasil serologis sebaiknya menggunakan istilah serologis positif dan serologis negatif sehingga lebih jelas maksud dari hasil tersebut. Untuk serologis positif, titer antibodi yang terbaca adalah ≥24, sedangkan dibawah itu menunjukkan titer antibodi negatif.
Secara umum hasil kegiatan ini sangat bermanfaat untuk mengumpulkan informasi yang sebanyak-banyaknya tentang keberadaan virus AI di Kalimantan.