SINTESIS ARILAMIDA-4 DAN UJI AKTIVITAS IN VITRO TERHADAP MATRIX METALLOPROTEINASE-9 (MMP-9) SEBAGAI KANDIDAT
ANTI KANKER PAYUDARA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Farmasi
Oleh:
Ervan Setyo Nugroho NIM : 158114085
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
i
SINTESIS ARILAMIDA-4 DAN UJI AKTIVITAS IN VITRO TERHADAP MATRIX METALLOPROTEINASE-9 (MMP-9) SEBAGAI KANDIDAT
ANTI KANKER PAYUDARA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Farmasi
Oleh:
Ervan Setyo Nugroho NIM : 158114085
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
iv
HALAMAN PESEMBAHAN
“Serahkanlah segala kekuatiranmu kepada
-Nya, sebab Ia yang
memelihara kamu.”
(1 Petrus 5:7)
“
Sesungguhnya, Allah adalah penolongku; Tuhanlah yang menopang
aku
.
”
(Mazmur 54:4)
Karya ini dipersembahkan untuk Tuhan dan demi kemuliaan
Allah yang lebih besar.
vii PRAKATA
Puji dan syukur penulis haturkan kepada Tuhan Yang Maha Esa atas berkat dan rahmat-Nya, sehingga skripsi yang berjudul “Sintesis Arilamida-4 Dan Uji Aktivitas In Vitro Terhadap Matrix Metalloproteinase-9 (Mmp-9) Sebagai Kandidat Anti Kanker Payudara” dapat selesai pada waktu yang tepat. Penelitian ini merupakan bagian dari penelitian Maywan Hariono, Ph.D., Apt berjudul “Synthesis, Enzymatic Assay, and Molecular Modelling of Purine Derivatives Targeting Hemopexin Domain of Matrix Metalloproteinase (PEX-9) in The
Discovery of Novel Anti-Breast Cancer” yang didanai oleh Indonesia Toray Science Foundation (ITSF). Skripsi ini merupakan salah satu syarat untuk mendapatkan gelar sarjana Farmasi (S. Farm) di Universitas Sanata Dharma Yogyakarta.
Proses penyusunan skripsi ini melibatkan banyak pihak, baik secara langsung atau pun secara tidak langsung. Pada kesempatan ini, penulis mengucapkan terima kasih kepada:
1. Dr. Yustina Sri Hartini, Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta
2. Maywan Hariono, Ph.D, Apt. selaku dosen pembimbing yang telah memberikan segenap waktu dan tenaga untuk membimbing penulis hingga dapat menyelesaikan penulisan naskah ini.
3.
Dr. Christine Patramurti, Apt.dan
Damiana Sapta Candrasari, S.Si. M.Sc.selaku dosen penguji yang telah memberikan arahan dan masukan yang membangun dari awal sehingga penelitian dapat diselesaikan dengan baik. 4. Pak Parlan (Laboran Laboratorium Kimia Organik), Mas Kunto (Laboran
Laboratorium Kimia Analisis), Mas Bimo (Laboran Laboratorium Kimia Analisis Instrumental), dan Pak Wagiran (Laboran Laboratorium
Farmakognosi Fitokimia) yang telah membantu memberikan pelayanan selama penelitian berlangsung.
viii
6. Kevin, Sangga, Aldo, Krisna, dan Wisnu selaku tim penelitian ini yang selalu memberikan dukungan dan hiburan di setiap waktu sehingga penelitian ini menjadi tidak membosankan.
7. Papa, Mama, dan Mas Chandra, serta segenap keluarga besar yang selalu mendukung dan menemani di setiap suka dan duka selama proses perkuliahan dan penelitian ini berlangsung.
8. Teman-teman FSMB 2015 Universitas Sanata Dharma yang selalu memberikan dukungan, motivasi, dan masukan dalam menyelesaikan naskah
ini.
9. Teman-teman “Pethodon” yang terdiri atas Sangga, Aris, Kevin, Ricky, Kemara, Willy dan “SKJL” yang terdiri atas Veve, Valen, Alicia, yang juga memberikan dukungan dan masukan yang sangat bermanfaat untuk menyelesaikan naskah ini, serta selalu mendukung penulis bahkan dari awal masa perkuliahan.
10. Semua teman-teman yang tidak dapat disebutkan satu-persatu karena keterbatasan tempat, yang telah membantu penulis di segala hal selama proses perkuliahan, baik dalam bidang akademis maupun dalam bidang yang lain. 11. Last but not least, Anastasia Dea Putri Wijayanti yang selalu setia menemani
serta memberikan dukungan dan motivasi yang tiada hentinya hingga saat ini, dalam penyelesaian naskah ini.
Penulis menyadari bahwa naskah penelitan ini masih jauh dalam kesempurnaan dan masih memiliki banyak kekurangan. Penulis sangat mengharapkan kritik dan saran yang dapat membangun naskah penelitian agar dapat bermanfaat dalam pengembangan ilmu pengetahuan.
Yogyakarta, 31 Januari 2019
ix ABSTRAK
Kanker merupakan penyakit penyebab kematian kedua terbesar di dunia, dengan prevalensi tertinggi pada wanita berupa kanker payudara. Kematian pada penderita kanker tidak disebabkan kanker primernya, melainkan kanker yang sudah menyebar ke daerah lain yang disebut metastasis. Penyebab terjadinya metastasis adalah karena degradasi extracellular matrix (ECM) oleh enzim Matrix Metalloproteinase (MMP). Pada kanker payudara HER-2 positif dan triple negative
diekspresikan MMP-9 dalam jumlah yang besar. Oleh karena MMP-9 dapat dihambat secara selektif pada domain hemopexin, maka disintesis senyawa arilamida-4 yang mengambil farmakofor dari senyawa pada penelitian sebelumnya yang terbukti dapat menghambat pada domain hemopexin. Sintesis arilamida-4 dilakukan melalui reaksi substitusi nukleofilik asil (SNA). Sintesis dilakukan
dengan mereaksikan sulfadiazin dan 3-bromopropionil klorida dengan katalisator piridin pada suhu kamar. Senyawa hasil sintesis berupa serbuk kuning (rendemen 66%), negatif terhadap DAB-HCl, larut dalam DMSO, dan memiliki titik lebur 191-195oC. Senyawa hasil sintesis sudah dipastikan strukturnya dengan NMR, FTIR, dan MS. Uji aktivitas in vitro terhadap MMP-9 menunjukkan bahwa nilai IC50
sebesar 193 µM, sehingga dapat disimpulkan bahwa arilamida-4 aktif dalam menghambat enzim MMP-9.
x ABSTRACT
Cancer is the leading largest cause of death in the world, in which breast cancer being the highest prevalence in female among others. The mortality in cancer is caused by the cells has been spreading over areas which is called as metastasis, rather than the primary one. The metastasis is due to the degradation of extracellular matrix (ECM) by the Matrix Metalloproteinase (MMP) enzyme. In HER-2 positive and triple negative breast cancers, MMP-9 is overexpressed, therefore is an interesting target in breast cancer drug discovery. In this study, it was synthesized compound (Arylamide-4) having pharmacophores similar to the active compound being found to inhibit MMP-9 selectively in hemopexin domain. Arylamide-4 was synthesized by reacting sulfadiazine and 3-bromopropionyl chloride using pyridine as the catalyst at room temperature through acyl nucleophilic substitution reactions (SNA). The physical appearance of the synthesize compound is yellow powder
(yield = 66%), which negatively reacts with DAB HCl, soluble in DMSO, having melting range 191-195oC. The synthetic product was characterized using NMR, FTIR, and MS, and then in vitro testing against MMP-9. The conclusion is arilamide-4 compound is able to inhibit MMP-9 with a potent activity as calculated IC50 is equal to 193 µM.
Keywords: Arylamide-4, Hemopexin, Breast Cancer, Matrix Metalloproteinase 9,
xi DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
xii
DAFTAR TABEL
Halaman
Tabel I. Tabel kelarutan produk sintesis ... 8 Tabel II. Kurva hubungan log konsentrasi arilamida-4 dengan
xiii
DAFTAR GAMBAR
Halaman Gambar 1. (a) Struktur Compound 2 yang disintesis oleh Dufour et al.,
(2011) beserta gugus farmakofornya, (b) Struktur senyawa hasil sintesis Adhipandito, (c) Struktur senyawa hasils sintesis
Ludji, (d) Senyawa arilamida-4 ... 2
Gambar 2 Mekanisme reaksi sintesis arilamida-4 ... 5
Gambar 3 (a) Produk sintesis serbuk arilamida-4, (b) Serbuk starting material sulfadiazin ... 6
Gambar 4 Hasil Uji KLT Arilamida-4 ... 7
Gambar 5. Spektrum 1H-NMR produk sintesis ... 10
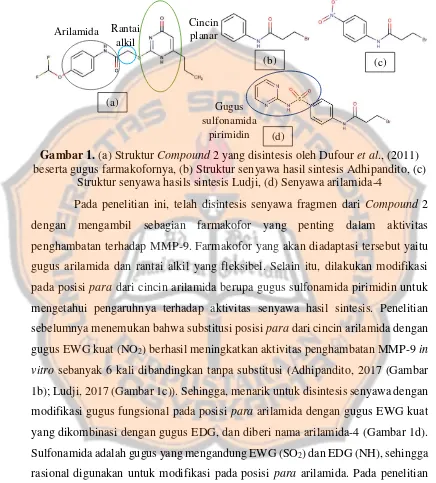
Gambar 6. Spektrum 13C-NMR produk sintesis ... 11
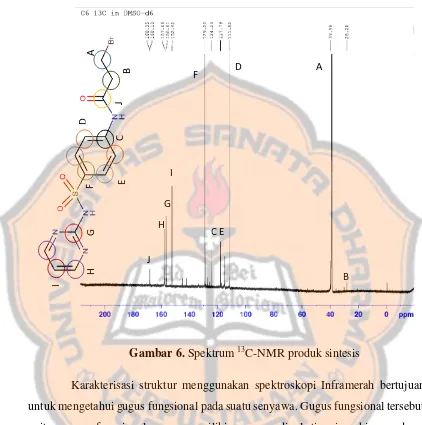
Gambar 7. Pita vibrasi inframerah produk sintesis ... 12
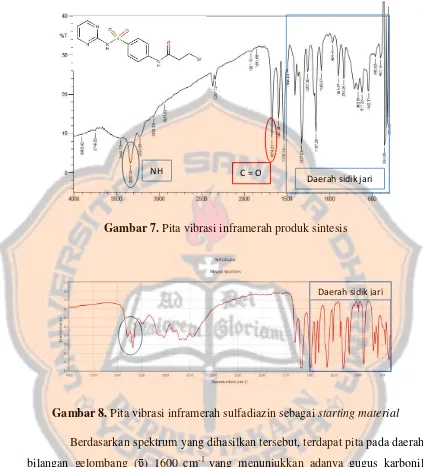
Gambar 8. Pita vibrasi inframerah sulfadiazin sebagai starting material .. 12
Gambar 9. Kromatogram GC produk sintesis dengan intensitas A (14,29%), B (19,05%), C(4,76%), dan D (61,90%) ... 13
Gambar 10. Spektrum MS produk sintesis ... 14
xiv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Produk reaksi berupa suatu semisolid yang berwarna
kuning ... 19
Lampiran 2. Mekanisme reaksi antara DAB-HCl dan sulfadiazin ... 19
Lampiran 3. Visualisasi produk reaksi dengan DAB-HCl dibandingkan dengan sulfadiazin sebagai starting material ... 20
Lampiran 4. Perhitungan Rf hasil uji KLT produk sintesis... 20
Lampiran 5. Perhitungan bahan dan rendemen produk sintesis ... 20
Lampiran 6. Perbesaran spektrum HA dan HB ... 22
Lampiran 7. Perbesaran spektrum HC dan HF ... 23
Lampiran 8. Perbesaran spektrum HE ... 23
Lampiran 9. Perbesaran spektrum HD ... 24
Lampiran 10. Mekanisme pola fragmentasi m/z 65 dan m/z 319 ... 24
Lampiran 11. Mekanisme pola fragmentasi base peak m/z 185 ... 24
Lampiran 12. Representasi tata letak 96-microwell plate uji aktivitas in vitro ... 25
1 PENDAHULUAN
Kanker merupakan kumpulan sel abnormal yang tumbuh secara tidak beraturan yang merupakan hasil dari mutasi somatik atau perubahan ekspresi gen yang spesifik (Paulmurugan, 2012). Salah satu enzim yang berperan dalam proses perkembangan kanker adalah Matrix Metalloproteinase (MMP) yang berfungsi mendegradasi extracellular matrix (ECM), sehingga sel kanker dapat bermetastasis (Löffek et al., 2011). Pada kanker payudara, terjadi ekspresi MMP-9 yang berlebih dibandingkan dengan sel payudara normal (Merdad et al., 2014, Yousef et al.,
2014). Sebagian besar inhibitor MMP-9 yang sudah disintesis memiliki target yang tidak spesifik, sehingga mengakibatkan banyaknya efek samping yang merugikan, seperti inflamasi dan nyeri muskuloskeletal pada penggunaan marimastat (Cathcart
et al., 2015). Inhibitor-inhibitor tersebut cenderung menarget pada domain katalitik yang memiliki homologi yang cukup besar terhadap domain katalitik pada MMP lain, sehingga aktivitas MMP lain juga ikut terhambat (Vandenbroucke and Libert, 2014). Sedangkan domain hemopexin MMP-9 memiliki homologi yang cukup kecil, yaitu sekitar 25-33% sekuens asam amino terhadap domain hemopexin pada MMP yang lain (Dufour et al., 2011). Hal tersebut menunjukkan bahwa dengan menarget pada domain hemopexin suatu MMP dapat mengurangi resiko penghambatan terhadap MMP lain.
Dufour et al., (2011) dan Alford et al., (2017) telah menemukan dua senyawa aktif yang dipilih melalui virtual screening terhadap hemopexin-9 (PEX-9) dengan menggunakan metode molecular docking yang divalidasi dengan uji in vitro dengan Kd masing-masing 2,2 µM dan 0,32 µM. Senyawa Dufour diperoleh
dari zinc database dengan kode 135415473 (~{N}- [4-(difluoromethoxy) phenyl]-2- [(6-oxo)-4- propyl-1~{H}- pyrimidin-2-yl) sulfanyl] acetamide; www.pubchem.ncbi.nlm.nih.gov), yang kemudian diberi nama “Compound 2”
(Gambar 1a). Gugus-gugus penting yang diduga memiliki peran dalam aktivitas
2
dapat memblok signaling pathway untuk migrasi sel. Dufour tidak menjelaskan pentingnya Electron Withdrawing Group (EWG) yang terdapat pada Compound 2 memiliki pengaruh terhadap efek sitostatiknya.
Gambar 1. (a) Struktur Compound 2 yang disintesis oleh Dufour et al., (2011) beserta gugus farmakofornya, (b) Struktur senyawa hasil sintesis Adhipandito, (c)
Struktur senyawa hasils sintesis Ludji, (d) Senyawa arilamida-4
Pada penelitian ini, telah disintesis senyawa fragmen dari Compound 2 dengan mengambil sebagian farmakofor yang penting dalam aktivitas penghambatan terhadap MMP-9. Farmakofor yang akan diadaptasi tersebut yaitu gugus arilamida dan rantai alkil yang fleksibel. Selain itu, dilakukan modifikasi pada posisi para dari cincin arilamida berupa gugus sulfonamida pirimidin untuk mengetahui pengaruhnya terhadap aktivitas senyawa hasil sintesis. Penelitian sebelumnya menemukan bahwa substitusi posisi para dari cincin arilamida dengan gugus EWG kuat (NO2) berhasil meningkatkan aktivitas penghambatan MMP-9 in vitro sebanyak 6 kali dibandingkan tanpa substitusi (Adhipandito, 2017 (Gambar 1b); Ludji, 2017 (Gambar 1c)). Sehingga, menarik untuk disintesis senyawa dengan modifikasi gugus fungsional pada posisi para arilamida dengan gugus EWG kuat
yang dikombinasi dengan gugus EDG, dan diberi nama arilamida-4 (Gambar 1d). Sulfonamida adalah gugus yang mengandung EWG (SO2) dan EDG (NH), sehingga
rasional digunakan untuk modifikasi pada posisi para arilamida. Pada penelitian kali ini akan digunakan sulfadiazin sebagai gugus substituen pada posisi para
dengan asumsi adanya cincin pirimidin juga memiliki karakter EWG, sehingga diharapkan lebih meningkatkan aktivitasnya.
3 METODE PENELITIAN
Bahan
Bahan utama yang digunakan adalah sulfadiazin, 3-bromopropionil klorida, dan piridin. Bahan-bahan lain yang berfungsi sebagai pelarut, fase gerak, fase diam, dan juga reagen antara lain n-heksana, etil asetat, metanol, dimetil sulfoksida (DMSO), gel silika 60 GF254 untuk KLT (Merck 7730), dan
dimetilaminobenzaldehida HCl (DAB-HCl). Pada proses elusidasi struktur, digunakan pellet Kalium Bromida (KBr) untuk FTIR dan DMSO-d6 untuk pelarut
1H-NMR dan 13C-NMR. Pada uji aktivitas in vitro menggunakan Kit Enzim yang
disuplai dari BioVision, yang terdiri dari enzim MMP-9 terliofilisasi, substrat peptida, bufer Tris HCl, peptida NNGH sebagai kontrol positif, gliserol untuk mengencerkan enzim, dan DMSO sebagai pelarut sampel.
Alat
Labu alas bulat (LAB) (pyrex), timbangan analitik (Mettler Toledo®), pompa vakum (GAST model DOA-P504-BN), dan oven (Memmert GmbH + Co.KG), pengaduk magnetiK, lampu UV254, dan alat gelas pada umumnya. Pada
proses elusidasi struktur digunakan spektrofotometer inframerah (Shimadzu), spektrometer nuclear magnetic resonance (Bruker 176 dan 700 MHz), spektrometer massa (GCMS-QP2010S Shimadzu). Pada uji aktivitas in vitro, digunakan pipet mikro (Eppendorf), micro well plate 96, pipet tips, inkubator, vortex, dan Tecan Microplate Reader (Infinite 200 Pro).
Tata Cara Penelitian
Sintesis 3-bromo-N-{4-[pyrimidin-2-yl)sulfamoyl]phenyl} propenamide (Diadaptasi dari metode Arifiyanto, 2001)
Sulfadiazin dimasukkan sebanyak 3,59 mmol (0,898 g) ke dalam LAB di lemari asam, kemudian katalisator piridin ditambahkan sebanyak 7,18 mmol (0,580
4
hingga pH netral kemudian dicuci dengan air dan dikeringkan di oven pada suhu 40oC.
Uji Pendahuluan dan Elusidasi Struktur
Pengujian selanjutnya adalah organoleptis, titik lebur, dan uji DAB-HCl dengan membandingkan hasil uji senyawa sulfadiazin sebagai starting material dan senyawa arilamida-4 sebagai produk sintesis. Selain itu, dilakukan uji kelarutan dan penghitungan rendemen produk sintesis. Pemastian struktur molekul dilakukan menggunakan 1H-NMR, 13C-NMR di Institut Farmasetikal dan Nutrasetikal
Malaysia, sedangkan FTIR dan GC-MS dilakukan di Fakultas MIPA Universitas Gajah Mada.
Uji Aktivitas in Vitro
Uji aktivitas in vitro dilakukan di Universitas Padjajaran, Jatinangor. Enzim yang terliofilisasi direkonstitusi dengan 110 µL gliserol 30% dalam
deionised water. Larutan tersebut diencerkan dalam 550 µL bufer dan siap digunakan untuk pengujian. Sampel dilarutkan dalam DMSO hingga mencapai konsentrasi akhir 200 µg/mL di dalam 96-microwell plate. Konsentrasi akhir DMSO dalam wellplate tidak lebih dari 2%. Sampel (1µL) kemudian dicampur dengan bufer (44 µL) dan enzim (5 µL) pada tiga well sebagai sampel yang diamati. Inhibitor NNGH 2mM (2 µL) dimasukkan ke dalam tiga sumuran lain dengan ditambahkan enzim MMP-9 (5 µL) dan bufer (43 µL) sebagai kontrol positif. Kemudian enzim MMP-9 (5 µL) dimasukkan ke dalam tiga sumuran lain dan ditambahkan bufer (45 µL) sebagai kontrol negatif. Dapar (100 µL) dimasukkan ke dalam tiga sumuran lain yang digunakan sebagai blanko. Campuran tersebut diinkubasi selama 30 menit pada suhu 37ºC. Substrat 40 µM (50 µL) ditambahkan ke dalam masing-masing well hingga volume total 100 µL dan diinkubasi selama 60 menit pada suhu 37ºC. Fluorosensi dari masing-masing sumuran kemudian dibaca menggunakan Tecan Infinite 200 Pro Microplate Reader dengan panjang
gelombang 325/393 nm. Pada perhitungan IC50, dibuat seri larutan dengan empat
konsentrasi, yaitu 50 µg/mL, 100 µg/mL, 200 µg/mL dan 300 µg/mL. IC50 dihitung
5
yang didapat dari kurva hasil pengukuran seri larutan. HASIL DAN PEMBAHASAN
Sintesis 3-bromo-N-{4-[pyrimidin-2-yl)sulfamoyl]phenyl} propenamide Tahap sintesis menggunakan reaksi SNA yang melibatkan sulfadiazin
sebagai nukleofil karena memiliki amina primer, dan 3-bromopropionil klorida yang memiliki gugus asil. Reaksi dibantu dengan katalisator piridin yang berfungsi untuk mempercepat reaksi. Piridin akan mensubstitusi gugus klorida karena gugus klorida masih bersifat ekeltronegatif yang terikat kuat dengan C karbonil yang
bersifat elektropositif dengan membentuk 3-bromopropionil piridin. Piridin sebagai gugus pergi sangat reaktif karena N positif cenderung tolak-menolak dengan C karbonil yang elektropositif, sehingga amina primer dari sulfadiazin lebih mudah masuk. Gugus amida dapat disintesis melalui beberapa metode, salah satunya dengan mereaksikan amina primer dengan asil klorida, sehingga Cl pada C karbonil akan tersubstitusi oleh amina. Amina primer akan menyerang karbon karbonil (C karbonil) pada 3-bromopropionil piridin dan gugus piridin akan lepas sebagai gugus pergi (Koltunov et al., 2016). Reaksi tersebut menghasilkan senyawa yang memiliki gugus amida. Mekanisme reaksi disajikan pada Gambar 2.
Gambar 2. Mekanisme reaksi sintesis arilamida-4 Uji Pendahuluan dan Elusidasi Struktur
Produk reaksi berupa suatu semisolid yang berwarna kuning (Lampiran 1) yang masih memerlukan tahap pemurnian. Produk masih memiliki pH asam karena produk samping yang dihasilkan adalah asam klorida (HCl), sehingga perlu dinetralkan dengan Na2CO3 10% membentuk NaCl, H2O dan CO2 yang dapat dicuci
6
menghidrolisis gugus amida pada arilamida-4. Warna serbuk sulfadiazin adalah putih, sedangkan serbuk senyawa arilamida-4 adalah kuning. Perubahan warna tersebut disebabkan oleh adanya pertambahan panjang ikatan rangkap yang terkonjugasi sehingga menyebabkan senyawa menjadi berwarna. Produk sintesis dan starting material sulfadiazin disajikan pada Gambar 3.
(a) (b)
Gambar 3. (a) Produk sintesis serbuk arilamida-4, (b) Serbuk starting material
sulfadiazin
Senyawa kemudian dilakukan identifikasi awal dengan DAB-HCl. Tujuan dari uji tersebut adalah untuk memastikan bahwa amina primer sudah tersubstitusi. Senyawa yang memiliki gugus amina primer akan bereaksi dengan DAB-HCl sehingga membentuk basa Schiff yang berwarna jingga (Adegoke, 2011). Hasil pengujian menunjukkan bahwa senyawa arilamida-4 tidak berubah warna menjadi jingga. Hal tersebut menunjukkan bahwa basa Schiff tidak terbentuk karena amina primer sudah tersubstitusi. Mekanisme reaksi antara DAB-HCl dan sulfadiazin disajikan pada Lampiran 2, sedangkan visualisasi produk hasil reaksi dengan DAB-HCl dibandingkan dengan sulfadiazin sebagai starting material disajikan pada Lampiran 3.
Pengujian dilanjutkan dengan KLT untuk melihat bahwa senyawa baru sudah terbentuk beserta kemurniannya. Hasil uji KLT menunjukkan bahwa
retention factor (Rf) senyawa arilamida-4 (0,64) berbeda dengan senyawa awal
sulfadiazin (0,58) dan piridin (0,66). Perbedaan nilai Rf sebesar 0,02 hingga 0,08
7
Meskipun arilamida-4 memiliki gugus etilen yang bersifat non polar, namun polaritasnya diimbangi dengan adanya gugus C karbonil dan Br yang bersifat polar. Perhitungan Rf disajikan pada Lampiran 4.
Gambar 4. Hasil Uji KLT Arilamida-4
Rendemen arilamida-4 yang terbentuk adalah 66%. Meskipun rendemennya sudah lebih dari 50%, namun masih dapat dioptimasi dengan melakukan variasi metode berupa mol reaktan, suhu, dan waktu pengadukan. Perhitungan bahan dan rendemen produk sintesis disajikan pada Lampiran 5.
Senyawa arilamida-4 kemudian diuji titik leburnya untuk mendukung kualitas kemurniannya. Hasil yang didapat menunjukkan bahwa titik lebur senyawa arilamida-4 adalah 191-195oC, yang sudah berbeda dengan titik lebur senyawa sulfadiazin yaitu 252-256oC (O’Neil et al., 2001). Oleh karena perbedaan rentang titik leburnya, menunjukkan bahwa produk sintesis berbeda dari senyawa awalnya. Suatu senyawa dinyatakan murni bila jarak leburnya adalah 0,5-1,5oC (Mohrig et al., 2014). Jarak lebur senyawa arilamida-4 sebesar 4oC, sehingga dikatakan masih terdapat impurities pada produk sintesis. Hal tersebut disebabkan karena belum dilakukan pemurnian kembali untuk mendapatkan senyawa arilamida-4 yang lebih murni.
Selain uji pendahuluan yang lain, juga dilakukan uji kelarutan senyawa arilamida-4. Hasil uji kelarutan senyawa arilamida-4 disajikan pada Tabel I. Uji kelarutan dilakukan khususnya untuk mengetahui pelarut yang sesuai untuk
A B
C
Rf A (Arilamida-4) = 0,64
Rf B (Piridin) = 0,66
8
pengujian dengan spektroskopi. Senyawa arilamida-4 merupakan senyawa yang bersifat semipolar karena dapat larut dalam pelarut semipolar, seperti DMSO.
Tabel I. Tabel kelarutan produk sintesis
Elusidasi struktur dilakukan dengan spektrosopi NMR, IR, dan GC-MS.
Tujuan dari spektroskopi NMR adalah untuk mengetahui kerangka hidrokarbon dari produk sintesis. Berdasarkan hasil uji kelarutan, pelarut yang digunakan pada pengujian 1H-NMR dan 13C-NMR adalah DMSO-d6. Spektrum 1H-NMR arilamida-4 ditunjukkan pada Gambar 5.
Sinyal-sinyal yang muncul pada pergeseran 3,87 ppm dan 3,72 ppm merupakan HA (integrasi= 2), dan sinyal pada pergeseran 2,99 ppm dan 2,86 ppm
merupakan HB (integrasi= 2). Dengan munculnya set proton HA dan HB yang
merupakan etilen, menegaskan bahwa senyawa arilamida-4 telah terbentuk. Sinyal dari suatu proton alkil akan muncul pada geseran kimia 2,00-3,00 (Vollhardt dan Schore, 2014). Hal tersebut menunjukkan bahwa proton HA dan HB yang muncul
pada geseran kimia sekitar 2,00-3,00 ppm sudah sesuai dengan teori.
Pola splitting dari kedua sinyal tersebut adalah triplet, karena kedua set proton tersebut memiliki jumlah proton tetangga yang tidak ekivalen secara magnetik sebanyak dua. Pada umumnya, kedua set proton tersebut masing-masing menunjukkan satu triplet. Namun pada hasil percobaan kedua set proton tersebut menunjukkan empat triplet pada jarak yang berdekatan. Hal ini kemungkinan disebabkan oleh efek ikatan tunggal pada etilen yang bersifat free rotatable,
sehingga pada sudut tertentu atom H pada karbon yang sama bisa memiliki lingkungan kimia yang berbeda. Oleh karena itu, masing-masing proton tersebut akan mengenali proton tetangganya sebanyak dua kali. Hal tersebut ditegaskan dengan jumlah integrasi dari sinyal triplet sebanyak dua. Nilai J coupling constant
Pelarut Kelarutan Produk Sintesis
DMSO Larut (1:20)
Etanol Agak sukar larut (1:80) Aseton Agak sukar larut (1:80) Asetonitril Tidak larut
Etil asetat Tidak larut
n-heksana Tidak larut
9
untuk kedua sinyal triplet tersebut adalah6,3 Hz, yang menunjukkan bahwa kedua set proton tersebut bertetangga secara langsung. Perbesaran spektrum proton HA
dan HB disajikan pada Lampiran 6.
Proton selanjutnya yang terdeteksi adalah proton pada benzena yang terdiri atas dua lingkungan kimia, yaitu lingkungan HC dan HD. HC muncul pada geseran
kimia 6,57 ppm (integrasi= 2) (J= 9,1 Hz), sedangkan HD pada geseran kimia 8,48
ppm (integrasi= 2) (J= 4,9 Hz). HC berada pada posisi yang lebih shielded
dibandingkan dengan HD, karena HD menempel pada C yang bersebelahan dengan
gugus sulfonil (SO2) yang memiliki elektronegativitas yang tinggi, sehingga
cenderung menarik elektron pada HD menjadi tidak terlindungi. HC dan HD muncul
sebagai doblet karena masing-masing memiliki satu proton tetangga. Sinyal dari suatu proton aromatik akan muncul pada geseran kimia 7,00-8,00 (Vollhardt dan Schore, 2014). Hal tersebut menunjukkan bahwa proton HC dan HD yang muncul
pada geseran kimia sekitar 7,00-8,00 ppm sudah sesuai dengan teori. Perbesaran spektrum proton HC disajikan pada Lampiran 7, sedangkan perbesaran proton HD
disajikan pada Lampiran 9.
Proton selanjutnya adalah proton-proton pada pirimidin, yang memiliki dua lingkungan kimia yaitu HE dan HF. HE terletak di dekat N heterosiklik yang
bersifat elektronegatif sehingga berada di pergeseran yang lebih deshielded
dibandingkan HF, yaitu pada 7,62 ppm (integrasi= 2) (J= 9,1 Hz). Hal tersebut
disebabkan oleh proton HE yang lebih tidak terlindungi dibanding HF karena adanya
pengaruh dari gugus elektronegatif di sebelahnya. HE muncul sebagai doblet karena
hanya memiliki satu proton tetangga. Sedangkan sinyal HF muncul pada geseran
7,01 ppm (integrasi= 1) (J= 4,9 Hz) sebagai triplet karena memiliki dua proton tetangga. Perbesaran spektrum proton HE disajikan pada Lampiran 8, sedangkan
perbesaran proton HF disajikan pada Lampiran 7. Spektrum 1H-NMR disajikan
10
Gambar 5. Spektrum 1H-NMR Produk Sintesis
Pada spektrum 13C-NMR, terdapat 9 sinyal yang diindikasi sebagai karbon
pada struktur produk sintesis. Karbon etilen yang ditunjukkan dengan simbol CA
dan CB berturut-turut berada pada geseran 39,9 dan 28,3 ppm. Karbon karbonil (CJ)
berada pada geseran 168,4 ppm. Karbon pada benzena memiliki 4 lingkungan kimia
yang berbeda, yaitu CC, CD, CE, dan CF. CC berada pada geseran 124,2 ppm, CD
pada 111,5 ppm, CE pada 117,8 ppm, dan CF pada 129,2 ppm. Karbon pada
pirimidin terdiri atas 3 lingkungan kimia , yaitu CG, CH, dan CI. CG berada pada
geseran kimia 156,6 ppm, CH pada 157,7 ppm, dan CI pada 152,4 ppm. 13C-NMR
hanya dapat digunakan untuk mengindikasikan geseran kimianya, dan tidak mengindikasikan splitting, integrasi, dan J coupling constant karena 13C memiliki momen magnetik yang rendah yaitu 67,28% radians/Tesla. Selain itu, kelimpahan
13C di alam sangat kecil, yaitu sebesar 1,08% sehingga menyebabkan pola splitting
dan integrasi menjadi tidak spesifik (Pavia et al., 2015). Berdasarkan analisis 1 H-NMR dan 13C-NMR, dapat disimpulkan bahwa struktur hidrokarbon produk sintesis sudah sesuai dengan struktur arilamida-4. Spektrum 13C-NMR disajikan
11 pada Gambar 6.
Gambar 6. Spektrum 13C-NMR produk sintesis
Karakterisasi struktur menggunakan spektroskopi Inframerah bertujuan
untuk mengetahui gugus fungsional pada suatu senyawa. Gugus fungsional tersebut yaitu gugus fungsional yang memiliki momen dipol tinggi, sehingga dapat menyerap radiasi inframerah dan menyebabkan ikatannya bervibrasi secara mengulur (stretching) maupun menekuk (bending) (Fessenden, 1986; Pavia et al.,
12
Gambar 7. Pita vibrasi inframerah produk sintesis
Gambar 8. Pita vibrasi inframerah sulfadiazin sebagai starting material
Berdasarkan spektrum yang dihasilkan tersebut, terdapat pita pada daerah bilangan gelombang (ῡ) 1600 cm-1 yang menunjukkan adanya gugus karbonil (C=O). Gugus karbonil tersebut diprediksi sebagai amida karena terdapat juga pita pada daerah 3300 cm-1 yang diduga sebagai NH amida. Spektrum IR produk sintesis
dibandingkan dengan starting material yaitu sulfadiazin. Pada spektrum FTIR sulfadiazin tidak dijumpai pita ulur tajam pada 1600 cm-1. Kemudian juga pada
bilangan gelombang 3300 cm-1 pita NH terlihat sebagai kembar, karena tidak tersubstitusi. Selain itu, hasil spektroskopi IR juga menunjukkan daerah sidik jari (500-1500 cm-1) pada produk sintesis berbeda dengan daerah sidik jari pada
NH C = O
Daerah sidik jari
13
spektrum sulfadiazin sebagai starting material. Hal tersebut mendukung profil
NMR produk sintesis sudah sesuai pada aspek gugus fungsionalnya.
Metode selanjutnya adalah kromatografi gas-spektrometri massa (GC-MS) yang bertujuan untuk mengetahui kemurnian dan bobot molekul dari produk sintesis. Sebelum dideteksi bobot molekulnya, senyawa dipisahkan terlebih dahulu menggunakan GC. Kromatografi gas dapat digunakan pada produk sintesis, karena produk sintesis memiliki titik lebur <300oC, yaitu 191-195oC. Senyawa
arilamida-4 dinyatakan murni apabila hanya terdapat satu puncak yang muncul pada
kromatogram. Namun kromatogram senyawa arilamida-4 menunjukkan bahwa muncul empat puncak, yaitu puncak A, B, C, dan D, sehingga dapat diindikasikan bahwa senyawa arilamida-4 tidak 100% murni. Hal ini sesuai dengan hasil dari pengujian titik lebur yang masih memiliki jarak lebur yang lebar (>1,5oC) yang menunjukkan bahwa masih terdapat impurities pada produk sintesis. Namun dengan kemurnian setidaknya 80% masih dapat dibaca spektra massanya (Triono, 2007). Sehingga pada penelitian selanjutnya disarankan untuk melakukan pemurnian lebih lanjut.Puncak D pada waktu retensi 41 menit merupakan puncak tertinggi yang menunjukkan bahwa puncak tersebut adalah senyawa arilamida-4 karena memiliki intensitas yang paling tinggi. Kromatogram GC produk sintesis disajikan pada Gambar 9.
Gambar 9. Kromatogram GC produk sintesis dengan intensitas relatif A (14,29%), B (19,05%), C(4,76%), dan D (61,90%)
Puncak yang terpisah dari GC, bobot molekulnya dideteksi dengan spektrometer massa yang menunjukkan bobot molekul per ion (m/z) terbesar adalah
A B C
14
319. Bobot molekul utuh produk sintesis seharusnya 384. Kehilangan massa per ion yang hilang sebesar 65 diduga akibat fenomena penataan ulang gugus amina pada sulfonamida yang terikat pada posisi para dari benzena setelah SO2 terlepas sebagai
m/z 65 (Sun et al., 2008). Pola fragmentasi ini dapat dilihat pada Lampiran 10. Selain itu, base peak terdeteksi pada m/z 185 yang merupakan fragmen yang paling banyak terjadi dan stabil. Pola fragmentasi base peak dapat dilihat pada Lampiran 11. Secara keseluruhan berdasarkan hasil analisis NMR, FTIR, dan MS, produk sintesis dipastikan strukturnya sebagai arilamida-4. Spektrum MS produk sintesis
disajikan pada Gambar 10.
Gambar 10. Spektrum MS produk sintesis Uji Aktivitas in Vitro Terhadap MMP-9
MMP-9 merupakan suatu enzim protease, sehinga dapat memotong ikatan peptida pada substratnya melalui aktivitas proteolitik. Dalam pengujian ini, substrat berikatan dengan suatu fluorofor. Saat MMP-9 memotong ikatan peptida pada substrat, fluorofor akan terlepas dan dibaca fluorosensinya oleh spektrofluorometer pada panjang gelombang 325/393 nm. Semakin tinggi fluorosensi yang terbaca menunjukkan semakin tinggi pula aktivitas enzim (Nicolotti, 2012). Senyawa arilamida-4 memiliki aktivitas penghambatan terhadap MMP-9 sebesar 95% pada konsentrasi 200 µg/mL. Karena memiliki persen penghambatan ≥50%, maka dapat dilanjutkan dengan menghitung nilai IC50. Pada penghitungan IC50 dibuat seri
konsentrasi yaitu 50, 100, 200, dan 300 µg/mL. Kurva hubungan log konsentrasi arilamida-4 terhadap % inhibisi disajikan pada Gambar 11. Kurva tersebut menunjukkan dengan meningkatnya konsentrasi sampel, proporsional terhadap %
15
0,9962. Berdasarkan regresi non linier, diperoleh persamaan y = -74,319x2+370,34 x – 382,93. y adalah % inhibisi dan x adalah konsentrasi. Untuk menghitung IC50,
angka 50 dimasukkan sebagai y sehingga diperoleh x sebagai log konsentrasi minimal yang menghambat 50% aktivitas enzim MMP-9. Senyawa dapat dikategorikan berdasarkan spektrum aktivitas secara umum untuk aktivitas biologi dari suatu senyawa menjadi sangat aktif (<1 µM), aktif (1-25 µM), moderat (25-50 µM), rendah (50-100 µM), sangat rendah (100-500 µM), dan inaktif (>500 µM) (Zhu et al., 2013).IC50 yang terhitung adalah 193 µM yang mengindikasikan bahwa
arilamida-4 memiliki aktivitas yang sangat rendah. Namun dalam reviewnya, Zhu
et al., (2013) menyebutkan bahwa terdapat 56 publikasi penelitian yang menyatakan bahwa IC50 pada rentang 100-500 µM sudah dapat dinyatakan aktif
untuk studi pendahuluan seperti pada penelitian ini. Sehingga dapat disimpulkan bahwa senyawa arilamida-4 aktif menghambat enzim MMP-9 in vitro. Perhitungan % inhibisi senyawa arilamida-4 disajikan pada Tabel II.
Tabel II. Perhitungan % inhibisi senyawa arilamida-4
Sampel Reading 1 Reading 2 Reading 3 Purata Reading
Blanko (B) 9683 9349 9217 9416
Kontrol (-) 32989 33687 30321 32332
Kontrol (+) 5946 5946 7898 6597
Arilamida-4 (S) 8855 11236 11426 10506
Sampel Purata-Blanko % Aktivitas Enzim % Inhibisi Blanko (B)
Kontrol (-) 22916 100 0
Kontrol (+) -2819 -12 112
16
0.00 0.50 1.00 1.50 2.00 2.50 3.00
KURVA HUBUNGAN LOG KONSENTRASI
ARILAMIDA-4 DENGAN %INHIBISI
74 ± 1 79 ± 2
Gambar 11. Kurva hubungan log konsentrasi arilamida-4 dengan % inhibisi KESIMPULAN DAN SARAN
Kesimpulan
Hasil penelitian menunjukkan bahwa senyawa arilamida-4 dapat disintesis dengan mereaksikan sulfadiazin dan 3-bromopropionil klorida dengan katalisator piridin melalui SNA. Senyawa arilamida-4 aktif menghambat aktivitas enzim
MMP-9 dengan IC50 sebesar 193 µM.
Saran
Berdasarkan hasil penelitian yang menunjukkan bahwa senyawa arilamida-4 aktif menghambat aktivitas enzim MMP-9 in vitro pada tingkat molekular, dapat dilakukan uji in vitro terhadap sel kanker payudara jenis MDA MB-231 untuk menguji potensi senyawa arilamida-4 dalam menghambat metastasis pada tingkat selular.
Ucapan Terima Kasih
Ucapan terima kasih disampaikan kepada Indonesia Toray Science Foundation (ITSF) 2017-2018 dan divisi Penelitian dan Pengembangan BEMF Farmasi USD 2017 atas dukungan dana selama penelitian.
17 DAFTAR PUSTAKA
Adegoke, O.A., 2011. Analytical, biochemical and synthetic applications of para-dimethylaminobenzaldehyde. International Journal of Pharmaceutical Sciences Review and Research, 11 (2), 17–29.
Adhipandito, C.F. 2017. Sintesis Analog Purin (FFUSD-001) dan Studi In Silico Terhadap Matrix Metalloproteinase-9 Hemopexin Domain sebagai Kandidat Anti-Kanker Payudara. Skripsi. Universitas Sanata Dharma.
Alford, V.M., Kamath, A., Ren, X., Kumar, K., Gan, Q., Awwa, M., et al. 2017. Targeting the Hemopexin-like Domain of Latent Matrix Metalloproteinase-9 (proMMP-9) with a Small Molecule Inhibitor Prevents the Formation of Focal Adhesion Junctions. ACS Chemical Biology. 12: 1 - 44.
Arifiyanto, A. 2001. Pengaruh Penambahan Basa Natrium Hidroksida dan Piridin dalam Sintesis Benzoilanilida. Skripsi. Universitas Sanata Dharma.
Cathcart, J., Pulkoski-gross, A., and Cao, J., 2015. Targeting matrix metalloproteinases in cancer : Bringing new life to old ideas. Genes & Diseases, 2 (1), 26–34.
Dufour, A., Sampson, N.S., Li, J., Kuscu, C., Rizzo, R.C., Deleon, J.L., Zhi, J., Jaber, N., Liu, E., Zucker, S., and Cao, J., 2011. Small-Molecule Anticancer Compounds Selectively Target the Hemopexin Domain of Matrix Metalloproteinase-9. Cancer Res, 71 (14), 4977–4988.
Fessenden, R.J., Fessenden, J.S., 1986. Kimia Organik Edisi Ketiga. Jakarta: Penerbit Erlangga.
Koltunov, K.Y., Sobolev, V.I., and Bondareva, V.M.B., 2016. Oxidation, oxidative esterification and ammoxidation of acrolein over metal oxides: Do these reactions include nucleophilic acyl substitution? Catalysis Today, 1–5.
Löffek, S., Schilling, O., and Franzke, C.W., 2011. Biological role of matrix metalloproteinases: A critical balance. European Respiratory Journal.
Ludji, D.P.K.S. 2017. Sintesis Analog Purin (FUSD-002) dan Studi In Silico Terhadap Matrix Metalloproteinase-9 Hemopexin Domain sebagai Kandidat Anti-Kanker Payudara. Skripsi. Universitas Sanata Dharma.
Merdad, A., Karim, S., Schulten, H., and Dallol, A., 2014. Expression of Matrix Metalloproteinases ( MMPs ) in Primary Human Breast Cancer : MMP-9 as a Potential Biomarker for Cancer Invasion and Metastasis, 1366, 1355–1366. Mohrig, J.R., Alberg, D.G., Schatz, P.F., Holfmeister, G.E., Schatz, P.F., and
Hammond, C.N., 2014. Laboratroy Techniques in Organic Chemistry: Supporting Inquiry- Driven Experiements.
Nicolotti, O., Catto, M., Giangreco, I., Barletta, M., Leonetti, F., Stefanachi, A., et al. 2012. Design, synthesis and biological evaluation of hydroxy, 5-substituted pyrimidine-2,4,6-triones as potent inhibitors of gelatinases MMP-2 and MMP-9. European Journal of Medicinal Chemistry. 58: 368 - 376. O'Neil, M.J., Smith, A., Heckelman, P.E., Obenchain Jr., J.R., Gallipeau, J.A.R., et
al., 2001. The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 13th Edition. MERC & CO., INC. 1406.
18
Pavia, D.L., Lampman, G.M., Kriz, G.S., and Vyvyan, J.R., 2015. Introduction to Spectroscopy Fifth Edition. Journal of Magnetic Resonance, Series A.
Sun, M., Dai, W., and Liu, D.Q., 2008. Fragmentation of Aromatic Sulfonamides in Electrospray Ionization Mass Spectrometry: Elimination of SO2 Via Rearrangement. Journal of Mass Spectrometry, 43, 383–393.
Triono, S., 2007. Konsultasi GC-MS. Wawancara oleh Maywan Hariono pada tahun 2007 di Fakultas MIPA Kimia Universitas Gadjah Mada.
Vandenbroucke, R.E. and Libert, C., 2014. Is there new hope for therapeutic matrix metalloproteinase inhibition ? Nature Publishing Group, (November).
Vollhardt, P. dan Schore, N. 2014. Organic Chemistry Structure and Function. 7th Edition. W. H. Freeman and Company. USA.
Yousef, E.M., Tahir, M.R., St-pierre, Y., and Gaboury, L.A., 2014. MMP-9 expression varies according to molecular subtypes of breast cancer, 1–12. Zhu, T., Cao, S., Su, P.C., Patel, R., Shah, D., Chokshi, H.B., Szukala, R., Johnson,
M.E., and Hevener, K.E., 2013. Hit identification and optimization in virtual screening: Practical recommendations based on a critical literature analysis.
19 LAMPIRAN
Lampiran 1. Produk reaksi berupa suatu semisolid yang berwarna kuning
20
Lampiran 3. Visualisasi produk hasil reaksi dengan DAB-HCl dibandingkan dengan sulfadiazin sebagai starting material
A merupakan visualisasi reaksi produk sintesis dengan DAB-HCl, sedangkan B merupakan visualisasi reaksi sulfadiazin sebagai starting material dengan
DAB-HCl.
Lampiran 4. Perhitungan Rf hasil uji KLT produk sintesis
“A” merupakan titik eluasi produk sintesis, “B’ merupakan titik eluasi piridin, dan “C” merupakan titik eluasi sulfadiazin.
Lampiran 5. Perhitungan bahan dan rendemen produk sintesis
Bahan
Sulfadiazin = mol sulfadiazin x Mr sulfadiazin
= 3,59 mmol x 250,278 g/mol
= 0,00359 mol x 250,278 g/mol
= 898,50 g
A
Nilai Rf A = 2,6
4,1
= 0,64
Nilai Rf B = 2,7
4,1
= 0,66
Nilai Rf C = 2,4
21
3-bromopropionil klorida = mol 3-bromopropionil klorida x Mr
= 5,39 mmol x 171,418 g/mol
Piridin = mol piridin x Mr piridin = 7,18 mmol x 79,1 g/mol
22 Lampiran 6. Perbesaran spektrum HA dan HB
A A B
23 Lampiran 7. Perbesaran spektrum HC dan HF
Lampiran 8. Perbesaran spektrum HE
E
C F
24 Lampiran 9. Perbesaran spektrum HD
Lampiran 10. Mekanisme pola fragmentasi m/z 65 dan m/z 319
25
Lampiran 12. Representasi tata letak 96-microwell plate uji aktivitas in vitro
B100 : Blanko 100 µL B44 : Blanko 44 µL B43 : Blanko 43 µL B45 : Blanko 45 µL
Sp1 : Sampel 1 µL (Senyawa Arilamida-4) In2 : NNGH Inhibitor 2 µL
E5 : Enzim MMP-9 5 µL Sb50: Substrat 50 µL
Lampiran 13. Perhitungan nilai IC50 arilamida-4
Sampel Reading 1 Reading 2 Reading 3 Purata Reading
Blanko (B) 9683 9349 9217 9416
Kontrol (-) 40684 41975 41625 41428
Konsentransi Sampel 50 µL 34283 24873 35011 31389
Konsentransi Sampel 100 µL 24457 20984 19579 21673
26
Konsentransi Sampel 300 µL 16795 15137 16261 16064
Sampel Purata
-Konsentransi Sampel 100 µg/mL 12257 38 62
Konsentransi Sampel 200 µg/mL 8308 26 74
Konsentransi Sampel 300 µg/mL 6648 21 79
Konsentrasi Sampel Log Konsentrasi (x) % Inhibisi (y)
27
Persamaan non linear yang didapatkan adalah y = -74,319x2+370,34 x – 382,93.
Untuk menghitung IC50, dimasukkan angka 50 sebagai y, dan nilai x dicari
28
𝑥 =
−
370,34(
± 91,94
−148,64
)
𝑥1 =
−
370,34+ 91,94
(−148,64)
𝑥2 =
−
370,34 −91,94
(−148,64)=
−
278,4(−148,64)
=
− 462,28
(−148,64)
𝑥1 = 1,87
𝑥2 = 3,11
Antilog X
1= 74,13
µg/mLAntilog X
2= 1288,25
µg/mL𝐾𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑋1 = 74,13 µg/mL
384 𝑔𝑚𝑜𝑙 𝑥 1000 𝑚𝐿
= 193 µM
𝐾𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑋2 = 1288,25 µg/mL
384 𝑔𝑚𝑜𝑙 𝑥 1000 𝑚𝐿
29
BIOGRAFI PENULIS
Penulis skripsi berjudul “Sintesis Arilamida-4 Dan Uji Aktivitas In Vitro Terhadap Matrix Metalloproteinase-9