R. Susanti
Diterbitkan olehVIRUS AVIAN INFLUENZA &
DINAMIKA MOLEKULERNYA
R. Susanti VIRUS A
VIAN INFLUENZ
A & DINAMIKA MOLEKULERNY
MONOGRAF
VIRUS AVIAN INFLUENZA dan
DINAMIKA MOLEKULERNYA
R. Susanti
Diterbitkan oleh:
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS NEGERI SEMARANG
VIRUS
AVIAN INFLUENZA
dan
DINAMIKA MOLEKULERNYA
Penulis : Dr. drh R. Susanti M.P
Penyunting : _________________
Desain sampul dan tata letak : Yoris Adi Maretta
ISBN : 978-602-18553-5-5
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip atau memperbanyak
sebagian atau seluruh isi monograf
KATA PENGANTAR
Puji syukur ke hadirat Allah swt atas anugerah-Nya
sehingga buku monograf berjudul “Virus Avian Influenza dan Dinamika Molekulernya” ini dapat terselesaikan. Monograf ini
berisi konsep, teori dan hasil penelitian tentang karakter virus
avian influenza subtipe H5N1 secara molekuler. Hasil-hasil
penelitian mencakup semua isolat virus avian influenza subtipe
H5N1 di dunia, namun paparan lebih rinci pada isolat di
Indonesia.
Virus avian influenza (VAI) adalah virus influenza tipe A
yang menyerang unggas dan menyebabkan penyakit “flu burung”. Virus ini termasuk famili Orthomyxoviridae. Virus influenza memiliki 8 segmen genom RNA berserat tunggal
(single-stranded RNA) berpolaritas negatif yang menyandi 11 protein. Virus ini merupakanpatogen intraseluler, sehingga untuk
dapat beradaptasi, bertahan hidup dan bereplikasi dalam tubuh
hospesnya, VAI mempunyai mekanisme untuk menghindar dari
respon imun hospes. Mekanisme untuk menghindar dari respon
hospes tersebut terjadi melalui fenomena yang disebut hanyutan
antigenik (antigenic drift). Hanyutan antigenik adalah
perubahan/mutasi secara periodik akibat mutasi genetik struktur
protein permukaan VAI sehingga antibodi yang telah terbentuk
oleh tubuh akibat vaksinasi atau infeksi alami sebelumnya tidak
dapat mengenali keberadaan virus tersebut.
Virus HPAI subtipe H5N1 dari Asia menunjukkan
karakteristik zoonotik paling tinggi dan dapat ditransmisikan dari
Tingginya tingkat kejadian dan kematian manusia dan unggas
akibat VIA subtipe H5N1 di Indonesia, bahkan penyebab
kematian manusia tertinggi di dunia, menarik dilakukan
karakterisasi molekuler gen-gen penyusunnya. Nukleotida
penyusun gen-gen VAI merupakan karakter dasar yang
menentukan karakter fenotip suatu virus. Karakter genotip secara
molekuler akan dapat mengungkap karakter zoonotik, transmisi,
resistensi terhadap obat dan patogenesitas virus berdasarkan
sekuen nukleotida dan asam amino genom-genom yang terlibat
pada proses tersebut
Buku monograf ini merupakan salah satu bahan ajar
untuk mata kuliah biokimia, imunologi, biologi molekuler,
taksonomi, virologi, mikrobiologi ataupun biologi umum. Monograf
ini juga dapat digunakan sebagai referensi bagi mahasiswa S1,
S2 dan S3, masyarakat umum maupun dinas terkait yang
berkecimpung dalam penelitian, pencegahan dan pengendalian
penyakit hewan khususnya “flu burung”. Tingginya kemanfaatan hasil-hasil penelitian tentang avian influenza bagi mahasiswa
maupun peneliti, mendorong diterbitkannya monograf ini. Buku
monograf ini berturut-turut berisi (1) Pendahuluan, (2) Biologi virus
avian influenza, (3) Teknik menumbuhkan dan mengisolasi virus
avian influenza, (4) Teknik identifikasi virus avian influenza dan
subtipenya, (5) Teknik analisa molekuler nukleotida penyusun
gen-gen virus avian influenza, (6) Dinamika molekuler virus avian
influenza subtipe H5N1 di Indonesia, (7) Epidemiologi virus avian
Penulis mengucapkan terima kasih kepada Dra. Retno
Sri Iswari, SU yang telah menyunting monograf ini. Pada
kesempatan ini penulis menyampaikan ucapan terima kasih
kepada mahasiswa yang terlibat dalam penelitian virus avian
influenza, serta semua teman-teman yang telah memotivasi
penulis untuk menyelesaikan monograf ini. Semoga karya buku
monograf ini bermanfaat bagi dunia pendidikan dan penelitian di
Indonesia. Kritik dan saran demi kesempurnaan monograf ini
sangat penulis harapkan.
Semarang, Agustus 2013
DAFTAR ISI
BAB III TEKNIK MENUMBUHKAN DAN MENGISOLASI VIRUS AVIAN INFLUENZA 29 Preparasi Sampel...………... 31
Media Perbanyakan virus ...……….………... 31
Metode Propagasi Virus pada Telur Ayam Berembrio SPF 34 BAB IV TEKNIK IDENTIFIKASI VIRUS AVIAN INFLUENZA DAN SUBTIPENYA 39 Uji Hemaglutinasi (HA)..………... 39
Metode Uji Hemaglutinasi (HA)………... 41
Uji Agar Gel Immunodiffusion (AGID) Test ……..……... 42
Metode uji AGPT….………... 44
Identifikasi subtipe virus avian influenza secara molekuler 46 Metode Isolasi RNA Virus .………... 47
Metode RT-PCR……..,.………... 52
Elektroforesis ……….………... 54
Metode Elektroforesis Hasil RT-PCR pada Gel Agarose 56
PENYUSUN GEN-GEN VIRUS AVIAN INFLUENZA
Contoh Metode Amplifikasi Gen HA Dengan Primer
Spesifik 60
Purifikasi produk PCR………..……... 61
Sekuensing………..………... 62
Metode analisis nukleotida dengan program MEGA 3.1 62 BAB VI DINAMIKA MOLEKULER VIRUS AI SUBTIPE H5N1 DI INDONESIA 72 Gen Hemaglutnin (HA) ....………... 73
Gen Non Struktural-1 (NS1) ...………... 96
Gen Polymerase Basic 1 (PB1) ...………... 102
Gen Polymerase Basic 2 (PB2) ... 108
Gen Neuraminidase (NA) ….………. 112
BAB VII EPIDEMIOLOGI VIRUS AVIAN INVLUENZA DAN PERAN UNGGAS AIR 118 Epidemiologi Virus Avian Influenza…………... 118
Telaah Virus Avian Influenza di Indonesia …….……... 121
Peran unggas air pada penyebaran virus avian influenza… 123
Cara Perlindungan dan Pencegahan Infeksi Virus Avian Influenza 128 BAB VIII PENUTUP ………. 132
DAFTAR PUSTAKA ……… 141
GLOSARIUM………. ……… 169
INDEKS ………. ……… 174
DAFTAR TABEL
Halaman
Tabel 1 Segmen genom virus influenza A serta fungsi protein
yang disandinya ... 12
Tabel 2 Level laboratorium untuk penelitian yang berhubungan
dengan mikroorganisme penyebab penyakit... 29
Tabel 3 Sekuen basa primer untuk mengamplifikasi gen H5, H1
dan ND serta besaran produk PCR yang
diharapkan……… 53
Tabel 4 Sekuen nukleotida primer untuk mengamplifikasi gen
HA ... 59
Tabel 5 Variasi antigenik site dari gen HA virus AI subtipe
H5N1 asal hewan dan manusia di Indonesia …... 76
Tabel 6 Variasi daerah antigenik dari gen HA virus AI subtipe
H5N1 asal hewan dan manusia di Indonesia ... 79
Tabel 7 Variasi residu pengikat reseptor dari gen HA virus AI
subtipe H5N1 asal hewan dan manusia di Indonesia… 80
Tabel 8 Variasi peptida fusi dari gen HA virus AI subtipe H5N1 asal hewan dan manusia di Indonesia ... 86
Tabel 9 Variasi sekuen daerah pemotongan virus avian
influenza H5N1 di Indonesia dari tahun 2003-2010 …. 88
Tabel 10 Variasi posisi glikosilasi dari gen HA virus AI subtipe
H5N1 asal hewan dan manusia di Indonesia ... 92
Tabel 11 Variasi peptida fusi dari gen HA virus AI subtipe H5N1
asal hewan dan manusia di Indonesia ... 100
Tabel 12 Variasi dari gen PB1 dan PB1-F2 virus AI subtipe
Tabel 13 Variasi dari gen PB2 virus AI subtipe H5N1 asal hewan dan manusia di Indonesia ... 109
Tabel 14 Variasi dari posisi glikosilasi gen NA virus AI subtipe
H5N1 asal hewan dan manusia di Indonesia ... 113
Tabel 15 Variasi dari oseltamifir binding pocket gen NA virus AI
DAFTAR GAMBAR
Halaman
Gambar 1 Bentuk pleiomorfik virus influenza ... 9
Gambar 2 Struktur dan segmen-segmen genom virus influenza A ……….…… 14 Gambar 3 Siklus replikasi virus influenza …... 15
Gambar 4 Pertumbuhan virus avian influenza subtipe H5N1 pada TAB ……….. 36 Gambar 5 Antigen virus virus HPAI H5N1 isolat unggas air pada organ-organ embrio……….. 38 Gambar 6 Hemaglutinasi sel darah merah oleh virus yang mampu mengaglutinasi ……… 40 Gambar 7 Gambaran contoh hasil uji HA ...……... 42
Gambar 8 Pembentukan presipitasi pada uji AGPT ... 43
Gambar 9 Interpretasi hasil AGPT...…...………... 44
Gambar 10 Contoh hasil AGPT …………... 46
Gambar 11 Elektroforegram RT-PCR gen H5 ………... 57
Gambar 12 Elektroforegram RT-PCR gen N1………... 57
Gambar 13 Elektroforegram RT-PCR ………..……. 58
Gambar 14 Tampilan program MEGA pada persiapan alignment ……… 64 Gambar 15 Tampilan prosedur alignment………... 66
Gambar 17 Proses penyimpanan data alignment ke word……... 70
Gambar 18 Pembuatan pohon filogeni dan jarak genetik…….... 71
Gambar 19 Pohon filogenetik 1695 basa gen HA virus AI H5N1 96
Gambar 20 Pohon filogenetik 690 basa gen NS virus AI H5N1.. 101
Gambar 21 Pohon filogenetik 2268 basa gen PB1 virus AI
H5N1 ………
107
Gambar 22 Pohon filogenetik 2200 basa gen PB2 virus AI
H5N1 ………
111
BAB I
PENDAHULUAN
Influenza (atau biasa disingkat menjadi flu) bukan penyakit
yang asing lagi bagi masyarakat dunia, termasuk Indonesia.
Influenza banyak dan sering menyerang manusia dan hewan.
Avian Influenza (AI) atau dikenal juga dengan “flu burung” adalah
penyakit flu pada unggas yang sangat menular, disebabkan oleh
virus influenza tipe A, termasuk famili Orthomyxoviridae (Lamb &
Krug 2001). Virus influenza yang menyerang unggas dan
menyebabkan penyakit “flu burung” disebut Virus Avian Influenza
(VAI).
Virus influenza memiliki 8 segmen genom RNA
(ribonucleic acid) serat tunggal (single-stranded RNA) berpolaritas negatif yang menyandi 11 protein. Kedelapan
segmen RNA bersama-sama dengan nukleoprotein (NP)
membentuk ribonukleoprotein (RNP) (Bui et al. 2000; Elton et al.
2001; Munch et al. 2001). Kedelapan segmen genom RNA dari VAI, segmen genom ke-7 yaitu matriks (M) dianggab paling
stabil/conserve dibandingkan 7 genom lainnya. Sementara genom
yang paling tinggi tingkat mutasinya adalah genom HA
(hemaglutinin). Hasil penelitian Susanti et al. (2008a)
menunjukkan bahwa domain asam amino daerah antigenik, posisi
glikosilasi dan kantong pengikat reseptor pada gen HA virus AI
isolat unggas air di Jawa Barat menunjukkan adanya
mekanisme zoonotik, transmisi dan virulensi/patogenesitas VAI
adalah segmen genom polymerase basic 2 (PB2), PB1,
hemaglutinin (HA), neuraminidase (NA), dan non-struktural 1
(NS1).
Sebagai patogen intraseluler, VAI mempunyai mekanisme
untuk menghindar dari respon imun hospes sehingga virus dapat
bertahan hidup dan bereplikasi dalam tubuh hospes. Peningkatan
kemampuan virus untuk menghindari sistem imun hospes, secara
langsung berkorelasi dengan peningkatan patogenesitas virus.
VAI mempunyai berbagai mekanisme untuk menghindar dari
respon imun bawaan dan adaptif hospes (Coleman 2007).
Virus AI mempunyai kemampuan untuk menghindar dari
respon humoral hospes melalui fenomena yang disebut hanyutan
antigenik (antigenic drift). Mutasi yang mengarahkan pada fenomena ini adalah perubahan asam amino glikoprotein
permukaan hemaglutinin (HA) (Plotkin & Dushoff 2003). Hanyutan
antigenik adalah perubahan secara periodik akibat mutasi genetik
struktur protein permukaan VAI sehingga antibodi yang telah
terbentuk oleh tubuh akibat vaksinasi sebelumnya tidak dapat
mengenali keberadaan virus tersebut (Munch et al. 2001). Konsep hanyutan antigenik ini menuntut produksi vaksin selalu
diperbaharui. Ancaman yang lebih besar dari penghindaran
respon imun bawaan dan perolehan adalah kemampuan virus
untuk reasorsi melalui fenomena yang disebut lompatan antigenik
(antigenic shift) (Coleman 2007).
Virus AI dengan kepemilikan mekanisme untuk
merupakan salah satu faktor meluasnya wabah virus ini. Wabah
VAI subtipe H5N1 patogenik tinggi (highly pathogenic avian influenza; HPAI) pertama kali dilaporkan di Cina Selatan tahun 1996-1997, kemudian menyebar dan menyebabkan kematian
unggas di Vietnam, Thailand, Indonesia dan Negara Asia Timur
sejak awal tahun 2004 (Smith et al. 2006). Wabah virus HPAI subtipe H5N1 pada unggas di Indonesia muncul pertama kali
pada bulan Agustus 2003 di beberapa peternakan ayam ras
komersial di Jawa Barat dan Jawa Tengah, namun secara resmi
baru dilaporkan pada Januari 2004. Kasus ini kemudian meluas
ke berbagai daerah di Jawa Tengah, Jawa Barat, Jawa Timur,
DIY, Lampung, Bali serta beberapa daerah di Sumatera dan
Kalimantan. Berdasarkan laporan Direktorat Jenderal Peternakan
dan Kesehatan Hewan (2012), sejak dideklarasikan Januari 2004,
jumlah kasus infeksi VAI secara bertahap menurun setiap
tahunnya, yakni 1411 kasus pada tahun 2011. Jumlah tersebut
lebih rendah dibanding tahun sebelumnya yaitu 1502 (tahun
2010), 2293 (tahun 2009), 1413 (tahun 2008), 2751 (tahun 2007)
dan 612 (tahun 2006).
Berdasarkan kajian epidemiologi molekuler, Pulau Jawa
merupakan pusat penyebaran (epicenter) VAI subtipe H5N1 di
Indonesia. Virus-virus H5N1 ini diintroduksi dari pulau Jawa ke
pulau-pulau di sekitarnya melalui jalur perdagangan unggas.
Sampai saat ini, avian influenza dinyatakan endemis di 32 dari 33
propinsi di Indonesia. Infeksi VAI subtipe H5N1 pada manusia
mulai terjadi pada Juli 2005. Infeksi VAI H5N1 pada manusia
(Kandun et al. 2006; Sedyaningsih et al. 2007). Kasus infeksi VAI H5N1 pada klaster famili kemungkinan dipengaruhi oleh faktor
genetik, tingkah laku, imunologik, dan lingkungan (Kandun et al. 2006). Semua kasus infeksi VAI H5N1 di Indonesia merupakan
VAI H5N1 clade 2 subclade 1 (Kandun et al. 2006; Sedyaningsih
et al. 2007).
Virus HPAI subtipe H5N1 dari Asia menunjukkan
karakteristik zoonotik paling tinggi dan dapat ditransmisikan dari
unggas ke berbagai spesies mamalia termasuk manusia (Kalthoff
et al. 2010). Sampai tanggal 10 Agustus 2012, jumlah kasus dan kematian akibat VAI H5N1 pada manusia Indonesia tercatat
paling tinggi di dunia dengan jumlah kematian 159 orang dari 191
orang positif terinfeksi. Data kejadian dan kematian di seluruh
dunia adalah 359 kematian dari 608 kejadian (WHO 2012).
Kematian manusia paling banyak terjadi di Propinsi DKI Jakarta,
Jawa Barat dan Banten. Semakin banyaknya kasus transmisi
zoonotik ke manusia, semakin meningkatkan potensi terjadinya
pandemi (Smith et al. 2006).
Virus AI subtipe H5N1 diperkirakan akan selalu bermutasi
sehingga berpotensi meningkatkan kapasitas untuk melompati
barier spesies, dan dapat menular secara mudah antar manusia.
Penularan VAI H5N1 antar manusia merupakan awal terjadinya
pandemik secara global. Nampaknya, semua fragmen gen VAI
H5N1 secara bersama-sama menentukan apakah suatu
strain/galur dapat menginfeksi manusia atau mamalia. Tingginya
tingkat kejadian dan kematian manusia dan unggas akibat flu
penyebab kematian manusia tertinggi di dunia, menarik untuk
dikaji dinamika molekuler VAI asal manusia dan hewan di
Indonesia. Hal ini menjadi sangat penting dilakukan sebagai
dasar penentuan pengobatan, pengendalian dan pencegahan
penyebaran virus ini. Karakterisasi genotip merupakan karakter
dasar yang menentukan karakter fenotip suatu virus. Karakter
fenotip selain ditentukan karakter genotip, juga dipengaruhi oleh
lingkungan dan respon hospes yang diinfeksi. Karakter genotip
secara molekuler akan dapat mengungkap karakter zoonotik,
transmisi, resistensi terhadap obat dan patogenesitas virus
berdasarkan sekuen nukleotida dan asam amino genom-genom
yang terlibat pada proses tersebut.
Rumusan Masalah
Virus HPAI H5N1 dari Asia menunjukkan karakteristik
zoonotik paling tinggi dan dapat ditransmisikan dari unggas ke
berbagai spesies mamalia termasuk manusia. Jumlah kasus dan
kematian akibat VAI subtipe H5N1 pada manusia tercatat paling
tinggi di dunia dengan jumlah kematian 152 orang dari 184 orang
positif terinfeksi. Semakin banyaknya kasus transmisi zoonotik ke
manusia, semakin meningkatkan potensi terjadinya pandemi.
Sebagai patogen intraseluler, VAI mempunyai mekanisme untuk
menghindar dari respon imun hospes sehingga virus dapat
bertahan hidup dan bereplikasi dalam tubuh hospes. Peningkatan
kemampuan virus untuk menghindari sistem imun hospes, secara
langsung berkorelasi dengan peningkatan patogenesitas virus.
respon imun bawaan dan adaptif hospes. Tingginya tingkat
kejadian dan kematian manusia dan unggas akibat virus flu
burung (VIA) subtipe H5N1 di Indonesia, bahkan penyebab
kematian manusia tertinggi di dunia, perlu dilakukan kajian
dinamika molekuler melalui karakter gen-gen penyusun VAI asal
manusia dan hewan di Indonesia. Hal ini menjadi sangat penting
dilakukan sebagai dasar penentuan pengobatan, pengendalian
dan pencegahan penyebaran virus ini. Karakterisasi genotip
merupakan karakter dasar yang menentukan karakter fenotip
suatu virus. Karakter fenotip selain ditentukan karakter genotip,
juga dipengaruhi oleh lingkungan dan respon hospes yang
diinfeksi. Karakter genotip secara molekuler akan dapat
mengungkap karakter zoonotik, transmisi, resistensi terhadap
obat dan patogenesitas virus berdasarkan sekuen nukleotida dan
asam amino genom-genom yang terlibat pada proses tersebut.
Berdasarkan hal-hal tersebut, permasalahan yang
dipecahkan/dikaji dalam buku ini adalah :
1. Bagaimana menumbuhkan dan mengisolasi virus AI ?
2. Bagaimana mengidentifikasi Virus Influenza?
3. Bagaimana mengkarakterisasi virus avian influenza
secara molekuler?
4. Bagaimana dinamika molekuler gen-gen virus AI subtipe
H5N1 di Indonesia ?
Tujuan Penulisan buku
Penulisan buku ini bertujuan untuk menyebarluaskan teori,
fenotip dan molekulernya. Tulisan ini diharapkan bermanfaat
sebagai (a) bahan pengayaan mata kuliah biokimia, imunologi,
biologi molekuler, taksonomi, virologi, mikrobiologi ataupun
biologi umum (b) dasar pertimbangan berbagai pihak dalam
penelitian virus AI secara molekuler dan (c) dasar pengambil
kebijakan dalam pencegahan, pengobatan dan pengendalian
virus avian influenza (VAI) di Indonesia.
Metode Pemecahan Masalah
Permasalahan tersebut dapat dipecahkan dengan
melakukan kajian pustaka dan hasil-hasil penelitian tentang
biologi virus AI, prinsip dasar isolasi dan identifikasi virus
influenza khususnya subtipe H5N1, prinsip dasar teknik
karakterisasi molekuler virus influenza,khususnya subtipe H5N1,
dan dinamika molekuler virus AI di Indonesia. Dalam tulisan ini
dibahas kajian teoritis dan hasil penelitian tentang :
1. Biologi Virus Avian Influenza (struktur, morfologi,
klasifikasi, siklus hidup)
2. Teknik menumbuhkan dan mengisolasi virus AI
3. Teknik mengidentifikasi Virus Avian Influenza
4. Teknik analisis gen-gen Virus Avian Influenza secara
molekuler
5. Dinamika molekuler gen-gen Virus Avian Influenza subtipe
H5N1 di Indonesia
6. Epidemiologi Virus Avian Influenza dan peran unggas air
BAB II
BIOLOGI VIRUS AVIAN INFLUENZA
Virus bukan merupakan sel utuh dan tidak dapat
bereproduksi sendiri. Untuk dapat bereproduksi atau
memperbanyak diri, virus harus menyerang sel hidup dan
menggunakan sumber daya sel tersebut untuk memperbanyak
diri. Pada dasarnya, virus hanya merupakan material genetik
yang dibungkus kantong protein, sehingga virus tidak dapat
dikatakan “hidup”. Meskipun demikian, karena mampu
memperbanyak diri dan memiliki material genetik maka sebagian
ilmuwan sepakat virus merupakan makhluk hidup. Berdasarkan
material genetik yang dimiliki virus, ada 2 jenis virus yaitu virus
yang memiliki ribonucleic acid (RNA) atau deoxyribonucleic acid
(DNA).
Morfologi
Bentuk dan ukuran virus influenza bersifat pleiomorfik
(bentuk dan ukuran berubah-ubah), berbentuk filamen atau
sferoid (bola) dengan diameter 80-120 nm (Harris et al. 2006) (Gambar 1). Virus yang ditumbuhkan secara in vitro, karena pertumbuhannya yang cepat, sehingga lebih banyak
berbentuk sferoid dengan diameter dan panjang yang
konstan (review oleh Whittaker 2001). Virus yang diisolasi dari infeksi alami biasanya berbentuk filamen dengan diameter
konstan 100-150nm tetapi panjangnya bervariasi. Virus
dengan glikoprotein integral yang menjulur keluar
membentuk duri (spike) di permukaan virion (Harris et al. 2006). Virus yang berbentuk filamen lebih infektif dan lebih
banyak mengandung RNA dibanding virus berbentuk sferoid
(Roberts & Compans 1998).
Gambar 1. Bentuk pleiomorfik virus influenza (A) bentuk filamen (Robert & Compans 1998) (B) sferoid
(Whittaker 2001)
Klasifikasi
Virus influenza adalah virus anggota famili
Orthomyxoviridae (ICTV 2006). Virus ini dibagi menjadi influenza tipe A, B dan C berdasarkan perbedaan antigenik
pada nukleoprotein (NP) dan matriks (M) (Payungporn et al. 2004). Namun, dari ketiga tipe tersebut hanya tipe A yang
berpotensi menimbulkan pandemik (Liu 2005). Influenza A dan B
memiliki kemiripan biologis, antigenik, genetik dan struktur,
namun cakupan hospes (host range), pola strategi dan evolusi kode genetiknya bervariasi (Lamb & Krug 1996; Murphy &
Webster 1996). Influenza A dapat menginfeksi berbagai hewan
B
dan manusia, serta dibagi menjadi beberapa subtipe antigenik.
Influenza B hanya menginfeksi manusia dan tidak ditemukan
menginfeksi hewan secara alamiah, serta tidak dibagi menjadi
subtipe-subtipe antigenik. Virus Influenza B hanya bersirkulasi
pada manusia, dan biasanya tidak menyebabkan penyakit
sesakit akibat Influenza A. Analisis evolusi gen HA influenza B
memiliki karakteristik membentuk 2 jenis antigenik yang berbeda,
yaitu B/Yamagata/16/88-like dan B/Victoria/2/87-like (Kanegae et al. 1990; Rota et al. 1990; Rota et al. 1992; Nerome et al. 1998; Lindstrom et al. 1999).
Di dalam virion influenza tipe A dan B terdapat 8
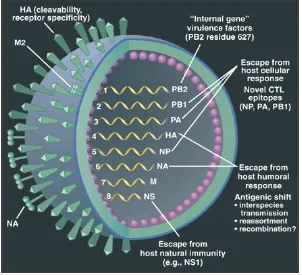
segmen genom RNA serat tunggal (single-stranded RNA) berpolaritas negatif yang menyandi 11 protein (Tabel 1).
Delapan segmen tersebut adalah PB1 (PB1 dan PB1-F2), PB2,
PA, HA, NP, NA, M (M1 dan M2), dan NS (NS1 dan NS2)
(Horimoto & Kawaoko 2001; Whittaker 2001). Kedelapan segmen
RNA bersama-sama dengan nukleoprotein (NP) membentuk
ribonukleoprotein (RNP) (Bui et al. 2000; Elton et al. 2001; Munch
et al. 2001). RNP dikelilingi oleh protein matriks M1. Pada permukaan amplop virus terdapat glikoprotein HA dan NA serta
kanal ion (ion channel) M2 (Elton et al. 2001). Hemaglutinin (HA) virus disandi dalam segmen ke-4 dan neuraminidase (NA) dalam
segmen ke-6. Segmen yang lain menyandi protein internal virus
dan protein lain yang penting untuk viabilitas virus seperti
misalnya segmen 8 yang menyandi NS1 yaitu suatu protein
nonstruktural yang berfungsi dalam melakukan hambatan
yang dimiliki oleh virus ini antara lain nukleoprotein (NP) yang
menjadi protein struktural utama, protein membran/matriks (M1
dan M2), protein polimerase (PA, PB1, dan PB2), dan protein
nonstruktural (NS1 dan NS2) (Yuen et al. 1998; Chan 2002; Guan
et al. 2002; Peiris et al. 2004). Glikoprotein HA membentuk
tonjolan (spike) pada permukaan virion, berfungsi sebagai media
untuk berikatan dengan reseptor pada sel inang dan memasuki
sel inang kemudian terjadi fusi dengan membran sel inang.
Protein NA membentuk struktur pada permukaan partikel virus
dan mengkatalisis pembebasannya dari sel yang terinfeksi,
sehingga virus dapat menyebar (WHO 2005a).
Struktur dan segmen-segmen genom virus influenza A
terlihat pada Gambar 2. Virus influenza tipe C mempunyai 7
segmen genom RNA, karena hanya mempunyai satu jenis
glikoprotein permukaan yaitu hemagglutinin esterase fusion
(HEF). HEF berfungsi sebagai pengikat reseptor (H), fusi
membran (F) dan esterase (E) (review oleh Whittaker 2001). Virus influenza tipe A secara natural dapat menginfeksi
unggas dan manusia (Khawaja et al. 2005). Virus ini dibagi ke dalam berbagai subtipe berdasarkan analisis serologis dan
genetis glikoprotein hemaglutinin (HA) dan neuraminidase (NA)
(Lee et al. 2001). Sampai saat ini ada 16 subtipe HA (H1-H16) dan 9 subtipe NA (N1-N9) (Russell & Webster 2005). Subtipe H16
baru ditemukan tahun 2004, pertama kali diisolasi dan
diidentifikasi pada burung camar laut kepala hitam (Fouchier et al. 2005). Semua subtipe HA dan NA ditemukan pada unggas air,
ditemukan pada manusia (Hoffman et al. 2001). Subtipe H5 dan H7 yang sangat virulen pada unggas (Lee et al. 2001; Khawaja et al. 2005) dilaporkan berpotensi sebagai penyebab pandemi (Russell & Webster 2005).
Semua strain virus influenza diberi nama sesuai
nomenklatur standar, berturut-turut tersusun dari tipe virus
influenza/spesies hewan (jika bukan manusia)/wilayah
isolasi/urutan nomor isolasi laboratorium/tahun isolasi (subtipe)
(WHO 2002). Misalnya Influenza A/goose/Guangdong/1/1996
(H5N1), artinya virus ini termasuk tipe virus influenza A, diisolai
dari angsa di Guangdong dengan nomor isolat 1, diisolasi tahun
1996, virus termasuk subtipe H5N1. Jika virus diisolasi dari
manusia, tidak perlu disebutkan spesiesnya. Contohnya Influenza
A/Indonesia/2A/2005 (H5N1), artinya virus ini termasuk tipe virus
influenza A, diisolai dari manusia di Guangdong dengan nomor
isolat 2A, diisolasi tahun 2005, virus termasuk subtipe H5N1.
(clearance) virus
Meningkatkan terjadinya infeksi sekunder oleh bakteri
3/PA Polimerase Asam Perakitan kompleks RdRp
Endonuklease Replikasi
Menghambat respon imun seluler
4/HA Hemaglutinin Attchment (penempelan virus
pada sel hospes)
Fusi dengan membran endosom Target netralisasi antibodi
5/NP Nukleoprotein Tanda isyarat (signal) impor
vRNP
Menghambat respon imun seluler
6/NA Neuraminidase Memotong ujung asam sialat dari
reseptor sel hospes sehingga progeni virion lepas dari sel Target netralisasi antibodi
7/M Matriks 1 (M1) Perakitan (assembly) progeni
virus
Matriks 2 (M2) Tanda isyarat transpor ke
permukaan sel Kanal ion
8/NS Nonstruktural 1
(NS1)
Siklus Hidup
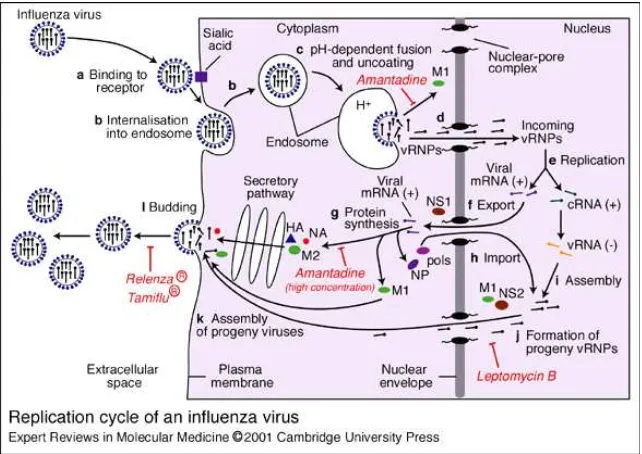
Siklus replikasi virus influenza A mempunyai keunikan
karena semua sintesis mRNA dan replikasi genom terjadi di
dalam nukleus sel hospes yang terinfeksi. Proses replikasi virus
sangat cepat, sekitar 10 jam/siklus (Coleman 2007). Infeksi virus
influenza diawali dengan masuknya virus ke dalam sel hospes
(entry), diikuti transkripsi, translasi, perakitan dan budding virion-virion baru keluar sel hospes (Gambar 3).
Gambar 3. Siklus replikasi virus influenza (Whittaker 2001)
Virus influenza masuk sel hospes melalui endositosis yang
diperantarai reseptor (receptor–mediated endositosis) (Elton et al. 2001). Ikatan pada reseptor merupakan determinan awal
patogenesitas, dan spesifisitas ikatan reseptor menentukan
tropisme suatu virus pada spesies hospes tertentu. Residu asam
amino bagian dari HA yang berikatan dengan reseptor adalah
asam amino nomor 222 dan 224 (penomoran menurut H5).
Glikoprotein HA virus influenza strain manusia yang mempunyai
asam amino leusin pada posisi 222 dan serin pada 224 dapat
berikatan dengan asam sialat α-2,6NeuAcGal. Sementara HA virus influenza strain unggas yang mempunyai asam amino
dengan asam sialat α-2,3NeuAcGal (Vines et al. 1998; Zhou et al.
1999; Suzuki et al. 2000; Leung 2007).
Setelah interaksi virus dengan reseptor pada permukaan
sel, terjadi internalisasi virus secara cepat melalui endositosis
(Bui et al. 1996). Rendahnya pH dalam endosom (5,5) memacu terjadinya pelepasan mantel (uncoating) virus. Kondisi asam itu juga menyebabkan perubahan konformasi HA sehingga regio
peptida fusi HA dapat disisipkan ke membran endosom dan
terjadi fusi antara membran endosom dengan membran virus.
Proses fusi hanya dapat terjadi jika HA dipotong menjadi HA1 dan
HA2 oleh protease sel hospes (Steinhauer 1999).
Rendahnya pH endosom juga menyebabkan aliran ion ke
bagian interior virus melalui protein M2 dan memutus interaksi
M1-vRNP (Pinto et al. 1992; Bui et al. 1996). Pelepasan mantel virus menyebabkan vRNP dan M1 masing-masing lepas ke
sitoplasma dan menuju nukleus melewati nuclear core protein
(NCP) (Bui et al. 1996). Impor vRNP melalui NCP diperantarai oleh nuclear localization signal (NLS) 1 dan 2 pada protein NP (Cros et al. 2005; Ozawa et al. 2007; Wu et al. 2007). Sementara, impor protein M1 ke dalam nukleus terjadi secara difusi pasif (Bui
et al. 1996). Amantadin dan rimantadin yang banyak dipakai sebagai antivirus bekerja dengan menghambat aktivitas M2 untuk
memutus interaksi M1-vRNP sehingga materi genetika virus tidak
dapat masuk nukleus (Hayden 2006)
Transkripsi dan replikasi genom RNA virus (vRNA) influenza
dilakukan di dalam nukleus sel hospes, dikatalisis oleh enzim
Crow et al. 2004; Hara et al. 2006). Genom vRNA membentuk kompleks dengan RdRp dan NP membentuk vRNP sebagai
cetakan transkripsi (membentuk mRNA) dan cetakan replikasi
(membentuk genom vRNA dari cRNA) (Vreede et al. 2004). Sintesis mRNA virus diawali dengan penambahan fragmen
tudung pada ujung „5 mRNA sebagai primer inisiasi transkripsi.
Fragmen tudung (7mGppp dan 10-13 nukleotida setelah tudung)
dari pre-mRNA sel hospes dipotong oleh enzim PB1 kemudian
dikenal dan diikat oleh enzim PB2. Proses perampasan tudung
dari pre-mRNA seluler tersebut disebut dengan cap snatching
(Rao et al. 2003; Crow et al. 2004; Hara et al. 2006). Setelah
penambahan tudung, pemanjangan (elongasi) rantai mRNA
berjalan sampai pada sekuen kaya uridin yang terletak 15-22
nukleotida sebelum ujung 3‟ mRNA. Pemanjangan mRNA virus ini dikatalisis oleh enzim PB1. Seperti juga mRNA eukariot, mRNA
virus yang baru disintesis juga mengalami poliadenilasi pada
ujung 3‟, dikatalisis oleh RdRp (Honda et al. 2002).
mRNA virus tetap terlindung dari degradasi selama
kompleks RdRp terikat pada sekuen spesifik
5‟AGCAAAAGCAGG‟3 yang ditemukan pada semua mRNA virus. Sekuen ini komplementer dengan 12 nukleotida ujung 3‟ dari
genom vRNA. Semua segmen genom virus influenza mempunyai
12 nukleotida pada ujung „3 dan 13 nukleotida pada ujung „5 yang
bersifat stabil (Bae et al. 2001; Crow et al. 2004). Primer untuk mengamplifikasi secara lengkap semua genom virus didisain
Replikasi genom vRNA tidak memerlukan primer dan
dibentuk dari cetakan cRNA. Pada tahap I replikasi, vRNA dikopi
menjadi cRNA berpolaritas positif. Inisiasi pembentukan cRNA
tidak memerlukan tudung 7mGppp (Crow et al. 2004; Vreede et al. 2004; Hara et al. 2006). Tahap II replikasi adalah sintesis vRNA berpolaritas negatif dengan cRNA sebagai cetakannya
(Hara et al. 2006). Seluruh serat cRNA disebut anti genom karena merupakan cetakan untuk sintesis vRNA. RdRp yang
mengkatalisis replikasi genom, tidak mempunyai mekanisme
untuk memperbaiki kesalahan (proofreading) sehingga tingkat kesalahan mencapai 1 dari 104 nukleotida per siklus replikasi (review oleh Webster et al. 1992).
Pembentukan cRNA tidak memerlukan tudung 7mGppp.
Perubahan fungsi katalitik polimerase dari transkripsi mRNA ke
replikasi cRNA diperantarai oleh protein NP yang berikatan
langsung dengan PB1 dan PB2 (Portela & Digard 2002).
Perubahan fungsi katalitik polimerase PB1 memerlukan
perubahan strukter sekunder polimerase, karena regio ikatan
cRNA berbeda dengan regio ikatan mRNA (Gonzales & Ortin
1999). Berbeda dengan mRNA, 2 bentuk RNA lainnya (yaitu
cRNA dan vRNA) dibungkus (encapsidated) oleh protein NP membentuk vRNP (Portela & Digard 2002).
Translasi (sintesis protein) dari mRNA virus influenza
seluruhnya menggunakan mekanisme translasi dalam sitoplasma
sel hospes. Protein PA, PB1, PB2 dan NP hasil translasi
selanjutnya masuk ke nukleus untuk mengkatalisis transkripsi dan
membentuk vRNP (Klumpp et al. 1997). vRNP diekspor ke sitoplasma melalui pembentukan kompleks NEP-M1-RNP, dan
berinteraksi dengan reseptor ekspor nuklear sel hospes
(superfamili importin-β) yang bersifat stabil (Cullen 2000;
Neumann et al. 2000; Sandri-Goldin 2004). Ekspor vRNP virus influenza dihambat oleh antibiotik leptomisin B yang berikatan
dengan CRM-1 (Elton et al. 2001).
Fragmen gen virus influenza A ada yang menyandi satu
protein (PB1, PB2, PA, NA, HA, NP) ada yang lebih dari satu
protein (gen NS dan M). Splicing mRNA dari gen NS menjadi mRNA NS1 dan mRNA NS2 (berturut-turut menyandi protein NS1
dan NS2) dilakukan di nukleus sel hospes menggunakan
mekanisme splicing pre-mRNA sel hospes. Splicing yang sama juga dilakukan terhadap mRNA gen M menjadi mRNA M1 dan
mRNA M2 (Whittaker 2001).
Sebagai target protein transmembran, protein HA, NA dan
M2 mengalami modifikasi pascatranslasi, berupa glikosilasi dan
pelipatan, selama melintasi retikulum endoplasma dan aparatus
Golgi (Gomez-Puertas et al. 2000). Sebagian molekul M1
berikatan dengan vRNP dan sebagian lagi membentuk selubung
di bawah amplop virus. Glikoprotein HA pada transmembran
menstimulasi M1 untuk berikatan/menempel pada membran.
Interaksi antara ekor transmembran HA dengan M1 merupakan
membran sel yang kaya dengan detergent-insoluble glikolipid
(DIG) atau disebut lipid raft (Zhang et al. 2000).
Perakitan virion diikuti dengan budding, yaitu pembentukan dan penutupan kuncup vRNP yang dikelilingi amplop pada
membran sel hospes sehingga virion terlepas ke ekstrasel tanpa
merusak membran sel (review oleh Garoff et al. 1998; Chazal & Gerlier 2003). Budding dapat terjadi melalui permukaan apikal atau basolateral sel epitel. Jika budding terjadi pada permukaan membran basolateral epitel, virus akan menyebar secara sistemik
(Whittaker 2001).
Progeni virus dilepaskan ke ekstrasel jika NA memotong
asam sialat dari reseptor sel hospes, sehingga progeni virus yang
baru dilepaskan tidak berikatan kembali dengan reseptornya
(Stray et al. 2000; Mishin et al. 2005). Peningkatan afinitas HA pada reseptor asam sialat dapat meningkatkan patogenesitas
infeksi, namun di sisi lain dapat menghambat aktivitas NA pada
proses budding. Pelepasan virus dan penyebarannya
memerlukan keseimbangan fungsi antara kedua glikoprotein (HA
dan NA) tersebut (Kobasa et al. 2001). Inhibitor neuraminidase sebagai antivirus yaitu zanamivir (Relenza) dan oseltamivir
(Tamiflu) menghambat aktivitas NA sehingga budding tidak dapat terjadi (Hayden 2006).
Mutasi Gen VAI
Seperti dijelaskan sebelumnya, bahwa enzim RdRp tidak
menerus dengan tingkatan yang cukup tinggi. Berbeda dengan
polimerase DNA yang hanya mempunyai kesalahan 1 dari 109 basa, kesalahan replikasi oleh RdRp adalah 1 dari 104 nukleotida per siklus replikasi (review oleh Webster et al. 1992). Selain mutasi di masing-masing gen akibat tidak adanya mekanisme
repair, mutasi juga dilakukan virus sebagai adaptasi terhadap
tekanan imun hospes atau adaptasi terhadap spesies hospes
baru. Mutasi pada level ini biasanya berbentuk delesi atau
substitusi titik/poin. Substitusi titik/poin dapat dibedakan atas
substitusi sinonim dan substitusi nonsinonim.
Substitusi sinonim adalah perubahan nukleotida tidak diikuti
perubahan ekspresi asam amino. Hal ini terjadi pada semua
asam amino, kecuali metionin dan triptofan yang hanya disandi
oleh 1 kodon. Substitusi sinonim ini menyebabkan kodon bias,
yaitu ketidakseimbangan penggunaan kodon sinonim yang
menyandi asam amino. Kodon bias ini terlihat pada semua
spesies di semua bagian genom, baik daerah intron maupun
ekson. Karena kodon bias tidak mengubah fenotip produk
ekspresi, sehingga kodon bias selalu ada dalam genom.
Penggunaan kodon (codon usage) pada gen berkorelasi dengan akurasi dan tingkat translasi. Kodon pilihan (codon preference) biasanya adalah kodon yang tRNA untuk kodon tersebut
melimpah sehingga dapat ditranslasi lebih cepat (Lavler & Kotlar
2005; Wu & Freeland 2005).
Seperti organisme lainnya, substitusi sinonim pada VAI juga
berkaitan dengan kelimpahan tRNA (Plotkin & Dushoff 2003).
mekanisme translasi sel hospes, substitusi sinonim tersebut lebih
dikarenakan seleksi penyesuaian terhadap penggunaan kodon
sel hospes. Hal ini terjadi karena perbedaan penggunaan kodon
antara virus dengan sel hospes dapat mempengaruhi kecepatan
translasi protein (Garmory et al. 2003).
Substitusi nonsinonim adalah perubahan nukleotida diikuti
dengan perubahan ekspresi asam amino. Substitusi nonsinonim
hanya terjadi pada bagian tertentu dari gen yang mengalami
tekanan. Semakin sering mengalami tekanan, semakin tinggi
tingkat substitusinya (Plotkin & Dushoff 2003). Adanya tekanan
seleksi akan menyebabkan munculnya varian dengan tingkat
efektivitas replikasi yang tinggi (Jong et al. 2000). Tingkat perubahan asam amino virus di dalam tubuh hospes (in vivo) lebih tinggi dibandingkan virus yang ditumbuhkan secara in vitro. Hal ini menunjukkan bahwa tingginya tekanan imun berkorelasi
dengan perubahan asam amino (Nakajima et al. 2003).
Kecepatan substitusi nonsinonim virus influenza mencapai
2-3x substitusi per posisi per tahun (Tumpey et al. 2002; Swayne & Suarez 2003). Rasio kecepatan mutasi nonsinonim dan sinonim
sangat penting untuk mempelajari mekanisme evolusi molekuler
sekuen gen tertentu. Rasio kecepatan mutasi nonsinonim/sinonim
(ω = dN/dS) juga merupakan indikator tekanan seleksi pada level protein. Jika ω=1 berarti seleksi netral, ω<1 berarti seleksi
pemurnian (purifying selection) dan ω=>1 berarti seleksi positif
(Yang et al. 2000).
Analisis genom VAI subtipe H5N1 yang menginfeksi unggas
PB2, HA dan NS1 mengalami tekanan seleksi positif, sementara
gen lainnya (PA, PB1, M, NA, NS2, NP) mengalami tekanan
seleksi pemurnian (Campitelli et al. 2006). Namun, isolat VAI H5N1 penyebab wabah di Indonesia dan Vietnam pada dekade
terakhir menunjukkan bahwa hanya gen M2 (ω=1,23) dan PB1-F2
(ω=3,01) yang mengalami seleksi positif. Hal ini menunjukkan keterlibatan gen ini dalam adaptasi VAI pada hospes baru dan
transmisi interspesies. Seleksi positif pada gen M2 terjadi akibat
tekanan seleksi untuk adaptasi VAI dari unggas air ke unggas
darat. Perbedaan pH dan lingkungan seluler antara unggas air
dan unggas darat merupakan tekanan seleksi pada M2 sebagai
kanal ion hidrogen. Tekanan seleksi pada PB1-F2 dikarenakan
peran protein ini dalam menginduksi apoptosis makrofag (Smith
et al. 2006).
Virus AI subtipe H5N1 garis Asia menunjukkan jumlah asam
amino yang mengalami seleksi positif meningkat dari tahun ke
tahun, terutama pada daerah antigenik, posisi glikosilasi dan
kantong pengikat reseptor. Hal ini kemungkinan berhubungan
dengan peningkatan patogenesitas dan kemampuan virus untuk
transmisi ke manusia (Campitelli et al. 2006). Mekanisme virus untuk menghindar dari sistem imun hospes merupakan tekanan
untuk mutasi secara gradual sehingga muncul strain-strain virus
baru yang secara imunologik berbeda (hanyutan antigenik)
(Munch et al. 2001; Smith et al. 2004). Hanyutan antigenik berjalan lambat namun progresif dan cenderung menimbulkan
penyakit yang terbatas pada suatu kawasan tertentu (Tumpey et
Adaptasi selalu dilakukan VAI, baik adaptasi terhadap
tekanan imun maupun adaptasi pada spesies hospes baru
(Voeten et al. 2000; Taubenberger et al. 2005). Adaptasi merupakan kekuatan utama dari evolusi. Perbedaan spesies
hospes dan perbedaan tekanan menyebabkan pebedaan
kecepatan evolusi VAI (Brown et al. 2001). Lama infeksi dan frekuensi reinfeksi virus influenza pada manusia, menyebabkan
tingginya tekanan seleksi oleh sistem imun (Bush et al. 1999; Suzuki & Nei 2002).
Kecepatan mutasi glikoprotein HA kira-kira 2 x 10-3 nukleotida per posisi per replikasi (Webster et al. 1992). Kecepatan mutasi HA tersebut lebih tinggi dibanding NA karena
NA bukan merupakan determinan antigenik utama dan jumlah
NA pada permukaan virion hanya 1/5 jumlah HA (Plotkin &
Dushoff 2003). Sekuen nukleotida VAI isolat unggas air di Jawa
Barat yang disepadankan dengan nukleotida Gs/GD/1/96
menunjukkan bahwa jumlah kodon substitusi bervariasi dari 23
sampai 50, dan jumlah substitusi nonsinonim bervariasi dari 5-18
(Susanti et al. 2008a). Tingkat mutasi yang tinggi akibat lemahnya
mekanisme proofreading dari RdRp, menyebabkan perubahan
nukleotida terjadi terus menerus. Kecepatan mutasi HA lebih
tinggi dibanding NA karena NA bukan merupakan determinan
antigenik utama dan jumlah NA pada permukaan virion hanya 1/5
jumlah HA (Plotkin & Dushoff 2003).
Protein internal tidak berperan dalam pengikatan dengan
reseptor sel hospes dan tersembunyi dari antibodi, sehingga
Dushoff 2003; Berkhoff et al. 2005). Struktur dan fungsi protein internal juga sangat mendasar sehingga tidak menguntungkan
VAI jika mutasi terjadi secara cepat. Hal ini menyebabkan VAI
menghadapi konflik intragenom tentang kecepatan mutasi. Gen
atau bagian spesifik gen tertentu dalam genom tersebut
mengalami seleksi positif untuk berubah, sementara gen lain
mengalami seleksi pemurnian untuk tidak berubah (Plotkin &
Dushoff 2003).
Protein/regio protein yang fungsinya berkaitan erat dengan
pertahanan terhadap respon imun hospes, daya adaptasi dan
patogenesitas mempunyai tingkat substitusi nonsinonim lebih
tinggi dibanding substitusi sinonim (Plotkin & Dushoff 2003).
Kecepatan substitusi nonsinonim gen subunit HA1 dari VAI
subtipe H3 sebesar 5,7 x10-3 per posisi per tahun. Hal ini disebabkan karena pada HA1 terdapat daerah antigenik, kantong
pengikat reseptor dan posisi glikosilasi (Bush et al. 1999). Lima virus AI subtipe H5N1 isolat unggas air (IPB1-RS s/d IPB5-RS),
mengalami substitusi nonsinonim 3 asam amino kantong pengikat
reseptor. Sebanyak 11 substitusi nonsinonim pada isolat IPB6-RS, 10 diantaranya merupakan daerah antigenik, posisi glikosilasi
dan kantong pengikat reseptor. Dari 17-18 substitusi nonsinonim
pada 3 isolat virus (IPB7-RS, IPB8-RS dan IPB9-RS), 16
substitusi diantaranya merupakan daerah antigenik, posisi
glikosilasi dan kantong pengikat reseptor (Susanti et al. 2008a).
Hanyutan antigenik (antigenic drift)
Adaptasi terhadap tekanan imun hospes dilakukan VAI
sel T sitotoksik. Antibodi netralisasi terhadap protein HA bersifat
protektif melawan infeksi, sehingga protein ini paling tinggi
mengalami tekanan imun dibandingkan protein internal (Berkhoff
et al. 2005). Mekanisme VAI untuk menghindar dari sistem imun hospes merupakan tekanan untuk mutasi secara gradual
sehingga muncul strain-strain virus baru yang secara imunologik
berbeda (hanyutan antigenik) (Horimoto & Kawaoka 2001; Munch
et al. 2001; Smith et al. 2004).
Hanyutan antigenik adalah perubahan secara periodik
akibat mutasi genetik struktur glikoprotein permukaan VAI
sehingga antibodi yang telah terbentuk oleh tubuh akibat infeksi
atau vaksinasi sebelumnya tidak dapat mengenali keberadaan
virus tersebut (Munch et al. 2001). Hanyutan antigenik berjalan lambat namun progresif dan cenderung menimbulkan penyakit
yang terbatas pada suatu kawasan tertentu (Tumpey et al. 2002; Swayne & Suarez 2003). Hanyutan antigenik menuntut
pembuatan vaksin selalu diperbarui mengikuti munculnya strain
virus baru (Plotkin et al. 2002; Smith et al. 2004).
Reasorsi dan transmisi VAI
Pandemi dapat terjadi jika subtipe virus influenza baru dapat
melintasi barier hospes antara unggas dan mamalia, termasuk
manusia. Adaptasi VAI strain unggas ke manusia antara lain
melalui reasorsi (reassortment), yaitu pertukaran atau
pencampuran gen. Genom RNA yang tersusun
bersegmen-segmen memudahkan terjadinya reasorsi, yaitu segmen gen
lainnya. Reasorsi menyebabkan perubahan struktur antigen
secara dominan, sehingga disebut lompatan antigenik (antigenic shift). Reasorsi hanya dapat terjadi jika suatu sel secara simultan terinfeksi oleh 2 atau lebih strain VAI yang berbeda, sehingga
terjadi penyusunan kembali suatu strain virus baru yang
bermanifestasi sebagai genotipe virus baru. Hospes yang dapat
diinfeksi oleh 2 jenis strain VAI yaitu strain avian dan manusia
dikenal dengan “mixing vessel”. Hospes ini memungkinkan
sebagai hospes perantara transmisi VAI dari unggas ke manusia
(Ito et al. 1998; Hoffman et al. 2001; Li et al. 2004).
Virus influenza A subtipe H1N1 penyebab pandemi
influenza tahun 1918 mengalami lompatan antigenik sehingga
tahun 1958 muncul subtipe H2N2 dan tahun 1968 muncul subtipe
H3N2 (Belshe 2005). Transmisi langsung VAI Vdari unggas ke
manusia biasanya mengakibatkan kematian, seperti terjadi di
Hongkong tahun 1997-1998. Virus HPAI H5N1 yang menyerang
dan mematikan manusia dan ayam di Hongkong tersebut (Lee et
al. 2001), merupakan produk reasorsi dengan VAI H9N2 yang bertindak sebagai donor gen internal (Guan et al. 1999). Virus tersebut kemudian berkembang cepat di pasar unggas
Hongkong, dan mempunyai kemampuan untuk transmisi
langsung ke manusia (Zhou et al. 1999; Cauthen et al. 2000).
Kejadian tersebut merupakan kasus pertama, dimana
infeksi VAI H5N1 langsung pada manusia tanpa terlebih dulu
beradaptasi pada hospes mamalia perantara (Tumpey et al.
mematikan ribuan unggas air migratori dilaporkan juga
merupakan virus hasil reasorsi (Zhou et al. 2006). Burung puyuh menyediakan lingkungan yang memungkinkan VAI H3N2 babi
mengalami reasorsi dan menghasilkan virus influenza yang
berpotensi menyebabkan pandemi (Perez et al. 2003).
Transmisi VAI H5N1 dari manusia ke manusia belum
pernah dilaporkan (Buxton et al. 2000; The Writing Committee WHO 2005; Kandun et al. 2006). Namun, VAI subtipe H5N1 berpotensi sebagai penyebab pandemi influenza pada manusia
melalui 2 mekanisme. Manusia yang terinfeksi VAI H5N1 dan
strain influenza manusia (misalnya H1N1) akan memicu reasorsi,
sehingga memunculkan VAI subtipe H5 yang mampu
ditransmisikan dari manusia ke manusia. Alternatif lain adalah
mutasi langsung VAI H5N1 yang berkemampuan untuk transmisi
BAB III
TEKNIK MENUMBUHKAN DAN MENGISOLASI VIRUS AVIAN INFLUENZA
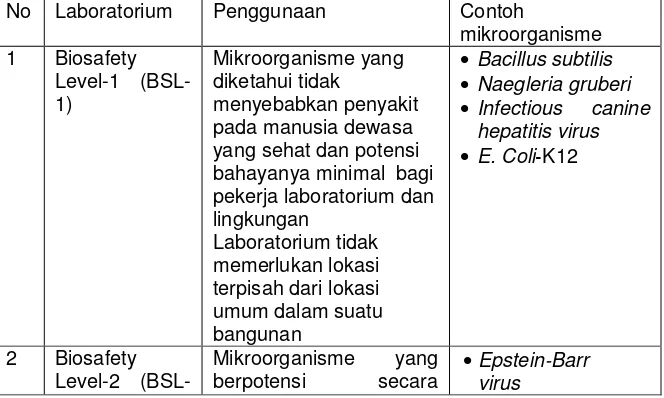
Penelitian yang berhubungan dengan virus avian influenza
dilakukan di laboratorium standart Biosafety Level 2 (BSL-2) plus atau BSL-3. Namun untuk propagasi virus AI subtipe H5N1 pada
hewan coba (pada tikus, marmut, ayam atau itik, dll) harus
dilakukan di laboratorium BSL-3. Semakin tinggi potensi suatu
agen penyakit (mikroorganisme) untuk menular dan
menyebabkan penyakit pada manusia (peneliti/pekerja
laboratorium), semakin tinggi tingkat (level) biosafety laboratorium yang diperlukan. Pada Tabel 2 berisi jenjang safety laboratorium dan penggunaannya.
Tabel 2. Level laboratorium untuk penelitian yang berhubungan dengan mikroorganisme penyebab penyakit
No Laboratorium Penggunaan Contoh
Preparasi Sampel
Tahap pertama yang harus dilakukan untuk memperbanyak
dan mengisolasi virus adalah mengambil contoh/sampel yang
diduga mengandung virus. Mengingat VAI berkembang/
bermultiplikasi pada sel epitel saluran pencernaan dan
pernafasan, maka sampel dapat diambil dari usap hidung, usap
anus atau usap kloaka. Sampel usap kloaka diambil dari hewan
yang diperiksa atau hewan/manusia yang diduga terinfeksi VAI.
Sampel usap kloaka/anus/hidung selanjutnya dimasukkan dalam
tabung berisi media transport PBS gliserol (WHO 2002). Sampel
selanjutnya dimasukkan dalam inkubator suhu dingin -4oC atau lebih dingin lagi. Jika pengambilan sampel dari lapangan, tabung
berisi sampel dimasukkan dalam ice box kemudian dibawa ke laboratorium. Cara membuat PBS gliserol adalah dengan
mencampurkan PBS 1x dan gliserol dengan perbandingan 1:1.
Dalam 1 liter PBS Gliserol, ditambahkan Penisilin-G 2x106 U/L dan Srteptomisin 200 mg/L (Susanti et al. 2008b).
Media Perbanyakan virus
Untuk mengetahui apakah pada sampel terdapat virus yang
dimaksud atau tidak, sampel harus ditanam pada media yang
sesuai. Mengingat virus adalah organisme yang hanya dapat
bereplikasi pada sel hidup, maka media yang sesuai untuk
menumbuhkan virus adalah sel hidup. Virus influenza A dapat
Kidney (MDCK) (Ito et al. 1997; Whittaker 2001). Sel MDCK
mempunyai reseptor α-(2,6) dan α-(2,3) sehingga efektif untuk replikasi virus influenza isolat manusia maupun avian. Untuk
dapat menumbuhkan virus influenza pada sel MDCK, perlu
ditambahkan protease tripsin untuk memotong HA menjadi HA1
dan HA2 (Webster et al. 1992). Pertumbuhan virus ditandai adanya cytopathogenic effect (CPE). Karena sel MDCK memiliki
2 jenis reseptor (α-(2,6) dan α-(2,3)), kultur virus influenza pada MDCK tidak menyebabkan tekanan seleksi sehingga tidak terjadi
substitusi asam amino tertentu, namun kurang efektif jika
digunakan untuk mendapatkan virus dalam jumlah besar (Ito et al. 1997).
Ruang alantois TAB hanya mempunyai reseptor α-(2,3),
sementara pada sel amnion mempunyai reseptor α-(2,6) dan α -(2,3). Secara in ovo, perbedaan reseptor sel hospes dengan spesifisitas asam amino titik pengikat reseptor merupakan
tekanan seleksi yang memicu substitusi hemaglutinin (HA). Kultur
virus influenza strain manusia pada sel amnion (yang mempunyai
reseptor α-(2,6) dan α-(2,3)), sampai pasase ke-2 masih
mempertahankan spesifisitas reseptor pada α-(2,6). Namun, jika virus influenza strain manusia ini dikultur pada sel alantois yang
hanya mempunyai reseptor α-(2,3) menyebabkan mutasi substitusi L226G sehingga spesifisitas reseptor bergeser dari α
-(2,6) menjadi α-(2,3) (Ito et al. 1997). Isolasi virus dalam TAB lebih tepat untuk strain avian (Ito et al. 1997). Meskipun demikian, menurut hasil-hasil penelitian selanjutnya menunjukkan bahwa
1992; Harimoto & Kawaoka 2001; Whittaker 2001). Hal ini
disebabkan karena protease serupa dengan faktor pembeku
darah “Xa” (anggota famili protrombrin) dalam cairan alantois
bertanggung jawab atas proteolitik HA pada cleavage site
sehingga virus dapat bereplikasi secara in ovo (Harimoto & Kawaoka 2001). Protease yang dapat memotong HPAI dan LPAI
adalah enzim “trypsin like”, yaitu faktor pembeku darah “Xa”,
triptase, mini plasmin dan protease bakterial (Harimoto &
Kawaoka 2005). Enzim proteolitik mengenal sekuen asam amino
motif B-X-B-R (B=asam amino basa, X=asam amino non-basa)
(Harimoto & Kawaoka 2001).
Propagasi virus pada TAB merupakan metode yang
banyak dilakukan untuk diagnosis, isolasi virus, identifikasi virus
dan uji neutralisasi. TAB merupakan metode terbaik untuk isolasi
virus influenza, karena lebih sensitif dibandingkan sel kultur
MDCK (Clavijo et al. 2002). Meskipun demikian, MDCK
merupakan sel yang paling sensitif untuk isolasi virus influenza A
dibanding sel kultur Vero dan MRC-5 (Reina et al. 1997). Propagasi virus pada TAB digunakan sebagai metode pembuatan
vaksin influenza A yang telah beredar selama beberapa dekade
(kurang lebih 30 tahun) (Scannon 2006). Lebih lanjut disebutkan
bahwa TAB merupakan media utama produksi vaksin influenza
Metode Propagasi Virus pada Telur Ayam Berembrio SPF
Setiap sampel dari setiap ekor hewan yang diduga
mengandung virus, idealnya ditumbuhkan pada 1 butir TAB.
Namun, hal ini bergantung pada tujuan penelitian dan
ketersediaan biaya. Jika tujuannya untuk mengetahui apakah
hewan-hewan di suatu tempat (biasanya hewan dipelihara
berkelompok) terinfeksi, maka sampel diambil secara sampling
atau diambil semua. Jika sampel diambil semua, untuk efisiensi
biaya dan tujuan tercapai, maka sampel di-polling. Setiap 1-4 sampel usap kloaka/anus/hidung (masing masing sebanyak 100
µl) dikumpulkan (polling) menjadi satu inokulum berdasarkan jenis hewan dan pemilik. Hal ini ditujukan untuk efisiensi jumlah TAB.
Jika sampel yang dianalisa menunjukkan hasil positif, hal ini
berimplikasi pada pengambilan keputusan bahwa hewan di lokasi
dan hewan tersebut terdapat hewan positif terinfeksi virus AI
sehingga pencegahan dan pengendaliannya ditujukan pada
semua hewan dan manusia di kawasan tersebut (Susanti et al.
2008b). Inokulum yang berhasil ditumbuhkan dalam TAB,
menunjukkan bahwa pada sampel mengandung virus yang hidup
dengan jumlah melebihi ambang batas untuk dapat tumbuh
dalam TAB yaitu 1 egg infectious dose 50% (EID50) (Beato et al.
2007; Terregino et al. 2007).
TAB yang digunakan hendaknya specific pathogen free
(SPF). Artinya, jika kita akan menumbuhkan sampel yang diduga
mengandung virus AI, maka TAB yang digunakan minimal bebas
dari virus tersebut. Hal ini sangat penting dilakukan untuk
bebar-benar berasal dari sampel dan bukan dari TAB. TAB dapat
diperoleh di laboratorium-laboratorium yang memproduksi TAB
SPF, seperti laboratorium pada perusahaan yang memproduksi
vaksin.
Sampel usap kloaka ditumbuhkan pada TAB (SPF) umur 9
hari. Inokulum dibuat dengan mencampur sampel usap kloaka ke
dalam tabung yang telah berisi 10 µl phosphate buffer saline
(PBS) yang mengandung 2x106 U/L penisilin dan 200 mg/L streptomisin. Setelah diinkubasi 30 menit pada suhu kamar,
inokulum diinokulasikan pada ruang alantois TAB SPF. Telur
diinkubasi pada suhu 37 oC dan diamati setiap hari selama 4 hari. Telur ayam berembrio yang mati sebelum hari keempat dan
embrio yang masih hidup sampai hari ke empat, dipanen cairan
alantoisnya untuk diidentifikasi kemampuannya mengaglutinasi
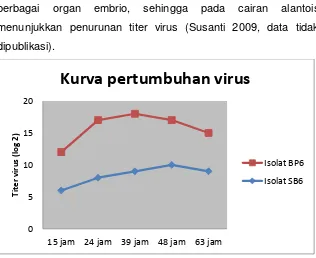
sel darah merah (SDM) (WHO 2002; Susanti et al. 2008b). Berdasar hasil penelitian, kurva pertumbuhan virus HPAI
H5N1 pada TAB selama 24 jam menunjukkan bahwa virus telah
bereplikasi dengan jumlah titer virus cukup tinggi (Gambar 4)
(Susanti 2009; data tidak dipublikasi). Menurut Coleman (2007),
proses replikasi virus terjadi sangat cepat, yaitu 10 jam. Ambang
batas jumlah virus yang viabel yang dapat tumbuh dalam telur
ayam berembrio adalah 1 EID50 (Beato et al. 2007; Terregino et
al. 2007). Pada kurva pertumbuhan nampak bahwa pertumbuhan
mencapai titer tertinggi pada inkubasi 48 jam (2 hari). Setelah 48
jam, titer virus pada cairan alantois mulai menurun. Menurunnya
jumlah titer virus pada inkubasi lebih dari 48 jam, kemungkinan
berbagai organ embrio, sehingga pada cairan alantois
menunjukkan penurunan titer virus (Susanti 2009, data tidak
dipublikasi).
Gambar 4. Pertumbuhan virus avian influenza subtipe H5N1 pada
TAB (Susanti 2009)
Pada inkubasi 24 jam, virus dapat terdeteksi di sebagian
besar pembuluh darah (Susanti 2009, data tidak dipublikasikan).
Virus berikatan dengan reseptor α-(2,3) pada sel alantois, bereplikasi dan dilepaskan dalam cairan alantois. Dari cairan
alantois, virus masuk sistem pembuluh darah dan keluar pada
tissu-blood junction (Kuiken et al. 2006). Virus HPAI dilaporkan dapat bereplikasi secara efisien pada sel endotel pembuluh darah
dan perivaskuler sel parenkim, sehingga virus dapat terdeteksi
pada berbagai organ internal dan pembuluh darah (Harimoto &
Kawaoka 2005; Swayne 2007). Dengan metoda imunohistokimia,
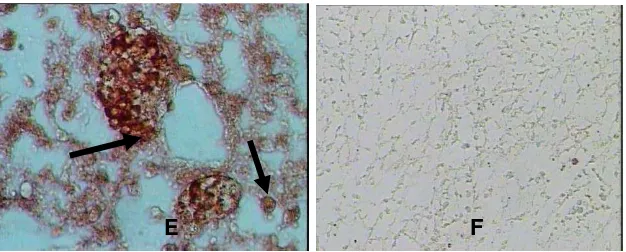
antigen virus dapat terdeteksi pada organ ginjal, paru-paru, hati
dan intestinum (Gambar 5). Pada ginjal, virus banyak terdapat di
glomerulus. Pada intestinum, virus banyak terdeteksi di epitel vili,
lumen dan serosa. Pada paru, terutama virus banyak terdapat di
pembuluh darah (Susanti 2009, data tidak dipublikasikan). Infeksi
virus HPAI H5N1 secara in vivo pada itik menunjukkan bahwa virus menyebar secara sistemik pada trakea, paru, hati, pankreas,
rektum, bursa fabrisius, limpa, otak, jantung dan ginjal (Songserm
et al. 2006). Pada mamalia (mencit), infeksi HPAI H5N1 isolat itik juga menyebar secara sistemik pada limpa, ginjal dan otak (Chen
et al. 2004).
C D
Gambar 5. Antigen virus virus HPAI H5N1 isolat unggas air pada organ-organ embrio. (A) Glomerulus, (C) Intestinum, (E)
Paru-paru. B, D dan F adalah kontrol negatif (Susanti 2009)
BAB IV
TEKNIK IDENTIFIKASI VIRUS AVIAN INFLUENZA DAN
SUBTIPENYA
Deteksi atau identifikais virus AI dapat dilakukan dengan uji
hemaglutinasi (HA), Uji Agar Gel Immunodiffusion (AGID) Test
atau dikenal juga dengan Agar gel Presipitation test (AGPT),
haemagglutination inhibition (HI), atau PRC (WHO 2002; OIE
2005b). Uji HI dan AGID dilakukan untuk mengetahui variasi
antigenik molekul HA virus dengan mereaksikannya dengan
antibodi monoklonal/poliklonal (WHO 2002; OIE 2005).
Uji Hemaglutinasi (HA)
Sebagai skrining awal keberadaan virus influenza adalah uji
hemaglutinasi (HA). Uji hemaglutinasi digunakan untuk
mendeteksi keberadaan virus yang mempunyai kemampuan
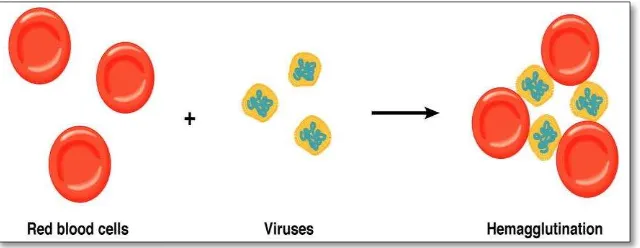
mengaglutinasi sel darah merah. Hemaglutinasi adalah terjadinya
penggumpalan sel darah merah (SDM). Penggumpalan dapat
diakibatkan oleh protein hemaglutinin yang dimiliki oleh beberapa
virus seperti golongan virus influenza, virus New castle disease,
virus mixo, dan virus rabies. Dengan demikian, untuk identifikasi
virus AI menggunakan uji HA ini memiliki diagnostik banding virus
New-castle yang juga memiliki hemaglutinin. Hemaglutinin akan
melekat secara spontan pada SDM. Bagian dari virus yang
melekat SDM merupakan bagian spesifik (yaitu glikoprotein
spesifik juga) pada SDM. Secara sederhana, konsep dasar
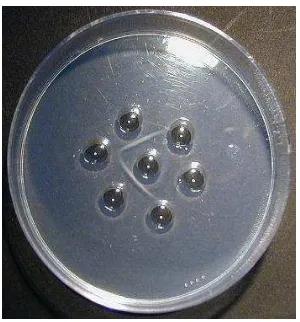
hemaglutinasi digambarkan di Gambar 6.
Jika sampel yang diduga mengandung berasal dari unggas,
virus yang berkemampuan mengaglutinasi SDM merupakan virus
golongan Orthomyxoviridae (misal: virus influenza) atau
Paramyxoviridae (misal: New Castle Disease; ND) (OIE 2004).
Dengan demikian, jika hasil uji HA positif, kemungkinan sampel
mengandung virus ND atau virus AI, sehingga perlu diuji lebih
lanjut dengan penanda lain (misal dengan PCR atau uji
antigenesitas). Uji HA dapat dilakukan 2 tahap, yaitu secara
makro dan secara mikro (Susanti et al. 2008b). Uji HA secara makro hanya ditujukan untuk mendeteksi keberadaan virus yang
memiliki protein hemaglutinin (kualitatif) sehingga mampu
mengaglutinasi, sementara uji HA mikro ditujukan untuk
mengatahui titer virus (kuantitatif) yang mampu mengaglutinasi
sel darah merah.
Gambar 6. Hemaglutinasi sel darah merah oleh virus yang
Metode Uji Hemaglutinasi (HA)
Sebelum uji HA titrasi secara mikro, dilakukan uji aglutinasi
cepat dengan mencampurkan satu tetes cairan alantois dengan
SDM ayam 5% (v/v). Keberadaan virus ditunjukkan adanya
aglutinasi SDM dalam waktu 15 detik setelah dicampur. Cairan
alantois yang positif berdasar uji HA cepat, selanjutnya dilakukan
uji HA secara mikro menggunakan microplate U buttom (Nunc). Uji hemaglutinasi cairan alantois dilakukan sesuai dengan
prosedur standar yang berlaku. Sumur 1–12 dari microplate diisi dengan PBS pH 7,2 masing-masing 25 l dengan mikropipet
kapasitas 10-100 l. Cairan alantois diambil sebanyak 25 l dan
dimasukkan ke dalam sumur yang telah ditandai dengan nomor
sampel uji. Selanjutnya cairan alantois diencerkan bertingkat
kelipatan dua dengan PBS, kemudian ditambahkan 25 l
suspensi SDM ayam 0,5% ke dalam seluruh sumur. Tahap
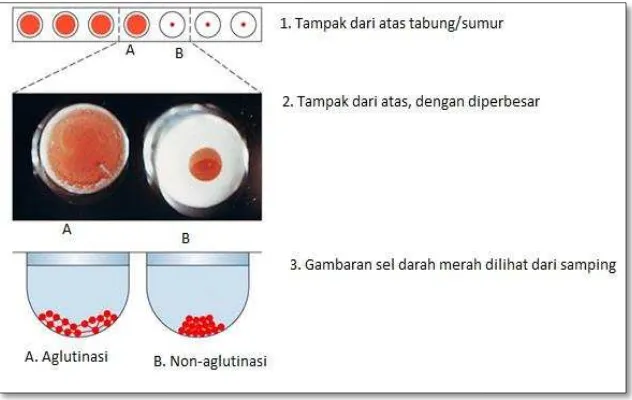
terakhir dilakukan pengocokan microplate dengan menggoyang-goyangkannya, kemudian diinkubasikan pada suhu ruang selama
kurang lebih 30 menit. Pembacaan hasil uji dapat dilakukan
apabila SDM pada sumur kontrol telah teraglutinasi di dasar
sumur. Sampel dinyatakan positif apabila SDM pada sumur
sampel mengalami aglutinasi. Titer HA dihitung berdasarkan
pengenceran tertinggi alantois yang dapat mengaglutinasi SDM
Gambar 7. Gambaran contoh hasil uji HA
Uji Agar Gel Immunodiffusion (AGID) Test
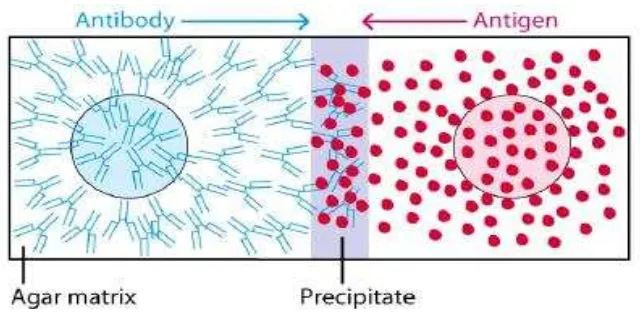
Uji AGID atau dikenal juga dengan Agar gel Presipitation
test (AGPT) adalah teknik imunopresipitasi, merupakan salah
satu cara yang banyak dipakai untuk mengukur secara kualitatif
antigen atau antibodi. Walaupun uji ini kurang peka dibanding
dengan uji pengikatan primer, namun relatif mudah dilakukan.
Pada uji ini digunakan selapis media agar yang dilubangi (dengan
alat khusus) membentuk sumur-sumur. Kemudian ke dalam
sumur-sumur tersebut masing-masing diisi dengan antigen dan
serum yang mengandung antibodi pereaksi. Antigen dan antibodi
akan merembes, berdifusi ke sekitar sumur secara radial
(Gambar 8). Apabila antigen bereaksi dengan antibodi spesifik,
akan terbentuk kompleks antigen-antibodi yang besar sehingga