BAB II
TINJAUAN PUSTAKA 2.1. Pengertian Baterai Lithium
Baterai lithium secara teori adalah baterai yang digerakkan oleh ion
lithium. Dalam kondisi discharge dan recharge baterai lithium bekerja menurut
fenomena interkalasi, dimana ion lithium melakukan migrasi dari katoda lewat
elektrolit ke anoda atau sebaliknya tanpa terjadi perubahan struktur kristal dari
bahan katoda dan anoda. Proses perpindahan ion lithium dari katoda ke anoda
dapat dilihat di Gambar 2.1.
Gambar 2.1.Perpindahan ion lithium dari katoda ke anoda [46].
Interkalasi merupakan proses pelepasan ion lithium dari tempatnya di struktur
kristal suatu bahan elektroda dan pemasukan ion lithium pada tempat di struktur
kirstal bahan elektroda yang lain. Proses terjadinya interkalasi dapat digambarkan
Gambar 2.2.Proses interkalasi dalam beberapa fase.
Sehingga keunggulan bahan anoda dan katoda terletak pada stabilitas Kristal
dalam proses interkalasi. Sehingga bahan elektroda harus mempunyai tempat bagi
perpindahan ion lithium yang sering disebut host.Oleh karena itu bahan elektroda
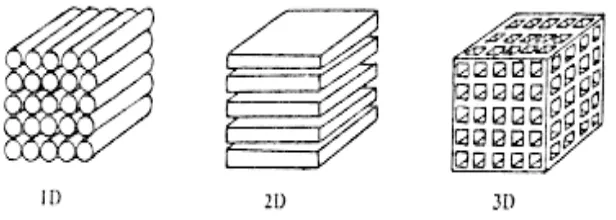
harus mempunyai struktur host.Pada umumnya bahan mempunyai tiga kategori/
model dalam melakukan interkalasi yang bergantung pada bentuk host
strukturnya, yaitu interkalasi dalam satu dimensi, dua dimensi dan tiga dimensi,
seperti tergambar di Gambar 2.3.
Gambar 2.3.Tiga model host dari bahan katoda dan anoda
Sel baterai lithium yang dibuat dalam rangkaian penelitian ini telah memilih
menggunakan lithium mangan oxide sebagai katoda dan grafit sebagai anoda,
sedang lithium titanium alumunium posfat (LTAP) sebagai elektrolitnya. Lithium
mangan oxide mempunyai host interkalasi dalam tiga dimensi. Grafit mempunyai
host interkalasi satu dimensi.
2.2. Bahan Elektroda
2.2.1. Lithium Mangan Oksida
Kebanyakan baterai lithium yang sudah diproduksi di pasaran masih
banyak menggunakan LiCoO2 dan LiNiO2 sebagai katodanya.Namun bahan
Cobalt dan Nikel cukup mahal. Dalam pencarian baterai lithium yang murah,
bahan katoda yang murah dari segi bahan dasar dan proses pembuatan menjadi
salah satu penyelesaiannya. LixMn2O4 yang juga dikenal sebagai bahan katoda
akan menjadi alternatif jawaban. LixMn2O4 mempunyai keunggulan lain dengan
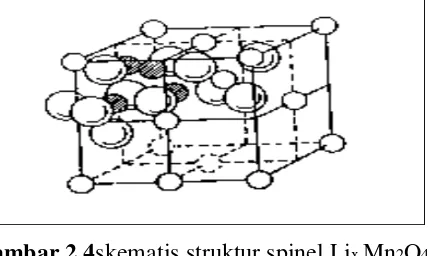
struktur spinel yang cukup stabil dalam proses interkalasi. Sebagaimana diketahui
bahwa LixMn2O4 mempunyai struktur spinel yang tergambar di Gambar 2.4.
Gambar 2.4skematis struktur spinel Lix Mn2O4
Bahan berstruktur spinel mempunyai komposisi pada umumnya sebagai berikut:
Me(II)Me(III)2O4
Dalam struktur spinel normal susunan atom oksigen membentuk kubus
dengan susunan rapat. Seperdelapan dari tempat tetrahedaral terbentuk dalam
lapisan susunan rapat dari ion O2- diisi oleh ion metal bervalensi 2 dan
setengahdari octahedral diisi oleh metal ion bervalensi 3. Sedang di dalam bahan
LixMn2O4 tempat ion metal bervalensi 2 diduduki oleh ion lithium bervalensi 1
dantempat ion metal bervalensi 3 diduduki oleh ion mangan dengan dua
macamvalensi, yaitu 3+ dan 4+. Rumus komposisi spinel Lix Mn2O4 adalah :
Lix[Mn3+]x[Mn4+]2-xO4
Susunan atom oksigen dan octahedral mangaan membentuk sebuah
spinelframework dalam spinel Lix Mn2O4, seperti terlihat di gambar 1b. Hal
inimembuat gerak ion lithium dalam proses interkalasi menjadi bebas dalam
tigademensi. Dan framework ini cukup stabil ketika ion lithium
2.2.2. Grafit
Anoda yang dipilih dalam percobaan ini adalah grafit.Dengan Kristal
strukturnya yang hexagonal.Grafit mempunyai kemampuan yang cukup tinggi
dalam perannya sebagai anoda dan lebih baik dibandingkan dengan logam
lithium.Selain itu grafit merupakan bahan alam yang cukup murah.
2.3 Elekktrolit
Elektrolit merupakan perangkat elektrokimia yang sangat penting dalam
sautu baterai.Elektrolit merupakan material yang bersifat penghantar ionik.Fungsi
elektrolit ialah sebagai media untuk mentransfer ion antara elektroda.Ada
beragam jenis elektrolit seperti cair, padat, polimer dan komposit
elektrolit.Elektrolit yang banyak digunakan pada baterai lithium adalah elektrolit
cair yang terdiri dari garam lithium yang dilarutkan dalam pelarut berair.Hal yang
paling penting dalam suatu elektrolit adalah interaksi antara elektrolit dan
elektroda pada baterai. Hubungan dua bahan ini akan mempengaruhi kinerja
baterai secara signifikan.(Fadhel,A. 2009)
Berdasarkan daya hantar listriknya elektrolit dapat dibedakan menjadi dua yaitu :
1. Elektrolit kuat
Elektrolit kuat adalah elektrolit yang dapat menghantarkan larutan dengan
daya hantar listrik yang baik. Senyawa NaCl, HCl, dan H2SO4dapat terurai
sempurna dalam pelarut air dapat membentuk banyak ion.
2. Elektrolit Lemah
Elektrolit Lemah adalah elektrolit yang dapat menghasilkan larutan dengan
daya hantar listrik yang buruk.Senyawa CH3COOH dan NH3akan terurai
sebagian kecil dalam pelarut air membentuk sedikit ion secara
kuantitatif.(Fadhel,A. 2009)
Tujuan pemberian elektrolit pada baterai adalah mampu mencerminkan
tujuan dari baterai itu sendiri.Elektrolit menjalankan perannya sebagai kunci
penentu karakteristik suatu baterai.Untuk mencapai level energy tinggi maka
dibutuhkan elektrolit untuk membutuhkan elektrolit untuk memberikan
meningkatkan total area permukaan elektroda ini secara langsung mengurangi
kembali meningkatkan material inert untuk menutupi sel fisik yang besar.
Selanjutnya energi spesifik sel dan densitas energy turun secara cepat.(Heitner,K.
2000)
Lithium ion baterai umumnya beroperasi pada tegangan tinggi (~4.2 V),
yang membutuhkan pelarut organik yang stabil terhadap oksida. Ada syarat-syarat
yang harus dipenuhi suatu elektrolit yaitu :
1. Konduktansi ion yang tinggi dan insulator elektronik untuk meminimalisir
resistansi sel serta mencapai tingkat kapabilitas yang baik dan menjaga proses
pemakaian minimum.
2. Memiliki stabilitas panas dan kimia yang tinggi.
3. Memiliki rentang batas tegangan dekomposisi dengan oksidatif dan reduksi
dari elektrolitnya.
4. Reaktivitas rendah terhadap komponen lain dalam baterai seperti elektroda,
pengumpul arus dan separator.
5. Bukan bahan beracun dan aman.
6. Titik leleh (Tm) rendah, sehingga mempunyai konduktivitas pada saat
temperature rendah.
7. Titik didih (Tb) tinggi, untuk mencegah terjadi kenaikan tekanan sehingga
tidak terjadi ledakan.
8. Biayanya rendah
Elektrolit pelarut yang ideal harus memiliki sifat-sifat sebagai berikut :
1. Konstanta dielektrik tinggi
2. Viskositas rendah
3. Pelarut harus tetap inert untuk semua komponen sel.
4. Titik leleh rendah (Tm)
5. Titik didih tinggi (Tb)
6. Aman, tidak beracun dan ekonomis
Sifat yang paling penting pada pelarut elektrolit untuk konduktansi ionic
adalah viskositas dan dielektrik yang konstan.Pelarut organik telah banyak diteliti
dan mayoritas dapat diklasifikasikan sebagai karbonat alkil, ester dan
eter.(Fadhel,A. 2009)
2.4. Bahan Elektrolit
2.4.1. Bahan Elektrolit Cair Dan Padat
Elektrolit memegang peranan yang penting dalam mendesain sel
baterai.Elektrolit merupakan suatu material yang bersifat penghantar ionik, baik
dalam bentuk cair ataupun padat.Kebanyakan baterai menggunakan elektrolit cair
namun ada juga yang menggunakan elektrolit padat.Elektrolit padat menunjukkan
kestabilan pada suhu tinggi, self-discharge rendah dan memiliki resistansi listrik
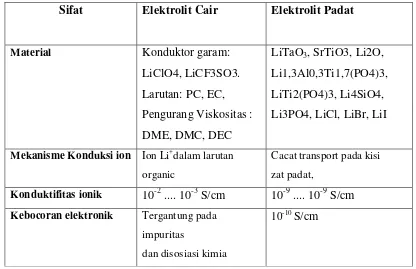
yang baik. Tabel II.1. menunjukkan perbandingan elektrolit cair dan elektrolit
padat.
Elektrolit padat memiliki beberapa kelemahan diantaranya aliran arus
rendah (dalam skala mikroampere), kemampuannya menurun pada temperature
rendah dan sangat rentan terhadap hubungan singkat yang dapat menyebabkan
hilangnya energi.
Tabel II.1. Perbandingan elektrolit cair dan elektrolit padat. Sifat Elektrolit Cair Elektrolit Padat
Material Konduktor garam:
LiClO4, LiCF3SO3.
Larutan: PC, EC,
Pengurang Viskositas :
DME, DMC, DEC
LiTaO3, SrTiO3, Li2O,
Li1,3Al0,3Ti1,7(PO4)3,
LiTi2(PO4)3, Li4SiO4,
Li3PO4, LiCl, LiBr, LiI
Mekanisme Konduksi ion Ion Li+dalam larutan
organic
Cacat transport pada kisi
zat padat,
Konduktifitas ionik 10-2 .... 10-3 S/cm 10-9 .... 10-9 S/cm
Kebocoran elektronik Tergantung pada
impuritas
dan disosiasi kimia
Pembuatan Mahal, larutan beracun,
rentan meledak,
Baik, tidak mengandung
racun, Sputtering untuk film
tipis, Keramik sintering, atau
pasta untuk aplikasi lain.
Sumber : Physics and Chemistry of Lithium-Ion-type-Accumulators.
Namun dalam memahami proses interkalasi fungsi elektrolit cair perlu
dimengerti. Proses interkalasi berjalan dengan lancar, jika bahan elektroda
bersentuhan langsung dengan bahan elektrolit.
Bahan elektrolit cair dapat menembus celah – celah atau pori – pori dari
bahan elektroda, baik anoda maupun katoda. Karena elektrolit berupa larutan,
maka elektrolit sangat mudah mencapai permukaan serbuk elektroda.Pada
penerapan elektrolit padat persyaratan tersebut harus tetap dipenuhi, dimana
pertemuan permukaan serbuk elektroda dan elektrolit harus terjadi.Oleh karena itu
komponen elektroda dibuat dengan komposisi beberapa persen merupakan
pencampuran dari bahan elektrolit padat atau garam lithium.Sehingga reaksi
redoks dapat berlangsung tepat di permukaan serbuk elektroda.
2.4.2. Separator Berpori
Penerapan elektrolit padat pada baterai lithium dipengaruhi oleh kehadiran
pori di lembaran elektrolit tersebut. Bahan elektrolit seharusnya tidak mempunyai
pori pada aplikasi di dalam sel baterai atau aplikasi lainnya. Oleh karena itu
elektrolit tanpa pori harus dapat dibuat untuk memenuhi syarat tersebut.
Elektrolit yang dibuat merupakan bahan keramik berupa komposit dari
bahan gelas soda lime silica dan LTAP. Bahan keramik selalu mempunyai pori
pada hasil akhir dari proses pembuatannya. Kehadiran pori pada lembaran
elektrolit dapat dipastikan muncul dan tidak dapat dihindari. Kondisi ini dapat
diambil contoh penerapan elektrolit cair pada baterai lithium dengan separator
porous atau polimer pemisah antara bahan katoda dan anoda, sebagaimana desain
Gambar 2.5.konstruksi baterai telepon selulair dengan elektrolit cair. Separator berpori dapat dilewati oleh elektrolit cair dengan mudah melalui
pori – porinya. Sehingga separator ini yang sebelumnya hanya berfungsi sebagai
pembatas antara anoda dan katoda, dapat juga berfungsi sebagai elektrolit dengan
pori – porinya terisi oleh elektrolit cair. Ion Li dapat dengan mudah mencapai
anoda ataupun katoda, sebagaimana diilustrasikan di Gambar 2.5.(P.Bambang,
2008)
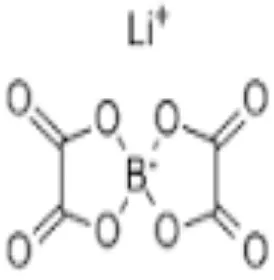
2.5 LiBOB
LiBOB adalah garam baru yang ditemukan oleh lischka et al 57 di Jerman
Dan Angell et al 58 di Amerika Serikat.Berat LiBOB 194 g/mol. LiBOB
merupakan campuran garam berbasis.Stabilitas termal garam ini dalam kisaran
suhu 40-3500C elektrolit yang diteliti sebagai calon potensial untuk
daya/penyimpanan tinggi baterai litium ion terutama bermanfaat untuk aplikasi
LiBOB Gambar 2.6 struktur LiBOB
Struktur LiBOB berisi empat oksigen karbonil dan empat oksigen
eter.Hanya ada muatan negatif tunggal yang didistribusikan diantara atom-atom
sehingga ikatan koordinasinya rendah.Akibatnya, disosiasi LiBOB tinggi dan
diharapkan dapat memberikan konduktivitas ionik yang baik.(Z.H. Chen, 2006)
Selama sepuluh tahun terakhir sejumlah jurnal dan makalah muncul di
literatur menunjukan kinerja yang baik dari grafit anoda dan katoda logam transisi
dalam larutan yang mengandung LiBOB dibandingkan dengan LiPF6.Hal ini
menunjukan stabilitas termal larutan elektrolit untuk baterai ion berdasarkan
LiBOB jauh lebih tinggi dari pada yang didasarkan pada garam Li lainnya
(misalnya LiPF6, LiBFF4).(S.S.Zhang, 2002)
Garam LiBOB memiliki banyak keunggulan seperti stabilitas termal yang
tinggi (sampai 3200C).Hampir semua studi dilakukan dengan LiBOB selama
enam tahun terakhir menggunakan pelarut terutama karbonat.Selain keunggulan
LiBOB juga memiliki kelemahan yaitu bila digunakan dengan karbonat
linier.Dalam upaya untuk meningkatkan kinerja, meningkatkan keselamatan dan
menurunkan biaya litium ion. Katoda setengah sel yang menggunakan elektrolit
LiBOB berbasis memberikan kinerja yang baik, dan dalam kasus LiMn2O4
setengah sel. Diharapkan LiMn2O4 katoda akan menurunkan biaya baterai
lithium-ion berdasarkan biaya material. Kinerja LiFePO4 dan LiCO2 sel setengah
menggunakan gel elektrolit sebanding dengan setengah sel dengan menggunakan
menggunakan gel elektrolit, yang harus menurunkan biaya baterai
lithium-ion.(Science Direct)
2.6 X-Ray Difraction (XRD)
Sinar X ditemukan pertama kali oleh Wilhem Conrad Rontgen pada tahun
1895, di Universitas Wurtzburg Jerman. Karena asalnya tidak diketahui waktu itu
maka disebut sinar X. Untuk penemuan ini Rontgen mendapat hadiah nobel pada
tahun 1901, yang merupakan hadiah nobel pertama dibidang fisika. Sejak
ditemukannya, sinar-X telah umum digunakan untuk tujuan pemeriksaan tidak
merusak pada material maupun manusia. Disamping itu, sinar-X dapat juga
digunakan untuk menghasilkan pola difraksi tertentu yang dapat digunakan dalam
analisis kualitatif dan kuantitatif material, pengujian dengan menggunakan
sinar-X disebut dengan pengujian sinar-XRD (X-Ray Diffraction)
XRD digunakan untuk analisis komposisi fasa atau senyawa pada material
dan juga karakterisasi kristal. Prinsip kerja XRD adalah mendifraksi cahaya oleh
kisi-kisi atau kristal ini dapat terjadi apabila difraksi tersebut berasal dari radius
yang memiliki panjang gelombang yang setara dengan jarak antar atom yaitu
sekitar 1 Angstrom. Radiasi yang digunakan berupa radiasi sinar-X elektron dan
neutron.
Sinar-X merupakan foton dengan energi tinggi yang memiliki panjang
gelombang berkisar antara 0,5 sampai 2,5 Angstrom. Ketika berkas sinar-X
berinteraksi dengan suatu material, maka sebagian berkas akan diabsorbsi,
ditransmisikan dan sebagian lagi dihamburkan terdifraksi. Hamburan yang
terdifraksi inilah yang terdeteksi oleh XRD.
Pada awalnya teori mengenai sinar-X dari sistem kristal telah
dikembangkan dengan persamaan Laue. Kemudian Bragg mengembangkannya
lebih lanjut dengan menggunakan model kristal semi transparan yang terdiridari
beberapa lapisan atau bidang. Pada penelitiannya, sebagian sinar-X yang
diarahkan dalam suatu bidang akan direfleksikan dengan suatu sudut refleksi sama
dengan sudut sinar datang terhadap sudut sinar datang tersebut. Sebagian lagi
akan diteruskan kesisi dan kemudian direfleksikan oleh bidang bagian lebih dan
XRD merupakan teknik analisis non-destruktif untuk mengidentifikasikan
dan menentukan secara kuantitatif tentang bentuk-bentuk berbagai Kristal, yang
disebut dengan fase.Identifikasi diperoleh dengan membandingkan pola difraksi
dengan sinar-X. XRD dapat digunakan untuk menentukan fase apa yang ada
dalam bahan dan konsentrasi bahan-bahan penyusunnya. XRD juga dapat
mengukur macam-macam keacakan dan penyimpangan Kristal.XRD juga dapat
mengidentifikasi mineral-mineral yang berbutir halus seperti tanah liat(M.Hilmy,
2008).
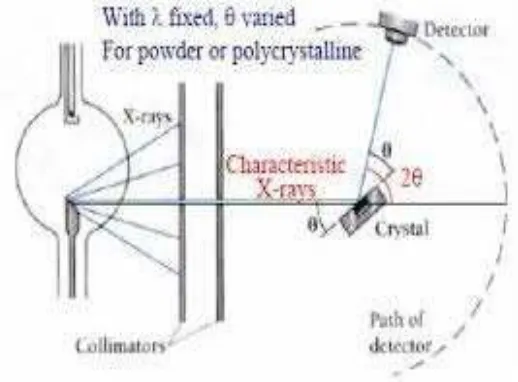
Prinsip Kerja XRD
Dasar dari prinsip pendifraksian sinar yaitu difraksi sinar-X terjadi pada hamburan
elastic foton-foton sinar-X oleh atom dalam sebuah kisi periodik. Hamburan
monokromatis sinar-X dalam fasa tersebut memberikan interferensi yang
konstruktif. Dasar dari penggunaan difraksi sinar-X untuk mempelajari kisi
Kristal adalah berdasarkan persamaan Bragg :
n.λ = 2.d.sin θ ; n = 1,2,3,4…... (2.1) prinsip-prinsip dari difraksi adalah hasil dari pantulan elastik yang terjadi ketika
sebuah sinar berbenturan dengan sasaran serta pantulan sinar yang bersifat elastic.
Fenomena dapat dijelaskan dengan Hukum Bragg.Sinar-X dalam
pembangkitannya dideskripsikan oleh gambar dibawah ini dan didalam sinar-X
terdapat dua jenis radiai yaitu sinar-X kontinyu dan karakteristik. Untuk alat XRD
terdapat filter guna menyaring sinar-X kontinyu dan hanya meneruskan sinar-X
karakteristik.
Prinsip dari alat XRD (X-Ray powder diffraction) adalah sinar-X yang
dihasilkan dari suatu logam tertentu memiliki panjang gelombang tertentu,
sehingga dengan memvariasi besar sudut pantulan sehingga terjadi pantulan
elastik yang dapat dideteksi.Maka menurut Hukum Bragg jarak antar bidang
atomdapat dihitung dengan data difraksi yang dihasilkan pada besar sudut –sudut
Gambar 2.7 Mekanisme Xray Diffraction
Seberkas sinar-X dengan panjang gelombang λ (cahaya monokromatik )
jatuh pada struktur geometris atom atau molekul dari sebuah Kristal pada sudut datang θ. Jika beda lintasan antara sinar yang dipantulkan dari bidang yang berturut-turut sebanding dengan n panjang gelombang, maka sinar tersebut
mengalami difraksi. Peristiwa difraksi mungkin terjadi karena jarak antaratom
dalam Kristal dan molekul berkisar antara 0,15 hingga 0,4 nm, yang bersesuaian
dengan spektrum gelombang elektromagnet pada kisaran panjang gelombang
sinar-X dengan energy foton antara 3 hingga 8 keV. Sesuai dengan hukum Bragg, dengan memvariasikan sudut θ diperoleh lebar antar celah yang berada dalam bahan polikristalin.Kemudian, posisi sudut dan intensitas puncak hasildifraksi
digrafikkan dan diperoleh pola yang merupakan karakteristik sampel. Setiap
Kristal memiliki pola XRD yang berbeda satu sama lain yang bergantung pada
struktur internal bahan. Pola XRD ini merupakan karakteristik dari
masing-masing bahan sehingga disebut sebagai ‘fingerprint’ dari suatu material atau
bahan Kristal. (M.Hilmy, 2008)
2.7 Charging Discharging
Kemampuan kapasitas energi yang tersimpan dalam baterai lithium
tergantung pada berapa banyak ion lithium yang dapat disimpan dalam struktur
charging dan discharging, karena jumlah arus elektron yang etrsimpan dan
tersalurkan sebanding dengan jumlah ion lithium yang bergerak.
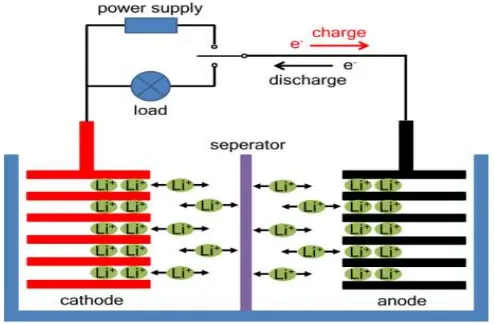
Pada proses charging, material katoda akan terionisasi, menghasilkan ion
lithium bermuatan positif dan bermigrasi ke dalam elektrolit menuju komponen
anoda, sementara elektron yang diberikan akan dilepaskan bergerak melalui
rangkaian luar menuju anoda. Ion lithium ini akan masuk kedalam anoda melalui
mekanisme interkalasi seperti terlihat yang terlihat pada Gambar 2.8
saatdischargingakan terjadi aliran ion dan elektron dengan arah kebalikan dari
proses charging.
Gambar 2.8 Struktur dan prinsip kerja.
Suatu material elektrokimia dapat berfungsi baik sebagai elektroda anoda
maupun katoda bergantung pada pemilihan material (material selection) yang
akan menentukan karakteristik perbedaan nilai tegangan kerja (working voltage)
dari kedua material yang dipilih. Potensial tegangan yang terbentuk antara
elektroda anoda dan katoda bergantung dari reaksi kimia reduksi-oksidasi dari
bahan elektroda yang dipilih.
2.8. FTIR (Fourier Transform Infrared)
Spektroskopi FTIR (FourierTransform Infrared) merupakanspektroskopi
inframerah yang dilengkapidengan transformasi Fourier untuk deteksidan analisis
hasil spektrumnya.Intispektroskopi FTIR adalah interferometerMichelson yaitu
alat untuk menganalisisfrekuensi dalam sinyal gabungan.Spektrum inframerah
tersebutdihasilkan dari pentrasmisian cahaya yangmelewati sampel, pengukuran
sampel sebagai fungsi panjang gelombang.Spektrum inframerah yang diperoleh
kemudian diplot sebagai intensitas fungsi energi, panjang.gelombang (µm) atau
bilangan gelombang (cm-1).
Pengujian FTIR memiliki 3 fungsi yaitu (i) untuk mengidentifikasi
material yang belum diketahui (ii) untuk menentukan kualitas atau konsistensi
sampel, dan (iii) untuk menentukan intensitas suatu komponen suatu komponen
dalam suatu campuran. FTIR merupakan pengujian kuantitatif untuk sebuah
sampel.Ukuran puncak (peak) data FTIR menggambarkan jumlah atau intensitas
senyawa yang terdapat didalam sampel.FTIR menghasilkan data berupa grafik
intensitas dan frekuensi .intensitas menunjukan tingkatan jumlah senyawa
sedangkan frekuensi menunjukkan jenis senyawa yang terdapat dalam sebuah
sampel.(Y.Yuanyuan, 2010)
Atom-atom dalam suatu molekul tidak diam melainkan bervibrasi. Bila
radiasi infra merah yang kisaran energinya sesuai dengan frekuensi vibrasi
rentangan (stretching) dan vibrasi bengkokan (bending) dari ikatan kovalen dalam
kebanyakan molekul dilewatkan dalam suatu cuplikan, maka molekul-molekul
akan menyerap energi tersebut dan terjadi transisi diantara tingkat energi vibrasi
dasar dan tingkat vibrasi tereksitasi.Hanya ikatan yang mempunyai momen dipol
dapat menyerap radiasi infra merah.Umumnya daerah radasi infra merah (IR)
terbagi dalam daerah IR dekat (14290-4000 cm-1), IR jauh (700-299 cm-1) dan IR
tengah (4000-666 cm-1).Daerah yang paling banyak digunakan untuk keperluan
![Gambar 2.1.Perpindahan ion lithium dari katoda ke anoda [46].](https://thumb-ap.123doks.com/thumbv2/123dok/1559737.1064799/1.595.158.469.320.531/gambar-perpindahan-ion-lithium-dari-katoda-ke-anoda.webp)