PEMBUATAN SERBUK LiBOB (LITHIUM BIS(OXALATO) BORATE)
SEBAGAI ELEKTROLIT BATERAI LITHIUM DENGAN VARIASITEMPERATUR PEMANASAN.
SKRIPSI
WIRIYA SASMITA
110801018
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PEMBUATAN SERBUK LiBOB (LITHIUM BIS(OXALATO) BORATE)
SEBAGAI ELEKTROLIT BATERAI LITHIUM DENGAN VARIASITEMPERATUR PEMANASAN.
SKRIPSI
Diajukan Sebagai Salah Satu Syarat UntukMenyelesaikan Program Sarjana Sains Bidang Fisika
WIRIYA SASMITA
110801018
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERNYATAAN
PEMBUATAN SERBUK LiBOB (LITHIUM BIS(OXALATO) BORATE) SEBAGAI ELEKTROLIT BATERAI LITHIUM DENGAN VARIASI
TEMPERATUR PEMANASAN.
SKRIPSI
Saya mengaku bahwa Skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, 10 Agustus 2015
WIRIYA SASMITA
PENGHARGAAN
Alhamdulillah, puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat, berkah, serta hidayah-Nya kepada penulis sehingga dapat menyelasaikan Skripsi ini tepat pada waktunya.Skripsi ini dibuat sebagai salah satu syarat untuk menyelesaikan perkuliahan pada Program Studi Sarjana Sains bidang Fisika pada Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. Adapun judul Tugas Akhir yang penulis buat adalah”PEMBUATAN SERBUK LiBOB (LITHIUM BIS(OXALATO) BORATE ) SEBAGAI ELEKTROLIT BATERAI LITHIUM DENGAN VARIASI TEMPERATURE PEMANASAN”.
Dalam menyelesaikan Skripsi ini, penulis banyak sekali mendapatkan doa, bantuan, dukungan, serta motivasi baik secara langsung maupun yang tidak langsung. Atas bebagai hal tersebut, pada kesempatan ini penulis menghaturkan ucapan terima kasih yang sebesar-besarnya kepada :
1. Bapak Dr. Sutarman,M.Sc Selaku Dekan FMIPA USU
2. Bapak Dr. Marhaposan Situmorang dan Bapak Drs. Syahrul Humaidi, M.Sc Selaku Ketua Departemen Fisika dan Sekretaris Departemen Fisika yang telah banyak membantu dalam pembuatan surat-surat untuk melengkapi berkas-berkas penelitian.
3. Bapak Tua Raja Simbolon, S.Si.,M.Si selaku dosen Pembimbing I di kampus Universita Sumatera Utara yang bersedia membantu saya dalam membimbing serta Koordinator seminar di Kampus.
4. Bapak Dr.Ir. Bambang Prihandoko. MT selaku dosen pembimbing II atas segala bimbingan dan kesabarannya selama penelitian untuk skripsi di LIPI.
5. Dra. Titik Lestariningsih selaku pembimbing lapangan yang rela meluangkan waktunya kepada penulis ditengah kesibukan dan atas segala waktu yang disediakan dalam mentransfer wawasan dan rela memberikan bahan-bahan literatur.
7. Keluargaku Tercinta : Ayahanda Muhammad Jais, Ibunda Umi Kalsum, Kakak Yatima Hariani, Abang Ipar Nanang, Adikku Widiya Sarasmita yang telah memberikan do’a, dukungan dan semangat kepada penulis.
8. Teman seperjuangan stambuk 2011 yang tidak dapat disebutkan oleh penulis satu persatu.
Penulis menyadari bahwa tulisan ini masih mempunyai kekurangan disebabkan keterbatasan kemampuan dan pengetahuan yang penulis miliki, walaupun penulis duah berusaha untuk yang terbaik.Oleh sebab itu dengan kerendahan hati, penulis menerima kritik dan saran yang membangun demi kesempurnaan tulisan ini.
Medan, 10 Agustus 2015
Penulis
110801018
ABSTRAK
Telah dilakukan penelitian tentang pembuatan serbuk LiB(C2O4)2 atau
Lithium bis (oxalato) borate atau LIBOB. LIBOB merupakan kandidat utama
pengganti LiPF6 yang merupakan elektrolit baterai lithium yang sangat beracun dan berbahaya bagi kesehatan manusia.LiBOB mempunyai kelebihan yaitu tidak membentuk gas dan lebih ramah lingkungan karena senyawa tersebut tidak mengandung unsur halogen yang berpotensi mencemari lingkungan. Tahapan proses yang dilakukan meliputi perhitungan komposisi, penimbangan, pencampuran dan pembakaran. Untuk mengetahui fasa dan mengidentifikasi spektrum pada sampel dilakukan analisa XRD dan FTIR. Proses ini dimulai dengan perhitungan komposisi bahan kimia asam oksalat dihidrat (H2C2O4.2H2O), asam borat (H3BO3), dan Litium hidroksida (LiOH), dengan rasio mol 2:1:1. Selanjutnya serbuk dicampur dengan digerus sehingga diperoleh campuran yang
cukup rata.Dilakukan pembakaran dengan suhu 120oC, 110oC dan
100oC.Kemudian serbuk LiBOB yang dihasilkan dianalisa dengan XRD dan FTIR. Hasil XRD menunjukan fasa yang terbentuk adalah fasa LiBOB , fasa LiBOB hidrat, fasa metaborit (HBO2) dan fasa litium hidroksida hidrat (Li(OH) (H2O). Dan hasil FTIR menunjukan gugus fungsi C=O, C=O, COO, C-O-B-O-C, C-O-C, O-B-O, COO, B-O.
ABSTRACT
DAFTAR ISI
Halaman
LEMBAR PENGESAHAN ... i
PERNYATAAN ... ii
PENGHARGAAN ... iii
ABSTRAK ... v
ABSTRACT... ... vi
DAFTAR ISI ... vii
DAFTAR GRAFIK ... x
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 RumusanMasalah ... 3
1.3 Tujuan Penelitian ... 3
1.4 BatasanMasalah... 3
1.5 ManfaatPenelitian ... 4
1.6 Waktu dan Tempat Penelitian ... 4
1,7 Sistematika Penulisan ... 4
BAB 2 TINJAUAN PUSTAKA ... 6
2.1PengertianBateraiLithium ... 6
2.2BahanElektroda ... 8
2.2.2.Grafit ... 9
3.1 BahandanAlatPenelitian ... 20
3.1.1. BahanPenelitian... 20
3.1.2 AlatPenelitian ... 20
3.2 Proses Pembuatan LiBOB ... 22
3.3 Proses Pembuatan Sampel ... 23
3.3.1. Penentuan Komposisi Bahan ... 23
3.3.2 Proses Pencampuran dan Penggerusan Serbuk ... 23
3.3.3 Pembakaran Dengan Perlakuan Khusus... 24
3.4. Uji Karakterisasi XRD ... 24
3.5. Uji FTIR ( Fourier Transform Infrared )……… ... 25
3.6. Uji Charge-Discharge………... 27
3.7. Uji CV ( Cyclic Voltammetry )... 28
4.1 Hasil Pengujian Karakterisasi XRD ... 31
4.2 Hasil Pengujian Spektroskopi FTIR ... 34
4.3 Hasil Pengujian Charge-Discharge ... 37
4.4 Hasil Pengujian CV ( Cyclic Voltammetry ... 38
BAB 5 KESIMPULAN DAN SARAN ... 39
5.1 Kesimpulan ... 39
5.2 Saran ... 39
DAFTAR PUSTAKA... xi
LAMPIRAN... xii
Halaman
Gambar 4.1.1 Grafik Pengjuian Difraktogramsinar-X serbukLiBOB A1… 30
Gambar 4.1.2 Grafik Pengjuian Difraktogramsinar-X serbukLiBOB A2… 32
Gambar 4.1.3 Grafik Pengjuian Difraktogramsinar-X serbukLiBOB A3… 33
Gambar 4.2.1 Grafik Pengjuian FTIRserbukLiBOB A1……….. 34
Gambar 4.2.2 Grafik Pengjuian FTIRserbukLiBOB A1……….. 35
Gambar 4.2.3 Grafik Pengjuian FTIRserbukLiBOB A1………. 35
Gambar 4.3.1.Grafik Pengjuian Charge-Discharge………..… 37
Gambar 4.3.2.Grafik Pengjuian Discharge LiBOB A1………. 38
Gambar 4.3.3.Grafik Pengjuian Discharge LiBOB A2………. 38
Gambar 4.3.4.Grafik Pengjuian Discharge LiBOB A3………. 39
ABSTRAK
Telah dilakukan penelitian tentang pembuatan serbuk LiB(C2O4)2 atau
Lithium bis (oxalato) borate atau LIBOB. LIBOB merupakan kandidat utama
pengganti LiPF6 yang merupakan elektrolit baterai lithium yang sangat beracun dan berbahaya bagi kesehatan manusia.LiBOB mempunyai kelebihan yaitu tidak membentuk gas dan lebih ramah lingkungan karena senyawa tersebut tidak mengandung unsur halogen yang berpotensi mencemari lingkungan. Tahapan proses yang dilakukan meliputi perhitungan komposisi, penimbangan, pencampuran dan pembakaran. Untuk mengetahui fasa dan mengidentifikasi spektrum pada sampel dilakukan analisa XRD dan FTIR. Proses ini dimulai dengan perhitungan komposisi bahan kimia asam oksalat dihidrat (H2C2O4.2H2O), asam borat (H3BO3), dan Litium hidroksida (LiOH), dengan rasio mol 2:1:1. Selanjutnya serbuk dicampur dengan digerus sehingga diperoleh campuran yang
cukup rata.Dilakukan pembakaran dengan suhu 120oC, 110oC dan
100oC.Kemudian serbuk LiBOB yang dihasilkan dianalisa dengan XRD dan FTIR. Hasil XRD menunjukan fasa yang terbentuk adalah fasa LiBOB , fasa LiBOB hidrat, fasa metaborit (HBO2) dan fasa litium hidroksida hidrat (Li(OH) (H2O). Dan hasil FTIR menunjukan gugus fungsi C=O, C=O, COO, C-O-B-O-C, C-O-C, O-B-O, COO, B-O.
ABSTRACT
BAB I
PENDAHULUAN
1.1 LatarBelakang
Saat ini baterai lithium merupakan salah satu alat penyimpanan energi paling canggih dan populer.Hal ini dikarenakan baterai lithium mempunyai kapasitas yang besar, tahan lama, ringan dan tidak merusak lingkungan. Selain itu, baterai litium dapat didesain sesuai ukuran yang diperlukan (fleksibel dalam ukuran dan bentuk) .(U.Lischka, 1999)
Berdasarkan fakta tersebut baterai litium akan menjadi baterai yang diunggulkan dimasa depan. Seiring dengan permasalahan itu, maka perlu adanya penelitian dan pengembangan baterai litium untuk dapat mengaplikasikan baterai sekunder.Secara umum baterai tersusun dari komponen-komponen seperti katoda, anoda, separator dan elektrolit.Elektrolit merupakan salah satu material pada baterai litium yang sangat penting. Material elektrolit baterai litium yang baru ditemukan saat ini salah satunya adalah Lithium Bis(oxalate) Borate (LIBOB).
Material ini merupakan material elektrolit yang menjanjikan dan potensial untuk pembuatan garam litium sebagai zat terlarut elektroilt dalam baterai litium ion.(W.XU and C.A.Angel, 2001)
Lithium bisoksalato borate atau dikenalsebagai LIBOB
merupakankandidat yang sangatmenjanjikansebagaigaramelektrolitbateraiLithium
ion. Garamlithium baruLithium bis (oxalato) borate(LIBOB)
itudiungkapkanpertama kali padatahun 1999 olehLischka et al dan Xu Angell sebagaielektrolit yang sangatmenjanjikandanmenguntungkanbagi baterai Li- ion isi ulang. LiBOB mempunyai kelebihan yaitu tidak membentuk gas dan lebih ramah lingkungan karena senyawa tersebut tidak mengandung unsur halogen yang berpotensi mencemari lingkungan.(W.XU and C.A.Angel, 2001)
Dalam perkembangannya LiPF6 ini mempunyaibanyakkelemahanya
kendaraanListrik.Olehkarenaitupenelitian tentang pengembangan garam elektrolitbaterai lithium untuk menggantikan LiPF6 sangatpesat dilakukan oleh peneliti.(Sasaki Y, 2001)
Beberapatahunterakhirini, sejumlahmakalahmunculdalam publikasi menunjukkan kinerja yang baik untuk anodagrafitdankatodalogamtransisidalam larutan yang mengandung LiBOB (dibandingkandalam larutan yang mengandung LiPF6). Hal ini menunjukkanbahwastabilitasthermal larutanelektrolituntuk baterai Li ion berdasarkan LiBOBjauhlebih tinggi dari pada garam Li lainnya (misalnya, LiPF6, LiBF4).(S.S. Zhang, 2002)
Oleh karena itu, jelaslah bahwa perilaku thermal pada LiBOB adalah hal yang menarik dan penting.Dalam beberapa tahun terakhir beberapa laporan tentang thermal dari LiBOB muncul dalam makalah dengan perincian sebagai
berikut.Menurut percobaan termografimetri Lithium-bis (ocalato) borat
sepenuhnya stabil sampai kira-kira 320oC. Diatas suhu ini akan terurai bukannya mencair. Garam ini secara kimiawi stabil dalam larutan organic.(U. Lischka, 1999)
Beberapa penelitian yang menggunakan LiBOB sebagai komponen dari baterai baik sebagai elektrolitmaupun sebagai aditif elektrolit lain telah dilakukan. Para peneliti telah meneliti tentang penggunaan senyawa LiBOB sebagai bahan aditif elektrolit padat LiPF6 untuk baterai Li-ion.Para peneliti telah melakukan pengujian karakteristik senyawa LiBOB sebagai elektrolit baterai Li-ion dan siklus kerjanya pada half cell LiMNO2.Para peneliti telah melakukan penelitian mengenai studi penggunaan senyawa LiBOB untuk nanocomposite gel polymer electrolytes (NCGPE) untuk baterai Li-ion.
LiBOB merupakan senyawa yang mudah untuk disintesis, yakni melalui reaksi antara asam oksalat dihidrat, lithium hidroksida monohidrat dengan asam borat.Berdasarkan studi literatur dapat diketahui bahwa beberapa metode penelitian terkait sintesis senyawa LiBOB telah dilakukan.Meskipun demikian, studi mengenai kinetika reaksi sintesis senyawa LiBOB sampai saat ini masih sangat terbatas.(Yu, dkk 2007)
Adapun proses pembuatannya melalui metode pencampuran/penggerusan dengan komposisi bahan baku (rasio mol H2C2O4.2H2O :LiOH : H3BO3 = 2:1:1 ) serta pembakaran dengan temperature tertentu.
Adapun pengujian serbuk itu dikarakterisasi dengan XRD maupun FTIR. Garam ini diaplikasi dengan Sel dan diuji dengan Charge-Discharge dan CV. Untuk itu, fokus penelitian ini adalah mempelajari pembuatan serbuk LiBOB dengan variasi suhu yang kemudian akan dipergunakan sebagai elektrolit.
1.2 RumusanMasalah.
1. Produk LIBOB selalu diikuti dengan senyawa hidrat (H2O) yang mempengaruhi aplikasinya sebagai elektrolit baterai lithium.
2. Apakah proses pembuatan serbuk LiBOB dengan furnace vakum yang kedap udara dapat menghadirkan reaksi hidrat?
3. Apakah proses pembuatan LIBOB dengan furnace vakum dapat menurunkan suhu pemanasan?
1.3 TujuanPenelitian
Adapun tujuan dari penelitian ini adalah : 1. Mempelajari dan memahami serbuk LiBOB.
2. Membuat serbuk LiBOB dari material PA dengan variasi temperature pemanasan.
3. Memverifikasikan hasil sampel LiBOB dengan uji karakterisasi melalui uji XRD dan FTIR.
4. Mengaplikasikan garam LiBOB ke Uji Sel dengan CV dan
Charge-Discharge.
1.4 BatasanMasalah
Batasan masalah untuk proses pembuatan elektrolit LiBOB dari bahan PA dengan Variasi suhu :
1. Penentuan komposisi bahan dengan menggunakan perbandingan antara jumlah mol dengan perhitungan stoikiometri.
3. Pembakaran sampel didalam Vacum Furnace selama beberapa jam dengan variasi temperatur tertentu.
4. Pengujian serbuk hasil pembuatan dengan karakterisasi XRD maupun FTIR dan diaplikasi dengan sel dan di uji dengan CV dan Charge-Discharge.
1.5 ManfaatPenelitian.
Penelitianinidiharapkandapatmenjadiacuandalammerekayasa material serbuk LiBOB.Material tersebutsemogadapatdigunakanuntukbaterai Li-ion isiulang yang penggunaanyasangatdibutuhkansaatini.
1.6 WaktudanTempatPenelitian. Penelitian ini dilaksanakan pada :
NamaInstansi : Pusat Penelitian Fisika (P2F)
Lembaga Ilmu Pengetahuan Indonesia
Alamat : Kawasan Puspitek Serpong, Tanggerang 15314,
Telepon (021) – 7560570, 70618892
Fax (021) – 7560554
Webside : www.fisika.lipi.go.id
Waktu : 05 Februari 2015 – 10 Mei 2015
1.7 SistematikaPenulisan
Sistematika penulisan laporan yang merupakan analisa dari hasil penelitian meliputi :
BAB I PENDAHULUAN
BAB II TINJAUAN PUSTAKA
Bab ini mengurai kan tentang pengertian dan teori-teori yang digunakan sebagai landasan atau dasar dari laporan ini.
BAB III METODE PENELITIAN
Bab ini menguraikan tentang peralatan dan bahan-bahan yang digunakan dalam penelitian serta tahapan sintesis serbuk LiBOB dengan komposisi bahan penyusunnya yang optimal.
BAB IV HASIL DAN PEMBAHASAN
Bab ini menguraikan tentang hasil pembuatan serbuk LiBOB yang telah dibuat dan bagaimana hasil uji bahan dengan FTIR, XRD, CVdan CHARGE-DISCHARGE.
BAB V KESIMPULAN
BAB II
TINJAUAN PUSTAKA
2.1. Pengertian Baterai Lithium
Baterai lithium secara teori adalah baterai yang digerakkan oleh ion lithium. Dalam kondisi discharge dan recharge baterai lithium bekerja menurut
fenomena interkalasi, dimana ion lithium melakukan migrasi dari katoda lewat elektrolit ke anoda atau sebaliknya tanpa terjadi perubahan struktur kristal dari bahan katoda dan anoda. Proses perpindahan ion lithium dari katoda ke anoda dapat dilihat di Gambar 2.1.
Gambar 2.1.Perpindahan ion lithium dari katoda ke anoda [46].
Gambar 2.2.Proses interkalasi dalam beberapa fase.
Sehingga keunggulan bahan anoda dan katoda terletak pada stabilitas Kristal dalam proses interkalasi. Sehingga bahan elektroda harus mempunyai tempat bagi perpindahan ion lithium yang sering disebut host.Oleh karena itu bahan elektroda
harus mempunyai struktur host.Pada umumnya bahan mempunyai tiga kategori/
model dalam melakukan interkalasi yang bergantung pada bentuk host
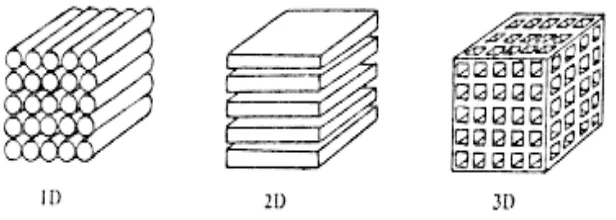
strukturnya, yaitu interkalasi dalam satu dimensi, dua dimensi dan tiga dimensi, seperti tergambar di Gambar 2.3.
Gambar 2.3.Tiga model host dari bahan katoda dan anoda
Sel baterai lithium yang dibuat dalam rangkaian penelitian ini telah memilih menggunakan lithium mangan oxide sebagai katoda dan grafit sebagai anoda, sedang lithium titanium alumunium posfat (LTAP) sebagai elektrolitnya. Lithium mangan oxide mempunyai host interkalasi dalam tiga dimensi. Grafit mempunyai host interkalasi satu dimensi.
2.2. Bahan Elektroda
2.2.1. Lithium Mangan Oksida
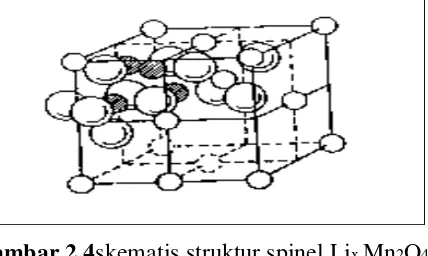
Kebanyakan baterai lithium yang sudah diproduksi di pasaran masih banyak menggunakan LiCoO2 dan LiNiO2 sebagai katodanya.Namun bahan Cobalt dan Nikel cukup mahal. Dalam pencarian baterai lithium yang murah, bahan katoda yang murah dari segi bahan dasar dan proses pembuatan menjadi salah satu penyelesaiannya. LixMn2O4 yang juga dikenal sebagai bahan katoda akan menjadi alternatif jawaban. LixMn2O4 mempunyai keunggulan lain dengan struktur spinel yang cukup stabil dalam proses interkalasi. Sebagaimana diketahui
bahwa LixMn2O4 mempunyai struktur spinel yang tergambar di Gambar 2.4.
Gambar 2.4skematis struktur spinel Lix Mn2O4
Bahan berstruktur spinel mempunyai komposisi pada umumnya sebagai berikut:
Me(II)Me(III)2O4
Dalam struktur spinel normal susunan atom oksigen membentuk kubus dengan susunan rapat. Seperdelapan dari tempat tetrahedaral terbentuk dalam lapisan susunan rapat dari ion O2- diisi oleh ion metal bervalensi 2 dan setengahdari octahedral diisi oleh metal ion bervalensi 3. Sedang di dalam bahan LixMn2O4 tempat ion metal bervalensi 2 diduduki oleh ion lithium bervalensi 1 dantempat ion metal bervalensi 3 diduduki oleh ion mangan dengan dua macamvalensi, yaitu 3+ dan 4+. Rumus komposisi spinel Lix Mn2O4 adalah : Lix[Mn3+]x[Mn4+]2-xO4
Susunan atom oksigen dan octahedral mangaan membentuk sebuah
spinelframework dalam spinel Lix Mn2O4, seperti terlihat di gambar 1b. Hal
inimembuat gerak ion lithium dalam proses interkalasi menjadi bebas dalam tigademensi. Dan framework ini cukup stabil ketika ion lithium
2.2.2. Grafit
Anoda yang dipilih dalam percobaan ini adalah grafit.Dengan Kristal strukturnya yang hexagonal.Grafit mempunyai kemampuan yang cukup tinggi dalam perannya sebagai anoda dan lebih baik dibandingkan dengan logam lithium.Selain itu grafit merupakan bahan alam yang cukup murah.
2.3 Elekktrolit
Elektrolit merupakan perangkat elektrokimia yang sangat penting dalam sautu baterai.Elektrolit merupakan material yang bersifat penghantar ionik.Fungsi elektrolit ialah sebagai media untuk mentransfer ion antara elektroda.Ada beragam jenis elektrolit seperti cair, padat, polimer dan komposit elektrolit.Elektrolit yang banyak digunakan pada baterai lithium adalah elektrolit cair yang terdiri dari garam lithium yang dilarutkan dalam pelarut berair.Hal yang paling penting dalam suatu elektrolit adalah interaksi antara elektrolit dan elektroda pada baterai. Hubungan dua bahan ini akan mempengaruhi kinerja baterai secara signifikan.(Fadhel,A. 2009)
Berdasarkan daya hantar listriknya elektrolit dapat dibedakan menjadi dua yaitu :
1. Elektrolit kuat
Elektrolit kuat adalah elektrolit yang dapat menghantarkan larutan dengan daya hantar listrik yang baik. Senyawa NaCl, HCl, dan H2SO4dapat terurai sempurna dalam pelarut air dapat membentuk banyak ion.
2. Elektrolit Lemah
Elektrolit Lemah adalah elektrolit yang dapat menghasilkan larutan dengan daya hantar listrik yang buruk.Senyawa CH3COOH dan NH3akan terurai sebagian kecil dalam pelarut air membentuk sedikit ion secara kuantitatif.(Fadhel,A. 2009)
meningkatkan total area permukaan elektroda ini secara langsung mengurangi kembali meningkatkan material inert untuk menutupi sel fisik yang besar. Selanjutnya energi spesifik sel dan densitas energy turun secara cepat.(Heitner,K. 2000)
Lithium ion baterai umumnya beroperasi pada tegangan tinggi (~4.2 V), yang membutuhkan pelarut organik yang stabil terhadap oksida. Ada syarat-syarat yang harus dipenuhi suatu elektrolit yaitu :
1. Konduktansi ion yang tinggi dan insulator elektronik untuk meminimalisir resistansi sel serta mencapai tingkat kapabilitas yang baik dan menjaga proses pemakaian minimum.
2. Memiliki stabilitas panas dan kimia yang tinggi.
3. Memiliki rentang batas tegangan dekomposisi dengan oksidatif dan reduksi dari elektrolitnya.
4. Reaktivitas rendah terhadap komponen lain dalam baterai seperti elektroda, pengumpul arus dan separator.
5. Bukan bahan beracun dan aman.
6. Titik leleh (Tm) rendah, sehingga mempunyai konduktivitas pada saat temperature rendah.
7. Titik didih (Tb) tinggi, untuk mencegah terjadi kenaikan tekanan sehingga tidak terjadi ledakan.
8. Biayanya rendah
Elektrolit pelarut yang ideal harus memiliki sifat-sifat sebagai berikut : 1. Konstanta dielektrik tinggi
2. Viskositas rendah
3. Pelarut harus tetap inert untuk semua komponen sel. 4. Titik leleh rendah (Tm)
5. Titik didih tinggi (Tb)
6. Aman, tidak beracun dan ekonomis
Sifat yang paling penting pada pelarut elektrolit untuk konduktansi ionic adalah viskositas dan dielektrik yang konstan.Pelarut organik telah banyak diteliti dan mayoritas dapat diklasifikasikan sebagai karbonat alkil, ester dan eter.(Fadhel,A. 2009)
2.4. Bahan Elektrolit
2.4.1. Bahan Elektrolit Cair Dan Padat
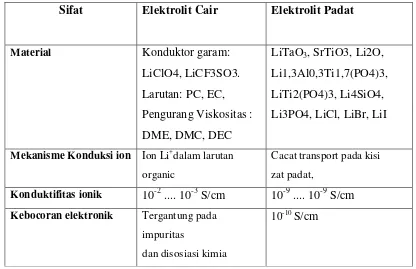
Elektrolit memegang peranan yang penting dalam mendesain sel baterai.Elektrolit merupakan suatu material yang bersifat penghantar ionik, baik dalam bentuk cair ataupun padat.Kebanyakan baterai menggunakan elektrolit cair namun ada juga yang menggunakan elektrolit padat.Elektrolit padat menunjukkan kestabilan pada suhu tinggi, self-discharge rendah dan memiliki resistansi listrik yang baik. Tabel II.1. menunjukkan perbandingan elektrolit cair dan elektrolit padat.
Elektrolit padat memiliki beberapa kelemahan diantaranya aliran arus rendah (dalam skala mikroampere), kemampuannya menurun pada temperature rendah dan sangat rentan terhadap hubungan singkat yang dapat menyebabkan hilangnya energi.
Tabel II.1. Perbandingan elektrolit cair dan elektrolit padat. Sifat Elektrolit Cair Elektrolit Padat
Material Konduktor garam: Li3PO4, LiCl, LiBr, LiI
Mekanisme Konduksi ion Ion Li+dalam larutan
organic
Cacat transport pada kisi zat padat,
Konduktifitas ionik 10-2 .... 10-3 S/cm 10-9 .... 10-9 S/cm
Kebocoran elektronik Tergantung pada
impuritas
dan disosiasi kimia
Pembuatan Mahal, larutan beracun, rentan meledak,
Baik, tidak mengandung racun, Sputtering untuk film tipis, Keramik sintering, atau pasta untuk aplikasi lain.
Sumber : Physics and Chemistry of Lithium-Ion-type-Accumulators.
Namun dalam memahami proses interkalasi fungsi elektrolit cair perlu dimengerti. Proses interkalasi berjalan dengan lancar, jika bahan elektroda bersentuhan langsung dengan bahan elektrolit.
Bahan elektrolit cair dapat menembus celah – celah atau pori – pori dari bahan elektroda, baik anoda maupun katoda. Karena elektrolit berupa larutan, maka elektrolit sangat mudah mencapai permukaan serbuk elektroda.Pada penerapan elektrolit padat persyaratan tersebut harus tetap dipenuhi, dimana pertemuan permukaan serbuk elektroda dan elektrolit harus terjadi.Oleh karena itu komponen elektroda dibuat dengan komposisi beberapa persen merupakan pencampuran dari bahan elektrolit padat atau garam lithium.Sehingga reaksi redoks dapat berlangsung tepat di permukaan serbuk elektroda.
2.4.2. Separator Berpori
Penerapan elektrolit padat pada baterai lithium dipengaruhi oleh kehadiran pori di lembaran elektrolit tersebut. Bahan elektrolit seharusnya tidak mempunyai pori pada aplikasi di dalam sel baterai atau aplikasi lainnya. Oleh karena itu elektrolit tanpa pori harus dapat dibuat untuk memenuhi syarat tersebut.
Elektrolit yang dibuat merupakan bahan keramik berupa komposit dari bahan gelas soda lime silica dan LTAP. Bahan keramik selalu mempunyai pori
Gambar 2.5.konstruksi baterai telepon selulair dengan elektrolit cair. Separator berpori dapat dilewati oleh elektrolit cair dengan mudah melalui pori – porinya. Sehingga separator ini yang sebelumnya hanya berfungsi sebagai pembatas antara anoda dan katoda, dapat juga berfungsi sebagai elektrolit dengan pori – porinya terisi oleh elektrolit cair. Ion Li dapat dengan mudah mencapai anoda ataupun katoda, sebagaimana diilustrasikan di Gambar 2.5.(P.Bambang, 2008)
2.5 LiBOB
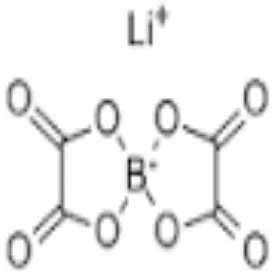
LiBOB
Gambar 2.6 struktur LiBOB
Struktur LiBOB berisi empat oksigen karbonil dan empat oksigen eter.Hanya ada muatan negatif tunggal yang didistribusikan diantara atom-atom sehingga ikatan koordinasinya rendah.Akibatnya, disosiasi LiBOB tinggi dan diharapkan dapat memberikan konduktivitas ionik yang baik.(Z.H. Chen, 2006)
Selama sepuluh tahun terakhir sejumlah jurnal dan makalah muncul di literatur menunjukan kinerja yang baik dari grafit anoda dan katoda logam transisi dalam larutan yang mengandung LiBOB dibandingkan dengan LiPF6.Hal ini menunjukan stabilitas termal larutan elektrolit untuk baterai ion berdasarkan LiBOB jauh lebih tinggi dari pada yang didasarkan pada garam Li lainnya (misalnya LiPF6, LiBFF4).(S.S.Zhang, 2002)
menggunakan gel elektrolit, yang harus menurunkan biaya baterai lithium-ion.(Science Direct)
2.6 X-Ray Difraction (XRD)
Sinar X ditemukan pertama kali oleh Wilhem Conrad Rontgen pada tahun 1895, di Universitas Wurtzburg Jerman. Karena asalnya tidak diketahui waktu itu maka disebut sinar X. Untuk penemuan ini Rontgen mendapat hadiah nobel pada tahun 1901, yang merupakan hadiah nobel pertama dibidang fisika. Sejak ditemukannya, sinar-X telah umum digunakan untuk tujuan pemeriksaan tidak merusak pada material maupun manusia. Disamping itu, sinar-X dapat juga digunakan untuk menghasilkan pola difraksi tertentu yang dapat digunakan dalam analisis kualitatif dan kuantitatif material, pengujian dengan menggunakan sinar-X disebut dengan pengujian sinar-XRD (X-Ray Diffraction)
XRD digunakan untuk analisis komposisi fasa atau senyawa pada material dan juga karakterisasi kristal. Prinsip kerja XRD adalah mendifraksi cahaya oleh kisi-kisi atau kristal ini dapat terjadi apabila difraksi tersebut berasal dari radius yang memiliki panjang gelombang yang setara dengan jarak antar atom yaitu sekitar 1 Angstrom. Radiasi yang digunakan berupa radiasi sinar-X elektron dan neutron.
Sinar-X merupakan foton dengan energi tinggi yang memiliki panjang gelombang berkisar antara 0,5 sampai 2,5 Angstrom. Ketika berkas sinar-X berinteraksi dengan suatu material, maka sebagian berkas akan diabsorbsi, ditransmisikan dan sebagian lagi dihamburkan terdifraksi. Hamburan yang terdifraksi inilah yang terdeteksi oleh XRD.
XRD merupakan teknik analisis non-destruktif untuk mengidentifikasikan dan menentukan secara kuantitatif tentang bentuk-bentuk berbagai Kristal, yang disebut dengan fase.Identifikasi diperoleh dengan membandingkan pola difraksi dengan sinar-X. XRD dapat digunakan untuk menentukan fase apa yang ada dalam bahan dan konsentrasi bahan-bahan penyusunnya. XRD juga dapat mengukur macam-macam keacakan dan penyimpangan Kristal.XRD juga dapat mengidentifikasi mineral-mineral yang berbutir halus seperti tanah liat(M.Hilmy, 2008).
Prinsip Kerja XRD
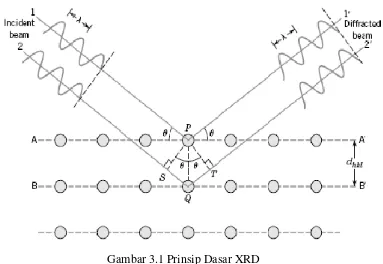
Dasar dari prinsip pendifraksian sinar yaitu difraksi sinar-X terjadi pada hamburan elastic foton-foton sinar-X oleh atom dalam sebuah kisi periodik. Hamburan monokromatis sinar-X dalam fasa tersebut memberikan interferensi yang konstruktif. Dasar dari penggunaan difraksi sinar-X untuk mempelajari kisi Kristal adalah berdasarkan persamaan Bragg :
n.λ = 2.d.sin θ ; n = 1,2,3,4…... (2.1) prinsip-prinsip dari difraksi adalah hasil dari pantulan elastik yang terjadi ketika
sebuah sinar berbenturan dengan sasaran serta pantulan sinar yang bersifat elastic. Fenomena dapat dijelaskan dengan Hukum Bragg.Sinar-X dalam pembangkitannya dideskripsikan oleh gambar dibawah ini dan didalam sinar-X terdapat dua jenis radiai yaitu sinar-X kontinyu dan karakteristik. Untuk alat XRD terdapat filter guna menyaring sinar-X kontinyu dan hanya meneruskan sinar-X karakteristik.
Prinsip dari alat XRD (X-Ray powder diffraction) adalah sinar-X yang
Gambar 2.7 Mekanisme Xray Diffraction
Seberkas sinar-X dengan panjang gelombang λ (cahaya monokromatik )
jatuh pada struktur geometris atom atau molekul dari sebuah Kristal pada sudut
datang θ. Jika beda lintasan antara sinar yang dipantulkan dari bidang yang
berturut-turut sebanding dengan n panjang gelombang, maka sinar tersebut mengalami difraksi. Peristiwa difraksi mungkin terjadi karena jarak antaratom dalam Kristal dan molekul berkisar antara 0,15 hingga 0,4 nm, yang bersesuaian dengan spektrum gelombang elektromagnet pada kisaran panjang gelombang sinar-X dengan energy foton antara 3 hingga 8 keV. Sesuai dengan hukum Bragg,
dengan memvariasikan sudut θ diperoleh lebar antar celah yang berada dalam
bahan polikristalin.Kemudian, posisi sudut dan intensitas puncak hasildifraksi digrafikkan dan diperoleh pola yang merupakan karakteristik sampel. Setiap Kristal memiliki pola XRD yang berbeda satu sama lain yang bergantung pada struktur internal bahan. Pola XRD ini merupakan karakteristik dari masing-masing bahan sehingga disebut sebagai ‘fingerprint’ dari suatu material atau
bahan Kristal. (M.Hilmy, 2008)
2.7 Charging Discharging
charging dan discharging, karena jumlah arus elektron yang etrsimpan dan
tersalurkan sebanding dengan jumlah ion lithium yang bergerak.
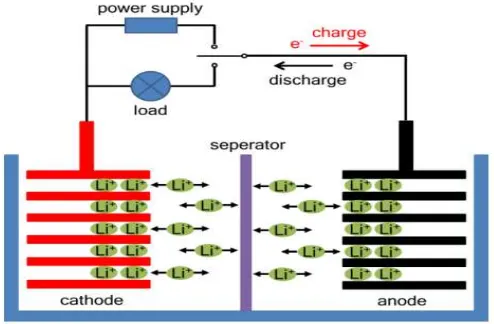
Pada proses charging, material katoda akan terionisasi, menghasilkan ion lithium bermuatan positif dan bermigrasi ke dalam elektrolit menuju komponen anoda, sementara elektron yang diberikan akan dilepaskan bergerak melalui rangkaian luar menuju anoda. Ion lithium ini akan masuk kedalam anoda melalui mekanisme interkalasi seperti terlihat yang terlihat pada Gambar 2.8 saatdischargingakan terjadi aliran ion dan elektron dengan arah kebalikan dari
proses charging.
Gambar 2.8 Struktur dan prinsip kerja.
Suatu material elektrokimia dapat berfungsi baik sebagai elektroda anoda maupun katoda bergantung pada pemilihan material (material selection) yang
akan menentukan karakteristik perbedaan nilai tegangan kerja (working voltage)
dari kedua material yang dipilih. Potensial tegangan yang terbentuk antara elektroda anoda dan katoda bergantung dari reaksi kimia reduksi-oksidasi dari bahan elektroda yang dipilih.
2.8. FTIR (Fourier Transform Infrared)
Spektroskopi FTIR (FourierTransform Infrared) merupakanspektroskopi
sampel sebagai fungsi panjang gelombang.Spektrum inframerah yang diperoleh kemudian diplot sebagai intensitas fungsi energi, panjang.gelombang (µm) atau bilangan gelombang (cm-1).
Pengujian FTIR memiliki 3 fungsi yaitu (i) untuk mengidentifikasi material yang belum diketahui (ii) untuk menentukan kualitas atau konsistensi sampel, dan (iii) untuk menentukan intensitas suatu komponen suatu komponen dalam suatu campuran. FTIR merupakan pengujian kuantitatif untuk sebuah sampel.Ukuran puncak (peak) data FTIR menggambarkan jumlah atau intensitas
senyawa yang terdapat didalam sampel.FTIR menghasilkan data berupa grafik intensitas dan frekuensi .intensitas menunjukan tingkatan jumlah senyawa sedangkan frekuensi menunjukkan jenis senyawa yang terdapat dalam sebuah sampel.(Y.Yuanyuan, 2010)
Atom-atom dalam suatu molekul tidak diam melainkan bervibrasi. Bila radiasi infra merah yang kisaran energinya sesuai dengan frekuensi vibrasi rentangan (stretching) dan vibrasi bengkokan (bending) dari ikatan kovalen dalam
BAB III
METODOLOGI PENELITIAN
3.1 Bahan dan Alat Penelitian
3.1.1. Bahan Penelitian
a. Serbuk Asam Oksalat dihidrat (H2C2O4.2H2O) b. Serbuk Asam Borat (H3BO3)
c. Serbuk Litium Dihidroksida (LiOH)
3.1.2. Alat Penelitian
Alat-alat yang dipergunakan dalam pembuatan elektrolit LiBOB adalah :
a. Mortar dan alu
Berfungsi untuk mencampur, menghaluskan, dan mengaduk sampel yang masih berbentuk padatan/Kristal.
b. Spatula dan sendok
Berfungsi untuk mengambil/memindahkan sampel bahan
c. Plastik sampel
Berfungsi sebagai tempat sampel
d. Stopwatch
Berfungsi untuk menghitung waktu
e. Timbangan analitik
Berfungsi untuk menimbang massa sampel
f. Boat/perahu
Berfungsi sebagai tempat untuk pengambilan sampel.
g. Lemari asam / Tabung Asam
Berfungsi sebagai tempat reaksi kimia yang menggunakan bahan yang mudah menguap, tempat transfer bahan kimia.
h. Aluminium foil
Berfungsi untuk menutup wadah yang telah berisi bahan sampel
Berfungsi untuk mengeringkan sampel dan menjaga suhu pada sampel.
j. Cawan porselen / gelas kecil
Berfungsi sebagai wadah untuk menyimpan sampel saat dioven.
k. Porselen dan crucible
3.2 Proses Pembuatan LiBOB
Dipanasi 60oCDitahan 2 Jam pada vacum furnace
Dipanasi 70oCDitahan 6 jam pada Vacum furnace
3.3 Prosedur Pembuatan Sampel
3.3.1 Penentuan Komposisi Bahan
- Terlampir
3.3.2 Proses Pencampuran dan Penggerusan Serbuk
Tahapan yang dilakukan setelah perhitungan adalah proses pencampuran dan penggerusan sampel. Proses penggerusan ini dilakukan dengan menggunakan bahan-bahan asam oksalat hidrat (H2C2O4.2H2O), litium hidroksida (LiOH), asam borat(H3BO3). Tahapan dalam proses ini diawali dengan menyiapkan ketiga bahan baku, kemudian menimbang setiap bahan sesuai dengan komposisi bahan dari hasil perhitungan dengan rasio mol sebesar 2:1:1 yaitu Asam Oksalat sebanyak 25.9 gram ,Litium Hidroksida
sebanyak 2.4 gram, Asam Borat sebanyak 6.3 gram. Lithium Hidroksida dan Asam Oksalat dicampur menjadi satu lalu digerus/dihaluskan dengan mortar
selama 10 menit searah dengan jarum jam di tabung asam. Penggerusan dilakukan hingga semua bahan menyatu dan tercampur secara merata.Setiap sampel yang telah dicampur kemudian diberi label tujuannya agar dapat diketahui mana sampel A1, A2 dan A3, kemudian disimpan didalam oven dengan suhu 600C selama 2 jam.Setelah itu sampel diambil dan dicampur
dengan Asam Borat. Sampel tersebut dicampur menjadi satu lalu
3.3.3 Pembakaran Dengan Perlakuan Khusus
Tahapan selanjutnya adalah proses pembakaran. Proses pembakaran ini dilakukan di Laboratorium Penelitian Pusat Fisika (P2F) serpong denganmenggunakan Oven vacuum dengan temperatur pembakaran
yang bervariasi dan penahanan.
Pada sampel LiBOB A1 proses pembakaran dilakukan dengan tahap sebagai berikut :
I. Suhu 600C → dialiri N2(g) 1 menit → ditahan 2 jam II. Suhu 700C → dialiri N2(g) 1 menit → ditahan 6 jam
III. Suhu 1200C, 110oC, 100oC → dialiri N2(g) 1 menit → ditahan 3 jam
3.4 Uji Karakteristik XRD
Pengamatan struktur kristal dengan XRD dilakukan sebagai tahap awal karakterisasi untuk mengidentifikasi sejauh mana fasa yang terbentuk seperti yang diinginkan dan fasa lainnya yang tidak diharapkan. Analisa dilakukan dengan memanfaatkan fasilitas XRD di LIPI Serpong.
Sinar-X adalah gelombang elektromagnetik yang medan listriknya berubahsecara sinusoidal pada setiap waktu dan setiap titik berkas (beam) nya.
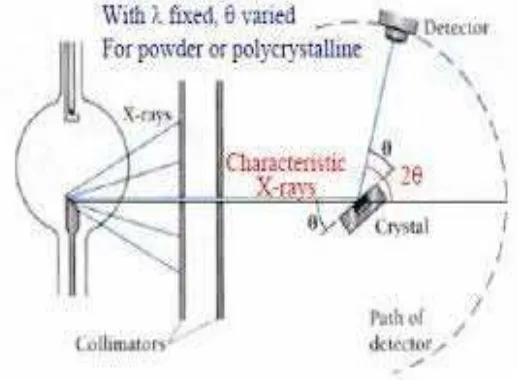
Gambar 3.1 Prinsip Dasar XRD
Proses pengujian XRD adalah sebagai berikut :
1. (A) adalah generator tegangan tinggi berfungsi sebagai catu daya sinar-X (B)
2. Sinar-X dari sumber (B) didifraksi oleh sampel menjadi berkas konvergen yang terfokus dicelah E, kemudian dimasukka alat pencacah (F).
3. (D) dan (F) kemudian dihubungkan secara mekanis, jika F berputar sebesar 2θ maka D akan berputar sejauh θ.
4. Intesitas sinar-X yang dimasukan dalam alat pencacah (F) dikonversikan dengan alat kalibrasi (G) dengan signal tegangan yang sesuai dan direkam oleh alat rekam (H) dalam bentuk kurva.
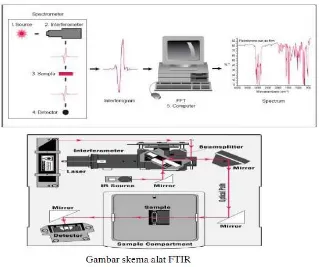
3.5 Uji FTIR (Fourier Transform Infrared)
Gambar 3.2 menunjukkan prinsip kerja FTIR.
Proses pengujian FTIR adalah sebagai berikut :
1. Radiasi sinar infra merah ditembakkan ke arah sebuah sampel.
2. Sebagian radiasi infra merah tersebut diserap (diadsorpsi) oleh sampel dan sebagian lagi diteruskan (ditransmisikan) melalui sampel tersebut yang menghasilkam sebuah spektrum.
3. Spektrum infra merah tersebut dihasilkan dari pentransmisian cahaya yang melewati sampel.
4. Pengukuran intensitas cahaya dengan detektor dan dibandingkan dengan intensitas tanpa sampel sebagai fungsi panjang gelombang. 5. Spektrum infra merah yang diperoleh kemudian diplot sebagai
3.6 Uji Charge-Discharge
Untuk mendapatkan performasi sebuah baterai maka diperlukan pengujian charge/discharge sehingga akan didapatkan besar kapasitas sel baterai. Pada penelitian pengujian dilakukan dengan membuat sistem pengujian charging dan discharging.Gambar 3.3 memperlihatkan desain skematik rangkaian elektronik pengujian sel baterai. Data selama pengujian sel direkam dengan Dicologer ADC20 yang memiliki kemampuan merekam hingga 50 ms yang terdiri dari 8 channel input. Multimeter dibuat sebagai pengatur waktu switch antara Charge-Discharge.
Gambar 3.3.Gambaran skema konfigurasi elektronik pengujian karakterisasi
charge/discharge selbaterai.
Proses pengujian Charge-Discharge adalah sebagai berikut : 1. Pengaturan waktu T1 dilakukan untuk waktu charging.
2. T2 untuk mengaturwaktu discharging.
3. ΔT untuk mengatur waktu jeda antara charging dan discharging.
5. Data pengukuran dapat direkam setiap 50-500 ms.
6. Pengaturan T diperlukan untuk mengamati tegangan baterai Vocv. 7. Data pengukuran dapat direkam setiap 50-500 ms.
8. Sebagai pembanding, sistem pengujianini diaplikasi untuk mengamati karakteristik sebuah baterai handphone yang banyak beredar dipasaran. 9. Sampel baterai komersil Nokia BL-6C 1100 mAh diambil sebagai
sampel uji kapasitas baterai.Kapasita 1C dari sel baterai ditentukan 1000 mAh, sedikit di bawah label yang menunjukkan 1100 mAh. 10.Perhitungan kapasitas dilakukan dengan program excel sederhana.
3.7 Uji CV ( Cyclic Voltammetry)
Siklik voltammogram merupakan suatu pengukuran untuk menentukan nilai kapasitansi sel elektrokimia dari material karbon dengan laju scan dari tegangan awalsampai tegangan akhir. Siklis voltammogram (CV) dapat digunakan sebagai pengatur aliran ion dalam proses perubahan sifat nanopartikel dan karakterisasi sifat potensial suatu bahan, selain itu juga dapat digunakan untuk mengukur sifat kapasistansi superkapasitor.Pengambilan data diperlihatkan pada Gambar 3.4
Untuk mengukur arus suatu sel superkapasitor Elektrolit LiBOB A1, A2 dan A3 dimulai dari :
1. Menghubungkan sel superkapasitor ke alat siklik voltamogram.
2. sel superkapasitor memiliki dua kutup yang dihubungkan ke alat sebagai pendeteksi tegangan pada sel superkapasitor.
3. Keluaran dari sel superkapasitor berupa arus analog yang kemudian diperkuat oleh penguat analog sehingga dapat dikonverter ke ADC dan selanjutnya diproses ke mikrokontroler dan di antarmuka pada computer. 4. Larutan yang akan diukur dimasukan kedalam sel voltametri yang telah
disiapkan. Larutan terdiri dari larutan sampel dengan larutan pembanding standart dengan pendukung yang jenis konsentrasinya sama.
5. Alat dirangkai dalam keadaan tertutup.
6. Dilakukan proses dearasi dengan proses pengadukan.
7. Melakukan proses deposisi dengan pengadukan dengan potensial tetap yang harganya tertentu (dapat berharga (+) atau (-) ).
8. Konsentrasi yang terdekomposisi pada elektroda tergantung pada
kecepatan pengadukan.
9. Waktu deposisi yang digunakan tergantung pada konsentrasi elektrolitnya. 10.Hasil pengukuran yang diperoleh perubahan besaran arus dan tegangan. 11.Perekam datanya berupa kurva arus Vs potensial yang disebut voltagram. 12.Perubahan arus di sebabkan oleh variasi tegangan (V) sehingga hasil
BAB IV
HASIL DAN PEMBAHASAN
4.1 HasilPengujianKarakterisasi XRD
Analisastruktur Kristal LiBC4O8 ( Lithiumbisoksalato borat) dilakukan
dengan menggunakanalatXrayDiffractometer(XRD) yang
bertujuanuntukmengetahuifasa-fasa yang terbentukpadasampelujidalampembuatansenyawa LiBC4O8 (LIBOB). Proses
pembakaran merupakan prosespembentukanfasebarumelalui proses
pemanasandimanapadasaatterjadireaksikomponenpembentukmasihdalambentukpa datdaricampuranserbuk. Berikut ini hasil uji XRD pada sampel LiBOB.
Grafik Hubungan Antara Intensity Vs 2-Theta
Gambar 4.1 Difraktogramsinar-X serbukLiBOB A1
Tabel 4.1. Data HasilAnalisa XRD
Tabel 4.1.IndentifikasiSinar- X pada T = 1200C PadaSampelLiBOB A1
No. 2 θ Dobs (Å) Dref (Å) Fasa PDF 4 No. hkl
Grafik Hubungan Antara Intensity Vs 2-Theta
Gambar 4.2.Difraktogramsinar-X LiBOB A2
Tabel 4.2 IdentifikasiSinar-X pada T = 1100CPadaSampelLiBOB A2
No 2θ Dobs (Å) Dref (Å) Fasa PDF 4 No. Hkl
Dari hasil analisa XRD pada gambar 4.2 terlihat bahwa sampel pada temperature 1100C dengan penahanan 3 jam tanpa pengaliran gas Nitrogen memperlihatkan bahwa belum membentuk LiBOB yang diinginkan karena sampel yang terbentuk masih dalam fasa sasolite (HBO2) dan Litium Karbonat (Li4CO4).
Grafik Hubungan Antara Intensity Vs 2-Theta
Gambar 4.3 Difraktogramsinar-X LiBOB A3
Tabel 4.3 Identifikasi Sinar-X pada T = 1000C PadaSampelLiBOB A3
No 2θ Dobs (Å) Dref (Å) Fasa PDF 4 No. Hkl
Dari hasil Analisa XRD pada gambar 4.3 Terlihat bahwa sampel pada temperature 1000C dengan penahanan 3 jam tanpa pengaliran gas Nitrogen
memperlihatkan bahwa belum membentuk LiBOB yang diinginkan karena sampel yang terbentuk masih dalam fasa Karbon Monoksida (CO) dan Litium Karbonat (Li4CO4).
4.2 HasilPengujianSpektroskopi FTIR (Fourier Transform Infrared)
Dalam suatu sintesis diperlukan suatu karakterisasi struktur untuk mengetahui apakah senyawa yang kita harapkan berhasil terbentuk atau tidak.Karakterisasi gugus fungsi LiBOB A1, A2 & A3 ditentukan dengan alat FTIR (Fourier Transform Infra Red) dan hasil pantuan gugu sfungsi disajikan pada gambar.
Grafik Hubungan Antara %Transmittance Vs Wavenumbers(cm-1)
Gambar 4.4 Spektrum FTIR dariLiBOB A1
Grafik Hubungan Antara %Transmittance Vs Wavenumbers(cm-1)
Gambar 4.5 Spektrum FTIR dariLiBOB A2
Grafik Hubungan Antara %Transmittance Vs Wavenumbers(cm-1)
Gambar 4.6 Spektrum FTIR dari LiBOB A3
Table 4.4 FTIR PuncakutamaLiBOBdanGugusfungsi yang terjadi.
Wavenumber (cm-1)
A1 A2 A3 Possible Assignment
1811 1809 1809 C=O O terombangambingdalamfasa
1779 1798 1795 1795 C=O Obersosialisasikeluardarifase
1750 1768 1768 1768 C=O meregang
1640 1630 1630 1630 COO Asimetrismeregang
1442 1447 1447 1447 COO Simetrismeregang
1372 1350 1380 B-O Meregang
1297 1303 1303 1303 C-O-B-O-C Meregang
1215 1227 1230 1230 C-O-C Asimetrismeregang
1070 1085 1082 1082 O-B-O Simetrismeregang
999 991 991 997 O-B-O Simetrismeregang
708 712 712 712 COO Merusakbentuk
604 611 617 614 B-O Merusakbentuk
481 488 488 BO4Ikatanbaik
Dari hasi lAnalisa Spektrum FTIR Pada Gambar 4.2 terlihat bahwa LiBOB A1, A2 dan A3 terdiri dari beberapa puncak kuat yaitu daerah 3511.37, 1798.20, 1795.26 1630.12, 1447.91, 712.02 Cm-1 (aragonite). Spektrum FTIR LiBOB A1, A2 dan A3 memperlihatkan adanya puncak serapan didaerah bilangan gelombang berturut-turut 1768.77 Cm-1Stretch (C=O), 1630.12 Cm-1Asymmetric stretch
4.3 Hasil Pengujian Charge-Discharge
Pengujianselbateraidilakukandengan proses charging dandischarging.Agar
dapatdiketahuibesarnyakapasitaspada sel.
Grafik Hubungan Antara Voltage(V) Vs Capacity (mAHr/g)
Gambar 4.7GrafikDischarge LiBOB A1, A2 dan A3.
First discharging LFP vs Graphite, Pembanding LiPF6 = ~80 mAh/g,
A1 = ~27 mAh/g,
A2 = ~ 2 mAh/g,
Grafik Hubungan Antara Voltage(V) Vs Capacity (mAHr/g)
Gambar 4.8 Grafik Charge-Discharge LiBOB A1.
Grafik Hubungan Antara Voltage(V) Vs Capacity (mAHr/g)
Grafik Hubungan Antara Voltage(V) Vs Capacity (mAHr/g)
Gambar 4.10 Grafik Charge-Discharge LiBOB A2
4.4 HasilPengujian CV ( Cyclic Voltammetry)
Pengujian CV bertujuanuntukmengetahuinilaikapasitifelektrokimiadari elektrolit LiBOB.Gambar 4.1 di bawahiniadalahhasiluji CV dari elektrolit LiBOB
A1, A2 dan A3 pada temperatur 120oC.110oC dan 100oC.
Grafik Hubungan Antara Current (mA) Vs Voltage (V)
Gambar 4.11 Grafik CV LiBOB A1, A2 dan A3.
Working voltage LFP vs C dalam LiPF6 = (3.8+2.8)/2 = 3.3
A1 = (3.6+2.85)/2 V = 3,225
A2= (3.8 +2.4)/2 V = 3,1
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan Analisis dan Pembahasan pada Bab sebelumnya dapat diambil kesimpulan :
1. Dari hasil analisa XRD menunjukan proses pembuatan dengan furnace vakum bahwa sampel LiBOB masih banyak menghasilkan fasa yang lain dan senyawa LiBOB yang diinginkan masih belum terbentuk.
2. Dari hasil analisa FTIR terbentuknya gugus fungsi senyawa
LiB(C2O4)2 ditandai dengan munculnya pitaserapan C=O ( meregang ) , COO (Asimetris meregang), COO (simetris meregang), C-O-B-O-C (Meregang), dan COO (Merusak bentuk).
3. Pada sampel dinyatakan bahwa suhu optimal dari ketiga sampel itu adalah suhu 120o C, karena dapat dilihat dari tegangannya yaitu 3,225V dan terlihat juga dari kapastiasnya yaitu 27 mAh. Maka pembuatan dengan furnace vacum dengan suhu terbaik 120oC sama seperti menggunakan furnace lainnya, maka tidak perlu dilakukan penurunan suhu lagi.
5.2. Saran
1. Diharapkan kepada peneliti selanjutnya lebih teliti dalam penggerusan sampel.
2. Diharapkan kepada peneliti selanjutnya agar dapat menikkan suhu pada pembakaran sampel.
DAFTAR PUSTAKA
C.K. Xu, S.S Zhang, T.R Jow, W. Xxu, C.A.L. Angel. 2002. Electrochem. Solid- State Lett 5 A26-A29.
Fadhel, A.Kh.A. Azees. 2009. “Lithium Bis(Oxlato)Borate-Based Electrolyte For Lithium-Ion Cells”. North Carolina.
Gao Hong-Quan, Zhang Zhi-An, Li Jie,Liu Ye-Xiang. 2008. “Structur Characte- rization andelectrochemical properties of new lithium salt LiODFB for
electrolyte of lithium ion batteries” J. Cent.South Univ. Technol. 15:
830−834.
Heitner, K.L. 2000.“The Search for the Better Polymer Electrolite”. J. Power
Source 89.128-131.
K. Amine, J. Liu, S. Kang, I.Belharouak, Y. Hyung, D.Vissers and G. Heriksen. J. 2002. Power Sources 192, PP. 14-19 [SD-008].
M. Hilmy, Alfarugi. 2008. “Pengaruh Konsentrasi Hidrogen”. FT. UI
Prihandoko, Bambang, dkk. 2008. “Pemanfaatan Soda Sebagai Baterai Lithium”. FT UI.
Sasaki, Y. Handa, M. Sekiya, S.Katsuji K. Kyohei. 2001. ”Aplication to Lithium Battery Electrolite of Lithium Chelate Compound With Boron”
.
JournalOf Power Sources. 97/98 : 561-565.
W. XU, C.A. Angell. 2001. “Electrochem Solid-State Lett 4 E1”.
Y. Yuanyuan, L. Bin, W. Xiaoguang, Z. Yingxiang, Jingxiang. 2010. Chemical Engineering Journal. 162. 738-742.
Z. H. Chen and J. R. Dahn. 2011. “Electrochem. Solid-State Lett 4 E1”.
LAMPIRAN 1
Bahan dan Peralatan Penelitian
1. Bahan
Asam Oksalat Asam Borat
2. Alat
Mortar dan Alu Spatula dan Sendok
Plastik Sampel Timbangan Analitik
Lampiran 2
Perhitungan Komposisi Bahan
Bahan-bahan kimia yang digunakan dalam eksperimen ini adalah mulai dari Asam Oksalat (±99,5%), Litium hidroksida (±95,5%) bahan Pa dan Teknis, dan Asam borat (±95,5%). Selanjutnya dicampur pada rasio mol sebesar 2:1:1.
Reaksi kimia yang terjadi pada sampel adalah
2H2C2O4.2H2O + LiOH + H3BO3→ LiB (C2O4)2 + 8H2O
Dimana massa atom setiap unsur adalah
Ar Li = 7, Ar O = 16, Ar B = 11, Ar H = 1, Ar C = 12
Untuk pembuatan 20 gr LiBOB diperlukan
n
=
�������
=
20 ��
194 ��/ ���
= 0,103
Jadi, untuk pembuatan 20gr LiBOB diperlukan
H3BO3 = 62 gr/mol x 0.103 mol = 6.386 gram
LiOH = 24 gr/mol x 0.103 mol = 2.472 gram
H2C2O4.2H2O = 126 gr/mol x 0.103 mol = 12.978 gram
Maka bahan baku untuk membuat 20 gr LiBOB dengan perbandingan 2:1:1 (2mol H2C2O4.2H2O : 1 mol H3BO3 : 1 mol LiOH) adalah sebagai berikut :
H2C2O4.2H2O = 126gr/mol x 0.103 mol = 12.978 gr x 2 mol = 25.956 gram
H3BO3 = 62 gr/mol x 0.103 mol = 6.386 gram
![Gambar 2.1.Perpindahan ion lithium dari katoda ke anoda [46].](https://thumb-ap.123doks.com/thumbv2/123dok/581102.69078/19.595.158.469.321.531/gambar-perpindahan-ion-lithium-dari-katoda-ke-anoda.webp)