MAKALAH KULTUR SEL
MAKALAH KULTUR SEL
PEMICU I
PEMICU I
PENGEMBANGAN KULTUR SEL DALAM ERA
PENGEMBANGAN KULTUR SEL DALAM ERA
KEMAJUAN BIOTEKNOLOGI
KEMAJUAN BIOTEKNOLOGI
Disusun untuk Memenuhi Tugas Mata Kuliah Kultur Sel
Disusun untuk Memenuhi Tugas Mata Kuliah Kultur Sel
OLEH OLEH KELOMPOK 4 KELOMPOK 4
EVIANA
(1406566685)
EVIANA
(1406566685)
HARIS
HARIS ABDUL
ABDUL AZIS
AZIS
(1406605755)
(1406605755)
MUHAMMAD
MUHAMMAD GALIH
GALIH
(1406533554)
(1406533554)
RETNO
RETNO WIDYATI
WIDYATI
(1406533491)
(1406533491)
YASMIN
YASMIN EKAPRATIWI
EKAPRATIWI
(1406533610)
(1406533610)
PROGRAM STUDI TEKNOLOGI BIOPROSES
PROGRAM STUDI TEKNOLOGI BIOPROSES
DEPARTEMEN TEKNIK KIMIA FAKULTAS TEKNIK
DEPARTEMEN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS INDONESIA
UNIVERSITAS INDONESIA
DEPOK 2016
DEPOK 2016
KATA PENGANTAR
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa karena atas rahmat dan Puji syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa karena atas rahmat dan karunia-Nya penulis dapat menyelesaikan makalah Pemicu I :Pengembangan Kultur Sel karunia-Nya penulis dapat menyelesaikan makalah Pemicu I :Pengembangan Kultur Sel Dalam Era Kemajuan Bioteknologi.
Dalam Era Kemajuan Bioteknologi.
Makalah ini membahas mengenai kultur sel, meliputi teknik-teknik yang digunakan Makalah ini membahas mengenai kultur sel, meliputi teknik-teknik yang digunakan dalam kultur sel, faktor yang mempengaruhi kultur sel, media kultur sel, dan aplikasi kultur dalam kultur sel, faktor yang mempengaruhi kultur sel, media kultur sel, dan aplikasi kultur sel. Selain itu, makalah ini membahas tentang tanaman jati emas yang dikembangkan dengan sel. Selain itu, makalah ini membahas tentang tanaman jati emas yang dikembangkan dengan teknik kultur jaringan, syarat yang harus dimiliki untuk kultur jaringan, keuntungan yang teknik kultur jaringan, syarat yang harus dimiliki untuk kultur jaringan, keuntungan yang diperoleh, dan cara pengoptimalannya.
diperoleh, dan cara pengoptimalannya.
Pada akhirnya, penulis menyadari bahwa penulis tidak dapat terlepas dari kesalahan Pada akhirnya, penulis menyadari bahwa penulis tidak dapat terlepas dari kesalahan dalam menulis makalah ini. Oleh karena itu penulis mengucapkan terima kasih kepada dosen dalam menulis makalah ini. Oleh karena itu penulis mengucapkan terima kasih kepada dosen mata kuliah Kultur Sel yaitu
mata kuliah Kultur Sel yaitu Ibu Dr. Dianursanti S.T., M.T.Ibu Dr. Dianursanti S.T., M.T. serta asisten dosen yang telah serta asisten dosen yang telah membimbing dan mengarahkan penulis. Penulis berharap, makalah ini dapat menerangkan membimbing dan mengarahkan penulis. Penulis berharap, makalah ini dapat menerangkan konsep kultur sel dengan baik kepada pembaca.
konsep kultur sel dengan baik kepada pembaca.
Depok, 27 September 2017 Depok, 27 September 2017
Tim Penulis Tim Penulis
DAFTAR ISI
DAFTAR ISI
Halaman
Halaman Judul
Judul
ii
Kata
Kata Pengantar
Pengantar
1
1
Daftar
Daftar Isi
Isi
2
2
Daftar
Daftar Gambar
Gambar
3
3
Daftar
Daftar Tabel
Tabel
3
3
BAB
BAB I
I Pendahuluan
Pendahuluan
Latar
Latar Belakang
Belakang
4
4
Tujuan
Tujuan Pembelajaran
Pembelajaran
5
5
Peta
Peta Konsep
Konsep
6
6
BAB
BAB II
II Isi
Isi
Pembahasan
Pembahasan nomor
nomor 1
1
7
7
Pembahasan
Pembahasan nomor
nomor 2
2
7
7
Pembahasan
Pembahasan nomor
nomor 3
3
8
8
Pembahasan
Pembahasan nomor
nomor 4
4
8
8
Pembahasan
Pembahasan nomor
nomor 5
5
10
10
Pembahasan
Pembahasan nomor
nomor 6
6
12
12
Pembahasan
Pembahasan nomor
nomor 7
7
15
15
Pembahasan
Pembahasan nomor
nomor 8
8
22
22
BAB III Penutup
BAB III Penutup
Kesimpulan
27
Kesimpulan
27
Saran
27
Saran
27
Daftar
DAFTAR GAMBAR
Gambar 1 Media Kultur Sel ... 10
Gambar 2 Jenis pengaduk pada labu spinner ... 17
Gambar 3 Sel beku yang nantinya akan dilelehkan. ... 21
Gambar 4 Teknik Mikropropagasi: dari eksplan diinisiasi langsung untuk
membentuk multiplikasi tunas; eksplan dapat berasal dari jaringan meristem,
pucuk atau tunas samping . ... 22
Gambar 5
Seleksi In Vitro ... 23
Gambar 6
Contoh-contoh metabolit sekunder ... 24
Gambar 7 Produksi antibiotik dari e-coli ... 25
Gambar 8 Stem Cell ... 26
DAFTAR TABEL
Tabel 1
Kandungan Utama Serum dan Konsentrasinya ... 9
Tabel 2 Adherent Culture vs. Suspension Culture ... 13
BAB I
PENDAHULUAN
1.1 Latar Belakang
Kultur sel merupakan salah satu komponen penting dalam aplikasi-aplikasi yang akan dihadapi oleh mahasiswa program Teknologi Bioproses kedepannya. Seperti yang kita ketahui, mahasiswa program Teknologi Bioproses berfokus pada pengolahan/penggunaan makhluk hidup/ sel makhluk hidup seperti sel alga, sel bakteri, dsb. Karena itulah pengembangbiakan sel-sel tersebut sangat penting untuk mampu melakukan proses produksi dengan menggunakan sel-sel tersebut. Oleh karena itulah, kemampuan mengkultur sel ini diangkat menjadi salah satu keahlian utama yang harus dikuasai oleh mahasiswa Teknologi Bioproses agar dapat diaplikasikan di lingkungan kerja.
Di masa modern, kebutuhan pasar untuk bibit varietas unggul sangat tinggi.Masyarakat menginginkan mendapatkan sesuatu dengan kualitas tinggi namun dengan harga yang murah juga. Karena bibit dari suatu varietas unggul yang dihasilkan jumlahnya sangat terbatas sedangkan bibit tanaman yang dibutuhkan jumlahnya sangat banyak, dibutuhkanlah proses penyediaan bibit unggul. Salah satu teknologi harapan yang banyak dibicarakan dan telah terbukti memberikan keberhasilan adalah melalui teknik kultur jaringan. (Indriyanto, G., 1987)
Kultur jaringan adalah metode perbanyakan vegetatif dengan menumbuhkan sel, organ atau bagian tanaman dalam media buatan secara steril dengan lingkungan yang terkendali. Teknik kultur jaringan merupakan suatu metode mengisolasi bagian tertentu dari tanaman seperti protoplas, sel, sekelompok sel, jaringan dan atau organ yang kemudian menumbuhkannya pada kondisi aseptik yang terkontrol sehingga bagian-bagian tersebut dapat tumbuh dan beregenerasi menjadi tanaman yang lengkap. (Ahloowalia B 1986)
Salah satu kebutuhan masyarakat adalah bahan baku untuk pembuatan furnitur, rumah, dll. Untuk membuat furniture yang berkualitas tinggi, biasanya produsen menggunakan pohon jati emas.Jati emas dikatakan memiliki tekstur yang lebih mudah dibentuk, namun tetap kuat (Anonim, 2011). Jati emas jelas menjadi primadona sebagai budidaya tanaman semenjak ia terlahir dari riset laboratorium terhadap sistem kultur jaringan
dari bibit unggul. Keunggulan yang didapat dari jati emas antara lain tidak membutuhkan lamanya waktu panen.
Pada makalah kali ini, pengetahuan mengenai kultur jaringan, termasuk kelebihan kultur jaringan, perbedaannya dengan makhluk hidup yang tumbuh secara alami, pembuatan
media buatan untuk kultur, faktor-faktor pendukung dalam kultur jaringan, metode kultur jaringan, dan aplikasi kultur jaringan.
1.2 Tujuan Pembelajaran
1. Mengetahui alasan dan keunggulan kultur jaringan
2. Mengetahui perbedaan produk hasil kultur jaringan dengan produk yang tumbuh secara alami
3. Mengetahui sifat yang harus dimiliki sebagai syarat untuk dapat dikultur
4. Mampu mengidentifikasi dan membedakan jenis-jenis media kultur beserta kelebihan dan kekurangannya
5. Mengetahui cara pembuatan media buatan
6. Mengetahui dan memahami metode-metode/teknik-teknik kultur jaringan
BAB II
PEMBAHASAN
1. Dapatkan anda menjelaskan mengapa tanaman jati emas banyak dikembangkan dengan teknik kultur jaringan? Bagaimana bila ditumbuhkan secara alamiah?
Keunggulan yang didapat dari jati emas antara lain tidak membutuhkan lamanya waktu panen. Hal ini dicapai dengan inovasi teknologi kultur jaringan,panen yang di masa silam mesti menunggu sekitar 40 hingga 50 tahun, kini hanya perlu 15 tahun, dan bahkan bisa panen hanya dalam kurun 7 tahun seusai pembibitan.Saat mencapai 7 tahun, jati emas
memiliki lingkar pohon 27 cm dan tinggi pohonnya bisa sampai 16 meter. Di samping itu, jati emas tidak merepotkan hal penanaman juga proses pemeliharaannya pun terbilang
mudah, apalagi karena jati emas tidak rawan penyakit. Bentuk batang hasil kultur jaringan lebih lurus dan silindris, juga pertumbuhan pohon relatif seragam. Untuk mencapai semua keunggulan itulah kultur jaringan dilakukan pada tanaman jat i emas.(Anonim, 2011)
Apabila ditumbuhkan secara alamiah, bibit jati akan tumbuh dengan kelajuan pertumbuhan yang lama, sehingga akan mempersulit memenuhi kebutuhan pasar akan kayu jati. Ketersediaan jati yang tumbuh secara alami jumlahnya semakin menurun akibat dari tidak adanya keseimbangan antara penebangan dan penanaman kembali dan akan membuat kerusakan lingkungan. (Seika, 2011)
2. Apakah semua tanaman dapat dibudidayakan dengan kultur jaringan? Sifat apa yang dimiliki tanaman sehingga dapat dilakukan kultur jaringan?
Pelaksanaan teknik kultur jaringan tanaman ini berdasarkan teori sel seperti yang dikemukakan oleh Schleiden, yaitu bahwa sel mempunyai kemampuan autonom, bahkan mempunyai kemampuan totipotensi. Totipotensi Sel, yaitu bahwa setiap sel memiliki kemampuan untuk beregenerasi membentuk individu baru pada kondisi yang sesuai. Suatu sel atau irisan jaringan tanaman disebut eksplan.
Syarat-syarat (Ahlowalia, 2016) :
1. Jaringan tersebut sedang aktif pertumbuhanya,diharapkan masih terdapat zat tumbuh yang masih aktif sehingga membantu perkembangan jaringan selanjutnya
2. Eksplan yang diambil berasal dari bagian daun, akar, mata tunas, kuncup, ujung batang, dan umbi
3. Eksplan yang diambil dari bagian yang masih muda (bila ditusuk pisau akan terasa lunak sekali.
4. Memiliki sifat induk yang baik yang diinginkan
3. Dapatkah anda menjelaskan keunggulan dari dilakukannya kultur jaringan ini?
Tujuan dari teknik kultur jaringan ini diantaranya
1. Memperbanyak tanaman dalam jumlah yang banyak dalam waktu singkat; menghasilkan varietas-varietas baru;
2. Memodifikasi genotipe tanaman pada kegiatan pemuliaan tanaman;
3. Mengeliminasi penyakit tanaman agar diperoleh bibit yang bebas penyakit
Keunggulan dari teknik kultur jaringan ini diantaranya
1.
Mendapatkan tanaman baru dalam jumlah banyak dalam waktu yang relatif singkat, yang mempunyai sifat fisiologi dan morfologi sama persis dengan induknya,.
2. Memperoleh tanaman baru yang bersifat unggul jumlah yang dihasilkan banyak, tidak terbatas,
3. Bibit terhindar dari hama penyakit,
4. Perbanyakan tumbuhan/kultur jaringan dapat dilakukan secara cepat dan hemat waktu, 5. Pengadaan bibit tidak tergantung musim,
6. Bibit dapat diproduksi dalam jumlah banyak,
7. Biaya pengangkutan bibit relatif lebih murah dan mudah
4. Salah satu upaya mengoptimalkan pertumbuhan dari sel-sel tanaman tertentu (pembibitan) melalui penyediaan media secara buatan, bagaimana hal ini dilakukan?
Salah satu upaya pengoptimalan pertumbuhan sel tanaman dengan metode kultur sel dilakukan dengan penggunaan media secara buatan. Hal ini disebabkan karena pada media buatan, dilakukan penambahan nutrisi dan zat-zat yang dapat mendukung pertumbuhan tanaman secara optimum. Zat yang terdapat pada medium sebagai upaya
mengoptimalkan pertumbuhan diantarnya:
Garam Anorganik
Garam anorganik berperan dalam menjaga tekanan osmotic dan membantu dalam pengaturan potensial membrane dengan ion sodium, potassium dan kalsium.
Asam Amino
Asam amino adalah “building blocks” protein dan merupakan komponen wajib dalam media kultur sel. Asam amino esensial harus terdapat pada media karena sel tidak dapat mensintesisnya sendiri. Asam amino non-esensial juga dapat
ditambahkan pada medium untuk menggantikan asam amino lain yang habis ketika pertumbuhan serta mempertahankan kelangsungan hidup sel.
Carbohydrates, Lipid, dan Asam Lemak
Karobihodrat, lipid, dan asam lemak merupakan sumber energy dari sel.
Proteins and Peptides
Protein yang sering terdapat pada media adalah albumin dan aprotinin.
Albumin berperan sebagai pengikat air, garam, asam lemak bebas, hormone, dan vitamin lalu mentransfernya diantara sel dan jaringan. Aprotinin merupakan pelindung dalam system kultur sel, dimana ia berperan menstabilan pH, resisten
terhadap suhu tinggi dan melakukan degradasi dengan enzim proteolitik.
Vitamins
Vitamin penting untuk pertumbuhan dan proliferasi sel. Vitamin tidak dapat disintesis dalam jumlah yang cukup oleh sel sehingga merupakan suplemen penting yang dibutuhkan dalam kultur jaringan.
Antibiotik
Antibiotik sering digunakan untuk mengontrol pertumbuhan kontaminan bakteri dan jamur. Namun, penggunaan rutin antibiotik untuk kultur sel tidak dianjurkan karena antibiotic dapat menyebabkan resistensi. Selain itu, antibiotik juga dapat mengganggu metabolisme sel-sel sensitif.
Tabel 1Kandungan Utama Serum dan Konsentrasinya (Keterangan: Diperoleh dari “Culture Conditions and Types of Growth Media for MammalianCells” oleh Z. Yang dan H.R. Xiong,
Oleh karena itu, pada medium buatan sering ditambahkan serum. Serum merupakan salah satu komponen yang paling penting dari media kultur sel dan berfungsi sebagai sumber asam amino, protein, vitamin (vitamin terutama yang larut dalam lemak seperti A, D, E, dan K), karbohidrat, lipid, hormon, faktor pertumbuhan , mineral, dan elemen. Serum yang sering digunakan diantaranya Calf Serum (CS) dan FBS (Fetal Bovine Serum). Media pertumbuhan normal biasanya mengandung 2-10% serum. Suplementasi media dengan serum berfungsi memberikan nutrisi dasar untuk sel, menyediakan beberapa faktor pertumbuhan dan hormon yang terlibat dalam promosi pertumbuhan dan fungsi sel khusus, menyediakan beberapa protein yang mengikat seperti albumin, transferin, yang dapat membawa molekul lain ke dalam sel. menyediakan mineral, seperti Na +, K +, Zn2+, Fe2+, meningkatkan viskositas menengah sehingga melindungi sel dari kerusakan mekanis selama agitasi dari kultur suspense, dan bertindak buffer.
5. Apa yang dapat anda jelaskan terkait dengan jenis media kultur dan bagaimana keunggulan dan kekurangan dari masing-masing media tersebut?
Berdasarkan Media kultur sel berdasarkan sifatnya digolongkan menjadi media alami dan media buatan (artificial).
Gambar 1Media Kultur Sel (Sumber: microbeonline.com, 2012) Media Alami
Media alami terdiri atas secara cairan biologis alami. Contoh sumber biologis yang digunakan yaitu cairan tubuh seperti plasma, serum, dan getah bening; ekstrak jaringan seperti ekstrak dari hati, limpa, sumsum tulang, leucocyes, dan embrio ayam; gumpalan plasma; dan ekstrak embrio sapi. Keuntungan dari media alami ini adalah karena bersifat
nutrisi, somatomedin, dan hormone; dan memiliki tekanan osmotic dan pH yang mirip dengan lingkungan alaminya. Kerugian utama media alami adalah reproduksi yang buruk karena tidak diketahuinya komposisi yang tepat dari media, toksisitas dan sterilitas
Media Buatan (Artificial)
Media buatan (artificial) dibuat dengan menambahkan nutrisi (organik dan anorganik), vitamin, garam, O2 dan fase gas CO2, protein serum, karbohidrat, dan kofaktor. Media buatan menjaga pH fisiologis sekitar 7 dengan bantuan sistem buffering. Jenis media buatan diantaranya:
Basal Medium
Basal Medium adalah medium sederhana, seperti nutrient agar. Terdiri atas pepton, ekstrak daging, sodium chloride dan air. Pada media basal, ditambahkan serum didalamnya. Keuntungan dari media basal adalah karena ditambahkan serum, maka media ini sangat kaya nutrisi yang menyebabkan pertumbuhan sel secara optimum. Kerugiannya adalah kandungan serum yang kompleks, dapat berupa zat yang tidak cocok dengan sel yang dikultur sehingga dapat menghambat pertumbuhannya.
Reduced Serum Media
Reduced Serum Media pada dasarnya merupakan formulasi basal media yang diperkaya dengan nutrisi dan faktor berasal dari hewan, sehingga mengurangi jumlah serum yang diperlukan. Keuntungannya yaitu mengurangi efek yang tidak diinginkan dari serum dalam percobaan kultur sel namun tetap menyediakan nutrisi serum yang dibutuhkan.
Serum-Free Media
Serum-free media (SFM) menghilangkan masalah dengan menggunkan serum (darah) hewan dengan mengganti serum dengan formulasi nutrisi dan hormone yang memadai. Formula serum-free media dapat digunakan untuk banyak kultur primer dan cell line, seperti pembuatan protein rekombinan dari Chinese Hamster Ovary (CHO). Keuntungan dari penggunaan Serum-free media yaitu dapat membuat media selektif untuk sel spesifik dengan memilih kombinasi factor tumbuh tertentu dan kinerja yang konsisten. Sedangkan kerugiannya yaitu lambatnya pertumbuhan, membutuhkan reagen yang lebih murni dan membutuhkan formulasi media untuk sel spesifik tertentu.
Protein Free Media
Protein-free media tidak mengandung protein apapun dan hanya mengandung zat non-protein. Formula seperti MEM, RPMI-1640 adalah contoh dari protein-free media. Dibandingkan dengan serum-supplemented media, mengurangi resiko penyakit yang tularkan oleh protein sehingga produk hasil kultur sel lebih aman.
6. Hal-hal apakah yang perlu diperhatikan dalam pengembangan kultursel?
1. Sistem Kultur
Penggunaan sistem kultur yang tepat sangatlah penting untuk mengembangkan suatu kultur sel.
Adherent Culture Suspension Culture
Sesuai untuk sebagian besar jenis sel, termasuk kultur primer.
Hanya sesuai untuk sel yang diadaptasikan dengan kultur suspensi dan lini sel lain yang nonadhesive/ non perekat.
Membutuhkan passaging secara periodik tetapi mudah diamati di bawah mikroskop.
Lebih mudah untuk passaging , tetapi membutuhkan perhitungan sel setiap hari dan pengecekan hidup/matinya sel untuk mengikuti pola pertumbuhannya; kultur dapat diencerkan untuk merangsang pertumbuhan.
Sel dipisahkan secara enzimatis atau mekanis.
Tidak membutuhkan pemisahan secara enzimatis atau mekanis.
Pertumbuhan sel dibatasi oleh area permukaan yang juga dapat membatasi
yield produk
Pertumbuhan dibatasi oleh konsentrasi sel dalam medium, memudahkan scape-up/ peningkatan
Membutuhkan vessel yang sudah diperlakukan kultur jaringan.
Dapat di pertahankan dalam vessel
kultur yang belum diperlakukan kultur jaringan, namun membutuhkan agitasi (kocok atau aduk) untuk pertukaran gas yang memadai.
Digunakan untuk sitologi, memanen produk secara kontinu dan untuk penelitian.
Digunakan untuk produksi protein dalam jumlah besar, batch harvesting dan penelitian.
Tabel 2 Adherent Culture vs. Suspension Culture (Sumber: Handbook Cell Culture Basic)
2. Media Kultur
Medium kultur adalah komponen terpenting pada lingkungan kultur, karena medialah yang memberikan nutrisi, faktor-faktor pertumbuhan, hormon untuk pertumbuhan sel serta meregulasikan pH dan tekanan osmotik pada kultur.
Untuk keperluan standardisasi, media yang berkualitas dan kebutuhan yang tinggi maka media dibagi menjadi tiga kelas:
a. Basal Media
b. Reduced-Serum Media c. Serum-Free Media (SFM)
Salah satu keuntungan utama menggunakan media bebas serum adalah kemampuannya untuk membuat media menjadi selektif untuk jenis sel tertentu dengan memilih kombinasi yang tepat dari faktor pertumbuhan.
Keuntungan Kerugian
Meningkatan penentuan (lebih
terdefinisi)
Media membutuhkan formulasi yang spesifik untuk masing-masing sel
Lebih konsisten kinerjanya Pertumbuhan lebih lambat
Purifikasi lebih mudah dan downstream processing
Perlu reagen dengan kemurnian yang tinggi
Dapat menentukan fungsi selular lebih baik
Produktivitas lebih tinggi
Dapat dikontrol lebih mudah dengan respons fisiologis
Meningkatkan deteksi mediator selular
d.Serum
Penggunaan serum dapat memberikan banyak keuntungan. Namun dengan menggunakan serum, media memiliki sejumlah kelemahan termasuk biaya tinggi, masalah dengan standarisasi, spesifisitas, variabilitas, dan efek yang tidak diinginkan seperti rangsangan atau penghambatan pertumbuhan dan / atau fungsi sel pada kultur sel tertentu.
Jika serum tersebut tidak diperoleh dari sumber yang terpercaya, kontaminasi juga dapat menimbulkan ancaman serius bagi sukses percobaan kultur sel.
3. Temperatur
Temperatur yang berfluktuasi dari kisaran normalnya dapat mempengaruhi pertumbuhan sel pada kultur. Sel mamalia harus diinkubasi pada 37 ±1°C sedangkan sel serangga harus dipertahankan suhunya pada 25 ± 2°C untuk mencapai pertumbuhan yang optimum. Sel unggas perlu dipertahankan pada 38°C untuk pertumbuhan maksimum dan akan tumbuh lebih perlahan pada 37°C. Pada hewan berdarah dingin, sel lininya dapat menoleransi suhu pada kisaran 15-26°C
4. pH
Kebanyakan/sebagian besar sel bersifat sangat sensitif terhadap kondisi dari pH pada lingkungannya.Kondisi yang terlalu asam atau terlalu basa dapat menyebabkan kerusakan pada sel. Kisaran pH optimum untuk kebanyakan sel mamalia adalah sekitar 7.2 ±
0.2.Namun, beberapa lini sel tumbuh lebih baik dengan kondisi yang lebih asam yaitu sekitar pH 7.0-7.4, sedangkan beberapa lini sel fibroblast yang normal lebih optimal kondisi lingkungan yang lebih basa yaitu sekitar pH 7.4-7.7. Di sisi lain, sel serangga dapat tumbuh dengan baik pada rentang pH 6.2 ±0.1.
5. Karbon Dioksida (CO2)
Media kultur sel mamalia biasanya berisi sistem penyangga yang membutuhkan CO2 dari atmosfir untuk mempertahankan kondisi pH. Biasanya, sistem penyangga ini didapatkan dengan menyertakan buffer basa CO2-bikarbonat atau organik.
Perubahan pH yang signifikan dapat terjadi jika kadar CO2 yang memadai tidak dipertahankan. Sekitar 5% dari CO2 pada kultur biasanya cukup di untuk sebagian besar sistem kultur.
Media kultur sel serangga, maupun beberapa media mamalia seperti Medium L-15 (Leibovitz), berisi sistem penyangga yang tidak bergantung pada CO2. Kultur ini harus terkena kondisi atmosfer.
6. Kelembapan
Untuk vessel kultur yang harus memiliki penutup yang longgar untuk pertukaran gas, tingkat kelembaban juga penting. Kelembaban yang rendah dapat menyebabkan penguapan air dari media yang mengakibatkan meningkatnya konsentrasi kadar garam dan kondisi yang menyebabkan lisis sel.
7. Kandungan Konsentrasi Nutrisi
Karena jenis sel yang berbeda dan sejumlah sel memiliki kebutuhan gizi yang berbeda- beda, sulit untuk memiliki satu sistem media yang akan memuaskan semua kultur. Kinerja sel yang tidak memuaskan (pertumbuhan yang buruk, lampiran yang rendah dan/atau pengelupasan monolayer) sering terjadi jika persyaratan gizi sel tidak terpenuhi dengan baik.
8. Penghambat pada Kultur Sel
Sitotoksisitas dan kontaminasi adalah dua penghambat yang paling utama yang dapat timbul selama proses kultur sel.
Toksisitas sel atau sitotoksisitas adalah penghambatan pertumbuhan sel karena konsentrasi yang berlebihan dari bahan tertentu.Sitotoksisitas dapat disebabkan oleh media, serum atau suplemen.
Kontaminasi mikroba datang dalam berbagai bentuk termasuk bakter gram+ve dan gram-ve. Antibiotik seperti gentamisin, streptomisin dan penisilin sering digunakan dalam media kultur sel untuk mengontrol/mempertahankan rendahnya kontaminasi. Antibiotik juga bisa sitotoksik bila digunakan pada konsentrasi tinggi dan kultur dengan tingkat serum yang rendah atau kultur yang tidak terdapat serum sangat rentan terhadap masalah inisehingga produk hasil kultur sel lebih aman.
7.Metode-metode/teknik apa sajakah yang dapat dikembangkan dalam kultur jaringan?
a. Methods Subculturing Adherent Cells Material yang dibutuhkan
• Wadah kultur yang mengandung adherent
• Inkubator 37°C dengan kelembapan 5% CO2
• Larutan garam seimbang seperti Dulbecco’s Phosphate Buffered Saline (DPBS),
tidak mengandung kalsium, magnesium, dan fenol merah
• Reagen pemisah seperti tripsin atau TrypLE™ Express
• Reagent dan peralatan untuk menentukan jumlah sel yang layak dan sel total Countess® Automated Cell Counter, Trypan Blue dan hemacytometer, or Coulter Counter® (Beckman Coulter)
Prosedur untuk Subkultur Adherent Cell
1. Lepaskan dan buang media kultur sel yang telah terpakai dari wadah kultur.
2. Cuci sel menggunakan larutan garam seimbang tanpa kalsium dan magnesium (sekitar 2 mL per 10 cm2 luas permukaan area). Tambahkan larutan pencuci ke sisi wadah berlawanan dengan lapisan sel yang melekat untuk menghindari gangguan pada lapisan sel, dan goyangkan wadah bolak-balik beberapa kali.
3. Catatan: Pencucian menghilangkan jejak serum, kalsium, dan magnesium yang akan menghambat aksi reagen disosiasi.
4. Lepaskan dan buang larutan pencuci dari wadah
5. Tambahkan disosiasi reagen yang telah dipanaskan seperti tripsin atau TrypLE ™
ke sisi labu; gunakan cukup reagen untuk menutupi lapisan sel (sekitar 0,5 mL per 10 cm2). Kocok perlahan wadah untuk melapisi lapisan sel.
6. Inkubasi wadah kultur pada suhu kamar selama kurang lebih 2 menit. Perhatikan bahwa waktu inkubasi yang sebenarnya bervariasi dengan cell line yang digunakan. 7. Amati sel di bawah mikroskop. Jika sel-sel kurang dari 90% terpisah, tingkatkan
waktu inkubasi beberapa menit, periksa disosiasi setiap 30 detik.
8. Ketika ≥ 90% dari sel-sel telah terpisah, memiringkan wadah untuk jangka minimal waktu untuk memungkinkan sel untuk mengering. Tambahkan setara dengan 2 volume (dua kali volume digunakan untuk reagen disosiasi) medium pertumbuhan lengkap yang telah dipanaskan. Sebarkan media menggunakan pipet diatas permukaan lapisan sel beberapa kali.
9. Transfer sel ke tabung 15-mL kemudian sentrifugasi pada 200 × g selama 5 sampai 10 menit. Perhatikan bahwa kecepatan sentrifugasi dan waktu bervariasi berdasarkan jenis sel.
10. Suspensi pelet sel dalam volume minimal medium pertumbuhan lengkap dan buang sampel untuk perhitungan.
11. Tentukan jumlah sel dan persen viabilitas menggunakan Hemasitometer, counter sel dan tripan biru pengecualian, atau Countess® Automated Sel Kontra.
12. Encerkan sel suspensi sesuai dengan kepadatan penyemaian yang direkomendasikan untuk cell line, dan pipet volume yang sesuai ke dalam pembuluh kultur sel baru, dan mengembalikan sel-sel ke inkubator.
b. Metode Subkultur Sel Suspensi
Berbeda dengan metode subkultur adharet cells, metode subkultur sel suspensi cenderung tidak rumit. Secara proses keseluruhan metode ini lebih cepat dan tidak menyebabkan stress yang berlebih pada sel sampel yang akan dikultur.
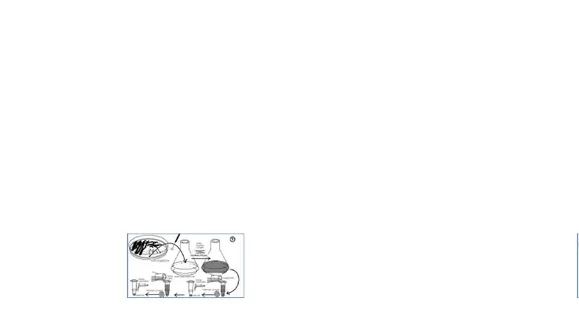
Pada metode ini secara umum terdapat dua pilihan wadah utama tempat mengkultur sel, yaitu labu shaker dan labu spinner . Labu shaker kurang direkomendasikan untuk treatment kultur jaringan dibandingkan labu spinner . Pada labu spinner terdapat dua desain. Desain pertama memiliki batang pengaduk sedangkan desain kedua memiliki vertical impeller . Baik kedua desain memiliki dua tutup samping yang bisa dibuka untuk menyediakan pertukaran gas dengan lingkungannya.
Gambar 2 Jenis pengaduk pada labu spinner (Sumber: Cell Culture Basics Handbook. Gibco)
Bahan-bahan yang digunakan untuk metode ini diantaranya adalah:
Media kultur yang mengandung suspensi sel
Labu shaker atau labu spinner
Media tumbuh yang baru, telah dipanaskan pada suhu 37oC
Inkubator 37oC dengan atmosfer lembab pada 5% CO2
Prosedur suspensi sel dengan labu shaker
1. Pindahkan labu sampel dari inkubator, lalu ambil sejumlah sampel dari labu dengan pipet steril.
2. Tentukan jumlah sel dengan menggunakan Automated Cell Counter atau cukup denganhemacytometer pada sampel.
3. Menghitung volume medium untuk dicampurkan dengan sampel pada labu.
4. Campurkan medium, yang telah dipanaskan sebelumnya pada suhu 37oC, ke dalam labu kultur dengan teknik aseptik, lalu masukkan sampel.
5. Masukkan kembali labu ke dalam inkubator shaker , lalu kocok labu kembali dengan kecepatan yang disesuaikan.
Prosedur suspensi sel dengan labu spinner
Untuk prosedur langkah proses kurang lebih sama dengan ketika menggunakan labu
shaker . Hal yang membedakannya hanyalah alat yang digunakan untuk mengkultur sampel
c. Freezing Cells
Kriopreservasi
Cell lines dalam kultur contiuous rentan terhadap penyimpangan genetik, cell lines yang terbatas akan menua, terkontaminasi mikroba, dan bahkan cell lines terbaik yang dikelola laboratorium dapat mengalami kegagalan karena peralatan. Karena cell lines adalah sumber daya yang berharga dan penggantinya mahal dan memakan waktu, sangat penting cell lines untuk dibekukan dan diawetkan untuk penyimpanan jangka panjang. Mereka harus dibekukan sebagai stok benih dan tidak dibuat tersedia untuk penggunaan laboratorium umum. Pengerjaan stok dapat dibuat dari stok benih beku. Jika benih unggulan habis, stok kriopreservasi kemudian dapat berfungsi sebagai sumber untuk menyiapkan benih segar dengan peningkatan minimum jumlah generasi dari pembekuan awal.
Metode terbaik untuk sel kultur kriopreservasi adalah menyimpan mereka dalam nitrogen cair dalam medium lengkap dengan adanya agen cryoprotective seperti dimetilsulfoksida (DMSO). agen cryoprotective mengurangi titik beku dari medium dan juga memungkinkan laju pendinginan lambat, sangat mengurangi risiko pembentukan kristal
Cara Kriopreservasi
• Bekukan sel kultur dengan konsentrasi tinggi dan dengan jumlah sedikit mungkin. Pastikan paling tidak 90% sel hidup sebelum dibekukan. Catat bahwa pembekuan optimal tergantung pada cell line yang digunakan. .
• Bekukan sel perlahan dengan mengurangi suhu sekitar 1 ° C per menit dengan menggunakan -freezer atau wadah cryo-freezing seperti "Mr. Frosty, "tersedia dari NALGENE® labware (Nalge Nunc)
• Selalu gunakan media pembekuan yang dianjurkan. Media pembekuan harus berisi agen cryoprotective seperti DMSO atau gliserol.
• Simpan sel beku di bawah -70 ° C; sel beku mulai memburuk di atas -50 ° C.
• Selalu gunakan cryovials steril untuk menyimpan sel beku. Cryovials mengandung sel-sel beku dapat tersimpan terendam dalam nitrogen cair atau dalam fase gas di atas nitrogen cair.
• Selalu memakai alat pelindung diri.
• Semua larutan dan peralatan yang mengalami kontak dengan sel harus steril. Selalu menggunakan teknik steril yang tepat dan bekerja di kap aliran laminar.
Material yang dibutuhkan
Wadah kultur yang mengandung kultur sel di fase log
Medium pertumbuhan yang lengkap
Agen cryoprotective seperti DMSO (menggunakan botol yang disisihkan untuk kultur sel, dibuka hanya di kap aliran laminar) atau medium beku seperti Synth-a-Freeze®
Cryopreservation Medium atau Recovery™ Cell Culture Freezing Medium
Tabung kerucut sekali pakai dan steril berukuran 15 ml
Reagen atau peralatan untuk menentukan jumlah sel hidup dan sel total (e.g., Countess® Automated Cell Counter, or hemacytometer, cell counter and Trypan Blue)
Botol penyimpanan kriogenik steril (i.e., cryovials)
Ruang isopropanol atau peralatan yang dapat diatur tingkat kebekuannya
Untuk sel adherent beku, material tambahan yang dibutuhkan :
Larutan garam seimbang seperti Dulbecco’s Phosphate Buffered Saline (D-PBS), tidak mengandung calcium, magnesium, dan phenol red
Protokol untuk Kriopreservasi Sel Kultur
1. Siapkan pembekuan medium dan simpan pada suhu 2 ° sampai 8 ° C sampai digunakan. Perhatikan bahwa media pembekuan yang tepat tergantung pada cell line.
2. Untuk adherent sel, lepaskan dengan lembut sel-sel dari wadah kultur jaringan mengikuti prosedur yang digunakan selama subkultur. Suspensi sel dalam medium lengkap yang
digunakan sesuai jenis sel.
3. Tentukan jumlah sel dan persen viabilitas persen menggunakan Hemasitometer, penghitung sel dan Trypan Blue exclusion, atau Countess® Automated Sel Counter. Menurut kepadatan sel hidup yang diinginkan, hitung volume yang dibutuhkan pembekuan media.
4. Sentrifugasi suspensi sel di sekitar 100-200 × g selama 5 sampai 10 menit. Secara aseptik tuang supernatan tanpa mengganggu pelet sel. Catatan: kecepatan Sentrifugasi dan durasi bervariasi tergantung pada jenis sel
5. Suspensi pelet sel dalam medium pembekuan dingin di kepadatan sel yang direkomendasikan untuk jenis sel tertentu.
6. Mengeluarkan aliquot dari suspensi sel ke dalam botol penyimpanan kriogenik. Bersamaan dengan itu, campur sel untuk mempertahankan suspensi sel homogen.
7. Bekukan sel dalam alat pembekuan, turunkansuhu sekitar 1 ° C per menit. Atau, menempatkan cryovials mengandung sel-sel dalam ruang isopropanol dan menyimpannya pada -80 ° C semalam.
8. Transfer sel beku ke nitrogen cair, dan menyimpannya dalam fase gas di atas nitrogen cair.
c. Melelehkan Sel Beku (Th awin g Fr ozen Cell s)
Adakalanya, kultur sel yang dibekukan butuh untuk dicairkan kembali. Proses pencairan menyebabkan stress pada sel kultur, dan dibutuhkan teknologi serta keterampilan yang memadai untuk menjamin agar dapat memperoleh jumlah sel yang hidup sebanyak- banyaknya. Berikut ini adalah panduan penting dalam melelehkan sel yang membeku dalam
kultur:
– Lakukan proses pencairan dengan cepat (kurang dari satu menit) dalam water bath pada suhu 37oC.
– Berikutnya cairkan sel beku secara perlahan, dengan menggunakan medium tumbuh baru yang telah dipanaskan sebelumnya.
– Kumpulkan sel beku dalam densitas tinggi untuk mengoptimalkan pemulihan sel.
– Lakukan kerja dengan prinsip teknik aseptik, serta lakukan proses dalam kap laminar flow.
– Selalu pakai peralatan pendukung kemanan kerja selama proses pencairan sel, termasuk masker wajah dan goggle. Cryovial dalam fasa cair dapat memicu adanya ledakan.
Beberapa medium pembekuan mengandung DMSO (Dimetil Sulfoksida), yang merupakan pelarut organik agar tersedia zat-zat organik yang dibutuhkan sel beku untuk tumbuh setelah dicairkan kembali. Tangani dengan baik reagen yang mengandung DMSO dengan peralatan serta prosedur kerja yang tepat untuk menangani bahan-bahan berbahaya seperti ini. Hal itu dilakukan untuk menghindari hal-hal yang tidak diinginkan selama kerja berlangsung.
Pada proses pencairan sel beku, beberapa alat dan bahan utama dibutuhkan dalam proses ini yang diantaranya adalah:
– Cryovial yang mengandung sel beku
– Medium tumbuh baru, sebeumnya telah dipanaskan pada suhu 37oC
– Tabung steril sentrifugasi sekali pakai
– Water bath pada suhu 37oC
– Etanol dengan kadar 70%
– Piring atau labu tempat perlakuan kultur
22
Adapun langkah-langkah pencairan sel beku dijelaskan seperti berikut. Perlu diperhatikan bahwa prosedur ini merupakan prosedur umum dalam mencairkan sel beku dengan sel yang dilindungi oleh cryovial. Prosedur dapat berbeda tergantung pada kultur sel beku yang digunakan.
1. Hilangkan kandungan cryovial pada kultur sel beku dari penyimpanan nitrogen cair dan langsung letakkan sel beku pada water bath dengan suhu 37oC.
2. Cairkan sel beku dengan cepat (kurang dari satu menit) dengan mengaduknya secara perlahan hingga tersisa sedikit es pada kultur beku (dalam vial).
3. Pindahkan kultur ke dalam kap laminar flow. Sebelum itu, usap bagian luar kultur (yang berada dalam vial) dengan etanol 70%.
4. Pindahkan kultur tetes demi tetes dari vial ke dalam tabung sentrifugasi yang sudah dimasuki medium tumbuh baru
5. Sentrifugasi suspensi sel pada kisaran 200 x g selama 5-10 menit. Kecepatan dan durasi sentrifugasi bervariasi tergantung pada jenis sel yang ada dalam suspensi.
6. Setelah sentrifugasi selesai, cek tingkat kejernihan supernatan dan visibilitas pellet/butirannya. Tuang supernatan tanpa menggau pelletnya dengan menggunakan
teknik aseptik.
Letakkan suspensi pada medium tumbuh yang baru dengan perlahan. Lalu pindahkan pada wadah kultur yang sesuai dan perhatikan kondisi lingkungan medium kulturnya.
8. Dapatkan anda menjelaskan aplikasi-aplikasi dari pengembangan kultur jaringan? a. Perbanyakan sel (mikro propagasi)
Perbanyakan sel bisa dilakukan untuk sel primer, sel lini dan sel strain. Sel lini adalah kultur sel hasil perbanyakan/turunan dari kultur sel primer. Sel lini yang terpilih (unggul) bisa disimpan dalam jangka panjang melalui kriopreservasi (penyimpanan beku dingin). Strain cell adalah kultur sel hasil seleksi (sel terpilih) dari sel lini. Teknik ini dilakukan dengan cara menanam eksplan berupa pucuk beserta jaringan meristemnya yang dikenal sebagai teknik kultur pucuk (shoot tip culture)
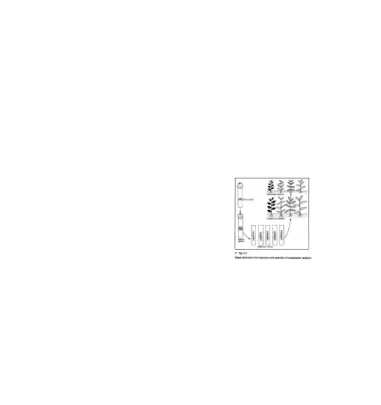
Gambar 4 Teknik Mikropropagasi: dari eksplan diinisiasi
atau menanam tunas lateral dengan satu atau lebih buku (single node and multiple node culture). Teknik terakhir juga dikenal dengan istilah invitro layering. Sel embriogenik diinduksi menjadi embrio somatik, kemudian dikecambahkan dan diaklimatisasi.
Perbanyakan mikro secara umum dapat diartikan sebagai usaha menumbuhkan bagian tanaman dalam media aseptis kemudian memperbanyak bagian tanaman tersebut sehingga dihasilkan tanaman sempurna dalam jumlah banyak. metoda ini menjadi salah satu alternatif dalam perbanayakan tanaman secara vegetatif .
b. Seleksi In Vitro (variasi somaklonal)
Kultur sel diarahkan untuk menghasilkan sel-sel yang tahan/toleran pada kondisi /stress tertentu. Kelebihan seleksi in vitro adalah lebih efektif karena pada tingkat sel, lebih pasti karena mutan sel dapat diregenerasikan menjadi individu mutan independen. Seleksi in vitro lebih efesien dan hasilnya dapat dipertanggung jawabkan, karena melalui seleksi in vitro jutaan sel dapat diseleksi dengan hanya menggunakan beberapa botol kultur atau petridis, sedangkan seleksi di lapang harus menggunakan berates - ratus tanaman yang diuji pada areal yang lebih luas, selain itu seleksi in vitro tidak terlalu dipengaruhi
oleh lingkungan serta memungkinkan melakukan seleksi pada tingkat sel (Biswas et al., 2002).
Sel ditumbuhkan pada medium kultur yang diberi agen seleksi tertentu (antibiotik, Al, PEG dll). Sel-sel yang terseleksi dapat diperbanyak dan diregenerasikan. Seleksi in vitro dapat dikombinasikan dengan radiasi. Seleksi in vitro telah banyak digunakan untuk mendapatkan tanaman yang toleran terhadap cekaman kekeringan. Beberapa jenis tanaman dilaporkan mengalami peningkatan toleransi terhadap cekaman kekeringan seperti pada tanaman padi, Barley, gandum, raspberry, jagung, tomat (Lestari et. al., 2004; Bandurska, 2000; Bajji, et.al., 2000; Georgieva, et.al., 2004; Matheka, et. al., 2008). Teknik in vitro melalui variasi somaklonal dan perlakuan mutasi fisik seperti iradiasi sinar gamma pada jaringan atau sekelompok sel (kalus) merupakan alternatif untuk mendapatkan varian yang diinginkan. Melalui seleksi in vitro varian tersebut dapat diseleksi untuk mendapatkan varian
Gambar 5 Seleksi In Vitro (Sumber: discussionbiology.com)
c. Produksi Metabolit Sekunder
Kultur sel dapat digunakan untuk memproduksi senyawa metabolit sekunder tertentu. Metabolit sekunder digunakan dalam industri seperti: industri farmasi, wangi-wangian, aditif makanan, pemanis, pewarna, dan antimikroba. Sebagai contoh produksi secara komersial senyawa “shikonin” dari kultur sel Lithospermum erythrorhizon. Kultur sel-sel tanaman memproduksi senyawa biokimia (metabolit sekunder) seperti alkaloid, terpenoid, phenyl propanoid dll.
Metabolit sekunder merupakan senyawa yang tidak terlibat langsung dalam pertumbuhan, perkembangan, atau reproduksi makhluk hidupyang fungsinya masih belum diketahui secara pasti. Senyawa ini biasa digunakan untuk pertahanan dan perkembangbiakan tanaman. Kebanyakan senyawa metabolit sekunder ini beracun bagi hewan. Penggolongan metabolit sekunder berdasarkan biosentesisnya meliputi
senyawa alkaloid, fenol, dan terpenoin (Anonim, 2010).
Sel diinduksi dari jaringan penghasil metabolit target. Keuntungan dari produksi metabolit sekunder ini adalah lebih praktis, cepat dan terkontrol. Sel primer di sub kultur lalu dibuat kultur sel (skala kecil/skala besar). Sel-sel penghasil metabolit dapat dipanen dan diekstrak dengan mudah. Metabolit sekunder yang dihasilkan murni dan steril jika kultur sel dan panen dilakukan secara aseptis.
Metabolit sekunder seperti kurkumin dari tanaman kunyit dan temulawak dapat dibentuk dengan cara menginduksi jaringan tanaman pada media yang mengandung zat pengatur tumbuh untuk membentuk kalus. Kalus berasal dari potongan organ yang telah steril dalam media yang telah mengadung auksin dan kadangkala sitokinin. Kalus selanjutnya diperbanyak dengan cara kultur kalus ataupun suspensi dan dapat juga menggunakan elisitor dalam fermentor atau bioreactor, contohnya ginseng.
Senyawa metabolit sekunder melalui kultur jaringan dapat diisolasi dari kalus atau sel. Kandungannya dapat ditingkatkan melalui seleksi bahan tanaman atau jaringan, tingkat pertumbuhan tanaman, pemakaian zat pengatur tumbuh dan prekusor, pemakaian mutagen baik secara fisik maupun kimia serta manipulasi faktor lingkungan. Kalus sebagai bahan senyawa sekunder dan produk lainnya dapat dipacu pembentukan dan pertumbuhannya dengan pemakaian zat pengatur tumbuh 2,4D, NAA, dan sering pula direkombinasikan Gambar 6Contoh-contoh metabolit sekunder (Sumber:
dengan sitokinin. Adakalanya, kombinasi auksin dengan sitokinin selain slain dapat merangsang proses pembelahan sel juga mempengaruhi kandungan senyawa sekundernya.
Pada kultur sel, kalus akan kehabisan hara yang disebabkan karena masa kultur yang panjang yang mengakibatkan penguapan air dan unsur hara dari waktu ke waktu. Selain kehabisan hara, sel-sel dalam kalus juga mengeluarkan persenyawaan-persenyawaan hasil metabolit sekunder.
d. Biofarming (obat-obatan)
Gambar 7Produksi antibiotik dari e-coli (Sumber: Saptowo, 2010)
Biofarming adalah penggunaan tumbuhan atau hewan yang telah direkayasa untuk memproduksi substransi atau molekul baru yang telah termodifikasi. Kultur sel dapat digunakan untuk memproduksi vaksin/senyawa berkasiat obat tertentu. Sel lini yang telah direkayasa genetik melalui insersi gen penghasil vaksin/senyawa obat tertentu diseleksi pada media kultur sehingga diperoleh sel strain terpilih. Sel strain dibuat kultur sel (skala kecil/besar) sehingga menghasilkan vaksin/obat tertentu. Sel kemudian dipanen dan diekstrak.
f. Biomedical (stem cell)
Kultur sel juga dapat digunakan untuk tujuan biomedical (terapi pengobatan). Kultur stem sel misalnya, dapat menghasilkan sel embrionik yang memiliki pluripotent. Keuntungan biomedical melalui kultur sel adalah lebih terkontrol, terarah dan aseptis.
Berdasarkan kemampuan berdiferensiasi, stem cell dibagi menjadi:
1. Totipotent adalah sel yang dapat berdiferensiasi menjadi semua jenis sel. Yang termasuk dalam stem cell totipotent adalah zigot (telur yang telah dibuahi).
2. Pluripotent adalah sel yang dapat berdiferensiasi menjadi 3 lapisan germinal: ektoderm, mesoderm, dan endoderm, tapi tidak dapat menjadi jaringan ekstraembryonik seperti
3. Multipotent adalah sel yang dapat berdiferensiasi menjadi banyak jenis sel.
Misalnya: hematopoietic stem cells.
4. Unipotent adalah sel yang hanya dapat menghasilkan 1 jenis sel. Tapi berbeda dengan non-stem cell, stem cell unipoten mempunyai sifat dapat memperbaharui atau meregenerasi diri (self-regenerate/self-renew)
g. Rekayasa Genetik (Transgenik)
Kultur sel dapat pula digunakan untuk bahan rekayasa genetik/transformasi genetik. Sel-sel embriogenik pada kultur Sel-sel sangat bagus digunakan sebagai Sel-sel target dalam transfer gen. Sel-sel embriogenik dapat diinsersi dengan gen target menggunakan penembak gen , mikroinjeksi, ataupun Agrobacterium. Sel-sel yang telah ditransformasi selanjutnya dapat diregenerasikan menjadi jaringan ataupun individu secara independen. Kelebihan rekayasa genetik menggunakan sel adalah lebih akurat (langsung ke dlm sel) dan diperoleh transforman yang berasal dari satu sel.
Pada tanaman, gen yang telah diidentikfikasi diisolasi dan kemudian dimasukkan ke dalam sel tanaman. Melalui suatu sistem tertentu, sel tanaman yang membawa gen tersebut dapat dipisahkan dari sel tanaman yang tidak membawa gen. Tanaman pembawa gen ini kemudian ditumbuhkan secara normal. Tanaman inilah yang disebut sebagai tanaman transgenik karena ada gen asing yang telah dipindahkan dari makhluk hidup lain ke tanaman tersebut (Muladno, 2002).
Tanaman transgenik memiliki kualitas lebih dibanding tanaman konvensional, kandungan nutrisi lebih tinggi, tahan hama, tahan cuaca, umur pendek, dll; sehingga penanaman komoditas tersebut dapat memenuhi kebutuhan pangan secara cepat dan
menghemat devisa akibat penghematan pemakaian pestisida atau bahan kimia lain serta tanaman transgenik produksi lebih baik
Teknik rekayasa genetika sama dengan pemuliaan tanaman; yaitu memperbaiki sifat-sifat tanaman dengan menambah sifat-sifat ketahanan terhadap cekaman hama maupun lingkungan yang kurang menguntungkan; sehingga tanaman transgenik memiliki kualitas lebih baik dari tanaman konvensional, serta bukan hal baru karena sudah lama dilakukan tetapi tidak disadari oleh masyarakat;
BAB III
PENUTUP
3.1 Kesimpulan
Pada dasarnya, kultur jaringan merupakan salah satu metode alternatif dalam menumbuhkan sel dalam jumlah banyak dengan waktu yang lebih singkat. Teknik kultur jaringan dapat digunakan pada tumbuhan karena sel tumbuhan memiliki sifat totipotensi,
yaitu kemampuan sel untuk beregenerasi membentuk individu baru pada kondisi yang sesuai. Kelebihan penggunaan teknik kutur jaringan tanaman diantaranya: kualitas bibit yang dihasilkan lebih baik; efisiensi dalam jumlah bibit yang dihasilkan terhadap waktu; biaya serta proses produksi yang murah dan mudah; serta prosesnya dapat dilakukan kapan pun.
Teknik kultur jaringan dapat digunakan untuk mengembangbiakkan tanaman jati emas. Hal itu disebabkan karena tanaman jati emas, seperti tumbuhan pada umumnya, memiliki sifat totipotensi. Pengembangbiakan sel tanaman jati emas dapat dilakukan dengan berbagai metode, seperti metode subkultur, metode freezing , dan metode-metode lainnya. Dengan kultur jaringan, diharapkan dapat diperoleh tanaman jati emas yang memiliki sifat unggul serta nilai jual yang lebih tinggi.
3.2 Saran
Sangat disayangkan bahwa pada kenyataannya, penerapan teknik kultur jaringan masih minim di Indonesia. Hanya segelintir lingkup masyarakat yang paham dan mampu mengaplikasikan metode-metodenya dalam kehidupan sehari-hari. Sejauh ini kebanyakan metode kultur jaringan diaplikasikan pada skala rumah tangga, seperti budi daya tanaman tertentu yang ingin dijual. Apabila kultur jaringan dapat dimanfaatkan secara maksimal, maka ketersediaan tumbuhan di Indonesia dapat dijaga keseimbangannya. Kejadian-kejadian seperti pembakaran hutan, penebangan pohon secara ilegal (illegal logging ), dan eksploitasi tumbuhan lainnya dapat diminimalisir karena kebutuhan akan tanaman tersebut dapat dipenuhi dengan adanya metode kultur jaringan.
Penulis menyarankan perlu adanya edukasi berkelanjutan terkait teknik kultur jaringan. Dengan teknik ini masyarakat dapat mengembangbiakan tanaman-tanaman tertentu tanpa mengganggu keseimbangan alam. Teknik ini juga dapat digunakan industri-industri besar yang membutuhkan kayu sebagai bahan mentahnya. Dengan teknik kultur jaringan, mereka
dapat memperoleh kayu dalam jumlah besar dan dengan waktu yang lebih singkat tanpa harus mengeksploitasi hutan-hutan di Indonesia.
DAFTAR PUSTAKA
Ahloowalia B 1986. Limitation to the use of somaclonal variation in crop improvement. In: Semal, J. (Ed.). Somaclonal Variation and Crop Improvement. Martinus Nijhoff Publ. Dordrecht. P.15-27.
Anonim. 2011. Cara Budidaya Jati Emas Unggulan. [ONLINE] Tersedia di http://1001budidaya.com/, Diakses pada 16 September 2016 pukul 18.09
Anonim.Factors Affecting Culture Cell.[ONLINE].(http://www.bccresearch.com/blog/report-archives/factors-affecting-cell-culture.html, diakses tanggal 20 September 2016, 04:12 WIB)
Anonim. 2014. Pengertian Teknik Kultur Jaringan, Keunggulan, Kelemahan, dan Tahapannya [ONLINE] Tersedia di http://www.ebiologi.com/2015/12/Pengertian-teknik-kultur-jaringan.html. Diakses pada 16 September 2016 pukul 19.29
Anonim. Cell Culture Basis Handbook. USA: Invitrogen&Gibco
Dalimonthe, S.L, 1987. Kultur jaringan sebagai sarana untuk menghasilkan metabolit sekunder. Dalam buku Risalah Seminar Nasional Metabolit Sekunder. 1987. (Ed) Suwijiyo pramono, D. Gunawan dan C.J. Soegihardjo, 6-9 September, Yogyakarta. PAU Bioteknologi UGM. Hal. 157-162.
Glazer AN., Nikaido H. (2007). Microbial Biotechnology: Fundamentals Of Applied Microbiology Second Edition. Cambridge University Press.
Heve 1999. Osmoregulatory role of proline in plant exposed to environtmental stress, In Perssarakli, M. Handbook of Plant and Crop Stress. Second Edition, Revised and Expanded.
Indriyanto, G., 1987. Produksi metabolit sekunder dengan teknik kultur jaringan. Dalam Buku Risalah Seminar Nasional Metabolit Sekunder. 1987. (Ed) Suwijiyo Pramono, D. Gunawan dan C.J. Soegiarto. 6-9 Sptember. Yogyakarta. PAU Boiteknologi UGM. Hal. 32-44.
Kumar, Sinibas. 2016. Somaclonal Variation: Isolation and Selection Techniques (With Diagram)
[ONLINE].Tersediadihttp://www.biologydiscussion.com/biotechnology/somaclonal variations/somaclonal-variation-isolation-and-selection-techniques-with-diagram/14809. Diakses pada 16 September 2016 pukul 20:45
Lovelock JE, Bishop MWH. Prevention of Freezing Damage to Living Cells by Dimethyl Ssulphoxide. Nature. 1959;183:1394-95.