i
PERBEDAAN TINGKAT EKSPRESI LMP-1 DAN EBNA-1 VIRUS
EPSTEIN-BARR ANTARA
HIGH GRADE
DAN
LOW GRADE
KARSINOMA KOLOREKTAL
TESIS
Untuk Memenuhi Sebagian Persyaratan Mencapai Derajat Magister
Kesehatan Program Studi Magister Kedokteran Keluarga
Minat Utama Ilmu Biomedik
Oleh:
RAHADIAN HARYANTO NIM. S56907001
PROGRAM PASCASARJANA UNIVERSITAS SEBELAS MARET
SURAKARTA 2014
ii
iii
iv
PERNYATAAN
Yang bertandatangan dibawah ini, saya: Nama :RahadianHaryanto
NIM : S56907001
Menyatakan dengan sesungguhnya, bahwa tesis berjudul PERBEDAAN TINGKAT EKSPRESI LMP-1 DAN EBNA-1 VIRUS EPSTEIN-BARR ANTARA HIGH GRADE DAN LOW GRADE KARSINOMA KOLOREKTAL adalah betul-betul karya saya sendiri. Hal-hal yang bukan karya saya dalam tesis tersebut diberi tanda citasi dan ditunjukkan dalam daftar pustaka.
Apabila di kemudian hari terbukti pernyataan saya tidak benar, maka saya bersedia menerima sanksi akademik berupa pencabutan tesis dan gelar yang saya peroleh dari tesis tersebut.
Surakarta, 19 Agustus 2014 Yang membuat pernyataan
(Rahadian Haryanto) S56907001
v
Perbedaan Tingkat Ekspresi LMP-1 dan EBNA-1 antara High Grade dan Low Grade Karsinoma Kolorektal Terkait Infeksi Virus Epstein-Barr.
ABSTRAK
Rahadian Haryanto. S56907001.2014. Perbedaan Tingkat Ekspresi LMP-1 dan EBNA-1 antara High Grade dan Low Grade Karsinoma Kolorektal Terkait Infeksi Virus Epstein-Barr. Tesis. Pembimbing I: DR.Dr.Ida Bagus Metria, Sp.B(K)BD, II: Prof.DR.dr.Ambar Mudigdo,Sp.PA(K). Program Studi Kedokteran Keluarga, Program Pasca Sarjana, Universitas Sebelas Maret, Surakarta.
Kanker kolorektal merupakan penyebab kematian ketiga setelah kanker paru dan kanker payudara. Kejadian karsinogenesis disebabkan multifaktorial, multi-level dan multi-step antara lain infeksi virus onkogenik Epstein-Barr.
Penelitian ini bertujuan mengetahui adanya perbedaan tingkat ekspresi LMP-1 dan EBNA-1 antara high grade dan low grade karsinoma kolorektal terkait infeksi virus Epstein-Barr.
Penelitian ini merupakan penelitian observasional analitik dengan rancangan cross sectional menggunakan jaringan karsinoma kolorektal, dilakukan pemeriksaan imunohistokimia LMP-1 dan EBNA-1 terhadap 10 sampel high grade dan 10 sampel low grade. Analisa statistik menggunakan uji beda t- test dan uji Mann-Whitney.
Hasil penelitian didapatkan ekspresi LMP-1 dan EBNA-1 lebih tinggi pada high grade (rerata 3,8+2,55) dan (rerata 6,4+2,69) dari pada low grade (rerata 1,86+1,68) dan (rerata 3,47+2,33). Hasil analisa uji beda didapatkan perbedaan yang bermakna ekspresi LMP-1 dan EBNA-1 pada high grade dan low grade karsinoma kolorektal (p= 0,000) dan (p= 0,036).
Terdapat perbedaan tingkat ekspresi LMP-1 dan EBNA-1 pada high dan low grade. Pada high grade tingkat ekspresi LMP-1 dan EBNA-1 lebih tinggi bila dibandingkan dengan low grade.
Kata kunci : virus Epstein-Barr, LMP-1, EBNA-1, high grade dan low grade karsinoma kolorektal.
vi
DIFFERENCE OF EXPRESSIONS LMP-1 AND EBNA-1 BETWEEN HIGH AND LOW GRADE COLORECTAL CARCINOMA RELATED TO INFECTIONS OF EPSTEIN BARR VIRUS
ABSTRACT
Rahadian Haryanto. S56907001.2014.Difference of Expressions LMP-1 and EBNA-1 between High and Low Grade Colorectal Carcinoma related to Infections of Epstein-Barr Virus.Dissertation. Supervisor I: DR.Dr.Ida Bagus Metria, Sp.B(K)BD, II: Prof.DR.dr.Ambar Mudigdo,Sp.PA(K). Program Study of Family Medicine-Biomedic. Post Graduate Program of Sebelas Maret University, Surakarta.
Colorectal cancer is the third leading cause of death after lung cancer and breast cancer. The incidence of carcinogenesis due to various multi factorial, multi level and multi step among other are caused by infections of oncogenic viral such as Epstein-Barr virus.
This research is to determine the difference of expressions LMP-1 between high grade and low grade colorectal carcinoma related to infections of Epstein-Barr virus.
This research use analytic observational study with cross-sectional design. Samples were taken by consecutive sampling from patients with histopathological pictures of high grade and low grade colorectal carcinoma then examine immunohistochemical of 10 samples LMP-1 and 10 samples EBNA-1. Analytic data use different test using the t test and Mann-Whitney test.
The results showed the expression of LMP-1 and EBNA-1 was higher in high grade (mean 3.8+2.55) and (mean 6.4+2.69) than in low grade (mean 1.86+1.68 ) and (mean 3.47+2.33). Analytic difference test results obtained were significant difference of expression of LMP-1 and EBNA-1 in high grade and low grade colorectal carcinoma (p =0.000) and (p =0.036).
There are difference of expressions LMP-1 and EBNA-1 which in high grade are higher than low grade colorectal carcinoma.
Keywords: expressions of LMP-1,EBNA-1, high grade and low grade colorectal carcinoma.
vii
Motto
“Allah tidak membebani seseorang melainkan sesuai dengan
kesanggupannya. Ia mendapat pahala (dari kebajikan) yang
diusahakannya dan ia mendapat siksa (dari kejahatan) yang
dikerjakannya”(QS.Al-Baqarah: 286).
“Hai orang-orang yang beriman, Jadikanlah sabar dan shalatmu Sebagai
penolongmu, sesungguhnya Allah beserta orang-orang yang sabar”
(Al-Baqarah: 153).
“Sesungguhnya jika kamu bersyukur, pasti Kami akan menambah
(nikmat) kepadamu, dan jika kamu mengingkari (nikmat-Ku), maka
sesungguhnya azab-Ku sangat pedih" (QS.Ibrahim14 : 7).
viii
KATA PENGANTAR
Assalamualaikum warahmatullahi wabarakatuh Al
Penyusun menyadari bahwa dalam penyusunan dan penulisan tesis ini masih banyak terdapat kekurangan, untuk itu penyusun mohon maaf dan sangat mengharapkan saran serta kritik yang membangun dalam rangka perbaikan penulisan penelitian tesis ini.
Surakarta, Agustus 2014
Penyusun
ix DAFTAR ISI
HALAMAN JUDUL ……… i
LEMBAR PERSETUJUAN PEMBIMBING…..……….………... ii
PENGESAHAN TESIS ……… iii
ORISINALITAS ……….. iv
ABSTRAK ... v
ABSTRACT ... vi
MOTTO ... vii
KATA PENGANTAR ... viii
DAFTAR ISI ...………...……….. xi
DAFTAR GAMBAR ..………..………...…… xiii
DAFTAR TABEL ………...………..……….………. xiv
DAFTAR SINGKATAN ... xiii
BAB 1. PENDAHULUAN 1.1 Latar Belakang Masalah ………...………... 1
1.2 Rumusan Masalah ………....………... 4
1.3 Tujuan Penelitian ………...……....……….... 4
1.4 Manfaat Penelitian ………...…….………...…... 5
I.4.1 Manfaat Teoritis………..………...…. 5
I.4.2 Manfaat Aplikatif ………... 5
BAB 2. TINJAUAN PUSTAKA 2.1 Virus Epstein-Barr ... 6
2.1.1Infeksi primer dan infeksi persisten virus Epstein-Barr ... 7
2.1.2 Biologi molekuler virus Epstein-Barr ... 8
2.1.3 Infeksi virus Epstein-Barr ... 9
2.1.4 Gen virus dan karsinogenesis ... 11
2.2 Latent Membran protein 1 (LMP-1) ... 12
2.3 EBNA-1 ... 17 2.4 Kanker kolorektal ... 20 2.4.1 Etiologi ... 21 2.4.2 Patogenesis ... 22 2.4.3 Deteksi ... 22 2.4.4 Indikasi ... 23 2.4.5 Stadium ...……….…… 24 2.4.6 Derajat histopatologi ... 26 2.4.7 Penatalaksanaan ... 27 2.4.7.1 Pembedahan ... 27 2.4.7.2 Radioterapi ... 28 2.4.7.3 Kemoterapi ... 28 2.4.7.4 Imunoterapi ... 29 2.8.9 Prognosis ... 30
BAB 3. KERANGKA KONSEPTUAL DAN HIPOTESIS 3.2 Kerangka konseptual ... 31
3.3 Hipotesis ... 32
BAB 4. METODE PENELITIAN 4.1 Jenis penelitian ... 33
4.2 Lokasi dan waktu penelitian ... 33
x 4.3 Populasi penelitian ... 33 4.3.1. Populasi target ... 33 4.3.2. Populasi aktual ... 33 4.4 Sampel ... 33 4.4.1. Teknik sampling ... 33
4.4.2. Estimasi besar sample ... 34
4.5 Kriteria restriksi ... 34 4.5.1. Kriteria inklusi ... 34 4.5.2. Kriteria ekslusi ... 34 4.6 Definisi operasional ... 35 4.6.1. Variabel penelitian ... 35 4.6.2. Definisi operasional ... 35
4.6.3. Skala pengukuran data ... 36
4.7 Kerangka operasional ... 38
4.8 Instrumentasi penelitian ... 39
4.9 Cara kerja imunohistokimia ... 40
4.10 Pelaksanaan penelitian ... 40
4.11 Pengolahan data ... 41
BAB 5. HASIL PENELITIAN 5.1.Ekspresi LMP-1 dan EBNA-1 ... 45
5.1.1. Uji normalitas data ...………... 48
5.1.2. Perbedaan ekspresi ...……... 49
5.1.3. Normalitas data dan perbedaan ekspresi ... 50
BAB 6. PEMBAHASAN ... 51
BAB 7. SIMPULAN DAN SARAN 7. Simpulan dan saran ... 56
DAFTAR PUSTAKA ... 57
LAMPIRAN ………...……….. 64
xi
DAFTAR GAMBAR
Gambar 2.1. Infeksi virus Epstein-Barr... 10
Gambar 2.2.Infeksi primer virus Epstein-Barr ……… ... 10
Gambar 2.3. Latent Membran Protein-1 ... 13
Gambar 2.4. LMP-1 ... 51
Gambar 2.5. Struktur representasi EBNA-1 …….. ... 18
Gambar 3.1. Kerangka konseptual ... 31
Gambar 4.1 Kerangka operasional ... 38
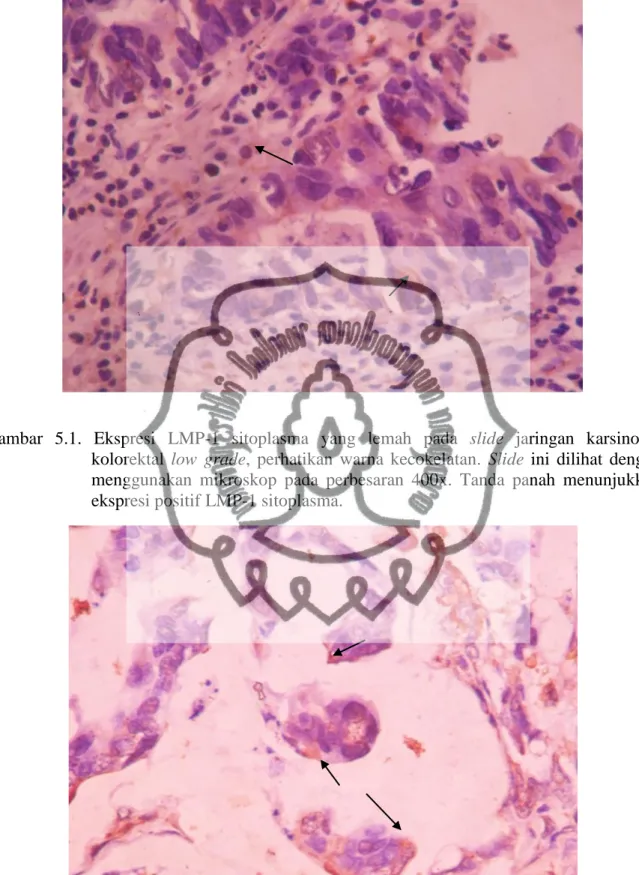
Gambar 5.1 Ekspresi LMP-1 sel tumor pada low grade ...…...…….... 43
Gambar 5.2 Ekspresi LMP-1 sel tumor pada high grade ... 43
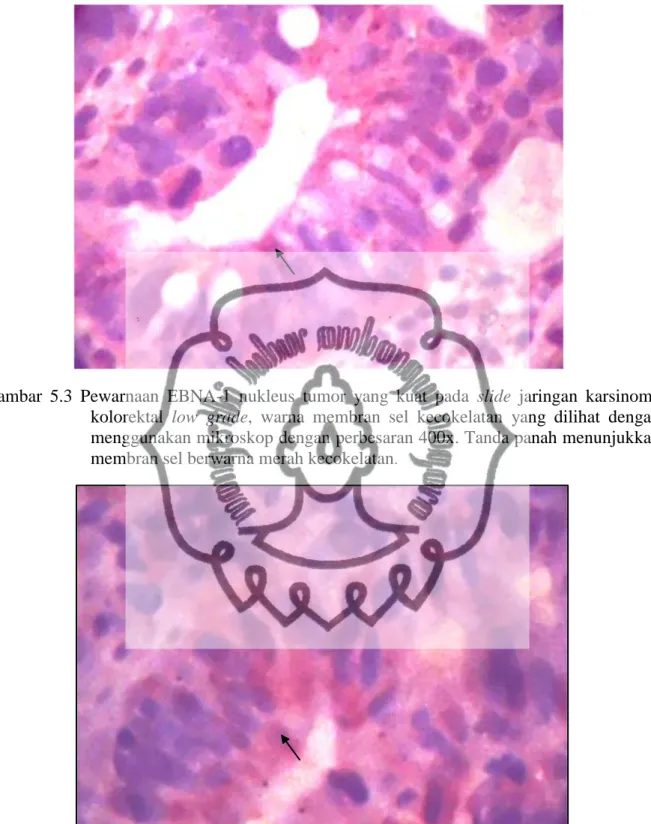
Gambar 5.3 Ekspresi EBNA-1 sel tumor pada low grade ... 44
Gambar 5.4 Ekspresi EBNA-1 sel tumor pada high grade ... 44
Gambar 5.5 Diagram histogram ekspresi LMP-1 dan EBNA-1 ...…… 46
Gambar 5.6 Diagram box plot ekspresi LMP-1 ………..…….... 47
Gambar 5.7 Diagram box plot ekspresi EBNA-1-1 ……… ………..…….... 48
xii
DAFTAR TABEL
Tabel 2.1. Ekspresi gen virus pada pola ketiga fase laten dari infeksi EBV ... 12
Tabel 2.2. Tingkat resiko kanker kolorektal ... 24
Tabel 2.3. Stadium klinis dari karsinoma kolon ... 26
Tabel 4.1. Grading prosentase jumlah sel dengan ekspresi positif ... 36
Tabel 4.2. Grading intensitas warna ekspresi ... 36
Tabel 4.3. Makna patologis ekspresi LMP-1 dalam nilai skor histologis ... 37
Tabel 5.1. Skor histologis ekspresi LMP-1 pada low grade dan high grade .. ... 45
Tabel 5.2. Nilai rata-rata ekspresi LMP-1 pada low grade dan high grade ... .... 46
Tabel 5.3. Uji normalitas ekspresi LMP-1 pada low grade ………... ... .... 48
Tabel 5.4. Uji normalitas ekspresi LMP-1 pada high grade……... ... .. 48
Tabel 5.5. Uji normalitas ekspresi LMP-1 pada high grade dan low grade …... ... . 48
Tabel 5.6. Uji normalitas ekspresi EBNA-1 pada low grade ………... .... 48
Tabel 5.7. Uji normalitas ekspresi EBNA-1 pada high grade……... .. 49
Tabel 5.8. Uji normalitas ekspresi EBNA-1 pada high grade dan low grade …... . 48
Tabel 5.9. Hasil analisis uji beda Mann-Whitney ekspresi LMP-1……... ... ... 49
Tabel 5.10. Hasil analisis uji beda t-test ekspresi EBNA-1……... ... ... 50
Tabel 5.11 Normalitas data dan perbedaan ekspresi LMP-1 dan EBNA-1... ... 83
xiii
DAFTAR SINGKATAN
EBV Epstein-Barr Virus
EBNA-1 EBV nuclear antigen 1
LMP-1 Latent Membrane Protein-1
JAK-STAT Janus kinases-signal transducing activators of transcription
PRb Protein retinoblastoma
PTEN Phospatase and Tensin homolog deleted on chromosome ten
CDK Cyclin-dependent kinase
TNF Tumour Necrosis Factor
IAP Inhibitors of Apoptosis Protein
TRAIL TNF-related apoptosis-inducing ligand
KDa kilo Dalton, satuan massa
MAPKs mitogen activated protein kinases
oriP origin of replication
EBER EBV encoded RNA
IM infectious mononucleosis
CTAR C-terminal activation
JNK c-jun N-terminal kinase
LCLs limfoblastoid cell lines
CTL Cytotoxic T-lymphocytes
DNA deoxyribo nucleic acid
RNA ribonucleic acid
MMP-9 Matrix metalloproteinase -9
xiv
HLA Human Leucocyte Antigen
MHC Major Histocompatibility Complex
WHO World Health Organization
AIDS Acquired Immuno Deficiency Syndrome
HIV Human Immunodeficiency Virus
KNF Karsinoma nasofaring
HNPCC Hereditary Non Polyposis Colorectal Cancer
NKC Natural Killer Cell
IFN-γ Interferron-γ
BL Burkitt’s Lymphoma
HHV Human Herpes Virus
TRAFS TNFR associated factors
TRADDs TNFR associated death domain proteins
NIK NF-κB inducing kinase
VEGF vascular endothelial growth factor
COX-2 cyclooxygenase 2
FGF-2 fibroblast growth factor 2
NF-κB Nuclear Factor-κB
FR family of repeats
ROS Reactive Oxygen Species
CD cluster of differentiation
USP ubiquitin-specific protease
FAP Familial Adenomatous Polyposis
Gen DCC Gen deleted in colorectal carcinoma
xv
RER Replication Error
MIN microsatellite instability
CIN chromosomal instability
CIMP CpG island methylator phenotype
KGB Kelenjar getah bening
DFS disease free survival
GC germinal centre
HL Hodgkin lymphoma
PTLDs post transplant lymphoproliferative disorders
BAB I PENDAHULUAN
A. Latar Belakang Masalah
Kanker kolorektal merupakan penyebab kematian ketiga setelah kanker paru dan kanker payudara. Angka kematian tertinggi terjadi pada usia diatas 50 tahun. Setiap tahun hampir 1 juta orang diseluruh dunia menderita kanker kolorektal (Hansen, 2007). Menurut Danish National Board of Health, tingkat kesintasan hidup relatif (relative survival rate) dalam 5 tahun adalah sekitar 50 % (Hansen, 2007). Angka kejadian tertinggi pada masyarakat barat seperti Amerika utara, Eropa barat, Australia dan New Zeland dengan angka kejadian 30-50 per 100.000 penduduk. Angka kejadian rendah pada negara Asia dan Afrika yaitu kurang dari 10 per 100.000 penduduk. Namun dilaporkan angka kejadian tinggi di Hiroshima Jepang dengan angka kejadian 87,6 per 100.000 laki-laki. Sementara pada kalangan Yahudi di Israel kanker kolorektal merupakan penyebab utama kematian pada kanker dibandingkan dengan bangsa Palestina (Darwis, 2002). Insiden spesifik (age spesific insidence) pada kanker kolorektal meningkat tajam setelah usia 35 tahun, dengan 90% kejadian pada usia lebih 50 th (Hansen, 2007). Dari evaluasi data Departemen Kesehatan Republik Indonesia, didapatkan angka kejadian 1,8 setiap 100.000 penduduk. Pada tahun 2002 terdapat lebih dari 1 juta insiden kanker kolorektal di Indonesia dengan tingkat mortalitas lebih dari 50%(Depkes, 2006).
Kejadian karsinogenesis disebabkan oleh berbagai faktor multifaktorial, multi level dan multi step antara lain adanya infeksi virus onkogenik seperti halnya virus Epstein-Barr. Infeksi virus onkogenik seperti virus Epstein-Barr telah banyak diketahui berassosiasi dengan karsinogenesis pada beberapa epitelial malignansi. Virus ini memiliki berbagai cara untuk menghambat, menghindari respon imun tubuh, dan mensukseskan penyebaran infeksinya. commit to user
Budiani et al, (2005) dalam penelitian tingkat ekspresi LMP-1 virus Epstein-Barr berhubungan dengan stadium klinik Duke’s A, B dan C pada karsinoma kolorektal menunjukkan bahwa sebanyak 15 sampel atau 100% mengekspresikan LMP-1 dengan makna positif sedang dan juga didapatkan tingkat ekspresi LMP-1 dengan nilai tampilan kuantitatif berbeda secara signifikan antar stadium Duke A, B dan C(Budiani et.al,2005). Beberapa penelitian terdahulu juga membuktikan adanya keterkaitan antara virus Epstein-Barr dengan kejadian karsinoma kolorektal(Saputra, 2012; Simatupang, 2012; Wahyudi, 2012)
Virus Epstein-Barr memilki 2 tipe, yaitu A dan B, yang dibedakan oleh produk genetik polimorfismenya antara lain EBNA-1, 2, 3A, 3B dan LMP-1, 2A dan 2B(Peh, 2003). Infeksi virus Epstein-Barr masuk melalui saliva ke dalam epitel orofaring menginfeksi limfosit B dengan glikoproteinnya gp350/220 berikatan dengan reseptor virus yaitu reseptor CR2/CD21 sehingga virus Epstein-Barr dapat mengalami fase laten yang lama(Chen, 2008). Virus Epstein-Barr mengkode protein Z(gen BZLF1/BCRF1) yang merupakan multiple transaktivator poten terhadap gen seluler untuk mengubah fase laten menjadi fase litik. BZLF1 menyerupai IL-10, dimana IL-10 menghambat pembentukan sitokin oleh sel T sehingga dapat mencegah proses inisiasi dan lisis CD8, sel NK, memblokade produksi IFN-γ dan mengurangi respon imun seluler(Chen, 2008). Kemampuan virus onkogenik ini dalam menginfeksi sel-sel epitel pada fase litiknya, tidak hanya terbatas pada epitel orofaring, tetapi juga pada epitel kolorektal. Dua jenis sel pada tubuh manusia yang bisa terinfeksi virus Epstein-Barr yakni target infeksi EBV adalah sel epitel dan sel limfosit B(Budiani et.al, 2005).
Latent membrane protein 1 (LMP-1) merupakan onkogen virus Epstein-Barr utama yang terlibat dalam immortalisasi dan proliferasi limfoblastoid cell lines (LCLs) dan berhubungan dengan sebagian besar keganasan oleh virus Epstein-Barr. Latent membrane protein 1 berfungsi sebagai reseptor aktif commit to user tumor necrosis factor (TNF) utama dan mengatur
protein anti apoptosis serta pro survival melalui aktivasi cellular signalling pathways. Ekspresi LMP-1 yang meningkat merupakan proses tumorigenesis oleh virus Epstein-Barr (Johansson, 2007). Ekspresi LMP-1 pada individu dengan defisiensi imun dapat menginduksi transformasi onkogenik dan proses limfoproliferatif dari sebukan limfosit B. Virus Epstein-Barr juga dideteksi pada individu tanpa defisiensi imun yang menderita karsinoma nasofaring, Limfoma Burkitt, limfoma non Hodgkin, limfoma Hodgkin, limfo-epitelioma timus dan karsinoma kelenjar liur, yang menimbulkan keterlibatan virus Epstein-Barr pada pathogenesis tumor tersebut (Gonzales, 2002).
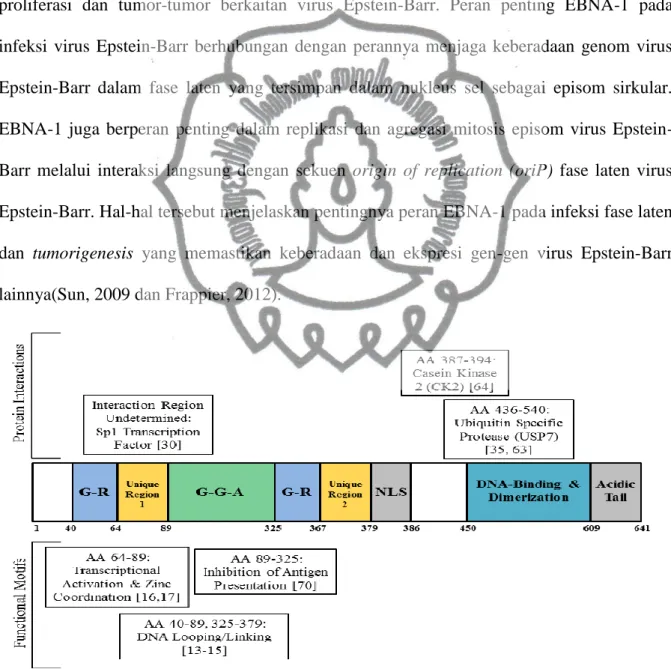
Ekspresi EBNA-1 merupakan produk protein inti virus Epstein-Barr yang berperan penting dalam regulasi gen virus Epstein-Barr, replikasi ekstra kromosom dan mempertahankan kehadiran episom virus Epstein-Barr melalui regulasi gen promotor virus. EBNA-1 dan LMP-1 secara bersamaan berperan dalam insersi informasi genom virus Epstein-Barr ke dalam host DNA, sehingga memungkinkan virus Epstein-Barr mengambil alih fungsi sel dan replikasi virus. Epstein-Barr nuclear antigen 1(EBNA-1) merupakan satu-satunya produk protein virus Epstein-Barr yang terekspresi dalam segala bentuk fase laten pada sel proliferasi dan tumor-tumor berkaitan virus Epstein-Barr. Peran penting EBNA-1 pada infeksi virus Epstein-Barr berhubungan dengan perannya menjaga keberadaan genom virus Epstein-Barr dalam fase laten yang tersimpan dalam nukleus sel sebagai episom sirkular. EBNA-1 juga berperan penting dalam replikasi dan agregasi mitosis episom virus Epstein-Barr melalui interaksi langsung dengan sekuen origin of replication (oriP) fase laten virus Epstein-Barr. Hal-hal tersebut menjelaskan pentingnya peran EBNA-1 pada infeksi fase laten dan tumorigenesis yang memastikan keberadaan dan ekspresi gen-gen virus Epstein-Barr lainnya(Frappier, 2012).
Kunci utama keberhasilan penanganan karsinoma kolorektal adalah ditemukannya kasus dalam stadium dini, sehingga terapi dapat dilaksanakan secara operatif kuratif. Tetapi commit to user
sebahagian besar pasien datang dalam keadaan lanjut sehingga umur harapan hidup rendah walaupun telah diberikan terapi. Keterlambatan pasien datang ke rumah sakit disebabkan oleh beberapa faktor antara lain, tidak jelasnya gejala awal dan ketidaktahuan dari pasien dan juga keterlambatan dari tenaga medis pemeriksa pertama (Zahari, 2000). Penapisan karsinoma kolorektal memegang peranan penting dalam deteksi dini. Dari berbagai pengalaman di negara maju memperlihatkan bahwa penapisan yang adekuat terbukti menurunkan angka kematian akibat dari karsinoma kolon dan rektum. Penapisan karsinoma kolorektal berdasarkan ekspresi beberapa protein produk virus Epstein-Barr seperti LMP-1 dan EBNA-1 belum banyak dilakukan. Berdasarkan uraian diatas maka dianggap perlu dilakukan penelitian untuk membuktikan adanya keterkaitan infeksi virus Epstein-Barr pada pathogenesis karsinoma kolorektal serta mempelajari perbedaan tingkat ekspresi LMP-1 dan EBNA-1 antara high grade dan low grade karsinoma kolorektal.
B. Rumusan Masalah
Apakah terdapat perbedaan tingkat ekspresi LMP-1 dan EBNA-1 virus Epstein-Barr antara high grade dan low grade karsinoma kolorektal ?
C. Tujuan Penelitian 1. Tujuan Umum
Untuk mengetahui adanya keterkaitan virus Epstein-Barr dengan pathogenesis karsinoma kolorektal melalui onkoprotein LMP-1 dan EBNA-1 virus Epstein-Barr. 2. Tujuan Khusus
Untuk mengetahui adanya perbedaan tingkat ekspresi LMP-1 dan EBNA-1 virus Epstein-Barr antara high grade dan low grade karsinoma kolorektal. commit to user
D. Manfaat Penelitian 1. Manfaat Teoritis
Mendapatkan bukti adanya infeksi virus Epstein-Barr dalam kaitannya dengan kejadian karsinoma kolorektal melalui studi tingkat ekspresi LMP-1 dan EBNA-1. 2. Manfaat Aplikatif
Membuktikan adanya keterkaitan antara infeksi virus Epstein-Barr pada pathogenesis karsinoma kolorektal. Sehingga dalam tatalaksana perlu dipertimbangkan pemberian obat komplementer berupa anti viral dan imunomodulator untuk menghilangkan infeksi virus Epstein-Barr.
3. Manfaat Untuk Kedokteran Keluarga
Melalui penelitian ini dengan adanya keterkaitan dan ekspresi positif dari infeksi virus Epstein-Barr terhadap pathogenesis karsinoma kolorektal, maka dapat bermanfaat untuk kedokteran keluarga dalam mengatasi infeksi virus Epstein-Barr untuk mengembangkan pemberian obat komplementer berupa anti viral dan imunomodulator.
BAB II
TINJAUAN PUSTAKA 1 Virus Epstein-Barr
Penemuan atas virus Epstein-Barr diperkenalkan oleh ahli bedah asal Inggris, Denise Burkitt, selama perjalanan tentang pelayanan kesehatan di Uganda. Burkitt pertama kalinya menjabarkan tentang adanya pembesaran limfoma pada anak-anak di rahang bawah, yang sekarang terkenal sebagai Burkitt’s Lymphoma (BL). Burkitt juga melaporkan bahwa limfoma Burkitt distribusinya tergantung faktor iklim seperti suhu dan musim hujan. Epidemiologi tentang limfoma Burkitt menarik perhatian Anthony Epstein dengan postulasinya bahwa penyebabnya berasal dari virus onkogen dan kemudian dimulailah penelitian terhadap jaringan tumor limfoma Burkitt. Akhirnya virus Epstein-Barr diidentifikasi dari turunan galur sel limfoma Burkitt menggunakan mikroskop elektron. Menariknya galur sel tersebut diproduksi dari luar pertumbuhan sel limfosit B (Johanson,2007). Oleh karena itu virus Epstein-Barr adalah tumor virus manusia pertama yang ditemukan.
Epstein Barr virus merupakan anggota famili herpesvirus dalam genus lymphocrytovirus yang ditemukan dari galur sel limfoma Burkitt. Virus Epstein-Barr menyebar luas pada populasi manusia, menginfeksi lebih dari 90% usia dewasa (Peh,2003 dan Cao,2011).
Seperti herpes virus lainnya, virus Epstein-Barr adalah virus berkapsul yang mengandung untaian inti DNA yang dilapisi nukleokapsid ikosahedral dan pembungkusnya. Anggota famili termasuk herpes simplex I dan II dan virus varisela zoster (sub famili alphavirus), cytomegalovirus, herpesvirus 8 dan virus Epstein-Barr (sub famili gamma herpesvirus). Meskipun herpesvirus dapat berada dimana-mana dalam alam, manusia tetap merupakan host alami bagi virus Epstein-Barr.
1.1 Infeksi primer dan infeksi persisten virus Epstein-Barr
Infeksi virus Eptein-Barr pada masa kanak-kanak bersifat asimptomatik. Bagaimanapun infeksi virus Epstein-Barr selama masa remaja dan dewasa mengakibatkan infeksi mononukleosis. Biasanya virus Epstein-Barr ditularkan melalui kontak dengan saliva. Individu yang terkena infeksi virus Epstein-Barr akan menjadi pembawa virus (carrier). Pada infeksi primer, virus Epstein-Barr menginfeksi dan bereplikasi dalam epitelium skuamosa berlapis dari nasofaring dan orofaring. Virus Epstein-Barr masuk ke sel B diperantarai oleh interaksi glikoprotein gp 350/220 dengan reseptor CD21 sel B dan gp 42/gH/dL dengan major histocompatibility complex (MHC) kelas II pada sel B. Akhir-akhir ini dilaporkan bahwa setelah infeksi primer pada sel B, virion virus Epstein-Barr tetap ada pada permukaan sel dan kemudian terjadi perpindahan ke sel epitel CD21 negatif sehingga terjadi infeksi pada kedua tipe sel tersebut (Johanson,2007)
Infeksi virus Epstein-Barr terhadap sel B mengakibatkan terjadinya perubahan isotop (He et al.,2003), proliferasi sel B mengakibatkan mutasi imunoglobulin (Casola et al., 2004) sehingga membuat sel B normal berubah menjadi sel B memori. Infeksi virus Epstein-Barr terhadap sel B membuat terekspresinya protein-protein laten yang nantinya terdeteksi oleh sel T spesifik yang mengontrol proliferasi sel, tetapi sel B memori yang terinfeksi mengakibatkan respon imun dengan antigen imunitas virus Epstein-Barr yang berkurang sehingga lolosnya sel B terinfeksi. Jika sel B yang terinfeksi virus Epstein-Barr masuk ke dalam plasma sel , dilepaskannya virus yang menimbulkan infeksi lebih lanjut (Johanson,2007). Fakta bahwa virus Epstein-Barr dapat mengakses dan berdiam diri pada sel B memori tanpa menimbulkan gejala panyakit adalah kunci sukses virus Epstein-Barr dalam menginfeksi sebagian besar populasi manusia.
1.2 Biologi molekular virus Epstein-Barr
Virus Epstein-Barr merupakan herpesvirus dengan panjang 184-kbp, untaian ganda genom DNA yang mengkode >85 gen. Genom virus terdiri dari 0,5 kb terminal dengan pengulangan pada tiap akhir dan interna untaian, yang membagi genom menjadi urutan domain pendek dan panjang dari kapasitas kode (Peh, 2003; Thompson, 2004).
Virus Epstein-Barr juga disebut sebagai lymphocryptovirus, karena virus ini menghasilkan (Human Herpes Virus/HHV-4 Immortalized Lymphoblastoid Cell Lines). Virus Epstein-Barr mengekspresikan enam protein inti: EBV nuclear antigen (EBNA) -1,2,3A,3B,3C dan leader protein (EBNA-LP) ;tiga latent membrane protein (LMP)-1,2A,2B; dan dua jenis small untranslated RNA yang dikenal EBV encoded RNA (EBER) -1 dan 2(Peh, 2003). LMP-1 adalah protein trans membran dengan 63 kDa fosfoprotein yang terdiri dari 3 domain, yang dibutuhkan untuk mentransformasi Rat-1 fibroblas. Virus Epstein-Barr seringkali dihubungkan dengan transformasi sel ganas, melalui aksi onkoprotein LMP-1, yang timbul selama infeksi virus (Gonzales, 2002). LMP dan EBNA 2 mengaktifasi sekresi dari molekul adhesi dari LFA-1, LFA-3 dan ICAM 1 dan CD23 FCR11 dan reseptor transferin pada sel limfoblastoid.
EBV-1 dan EBV-2 berbeda secara biologis dan distribusi geografis, walaupun tidak ditemukan perbedaan nyata dari penyakit yang ditimbulkan. Seseorang dapat terinfeksi oleh lebih dari satu jenis virus Epstein-Barr. EBV-1 ditemukan lebih sering pada sebagian besar populasi. EBV-2 ditemukan dalam jumlah yang hampir sama dengan EBV-1 di negara New Guinea. Penyebaran limfoma Burkitt dan malaria holoendemic umumnya terjadi di Afrika. Hampir separuh tumor limfoma Burkitt di Afrika mengandung EBV-2. Sedangkan 85% karsinoma nasofaringeal di Taiwan mengandung EBV-1 . Pasien dengan defisiensi imun mengalami infeksi dari kedua subtipe virus Epstein-Barr. Kondisi defisiensi imun yang telah commit to user
ada sebelumnya (HIV atau malaria) berperan penting bagi kemampuan EBV-2 untuk menginfeksi limfosit B dan menyebabkan transformasi. Penelitian lainnya menunjukkan bahwa hemophilia yang terinfeksi HIV memiliki tingkat infeksi EBV-2 lebih rendah dibandingkan homoseksual HIV. Hal ini menunjukkan adanya superinfeksi EBV-2 berkaitan dengan defisiensi imun pada pasien tersebut (Thompson, 2004).
1.3. Infeksi virus Epstein-Barr
Infeksi virus Epstein-Barr pada limfosit B diduga terjadi pada organ limfoid orofaring, dan pada carrier yang normal, virus tersebut menetap pada sel memori limfosit B yang beredar di sirkulasi. Secara alami limfotropik B yang terinfeksi virus Epstein-Barr mempunyai kemampuan membuat limfosit B yang normal menjadi immortal secara in vitro dan mengubahnya secara permanen menjadi galur sel limfoblastoid. Virus menyebar ke dalam saliva secara terus-menerus selama infeksi primer, dan kondisi ini dapat terjadi bertahun-tahun. Sekali virus sudah berkoloni di kompartemen limfosit B, reaktivasi dapat terjadi di mukosa manapun yang mengandung limfosit B.
Infeksi virus Epstein-Barr pada sel epitel merangsang aktifasi siklus litik dan replikasi virus. Pada sel B, virus Epstein-Barr tidak bereplikasi dan bahkan menunggu selesainya infeksi laten (Thorley-Lawson, 2005). Selama infeksi laten gen virus Epstein-Barr terekspresi yaitu, 6 buah antigen nukleus virus Epstein-Barr (EBNA 1-6) dan 3 buah latent membran protein (LMP-1, LMP-2A dan LMP-2B) dan juga dua buah non-polyadenylated RNA virus Epstein-Barr (EBERs) (Kieff & Rickinson,2001). Pada infeksi laten seluruh gen virus Epstein-Barr yang terekspresi membuat sel B terproliferasi. Aktifnya sel B oleh virus Epstein-Barr melalui reaksi germinal centre (GC) dimana beberapa gen saja yang terlibat (Babcock & Thorley –Lawson, 2000). Pada reaksi germinal centre (GC) sel B mengalami penukaran isotop dan mutasi gen immunoglobulin. Berdasarkan afinitas ikatan antigen commit to user
terhadap permukaan sel B dan sinyal dari sel T-helper, maka beberapa sel normal B mengalami reaksi GC akan menjadi sel B biasa sedangkan yang lain menjadi sel B memori.
Gambar 2.1. Infeksi virus Epstein-Barr (dikutip dari Fleisch dan Warren, 2003)
Epitel kolon (fase litik virus Epstein-Barr)
Gambar 2.2. Infeksi primer virus Epstein-Barr (modifikasi dikutip dari Johansson, 2007). Masuknya virus Epstein-Barr pada epitel kolon kemungkinan terjadi setelah fase latens akhir virus Epstein-Barr pada limfosit B .Sel limfosit B yang immortal dan mengandung banyak partikel virus Epstein-Barr akan segera lisis, melepaskan partikel virus Epstein-Barr dan mengadakan reinfeksi ke sel epitel kolon melalui berbagai jalur. Kehadiran virus Epstein-Barr pada epitel kolon sama dengan faktor-faktor lain akan
sama memunculkan fenotipe malignan (Budiani et.al, 2005).
Kemampuan virus onkogenik ini dalam menginfeksi sel-sel epitel pada fase litiknya, tidak hanya terbatas pada epitel orofaring, tetapi juga pada epitel kolorektal (Budiani et.al, 2005). Hal ini disebabkan epitel kolorektal memiliki reseptor khusus yang memungkinkan virus Epstein-Barr dapat berinteraksi dan selanjutnya mampu menginfeksi sel epitel mukosa kolorektal.
Budiani et al, (2005) dalam penelitiannya tingkat ekspresi LMP-1 berhubungan dengan stadium klinik Duke’s A, B dan C pada karsinoma kolorektal menunjukkan bahwa sebanyak 15 sampel atau 100% mengekspresikan LMP-1 dengan makna positif sedang dan juga didapatkan tingkat ekspresi LMP-1 dengan nilai tampilan kuantitatif berbeda secara signifikan antar stadium Duke A, B dan C.
1.4. Gen virus dan karsinogenesis
Pada infeksi laten virus Epstein-Barr tidak mengalami replikasi partikel virus pada keganasan neoplasma yang terkait virus Epstein-Barr, dimana ekspresi gen virus Epstein-Barr terbatas pada berbagai gen tumor dalam fase laten. Tumor-tumor tersebut diklasifikasikan dalam 3 tipe, yaitu laten I, II, dan III berdasarkan profil ekspresi gen virus Epstein-Barr. Virus Epstein-Barr terkait keganasan gaster, seperti juga pada Limfoma Burkitt, tampak pada infeksi laten I dimana ekpresi gen virus pada fase laten terbatas tehadap EBNA1, EBERs, LMP2A dan mengalami transkripsi dari BamHI A (BARF0 dan BARF1). Fase laten II neoplasma termasuk keganasan nasofaring dan limfoma Hodgkin dengan terekspresinya LMP-1. EBNA-2, 3A dan 3C sangat berperan dalam immortalisasi sel limfosit B, ditambah dengan kurang efektifnya mekanisme imun pada pasien dengan fase III neoplasma seperti limfoma pada penyakit AIDS atau pasien dengan transplantasi organ (Uozaki, 2008).
Tabel 2.1. Ekspresi gen virus pada pola ketiga fase laten dari infeksi virus Epstein-Barr (Dikutip dari Uozaki, 2008).
EBERs EBNA1 EBNA2,3s, LP LMP-1 LMP-2A BARFs Malignansi Laten 1 + + - - + + BL, GC dan HL Laten 2 + + - + + + NPC,NK/T dan AIDS-limfoma Laten 3 + + + + + + PTLDs
BL, Burkitt Lymphoma; HL, Hodgkin lymphoma; GC, gastric cancer; NPC, nasopharnyngeal carcinoma; PTLDs, post transplant lymphoproliferative disorders.
2. Latent membrane protein 1 (LMP-1)
Latent membrane protein 1 merupakan onkoprotein membran yang terdiri dari 386 asam amino. 6 buah domain transmembran yang saling terhubung antara domain sitoplasma
N-terminal lengan pendek dengan domain sitoplasma C-teminal lengan panjang. C-terminal
dari LMP-1 mengandung 2 fungsi domain; area C-terminal activation 1(CTAR 1) dan CTAR 2. CTAR 1, domain proksimal, berinteraksi dengan tumor necrosis factor-associated factors dan mengaktivasi NF-kB. CTAR 2, domain distal, berinteraksi tumor necrosis
factor-associated death domain protein dan juga mengaktivasi NF-kB. LMP-1 mengaktivasi c-jun
N-terminal kinase (JNK) kaskade melalui CTAR 2 dan juga menstimuli p38 mitogen-activated protein kinase (p38 MAPK) melalui CTAR 1 dan CTAR 2. CTAR 1 berikatan dengan TNFR associated factors (TRAFS) dan CTAR 2 mendorong TNFR associated death domain proteins (TRADDs) (Cahir-McFarland & Kieff, 2005). Area CTAR 1 PQQAT berikatan erat dengan TRAFs 1, 2, 3 dan 5. Hal ini mengakibatkan aktifnya NF-κB inducing kinase (NIK) dan inhibitor κB (I-κB) kinase α (IKKα) yang memperantarai aktivasi jalur non-canonical NF-κB (Atkinson et al., 2003; Eliopoulos et al., 2003; Lutfig et al., 2004). CTAR 2 mengaktifkan IKKβ yang membuat canonical NF-κB menjadi aktif (Eliopoulos et al., 2003).
Latent membrane protein-1 (LMP-1) merupakan onkogen virus Epstein-Barr utama yang terlibat dalam immortalisasi dan proliferasi limfoblastoid cell lines (LCLs) dan berhubungan dengan sebagian besar keganasan oleh virus Epstein-Barr. LMP-1 berfungsi sebagai reseptor aktif tumor necrosis factor (TNF) utama dan mengatur protein anti apoptosis serta pro survival melalui aktivasi cellular signalling pathways. Ekspresi LMP-1 yang tidak sesuai kemungkinan merupakan proses tumorigenesis oleh virus Epstein-Barr (Gonzales, 2002; Tang, 2003; Johansson, 2007). Perubahan LCLs dengan struktur LMP-1 , dimana CTAR 1 memperlihatkan bahwa kandungan yang sama pada kompleks nukleus NF-κB sebagai wild-type LCLs. Oleh sebab itu CTAR 1 dan 2 terlibat pada aktifasi NF-κB pada sel limfosit B. Penelitian-penelitian terbaru menunjukkan LMP-1 mengaktifkan jalur P13K/Akt dan berfungsi juga memetakan TRAF-binding domain kedalam CTAR1 dan residunya antara CTAR 1 dan CTAR 2 (Dawson et al., 2003; Mainou et al., 2005; Mainou et al., 2007). Jalur P13K/AKT berperan dalam survival sel yang terinfeksi, anti apoptosis dan proliferasi sel menjadi ganas(Chen, 2012).
Gambar 2.3. Latent Membran Protein-1(LMP-1) (Dikutip dari Johanson,2007).
Pada sel epitel, aktifnya JNK dan jalur p38 lebih banyak dipengaruhi oleh CTAR 2, sedangkan CTAR 1 lebih cenderung untuk mengaktifkan NF-κB. TRAF 1 mengekspresikan commit to user
CTAR 1 untuk mengaktifkan JNK pada sel epitel (Eliopoulos, 2003) dengan adanya sinyal melalui CTAR 1 dan CTAR 2 berbeda terhadap faktor yang ada pada sel inang dari virus Epstein-Barr.
Latent membrane protein 1 menginduksi ekspresi invasi seluler dan faktor metastasis, termasuk matrix metalloproteinase-9 (MMP-9), yang berperan penting dalam invasi tumor. LMP-1 menginduksi vascular endothelial growth factor (VEGF) melalui induksi cyclooxygenase 2 (COX-2). Lebih lanjut, LMP-1 menginduksi dan menyebabkan dilepasnya fibroblast growth factor 2 (FGF-2) ke dalam cairan ekstraseluler. Beberapa tumor dimana LMP-1 terekspresi dan invasi, seperti karsinoma nasofaring, sangat invasif dan dikarakteristik dengan pembentukan pembuluh-pembuluh darah baru (Wakisaka, 2004).
Gambar 2.4. LMP-1 (Dikutip dari Wakisaka,2004).
LMP-1 adalah onkogen virus Epstein-Barr utama yang terlibat dalam immortalisasi dan proliferasi limfoblastoid cell lines (LCLs) dan berhubungan dengan sebagian besar keganasan virus Epstein-Barr. LMP-1 menginduksi MMp-9, IL-8, FGF-2 dan COX-2 melalui sinyal NF-κB. LMP-1 juga menginduksi HIF-1α melalui ROS dan jalur P42/p44 MAPK. Kemudian LMP-1 menginduksi invasi dan faktor angiogenesis dan akhirnya mempromosikan metastasis tumor(Wakisaka,2004). LMP-1 terlibat dalam transformasi dengan berperan sebagai reseptor aktif utama (CD40) dan meniru sinyal pertumbuhan sel yang dalam keadaan
normal dihasilkan dari ikatan ligan CD40. LMP-1 berhubungan langsung onkogenesis karena kemampuannya untuk merekrut susunan gen sel. Hal ini menghambat apoptosis dengan meningkatkan tingkat Bcl-2.
LMP-1 adalah protein membran integral berukuran 62 kD dengan enam segmen membran hidrofobik dan gugus COOH-terminal, yang berisi efektor. Agregat LMP-1 pada membran plasma yang mirip dengan susunan yang dibentuk oleh ikatan ligan-reseptor faktor pertumbuhan. Analisis mutasi menunjukkan bahwa terminal NH2 dan segmen transmembran LMP-1 bertanggung jawab atas agregasi membran yang penting untuk immortalisasi (Thompson, 2004).
LMP-1 menyerupai CD40 dalam hal berhubungan dengan tumor necrosis factor receptor-associated factors (TRAFs) yang serupa. Domain COOH-terminal dari LMP-1 berinteraksi dengan TRAF-1 dan TRAF-2 serta tumor necrosis factor receptor-associated death domain protein. Interaksi TRAFs dan tumor necrosis factor receptor-associated death domain protein diperantarai oleh domain COOH-terminal LMP-1 yang dikenal sebagai area efektor transformasi. Transformation effector site-1 mengikat TRAFs, dan transformation effector site-2 mengikat tumor necrosis factor receptor-associated death domain. Sekitar empat jalur aktivasi sinyal, yaitu nuclear factor B, c-Jun NH2-terminal kinase, p38 mitogen-activated protein kinase, dan Janus kinase/signal transducers and activators of transcription mempengaruhi fungsi LMP-1. Molekul-molekul ini mempengaruhi signaling cascade Nuclear factor B merupakan kunci faktor transkripsi yang terlibat dalam regulasi pertumbuhan sel dan apoptosis. Faktor ini juga mengontrol ekspresi dari berbagai sitokin, termasuk lymphotoxin, yang merupakan autokrin faktor pertumbuhan sel yang ditransformasi oleh virus Epstein-Barr. p38/ mitogen activated protein kinase juga merupakan pusat jalur sinyal dan mengaktivasi faktor transkripsi ATF2. Sementara itu, kaskade Janus kinase/signal
transducers and activators of transcription berinteraksi dengan jalur activator protein-1 transcription factor (Tang, 2003; Thompson, 2004).
Aktivasi kaskade yang terkait dengan LMP-1 mengarah pada meningkatnya ekspresi adhesi molekul sel B (LFA1, CD54, dan CD58), meningkatkan ekspresi marker sel B (CD23, CD39, CD40, CD44, dan HLA kelas II), dan perubahan morfologis seperti penggumpalan sel. Interaksi LMP-1 juga menyebabkan ekspresi berlebihan protein BCL-2 dan A20, yang melindungi sel yang terinfeksi dari apoptosis yang diperantarai oleh p53 (Thompson, 2004). Pada sel limfoma Burkit, LMP1 dapat menginduksi proyeksi virus, pertumbuhan padat dan ekspresi dari penanda aktivasi (CD23 dan CD40), molekul adhesi (ICAM1, LFA, dan LFA3)dan protoonkogen bcl2 dan dapat menghambat apoptosis yang dipicu oleh p53 (Tang, 2003; Thompson, 2004).
Kemampuan berubahnya LMP-1 berhubungan dengan kemampuan untuk meregulasi protein anti-apoptosis. Regulasi LMP-1 dari beberapa protein seluler berpusat pada fungsinya dalam mengaktivasi beberapa jalur sinyal seluler seperti Nuclear Factor-κB(NF-κB), c-Jun NH2-terminal kinase (JNK), p38 kinase, phosphatidyllinositol 3-kinase(PI3K), dan beberapa
kemungkinan jalur lainnya (Dawson et al.,2003). LMP-1 melindungi sel melawan apoptosis dengan meregulasi ekspresi protein anti apoptosis Bcl-2, Mcl-1 dan A20. LMP-1 menginduksi ekspresi permukaan sel dari CD23, CD30, CD39, CD44 dan molekul adhesi sel LFA1, LFA3 dan ICAM1 (Kieff & Rickinson, 2001). LMP-1 memicu ekspresi survivin melalui NF-κB dan AP-1 signal pathways dan ekspresi survivin tersebut mengakibatkan proliferasi sel terus-menerus dan menghambat apoptosis.
Pada sel B yang terinfeksi virus Epstein-Barr, LMP-1 diekspresikan bersama-sama dengan gen-gen laten virus Epstein-Barr lainnya. LMP-1 dapat menyerupai sinyal CD40 yang menginduksi penanda permukaan sel secara luas termasuk aktivasi dan adhesi molekulnya. Hal ini mengarah ke proliferasi limfoblas baik morfologis dan fenotip yang menyerupai commit to user
antigen yang mengaktifkan sel B blast. Secara umum germinal centre sel B blast mengalami pertukaran Ig dan secara acak terjadi mutasi gen immunoglobulin yang nampak pada permukaan selnya. Sel B secara kompit terikat dengan antigennya dan mengekspresikan afinitas tertinggi reseptor sel B (BCR) dan memasuki reservoir sel B memori. LMP-1 dan LMP-2 bersama-sama mengekspresikan sinyal yang dibutuhkan sel B untuk dapat lolos dari kompartemen germinal centre menjadi sel B memori dengan ketiadaan sinyal BCR. Maka sinyal LMP-1 membantu virus Epstein-Barr memperoleh akses ke reservoir sel B memori sehingga virus tersebut dapat memperpanjang masa hidupnya( Thorley-Lawson, 2005). 3. EBNA-1
EBNA-1 merupakan homo-dimeric, protein pengikat DNA yang mengikat sisi spesifik terhadap sekuen DNA dengan panjang 16 bp (pasangan basa) melalui ikatan DNA dan dimerisasi domain yang terletak pada ujung C-terminal. Dengan ikatan EBNA-1 dengan origin of replication (oriP) dari virus Epstein-Barr, maka EBNA-1 memperlancar sintesis protein dari virus Epstein-Barr dan sintesis dari plasma virus ke sel anakan selama proses mitosis(Smith, 2013).
EBNA-1 juga berfungsi sebagai transaktivator transkripsi virus. Ketika berikatan dengan family of repeats(FR), EBNA-1 memperbanyak transkripsi dari Cp, sebuah promotor aktif selama fase laten dari siklus sel virus Epstein-Barr. EBNA-1 yang berikatan dengan family of repeats(FR) memperbanyak transkripsi gen virus, Laten Membrane Protein 1(LMP-1) dan dengan jarak 10 kbp menyilang pada akhir ujung sirkular dari genom virus. Ikatan EBNA-1 dengan FR memperbanyak transkripsi dari heterolog promotor dan transkripsi gen pada fase laten yang menginduksi dan mempertahankan proliferasi sel yang terinfeksi virus Epstein-Barr(Smith, 2013).
Ekspresi EBNA-1 merupakan produk protein inti virus Epstein-Barr yang berperan penting dalam regulasi gen virus Epstein-Barr, replikasi ekstra kromosom dan commit to user
mempertahankan kehadiran episom virus Epstein-Barr melalui regulasi gen promotor virus. EBNA-1 dan LMP-1 secara bersamaan berperan dalam insersi informasi genom virus Epstein-Barr ke dalam host DNA, sehingga memungkinkan virus Epstein-Barr mengambil alih fungsi sel dan replikasi virus.
Epstein-Barr nuclear antigen 1 (EBNA-1) merupakan satu-satunya produk protein virus Epstein-Barr yang terekspresi dalam segala bentuk fase laten dan fase litik pada sel proliferasi dan tumor-tumor berkaitan virus Epstein-Barr. Peran penting EBNA-1 pada infeksi virus Epstein-Barr berhubungan dengan perannya menjaga keberadaan genom virus Epstein-Barr dalam fase laten yang tersimpan dalam nukleus sel sebagai episom sirkular. EBNA-1 juga berperan penting dalam replikasi dan agregasi mitosis episom virus Epstein-Barr melalui interaksi langsung dengan sekuen origin of replication (oriP) fase laten virus Epstein-Barr. Hal-hal tersebut menjelaskan pentingnya peran EBNA-1 pada infeksi fase laten dan tumorigenesis yang memastikan keberadaan dan ekspresi gen-gen virus Epstein-Barr lainnya(Sun, 2009 dan Frappier, 2012).
Gambar 2.5. Struktur representasi EBNA-1 dengan domain protein berikatan(Smith, 2013).
Kemampuan EBNA-1 untuk mengatur ekspresi gen virus, replikasi gen dan partisi genom virus tergantung dari ikatan sisi spesifik terhadap genom virus melalui C-terminal DNA-binding dan dimerisasi domain. EBNA-1 membuat sel yang terinfeksi virus Epstein-Barr mempertahankan genom virusnya dengan cara meregulasi signaling pathways pada sel inang dan membuat sel terinfeksi terhindar dari identifikasi selama fase laten(Frappier, 2012). EBNA-1 dapat berperan sebagai onkoprotein dari virus Epstein-Barr dengan cara meningkatkan level Reactive Oxygen Species (ROS) dan instabilitas genom dengan meningkatnya ekspresi sub unit katalitik dari NADPH oksidase, Nox2 pada sel inang(Smith, 2013).
Ketika ekspresi EBNA-1 meregulasi transkripsi gen seluler tidak komplit, EBNA-1 berperan sebagai antigen. Ekspresi EBNA-1 pada sel terinfeksi tidak membuat sel tersebut dikenali oleh CD8(cluster of differentiation 8) cytotoxic T-cells. EBNA-1 berkontribusi dalam berbagai fungsi pada fase laten siklus sel, termasuk sintesis dan partisi genom virus dalam proliferasi dan regulasi sel(Smith, 2013).
EBNA-1 berperan dalam metilasi CpG suatu mekanisme penting dalam regulasi promotor dan ekspresi gen pada fase laten virus Epstein-Barr. EBNA-1 terekspresi pada keganasan yang berkaitan dengan virus Epstein-Barr dan berperan penting pada transformasi dan tumorigenesis sel. EBNA-1 berikatan dengan genom viral dan promotor seluler serta aktif dalam faktor transkripsi protein seluler dengan kaskade transkripsi yang memicu regulasi beberapa komplek molekul sel terinfeksi (Sompallae, 2010).
EBNA-1 berkontribusi dalam banyak hal infeksi virus Epstein-Barr dengan kemampuannya berinteraksi melalui sekuen DNA tertentu dan multipel protein seluler. Kontribusi EBNA-1 pada fase laten virus Epstein-Barr yakni berperan dalam replikasi dan segregasi mitosis episom virus Epstein-Barr, transkripsi virus dan efeknya pada protein seluler dan pathways sehingga berperan dalam keberlangsungan dan proliferasi sel commit to user
terinfeksi. EBNA-1 juga berperan dalam perubahan sel yang meningkatkan kerusakan DNA sehingga berperan dalam terjadinya keganasan terkait virus Epstein-Barr (Frappier, 2012). Peranan EBNA-1 tidak hanya terbatas menjaga genom virus Epstein-Barr, tetapi juga meningkatkan kondisi seluler sehingga menjadi tidak stabil dan akhirnya mengarah ke keganasan. EBNA-1 dapat menurunkan level p53 dengan memicu ubiquitin-specific protease USP7 sehingga p53 menjadi tidak stabil. Hal ini memungkinkan EBNA-1 dapat mengubah p53 pada epitel sel yang terinfeksi virus Epstein-Barr sehingga sel menjadi berproliferasi dan anti apoptosis (Sivachandran, 2011).
4. Kanker kolorektal
Kanker kolorektal merupakan penyebab kematian ketiga setelah kanker paru dan kanker payudara. Angka kematian tertinggi terjadi pada usia diatas 50 tahun. Setiap tahun hampir 1 juta orang diseluruh dunia menderita kanker kolorektal (Hansen, 2007). Menurut Danish National Board of Health, tingkat kelangsungan hidup relatif (relative survival rate) dalam 5 tahun adalah sekitar 50 % (Hansen, 2007). Angka kejadian tertinggi pada masyarakat barat seperti Amerika utara, Eropa barat, Australia dan New Zeland dengan angka kejadian 30-50 per 100.000 penduduk.
Angka kejadian rendah pada negara Asia dan Afrika yaitu kurang dari 10 per 100.000 penduduk. Namun dilaporkan angka kejadian tinggi di Hiroshima Jepang dengan angka kejadian 87,6 per 100.000 laki-laki. Sementara pada kalangan Yahudi di Israel kanker kolorektal merupakan penyebab utama kematian pada kanker dibandingngkan dengan bangsa Palestina (Darwis, 2002). Pada bangsa Israel yang lahir di Eropa mempunyai angka kejadian yang tinggi sekitar 42 per 100.000 peduduk dibanding penduduk Israel yang lahir di Afrika dengan angka 25 per 100.000 penduduk (Darwis, 2002). Sedangkan angka kejadian pada bangsa Palestina 7 per 100.000 penduduk (Darwis, 2002). Risiko seumur hidup (lifetime risk) commit to user
kanker kolorektal pada populasi negara industri barat dapat mencapai 6% (Hansen, 2007). Insiden spesifik (age spesific insidence) pada kanker kolorektal meningkat tajam setelah usia 35 tahun, dengan 90% kejadian pada usia lebih 50 th (Hansen, 2007).
Dari evaluasi data Departemen Kesehatan Republik Indonesia, didapatkan angka kejadian 1,8 setiap 100.000 penduduk(Sjamsuhidajat, 2006).Pada tahun 2002 terdapat lebih dari 1 juta insiden kanker kolorektal di Indonesia dengan tingkat mortalitas lebih dari 50%(Depkes, 2006).
4.1 Etiologi
Secara umum dinyatakan bahwa untuk perkembangan kanker kolorektal merupakan interaksi berbagai faktor yakni faktor lingkungan dan faktor genetik. Faktor lingkungan yang multipel bereaksi terhadap predisposisi genetik atau defek yang didapat dan berkembang menjadi kanker kolorektum(Kelompok Kerja Adenokarsinoma Kolorektal, 2006).
Terdapat 3 kelompok kanker kolorektal berdasarkan perkembangannya yaitu:
1.Kelompok yang diturunkan (inherited) yang mencakup kurang dari 10% dari kasus kanker kolorektum.
2.Kelompok sporadik, yang mencakup sekitar 70%. 3.Kelompok familial mencakup 20%.
Kelompok yang diturunkan adalah pasien yang waktu dilahirkan sudah dengan mutasi sel germinativum pada salah satu alel dan terjadi mutasi somatik pada alel yang lain. Contohnya adalah FAP(Familial Adenomatous Polyposis) dan HNPCC(Hereditary Non Polyposis Colorectal Cancer). HNPCC terdapat pada sekitar 5% dari kanker kolorektal. Kelompok sporadik membutuhkan dua mutasi somatik, satu pada masing-masing alelnya (Kelompok Kerja Adenokarsinoma Kolorektal, 2006).
Kelompok familial tidak sesuai ke dalam salah satu dari dominant inherited syndrome di atas (FAP danHNPCC) dan lebih dari 35% terjadi pada umur muda. Meskipun kelompok familial dari kanker kolorektal dapat terjadi karena kebetulan saja, ada kemungkinan peran dari faktor lingkungan, penetrasi mutasi yang lemah atau mutasi-mutasi germinativum yang sedang berlangsung(Zahari, 2000; Kelompok Kerja Adenokarsinoma Kolorektal, 2006). 4.2 Patogenesis
Banyak kasus karsinoma kolorektal berlangsung sporadik, dan hanya 25 % kasus pasien memiliki riwayat penyakit keluarga, dan kelainan gen lainnya yang menimbulkan gejala mengarah ke karsinoma kolorektal sekitar 5-6% kasus. Penelitian-penelitian terdahulu sudah ada yang meneliti tentang keterkaitan infeksi viral seperti virus Epstein-Barr terhadap pathogenesis karsinoma kolorektal(Saputra,2012;Simatupang,2012;Wahyudi,2012). Terdapat 2 model perjalanan perkembangan karsinoma kolorektal, yaitu:
1. LOH (loss of heterozygosity)
Model LOH mencakup mutasi tumor gen suppressor yang meliputi gen APC(adenomatous polyposis coli), gen DCC (deleted in colorectal carcinoma) dan p53 serta aktivasi onkogen yaitu K-ras proto oncogene. Sebagai contoh model ini adalah perkembangan polip menjadi karsinoma kolorektal.
2. RER (Replication Error)
Model RER karena ada mutasi gen hMSH2, hMLH1, hPMS1 dan hPMS2. Contoh model ini adalah perkembangan HNPCC menjadi kanker kolorektal. Pada bentuk sporadik, 80% berkembang lewat model LOH dan 20 % berkembang lewat model RER.
Pada kasus sporadik dapat diketahui subtipe molekul yang berperan pada karsinoma kolorektal, yaitu: MIN(microsatellite instability) 15% kasus, CIN (chromosomal instability) 50% kasus, CIMP(CpG island methylator phenotype) 35-40% kasus. (Selgrad,2008).
4.3 Deteksi
Deteksi dini atau skrining dan diagnosis pada penatalaksanaan kanker kolorektal memiliki peranan peranan penting didalam memperoleh hasil yang optimal yakni meningkatnya survival dan menurunnya tingkat morbiditas dan mortalitas para penderita kanker kolorektal.
Deteksi dini dapat diartikan adalah penemuan kasus pada individu asimptomatik untuk mendeteksi penyakit pada stadium dini sehingga dapat dilakukan terapi kuratif.
4.4 Indikasi
Secara umum deteksi dini dilakukan pada dua kelompok yaitu populasi umum dan kelompok resiko tinggi(Kelompok Kerja Adenokarsinoma Kolorektal, 2006)
Deteksi dini pada populasi dilakukan kepada individu yang berusia diatas 40 tahun
Deteksi dini dilakukan pula pada kelompok masyarakat yang memiliki resiko tinggi menderita karsinoma kolorektal yaitu:
Penderita yang telah menderita kolitis ulkserativa atau Crohn > 10 tahun.
Penderita yang telah menjalani polipektomi pada adenoma kolorektal.
Individu dengan adanya riwayat keluarga menderita karsinoma kolorektal
Individu dengan riwayat keluarga memiliki resiko menderita karsinoma kolorektal 5 kali lebih tinggi dari pada individu pada kelompok usia yang sama tanpa riwayat penyakit tersebut.
Terdapat dua kelompok pada individu dengan keluarga penderita karsinoma kolorektal yaitu:
Individu yang memiliki riwayat keluarga dengan Hereditary Non Polyposis Colorectal Cancer (HNPCC).
Individu yang didiagnosis secara klinis menderita Familial Adenomatous Polyposis
Pada kelompok HNPCC terdapat tiga tingkat resiko terhadap kemungkinan seseorang individu menderita karsinoma kolorektal dan kriteria untuk masing-masing resiko dapat dilihat pada tabel dibawah ini.
Kriteria tingkat resiko pada individu dengan riwayat keluarga penderita karsinoma kolorektal(Kelompok Kerja Adenokarsinoma Kolorektal, 2006).
Tabel. 2.2 Tingkat resiko kanker kolorektal(Kriteria Amsterdam) Tingkat Resiko Kriteria
Tinggi Paling sedikit tiga anggota keluarga menderita karsinoma kolorektal atau paling sedikit dua dengan karsinoma kolorektal dan satu dengan karsinoma endometrial pada paling sedikit dua generasi. Satu dari anggota keluarga telah menderita dibawah usia 50 tahun dan salah satu anggota yang didiagnosis adalah silsilah pertama dari keluarga
Ditemukannya pembawa (carrier) gen HNPCC
Anggota keluarga yang tidak diuji genetik
Sedang Seorang anggota keluarga silsilah pertama menderita karsinoma kolorektal pada usia < 45 tahun, atau
Dua anggota keluarga silsilah pertama menderita karsinoma kolorektal (seseorang pada usia < 55 tahun), atau
Dua atau tiga anggota keluarga (salah seorang pada usia< 55 tahun) dengan karsinoma kolorektal atau karsinoma endometrial yang merupakan silsilah pertama
Rendah Seseorang yang tidak memenuhi kriteria tinggi dan sedang
Apabila tidak dilakukan terapi, 7 % penderita Familial Adenomatous Polyposis akan menderita adenoma pada usia 21 tahun, 50% pada usia 39 tahun, dan 90% pada usia 45 tahun.
4.5 Stadium
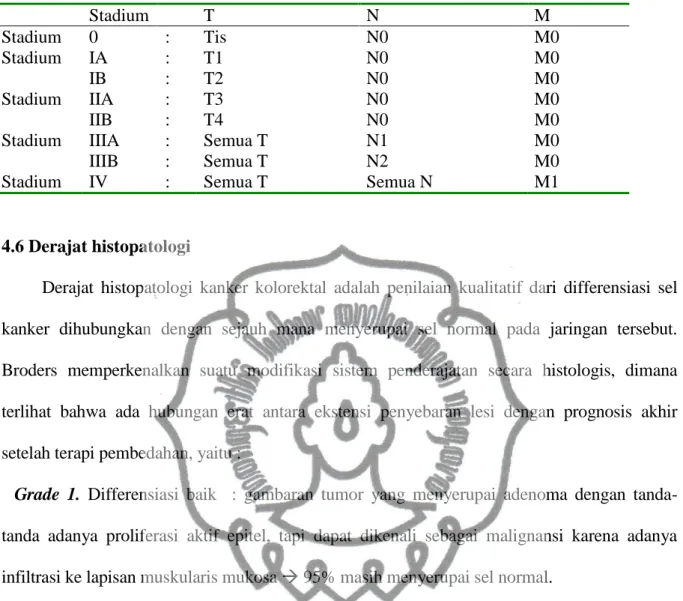
Stadium Dukes Modifikasi Astler Coller(Kelompok Kerja Adenokarsinoma Kolorektal, 2006)
Stadium A: tumor terbatas pada lapisan mukosa
Stadium B1: tumor menginvasi sampai lapisan muskularis propria
Stadium B2: tumor menginvasi menembus lapisan muskularis propria Stadium C1: tumor B1 dan ditemukan anak sebar pada KGB
Stadium C2: tumor B2 dan ditemukan anak sebar pada KGB Stadium D: tumor bermetastasis jauh
Stadium berdasarkan TNM pT – Tumor Primer
pTx : Tumor primer tidak dapat dinilai pT0 : Tumor primer tidak ditemukan
pTis : Karsinoma insitu, intraepithelial atau ditemukan sebatas lapisan mukosa saja pT1 : Tumor menginvasi submukosa
pT2 : Tumor mengivasi lapisan muskularis propia
pT3 : Tumor menembus muskularis propia hingga lapisan serosa atau jaringan perikolika/perirectal belum mencapai peritoneum
pT4 : Tumor menginvasi organ atau struktur disekitarnya atau menginvasi sampai peritoneum visceral
pN – Kelenjar getah bening Regional
pNx : Kelenjar getah bening regional tidak dapat dinilai
pN0 x : Tidak ditemukan metastasis pada kelenjar getah bening regional pN1 : Ditemukan anak sebar pada -3 kelenjar getah bening regional pN2 : Ditemukan anak sebar pada 4 atau lebih kelenjar getah bening regional pM – Metastasis jauh
pMx : Metastasis jauh tidak dapat dinilai pM0 : Tidak ditemukan metastasis jauh pM1 : Ditemukan metastasis jauh
Tabel 2.3. Stadium klinis dari karsinoma kolon Stadium T N M Stadium 0 : Tis N0 M0 Stadium IA : T1 N0 M0 IB : T2 N0 M0 Stadium IIA : T3 N0 M0 IIB : T4 N0 M0
Stadium IIIA : Semua T N1 M0
IIIB : Semua T N2 M0
Stadium IV : Semua T Semua N M1
4.6 Derajat histopatologi
Derajat histopatologi kanker kolorektal adalah penilaian kualitatif dari differensiasi sel kanker dihubungkan dengan sejauh mana menyerupai sel normal pada jaringan tersebut. Broders memperkenalkan suatu modifikasi sistem penderajatan secara histologis, dimana terlihat bahwa ada hubungan erat antara ekstensi penyebaran lesi dengan prognosis akhir setelah terapi pembedahan, yaitu :
Grade 1. Differensiasi baik : gambaran tumor yang menyerupai adenoma dengan tanda-tanda adanya proliferasi aktif epitel, tapi dapat dikenali sebagai malignansi karena adanya infiltrasi ke lapisan muskularis mukosa 95% masih menyerupai sel normal.
Grade 2. Diferensiasi sedang : gambaran tumor dengan sel-sel kanker yang banyak berkelompok tetapi tetap terbatas dalam bentuk yang cukup rata pada satu atau 2 lapisan lebih dalam di sekitar ruang glandula. Umum terlihat adanya nukleus yang berwarna dan bentuk mitosis yang tidak teratur 50 - 95% menyerupai sel normal.
Grade 3. Differensiasi buruk : gambaran sel tumor makin anaplastik dan tidak membentuk sistem glandular sama sekali, tetapi meliputi setiap jaringan atau dalam kelompok yang tidak teratur 5 – 49% menyerupai sel normal.
Grade 4. Tidak berdiferensiasi : dimana < 5% yang menyerupai sel normal dan terutama terdiri dari sel raksasa berkumparan pleomorfik atau sel kecil berinti atipik.
Kemudian dimodifikasi oleh WHO menjadi 2 grade(Carolyn,2012) : Low grade : G1 dan G2
High grade : G3 dan G4
4.7 Penatalaksanaan
Terapi kanker kolorektal merupakan terapi multi modalitas dengan andalan utama adalah terapi pembedahan.Dari beberapa laporan rumah sakit pendidikan di Indonesia ternyata bahwa 70-80% dari penderita tidak dapat dioperasi karena buruknya keadaan umum atau datang sudah dalam stadium lanjut. Di rumah sakit Dr. M. Djamil Padang sebagai rumah sakit pendidikan setiap tahunnya dapat menangani tidak kurang lebih dari 60 kasus/ tahun(Zahari, 2000; Zahari, 2002; Syamsuhidayat, 2006).
Modalitas terapi pada kasus kolorektal terdiri dari: 1.Operasi kuratif dan operasi paliatif
2.Kemoterapi adjuvan dan neoadjuvan 3.Kemoradioterapi pre dan paska operasi 4. Imunoterapi
4.7.1 Terapi pembedahan
Pembedahan tetap merupakan pilihan utama pada penatalaksanaan kanker kolorektal yang masih terlokalisir. Ada dua hal yang harus diperhatikan sebelum melakukan pembedahan pada karsinoma kolorektal yaitu terjadinya trombosis vena dan infeksi luka. Oleh karena itu perlu dilakukan persiapan pencegahan tromboemboli vena dan antibiotika profilaksis serta persiapan usus.
Operasi kanker kolon yang radikal dan kuratif adalah mengangkat satu blok jaringan lymphovaskular(en bloc resection). Untuk kanker kolon dapat dilakukan operasi seperti hemikolektomi kanan dan diperluas untuk kolon ascenden dam fleksura hepatika. Kanker commit to user
kolon yang berlokasi di kolon transversum bagian tengah dilakukan reseksi kolon transversum dan kanker kolon di fleksura lienalis dan kolon desenden dilakukan hemikolektomi kiri. Bila lokasi tumor di kolon sigmoid dapat dilakukan reseksi kolon sigmoid atau hemikolektomi kiri.
Pembedahan kanker rektum ditemukan banyak bukti dari penelitian studi kohort bahwa penggunaan teknik total mesorectal excision (TME) dapat mengurangi rekurensi lokal , memperbaiki angka ketahanan hidup. TME juga diindikasikan terutama pada kanker rektum letak sepertiga tengah dan bawah. Saat ini semua operasi tersebut dapat dilakukan secara laparoskopik, dengan keuntungan rasa nyeri paska operasi yang jauh berkurang, berkurangnya pemakaian obat analgetika, lama perawatan di rumah sakit dan jumlah perdarahan kurang dibandingkan cara konvensional(Zahari,2000; Syamsuhidayat, 2006). 4.7.2 Radioterapi
Angka kekambuhan paska operasi kanker kolorektal dengan KGB positif mencapai 60 %. Terjadi umumnya pada 2 tahun pertama 20-30%. Untuk memperbaiki hasil terapi ini diberikan radiasi pre- dan paska operasi dan kemoterapi. Radiasi pada kanker kolorektal dapat diberikan sebagai radiasi eksterna paska operasi, pra operasi dan kemoradiasi.
4.7.3 Kemoterapi
Perkembangan kemoterapi pada kanker kolorektal mengalami kemajuan yang amat pesat dalam dua dasawarsa ini. Tanpa pemberian kemoterapi pasien kanker kolorektal stadium III hanya mempunyai masa bebas penyakit disease free survival (DFS) 3 tahun sebesar 52%.
Beberapa protokol atau cara pemberian sitostatika pada kanker kolorektal yang saat ini digunakan adalah:
Capecitabine tunggal: 2500 mg/m2/hari dibagi 2 dosis, hari 1-14 diikuti 7 hari istirahat. Ulangi setiap 3 minggu commit to user
Protokol MAYO leucovorin 20 mg/m2/IV bolus, hari 1-5; 5 FU 425 mg/m2/IV bolus 1 jam setelah leucovorin hari 1-5; ulangi setiap 4 minggu.
Obat kemoterapi yang biasa digunakan pada karsinoma kolon dan rektum adalah 5-fluorouracil (5-FU), Leukovarin, Irinotecan, Oxiliplatin, Capecitabine, dan perkembangan terbaru pada terapi antibodi monoklonal karsinoma kolon dengan menggunakan bevacizumab dan cetuximab telah digunakan pada terapi karsinoma kolon (Ashariati, 2004; Kelompok Kerja Adenokarsinoma Kolorektal, 2006).
4.7.4 Imunoterapi
Strategi imunoterapi merangsang daya imun pasien untuk cepat berespon menyerang dan menghancurkan sel tumor. Sistem imun bekerja dengan mengaktifkan sel pengawas untuk mendeteksi dan menghancurkan benda asing. Sistem imun secara alami dapat mengidentifikasi dan menghilangkan sel berdasarkan ekspresi antigen, bagaimanapun sel tumor lebih canggih lagi dapat menghilangkan ekspresi antigen permukaan sehingga tidak menyerupai benda asing. Penatalaksanaan imunoterapi kanker dengan meningkatkan sistem imun atau melatih sistem imun untuk menyerang spesifik antigen sel tumor. Penatalaksanaan imunoterapi kanker kolorektal termasuk vaksin kanker, adapted cell transfer, immune checkpoint inhibitors, antibodi monoklonal, dan terapi kombinasi(Faster cures, 2014).
Vaksin aktif imunoterapi kanker terdiri dari antigen tumor yang mengandung molekul protein yang diekspresikan pada permukaan sel tumor. Antigen karsinoma kolorektal yang telah digunakan pada pengembangan vaksin termasuk CEA, MUC-1, CD55, CD17-1A, Ras mutant, p53 dan lainnya. Pendekatan imunoterapi lainnya adalah adoptive cell transfer(ACT) dengan cara anti tumor sel T(biasanya tumor infiltrating lymphocytes(TILs)) dimanipulasi in vitro kemudian ditarik lagi ke dalam sel. Sel tumor dapat merubah ekspresi beberapa molekul antigen permukaan sel agar tidak dikenali sebagai benda asing. Lebih spesifik lagi, sel tumor mengekspresikan molekul yang berfungsi sebagai “immune checkpoints” yang bertugas commit to user
mengirimkan sinyal ke sistem imun agar respon sistem imun tidak diaktifkan. Peneliti telah menemukan obat-obatan yang menghambat “immune checkpoints” yang efektif merusak ikatan molekul sehingga sistem imun dapat berespon melawan sel tumor. Obat-obatan ini disebut immune checkpoint inhibitor. Antibodi monoklonal yang digunakan ipilimumab(Yervoy) merupakan antibodi yang mengikat CTLA-4 pada sel tumor. Antibodi monoklonal lainnya adalah anti-PD-1 dan antibodi anti-PD-L1. Peneliti juga menggabungkan imunoterapi dan targeted therapy dengan keuntungan antara lain:
Regresi tumor secara cepat, sehingga menambah efektivitas imunoterapi
Memicu respon anti tumor
Membuat sel tumor lebih mudah dihancurkan oleh sistem imun
Menambah jumlah antigen presenting dendritic cells(Faster cures, 2014).
Pada disertasi Metria, 2006 tentang profil imunitas penderita karsinoma kolorektal usia muda, baya dan tua didapatkan hasil bahwa profil imunitas penderita KKR usia tua lebih baik dari profil imunitas penderita KKR usia muda dan pengelolaan stressor penderita KKR usia tua lebih baik dari pengelolaan stressor penderita KKR usia muda.(mekaisme koping penderita KKR usia tua lebih baik dari mekanisme koping penderita KKR usia muda) yang dicerminkan oleh penurunan kadar kortisol dan peningkatan kadar IFN dan IgG pada penderita KKR usia tua(Metria, 2006).
4.8. Prognosis
Prognosis karsinoma kolon tergantung pada stadium tumornya, ada tidaknya metastase jauh, yaitu klasifikasi penyebaran tumor dan tingkat keganasan sel tumor, keadaan umum penderita, umur penderita, adanya komplikasi perforasi dan obstruksi, serta pengelolaan pra dan pasca bedah yang teliti dengan pembedahan dan pengangkatan tumor primer dan metastase seradikal mungkin.
B. Penelitian yang Relevan
Penelitian yang relevan pernah dilakukan oleh:
1. Metria (2006) Profil Imunitas Penderita Karsinoma Kolorektal Usia Muda, Baya dan Tua. Tujuan penelitian ini adalah untuk membuktikan perbedaan profil imunitas(CRP, IL-1β, IL-6, IL-10, IFNγ, TNFα, CD-8, IgM dan IgG ) pada perubahan kadar kortisol darah penderita KKR usia muda, baya dan tua. Populasi penelitian ini adalah semua penderita karsinoma kolorektal yang berobat dan dilakukan operasi di beberapa Rumah Sakit Pemerintah maupun Swasta di Kodya Surakarta antara lain: RSUD Dr. MOEWARDI Surakarta, RSU Dr. OEN Surakarta, RSU Dr. OEN Solo Baru, RSU Kasih Ibu Surakarta, RSU PKU Surakarta, RSU Islam YARSIS Surakarta, RSU Panti Waluyo Surakarta, RSU Brayat Minulyo Surakarta dan RSU Islam Kustati Surakarta. Teknik analisis data dilakukan uji normalitas dan analisa statistik Manova dan analisa diskriminant. Hasil penelitian menunjukkan bahwa profil imunitas penderita KKR usia tua lebih baik dari profil imunitas penderita KKR usia muda dan pengelolaan stressor penderita KKR usia tua lebih baik dari pengelolaan stressor penderita KKR usia muda.
2. Simatupang (2012) Perbedaan Ekspresi EBNA-1 Pada Virus Epstein-Barr Terhadap High Grade Dan Low Grade Karsinoma Kolorektal. Tujuan penelitian ini membuktikan adanya hubungan infeksi virus Epstein-Barr terhadap derajat karsinoma kolorektal dengan memeriksa onkoprotein EBNA-1 terhadap high grade dan low grade karsinoma kolorektal. Hasil yang diperoleh didapatkan adanya perbedaan ekspresi EBNA-1 terhadap infeksi virus Epstein-Barr terhadap high grade dan low grade karsinoma kolorektal
C. Kerangka Konseptual
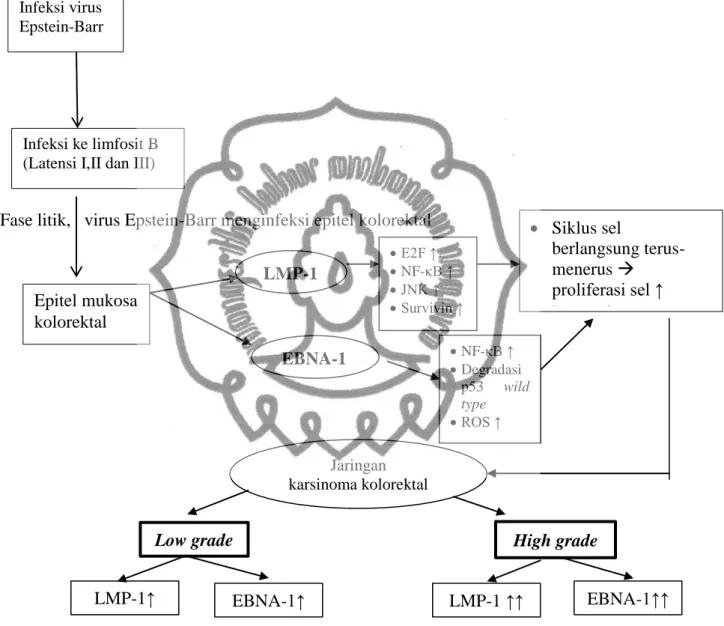
Pada penelitian ini, kerangka konseptual yang ditujukan adalah sebagai berikut :
Fase litik, virus Epstein-Barr menginfeksi epitel kolorektal
Gambar 3.1. Kerangka konseptual
LMP-1 E2F ↑ NF-κB ↑ JNK ↑ Survivin ↑ EBNA-1 NF-κB ↑ Degradasi p53 wild type ROS ↑ Jaringan karsinoma kolorektal LMP-1↑ EBNA-1↑ LMP-1 ↑↑ EBNA-1↑↑
Low grade High grade
Infeksi virus Epstein-Barr
Infeksi ke limfosit B (Latensi I,II dan III)
Epitel mukosa kolorektal Siklus sel berlangsung terus-menerus proliferasi sel ↑ Progresi tumor ↑ commit to user