A. Tujuan Percobaan
Untuk mengetahui kadar Amoniak (NH3) dalam sample menggunakan metode
Nessler secara spektrofotometri.
B. Dasar Teori
Ammonia (NH3) dan garam-garamnya bersifat mudah larut dalam air, ion ammonium merupakan bentuk transisi dari ammonia. Selain terdapat dalam bentuk gas , ammonia membentuk kompleks dengan beberapa ion logam. Ammonia banyak digunakan dalam proses produksi urea, industry bahan kimia, serta industry bubur kertas dan kertas. Ammonia yang terukur di perairan berupa ammonia total (NH3 dan NH4-). Ammonia bebas tidak dapat terionisasi (Effendi, 2003).
Adanya amoniak dalam air akan mempengaruhi pertumbuhan biota budi daya. Pengaruh langsung dari kadar amonia tinggi yang belum me,matikan ialah rusaknya jaringan insang, dimana lempeng insang membengkak sehingga fungsinya sebagai alat pernapasan akan terganggu. Sebagai akibat lanjut, dalam keadaan kronis biota budi daya tidak lagi hidup normal. Penyebab timbulnya amonia dalam air tambak/kolam adalah sisa-sisa ganggang yang mati, sisa pakan, dan kotoran biota budi daya sendiri (Sutrisno, 2006).
Konsentrasi ammonia yang tinggi pada pada permukaan air menyebabkan kematian ikan pada perairan tersebut. Nilai ph sangat mempengaruhi apa jumlah ammonia yang ada akan bersifat racun atau tidak. Pada kondisi ph rendah akan beracun bila jumlah ammonia banyak, sedangkan pada ph tinggi hanya dengan jumlah ammonia yang rendah sudah bersifat racun (Jenie dan Rahayu, 1993).
air. Air yang hampir murni mempunyai nilai BOD kira-kira 1 ppm, dan air yang mempunyai nilai BOD 3 ppm masih dianggap cukup murni. Tapi kemurnian air diragukan jika nilai BODnya mencapai 5 ppm atau lebih. Keputusan Menteri Negara Lingkungan Hidup nomor KEP-51/MENLH/10/1995 Tentang Baku Mutu Limbah Cair bagi Kegiatan Industri menyatakan bahwa baku mutu limbah cair ammonia bebas dikatakan normal pada rentang 1–5 mg/L. Selain itu juga dijelaskan beberapa kadar maksimal ammonia bebas dalam berbagai industri, seperti industri peyamakan kulit 10,0 mg/L, industri minyak sawit 20 mg/L, industri karet 10 mg/L, industri pupuk urea 50 mg/ L, industri karet lateks pekat 15 mg/L, industri karet bentuk kering 5 mg/L, dan industri kayu lapis 4 mg/L (MENLH, 1995).
Pengukuran kadar ammonia di dalam air dilakukan dengan alat spektrofotometer. Spektrofotometri merupakan salah satu metode analisis instrumental yang didasarkan pada interaksi radiasi elektromagnetik dengan atom maupun molekul suatu senyawa kimia. Dengan mengetahui interaksi yang terjadi, dikembangkan teknik-teknik analisis kimia yang memanfaatkan sifat-sifat dari interaksi tersebut. Hasil interaksi tersebut bisa menimbulkan beberapa peristiwa antara lain adalah: pemantulan, pembiasan/hamburan (scattering), difraksi, penyerapan, (absorpsi), fluoresensi, fosforesensi dan emisi (Hendayana, 1994).
panjang gelombang 30-40 nm. Sedangkan pada spektrometer, panjang gelombang yang benar-benar terseleksi dapat diperoleh dengan bantuan alat pengurai cahaya seperti prisma. Suatu spektrofotometer tersusun dari sumber spektrum tampak yang kontinyu, monokromator, sel pengabsorpsi untuk larutan sampel atau blanko dan suatu alat untuk mengukur perbedaan absorpsi antara sampel dan blanko ataupun pembanding (Khopkar, 1990).
Spektrofotometri UV-Vis adalah pengukuran panjang gelombang dan intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektroskopi UV-Vis biasanya digunakan untuk molekul dan ion anorganik atau kompleks di dalam larutan. Spektrum UV-Vis mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang bisa didapatkan dari spektrum ini sangat berguna untuk pengukuran secara kuantitatif. Sinar ultraviolet berada pada panjang gelombang 200-400 nm, sedangkan sinar tampak berada pada panjang gelombang 400-800 nm. Panjang gelombang (λ) adalah jarak antara satu lembah dan satu puncak, sedangkan frekuensi adalah kecepatan cahaya dibagi dengan panjang gelombang (λ). Bilangan gelombang adalah (v) adalah satu satuan per panjang gelombang. (Dachriyanus, 2004)
C. Pelakasanaan Percobaan
1. Alat yang Diperlukan : Spektrofotometer UV-Vis Kuvet
Labu Takar 50 mL
Beker glass 100 mL, 1000mL
Pipet Volume 1mL, 2 mL, 5 mL, 10 mL Mikro pipet 100-1000 µL dan pipet tip Pro Pipet
Pipet Tetes
2. Bahan yang Diperlukan:
Larutan Stock Amoniak 100 mg/L NH3-N
Larutan Standar Amoniak 10 mg/L NH3-N
Reagen Nessler A Reagen Nessler B
Larutan Rochelle Salt (Stabillizer Reagent) Larutan Zinc Sulfate
Sampel A dan B Aquades
II.3 Cara Kerja
a. Siapkan 7 buah labu takar 50 mL yang sudah dibersihkan.
b. Ambil dengan teliti menggunakan pipet volume larutan standar amonia 10 mg/L NH3-N
dengan volume berturut – turut 0 mL, 1 mL, 2 mL, 5 mL, dan 10 mL kemudian masukkan ke dalam labu takar 50 mL.
c. Ambil dengan teliti secara duplo (dua kali) menggunakan pipet volume sampel yang akan diuji sebanyak 5 mL dan masukkan ke dalam masing – masing dua buah labu takar 50 mL.
e. Tambahkan larutan ZnSO4 sebanyak 0,5 mL menggunakan mikro pipet , lalu
homogenkan.
f. Tambahkan sedikit aquades menggunakan botol semprot kira – kira 10 mL pada masing – masing labu takar, kemudian homogenkan pelan – pelan.
g. Tambahkan 5 mL reagen nessler B menggunakan pipet volume ke dalam masing – masing larutan standar, blanko, dan sampel.
h. Tambahkan sedikit aquades menggunakan botol semprot kira – kira 10 mL pada masing – masing labu takar, kemudian homogenkan pelan – pelan.
i. Tambahkan 2 tetes larutan Rochelle salt, kemudian encerkan dengan aquades sampai 50 mL dan gojog hingga homogen.
j. Tambahkan 1 mL reagen nessler A menggunakan mikro pipet ke dalam masing – masing larutan standar, blanko, dan sampel.
k. Gojog larutan hingga homogen, dan diamkan ± 30 menit. Gojog lagi agar tetap homogen. l. Ukur nilai absorbansi masing – masing larutan dengan alat spektrofotometer UV-Vis
pada panjang gelombang 430 nm. Lakukan kalibrasi zero dengan larutan blanko yang dibuat.
m. Catat hasil pengukuran dalam lembar kerja dan lakukan perhitungan kadar amonia dalam sampel.
D. PERHITUNGAN DAN PEMBAHASAN D.1 Perhitungan
Absorban dari masing – masing larutan standar dan sampel yang diukur dengan spektrofotometer UV-Vis pada panjang gelombang 430 nm adalah:
Volume Standar (mL) Volume Akhir mL Absorbansi
0 (blanko) 50 0,000
1 50 0,081
2 50 0,106
3 50 0,208
10 50 0,366
Sampel A 50 0,127
Sampel B 50 0,125
Dari data tersebut dapat dihitung konsentrasi larutan standar dengan menggunakan rumus pengenceran.
V1 . M1 = V2 . M2
Dimana :
V1 = volume larutan standar sebelum dilakukan pengenceran, mL
M1 = konsentrasi larutan standar sebelum dilakukan pengenceran, mg/L
V2 = volume larutan standar setelah dilakukan pengenceran, mL
M2 = konsentrasi larutan standar setelah dilakukan pengenceran, mg/L
a. Larutan standar 1 mL N2 = V1 . M 1
V2
M2 = 1 mL . 10 mg/L
50 mL
M2 = 0,2 mg/L
b. Larutan standar 2 mL
M2 = 2 mL . 10 mg/L
50 mL
M2 = 0,4 mg/L
c. Larutan standar 3 mL
M2 = 3 mL . 10 mg/L
50 mL
M2 = 0,6 mg/L
d. Larutan standar 10 mL
M2 = 10 mL . 10 mg/L
50 mL
Volume Larutan standar
Tabel 1: Perbandingan antara Konsentrasi dengan Absorbansi
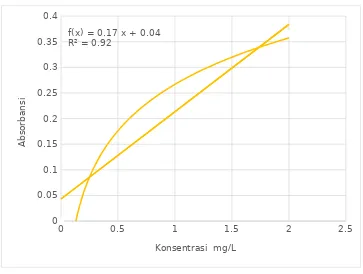
Dari table diatas maka dapat dibuat kurva standar seperti grafik di bawah
0 0.5 1 1.5 2 2.5
Grafik 1. Perbandingan antara konsentrasi dan absorbansi
Dari hasil persamaan regresi grafik di atas dapat dihitung konsentrasi amoniak sebagai
berikut :
a. Sampel simplo y = 0.1705x + 0.0431
Konsentrasi NH3 dalam sampel = Mr NH3 x Konsentrasi sampel
Mr N
= 17 g/mol x 0,492 mg/L 14 g/mol
= 0,597 mg/L NH3
Konsentrasi awal untuk sampel simplo sebelum pengenceran dapat diketahui menggunakan rumus pengenceran :
konsentrasi awal untuk sampel simplo sebelum pengenceran dapat diketahui menggunakan rumus pengenceran :
Berdasarkan hasil perhitungan di atas, maka dapat ditentukan konsentrasi NH3 dalam sampelrata
rata adalah 5,895 mg/L D.2 Pembahasan
sulfat, sedangkan bila kadar amoniak antara 0,25 – 5,0 mg NH3 – N/L dapat ditentukan dengan metode Nesler. Kadar NH3 – N lebih dari 5 mg/L dapat ditentukan dengan metode Nesler dan pengenceran.
Gangguan pada analisa Nesler adalah kekeruhan dan warna. Pada analisa Nesler tanpa destilasi harus ditambah basa dan ZnSO4 untuk mencegah gangguan ion Ca2+, Fe, dan Sn yang dapat menimbulkan kekeruhan. Dengan tambahan larutan basa dan ZnSO4 maka ion – ion tersebut akan mengendap.
Penentuan kadar amonia ini dilakukan dengan menggunakan larutan standar amonia dan larutan sampel dalam jumlah tertentu kemudian ditambah aquades sebagai pelarut dan ZnSO4
sebagai pengendap. Setelah itu pada masing – masing larutan ditambah reagen nessler B yang berfungsi sebagai indikator keberadaan amonia dalam larutan. Selanjutnya dilakukan penambahan reagen nessler A sebagai pemberi warna pada larutan standar maupun sampel.
Alat yang dipakai untuk mengukur absorban larutan standar dan sampel adalah spektrofotometer UV-Vis, karena panjang gelombang yang digunakan adalah 430 nm. Panjang gelombang ini termasuk dalam kisaran panjang gelombang sinar UV, yaitu 300 – 750 nm. Syarat untuk menggunakan spektrofotometer UV-Vis adalah larutan yang diukur absorbannya harus berwarna. Oleh karena itu, larutan standar dan sampel harus dijadikan berwarna dengan menambahkan reagen nessler A. Penambahan reagen ini mengakibatkan perubahan warna larutan dari bening menjadi kuning. Intensitas warna kuning ini meningkat seiring dengan meningkatnya jumlah larutan standar dan sampel yang digunakan.
Konsentrasi larutan pada masing-masing deret standar dapat dihitung dengan menggunakan rumus pengenceran. Berdasarkan hasil perhitungan, maka diketahui nilai konsentrasi larutan standar 1 mL, 2 mL, 5 mL, dan 10 mL berturut – turut adalah 0,2 mg/L; 0,4 mg/L; 0,6 mg/L; 2 mg/L. Setelah dilakukan pengukuran nilai absorbansi pada panjang gelombang 430 nm, maka diperoleh absrobansi untuk larutan standar 0,2 mg/L; 0,4 mg/L; 0,6 mg/L; dan 2 mg/L adalah 0,081, 0,106, 0,208, 0,306. Nilai absorbansi tersebut selanjutnya diplotkan ke dalam grafik hubungan konsentrasi larutan NH3-N dengan absorbansi untuk
perhitungan konsentrasi sampel.
dengan cara mengintrapolasikan nilai absorbansi sampel ke dalam kurva standar dengan menggunakan persamaan garisnya.
E.
Kesimpulan
Dari percobaan yang telah dilakukan diketahui bahwa konsentrasi NH3 dalam sampel