PENENTUAN KADAR FORMALIN DENGAN METODE SPEKTROFOTOMETRI VISIBEL
I. TUJUAN
Menetapkan kadar formalin dengan metode spektrofotometri visibel.
II. DASAR TEORI
2.1 Formalin
Formalin atau larutan formaldehida merupakan larutan yang mengandung formaldehida dan metanol sebagai stabilisator. Kadar formaldehida (CH2O) tidak kurang dari 34% dan tidak lebih dari 38%.
Formalin berupa cairan jernih, tidak berwarna atau hampir tidak berwarna, dan bau menusuk. Formalin dapat dicampur dengan air dan dengan etanol (95%) P (Depkes RI, 1979). Bobot tiap milliliter adalah 1,08 gram. Dapat bercampur dengan air dan alkohol, tetapi tidak bercampur dengan kloroform
dan eter. Titik didih formalin adalah 96oC (Windholz, 1976). Berikut adalah
gambar dari struktur kimia formalin yaitu:
Uji formalin dapat dilakukan secara kualitatif dan kuantitatif. Secara
kualitatif dapat dilakukan dengan KMnO4, sedangkan secara kuantitatif dapat
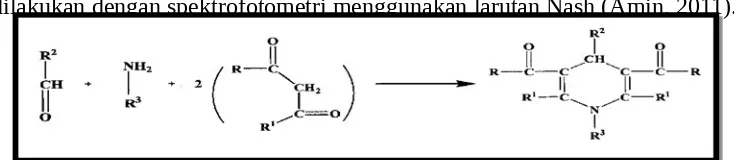
dilakukan dengan spektrofotometri menggunakan larutan Nash (Amin, 2011).
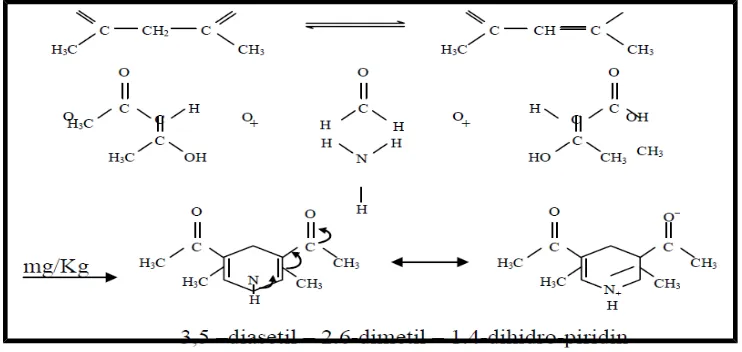
Nash (1953) memperkenalkan metode kolorimetri ke dalam analisis kimia untuk HCHO (formaldehid). Metode ini berdasarkan pada reaksi Hantzsch dari formaldehid dengan asetilaseton atau 2,4-pentanadion dalam
Gambar 2.1. Struktur Formalin (Hayat, 2000).
ammonia untuk membentuk hasil warna kuning dari
3,5-diasetil-1,4-dihidrolutidin (DDL) (Li et al, 2007).
Formalin dapat bereaksi membentuk warna dengan pereaksi Nash pada metode analisis formalin. Analisis spektrofotometer visibel dapat dijadikan sebagai metode standar untuk pengujian formalin (Dolaria, dkk., 2007).Berikut ini reaksi formalin dengan pereaksi nash :
2.2 Spektrofotometri UV-Vis
Spektrofotometri UV-Vis adalah anggota teknik analisis spektroskopik yang memakai sumber radiasi elektromagnetik UV dekat (190-380 nm) dan sinar tampak ((190-380-780 nm) dengan memakai instrumen spektrofotometer. Radiasi UV jauh (100-190 nm) tidak digunakan, sebab pada daerah radiasi tersebut diabsorpsi oleh udara. Adakalanya spektrofotometer UV-Vis yang beredar memberikan rentang pengukuran panjang gelombang 190-1100 nm. Hal ini perlu diperhatikan sebab di atas panjang gelombang 780 nm merupakan daerah radiasi infra merah. Karenanya, pengukuran di atas panjang gelombang 780 nm harus menggunakan detektor dengan kualitas sensitif terhadap radiasi inframerah (Mulja dan Suharman, 1995).
Spektrofotometri UV-VIS termasuk salah satu metode analisis instrumental yang frekuensi penggunaannya paling banyak dalam laboratorium analisis. Spektrofotometri UV-Vis melibatkan energi elektronik yang cukup besar pada molekul yang dianalisis, sehingga spektrofotometri UV-Vis lebih banyak dipakai untuk analisis kuantitatif dibandingkan kualitatif (Gandjar dan Rohman, 2007).
Prinsip penentuan spektrofotometer UV-Vis adalah aplikasi dari Hukum Lambert-Beer, yaitu:
A = - log T = - log It / Io = ε . b . C
Dimana :
A = Absorbansi dari sampel yang akan diukur T = Transmitansi
I0 = Intensitas sinar masuk
It = Intensitas sinar yang diteruskan ε = Koefisien ekstingsi
b = Tebal kuvet yang digunakan C = Konsentrasi dari sampel
(Gandjar dan Rohman, 2012) Hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan. Dalam Lambert-Beer tersebut ada beberapa pembatasan yaitu:
- Sinar yang digunakan dianggap monokromatis.
- Penyerapan terjadi dalam suatu volume yang mempunyai penampang luas yang sama.
- Senyawa yang menyerap dalam larutan tersebut tidak bergantung terhadap yang lain dalam larutan tersebut.
- Tidak terjadi peristiwa fluoresensi atau fosforisensi. - Indeks bias tidak tergantung pada konsentrasi larutan.
berwarna yang akan dianalisis dengan spektrofotometri visible karena senyawa tersebut harus diubah terlebih dahulu menjadi senyawa yang berwarna (Gandjar dan Rohman, 2012). Beberapa tahapan yang harus diperhatikan meliputi:
1. Pembentukan molekul yang dapat menyerap sinar UV-Vis
Hal ini diperlukan bila senyawa yang dianalisis tidak menyerap pada daerah tersebut. Senyawa harus diubah atau direaksikan dengan pereaksi tertentu dengan syarat reaksinya selektif dan sensitive, reaksinya cepat, kuantitatif, dan reprodusibel, serta hasil reaksi stabil dalam jangka waktu yang lama. Keselektifan dapat dinaikkan dengan mengatur pH,
pemakaian masking agent, atau penggunaan teknik ekstraksi (Gandjar
dan Rohman, 2012). 2. Waktu operasional
Cara ini biasanya digunakan untuk pengukuran hasil reaksi atau pembentukan warna. Tujuannya adalah untuk mengetahui waktu pengukuran yang stabil (Gandjar dan Rohman, 2012).
3. Pemilihan panjang gelombang juka dilakukan pengukuran ulang maka kesalahan yang disebabkan oleh pemasangan ulang panjang gelombang akan sangat kecil (Gandjar dan Rohman, 2012).
4. Pembuatan kurva baku
Dibuat seri larutan baku dari zat yang akan dianalisis dengan berbagai konsentrasi. Masing-masing absorbansi larutan dengan berbagai konsentrasi diukur, kemudian dibuat kurva yang merupakan hubungan antara absorbansi (y) dengan konsentrasi (x). Bila hukum Lambert-Beer terpenuhi, maka kurva baku berupa garis lurus (Gandjar dan Rohman, 2012).
Absorban yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,8 atau 15% sampai 70% jika dibaca sebagai transmitan. Anjuran ini berdasarkan anggapan bahwa kesalahan dalam pembacaan T adalah 0,005 atau 0,5% (kesalahan fotometrik) (Gandjar dan Rohman, 2012).
Gambar 1. Plot Hukum Lambert-Beer (Gandjar dan Rohman, 2007)
Penyebab kesalahan sistematik yang sering terjadi dalam analisis menggunakan spektrofotometer adalah:
a. Serapan oleh pelarut
Hal ini dapat diatasi dengan penggunaan blangko, yaitu larutan yang berisi matrik selain komponen yang akan dianalisis.
b. Serapan oleh kuvet
Kuvet yang biasa digunakan adalah dari bahan gelas atau kuarsa. Dibandingkan dengan kuvet dari bahan gelas, kuvet kuarsa memberikan kualitas yang lebih baik, namun tentu saja harganya jauh lebih mahal. Serapan oleh kuvet ini diatasi dengan penggunaan jenis, ukuran, dan bahan kuvet yang sama untuk tempat blangko dan sampel (Tahir, 2008) .
Setting nilai absorbansi = 0 Setting nilai transmitansi = 100 %
Penentuan kalibrasi dilakukan dengan mengikuti prosedur sebagai berikut: a. Dilakukan dengan larutan blangko (berisi pelarut murni yang
digunakan dalam sampel) dengan kuvet yang sama.
b. Setiap perubahan panjang gelombang diusahakan dilakukan proses kalibrasi.
c. Proses kalibrasi pada pengukuran dalam waktu yang lama untuk satu macam panjang gelombang, dilakukan secara periodik selang waktu per 30 menit.
Dengan adanya proses kalibrasi pada spektrofotometer UV-Vis ini maka akan membantu pemakai untuk memperoleh hasil yang akurat dan presisi (Tahir, 2008).
c. Amonium asetat ( NH4CH3COO)
d. Asam asetat (CH3COOH)
e. Asetil aseton
IV. PERHITUNGAN
4.1 Perhitungan pembuatan pereaksi Nash
Pereaksi Nash yang dibuat sejumlah 50 ml, sehingga jumlah masing – masing bahan adalah :
a. Amonium asetat = x 15 gr = 7,5 gr
c. Asetil Aseton = x 0,2 ml = 0,1 ml
d. Aquadest = x 100 ml = add 50 ml
IV.2 Pembuatan 10 mL Larutan Stok Formalin 2% b/v Dik :
Larutan formalin yang tersedia = 37% b/v Konsentrasi yang diperlukan = 2% b/v Volume larutan yang diperlukan = 10 mL
Dit : Volume larutan formalin 37% b/v yang diambil = ….. ? M1V1 = M2V2
37 % V1 = 2 % . 10 ml
V1 =
V1 = 0,54 mL
4.3 Pembuatan 10 mL larutan Formalin 100 µg/mL dari larutan formalin 2% b/v Dik :
Konsentrasi formalin = 2% b/v
Volume larutan formalin 100 µg/ml yang diperlukan = 10 mL
2 % b/v = 2 gram/100 ml = 2 x 104 g/ml
Dit : Volume larutan formalin 2% b/v yang diambil = ….. ? Jawab :
C1V1 = C2V2
2 x 104 µg/ml V
1 = 100 µg/ml x 10 ml
V1 =
V1 = 0,05 ml
Diketahui :
Vlarutan stok formalin standar1 = 0,1 mL
Vlarutan stok formalin standar2 = 0,2 mL
Vlarutan stok formalin standar 3 = 0,3 mL
Vlarutan stok formalin standar 4 = 0,4 mL
Vlarutan stok formalin standar 5 = 0,5 mL
Vmasing-masing larutan = 5 mL
Clarutan stok formalin = 100 µg/mL
Ditanya : C (konsentrasi) masing-masing larutan seri = …?
Jawab :
- Untuk standar 1
Cstok formalin x Vstok formalin = Clarutan formalin x Vlarutan formalin
100 µg/mL x 0,1 mL = Clarutan formalin standar 1 x 5 mL
Clarutan standar formalin standar
1 =
= 2 µg/mL
- Untukstandar 2
Cstok formalin x Vstok formalin = Clarutan formalin x Vlarutan formalin
100 µg/mL x 0,2 mL = Clarutan formalin standar 2 x 5 mL
Clarutanstandar formalin standar 2 =
= 4 µg/mL
- Untuk standar 3
Cstok formalin x Vstok formalin = Clarutan formalin x Vlarutan formalin
100 µg/mL x 0,3 mL = Clarutan formalin standar 3 x 5 mL
Cstok formalin x Vstok formalin = Clarutan formalin x Vlarutan formalin
100 µg/mL x 0,5 mL = Clarutanformalin standar 5 x 5 mL
Clarutan standar formalin standar 5 =
= 10 µg/mL
Clarutan stok formalin = 10 µg/mL
V larutan stok formalin yang digunakan = 0,35 mL
V larutan formalin yang ingin dibuat = 5 mL
Ditanya : C larutan stok formalin yang digunakan = …?
Jawab :
CstokFormalin x Vstok Formalin = ClarutanFormalin x V larutanFormalin
100 µg/mL x 0,35 mL = ClarutanFormalin x 5 mL
CstokFormalin =
= 7µg/mL
V. PELAKSANAAN PERCOBAAN
5.1 Prosedur Kerja
5.1.1 Pembuatan Larutan Formalin 2% b/v dari larutan Formalin 37% b/v Diambil 0,54 mL larutan formalin 2% b/v dengan pipet volume.
Dimasukkan kedalam labu ukur 10 mL dan ditambahkan aquadest hingga tanda batas dan digojog hingga homogen.
5.1.2 Pembuatan Larutan Stok Baku Formalin 100 µg/mL
Larutan formalin 2% b/v diambil sebanyak 0,05 mL menggunakan pipet volume dan dimasukkan ke dalam labu ukur 10 mL. Ditambahkan akuades hingga tanda batas kemudian digojog hingga homogen.
5.1.3 Pembuatan Pereaksi Nash
Ditimbang 7,5 gram Ammonium Asetat (NH4CH3COO) dan dimasukkan
dalam beaker glass. Ditambahkan 0,15 mL Asam Asetat (CH3COOH) dan
0,1 mL Asetil Aseton Dilarutkan dengan Aquadest hingga larut dan dimasukkan ke dalam labu ukur 50 mL Ditambahkan akuades hingga volume 50 mL dan digojog hingga homogen. Dimasukkan kedalam botol
kaca gelap serta dibungkus dengan aluminium foil.
5.1.4 Pembuatan Larutan Standar
masing-masing vial tersebut dipipet 1 mL, dimasukkan ke dalam vial baru, dan ditambahkan dengan 2 mL pereaksi Nash dan 2 mL akuades. Didiamkan kurang lebih selama 30 menit.
5.1.5 Pembuatan Larutan Sampel Formalin
Sebanyak 0,35 mL larutan stok baku formalin 100 µg/mL dipipet, kemudian ditempatkan pada labu ukur 5 mL. Ditambahkan akuades hingga tanda batas dan digojog. Larutan sampel kemudian ditampung pada botol vial. Diambil 1 ml larutan sampel dan ditambahkan 2 ml pereaksi Nash dan 2 ml akuades. Didiamkan kurang lebih selama 30 menit.
5.1.6 Penentuan Kadar Formalin
Diukur absorbansi salah satu larutan standar pada rentang panjang gelombang 352 nm - 451 nm, ditentukan panjang gelombang maksimumnya dan dilakukan pengukuran absorbansi masing-masing seri larutan standar pada panjang gelombang maksimum kemudian dibuat kurva kalibrasi dan persamaan regresi liniernya. Ditetapkan kadar sampel formalin dengan mengukur absorbansinya secara spektrofotometri visibel. Diukur absorbansi sampel formalin pada panjang gelombang maksimumnya. Ditetapkan kadar formalin dengan memanfaatkan persamaan regresi linear dari 5 variasi larutan standar dan dihitung persentase perolehan kembali.
5.2 Skema Kerja
5.2.1 Pembuatan Latutan Formalin 2% b/v dari larutan 37% b/v
5.2.2 Pembuatan Larutan Stok Baku Formalin 100 µg/mL
Diambil 0,54 mL larutan formalin 2% b/v dengan pipet volume
Ditambahkan akuades hingga 10 mL ke dalam labu ukur, digojog sampai homogen
5.2.3 Pembuatan Pereaksi Nash
5.2.4 Pembuatan Larutan Standar
5.2.5 Pembuatan Larutan Sampel Formalin
Ditimbang 7,5 gram ammonium Asetat (NH
4CH3COO),
dimasukkan ke dalam beaker glass
Diencerkan dengan akuades hingga 50 mL dan digojog sampai homogen
Dibuat 5 variasi kadar larutan standar
Diambil larutan stok baku sebanyak 0,1 mL; 0,2 mL; 0,3 mL; 0,4 mL; 0,5 mL
Dimasukkan ke dalam labu ukur 5 mL, ditambahkan dengan akuades hingga tanda batas
Diambil 1 ml larutan standar masing-masing ditambahkan 2 ml pereaksi Nash dan 2 ml akuades. Didiamkan kurang lebih selama
30 menit.
Dipipet sebanyak 0,35 mL larutan stok baku formalin 100 µg/mL
Ditambahkan 0,15 mL Asam Asetat (CH3COOH) DAN 0,1 mL
5.2.6 Penentuan Kadar Formalin
Dipipet 1 ml larutan sampel dan ditambahkan 2 ml pereaksi Nash dan 2 ml akuades
Didiamkan kurang lebih selama 30 menit.
Dihitung kadar sampel berdasarkan nilai absorbansi sampel dan persamaan regresi linier larutan standar
Dihitung kadar sampel berdasarkan nilai absorbansi sampel dan persamaan regresi linier larutan standar
Dilakukan pengukuran absorbansi larutan sampel pada panjang gelombang maksimum dengan spektrofotometer UV-Vis Diukur absorbansi salah satu larutan standar pada rentang panjang
gelombang 352 nm - 451 nm dengan spektrofotometer UV-Vis
Ditentukan panjang gelombang maksimumnya dan dilakukan pengukuran absorbansi masing-masing seri larutan standar pada
panjang gelombang maksimum
Amin, A. 2011. Identifikasi Formalin Dalam Produk Mie Basah Dan Tahu Dengan
Metode Kualitatif Larutan KMnO4. Jurnal Tasimak. Vol. II(1). Hal.
15-24.
Budiarti, A dkk . 2009. Pengaruh Perendaman Dalam Air Hangat Terhadap Kandungan Formalin pada Mie Basah dari Tiga Produsen yang Dijual di
Pasar Johar Semarang. Jurnal Ilmu Farmasi dan Ilmu Klinik. Vol VI(1).
Hal 1-6.
Gandjar, I. G. dan Abdul Rohman. 2007. Kimia Farmasi Analisis. Yogyakarta:
Pustaka Pelajar
Gandjar, I. G. dan A. Rohman. 2012. Analisis Obat Secara Spektrofotometri dan
Kromatografi. Yogyakarta: Pustaka Pelajar.
Hayat, M.A. 2000. Principles and Techniques of Electron Microscopy : Biological
Applications, Fourth Edition. Amerika: Cambridge University Press. Li, Q., P. Sritharathikhun and S. Motomizu. 2007. Development of Novel Reagent
for Hantzsch Reaction for the Determination of Formaldehyde by
Spectrophotometry and Fluorometry. Analytical Sciences. Vol. 23. Hal.
413-417.
Mulja, Muhammad dan Suharman. 1995. Analisis Instrumental. Surabaya:
Airlangga University Press
Tahir, Iqmal. 2008. Arti Penting Kalibrasi Pada Proses Pengukuran Analitik :