KOLOID
Nama
: Tri Mulyono
Kelas
: XI RPL 1
No
:
33
Jurusan : Rekayasa Perangkat Lunak
MAKALAH KIMAI
”KOLOID”
Disusun oleh :
Nama : Tri Mulyono
Kelas : XI RPL 1
No : 33
SMK N 4 KENDAL
PENGERTIAN KOLOID
Ada kehidupan sehari-hari ini, sering kita temui beberapa produk yang merupakan campuran dari beberapa zat, tetapi zat tersebut dapat bercampur secara merata/ homogen. Misalnya saja saat ibu membuatkan susu untuk adik, serbuk/ tepung susu bercampur secara merata dengan air panas. Produk-produk seperti itu adalah sistem koloid.
Koloid adalah suatu campuran zat heterogen (dua fase) antara dua zat atau lebih di mana partikel-partikel zat yang berukuran koloid (fase terdispersi/yang dipecah) tersebar secara merata di dalam zat lain (medium pendispersi/ pemecah). Ukuran partikel koloid berkisar antara 1-100 nm. Ukuran yang dimaksud dapat berupa diameter, panjang, lebar, maupun tebal dari suatu partikel. Contoh lain dari sistem koloid adalah adalah tinta, yang terdiri dari serbuk-serbuk warna (padat) dengan cairan (air). Selain tinta, masih terdapat banyak sistem koloid yang lain, seperti mayones, hairspray, jelly, dll.
Keadaan koloid atau sistem koloid atau suspensi koloid atau larutan koloid atau suatu koloid adalah suatu campuran berfasa dua yaitu fasa terdispersi dan fasa pendispersi dengan ukuran partikel terdispersi berkisar antara 7 sampai dengan 10-4 cm. Besaran partikel yang terdispersi, tidak menjelaskan keadaan partikel tersebut. Partikel dapat terdiri atas atom, molekul kecil atau molekul yang sangat besar. Koloid emas terdiri atas partikel-partikel dengan bebagai ukuran, yang masing-masing mengandung jutaan atom emas atau lebih. Koloid belerang terdiri atas partikel-partikel yang mengandung sekitar seribu molekul S8. Suatu contoh molekul yang sangat besar (disebut juga molekul makro) ialah haemoglobin. Berat molekul dari molekul ini 66800 s.m.a dan mempunyai diameter sekitar 6 x 10-7.
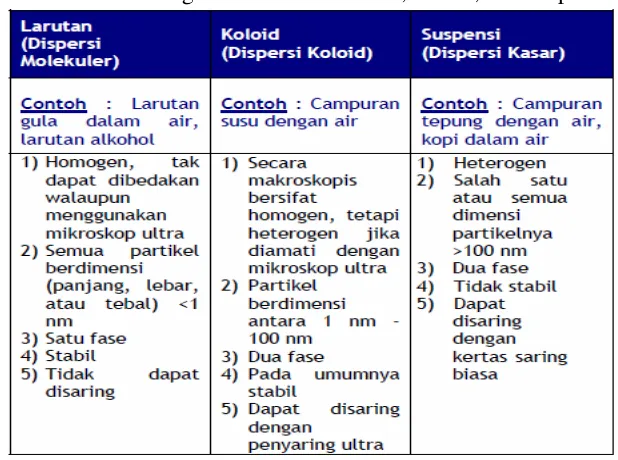
• Perbedaan Larutan, Koloid, Suspensi
Perbandingan sifat antara larutan, koloid, dan suspensi dijelaskan dalam Tabel 1
Jenis - Jenis Koloid
Penggolongan sistem koloid didasarkan pada jenis fase pendispersi dan fase terdispersi
1. Aerosol
Sistem koloid dari partikel padat atau cair yang terdispersi dalam gas disebut aerosol. Jika zat yang terdispersi berupa zat padat disebut aerosol padat. Contoh aerosol padat : debu buangan knalpot. Sedangkan zat yang terdispersi berupa zat cair disebut aerosol cair. Contoh aerosol cair : hairspray dan obat semprot. Untuk menghasilkan aerosol diperlukan suatu bahan pendorong (propelan aerosol). Contoh propelan aerosol yang banyak digunakan yaitu CFC dan CO2. 2. Sol
Sistem koloid dari partikel padat yang terdispersi dalam zat cair disebut sol. Contoh sol : putih telur, air lumpur, tinta, cat dan lain-lain. Sistem koloid dari partikel padat yang terdispersi dalam zat padat disebut sol padat. Contoh sol padat : perunggu, kuningan, permata (gem).
Macam macam sol :
a. Sol padat adalah sol dalam medium pendispersi padat Contoh: paduan logam, gelas warna, intan hitam b. Sol cair adalah sol dalam medium pendispersi cair Contoh: cat, tinta, tepung dalam air, tanah liat c. Sol gas adalah sol dalam medium pendispersi gas Contoh: debu di udara, asap pembakaran
3. Emulsi
Sistem koloid dari zat cair yang terdispersi dalam zat cair lain disebut emulsi. Sedangkan sistem koloid dari zat cair yang terdispersi dalam zat padat disebut emulsi padat dan sistem koloid dari zat cair yang terdispersi dalam gas disebut emulsi gas. Syarat terjadinya emulsi yaitu kedua zat cair tidak saling melarutkan. Emulsi digolongkan ke dalam 2 bagian yaitu emulsi minyak dalam air dan emulsi air dalam minyak.. Contoh emulsi minyak dalam air : santan, susu, lateks. Contoh emulsi air dalam minyak : mayonnaise, minyak ikan, minyak bumi. Contoh emulsi padat : jelly, mutiara, opal.
Emulsi terbentuk karena pengaruh suatu pengemulsi (emulgator). Misalnya sabun dicampurkan kedalam campuran minyak dan air, maka akan diproleh campuran stabil yang disebut emulsi.
Macam macam Emulsi :
a. Emulsi padat adalah emulsi dalam medium pendispersi padat Contoh: Jelly, keju, mentega, nasi
c. Emulsi gas adalah emulsi dalam medium pendispersi gas Contoh: hairspray dan obat nyamuk
4. Buih
Sistem koloid dari gas yang terdispersi dalam zat cair disebut buih, sedangkan sistem koloid dari gas yang terdispersi dalam zat padat disebut buih padat.Buih digunakan dalam proses pengolahan biji logam dan alat pemadam kebakarn. Contoh buih cair : krim kocok (whipped cream), busa sabun. Contoh buih padat : lava, biskuit.
Buih dapat dibuat dengan mengalirkan suatu gas ke dalam zat yang mengandung pembuih dan distabilkan oleh pembuih seperti sabun dan protein. Ketika buih tidak dikehendaki, maka buih dapat dipecah oleh zat-zat seperti eter, isoamil dan alkohol.
Macam macam Buih
a. Buih padat adalah buih dalam medium pendispersi padat Contoh: Batu apung, marshmallow, karet busa, Styrofoam b. Buih cair adalah buih dalam medium pendispersi cair Contoh: putih telur yang dikocok, busa sabun
- Untuk pengelompokan buih, jika fase terdispersi dan medium pendispersi sama- sama berupa gas, campurannya tergolong larutan
5. Gel
Sistem koloid dari zat cair yang terdispersi dalam zat padat dan bersifat setengah kaku disebut gel. Gel dapat terbentuk dari suatu sol yang zat terdispersinya mengadsropsi medium dispersinya sehingga terjadi koloid yang agak padat. Contoh gel : agar-agar, semir sepatu, mutiara, mentega.
Campuran gas dengan gas tidak membentuk sistem koloid tetapi suatu larutan sebab semua gas bercampur baik secara homogen dalam segala perbandingan.
Sifat-Sifat Koloid Sol
1. Efek Tyndall
Efek tyndall ini ditemukan oleh John Tyndall (1820-1893), seorang ahli fisika Inggris. Oleh karena itu sifat itu disebut efek tyndall.
Efek tyndall adalah efek yang terjadi jika suatu larutan terkena sinar. Pada saat larutan sejati (gambar kiri) disinari dengan cahaya, maka larutan tersebut tidak akan menghamburkan cahaya, sedangkan pada sistem koloid (gambar kanan), cahaya akan dihamburkan. hal itu terjadi karena partikel-partikel koloid mempunyai partikel-partikel yang relatif besar untuk dapat menghamburkan sinar tersebut. Sebaliknya, pada larutan sejati, partikel-partikelnya relatif kecil sehingga hamburan yang terjadi hanya sedikit dan sangat sulit diamati.
2. Gerak Brown
Jika kita amati system koloid dibawah mikroskop ultra, maka kita akan melihat bahwa partikel-partikel tersebut akan bergerak membentuk zigzag. Pergerakan zigzag ini dinamakan gerak Brown. Pergerakan tersebut dijelaskan pada penjelasan berikut:
Partikel-partikel suatu zat senantiasa bergerak. Gerakan tersebut dapat bersifat acak seperti pada zat cair dan gas, atau hanya bervibrasi di tempat seperti pada zat padat. Untuk system koloid dengan medium pendispersi zat cair atau gas, pergerakan partikel-partikel akan menghasilkan tumbukan dengan partikel-partikel koloid itu sendiri. Tumbukan tersebut berlangsung dari segala arah. Oleh karena ukuran partikel cukup kecil, maka tumbukan
yang terjadi cenderung tidak seimbang. Sehingga terdapat suatu resultan tumbukan yang menyebabkan perubahan arah gerak partikel sehingga terjadi gerak zigzag atau gerak Brown.
Semakin kecil ukuran partikel koloid, semakin cepat gerak Brown terjadi. Demikian pula, semakin besar ukuran partikel kolopid, semakin lambat gerak Brown yang terjadi. Hal ini menjelaskan mengapa gerak Brown sulit diamati dalam larutan dan tidak ditemukan dalam zat padat (suspensi).
Gerak Brown juga dipengaruhi oleh suhu. Semakin tinggi suhu system koloid, maka semakin besar energi kinetic yang dimiliki partikel-partikel medium
3. Adsorpsi koloid
Apabila partikel-partikel sol padat ditempatkan dalam zat cair atau gas, maka pertikel-partikel zat cair atau gas tersebut akan terakumulasi pada permukaan zat padat tersebut. Fenomena ini disebut adsorpsi. Beda halnya dengan absorpsi. Absorpsi adalah fenomena menyerap semua partikel ke dalam sol padat bukan di atas permukaannya, melainkan di dalam sol padat tersebut.
Partikel koloid sol memiliki kemampuan untuk mengadsorpsi partikel-partikel pada permukaannya, baik partikel netral atau bermuatan (kation atau anion) karena mempunyai permukaan yang sangat luas.
4. Muatan Koloid Sol
Sifat koloid terpenting adalah muatan partikel koloid. Semua partikel koloid pasti mempunyai muatan sejenis (positif atau negatif). Oleh karena muatannya sejenis, maka terdapat gaya tolak menolak antar partikel koloid. Hal ini
mengakibatkan partikel-partikel tersebut tidak mau bergabung sehingga memberikan kestabilan pada sistem koloid. Namun demikian, system koloid secara keseluruhan bersifat netral karena partikel-partikel koloid yang bermuatan ini akan menarik ion-ion dengan muatan berlawanan dalam medium pendispersinya. Berikut ini adalah penjelasannya:
a. Sumber Muatan Koloid Sol
Partikel-partikel koloid mendapat muatan listrik melalui dua cara, yaitu dengan proses adsorpsi dan proses ionisasi gugus permukaan partikel.
a.i. Proses Adsorpsi
Proses adsorpsi ini merupakan peristiwa dimana partikel koloid menyerap partikel bermuatan dari fase pendispersinya. Sehingga partikel koloid menjadi bermuatan. Jenis muatannya tergantung pada jenis partikel bermuatan yang diserap apakah anion atau kation.
Sebagai contoh: partikel sol Fe(OH)3 (bermuatan positif) mempunyai
kemampuan untuk mengadsorpsi kation dari medium pendispersinya sehingga sol Fe(OH) 3 bermuatan positif, sedangkan partikel sol As2S3 (bermuatan negatif)
Partikel koloid sol tersebut tidak selalu mengadsorpsi ion yang sama. Hal itu tergantung pada muatan yang berlebih dari medium pendispersinya. Misalnya, jika sol AgCl terdapat pada medium pendispersi dengan kation Ag+ berlebih, maka AgCl akan bermuatan positif. Sedangkan jika AgCl terdapat pada medium pendispersi dengan anion Cl- berlebih, maka sol AgCl akan bermuatan negatif.
a.ii. Proses Ionisasi Gugus Permukaan Partikel
Beberapa partikel koloid memperoleh muatan dari proses ionisasi gugus yang ada pada permukaan partikel koloid. Contohnya adalah koloid protein dan koloid sabun/ deterjen.
a.ii.a. Pada koloid protein:
Koloid ini adalah jenis sol yang mempunyai gugus yang bersifat asam (-COOH) dan basa (-NH2). Kedua gugus ini dapat terionisasi dan memberikan muatan
pada molekul-molekul protein.
Pada pH rendah (konsentrasi H+ tinggi), gugus basa –NH2 akan menerima
proton (H+) dan membentuk gugus –NH3+
NH2 + H+ à -NH3+
Pada pH tinggi, -COOH akan mendonorkan proton H+ dan membentuk gugus –COO-
COOH + H+ à –COO
-Maka, partikel sol protein bermuatan positif pada pH rendah dan bermuatan negatif pada pH tingi. Pada titik pH isoelektrik, partikel-partikel protein bermuatan netral karena muatan -NH3+ –COO- saling meniadakan menjadi netral.
a.ii.b. Pada koloid sabun / deterjen
Molekul sabun dan deterjen lebih kecil daripada molekul koloid. Pada
konsentrasi relatif pekat, kedua molekul ini dapat bergabung dan membentuk partikel-partikel berukuran koloid yang disebut misel. Lalu zat-zat yang tergabung dalam suatu fase pendispersi dan membentuk partikel-partikel berukuran koloid disebut koloid terasosiasi.
R-COO-Na+ à R-COO- + Na+
Anion
Anion-anion R-COO- akan bergabung membentuk misel. Gugus R- tidak larut dalam air sehingga akan terorientasi ke pusat, sedangkan COO- larut dalam air
sehingga berada di permukaan yang bersentuhan dengan air. b. Kestabilan Koloid
Partikel-partikel koloid ialah bermuatan sejenis. Maka terjadi gaya tolak-menolak yang mencegah partikel-partikel koloid bergabung dan mengendap akibat gaya gravitasi. Oleh karena itu, selain gerak Brown, muatan koloid juga berperan besar dalam menjaga kestabilan koloid.
c. Lapisan Bermuatan Ganda
Pada awalnya, partikel-partikel koloid mempunyai muatan yang sejenis yang didapatkannya dari ion yang diadsorpsi dari medium pendispersinya. Apabila dalam larutan ditambahkan larutan yang berbeda muatan dengan system koloid, maka sistem koloid itu akan menarik muatan yang berbeda tersebut sehingga membentuk lapisan ganda. Lapisan pertama ialah lapisan padat di mana muatan partikel koloid menarik ion-ion dengan muatan berlawanan dari medium pendispersi. Sedangkan lapisan kedua berupa lapisan difusi dimana muatan dari medium pendispersi terdifusi ke partikel koloid. Model lapisan berganda tersebut tijelaskan pada lapisan ganda Stern. Adanya lapisan ini menyebabkan secara keseluruhan bersifat
netral.
d. Elektroforesis
Oleh karena partikel sol bermuatan listrik, maka partikel ini akan bergerak dalam medan listrik.
Pergerakan ini disebut elektroforesis. Untuk lebih jelas, mari kita lihat tabung berikut di samping.
Pada gambar, terlihat bahwa partikel-partikel koloid bermuatan positif tersebut bergerak menuju elektrode dengan muatan berlawanan, yaitu elektrode
e. Koagulasi
Jika partikel-partikel koloid tersebut bersifat netral, maka akan terjadi penggumpalan dan pengendapan karena pengaruh gravitasi. Proses penggumpalan dan pengendapan ini disebut koagulasi. Penetralan partikel koloid dapat dilakukan dengan 4 cara, yaitu :
1.Menggunakan prinsip elektroforesis
Proses elektroforesis adalah pergerakan partikel-partikel koloid yang bermuatan ke elektrode dengan muatan berlawanan. Ketika partikel ini mencapai elektrode, maka system koloid akan kehilangan muatannya dan bersifat netral.
2.Penambahan koloid lain dengan muatan berlawanan
Ketika koloid bermuatan positif dicampur dengan koloid bermuatan negatif, maka muatan tersebut akan saling menghilang dan bersifat netral.
3. Penambahan elektrolit
Jika suatu elektrolit ditambahkan pada system koloid, maka partikel koloid yang bermuatan negatif akan mengasorpsi ion positif (kation) dari elektrolit. Begitu juga sebaliknya, partikel positif akan mengasorpsi ion negative (anion) dari elektrolit. Dari adsorpsi diatas, maka terjadi proses koagulasi.
4.Pendidihan
Kenaikan suhu sistem koloid menyebabkan jumlah tumbukan antara partikel-partikel sol dengan molekul-molekul air bertambah banyak. Hal ini melepaskan elektrolit yang teradsorpsi pada permukaan koloid. Akibatnya partikel tidak bermuatan.
f. Koloid pelindung
Sistem koloid di mana partikel terdispersinya mempunyai daya adsorpsi relatif besar disebut koloid liofil yang bersifat lebih stabil. Sedangkan jika partikel
Sol liofob/ hidrofob mudah terkoagulasi dengan sedikit penambahan elektrolit, tetapi menjadi lebih stabil jika ditambahkan koloid pelindung yaiut koloid liofil. Berikut ini penjelasan yang lebih lengkap mengenai koloid liofil dan liofob:
- Koloid liofil (suka cairan) adalah koloid di mana terdapat gaya tarik-menarik yang cukup besar antara fase terdispersi dan medium pendispersi. Contoh, disperse kanji, sabun, deterjen.
Koloid liofil dan Koloid liofob
Berdasarkan perbedaan daya adsorpsi dari fase terdispersi terhadap medium pendispersinya yang berupa zat cair, koloid dapat dibedakan menjadi dua jenis. Sistem koloid di mana partikel terdispersinya mempunyai daya adsorpsi yang relatif besar disebut koloid liofil. Sedangkan sistem koloid dimana partikel terdispersinya mempunyai daya adsorpsi yang relatif kecil disebut koloid liofob. Koloid liofil bersifat lebih stabil, sedangkan koloid liofob bersifat kurang stabil. Koloid liofil yang berfungsi sebagai koloid pelindung.
Koloid Liofil (suka cairan) : koloid dimana terdapat gaya tarik menarik yang cukup besar antara fase terdispersi dan medium pendispersinya.
Contohnya, dispersi kanji, sabun, deterjen, dan protein dalam air
Koloid liofob (tidak suka cairan) : koloid di mana terdapat gaya tarik menarik yang lemah atau bahkan tidak ada gaya tarik menarik antara fase terdsipersi dan medium pendispersinya. Contohnya, dispersi emas, Fe (OH)3, dan belerang dalam air. Contoh: sol kanji, agar-agar, lem, cat
Jika medium pendispersi koloid ini adalah air, maka istilah yang digunakan adalah koloid hidrofil dan koloid hidrofob.
Koloid hidrofil : Contoh, protein, sabun, detergen, agar-agar, kanji, dan gelatin.
Pembuatan Koloid
Ukuran partikel koloid berada di antara partikel larutan dan suspensi, karena itu cara pembuatannya dapat dilakukan dengan memperbesar partikel larutan atau
memperkecil partikel suspensi. Maka dari itu, ada dua metode dasar dalam pembuatan iystem koloid sol, yaitu :
• 1. Metode kondensasi
merupakan metode bergabungnya partikel-partikel kecil larutan sejati yang membentuk partikel-partikel berukuran koloid
• 2. Metode dispersi
merupakan metode dipecahnya partikel-partikel besar sehingga menjadi partikel-partikel berukuran koloid
1. METODE KONDENSASI
Metode di mana partikel kecil larutan sejati bergabung membentuk partikel-partikel berukuran koloid. Pembuatan koloid sol dengan metode ini pada umumnya dilakukan dengan cara kimia
• a. Dekomposisi Rangkap Misalnya:
* Sol As2S3 dibuat dengan gaya mengalirkan H2S dengan perlahan-lahan melalui larutan As2O3 dingin sampai terbentuk sol As2S3 yang berwarna kuning terang;
As2O3 (aq) + 3H2S(g) ? As2O3 (koloid) + 3H2O(l)
(Koloid As2S3 bermuatan negatif karena permukaannya menyerap ion S2-).
* Sol AgCl dibuat dengan mencampurkan larutan AgNO3 encer dan larutan HCl encer;
AgNO3 (aq) + HCl(aq) ? AgCl (koloid) + HNO3 (aq) b. Reaksi Hidrolisis
Hidrolisis adalah reaksi suatu zat dengan air. Misalanya :
* Sol Fe(OH3) dapat dibuat dengan hidrolisis larutan FeCl3 dengan memanaskan larutan FeCl3 atau reaksi hidrolisis garam Fe dalam air mendidih;
FeCl3 (aq) + 3H2O(l) ? Fe(OH) 3 (koloid) + 3HCl(aq)
(Koloid Fe(OH)3 bermuatan positif karena permukaannya menyerap ion H+)
* Sol Al(OH)3 dapat diperoleh dari reaksi hidrolisis garam Al dalam air mendidih;
c. Reaksi Reduksi - Oksidasi (redoks) Misalnya :
* Sol emas atau sol Au dapat dibuat dengan mereduksi larutan garamnya dengan melarutkan AuCl3 dalam pereduksi organic formaldehida HCOH;
2AuCl3 (aq) + HCOH(aq) + 3H2O(l) ?2Au(s) + HCOOH(aq) + 6HCl(aq)
* Sol belerang dapat dibuat dengan mereduksi SO2 yang terlarut dalam air dengan mengalirinya gas H2S ;
2H2S(g) + SO2 (aq) ? 3S(s) + 2H2O(l)
d. Penggatian Pelarut
Cara ini dilakukan dengan mengganti medium pendispersi sehingga fasa terdispersi yang semulal arut setelah diganti pelarutanya menjadi berukuran koloid. Misalnya;
o >> Untuk membuat sol belerang yang sukar larut dalam air tetapi mudah larut dalam alkohol seperti etanol dengan medium pendispersi air, belarang harus terlenih dahulu dilarutkan dalam etanol sampai jenuh. Baru kemudian larutan belerang dalam etanol tersebut
ditambahkan sedikit demi sedikit ke dalam air sambil diaduk. Sehingga belerang akan menggumpal menjadi pertikel koloid dikarenakan
penurunan kelarutan belerang dalam air.
o >> Sebaliknya, kalsium asetat yang sukar larut dalam etanol, mula-mula dilarutkan terlebih dahulu dalam air, kemudianbaru dalam larutan tersebut ditambahkan etanol maka terjadi kondensasi dan terbentuklah koloid kalsium asetat
2. METODE DISPERSI
Metode ini melibatkan pemecahan partikel-partikel kasar menjadi berukuran koloid yang kemudian akan didispersikan dalam medium pendispersinya. Ada 3 cara dalam metode ini, yaitu :
a. Cara Mekanik
Cara mekanik adalah penghalusan partikel-partikel kasar zat padat dengan proses penggilingan untuk dapat membentuk partikel-partikel berukuran koloid. Alat yang digunakan untuk cara ini biasa disebut penggilingan koloid, yang biasa digunakan dalam :
o - Industri makanan untuk membuat jus buah, selai, krim, es krim,dsb o - Industri kimia rumah tangga untuk membuat pasta gigi, semir sepatu,
deterjen, dsb
Sistem kerja alat penggilingan koloid :
Alat ini memiliki 2 pelat baja dengan arah rotasi yang berlawanan. Partikel-partikel yang kasar akan digiling melalui ruang antara kedua pelat baja tersebut. Kemudian, terbentuklah partikel-partikel berukuran koloid yang kemudian didispersikan dalam medium pendispersinya untuk membentuk sistem koloid. Contoh kolid yang dibuat adalah; pelumas, tinta cetak, sol belerang dsb.
\
b. Cara Peptisasi
Cara peptisasi adalah pembuatan koloid / sistem koloid dari butir-butir kasar atau dari suatu endapan / proses pendispersi endapan dengan bantuan suatu zat pemeptisasi (pemecah). Zat pemecah tersebut dapat berupa elektrolit
khususnya yang mengandung ion sejenis ataupun pelarut tertentu. Contoh:
o - Agar-agar dipeptisasi oleh air ; karet oleh bensin
o - Endapan NiS dipeptisasi oleh H2S ; endapan Al(OH) 3 oleh AlCl3 o - Sol Fe(OH) 3 diperoleh dengan mengaduk endapan Fe(OH) 33 yang
baru terbentuk dengan sedikit FeCl3. Sol Fe(OH) 3 kemudian dikelilingi Fe+3 sehingga bermuatan positif
o - Beberapa zat mudah terdispersi dalam pelarut tertentu dan membnetuk sistem kolid.
Contohnya; gelatin dalam air. o
KEGUNAAN SISTEM KOLOID
Sistem koloid banyak digunakan pada kehidupan sehari-hari, terutama dalam kehidupan sehari-hari. Hal ini disebabkan sifat karakteristik koloid yang penting, yaitu dapat digunakan untuk mencampur zat-zat yang tidak dapat saling melarutkan secara homogen dan bersifat stabil untuk produksi dalam skala besar.
Berikut ini adalah tabel aplikasi koloid:
Jenis industri Contoh aplikasi
Industri makanan Keju, mentega, susu, saus salad Industri kosmetika dan perawatan tubuh Krim, pasta gigi, sabun
Industri cat Cat
Industri kebutuhan rumah tangga Sabun, deterjen
Industri pertanian Peptisida dan insektisida
Berikut ini adalah penjelasan mengenai aplikasi koloid: 1. Pemutihan Gula
Gula tebu yang masih berwarna dapat diputihkan. Dengan melarutkan gula ke dalam air, kemudian larutan dialirkan melalui sistem koloid tanah diatomae atau karbon. Partikel koloid akan mengadsorpsi zat warna tersebut. Partikel-partikel koloid tersebut mengadsorpsi zat warna dari gula tebu sehingga gula dapat berwarna putih. 2. Penggumpalan Darah
Darah mengandung sejumlah koloid protein yang bermuatan negatif. Jika terjadi luka, maka luka tersebut dapat diobati dengan pensil stiptik atau tawas yang mengandung ion-ion Al3+ dan Fe3+. Ion-ion tersebut membantu agar partikel koloid di protein bersifat netral sehingga proses penggumpalan darah dapat lebih mudah dilakukan.
3. Penjernihan Air
Air keran (PDAM) yang ada saat ini mengandung partikel-partikel koloid tanah liat,lumpur, dan berbagai partikel lainnya yang bermuatan negatif. Oleh karena itu, untuk menjadikannya layak untuk diminum, harus dilakukan beberapa langkah agar partikel koloid tersebut dapat dipisahkan. Hal itu dilakukan dengan cara menambahkan tawas (Al2SO4)3.Ion Al3+ yang terdapat pada tawas tersebut akan
terhidroslisis membentuk partikel koloid Al(OH)3 yang bermuatan positif melalui reaksi:
Al3+ + 3H2O à Al(OH)3 + 3H+
Setelah itu, Al(OH)3 menghilangkan muatan-muatan negatif dari partikel koloid tanah