B
BAABB I.I.
PENDAHULUAN PENDAHULUAN
Hemoglobin (Hb) merupakan unsur utama dalam sel darah merah dan Hemoglobin (Hb) merupakan unsur utama dalam sel darah merah dan me
mempmpunyunyai ai perperananan an penpentinting g daldalam am penpenggangangkutkutan an okoksisigegen n dardari i parparu-u-parparuu keseluruh tubuh, dan sebaliknya mengangkut karbon dioksida dari jaringan ke keseluruh tubuh, dan sebaliknya mengangkut karbon dioksida dari jaringan ke paru-paru untuk dibuang.
paru-paru untuk dibuang.(1,2)(1,2) Hemoglobin berupa pigmen yang terdapat di dalamHemoglobin berupa pigmen yang terdapat di dalam eritr
eritrosit, terdiri dari osit, terdiri dari persenypersenyawaan antara heme awaan antara heme dan dan glglobin dan obin dan mempunymempunyai ai beratberat molek
molekul ul 64.0064.000 0 DaltDalton. on. Heme adalah suatu Heme adalah suatu persenypersenyawaan kompleks awaan kompleks yyang terdiriang terdiri dari
dari sebuasebuah h atom atom Fe Fe yanyang g terlterletak etak ditenditengahgah-ten-tengah gah strstruktuktur ur porfporfiriirin. n. SetSetiapiap molekul hemoglobin mengandung 4 heme.
molekul hemoglobin mengandung 4 heme.
Gambar 1.1 struktur heme Gambar 1.1 struktur heme (1)(1)
Globin adalah suatu protein yang terdiri dari 2 pasang rantai polipeptida, yang Globin adalah suatu protein yang terdiri dari 2 pasang rantai polipeptida, yang terdiri dari 2 pasang rantai dengan jumlah, jenis dan urutan asam amino tertentu. terdiri dari 2 pasang rantai dengan jumlah, jenis dan urutan asam amino tertentu. Masing-masing rantai polipeptida mengikat 1 gugus heme.
Masing-masing rantai polipeptida mengikat 1 gugus heme. (3,4,5,6)(3,4,5,6)
Manusia mempunyai 6 rantai polipeptida globin yaitu rantai aødan non aø Manusia mempunyai 6 rantai polipeptida globin yaitu rantai aødan non aø yyang ang terdiri terdiri dari dari ranati ranati ßß,?,?,d,d,e,e dadan n ??. . RanRantatai i aa memmempunpunyyai 141 ai 141 asasam am amamininoo
sed
sedangkaangkan ran rantai ntai ßæßæ,?æ,?ædan dan dædæmemmempupunyai nyai 146 146 asam asam aminamino. o. SedSedangkaangkan rn rantaantai eæi eædadan ?n ?ææ belum diketahui jelas susunan, jenis dan jumlah asam aminonya.
belum diketahui jelas susunan, jenis dan jumlah asam aminonya.
Gambar
Gambar 1.2. 1.2. strukstruktur tur globglobinin (1)(1)
Tipe hemoglobin ditentukan oleh rantai globin yang menyusunnya. Tipe rantai Tipe hemoglobin ditentukan oleh rantai globin yang menyusunnya. Tipe rantai gglolobibin n yyanang g tetersrsededia ia ununtutuk k sisintnteesa sa hehemomoglglobobiin n tetergrganantutung ng padpada a tatahhapap perkembangan individu.
perkembangan individu. (1,3,4,5)(1,3,4,5)
1.
1. Hb Hb EmbrEmbrionionikik..
Sintesa Eritrosit dimulai dalam yolk sack embrio yang berumur 19 hari, Sintesa Eritrosit dimulai dalam yolk sack embrio yang berumur 19 hari, berlan
berlanjut dalam hati jut dalam hati pada usia 6 pada usia 6 minggminggu, du, dan mulai dalam sumsum tulangan mulai dalam sumsum tulang pada kehamilan 4-5 bulan. Hb embrionik utama timbul pada 3-6 bulan pada kehamilan 4-5 bulan. Hb embrionik utama timbul pada 3-6 bulan pertama dalam uterus adalah :
pertama dalam uterus adalah : a.
a. Bh Bh GoGowewer 1 (r 1 (??22ee‘‘22), yang terdiri dari 2 rantai globin yang disebut), yang terdiri dari 2 rantai globin yang disebut Zet
Zeta a dan dan 2 2 ranrantai tai epsepsililonon, , mermerupaupakakan n suasuatu tu titipe pe gglolobin bin yyangang berhubungan dekat dengan globin non a*pada dewasa yang disebut berhubungan dekat dengan globin non a*pada dewasa yang disebut ß¼
ß¼glgloobbinin.. b.
b. Hb Hb GowGower er 2 (2 (aNaN22ee‘‘22), yang terdiri dari 2 ), yang terdiri dari 2 rantai aNrantai aNglobin dan 2 globin dan 2 rantairantai
e
eØØglobin.globin.
c.
c. Hb Hb PortPortlaland nd ((??ã22ã??‘‘22), yang terdiri dari 2 rantai), yang terdiri dari 2 rantai ??ããglobin dan 2 rantaiglobin dan 2 rantai ??ãã gl
sed
sedangkaangkan ran rantai ntai ßæßæ,?æ,?ædan dan dædæmemmempupunyai nyai 146 146 asam asam aminamino. o. SedSedangkaangkan rn rantaantai eæi eædadan ?n ?ææ belum diketahui jelas susunan, jenis dan jumlah asam aminonya.
belum diketahui jelas susunan, jenis dan jumlah asam aminonya.
Gambar
Gambar 1.2. 1.2. strukstruktur tur globglobinin (1)(1)
Tipe hemoglobin ditentukan oleh rantai globin yang menyusunnya. Tipe rantai Tipe hemoglobin ditentukan oleh rantai globin yang menyusunnya. Tipe rantai gglolobibin n yyanang g tetersrsededia ia ununtutuk k sisintnteesa sa hehemomoglglobobiin n tetergrganantutung ng padpada a tatahhapap perkembangan individu.
perkembangan individu. (1,3,4,5)(1,3,4,5)
1.
1. Hb Hb EmbrEmbrionionikik..
Sintesa Eritrosit dimulai dalam yolk sack embrio yang berumur 19 hari, Sintesa Eritrosit dimulai dalam yolk sack embrio yang berumur 19 hari, berlan
berlanjut dalam hati jut dalam hati pada usia 6 pada usia 6 minggminggu, du, dan mulai dalam sumsum tulangan mulai dalam sumsum tulang pada kehamilan 4-5 bulan. Hb embrionik utama timbul pada 3-6 bulan pada kehamilan 4-5 bulan. Hb embrionik utama timbul pada 3-6 bulan pertama dalam uterus adalah :
pertama dalam uterus adalah : a.
a. Bh Bh GoGowewer 1 (r 1 (??22ee‘‘22), yang terdiri dari 2 rantai globin yang disebut), yang terdiri dari 2 rantai globin yang disebut Zet
Zeta a dan dan 2 2 ranrantai tai epsepsililonon, , mermerupaupakakan n suasuatu tu titipe pe gglolobin bin yyangang berhubungan dekat dengan globin non a*pada dewasa yang disebut berhubungan dekat dengan globin non a*pada dewasa yang disebut ß¼
ß¼glgloobbinin.. b.
b. Hb Hb GowGower er 2 (2 (aNaN22ee‘‘22), yang terdiri dari 2 ), yang terdiri dari 2 rantai aNrantai aNglobin dan 2 globin dan 2 rantairantai
e
eØØglobin.globin.
c.
c. Hb Hb PortPortlaland nd ((??ã22ã??‘‘22), yang terdiri dari 2 rantai), yang terdiri dari 2 rantai ??ããglobin dan 2 rantaiglobin dan 2 rantai ??ãã gl
globinobin. . GlGlobin seperti obin seperti ßß yyang ang lain lain yyang ang mermerupakupakan an pengpenggangantiti ee
globin. globin.
Gambar 1.3. Persentasi variasi hemoglobin selama masa embrionik, fetal dan Gambar 1.3. Persentasi variasi hemoglobin selama masa embrionik, fetal dan
Infant Infant (1)(1)
2.
2. Hb Hb FetFetal al (aö(aö22?‘?‘22))
Hb F terdiri dari 2 rantai a»globin dan 2 rantai ?»globin dan timbul Hb F terdiri dari 2 rantai a»globin dan 2 rantai ?»globin dan timbul 90%-95%
95% daldalam am hehemogmoglolobibin n ututeruerus s dardari i kkehaehamilmilan an 8-8-35 35 mimingngggu u samsampaipai pertukaran dari HbF ke Hb dewasa.
pertukaran dari HbF ke Hb dewasa. 3.
3. Hb Hb DewaDewasa sa (a(a22ß‘ß‘22).).
Hb dewasa (Hb A) terdiri dari 2 rantai aãglobin dan 2 rantai ßãglobin, dan Hb dewasa (Hb A) terdiri dari 2 rantai aãglobin dan 2 rantai ßãglobin, dan menyebabkan 96%-98% Hb dewasa. Hb A
menyebabkan 96%-98% Hb dewasa. Hb A22 (a¨(a¨22d‘d‘22) terdiri dari 2 rantai a¨) terdiri dari 2 rantai a¨
globin dan 2
globin dan 2 rantai dqrantai dqglobin, dan meglobin, dan menunjukkan 1,5-3% Hb nunjukkan 1,5-3% Hb dewasa. Jumlahdewasa. Jumlah Hb F yang kecil (0,5-1%) juga masih dijumpai pada orang dewasa.
Gambar 1.4. Sintesa rantai globin pre dan post natal (1)
Sintesa rantai polipeptida globin
Sintesa rantai polipeptida globin ditentukan oleh gen yang terletak pada kromosom 11 dan kromosom 16. Terdapat 8 gen globin dalam keadaan haploid datu 16 gen dalam keadaan diploid. Lokasi gen aãdan ?ã disebut kelompok gen a¨dan terletak pada kromosom 16 sedangkan lokasi gen eq, ?qG, ?qA, dqdan ßqterletak berdekatan dan berhubungan erat sehingga dikelompokan sebagai kelompok gen ß: dan terletak pada kromosom 11.(1,3,4,5)
Produksi hemoglobin
Kelainan produksi rantai aâ terjadi pada semua jenis Hb kecuali Hb embrional yang diproduksi oleh yolk sac. Hb ini unik dan rantainya diatur secara terpisah. Dalam eritrosit muda dengan defisiensi rantai a©, 4 rantai ?©atau 4 rantai ß© bergabung menjadi satu unit dan menghasilkan Hb Barts yang terdiri dari 4 rantai ?ratau Hb H yang terdiri dari 4 rantai ßr. Hb Barts tampak menyolok pada masa embrional pada orang-orang dengan gangguan produksi rantai a×dimana papa masa ini rantai ?; merupakan rantai non a; yang dominant, sedangkan Hb H predominan setelah lahir, bila sebagian besar rantai globin yang diproduksi didominasi oleh rantai ß.(1,3,4,5,6)
Pada fetus dengan defek pada gen rantai ßÒ, tidak menunjukkan kelainan karena Hb F (a—2?‘2) benar-benar normal, dalam kehidupan ektrauterin,
pembentukan rantai ßdyang inadekuat menyebabkan rantai adberlebihan sehingga menumpuk. Sintesis rantai ?-atau d-dapat meningkat sebagai kompensasi terhadap defisiensi Hb A, sedangkan peningkatan Hb A2 (aö2d‘2) dan Hb F dapat membantu
mengatasi kekurangan transportasi oksigen dalam batas-batas tertentu. (1,4,5,6) Kadar Hb F untuk kompensasi bergantung pada kelengkapan perubahan produksi ?Mmenjadi rantai ßM. Rantai dMtidak pernah diproduksi sebagai kompensasi walaupun Hb A2 sangat diperlukan, kadar Hb ini tidak pernah melebihi 7-10%
kadar Hb total.
HEMOGLOBINOPATI
Hemoglobinopati adalah suatu kelainan herediter yang ditandai dengan kelainan sintesa hemoglobin sebagai akibat kegagalan pembentukan rantai polipeptida globin yang normal. Hemoglobinopati dapat dibagi ke dalam 2 kelompok besar yaitu Hb variant dan Thalassemia. Hb variant merupakan kelainan kualitatif akibat terdapatnya urutan asam amino yang abnormal pada salah satu atau lebih rantai polipeptida globin, sedangkan thalassemia adalah kelainan kuantitatif dimana terjadi sintesa yang kurang atau tidak ada sintesa satu atau lebih rantai globin yang ditandai dengan produksi Hb yang tidak adekuat. Disebut thalassemia aº apabila yang terganngu adalah sintesa rantai aº dan
thalassemia ßæapabila yang terganggu adalah sintesa rantai ßæ. Perbedaan antara Hb variant dan thalassemia adalah semua rantai yang disintesa pada thalassemia mempunyai struktur yang normal, akan tetapi jumlahnya kurang atau menurun.(7,8,9)
BAB II
ANALISA HEM OGLOBI N PADA HEM OGLOBI NOPATI
Prinsip deteksi, identifikasi dan kuantifikasi hemoglobin didasarkan pada pemisahan hemoglobin secara fisik pada cairan dan mencatat perubahan yang terjadi. Substitusi asam amino pada kebanyakan varian menyebabkan perubahan pada semua permukaan pada deteksi. (1, 10,11)
Diagnosis kelainan sintesa rantai hemoglobin biasanya memerlukan kombinasi beberapa tehnik. Sangat penting untuk dikenali bahwa banyak pemeriksaan laboratorium pada diagnosis rutin hanya menggunakan indikasi karakteristik fisikokimia dari hemoglobin dibandingkan ketepatan identifikasi. Untuk kepentingan klinis, identifikasi awal yang adekuat biasanya memerlukan kombinasi sedikitnya 2 teknik, dengan hasil penilaian dihubungkan dengan gambaran klinis, asal etnis pasien, darah rutin dan hitung darah tepi.(1,10,11-15)
1. PENGUMPULAN SAMPEL
Pemeriksaan laboratorium untuk hemoglobinopati sangat baik dilakukan dengan menggunakan sampel darah vena dengan antikoagulan garam ethylene diamine tetra-acetic acid ( K2EDTA). Pada kasus anak-anak, sampel
menggunakan darah kapiler dengan antikoagulan, sampel bisa didapat dari tusukan pada kulit, misalnya pada tumit. Pemeriksaan pada neonatus dapat dilakukan dengan menggunakan sampel darah tali pusat, darah vena atau tusukan pada kulit. Untuk mengurangi bahan kontaminasi yang tidak terduga, sampel darah tali pusat harus diambil dari pembuluh darah tali pusat dengan menggunakan syringe dan needle setelah dibersihkan dari semua darah permukaan di ujung tali pusat.(1,10,11,12,16)
Sampel harus disimpan pada suhu 4°C dan idealnya harus diperiksa dalam
waktu satu minggu, penyimpanan yang lama akan menimbulkan denaturasi hemoglobin dan menyebabkann band yang kurang jelas pada elektroforesis.
Sedangkan dried blood spot stabil selama 7 – 10 hari pada suhu ruangan. Sampel yang akan diperiksa harus disertai nama lengkap, tanggal lahir dan etnis dari pasien yang akan diperiksa. Data gambaran klinis dan riwayat keluarga kadang-kadang penting untuk interpretasi yang adekuat. Saat sampel darah diambil untuk konseling genetic dari orang tua yang potensial, identifikasi yang detil dari kedua orang tua harus dilakukan sehingga hasil pemeriksaan kedua orang tua dapat memberikan gambaran adanya resiko genetik. (1,11,12,16)
2. PERSI APAN LYSAT ERI TOSIT
Lysat sel darah merah dapat digunakan untuk banyak tujuan dan mudah disiapkan dengan menggunakan reagen lysing yang mengandung tetrasodium ethylene diamine tetra-acetic acid dan potasioum cyanide. Lysate ini mudah mengalami oxidasi, oleh karena itu harus digunakan dalam seminggu. Jika diperlukan penyimpanan lysate untuk jangka waktu panjang, cairan carbon tetrachlorida atau toluine lebih disukai penggunaannya. Alternatif lain yaitu dengan membekukan tetesan sel darah merah dengan membuat tetesan pada lapisan nitrogen cair. Jika tetesan telah beku dan cairan nitrogen menguap, sampel tersebut dapat disimpan pada suhu -40C. Penyimpanan yang lama diperlukan untuk sampel kontrol untuk penggunaan rutin atau untuk mempertahankan preparat referensi untuk hemoglobin yang jarang. (1,11,12 ,16)
Metode yang digunakan untuk mempersiapkan lysat sel darah merah dapat mempengaruhi kemampuan laboratorium untuk mendeteksi abnormalitas secara signifikan. Carbonic anhidrat dan beberapa turunannya dapat membingungkan bila preparat diwarnai dengan pewarna protein dibandingkan jika menggunakan pewarna heme khusus, jika dicurigai ada hal tersebut, elektroforesis harus diulangin menggunakan pewarna heme khusus seperti o-dianisidine. Karena umur eritrosit 120 hari maka ketidak-akuratan dapat terjadi jika sampel diperiksa dalam 4 bulan setelah transfusi terakhir.(1,16)
3. DETEKSI DAN IDENTI FIKASI
3.1 Elektroforesis(1, 10-13, 16-20)
Elektroforesis hemoglobin dapat mendeteksi fraksi hemoglobin normal dan mengetahui adanya hemoglobin varian. Dasar pemeriksaan ini adalah apabila hemoglobin diletakan pada suatu media penunjang dalam larutan dapar dengan pH tertentu daam medan listrik, maka hemoglobin dapat dipisahkan menjadi beberapa fraksi. Fraksi hemoglobin tersebut bermigrasi dengan kecepatan berbeda-beda tergantung pada besar dan jenis muatan listrik masing-masing dari katoda ke anoda. Pemisahan fraksi hemoglobin secara elektroforesis dipengaruhi oleh pH dan ionic strength larutan dapar, tegangan dan arus medan listrik, serta
media penunjang yang digunakan.
Media penunjang yang biasa digunakan adalah selulosa asetat, tepung kentang dan agarosa. Media agarosa mempunyai keunggulan dari pada yang lain karena mempunyai daya pisah yang lebih baik, tahanan listrik yang kecil dan sangat jernih. Namun media ini memerlukan persiapan pembuatan media terlebih dahulu dan mudah rusak. Karena pertimbangan ini banyak peneliti juga menggunakan selulosa asetat yang mempunyai keunggulan mendekati agarosa namun tidak cepat rusak.
Hemoglobin elektroforesis masih merupakan tehnik yang paling sering digunakan untuk deteksi awal dan menunjukkan hemoglobin varian, walaupun high performance liquid chromatography (HPLC) mulai meningkat penggunannya. Hemoglobin elektroforesis berdasarkan prinsip bahwa bila protein diletakan pada membran yang terpapar medan bermuatan, akan terpisah satu dengan yang lain dan dapat diperlihatkan dengan memberikan zat warna pada protein atau hem.
Hemoglobin elektroforesis paling baik dilakukan pada lysat sel darah merah karena mengandung sejumlah hemoglobin dan tidak pita yang muncul yang disebabkan oleh protein plasma.. Jika whole blood yang digunakan, adanya paraprotein atau immunoglobulin polyclonal konsentrasi tinggi akan
menimbulkan pita yang menonjol sehingga dapat membingungkan dengan hemoglobin varian. (gambar 2.1)
a. S
b. AS + Y globulin
c. AS
AFSC
Gambar 2.1. Elektroforesis hemoglobin selulo asetat pada pH 8.3 memperlihatkan adanya band abnormal karena adanya paraprotein : (a) pasien dengan anemia sickle sel; (b) Pasien dengan anemia sickle sel trait dan band paraprotein; (c) Pasien dengan anemia sickle sel trait; AFSC, sampel kontrol yang mengandung Hb A, F, S dan C (1)
3.1.1 E lektroforesis selulo asetat pada pH alkali (1,10,18-20)
Elektroforesis selulo asetat pada pH alkali (pH 8.2-8.6) merupakan prosedur elektroforesis awal yang sangat berguna. Tehnik ini bisa mengidentifikasi hemoglobin A, F, S/G/D/Lepore, C/E/O-Arab, H dan sejumah Hemoglobin varian yang jarang (gambar 2.2). Sebagian besar molekul dapat dipisahkan tetapi tidak dapat menentukan seluruh molekul hemoglobin dengan muatan listriknya. Pada pH ini, protein bermuatan negatif dan akan bergerak ke arah anoda yang bermuatan positif. Sampel kontrol yang mengandung hemoglobin A, F, S dan C akan berjalan pada unit masing-masing, Sampel yang mengandung hemoglobin A, F, S, C, D-Punjab, E, G-Philadelphia dan N-Baltimore tersedia secara komersial. Dengan tehnik elektroforesis yang baik, hemoglobin F dengan kadar yang lebih dari 2% dapat dikenali secara visual. Dengan tehnik yang bagus band A2 juga dapat dipisahkan dan peningkatan atau penurunan persentase hemoglobin A2 yang signifikan dapat dikenali secara visual. Pengenalan pada band A2 yang telah terpisah dapat digunakan untuk membedakan rantai α varian, seperti haemoglobin G-Philadelphia, dari rantai
varian, bukan pada rantai varian. Pengenalan band A2 juga penting jika seseorang didiagnosa dengan thalassemia trait yang juga memiliki rantai δ
varian. Peningkatan haemoglobin F pada elektroforesis harus diikuti dengan quantifikasi yang teliti, terutama jika diperlukan untuk diagnosis. Penilaian secara visual proporsi haemoglobin A2 dapat digunakan untuk melengkapi pengukuran yang lebih akurat dengan tehnik yang sesuai.
Gambar 2.2 Elektroforesis hemoglobin selulo asetat pada pH 8.3 memperlihatkan: (a) Hb A dan HbS (sickle sel trait); (b) HbA dan HbH (hemoglobin H disease); (c) HbA dan HbH (hemoglobin H disease); (d) HbA dan HbS (sickle sel trait); (e) Hb A, F dan S (Sickle sel trait pada bayi); (f) Hb A dan HbF (bayi normal); AFSC, sampel control yang mengandung Hb A, HbF, HbF dan HbC (1)
Jika haemoglobin varian dengan pergerakan haemoglobin S terdeteksi, haemoglobin elektroforesis harus diikuti dengan sickle solubility test. Jika negative atau pergerakan band abnormal lain muncul, tehnik pelengkap lain harus digunakan (misalnya elektroforesis pada pH asam atau HPLC). Jika band yang muncul membingungkan atau haemoglobin A tidak muncul (seperti pada sampel neonatus), tehnik lain harus digunakan, HPLC dan elektroforesis gel agarosa pada pH asam merupakan tehnik yang lebih sensitif untuk mendeteksi hemogloin normal atau varian dalam konsentrasi yang rendah.
Hemoglobin elektroforesis dengan selulo asetat dapat juga digunakan untuk quantifikasi hemoglobin norma atau varian, scan densitometry atau elusi
diikuti dengan spektrofotometry. Scaning densitometry diperlukan karena membran selulo asetat menjadi transparan setelah dicuci, ini merupakan prosedur yang rutin dilakukan di laboratorium. Scaning densitometry cukup tepat dalam mengukur hemoglobin yang muncul dalam persentase yang besar dari total hemoglobin. Sebagai contoh, tehnik ini adekuat untuk menilai persentase hemoglobin S untuk membedakan antara sickle sel trait dan sickle sel/ ßÚ thalassemia, atau untuk memonitor persentase hemoglobin S ketika anemia sickle sel diterapi dengan pertukaran tranfusi. Quantifikasi dengan densitometry dapat juga digunakan untuk membantu membedakan hemoglobin Lepor dengan bentuk hemoglobin lain yang mempunyai pergerakan yang sama dengan hemoglobin S. Hemoglobin Lepore meliputi 10% dari total hemoglobin, sedangkan hemoglobin D dan G meliputi 25-50%. Quantifikasi persentasi hemoglobin A2 dengan scaning densitometry tidak cukup akurat untuk diagnosa ß3 thalassemia trait. Jika elektroforesis selulo asetat digunakan untuk quantifikasi hemoglobin A2, elusi dan spektrofotomer diperlukan. Ini merupakan tehnik laboratorium yang intensif, jika sampel yang diperiksa berjumlah besar, chromatography microcolum atau
HPLC lebih disukai.
Pergerakan yang khas dari hemoglobin normal atau varian pada elektroforesis selulo asetat dengan pH alkali dapat dilihat pada gambar dibawah ini (gambar 2.3). perlu dicatat bahwa hemoglobin A2 mempunyai pergerakan elektroforetik yang serupa dengan hemoglobin C, E, O-Arab dan S-G Prhiladelphia hybrid dan oleh karena itu tidak dapat diquantifikasi dengan elektroforesis selulo asetat ketika varian hemoglobin diatas muncul. Terdapat perbedaan yang halus antara hemoglobin D-Punjab dan Lepore, dibandingkan dengan hemoglobin S; Hemoglobin varian D dan G tidak dapat dibedahkan secara jelas dengan hemoglobin S menggunakan tehnik ini dan hemoglobin Lepore dapat dipisahkan dengan mudah karena muncu dalam jumah yang lebih rendah. Terdapat juga perbedaan yang halus antara pergerakan hemoglobin C dan E, dimana HbC bergerak lebih lambat dari pada HbE dan biasanya terdapat dalam persentase yang lebih tinggi. Walaupun demikian dibutuhkan konfirmasi yang lebih lanjut.
(a)
(b)
Gambar 2.3 Diagram diatas memperlihatkan pergerakan hemoglobin normal dan hemoglobin varian pada selulo asetat pH 8.2-8.6 dibandingkan dengan pergerakan pada gel agarosa pH 6.0-6.2 : (a) hemoglobin dengan pergerakan yang dekat dengan A, S atau C; (b) fast hemoglobin (1)
Gambaran khas lain hemoglobin yang mempunyai pergerakan yang sama dengan hemoglobin S atau Hemoglobin C pada elektroforesis selulo asetat dapat dilihat pada tabel dibawah ini
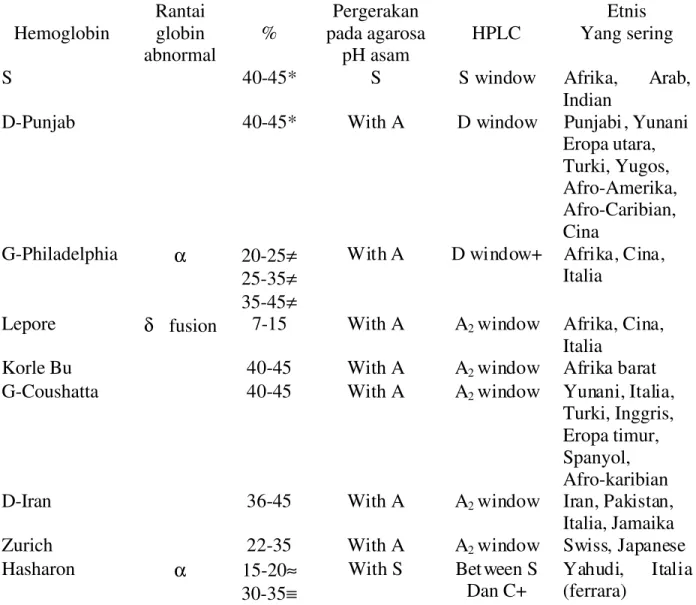
Tabel 2.1 Karakteristik beberapa hemoglobin varian yang mempunyai pergerakan yang sama dengan hemoglobin S pada elektroforesis selulo asetat pH alkali (1)
Hemoglobin Rantaiglobin
abnormal % Pergerakan pada agarosa pH asam HPLC Etnis Yang sering
S 40-45* S S window Afrika, Arab,
Indian
D-Punjab 40-45* With A D window Punjabi, Yunani
Eropa utara, Turki, Yugos, Afro-Amerika, Afro-Caribian, Cina G-Philadelphia α 20-25≠ 25-35≠ 35-45≠
With A D window+ Afrika, Cina,
Italia
Lepore δ fusion 7-15 With A A2window Afrika, Cina,
Italia
Korle Bu 40-45 With A A2window Afrika barat
G-Coushatta 40-45 With A A2window Yunani, Italia,
Turki, Inggris, Eropa timur, Spanyol, Afro-karibian
D-Iran 36-45 With A A2window Iran, Pakistan,
Italia, Jamaika
Zurich 22-35 With A A2window Swiss, Japanese
Hasharon α 15-20≈
30-35≡
With S Between S
Dan C+ Yahudi, (ferrara) Italia
* lebih rendah jika bersamaan dengan thalassemia αtrait
+ Terdapat juga hemoglobin A2 varian
≠Tergantung jumlah gen αnormal yang ada ≈Jika Yahudi dan ; ≡ Jika Italia
Tabel 2.2 Karakteristik beberapa hemoglobin varian yang mempunyai pergerakan yang sama dengan hemoglobin C pada elektroforesis selulo asetat pH alkali (1)
Hemoglobin Rantaiglobin
relevan % Pergerakan pada agarosa pH asam HPLC Etnis Yang sering
A2 δ 2-3.5* With A A2 window Hb minor normal
C 40-45+ C C window Afrika Barat
E 30-35 With A A2window Asia Tenggara
O-Arab 40-45 Sedikit pada
C dari S≠
Antara S
dan C Eropa Timur,Afro-Amerika Afro-Caribian
C-Harlem 40-45+ With S≠ Antara S
dan C Afrika Barat
* 3-5.8% adalah thalassemia trait
+ Lebih rendah jika bersamaan thalassemia αtrait
≠ O-Arab dan C-Harlem lebih mudah dibedakan satu dengan lain pada agar citrat
dari pada agarosa, pada agar citrat pH asam C-Herlem bergerak dengan S, O-Arab dan A, tetapi lebih dekat ke A.
3.1.2 E lektroforesis gel agarosa pada pH alkali (1,10,20)
Gel agarosa merupakan alternatif selulo asetat lain untuk elektroforesis pada pH alkali. (gambar 2.4). Tehnik ini lebih sensitif untuk deteksi adanya hemogobin varian dalam jumah kecil, akan tetapi lebih mahal dan kurang menyenangkan dibandingkan dengan elektroforesis selulo asetat lain.
Gambar 2.4. Elektroforesis hemoglobin gel agarosa pada pH alkali (pH 8.6) 1. HbA dan peningkatan HbA2 (thalassemia trait); 2. HbA dan HbA2 (normal); 3.
HbA dan HbS (sel sicke trait); 4. HbA dan HbA2 (normal); 5. HbA, HbF dan HbC
(HbC trait pada bayi); 6. HbA dan HbS (sel Sickel trait); 7. HbA dan HbA2
(normal); 8. HbA dan HbA2(normal)(1)
3.1.3 E lektroforesis agar sitrat atau gel agarosa pada pH asam.(1,10,18,20)
Jika adanya Hb varian terdeteksi dengan elektroforesis selulo asetat atau gel agarosa pada pH alkali, perlu segera dikonfirmasikan kebenaranya dengan tehnik lain, dan yang paling sering digunakan adalah elektroforesis agar citrat (gambar 2.5) atau gel agarosa (gambar 2.6) pada pH asam (6.0 – 6.2). Pada tehnik ini, hemoglobin yang telah dipisahkan diwarnai dengan pewarna haem seperti o- diansidine atau o-toluidine . Dengan tehnik ini, pemisahan hemoglobin tidak
komponen-komponen dalam agar atau agarosa. Agar mengandung agarosa dan agaropectin, suatu polisakarida sufat. Agarosa polimer tidak bergerak, tetapi agaropectin dapat membentuk komplek dengan asam amino dari hemoglobin, komplek hemoglobin agaropectin kemudian bergerak ke arah anoda. Sedangkan yang tidak membentuk komplek dengan hemoglobin akan bergerak ke arah katoda karena aliran osmotik. Terdapat perbedaan yang relatif hemoglobin varian antara gel agarosa (gambar 2.3) dan agar citrate (gambar 2.7). Kedua tehnik dapat membedakan Hb S dari D/G, tetapi tidak dapat membedakan kebanyakan tipe dari S dan G. Elektroforesis pada pH asam akan membedakan Hb C dari E, C-Harlem dan O-Arab dan akan membantu membedakan satu dengan yang lain dari 3 Hb varian yang terakhir. Elektoforesis agar dan gel agarosa pH asam tidak memisahkan hemoglobin A2 dari hemoglobin A. Elektroforesis pada pH asam diindikasikan
untuk pemeriksaan dugaan adanya hemoglobin dengan afinitas tinggi walaupun pada elektroforesis pH alkali normal, seperti beberapa hemoglobin afinitas tinggi mempunyai pergerakan abnormal hanya pada pH asam.
Gambar 2.5. Elektroforesis hemoglobin agar citrate pada pH 6.0 – 6.2 memperlihatkan : (a) normal (hemoglobin A); (b) normal (hemoglobin A); (c) Sickle trait (Hb A dan HbS) dengan G-Philadelphia keturunan; (d) HbA dan HbJ; (e) HbA dan HbC; (f) HbS dan HbC; (g) HbA dan HbS. (1)
Gambar 2.6 Elektroforesis hemoglobin gel agarosa pada pH 6.0 – 6.2 memperlihatkan : (a) Sampel control yang mengandung Hb F, A, S dan C; (b) HbF dan HbS (anemia sickle sel); (c) HbF Köln dan HbA (Hb Köln heterozigot); (d) HbA dan HbC (HbC trait); (e) HbS (anemia sickle sel); (f) HbS (anemia sickle sel); (g) HbA dan HbC ( HbC trait); (h) Sampel control dengan HbF, A, S dan C; (i) Sampel control dengan HbF, A, S dan C; (j) HbF, Köln dan A (Hb Köln heterozigot).(1)
Gambar 2.7 Diagram diatas memperlihatkan pergerakan hemoglobin normal dan hemoglobin varian pada selulo asetat pH 8.2-8.6 dibandingkan dengan pergerakan pada gel agar citrate pH 6.0-6.2 (1)
3.2 Elektroforesis Capilary (I soelectric Focusing)daftar puatakt (1,10,20-22)
Elektroforesis capillary (Isoelectric focusing) merupakan teknik yang menggunakan capillary tube, voltase tinggi dan waktu yang lebih pendek, metode ini membutuhkan sampel yang lebih sedikit. Capilary isoelectric dapat dikembangkan dengan semiautomatic. Isoelectric focusing (IEF) berdasarkan fakta bahwa total muatan protein tergantung pada pH cairan yang mengelilinginya. Pada pH rendah, protein kelompok asam carboxylic tidak bermuatan dan kelompok yang mengandung gugus N (NH3 +) menjadi bermuatan positif penuh. Pada pH tinggi, terjadi konversi, kelompok asam carboxylic bermuatan negatif (COO-) dan kelompok dasar yang tidak bermuatan, menjadi bermuatan negatif. Pada IEF, berbagai hemoglobin dipisahkan dalam gel (misalnya gel agarosa) menurut titik isoelektriknya (pI), yaitu titik dimana mereka tidak bermuatan.
Tersedia plate preparat komersial yang mengandung poyacrylamide atau selulo asetat yang terdiri dari molekul amphoteric dengan berbagai nilai pI, pH ditetapkan melalui plate. Ketika hemolysat dimasukkan ke plate yang telah dipersiapkan dalam lapangan bermuatan listrik kuat, molekul hemoglobin akan bergerak melewati plate sampai mencapai titik dimana pH sesuai dengan pI hemoglobin. Karena molekul hemoglobin menjadi tidak bermuatan, maka akan tetap pada titik tersebut. Berbagai band hemoglobin yang ada diwarnai (gambar 2.8) dan dapat di quantifikasi dengan densitometry . Band hasil densitometri dapat dilapiskan diatas band yang telah diketahui untuk identifikasi.
Band pada IEF lebih tajam dibandingkan dengan hasil elektoforesis selulo asetat. Beberapa hemoglobin yang tidak dapat dibedakan satu dengan yang lain dengan elektroforesis dapat dipisahkan dengan IEF. Sebagai contoh : Beberapa variant D dan G (seperti D-Punjab/Los Angeles dan G-Philadelphia) dapat dipisahkan dari hemoglobin S dan dapat dipisahkan satu dengan yang lain. (gambar 2.9). Walaupun quantifikasi dengan densitometri dimungkinkan tetapi ketelitiannya pada konsentrasi rendah sangat jelek dan oleh karena itu metode ini tidak dipergunakan untuk quantifikasi hemoglobin A2. IEF merupakan prosedur
yang lebih mahal dan biaya per test yang lebih tinngi dibandingkan dengan elektoforesis pada selulo asetat. IEF mempunyai peran penting dalam diagnosis
pada neonatus ketika sampel yang digunakan sedikit atau menggunakan elaute dari dried blood spot dan karena kemampuannya yang baik dalam memisahkan berbagai band. Bila sampel diperoleh dari orang dewasa, kelebihan IEF tadi tidak terlalu berarti, walaupun kemampuannya untuk membedakan hemoglobin D dan G lebih baik. IEF memiliki kekurangan berupa munculnya band methaemoglobin (akibat penyimpanan sampel yang lama) dan glycosylated haemoglobin yang dapat membingungkan dan mempersulit interpretasi. Untuk penggunaan yang rutin pada orang dewasa, HPLC merupakan tehnik yang lebih berguna.
Gambar 2.8. Plate isoelectric focusing diatas memperlihatkan dari kiri ke kanan : (a) Hb F, A dan Bart’s; (b) Hb S dan C; (c) Hb S dan F; (d) Hb S; (e) Hb A dan D; (f) Hb A dan S; (g) Hb A dan E; (h) normal ( Hb A dan A2)(1)
Gambar 2.9 Diagram diatas memperlihatkan pergerakan beberapa hemoglobin pada plate Isoelectric focusing (IEF). Hemoglobin yang mempunyai pergerakan yang mirip pada Hb Elektroforesis dapat dibedakan satu dengan yang lain : Hemoglobin A2, C dan E dapat dibedakan satu dengan yang lain ( tetapi HbE tidak dapat dibedakan dari Hb C-Harlem dan O-Arab); Hemoglobin S, D-Punjab dan G-Philadelphia dapat dibedakan satu dengan yang lain ( juga dari D-Iran dan G-Galveston, tetapi G-Philadelphia mempunyai pI yang sama dengan G-Coushatta dan Lepore) (1)
3.3 High Performance Liquid Chromatography(1,11-19, 23-27)
Cation-exchange high performance liquid chromatography (CE-HPLC or HPLC) merupakan teknik yang dikembangkan sejak tahun enam puluhan untuk tujuan penelitian dan merupakan metode pilihan untuk mendeteksi Hb varian secara dini. Prinsip kerjanya adalah pemisahan berbagai jenis hemoglobin oleh adanya perbedaan muatan antar molekul hemoglobin tersebut. Pada cara ini fase cair dipompakan melalui kolom fase padat. Hemolisat yang mengandung berbagai jenis Hb yang berbeda akan diadsorbsi pada fase padat yang bermuatan positif. Kecepatan elusi dari Hb yang berbeda jenis ditentukan oleh pH dan kekuatan ion larutan dapr pengelusi.
Dengan alat pencampur automatik, elusi dapat dilakukan dengan peningkatan kekuatan ion secara bergradasi. Fraksi yang dielusi dapat dideteksi dengan menggunakan detektor cahaya dan datanya dapat diolah dengan memasukkan ke program komputer. Besarnya area dibawah puncak adsorbsi sesuai dengan persentase fraksi yang bersangkutan. Kecepatan elusi (retention time ) dibandingkan dengan jenis Hb yang telah diketahui, baik Hb normal yaitu
HbA, HbF dan HbA2, maupun Hb varian seperti HbE, Hb Malay, HbO, dan
lain-lain. Dengan menggunakan cara ini hasil yang diperoleh sangat akurat dan reprodusibel. Terdapat korelasi antara kecepatan elusi pada HPLC dengan pergerakan pada elektroforesis asetat pH alkali. Hemoglobin yang lebih bermuatan positif ( seperti hemogobin S dan C) mempunyai kecepatan elusi yang lebih panjang, sama dengan pergerakan yang lebih lambat pada selulo asetat pH alkali.
Aplikasi HPLC untuk identifikasi hemoglobin varian bergantung pada kecepatan elusi dari tiap-tiap jenis hemoglobin, baik hemoglobin normal maupun varian sebelum muncul pada eluate. Banyak jenis hemoglobin varian dapat dipisahkan satu dengan lainnya, walaupun ada beberapa hemoglobin saling tumpang tindih. Beberapa hemoglobin yang tidak dapat ditentukan oleh elektroforesis asetat pada pH alkali dapat ditentukan dengan HPLC, seperti hemoglobin D-Punjab/Los Angeles dan G-Philadelphia dapat ditentukan dari hemoglobin S dan satu dengan yang lainnya. HPLC telah dirancang sedemikian rupa sehingga jenis-jenis Hb yang paling sering sudah dapat diidentifikasi, seperti
HbA2 /HbE, HbF, HbS dan HbD dan juga mampu mendeteksi Hb varian tersering
didunia yaitu HbS dan HbE.
Kemampuan dan pengalaman sangat dibutuhkan dalam menginterpretasi hasil HPLC karena data yang dihasilkan sangat komplek. Hemoglobin glycosylat varian mempunyai elution time yang berbeda dengan yang non-glycosilat dan
hemoglobin acetylat dengan yang non-acetylat. Hemoglobin varian mungkin mempunyai retention time yang sama dengan hemoglobin normal atau dengan
hemoglobin varian yang lain. Sebagai contoh : Hemoglobin E, hemoglobin Korle Bu, dan hemoglobin Lepore mungkin tumpang tindih dengan hemoglobin A 2 dan
hemoglobin A2 mungkin meningkat palsu jika terdapat hemoglobin S.
HPLC tidak hanya dapat digunakan untuk deteksi, identifikasi dan kuantifikasi hemoglobin varian, tetapi juga dapat digunakan untuk kuantifikasi hemoglobin A, A2 dan F. Bahan kontrol untuk memonitor ketelitian pemeriksaan
hemoglobin F dan A2 tersedia secara komersial. Beberapa keuntungan HPLC
dibandingkan dengan elektroforesis hemoglobin adalah:
- Teknik ini tidak memerlukan tenaga kerja yang banyak. - Adekuat dengan sampel yang sedikit.
- Kuantifikasi Hb normal dan abnormal tersedia untuk setiap sampel.
- Dengan berhasilnya kuantifikasi hemoglobin A2 varian, Thalassemia ßå
trait dapat didiagnosis dengan prosedur tunggal, menggantikan gabungan elektroforesis hemoglobin dan kromatografi mikrokolom.
- Dapat mengidentifikasi sejumlah besar jenis hemoglobin varian.
- Hemoglobin A2 varian dapat dengan mudah diidentifikasi, sehingga dapat
dibedakan varian rantai a¥ dan ߥdan dapat menegakkan diagnosis
thalassemiaß/trait dimana terdapat varian rantai a/secara lebih akurat.
- Dengan HPLC selain hasil kualitatif seperti deteksi hemoglobin varian, sekaligus memberikan nilai kuantitatif HbA2, sehingga waktu yang
dibutuhkan lebih singkat.
Kekurangan teknik ini adalah harga alat dan reagennya yang mahal dan tidak praktis bila dilakukan untuk jumlah pemeriksaan yang sedikit. Alat HPLC yang ada dipasaran merupakan alat automatik yang tidak dirancang untuk jumlah
pemeriksaan kecil. Karena itu biasanya alat ini hanya digunakan di laboratorium rujukan.
Pola elusi khas dari hemoglobin normal dan varian dapat dilihat pada beberapa gambar dibawah ini. Beberapa hemoglobin varian mungkin memiliki retention time yang tumpang tindih dengan hemoglobin A2dan hemoglobin S.
Gambar 2.10 Beberapa gambaran khas HPLC untuk hemoglobin normal
4. KUANTIFIKASI
4.1 Penetapan Fraksi Hemoglobin A2 Secara Kuantitatif(1,10-12, 16-19)
Penetapan fraksi HbA2 secara kuantitatif dapat diukur dengan melakukan
pencacahan, elusi pita elektroforesis, kromatografi mikrokolom atau imunodifusi radial. International Committee for Standarization of Hematology (ICSH) menganjurkan untuk menggunakan kromatografi mikrokolom atau elusi pita elektroforesis karena mempunyai ketelitian yang cukup baik dengan variasi kurang dari 4%.
Pada cara pencacahan, fraksi haemoglobin ditetapkan dengan melakukan elektroforesis terlebih dahulu, difiksasi kemudian diwarnai dan ditetapkan kadar masing-masing fraksi dengan densitometer. Penetapan fraksi HbA2 dengan cara
densitometer ini tidak lagi dianjurkan karena mempunyai variasi yang besar.
Pada cara elusi pita elektroforesis, kadarnya ditetapkan dengan menggunakan spektrofotometer. Dengan cara ini pita masing-masing fraksi hemoglobin tersebut dipisahkan dan dielusi dalam larutan dapar, kemudian diukur serapannya pada panjang gelombang 415 nm dan kadar masing-masing fraksi hemoglobin dapat ditentukan.
Cara imunodifusi radial merupakan cara yang tidak dianjurkan oleh ICSH, karena harganya mahal. Prinsipnya fraksi HbA2 yang terdapat dalam sumur pada
lempeng agar yang mengandung antibody terhadap HbA2 akan mendifusi ke
dalam agar dan bereaksi dengan antibody tersebut membentuk cincin presipitat. Dari besarnya diameter cincin presipitat dibandingkan dengan standar dapat diketahui kadar fraksi HbA2tersebut.
Kromatografi mikrokolom merupakan cara yang paling cepat dan tepat untuk menetapkan fraksi HbA2 secara kuantitatif. Prinsip pemeriksaan ini adalah diethylaminoethyl-cellulosa sebagai anion excahnge r esin akan mengikat seluruh
fraksi Hb pada ph 8,4 – 8,5. Berbagai jenis Hb mempunyai perbedaan muatan yang disebabkan oleh perbedaan susunan asam amino yang membentuknya. Dengan pengaturan pH atau ionic strenght larutan dapar yang dilakukan dengan
penambahan larutan pengembang, HbA2 terlepas dari fase padat dan akan berada
terhadap serapa Hb total pada panjang gelombang 415 nm. Penetapan fraksi HbA 2
secara kromatografi mikrokolom tidak terpengaruh oleh peningkatan fraksi HbF, namun adanya HbE, HbC, HbD, HbG, HbO dan HbS dapat mempengaruhi hasil pemeriksaan karena fraksi Hb abnormal tersebut akan ikut dalam elaute . Bila pada
penetapan fraksi HbA2 dengan cara ini dijumpai kadar yang sangat tinggi,
melebihi 8% perlu dicurigai adanya fraksi hemoglobin lain dan dilakukan pemeriksaan elektroforesis hemoglobin. Selain itu pada penetapan kadar HbA2
sebaiknya penderita tidak ditrnasfusi terlebih dahulu karena akan mempengaruhi hasil pemeriksaan. Pemeriksaan kadar HbA2 sebaiknya dilakukan 8 minggu pasca
transfusi darah.
Meningkatnya kadar HbA2 pada seorang yang secara klinis normal
merupakan kriteria diagnostik thalassemia heterozigot. Selain itu kadar HbA2
dapat pula meningkat pada hipertiroid dan anemia megaloblastik, peningkatan yang terjadi berkisar antara 3,6-7,8% dengan rata-rata 5,2%.
4.2. Penetapan Fraksi Hemoglobin F Secara Kuantitatif (1,10-12, 16-19)
Penetapan kadar HbF dapat dilakukan dengan cara denaturasi alkali, kromatografi mikrokolom dan imunodifusi radial. Metode pemeriksaan HbF yang digunakan secara luas pertama kali diperkenalkan oleh Betke, metode tersebut berdasarkan denaturasi alkali selektif hemoglobin lain dan meninggalkan HbF yang tahan terhadap denaturasi secara utuh. Berdasarkan ketelitian masing-masing cara tersebut, ICSH menganjurkan pengukuran kadar HbF dengan cara denaturasi alkali yang dimodifikasi oleh Betke tersebut untuk penetapan kadar HbF antara 2 – 40%, cara kromatografi mikrokolom untuk kadar HbF melebihi 40% dan cara imunodifusi untuk kadar HbF dibawah 2%. Pemeriksaan HbF dengan imunodifusi radial tidak dianjurkan karena kurang akurat.
Metode denaturasi alkali modifikasi Betke merupakan cara yang mempunyai variasi yang kecil, murah dan mudah dikerjakan. Metode ini dapat digunakan untuk mengukur kadar HbF, bila cara kromatografi mikrokolom dan imunodifusi tidak memungkinkan untuk dilakukan. Prinsip metode ini adalah fraksi HbF ternyata lebih tahan terhadap pH alkali dibandingkan fraksi hemoglobin lainnya. Bila larutan hemoglobinsianida dicampur dengan larutan
NaOH 1,25 M maka akan terjadi denaturasi jenis Hb yang tidak tahan alkali. Setelah waktu tertentu, denaturasi dihentikan dengan menambahkan (NH4)2SO4
jenuh yang juga berfungsi untuk presipitasi Hb yang didenaturasi. Selanjutnya presipitat dipisahkan dengan filtrasi kertas saring dan filtrat yang terkumpul merupakan hemoglobin tahan alkali seperti HbF. Filtrat diukur serapannya dengan menggunakan spektrofotometer pada panjang gelombang 540 nm. (15,7,31,9) Persentase HbF dihitung dengan cara membandingkan serapan HbF terhadap serapan Hb total. Pengukuran kadar Hb total dilakukan dengan mencampur larutan HiCN dengan air suling sebagai pengganti NaOH 1,25 M, kemudian ditambahkan larutan (NH4)2SO4 jenuh. Dari campuran tersebut ditambahkan
larutan sianida menurut Drabkin dan kemudian dibaca serapannya pada panjang gelombang 540 nm.
Hemoglobin F juga dapat dikuantifikasi dengan HPLC atau dengan elektroforesis hemoglobin kemudian dilanjutkan dengan densitometer. Densitometer sendiri tidak dapat dipercaya seluruhnya karena 10 – 15% masih dibawah HPLC atau denaturasi alkali (modifikasi Betke). HPLC memberikan hasil yang lebih baik dibandingkan dengan denaturasi alkali. Kromatogram harus diperiksa secara teliti jika hemoglobin F tampak meningkat pada HPLC, karena peningkatan hemoglobin glycosilat kadang-kadang teridentifikasi sebagai HbF. Jika HbF tampak lebih besar dari 10% pada HPLC, harus dikonfirmasikan dengan alternatif pemeriksaan lain untuk menyingkirkan kesalahan identifikasi dengan hemoglobin N atau hemoglobin J.
Pada orang dewasa normal kadar HbF kurang dari 1% dan akan meningkat ringan 1 – 5% pada 50% karier Thalassemia, 5 – 20% mengambarkan δ
thalassemia trait dan hereditary persistence of fetal Hb (HPFH), 20 – 45% merupakan gambaran HPFH panseluler tipe Africa. Pada beberapa kasus homozigot, HbF dapat mencapai >90% dari total Hb.
5. Kleihauer Test(1,10,16)
Kleihauer test digunakan untuk konfirmasi jika ada peningkatan persentase HbF. Distribusi hemoglobin F antara sel dapat membantu membedakan thalasemia δ trait. Cara ini juga disebut cara elusi asam, pertama kali
diperkenalkan oleh Kleihauer pada tahun 1957. Cara ini didasarkan sifat HbF yang sukar larut dalam suasana asam, sedangkan HbA d an hemoglobin yang lain lebih mudah larut. Bila sediaan hapus darah difiksasi dan dikeringkan dengan etanol 80%, kemudian sediaan direndam dalam larutan dapar (buffer) yang berisi asam (pH 3.3 untuk pulasan eosin dan 2.0 untuk amido black) maka hemoglobin yang lain akan terelusi, sedangkan HbF tidak terelusi.
Bila dilakukan pulasan tanding eritrosit yang mengandung HbF mengambil warna, sedangkan hemoglobin yang lain tidak mengambil warna. Sediaan tersebut kemudian diperiksa menggunakan mikroskop cahaya. Eritrosit yang mengandung HbF akan nampak berwarna merah muda dengan hematosiklin atau berwarna biru tua dengan amido black, sedangkan eritrosit yang mengandung HbA dan hemoglobin lain akan tampak sebagai eritrosit yang kosong atau ghost cells .
Gambar 2.11 Kleihauer test menunjukkan peningkatan hemoglobin F (a); Negatif kontrol untuk hemoglobin F (b) (1)
6. Analisa DNA. (1,10, 11-13, 16-19, 28)
Teknik Skrening standard yang telah diuraikan sebelumnya telah cukup untuk deteksi dan karakteristik dari mutasi yang sering terjadi, tetapi terbatas dalam identifikasi varian yang jarang dan mendefinisikan secara spesifik efek dari thalassemia. PCR terutana digunakan untuk deteksi point mutasi, delesi dan polimorfis DNA. Pada teknik ini dilakukan amplifikasi region DNA yang dibutuhkan, mudah, cepat dan terutama mendukung diagnosa prenatal, Teknik ini membutuhkan sampel yang sangat kecil yang dapat diperoleh dari sampel villi krorionik. Aplikasi klinis yang paling penting dari analisa adalah :
1. Untuk konfirmasi diagnosis dari thalassemia trait. Identifikasi lesi molekuler secara tepat sangat penting untuk tujuan konseling genetik, diagnosis prenatal dan kadang—kadang untuk tujuan penanganan klinis. 2. Untuk konfirmasi adanya haemoglobin D-Punjab dari hemoglobin
kelompok D atau G.
3. Untuk diagnosis prenatal adanya kelainan sintesa haemoglobin yang serius pada fetal (terutama untuk diagnosis trimester pertama).
Pada beberapa komunitas dimana thalassemia α, , δ dan interaksi hemoglobin
yang kompleks relatif sering terjadi dan dimana thalassemia silent terjadi, diperlukan analisa DNA yang lebih intensif untuk membuat diagnosis menjadi lebih akurat sebelum dilakukan konseling genetik. Di Thailand dan Malaysia, dimana hemoglobin Malay mewakili 15% alel thalassemia, analisa DNA untuk diagnosa antenatal merupakan kebutuhan primer dalam deteksi hemoglobin varian ini walaupun pada elektroforesis dan kromatografi tidak nampak.
Prinsip dari teknik PCR ini adalah sintesis DNA menggunakan primer sintetik (untaian pendek singl e stranded DNA), yang merupakan komplementer
region DNA yang dibutuhkan dan Taq polymerase. Amplifikasi DNA yang banyak secara enzimatik membuat fragment DNA yang diwarnai dalam gel agarosa dapat dilihat secara visual. Substitusi basa tunggal dapat diidentifikasi dengan perubahan ukuran fragmen DNA setelah digesti hasil PCR dengan enzim restriksi yang khusus untuk untaian DNA spesifik. Akan tetapi teknik ini membutuhkan waktu yang agak lama dan radioisotop.
Teknik baru telah dikembangkan berdasarkan teknik PCR yang diikuti tes mutasi spesifik tanpa menggunakan enzim restriksi dan radioisotop jika defek molekuler yang ingin dicari diketahui secara tepat sebelumnya sehingga hasil yang diinginkan dapat diperoleh dalam 24 jam. Salah satu contoh teknik ini adalah
ampli fication refractory mutation system (ARMS) yang menggunakan primer alel
spesifik. Pada teknik ini dua primer berbeda digunakan, satu komplementer alel normal dan satu komplementer alel mutasi. Kedua komplementer tersebut hanya berbeda pada titik mutasi. Primer yang didapatkan merupakan hasil PCR jika primer tersebut dan untaian DNA saling melengkapi. Sehingga primer normal dan mutasi akan mengamplifikasi alel yang normal dan mutasi secara berturut-turut.
Dengan teknik ini, mutasi gen spesifik dari DNA pasien dapat diperiksa, contohnya HbS. Primer yang telah dibuat adaah untuk A, S, C, E dan genotype
-thalassemia yang paling sering. Pada thalassemia, beberapa defek tertentu telah ditemukan sebagai prevalensi pada tiap kelompok etnis. Sehingga etnis asli dari pasien akan menjadi penentu utama seting primer dan digunakan pertama dalam analisis, dengan kemungkinan identifikasi positif yang tinggi pada skrening pertama.
Teknik GAP-PCR merupakan teknik yang digunakan untuk mendeteksi delesi pada DNA, dan sangat berguna dalam diagnosis bentuk yang sering dari thalassemia α+ dan α0, yang mengalami delesi dari aslinya. Teknik ini juga
digunakan dalam diagnosis molekuler dari Hb Lepore, thalassemia δ dan delesi
pada HPFH. Multiplex PCR merupakan teknik yang sangat berguna untuk memperlihatkan secara simultan sejumlah mutasi yang berbeda dalam tes tunggal.
7 M assSpectrometry(1, 16, 17, 29, 30)
Mass Spectrometry telah digunakan untuk karakterisasi hemoglobin varian oleh sejumlah laboratorium sejak tahun 1980 an, tetapi hanya terbatas pada beberapa laboratorium pusat. Kini teknik ini telah dikembangkan dengan prosedur yang cepat dan menggunakan sampel darah yang sangat sedikit. Prosedur ini telah dikerjakan bersama dengan elektroforesis dan kromatografi dan telah menunjukkan hasil identifikasi hemoglobin abnormal positif lebih dari 95% kasus, ini serupa dengan yang dihasilkan teknik lain.
Electrospray ionization mass spectrometry merupakan teknik riset yang
saat ini diaplikasikan untuk identifikasi hemoglobin varian. Teknik ini berdasarkan pada pengukuran massa dibandingkan dengan rasio muatan sehingga massa tersebut dapat disimpulkan. Teknik ini memungkinkan untuk menetapkan apakah varian yang ada adalah varian rantai α atau , dan dapat memperkirakan
proporsi dari varian tersebut serta memprediksi substitusi asam aminonya sehingga dapat menghitung setiap perubahan massa. Dengan menggunakan teknik ini, proporsi abnormalitas yang sangat kecil (5%) dari total hemoglobin dapat diidentifikasi. Dan dengan Tandem mas Spectrometry dapat ditentukan rantai mana yang mengandung mutasi yang sesuai.
Dengan mengunakan kombinasi prosedur phenotype dan mass spectrometry, identifikasi perbedaan varian massa yang hanya 1 Da dapat ditentukan dengan mudah, seperti HbC, HbE dan HbDPunjab dari HbA. Akan tetapi teknik ini sangat mahal dan membutuhkan tenaga yang sangat trampil dalam interpretasi hasil.
2.7 QUALI TY ASSURANCE(1,10,16, 19)
Semua pemeriksaan yang dilakukan harus dilakukan oleh tenaga yang terlatih dan mengikuti Standard Operating Prosecur (SOP) untuk setiap test. Kontrol harus digunakan setiap kali elektroforesis dijalankan dan harus mengandung hemoglobin varian yang sering dijumpai, begitu juga dengan hemoglobin normal. Kontrol yang mengandung campuran HbF, HbA, HbS dan HbC merupakan kontrol yang digunakan secara luas. Setiap laboratorium yang melakukan pemeriksaan hemoglobinopati harus mengikuti skema quality assurance external. Partisipasi ini diperlukan untuk akreditasi patologi klinik bagi laboratorium hemoglobinopati.
Kontrol komersial untuk kuatifikasi HbA2 dan HbF dan petanda HbA,
HbF, HbA2, HbS, HbC, HbD serta HbE untuk elektroforesis atau kromatografi
telah tersedia dari beberapa pabrik. Semua bahan kontrol yang telah tersedia harus hmendapat sertifikasi WHO.
BAB IV KESIMPULAN
Hemoglobinopati merupakan kelainan genetik hemolgobin. Kelainan ini dapat mengakibatkan berkurangnya produksi hemoglobin, dikenal sebagai thalassemia, atau kelainan struktur hemoglobin yang disebut sebagai hemoglobin varian. Hemoglobin varian ada juga yang disertai penurunan produksi hemoglobin seperti pada HbE dan Hb Malay, sehingga timbul gejala thalassemia, namun sering hemoglobin varian tidak menimbulkan gejala.
Analisa hemoglobin mempunyai peranan penting dalam diagnosis hemoglobinopati karena diagnosis hemoglobinopati ditegakkan berdasarkan gambaran hematologi dan analisa hemoglobin, baik thalassemia maupun Hb varian. Komponen Hb normal (HbA, HbF dan HbA2) maupun Hb varian dapat
dipisahkan satu sama lain berdasarkan perbedaan sifat molekulnya yaitu perbedaan muatan listrik yang merupakan muatan total dari seluruh asam amino, sifat fisiko-kimia dan massa yang menyusun molekul globin dari hemoglobin tersebut. Berbagai teknik telah dikembangkan dan dapat digunakan untuk analisis Hb, sebagian besar laboratorium menggunakan teknik elektroforesis pada pH alkali untuk analisis hemoglobin secara kuantitatif. Kelemahan metode ini adalah masih ada jenis-jenis hemoglobin yang tidak terpisah, sehingga adakalanya perlu dilanjutkan dengan elektroforesis pada pH asam.
Untuk menganalisa hemoglobin secara kuantitatif biasanya digunakan ion- exchange chromatogphy untuk HbA2 dan denaturasi alkali untuk HbF. Akan
tetapi memerlukan kerja yang kompleks dan waktu yang relatif lama. Teknik yang paling mutakhir untuk analisa hemoglobin saat ini adalah Hi gh Perfor mance Liquid Chomatography (HPLC) walaupun teknik mass spectrometry sudah bisa
diaplikasikan untuk analisa Hb akan tetapi masih terbatas untuk penelitian. Analisa hemoglobin menggunakan HPLC dapat memisahkan dan menyatakan secara kuantitatif jenis-jenis hemoglobin dengan sangat akurat, caranya mudah dan singkat waktu pengerjaannya. Namun cara ini juga tidak terlepas dari kemungkinan gagal mendeteksi jenis Hb tertentu, selain itu cara ini umumnya
tidak praktis bila dilakukan untuk jumlah pemeriksaan yang sedikit. Kadang-kadang diperlukan analisis DNA untuk mendeteksi adanya mutasi gen globin yang mendasari hemoglobinopati tersebut.
DAFTAR PUSTAKA
1. Barbara J.B. Haemoglobinopathy Diagnosis. 2nd Ed. Blackwell Publishing. 2006.
2. Alain J. M, Rowe MD. Structure–function relations of human hemoglobins. Bayl Univ Med Cent. 2006;19 : 239-245.
3. Ronal L.N. Hemoglobin Disorders : Molecular Methods and Protocols. Methods in Molecular Medicine. Humana Press. 2005.
4. Donald L. R. Hemoglobinopathies and Thalassemia in : Harold R.S. William A.R. JR. Sanford A.S. Handbook of Hematologic Pathology. Marcel Dekker Inc. 2000: 369-394.
5. David J. W. Haemoglobin and the inherited disorders of globin synthesis. In A. Victor H. Daniel C. Postgraduate Haematology. Blackwell Publishing. 5th Ed. 2005: 85-102.
6. Andreas E. K. Hemoglobin variants and the rarer hemoglobin disorders in Robert J. A. Ian M. H. Owen P. S. Pediatric Hematology 3rd Ed. Blackwell Publishing. 2006: 231-280.
7. Hilman R.S. Ault K.A. Rinder H. M. Hematology in Clinical Practice. 4th Ed. McGraw Hill. 2005: 81-94.
8. R. Gibbons, D.R. Higgs, J.M. Nancy F.O, Swee Lay Thien, W.G. Wood. The Thalassemia Syndrome. 4thEd. Blackwell Publishing. 2002: 686-723.
9. George F.A, Joseph D, Yogen S. et al. Hemoglobinopathies. American society of Hematology. 2003 : 14-38.
10. Lewis SM, Bain BJ, Bates IDacie and Lewis Practical Haematology. 9th Ed. Churchill Livingstone. 2001
11. Ronald J.A.T. Diagnosis of the Haemoglobinopathies. Clin Biochem Rev. Vol. 27. February 2006.
12. Gwendolyn M, Clarke, Trefor N. H. Laboratory Investigation of Hemoglobinopathies and Thalassemia : Review and Update. Clinical Chemistry. 46 (8). 2000: 1284-1290.
13. College of Amarican Pathologist. Introduction : Methods used in the evaluation of hemoglobinopathies. http://www.cap.org.
14. Wirawan R. Diagnosis Laboratorium Hemoglobinopati dalam Pendidikan Berkesinambungan Patologi Kinik. Departemen Patologi Klinik FK UI. 2005: 173-189.
15. Harahap A. R. Analisis Hemoglobin dengan High Performance Liquid Chromatography: Peran Dalam Diagnosis Hemoglobinopati, Keunggulan dan Keterbatasannya dalam Pendidikan Berkesinambungan Patologi Klinik. Departemen Patologi Klinik FK UI. 2004: 82-8
16. Barbara J.W, Barbara J.B. Detection and quantification of normal and variant haemoglobins : an analytical review. Annals of Clinical Biochemistry. 2004;41: 355-369
17. Stephen O. B. Fifty-Eight Years of Hemoglobin Analysis. Clinical Chemistry. 2008;54(1): 8-10.
18. The Thalassemia Working Party of the BCSH General Haematology Task Force. Guideline : The Laboratory Diagnosis of Haemoglobinopathies. British Journal of Haematology. 1998;101: 783-792.
19. Nick J. Anne S. Methods for the Identification of the Haemoglobinopathies in David B. John C The Science of Laboratory Diagnosis. 2nd Ed. John Wiley & Sons. 2005: 273-9.
20. Westermeier R. Electrophoresis in Practice. 4thEd. Wiley-VCH. 2005.
21. Hempe J.M, Craver R.D. Clinical Applications of Capillary Electrophoresis. Humana Press. 2008: 81-98.
22. Koepke J.A, Thoma J.F, Schmidt R.M. Identification of Human Hemoglobins by Use of Isoelectric Focusing in Gel. Clinical Chemistry. 1975;21(13): 1953-5.
23. Colah R.B, Surve R, Sawant P. HPLC studies in Hemoglobinopathies. Indian Journal of Pediatrics. 2007;74 : 657-662.
24. Chiang N.O, Cheryl L.R. Rapid Analysis of Hemoglobin variants by Cation-Exchange HPLC. Clinical Chemistry. 1993;39(5) : 820-4
25. Alla J, Joan H.N, Michael A.N. HPLC Retention Time as a Diagnostic Tool for Hemoglobin Variants and Hemoglobinopathies : A Study of 60.000 Samples in a Clinical Diagnostic Laboratory. Clinical Chemistry. 2004;50(10): 1736-1747.