Penentuan Resistensi terhadap Antibiotik
Ketiga galur B. japonicum BJ11, BJ38, dan KDR15 menunjukkan kemampuannya tumbuh pada media YMA + CR 0.0025% yang mengandung antibiotik ampisilin, rifampisin atau tetrasiklin (Tabel 1). Namun demikian ketiga galur tersebut tidak mampu tumbuh pada media YMA + CR 0.0025% + kanamisin (50 µg/ml). E. coli S17-1 (λ pir) dengan konsentrasi antibiotik yang sama mampu tumbuh pada media LA yang mengandung ampisilin ataupun kanamisin, tetapi tidak mampu tumbuh pada media LA yang mengandung rifampisin ataupun tetrasiklin (Tabel 1). Hal ini disebabkan karena E. coli S17-1 (λ pir) membawa plasmid pUTmini-Tn5Km1 yang membawa gen resistensi terhadap kanamisin dan ampisilin (Gambar 1).
Tabel 1 Pertumbuhan galur B. japonicum dan E. coli pada media agar yang mengandung antibiotik
Ampisilin Kanamisin Rifampisin Tetrasiklin Sandi galur 50 100 25 50 25 50 25 50 BJ11 BJ38 KDR15 E.c S17-1 λpir + + + + + + + + - - - + - - - + + + + - + + + - + + + - + + + -
Keterangan : + = tumbuh; - = tidak tumbuh; konsentrasi antibiotik yang digunakan dalam µg/ml
Gambar 4 memperlihatkan penampilan pertumbuhan ketiga galur B. japonicum (BJ11, BJ38, dan KDR15) pada media YMA + CR 0.0025% + rifampisin 50 µg/ml setelah diinkubasi selama 7 hari pada suhu ruang. Ketiga galur tersebut memiliki tipe koloni Large Watery atau berair pada masa inkubasi 8 hari.
23
Gambar 4 Penampilan pertumbuhan B. japonicum toleran asam-Al galur BJ11, KDR15, dan BJ38 pada media YMA + CR 0.0025% + rifampisin 50 µg/ml setelah inkubasi selama 8 hari pada suhu ruang.
Berdasarkan kemampuan tumbuh galur-galur tersebut pada media agar yang mengandung antibiotik, pada penelitian ini dapat ditentukan media YMA + CR 0.0025% + kanamisin (50 µg/ml) + rifampisin (50 µg/ml) digunakan sebagai media seleksi hasil konjugasi. Karena galur-galur B. japonicum sensitif terhadap kanamisin tetapi resisten rifampisin, sedangkan E. coli resisten kanamisin tetapi sensitif terhadap rifampisin, maka hasil seleksi pada proses konjugasi adalah koloni B. japonicum yang tumbuh pada media seleksi tersebut.
Mutagenesis dengan Transposon dan Seleksi Mutan B. japonicum Sensitif Asam-Al
Transposon mini-Tn5Km1 yang dibawa plasmid pUT dalam E. coli S17-1 (λ pir) telah berhasil ditransfer ke B. japonicum toleran asam-Al melalui konjugasi. Konjugasi bakteri dilakukan pada tiga waktu inkubasi mating yaitu 12, 18, dan 24 jam. Frekuensi tertinggi dicapai oleh galur BJ11 pada waktu inkubasi mating 24 jam sebesar 7.1x10-6 sel/resipien, sedangkan frekuensi terendah dicapai oleh galur BJ38 sebesar 6.1x10-8 pada waktu inkubasi mating 12 jam (Tabel 2).
Frekuensi konjugasi dari galur BJ11 dan KDR15 cenderung meningkat sampai waktu inkubasi mating 24 jam. Untuk galur BJ38 frekuensi konjugasinya meningkat sampai waktu inkubasi mating 18 jam dan mengalami penurunan
setelah waktu inkubasi 24 jam. Berdasarkan hasil konjugasi pada ketiga galur B. japonicum tersebut dengan menggunakan donor E. coli S17-1 (λ pir) terlihat bahwa penambahan lama waktu inkubasi mating dapat dilakukan antara 18-24 jam untuk mendapatkan frekuensi konjugasi yang lebih tinggi dibandingkan waktu inkubasi 12 jam.
Tabel 2 Frekuensi konjugasi pUTmini-Tn5Km1 dari E. coli S17-1 (λ pir) ke B. japonicum pada tiga waktu inkubasi mating yang berbeda
Frekuensi konjugasi (sel/resipien) Konjugasi Bakterial
12 jam 18 jam 24 jam
BJ11 x E. coli S17-1 λpir BJ38 x E. coli S17-1 λpir KDR15 x E. coli S17-1 λpir 6.7x10-7 6.1x10-8 3.4x10-6 1.1x10-6 6.6x10-7 5.1x10-6 7.1x10-6 1.3x10-7 6.3x10-6
Koloni transkonjugan yang diperoleh dari hasil konjugasi diuji sensitivitasnya pada media Ayanaba (pH 4.5; Al 50 µM) untuk menentukan koloni B. japonicum transkonjugan yang sensitif asam-Al. Koloni transkonjugan yang sensitif tidak mampu tumbuh atau terhambat pertumbuhannya pada media asam-Al, sedangkan koloni transkonjugan yang tetap toleran mampu tumbuh pada media tersebut. Koloni yang sensitif diduga telah mengalami penyisipan transposon pada gen yang terlibat dalam toleransi asam-Al sehingga tidak mampu tumbuh pada media asam-Al dan transkonjugan sensitif ini selanjutnya diberi nama mutan sensitif asam-Al (acid-Al sensitive= AAS).
Hasil seleksi transkonjugan dari galur BJ11 dan BJ38 diperoleh masing-masing tiga mutan sensitif asam-Al yaitu dengan sandi galur AAS11.1, AAS11.2, dan AAS11.5 yang dihasilkan dari galur BJ11 serta AAS38.1, AAS38.2, dan AAS38.3 yang dihasilkan dari galur BJ38. Hasil seleksi transkonjugan yang dihasilkan dari galur KDR15 diperoleh satu mutan sensitif asam-Al dengan sandi galur AAS15.2. Selanjutnya satu mutan yang dihasilkan dari galur BJ11, yang didesain sebagai AAS11.2 digunakan sebagai model untuk analisis genetika molekuler toleransi asam-Al pada B. japonicum.
25 Uji Pembentukan Bintil Akar
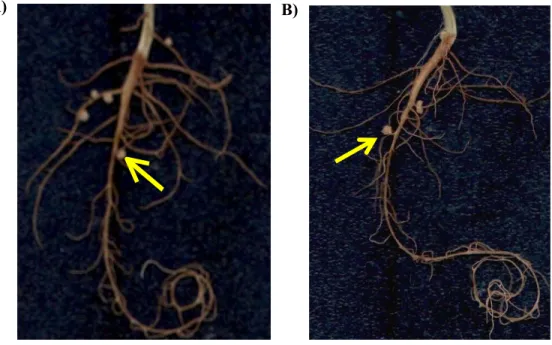
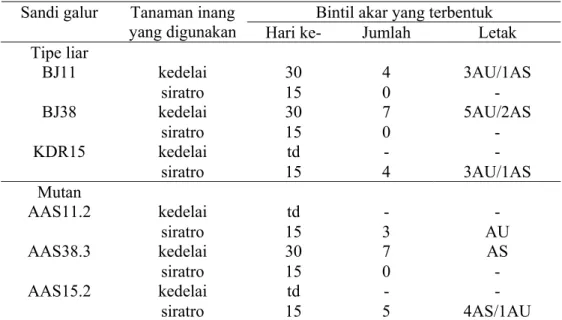
B. japonicum termasuk spesies bakteri tumbuh lambat yang dapat membentuk bintil akar baik pada tanaman dari genus Macroptilium maupun Glycine (Perret et al. 2000). Ketiga galur B. japonicum BJ11, KDR15, dan BJ38 beserta mutannya dapat membentuk bintil pada tanaman siratro (Macroptilium atropupureum) atau kedelai (Glycine max). Galur BJ11, BJ38, dan AAS38.3 tidak mampu membentuk bintil pada tanaman siratro, tetapi mampu membentuk bintil pada tanaman kedelai. Gambar 5 menampilkan bintil akar yang terbentuk pada tanaman siratro yang diinokulasi dengan galur liar (wild type= WT) KDR15 dan mutannya (AAS15.2). Waktu yang dibutuhkan untuk membentuk bintil pada tanaman siratro lebih cepat (15 hari) dibandingkan pada tanaman kedelai (30 hari). Jumlah dan letak bintil yang terbentuk cenderung beragam pada masing-masing galur yang diuji (Tabel 3).
Gambar 5 A) Bintil akar tanaman siratro yang terbentuk inokulasi dengan B. japonicum KDR15 (WT), dengan B) Bintil akar tanaman siratro yang terbentuk hasil inokulasi dengan mutan AAS15.2 (ditunjukkan dengan anak panah).
Tabel 3 Hasil uji pembentukan bintil akar pada tanaman siratro (Macroptilium atropupureum) dan kedelai (Glycine max)
Bintil akar yang terbentuk Sandi galur Tanaman inang
yang digunakan Hari ke- Jumlah Letak Tipe liar kedelai 30 4 3AU/1AS BJ11 siratro 15 0 - kedelai 30 7 5AU/2AS BJ38 siratro 15 0 - kedelai td - - KDR15 siratro 15 4 3AU/1AS Mutan kedelai td - - AAS11.2 siratro 15 3 AU kedelai 30 7 AS AAS38.3 siratro 15 0 - kedelai td - - AAS15.2 siratro 15 5 4AS/1AU
Keterangan: AU = akar utama; AS = akar sekunder; td = tidak dilakukan
Isolasi DNA Genom Pengapit Transposon dengan Inverse PCR dan Kloning Produk Inverse PCR
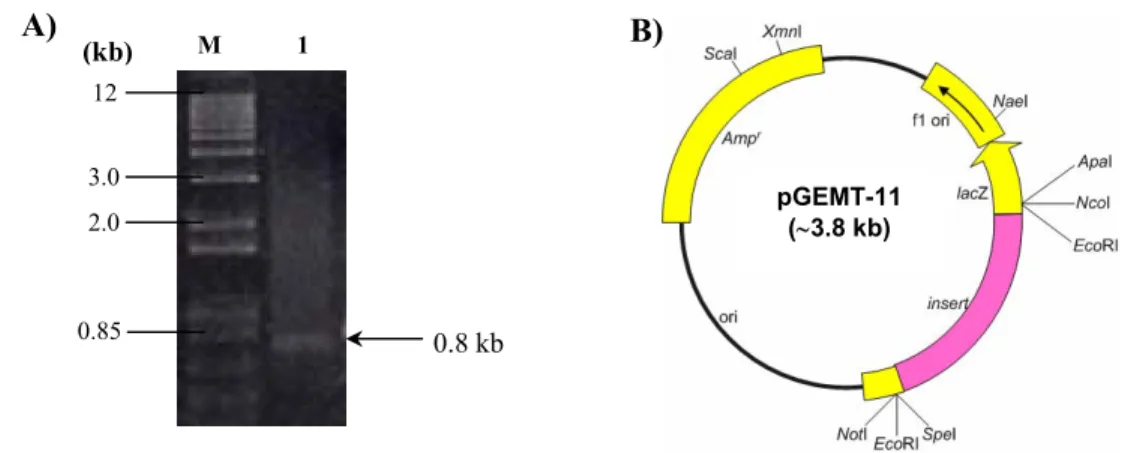
Amplifikasi DNA genom pengapit transposon yang berukuran 0.8 kb (Gambar 6A) dari galur mutan AAS11.2 telah berhasil diperoleh melalui inverse PCR. Ligasi fragmen DNA genom pengapit transposon yang berukuran 0.8 kb ke dalam pGEM-T Easy menghasilkan plasmid rekombinan pGEMT-11 (∼3.8 kb). Peta plasmid rekombinan pGEMT-11 ditampilkan pada Gambar 6B.
Plasmid rekombinan pGEMT-11 telah berhasil dikonstruksi dan diintro-duksikan ke dalam sel inang E. coli DH5 α. Hal ini ditunjukkan dengan hasil verifikasi plasmid rekombinan yang dipotong dengan EcoRI menghasilkan dua pita DNA yaitu pita berukuran ~3 kb (vektor pGEM-T) dan DNA sisipan (fragmen DNA genom hasil inverse PCR) yang berukuran 0.8 kb (Gambar 7A). Selain itu verifikasi dengan PCR pada plasmid rekombinan juga diperoleh pita DNA hasil amplifikasi yang berukuran sekitar 0.8 kb (Gambar 7B).
27
Gambar 6 A) Elektroforesis gel agarosa DNA genom pengapit transposon yang berhasil diamplifikasi dengan inverse PCR dari genom mutan B. japonicum sensitif asam-Al AAS11.2 (1) dan M= marker DNA 1 kb ladder plus. B) Peta plasmid rekombinan pGEMT-11 (∼3.8 kb).
Gambar 7 A) Hasil Elektroforesis gel agarosa plasmid rekombinan. M= Marker DNA 1 kb ladder plus, 1 dan 2= pGEM-T11 yang dipotong dengan EcoRI. B) Hasil verifikasi DNA sisipan (insert) dalam plasmid rekombinan dengan PCR pada gel agarosa 1%. M= Marker DNA 1 kb ladder plus, 1 dan 2= pita DNA insert yang diamplifikasi dengan PCR. Analisis Sekuen DNA Genom yang Terlibat dalam Toleransi Asam-Al
Fragmen DNA pengapit tranposon dari mutan AAS11.2 (0.8 kb) pada plasmid rekombinan pGEMT-11 telah disekuen dengan menggunakan primer universal M13-R dan M13-F. Hasil sekuensing DNA diperoleh 764 nukleotida. Analisis sekuen dengan menggunakan program BLASTX melalui situs European Bioinformatics Institute (EBI) menunjukkan similaritas dengan putative inner
B) 0.85 2.0 3.0 12 (kb) M 1 0.8 kb A) pGEMT-11 (∼3.8 kb) 0.8 kb 12 3.0 2.0 0.85 (kb) M 1 2 B) 1 A) kb 12 3.0 2.0 0.85 M 2 0.8 kb (insert) 3 kb (vektor = pGEM-T Easy)
membrane protein yang disandikan oleh gen yhfK (79% identity; 84% similarity, E-value= 1.0xe-100) dari Salmonella typhimurium (nomor akses Q8ZLK8). Pada Salmonella protein tersebut berfungsi sebagai efflux transporter. Hasil pensejajaran (alignment) dari sekuen tersebut terlihat pada Gambar 8.
Gambar 8 Hasil pensejajaran (alignment) homologi antara sekuen fragmen DNA genom yang terlibat dalam toleransi asam-Al pada B. japonicum dengan S. typhimurium.
PEMBAHASAN
Mutagenesis dengan transposon mini-Tn5Km1 melalui proses konjugasi pada tiga galur B. japonicum toleran asam-Al (BJ11, BJ38, dan KDR15) menghasilkan frekuensi konjugasi yang berkisar antara 10-8-10-6 sel/resipien artinya untuk memperoleh satu koloni transkonjugan dibutuhkan sel B. japonicum sebanyak 106-108 sel. Untuk mendapatkan koloni transkonjugan yang sensitif asam-Al dari hasil mutagenesis dengan transposon dibutuhkan frekuensi konjugasi yang tinggi, karena transposon mini-Tn5Km1 yang berukuran 1835 bp menyisip secara acak pada kromosom B. japonicum, sehingga kemungkinan untuk menyisip pada gen toleransi asam-Al sangat rendah. Frekuensi konjugasi tertinggi yang dicapai galur BJ11 (7.1x10-6 sel/resipien) lebih tinggi bila dibandingkan hasil konjugasi pada Magnetospirillum magneticum (2.7x10-7 sel/resipien) dengan menggunakan plasmid yang sama (Wahyudi et al. 2001), ataupun pada Bartonella henselae (10-9 sel/resipien) menggunakan pUT/Km (mini-Tn5 dengan Kmr) (Dehio & Meyer 1997). Frekuensi transkonjugasi dari BJ11 tersebut cukup untuk menghasilkan B. japonicum sensitif asam-Al seperti yang dilaporkan pada penelitian ini.
Plasmid pUT yang berperan sebagai pembawa transposon mini-Tn5Km1 diturunkan dari pGP704 dan memiliki origin of replication (ori) dari plasmid R6K yang hanya dapat bereplikasi pada bakteri penghasil protein π seperti di dalam λ pir lisogen dari E.coli K-12. Plasmid ini juga membawa oriT dari plasmid RP4 yang dapat menghasilkan proses transfer yang efisien ke sel resipien yang diperantarai fungsi mobilisasi RP4 di dalam donor. Selain itu pUT membawa tnp* yaitu mutan gen tnp dari IS50R yang menyandikan transposase yang dibutuhkan untuk perpindahan (transposisi) mini-Tn5 (Lorenzo et al. 1990). Setelah terjadi transfer pUTmini-Tn5Km1 dari E. coli S17-1 (λpir) ke sel B. japonicum melalui konjugasi, transposon mini-Tn5Km1 menyisip secara acak pada kromosom B. japonicum. Proses ini dapat menghasilkan insersi yang stabil, karena gen transposase berada di luar transposon mini-Tn5Km1 (Herrero et al. 1990). Sementara itu pUT tidak dapat bereplikasi di dalam sel B. japonicum karena untuk memulai replikasi membutuhkan fungsi protein pir (protein
initiation of replication) dari inangnya, sehingga setelah proses transfer plasmid ini tidak dapat dipertahankan pada sel inang B. japonicum atau dinamakan suicide vector.
Sebelumnya Wahyudi et al. (1998) melaporkan hasil konjugasi antara B. japonicum 11, 33, dan 43 dengan E. coli S17-1 λ pir (pUTmini-Tn5Km1) menggunakan perbandingan antara sel donor dan resipien (10:1) pada waktu inkubasi mating 12 jam diperoleh frekuensi konjugasi ∼10-9 sel/resipien. Penambahan waktu inkubasi 18-24 jam dan perbandingan yang sama antara sel donor dan resipien (1:1) pada ketiga galur B. japonicum yaitu BJ11, BJ38, dan KDR15 menghasilkan frekuensi konjugasi yang lebih tinggi dibandingkan waktu inkubasi 12 jam. Galur BJ11 dan BJ38 frekuensi konjugasinya meningkat 10 kali lipat setelah waktu inkubasi 18 dan 24 jam. Tetapi untuk galur KDR15 pening-katan frekuensi konjugasi pada tiga waktu inkubasi mating masih pada kisaran yang sama yaitu 10-6 sel/ resipien.
Pada kondisi yang optimal, beberapa plasmid hampir 100% dapat mentransfer dirinya sendiri ke sel lain setiap terjadi kontak antar sel. Sistem transfer dari plasmid RP4 memungkinkan efisiensi transfer yang tinggi dari sel donor ke sel resipien, karena plasmid ini bersifat promiscuous sehingga dapat mentransfer dirinya sendiri ke berbagai bakteri gram negatif (Snyder & Champness 1997). Namun frekuensi transposisi dari Tn5 sendiri secara in vivo dipengaruhi oleh inangnya (Goryshin & Reznikoff 1998). Perbedaan frekuensi konjugasi juga dapat dipengaruhi oleh perangkat sistem sel yang dimiliki bakteri (Wahyudi 2004). Jadi kemungkinan waktu inkubasi merupakan salah satu faktor yang dapat mempengaruhi efisiensi transfer plasmid dari sel donor ke sel resipien. Namun sistem sel inang sendiri juga menentukan efisiensi transposisi dari Tn5, sehingga terdapat perbedaan nilai frekuensi konjugasi diantara ketiga galur B. japonicum ataupun diantara spesies bakteri yang menggunakan plasmid yang sama.
Koloni B. japonicum tanskonjugan yang diperoleh dari hasil konjugasi secara konsisten dapat tumbuh pada media YMA + CR 0.0025% + rifampisin + kanamisin. Hal ini menunjukkan proses transfer transposon mini-Tn5Km1 telah berhasil dilakukan dengan adanya sel B. japonicum yang tidak hanya resisten
31 rifampisin tetapi juga resisten terhadap kanamisin. Mutan sensitif asam-Al diperoleh dari hasil seleksi koloni mutan B. japonicum pada media Ayanaba (pH 4.5; Al 50 µM) yang diduga telah mengalami insersi pada gen yang menyandikan toleransi asam-Al, sehingga tidak mampu tumbuh pada media Ayanaba pH 4.5 dan konsentrasi Al 50 µM. Menurut Ayanaba et al. (1983), setelah waktu inkubasi 10 hari galur toleran dapat tumbuh dengan baik dan pada media yang menggunakan indikator pH yaitu bromcresol purple (BCP) dan bromcresol green (BCG). Hal ini menunjukkan adanya perubahan pH dengan adanya perubahan warna media. Sedangkan galur yang sensitif tidak dapat tumbuh sampai waktu inkubasi 25 hari. Tujuh mutan sensitif asam-Al diperoleh dari hasil seleksi koloni transkonjugan galur BJ11, BJ38, dan KDR15 yang telah mengalami insersi transposon pada kromosomnya. O’Hara et al. (1989) melaporkan bahwa galur Rhizobium meliloti toleran pada media asam dikarenakan galur tersebut mempunyai kemampuan untuk mempertahankan pH intraseluler (pHi) antara 7.2 dan 7.4 ketika pH eksternalnya rendah (pH 5.6). Sedangkan pada empat galur mutan R. meliloti WSM419 yang genomnya disisipi dengan Tn5 tidak dapat tumbuh pada pH 5.6. Hal ini menunjukkan galur mutan kehilangan kemampuan untuk mempertahankan pHi-nya. Pada bakteri neutrofil, pemeliharaan pHi membutuhkan sistem transport elektron, ATPase untuk translokasi proton, dan antiporter proton/Kalium (Booth 1985).
Penyisipan transposon pada suatu gen dapat menimbulkan gen tersebut tidak terekspresi (inaktif) (Snyder & Champness 1997). Gen-gen yang berperan dalam nodulasi dan fiksasi N2 pada B. japonicum tidak terdapat pada plasmid seperti halnya Rhizobium, akan tetapi terdapat pada kromosom (Barbour et al. 1992). Jika transposon mini-Tn5Km1 menyisip pada gen nod yang berperan dalam pembentukan bintil pada B. japonicum, maka akan menimbulkan inaktivasi dari gen tersebut dan akibatnya B. japonicum tidak mampu membentuk bintil pada tanaman inangnya. Wahyudi et al. (1998) melaporkan dari 25 koloni transkonjugan B. japonicum yang mengalami insersi transposon mini-Tn5Km1 pada kromosomnya terdapat 1 koloni transkonjugan yang tidak mampu membentuk bintil. Pada penelitian ini mutan sensitif asam-Al dari ketiga galur B. japonicum BJ11, BJ38, dan KDR15 masih mampu membentuk bintil akar pada
tanaman inangnya, siratro maupun kedelai (Tabel 3). Kemungkinan transposon mini-Tn5Km1 hanya menyisip pada gen yang terlibat dalam toleransi asam-Al dan tidak terkait dengan gen untuk pembentukan bintil akar.
Fragmen DNA genom pengapit transposon dari mutan B. japonicum AAS11.2 telah berhasil diisolasi dengan teknik inverse PCR menghasilkan fragmen yang berukuran 0.8 kb (Gambar 6A). Teknik inverse PCR terdiri dari tiga tahap yaitu pemotongan dengan enzim restriksi yang tidak memotong pada bagian transposon, ligasi fragmen DNA membentuk lingkaran monomerik, dan produk ligasi digunakan sebagai substrat untuk amplifikasi dengan PCR menggunakan primer dekat ujung sekuen mini-Tn5Km1 yang diarahkan ke luar dari transposon. Produk inverse PCR adalah molekul DNA linier utas ganda dan titik temu antara daerah upstream dan downstream dapat diidentifikasi sebagai situs restriksi dari enzim yang digunakan untuk menghasilkan fragmen linier untuk self ligasi (Wahyudi et al. 2001). Wahyudi et al. (2001) melaporkan hasil amplifikasi DNA genom pengapit transposon mini-Tn5Km1 pada M. magneticum dengan teknik inverse PCR menghasilkan produk yang berukuran 1.3-4.7 kb yang diamplifikasi dari 14 mutan nonmagnetik.
DNA genom mutan B. japonicum AAS11.2 dipotong dengan EcoRV yang tidak memotong pada bagian transposonnya dan ligasi dari fragmen hasil pemotongan dengan EcoRV memungkinkan amplifikasi dari DNA genom pengapit transposon di bagian upstream dan downstream dari mini-Tn5Km1 dengan inverse PCR. Amplikon yang berukuran 0.8 kb hasil inverse PCR tersebut merupakan DNA genom yang diduga terlibat dalam toleransi B. japonicum terhadap cekaman asam-Al, karena insersi transposon pada bagian tersebut menimbulkan B. japonicum toleran asam-Al menjadi sensitif (tidak mampu tumbuh) pada media dengan cekaman asam-Al (pH 4.5; Al 50 µM). Menurut Glenn & Dilworth (1994), berdasarkan hasil mutagenesis dengan Tn5 pada R. meliloti kemungkinan terdapat lebih dari 20 gen yang terlibat dalam toleransi asam. Goss et al (1990), melaporkan insersi Tn5 pada lokus act (acid tolerance) dari R. meliloti WSM419 menimbulkan hambatan baik pada pertumbuhan maupun pemeliharaan pHi pada kondisi asam dan pada klon hasil insersi Tn5 tersebut menampilkan empat lokus yang unik, dua diantaranya berada dalam
33 fragmen 4.4 kb hasil pemotongan dengan EcoRI. Pada penelitian ini fragmen yang berukuran 0.8 kb yang diperoleh dari hasil insersi mini-Tn5Km1 kemungkinan hanya merupakan bagian dari salah satu gen yang terlibat dalam toleransi B. japonicum terhadap asam-Al.
Fragmen DNA hasil purifikasi produk inverse PCR selanjutnya diligasi dengan vektor pGEM-T Easy (∼3.0 kb) yang telah dirancang untuk TA-cloning dimana vektor telah dibuat linier hasil pemotongan dengan EcoRV dan ditambahkan timidin pada ujung 3’ di kedua sisinya. Hal ini dapat meningkatkan efisiensi ligasi produk PCR ke dalam plasmid karena resirkularisasi vektor dapat dicegah dan mempersiapkan produk PCR yang kompatibel dengan menambahkan deoksiadenosin pada ujung 3’ di kedua sisinya. Selain itu, vektor pGEM-T Easy memiliki situs restriksi yang dapat dipotong oleh banyak enzim pada bagian multiple cloning site (MCS)-nya yang memungkinkan pelepasan kembali DNA sisipan dengan menggunakan satu enzim restriksi seperti EcoRI, BstZI dan NotI.
Ligasi dari fragmen DNA pengapit transposon yang berukuran 0.8 kb pada bagian MCS plasmid pGEM-T Easy menghasilkan plasmid rekombinan yaitu pGEMT-11(∼3.8 kb). Peta plasmid rekombinan tersebut ditampilkan pada Gambar 6B. Bagian MCS dari plasmid pGEM-T Easy tepat berada pada coding region peptida α dari enzim β-galaktosidase, sehingga dapat dilakukan seleksi biru-putih dari koloni transforman setelah plasmid rekombinan diintroduksikan ke sel inang E. coli DH5 α pada cawan LA + ampisilin + X-gal. Koloni putih diambil untuk isolasi dan verifikasi plasmid rekombinan. Verifikasi dilakukan dengan mengambil kembali DNA sisipan menggunakan enzim EcoRI dan hasil pemotongannya ditampilkan pada Gambar 7A. Verifikasi dengan PCR menggu-nakan plasmid rekombinan sebagai template dan primer yang sama berhasil dilakukan. Amplikon yang diperoleh berukuran 0.8 kb (Gambar 7B). Hal ini menunjukkan kloning fragmen DNA pengapit transposon dari mutan AAS11.2 telah berhasil dilakukan.
Analisis sekuen fragmen DNA genom pengapit transposon (764 basa nukleotida) yang terlibat dalam toleransi asam-Al dilakukan dengan program BLASTX untuk mengetahui protein yang disandikan oleh sekuen tersebut (Claverie & Notredame 2003). Sekuen tersebut memiliki similaritas dengan
putative inner membrane protein (protein membran dalam) yang disandikan oleh gen yhfK dari Salmonella typhimurium yang berfungsi sebagai efflux transporter. Pompa efflux merupakan protein transport yang terlibat dalam ekstrusi substrat yang bersifat toksik dari dalam sel ke lingkungan. Protein-protein ini ditemukan pada bakteri gram positif maupun negatif bahkan pada organisme eukariotik. Pada kingdom prokariota terdapat lima famili efflux transporter yang utama yaitu MF (major facilitator), MATE (multidrug and toxic efflux), RND (resistance-nodulation-division), SMR (small multidrug resistance), dan ABC (ATP binding cassette). Seluruh sistem ini meggunakan proton motive force sebagai sumber energi kecuali famili ABC yang menggunakan hidrolisis ATP (Webber & Piddock 2003). Parra-Lopez et al. 1994 melaporkan tentang protein dari Salmonella typhimurium yang dibutuhkan dalam resistensinya terhadap senyawa antimikrob dan transport K+. Protein tersebut sangat identik (99%) dengan NAD+ binding protein TrkA dari E. coli yaitu suatu komponen yang memiliki afinitas yang rendah terhadap K+. Selain itu protein tersebut memiliki similaritas dengan protein KefC yang merupakan protein efflux yang diregulasi oleh glutathione yang berhubungan dengan transport K+.
Pada BBA yang toleran asam dibutuhkan kemampuan untuk memelihara pHi yang memungkinkan bagi pertumbuhan sel yaitu dengan memelihara keseimbangan proton influx dan efflux serta adanya sensor pHe yang dapat mengaktifkan sistem regulator intraseluler. Mekanisme yang mungkin terlibat dalam toleransi asam pada BBA diantaranya dengan menurunkan permeabilitas membran terhadap H+, pemompaan ion H+ keluar sel, mempertahankan pH sitoplasma, pembasaan media dengan ekskresi senyawa alkalin, aktivasi transkripsi dari protein yang terinduksi pada pH rendah, adanya sensor pH lingkungan, adanya regulator yang menjadi perantara antara sensor dan DNA, aktivasi transkripsi gen ATR (acid tolerance response), ekspresi gen act, dan peranan Ca2+ yang belum terdefinisi dalam toleransi asam (Glenn & Dilworth 1994). Berdasarkan hasil analisis sekuen yang menunjukkan adanya homologi gen toleransi asam-Al pada AAS11.2 dengan protein yang berfungsi sebagai efflux transporter kemungkinan pada B. japonicum toleran asam-Al, protein ini berperan untuk memelihara gradien proton dengan memompa ion H+ keluar sel
35 sehingga dapat mempertahankan pHi-nya. Menurut teori kemiosmotik Peter Mitchel dengan adanya transport atom hidrogen yang melibatkan NADH dehidrogenase menghasilkan gradien pH dan potensial elektrokimia melintasi membran dimana di dalam sitoplasma bermuatan negatif dan alkalin sementara di luar membran bermuatan positif dan bersifat asam (Madigan et al. 2003).
Riccillo et al. (2000) melaporkan hasil karakterisasi mutan Rhizobium tropici CIAT899-13T2 yang mengandung insersi tunggal Tn5-luxAB pada gen yang memiliki similaritas yang tinggi dengan gen gshB dari E.coli yang menyandikan glutathione synthetase. Tingkat kelimpahan kalium dan pH intraseluler pada mutan lebih rendah dibandingkan galur liarnya. Homeostasis pHi belum difahami dengan lengkap, tetapi telah diasumsikan tentang adanya keterlibatan ion Na+ dan K+. Sedangkan hasil analisis mutan R. leguminosarum bv. viciae dan Sinorhizobium meliloti menunjukkan bahwa sekuen yang berukuran 5.1 dan 3.2 kb hasil insersi Tn5 pada mutan WR1-14 dan RT3-27 menunjukkan bahwa gen tersebut menyandikan ATP-ase untuk transport kation yang sebelumnya telah diberi nama gen actP (acid tolerance P-type ATPase) (Reeve et al. 2002).