12 1 H = 12 𝑛(𝑛 + 1) 𝑅𝑖2 𝑛𝑖 − 3(𝑛 + 1) 2 FK = 𝑛 − 1 𝑛(𝑛 + 1) 𝑇 3 H = H FK Keterangan:
ni = banyaknya pengamatan tiap perlakuan atau jumlah panelis n = banyaknya data
Ri = jumlah rata-rata tiap perlakuan ke-i
T = banyaknya pengamatan yang seri dalam tiap ulangan H’ = H terkoreksi (ki-kuadrat)
FK = faktor koreksi
Apabila hasil uji chi-square menunjukkan di antara perlakuan tersebut memberikan pengaruh yang berbeda terhadap parameter yang diamati maka pengujian dilanjutkan dengan uji lanjut multiple comparison dengan menggunakan Uji Dunn.
3 HASIL DAN PEMBAHASAN
Karakteristik Ikan SegarNilai organoleptik ikan segar
Hasil penilaian secara organoleptik ikan segar dari tangkapan satu hari melaut nelayan TPI Cisolok Palabuhanratu menunjukkan bahwa ikan yang disimpan pada suhu kamar mengalami perubahan nilai rata-rata organoleptik yang meliputi mata, insang, lendir, daging, bau dan tekstur (Gambar-2).
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 2 Nilai organoleptik ikan tongkol pada penyimpanan suhu ruang. Penyimpanan jam ke-0; Penyimpanan jam ke-8; Penyimpanan jam ke-16; Penyimpanan jam ke-24; Penyimpanan jam ke-32. Hasil uji Kruskal-Wallis menunjukkan tidak ada pengaruh nyata (p>0,05) selama penyimpanan pada suhu ruang. Hal ini diduga adanya kandungan formalin yang terdapat pada ikan sehingga menyebabkan ikan lebih tahan selama
8,4a 8,2a 8,2a 8,3a 8,3a 8,5a 7,8a 7,6a 7,4a 7,6a 7,6a 7,9a 6,4a 6,7a 6,2a 6,3a 6,3a 6,5a 4,6a 5,1a 4,7a 5a 5,1a 4,9a 3,4a 4,3 a 2,9a 3,4 a 3,2a 3,6a 0 2 4 6 8 10
mata insang lendir daging bau tekstur
N ilai Or gan o le p tik Parameter Organoleptik
13 penyimpanan. Menurut Riyadi et al. (2007), produk hasil perikanan udang atau ikan yang menggunakan bahan pengawet formalin ditandai dengan warna putih bersih, kenyal, insangnya berwarna merah tua bukan merah segar, serta daya awet meningkat. Salosa (2013) menambahkan bahwa formalin digunakan untuk menghilangkan bakteri yang biasa hidup di sisik ikan. Ikan yang tanpa formalin akan mudah busuk jika tidak dilakukan penanganan dengan baik sehingga semakin lama waktu penyimpanan maka nilai penerimaan semakin menurun (Soekarto dan Hubeis 2000). Ariyani et al. (2007) menjelaskan bahwa perkembangan nilai penerimaan ikan selama penyimpanan berbeda tergantung pada jenis dan cara penanganannya. Ikan lemuru yang disimpan pada suhu kamar ditolak panelis setelah 10 jam (Nasran dan Arifudin 1982). Menurut Ariyani et al. (2007), secara organoleptik setelah 12 jam penyimpanan ikan mas belum ditolak panelis, penolakan oleh panelis terjadi setelah 24 jam tanpa menggunakan formalin.
Faktor-faktor yang dapat mempengaruhi kesegaran ikan adalah cara penangkapan, sortasi, pencucian dan pemberian es, ukuran, jumlah bakteri yang terdapat pada ikan, lingkungan air mempengaruhi penurunan mutu ikan, suhu dan sanitasi (Ilyas 1983; Koohdar et al. 2011).
Kadar histamin, TPC (Total Plate Count), TVB (total volatile base) pada ikan tongkol (Auxis rochei) selama penyimpanan pada suhu ruang
Hasil pengukuran dan pengamatan histamin, TPC dan TVB pada ikan tongkol (Auxis rochei) disajikan pada Tabel 1.
Tabel 1 Kadar histamin, TPC dan TVB pada ikan tongkol (Auxis rochei) selama penyimpanan pada suhu ruang
Parameter Uji Waktu Pengamatan (jam)
0 8 16 24 32 Histamin (mg/kg) TPC (log CFU/g) TVB (mgN/100g) 2,17a±0,17 3,83a±0,07 16,01a±0,004 11,1b±0,8 4,49ab±0,2 17,46b±0,6 17,9b±1,05 4,64ab±0,2 20,28c±0,05 79,2c±3,05 5,17b±0,15 29,15d±0,6 98,3d±3,64 5,43c±0,19 42,34e±0,5
Keterangan: Huruf superscript yang sama menunjukkan tidak berbeda nyata
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap peningkatan kadar histamin selama penyimpanan pada suhu ruang Tabel 1. Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan 0 jam berbeda nyata (p<0,05) dengan penyimpanan 8, 16, 24 dan 32 jam tetapi penyimpanan 8 jam tidak berbeda nyata (p>0,05) dengan penyimpanan 16 jam. Menurut (Chen et al. 2010), pada suhu kamar di daerah tropis (30oC) kerusakan ikan akan terjadi pada penyimpanan 12-24 jam tergantung pada jenis ikan dan metode penangkapan. Ikan di daerah dingin dan yang disimpan pada suhu 20oC akan mengalami kerusakan sebelum dua hari penyimpanan tetapi jika ikan disimpan pada suhu 5oC maka akan terjadi kerusakan sekitar 5-6 hari (Clucas dan Sutcliffe 1981). Hasil penelitian Pandit (2007) menunjukkan bahwa kadar histamin ikan tongkol yang disimpan pada suhu 30oC mengalami kenaikan dari 27,10 mg/100g menjadi 403,20 mg/100g selama 24 jam. Menurut Rinto (2007), pada suhu 38oC histamin terbentuk setelah ikan tuna disimpan selama 6 sampai 12 jam.
Hasil analisis histamin memperlihatkan bahwa kadar histamin pada ikan tongkol yang disimpan pada jam ke-0, 8 dan 16 tidak melebihi 50 ppm, namun
14
pada jam ke-24 dan 32 telah melebihi 50 ppm. FDA mengatur tentang kadar maksimum histamin ikan yang dapat dikonsumsi yakni tidak melebihi 50 ppm (FDA 2011). Peningkatan kadar histamin pada penyimpanan suhu ruang berkorelasi dengan peningkatan bakteri.
Total Plate Count (TPC) merupakan jumlah mikroorganisme hidup yang terdapat pada produk uji. Total Plate Count yang dapat diterima atau layak untuk konsumsi adalah tidak melebihi 5×105 CFU/g atau setara dengan log 5,67 CFU/g (BSN 2006a).
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap jumlah mikroba pada ikan tongkol. Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan 0 jam berbeda nyata (p<0,05) dengan penyimpanan 24 dan 32 jam, tetapi jam ke-0 tidak berbeda nyata (p>0,05) dengan 8 dan 16 jam. Penyimpanan jam ke-0 menunjukkan nilai terendah (log 3,83 CFU/g atau log 6,8×103 CFU/g) diduga mikroba baru melakukan adaptasi dengan lingkungannya, sedangkan pada jam ke-32 yakni log 5,43 CFU/g atau 2,7×105 Cfu/g menunjukkan bahwa produk ikan hampir busuk dan menurut SNI 01-2729-2000 batas maksimum nilai TPC untuk ikan segar adalah 5×105 Cfu/g. Yoswati (2012) menambahkan bahwa total bakteri ikan tongkol segar dengan perlakuan penyimpanan selama 32 jam menghasilkan total bakteri antara 1,5×103-2,2×105 Cfu/g. Selama penyimpanan, terjadi peningkatan log total mikroba dari 3,83 CFU/g (6,8×103 CFU/g) menjadi log 5,43 CFU/g (2,7×105 CFU/g). Peningkatan jumlah mikroba disebabkan oleh kesesuaian medium tempat tumbuhnya seperti kandungan nutrisi, pH dan suhu. Hasil analisis log total mikroba selama penyimpanan dicantumkan dalam Tabel 1
Total Volatile Base (TVB) merupakan jumlah dari amonia, dimetilamin (DMA), trimetilamin (TMA) dan komponen basa lainnya berbasis nitrogen yang bersifat volatil (Suwetja 2011). Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap kadar TVB pada ikan tongkol Tabel 1. Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan jam ke-0 berbeda nyata (p<0,05) dengan jam ke-8, 16, 24 dan 32 pada suhu ruang. Nilai rata-rata TVB pada ikan tongkol segar (Auxis rochei) yakni 42,34 mgN/100g pada jam ke-32, diduga karena semakin lama ikan disimpan pada suhu ruang maka semakin cepat proses pembusukan ikan. Hasil penelitian Shakila et al. (2003) menunjukkan pada lama penyimpanan 18 jam dengan suhu penyimpanan 32±2 oC, kadar TVB ikan mackerel dan ikan sardine telah mencapai lebih dari 30 mgN/100g, dan pada lama penyimpanan 24 jam dengan suhu penyimpanan 32±2 oC, kadar TVB ikan mackerel dan sardine telah mencapai lebih dari 50 mgN/100g. Hal ini diduga adanya kandungan formalin yang terdapat pada ikan sehingga pada hasil penelitian ini nilai TVB pada waktu penyimpanan jam ke-32 belum mencapai 50 mgN/100g. Hastuti (2010) menambahkan pemakaian formalin dapat mempercepat proses pengeringan dan membuat tampilan fisik tidak cepat busuk dan dapat menghambat pertumbuhan bakteri. Menurut Susanto et al. (2011), Standar mutu tidak melebihi tingkat batas penerimaan 30-35 mgN%. Mah et al. (2002) menambahkan bahwa batas maksimum untuk produk perikanan dan hasil laut yang bermutu baik adalah 30-40 mgN/100g. Hal tersebut berbeda menurut hasil penelitian Kerr et al. (2002); Pandit (2007), menjelaskan bahwa TVB merupakan indikator kualitas ikan tuna yang maksimum 200 mg/100g masih segar sedangkan 500 mg/100g merupakan batas layak dikonsumsi. Menurut Susanto et al. (2011), nilai TVBN dipengaruhi oleh jumlah non-protein nitrogen yang ada pada ikan,
15 yang semuanya tergantung pada tipe makanan, musim penangkapan dan ukuran ikan.
Hasil analisis ketiga parameter tersebut memperlihatkan adanya korelasi positif antara histamin, TPC dan TVB yang semakin lama penyimpanan akan menyebabkan kualitas ikan akan semakin menurun. Pembentukan TVB oleh mikroba erat kaitannya dengan enzim yang akan mengurai asam amino menjadi biogenik amin dan TMAO-ase yang mereduksi TMAO menjadi TMA. TMA terbentuk dari penguraian senyawa lipoprotein menjadi kolin lalu diuraikan menjadi TMAO oleh enzim dehidrogenase, kemudian mereduksi menjadi TMA (Rinto 2007). Histamin terbentuk akibat proses dekarboksilasi asam amino histidin yang terdapat di dalam tubuh ikan yaitu histidin bebas (Suliantari et al. 1994). Asam amino bebas yang kemudian menjadi senyawa-senyawa amin (mis: puresin, kadaveri, histamin, indol, skatol) asam disulfida, karbondioksida, asam-asam organik (Suwetja 2011). Menurut pandit (2007), hasil pemecahan protein bersifat volatil dan menimbulkan bau busuk misal amoniak, H2S, phenol, kresol, indol dan skatol.
Karakteristik Ikan Pindang
Kadar histamin dan TPC (Total Plate Count) ikan tongkol (Auxis rochei) selama pemindangan
Hasil pengukuran dan pengamatan histamin dan TPC pada ikan tongkol (Auxis rochei) selama pemindangan disajikan pada Tabel 2.
Tabel 2 Kadar histamin dan TPC pada waktu pemindangan ikan tongkol (Auxis rochei)
Parameter Uji Waktu Pemindangan (jam)
2 5 8 Histamin (mg/kg) TPC (log CFU/g) 0,45a±0,01 3,48b±0,07 0,28a±0,02 3,39b±0,13 0,26a±0,01 2,43a±0,51
Keterangan: Huruf superscript yang sama menunjukkan tidak berbeda nyata
Hasil analisis ragam menunjukkan tidak ada pengaruh nyata (p<0,05) terhadap kadar histamin pada ikan tongkol yang direbus selama 2 jam, 5 jam dan 8 jam sebagaimana tercantum pada Tabel 2, hal ini terjadi karena proses pemindangan menggunakan suhu tinggi dalam perebusan sehingga bakteri dan enzim dekarboksilase yang mengubah histidin menjadi histamin tersebut rusak. Susilo et al. (2014) menjelaskan bahwa pengolahan dengan pemanasan dapat mengakibatkan protein ikan mengalami denaturasi seluruhnya yang disertai dengan terjadinya pengeluaran air dari jaringan otot daging. Protein mengalami denaturasi, konfigurasi molekul-molekulnya berubah dan aktivitas enzim (yang juga merupakan protein) akan hilang bila dipanaskan. Sulthoniyah et al. (2013) menambahkan, asam amino yang menyusun protein dengan mudah mengalami kerusakan karena panas. Menurut Ariyani et al. (2004), meskipun dilakukan pengolahan, sekali histamin sudah terbentuk dalam suatu bahan maka histamin tersebut tidak akan hilang/rusak dengan perlakuan pembekuan, perebusan, pengasapan, penggaraman maupun pengalengan. Menurut (Suliantari et al. 1994; Djarismawati et al. 2002), pengukusan, pengeringan dan pengalengan adalah proses pemanasan yang sering diterapkan dalam proses pengawetan ikan untuk
16
menghambat bakteri dan enzim yang akan menyebabkan terjadinya perubahan warna, cita rasa atau nilai gizi selama penyimpanan.
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap total bakteri setelah pengolahan dicantumkan pada Tabel 2. Hasil uji lanjut Duncan menunjukkan bahwa perebusan selama 8 jam berbeda nyata (p<0,05) dengan perebusan selama 2 dan 5 jam. Nilai rata-rata menunjukkan adanya perubahan jumlah bakteri setelah pengolahan yakni log 3,83 CFU/g atau 6,8×103 CFU/g menjadi log 2,43 CFU/g atau 2,7×102 CFU/g sebelum penyimpanan diduga karena penggunaan suhu tinggi pada saat perebusan dapat menginaktifkan pertumbuhan mikroorganisme hingga dapat membunuh bakteri pembentuk histamin tetapi dalam penelitian ini, setelah melakukan pengolahan masih terdapat bakteri pada pindang ikan tongkol. Menurut Indriati et al. (2006), hal ini diduga terjadinya kontaminasi dari pengolah, karena bakteri ini merupakan bakteri yang terdapat pada bagian anggota tubuh manusia seperti tangan, kuku, hidung dan mulut. Djarismawati et al. (2002) menambahkan bahwa adanya kontaminasi pada proses transportasi dari tempat pengolahan sampai laboratorium pengujian. Bakteri yang toleran terhadap panas memiliki enzim, protein dan DNA
bakteri yang stabil dan bekerja optimum pada suhu ekstrim. Senyawa kimia sel
bakteri mampu mencegah denaturasi protein pada suhu panas (Fardiaz 1989).
Proses pengolahan dengan cara perebusan telah dilakukan, kemudian dilanjutkan dengan proses penyimpanan menggunakan perebusan jam ke-8 dengan presentase jumlah bakteri terendah. Menurut Ewald et al. (1999), pemanasan pada suhu 60oC selama 2 jam akan menurunkan aktivitas bakteri sebanyak 43%.
Nilai organoleptik penyimpanan ikan pindang
Hasil penilaian secara organoleptik ikan yang disimpan pada waktu yang berbeda (0, 8, 16, 24 dan 32 jam) dicantumkan pada Gambar 3.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 3 Nilai organoleptik ikan pindang pada penyimpanan suhu ruang. Penyimpanan jam ke-0; Penyimpanan jam ke-8; Penyimpanan jam ke-16; Penyimpanan jam ke-24; Penyimpanan jam ke-32. Hasil uji Kruskal-Wallis menunjukkan tidak ada pengaruh nyata (p>0,05) selama penyimpanan pada suhu ruang, hal ini diduga kandungan formalin yang terdapat pada ikan tidak hilang selama pengolahan sehingga menyebabkan ikan lebih tahan selama penyimpanan. Menurut Hastuti (2010), formalin dapat
6,6a 7,7a 8,4a 7,3a 8 a 6a 7a 7,2 a 6,7a 6,8a 5,2a 5,5a 5,9 a 5,7a 5,4a 4,4a 4,7a 5,1 a 4,9a 4,4a 3,1a 3,2a 3,6a 3,4a 2,5a -1 1 3 5 7 9
Penampakan Warna Aroma Tekstur Rasa
N ilai O rg an o le p ti k Parameter Organoleptik
17 membuat tampilan fisik tidak cepat busuk selama penyimpanan serta dapat menghambat pertumbuhan bakteri. Ariyani et al. (2000) menjelaskan bahwa ikan kukus pada penyimpanan 12 jam nilai penerimaan konsumen masih di atas nilai 5 tetapi menurun setelah penyimpanan 24 jam hingga nilai penerimaan dibawah 5. Suliantari et al. (1994) menjelaskan bahwa olahan ikan yang disimpan selama 24 jam telah memungkinkan tumbuh jamur dan bakteri. Menurut Ariyani et al. (2004), Penurunan nilai pada semua parameter sensoris meliputi penampakan, bau, tekstur, lendir terlihat sangat jelas dan nyata (p<0,05) akan terjadi setelah 4 hari penyimpanan.
Kadar histamin, TPC (Total Plate Count), TVB (total volatile base) pada ikan pindang tongkol (Auxis rochei) selama penyimpanan pada suhu ruang
Hasil pengukuran dan pengamatan histamin, TPC dan TVB pada ikan pindang tongkol (Auxis rochei) disajikan pada Tabel 3.
Tabel 3 Kadar histamin, TPC dan TVB pada pindang ikan tongkol (Auxis rochei) selama penyimpanan pada suhu ruang
Parameter Uji Waktu Pengamatan (jam)
0 8 16 24 32 Histamin (mg/kg) TPC (log CFU/g) TVB (mgN/100g) 0,26a±0,01 2,43a±0,51 31,97a±0,01 0,8a±0,06 3,32ab±0,12 32,61a±1,05 2,91b±0,3 4,53b±0,22 34,17b±0,04 3,64b±0,5 4,74b±0,05 38,19c±0,6 6,6c±0,6 5,25c±0,2 38,40c±0,09
Keterangan: Huruf superscript yang sama menunjukkan tidak berbeda nyata
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap peningkatan kadar histamin ikan pindang selama penyimpanan pada suhu ruang Tabel 3. Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan 0 dan 8 jam berbeda nyata (p<0,05) dengan penyimpanan 16, 24 dan 32 jam tetapi penyimpanan 0 hingga 8 jam dan penyimpanan 16 hingga 24 jam tidak berbeda nyata (p>0,05). Pembentukan histamin terjadi dengan sangat cepat pada penyimpanan suhu 30ºC, yakni naik hingga 6,6 mg/kg setelah penyimpanan selama 32 jam, meskipun demikian nilai tersebut masih dalam batas aman berdasarkan batas maksimum nilai yang disarankan oleh FDA (2011) bahwa batas maksimum kadar histamin dapat mengganggu kesehatan yaitu >50 ppm. Ariyani et al. (2004) menjelaskan bahwa penyimpanan pindang pada suhu kamar dapat menaikkan kadar histamin hingga 32,71 mg/100g selama 24 jam.
Selama penyimpanan terjadi kenaikan kadar histamin pindang tongkol yang kadarnya semakin tinggi dengan bertambahnya waktu penyimpanan diduga oleh aktivitas yang intensif dari bakteri-bakteri pembentuk histamin. Menurut Kerr et al. (2002), terdapat hubungan atau korelasi positif antara jumlah bakteri dan kadar histamin yang dihasilkan.
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap peningkatan total bakteri pada ikan pindang selama penyimpanan suhu ruang Tabel 3. Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan 0 hingga 8 jam tidak berbeda nyata (p>0,05) dan penyimpanan 8 jam hingga 24 jam tidak berbeda nyata, tetapi penyimpanan 16, 24 dan 32 jam berbeda nyata (p<0,05) dengan penyimpanan 0 jam dan penyimpanan 16 hingga 24 jam berbeda nyata dengan penyimpanan 32 jam. Setelah pengolahan, penyimpanan bakteri pada suhu ruang akan terjadi kenaikan jumlah bakteri. Menurut Ariyani et al.
18
(2004), terkontaminasinya kembali produk oleh bakteri pembentuk histamin merupakan hal yang dapat terjadi dan mengingat bahwa bakteri pembentuk histamin pada umumnya tumbuh dengan cepat pada suhu 32,2 oC. Menurut Suliantari et al. (1994), umumnya pindang merupakan produk yang sangat cepat membusuk terutama menghadapi masalah bakteri dan jamur yang pertumbuhannya sangat cepat. Pertumbuhan bakteri pembentuk histamin pada ikan berlangsung lebih cepat pada temperatur yang tinggi (21,1 ºC) daripada temperatur rendah (7,2 ºC) FDA (2011). Hidayati et al. (2002) menambahkan adanya mikroba pada makanan dapat berasal dari berbagai sumber, misalnya bahan baku, alat yang digunakan selama proses pengolahan, tempat penyimpanan makanan, orang yang terlibat dalam pengolahan serta lingkungan sekitarnya berupa tanah, air dan udara.
Hasil analisis kadar TVB setelah pengolahan berbanding terbalik dengan hasil analisis histamin dan TPC yakni nilai TVB meningkat setelah proses pengolahan yaitu 16,01 mgN/100g menjadi 31,97 sebelum penyimpanan, hal ini diduga karena proses pengolahan yang menggunakan panas sehingga senyawa-senyawa nitrogen menguap saat proses pemindangan.
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap peningkatan kadar TVB pada ikan pindang selama penyimpanan suhu ruang (Tabel 3). Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan pada jam ke-0 dan jam ke-8 berbeda nyata (p<0,05) dengan penyimpanan jam ke-16, 24 dan 32 tetapi penyimpanan sampai jam ke-8 tidak berbeda nyata (p>0,05). Menurut Syah (2004), semakin lama proses penyimpanan maka kadar TVB akan meningkat disebabkan oleh degradasi protein dan mikroba pembusuk yang menghasilkan basa-basa nitrogen yang mudah menguap. Menurut Ariyani dan Yennie (2008), pada umumnya nilai batas penerimaan TVB untuk ikan segar adalah 30 mgN/100g sedangkan untuk ikan olahan dengan proses penggaraman nilai batas penerimaan TVB adalah 200 mgN/100g, meskipun demikian nilai ini juga tergantung pada jenis/spesies ikan dan cara pengolahan.
Seleksi dan Identifikasi Bakteri Pembentuk Histamin
Hasil seleksi dan identifikasi awal menunjukkan bahwa bakteri mempunyai kemampuan membentuk histamin. Hal tersebut dapat diketahui dari perubahan warna medium Niven dari warna kuning menjadi merah jambu atau pink sebagaimana tercantum pada Gambar 4. Perubahan warna diakibatkan oleh bakteri pembentuk histamin pada medium Niven termodifikasi sehingga dapat dijadikan acuan sebagai identifikasi awal. Menurut Mangunwardoyo et al. (2007), histamin yang terbentuk pada medium Niven termodifikasi dapat meningkatkan pH medium, sehingga terjadi perubahan warna dari kuning menjadi merah jambu/pink dengan adanya indikator fenol merah.
19 Gambar 4. Perubahan warna medium dari kuning menjadi merah jambu pada medium Niven termodifikasi oleh koloni bakteri pembentuk histamin A (tanpa
bakteri) B (bakteri telah tumbuh)
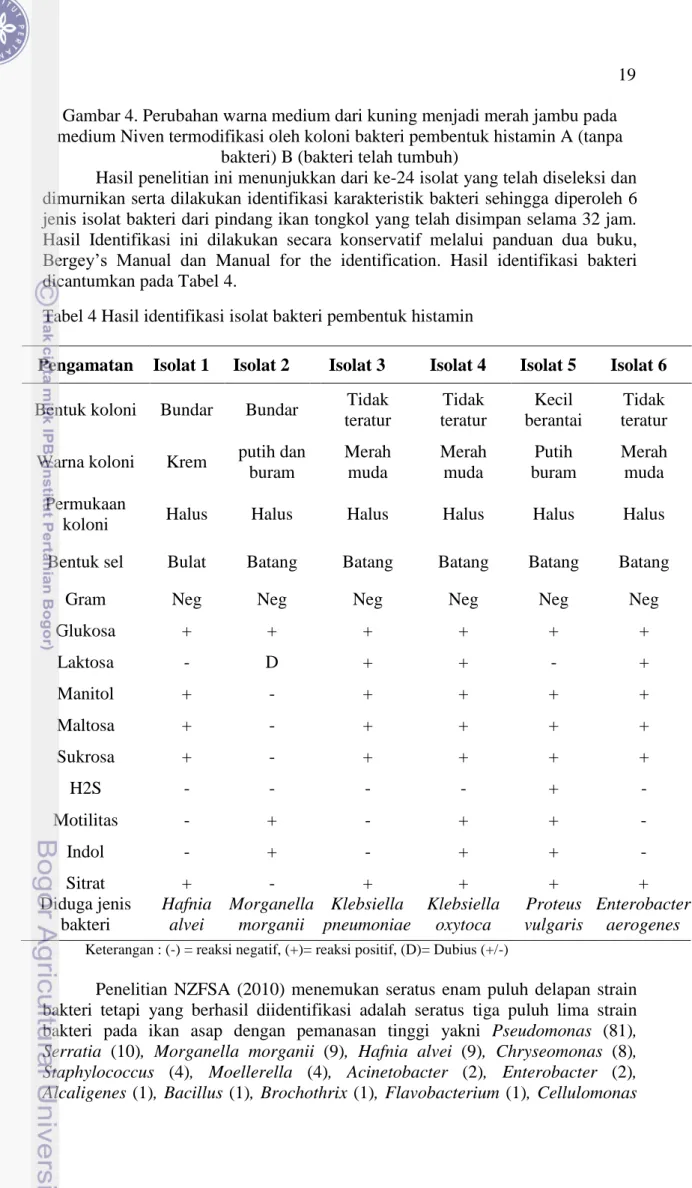
Hasil penelitian ini menunjukkan dari ke-24 isolat yang telah diseleksi dan dimurnikan serta dilakukan identifikasi karakteristik bakteri sehingga diperoleh 6 jenis isolat bakteri dari pindang ikan tongkol yang telah disimpan selama 32 jam. Hasil Identifikasi ini dilakukan secara konservatif melalui panduan dua buku, Bergey’s Manual dan Manual for the identification. Hasil identifikasi bakteri dicantumkan pada Tabel 4.
Tabel 4 Hasil identifikasi isolat bakteri pembentuk histamin
Keterangan : (-) = reaksi negatif, (+)= reaksi positif, (D)= Dubius (+/-)
Penelitian NZFSA (2010) menemukan seratus enam puluh delapan strain bakteri tetapi yang berhasil diidentifikasi adalah seratus tiga puluh lima strain bakteri pada ikan asap dengan pemanasan tinggi yakni Pseudomonas (81), Serratia (10), Morganella morganii (9), Hafnia alvei (9), Chryseomonas (8), Staphylococcus (4), Moellerella (4), Acinetobacter (2), Enterobacter (2), Alcaligenes (1), Bacillus (1), Brochothrix (1), Flavobacterium (1), Cellulomonas Pengamatan Isolat 1 Isolat 2 Isolat 3 Isolat 4 Isolat 5 Isolat 6 Bentuk koloni Bundar Bundar Tidak
teratur Tidak teratur Kecil berantai Tidak teratur Warna koloni Krem putih dan
buram Merah muda Merah muda Putih buram Merah muda Permukaan
koloni Halus Halus Halus Halus Halus Halus
Bentuk sel Bulat Batang Batang Batang Batang Batang
Gram Neg Neg Neg Neg Neg Neg
Glukosa + + + + + + Laktosa - D + + - + Manitol + - + + + + Maltosa + - + + + + Sukrosa + - + + + + H2S - - - - + - Motilitas - + - + + - Indol - + - + + - Sitrat Diduga jenis bakteri + Hafnia alvei - Morganella morganii + Klebsiella pneumoniae + Klebsiella oxytoca + Proteus vulgaris + Enterobacter aerogenes
20
(1) dan Moraxella (1). Lee et al. (2013) menambahkan saus ikan teri yang difermentasi selama 6 bulan memiliki kadar histamin, hal ini disebabkan oleh bakteri Proteus morganii, Hafnia alvei, dan Klebsiella pneumoniae yang memproduksi histidin dekarboksilasi. Ariyani dan Faisal (2006) menjelaskan bahwa Klebsiella sp. terdapat pada makanan ataupun minuman namun tidak menimbulkan masalah kesehatan apabila antibodi tubuh seseorang tetap terjaga. Menurut Hidayati et al. (2006), K.pmeuoniae memiliki kapsul yang dapat meningkatkan pertahanannya terhadap senyawa berbahaya dalam lingkungan dan bakteri patogen yang berhasil diisolasi dari makanan yang telah diolah adalah E. coli, P. vulgaris, K. pneumoniae, K. oxytoca, P. aeruginosa, E. agglomerans, S. aureus, dan S. epidermidis.
Aktivitas bakteri pembentukan histamin
Uji aktivitas perubahan warna pada bakteri dilakukan dengan mengukur diameter area pink/ungu yang terbentuk pada medium Niven’s Agar. Pengujian ini dilakukan untuk melihat bakteri yang mampu merubah warna medium dengan cepat. Perubahan warna ini disebabkan oleh histidin yang terdapat di dalam medium oleh aktivitas bakteri diubah menjadi histamin. Menurut Wei et al. (1988), adanya histamin dalam medium dapat meningkatkan pH medium sekitar 1,5 unit sehingga indikator fenol red yang mula-mula berwarna kuning akan menjadi pink/merah. Pengukuran bakteri pembentuk histamin dicantumkan dalam Gambar 5.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05) untuk aktivitas bakteri pembentuk histamin
Gambar 5 Aktivitas bakteri pembentuk histamin . Penyimpanan jam ke-8; Penyimpanan jam ke-16; Penyimpanan jam ke-24;
Penyimpanan jam ke-32.
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap aktivitas perubahan warna pada bakteri pembentuk histamin selama penyimpanan 32 jam. Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan selama 16 jam berbeda nyata (p<0,05) dengan penyimpanan 32 jam pada isolat 1, 3, 5 dan 6 sedangkan pada isolat 2 penyimpanan selama 16 jam berbeda nyata dengan penyimpanan 24 dan 32 jam kemudian isolat 4 penyimpanan selama 24 jam berbeda nyata dengan 32 jam penyimpanan. Menurut Mangunwardoyo et al. (2007), perubahan warna medium merupakan salah satu identifikasi awal yang menunjukkan karakteristik bakteri pembentuk histamin. Semakin lama waktu penyimpanan maka pembentukan histamin akan semakin meningkat berkorelasi
a a a a a a a a a a a a ab b ab a ab ab b b b b b b 0 0,5 1 1,5 2
Isolat 1 Isolat 2 Isolat 3 Isolat 4 Isolat 5 Isolat 6
Diam eter B ak ter i ( m m ) Jenis Bakteri
21 dengan peningkatan bakteri. Isolat yang diduga merupakan bakteri penghasil histamin lemah adalah Hafnia alvei. Menurut Kim et al. (2005), Proteus spp dan Morganella morganii merupakan bakteri yang memberikan kontribusi terbanyak dalam pembentukan histamin pada suhu kamar. Kung et al. (2009) menjelaskan bahwa Hafnia alvei diidentifikasi sebagai pembentuk histamin yang lemah.
Pengaruh suhu dan pH pada pertumbuhan bakteri pembentuk histamin Setiap mikroorganisme mempunyai respons yang berbeda terhadap faktor lingkungan (suhu, pH, salinitas) tinggi rendahnya suhu mempengaruhi pertumbuhan mikroorganisme. Bakteri dapat tumbuh dalam rentang suhu minus 5oC sampai 80oC, tetapi bagaimanapun juga setiap species mempunyai rentang suhu yang pendek yang ditentukan oleh sensitifitas sistem enzimnya terhadap panas (USDA 2012).
Hasil pengukuran pertumbuhan bakteri pada pH medium (5, 6, 7, 8, 9) dan suhu inkubasi (10, 30, 37 dan 50oC) dapat dilihat pada Gambar 6, 7, 8, 9, 10 dan 11.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 6 Pengaruh suhu dan pH pada pertumbuhan Isolat bakteri 5. Suhu 10 oC; Suhu 30 oC; Suhu 37 oC; Suhu 50 oC.
Hasil analisis ragam isolat bakteri 5 menunjukkan adanya pengaruh nyata (p<0,05) terhadap perubahan suhu dan pH pada bakteri pembentuk histamin. Hasil uji lanjut Duncan menunjukkan bahwa pH 8 pada suhu 30 dan 37oC berbeda nyata dengan pH 9 tetapi tidak berbeda nyata (p>0,05) pada suhu 10 dan 50oC.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 7 Pengaruh suhu dan pH pada pertumbuhan Isolat bakteri 1. Suhu 10 oC; Suhu 30 oC; Suhu 37 oC; Suhu 50 oC.
a a a a a ab ab ab b a ab ab ab b a ab a ab ab bc 0 0,1 0,2 0,3 0,4 0,5 0,6 5 6 7 8 9 N ilai OD pH bc bc ab ab a b ab ab ab a b b ab ab a a a a a a 0 0,2 0,4 0,6 0,8 5 6 7 8 9 N ilai OD pH
22
Hasil analisis ragam isolat bakteri 1 menunjukkan adanya pengaruh nyata (p<0,05) terhadap perubahan suhu dan pH pada bakteri pembentuk histamin. Hasil uji lanjut Duncan menunjukkan bahwa pH 5 pada suhu 10, 30 dan 37oC berbeda nyata dengan pH 9 tetapi tidak berbeda nyata (p>0,05) pada suhu 50oC.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 8 Pengaruh suhu dan pH pada pertumbuhan Isolat bakteri 6. Suhu 10 oC; Suhu 30 oC; Suhu 37 oC; Suhu 50 oC.
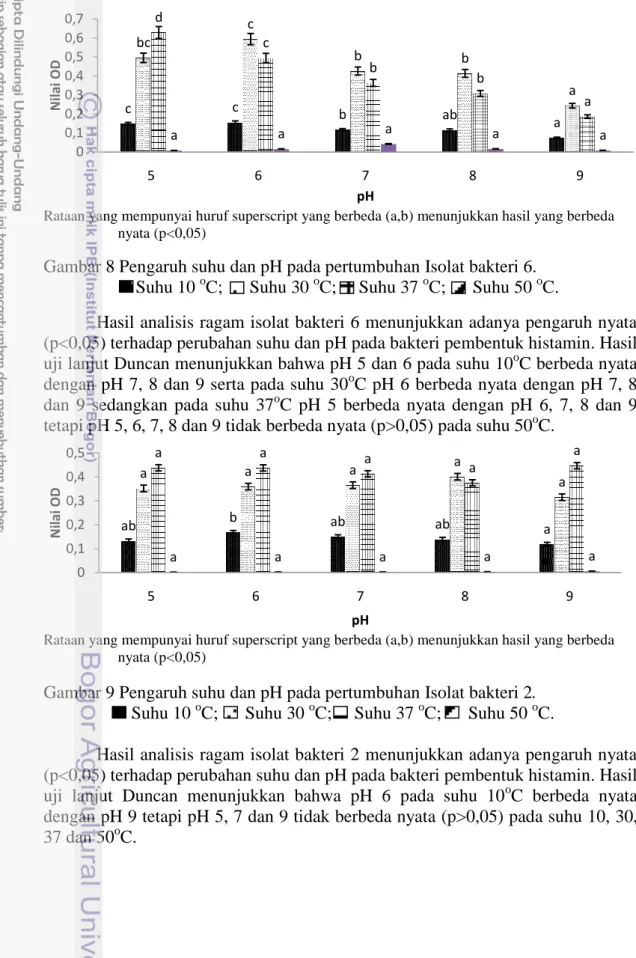
Hasil analisis ragam isolat bakteri 6 menunjukkan adanya pengaruh nyata (p<0,05) terhadap perubahan suhu dan pH pada bakteri pembentuk histamin. Hasil uji lanjut Duncan menunjukkan bahwa pH 5 dan 6 pada suhu 10oC berbeda nyata dengan pH 7, 8 dan 9 serta pada suhu 30oC pH 6 berbeda nyata dengan pH 7, 8 dan 9 sedangkan pada suhu 37oC pH 5 berbeda nyata dengan pH 6, 7, 8 dan 9 tetapi pH 5, 6, 7, 8 dan 9 tidak berbeda nyata (p>0,05) pada suhu 50oC.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 9 Pengaruh suhu dan pH pada pertumbuhan Isolat bakteri 2. Suhu 10 oC; Suhu 30 oC; Suhu 37 oC; Suhu 50 oC.
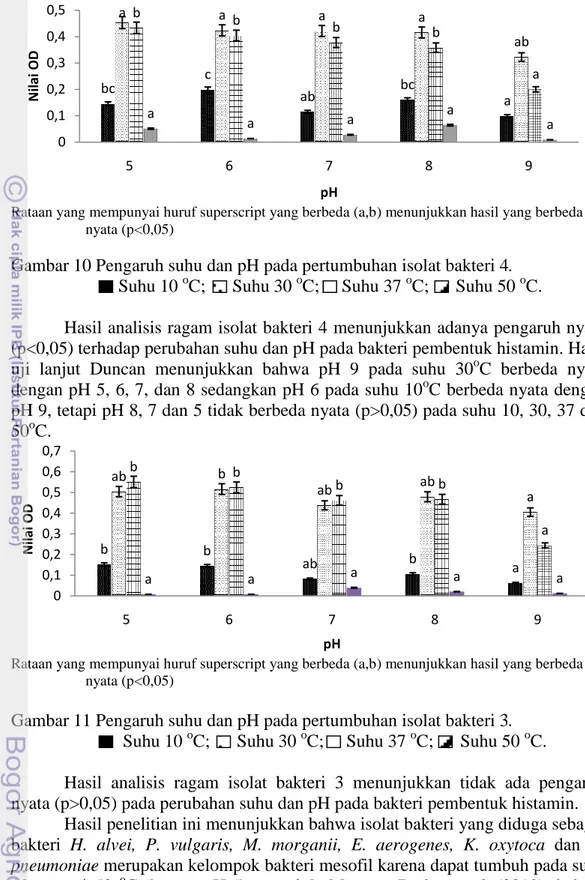
Hasil analisis ragam isolat bakteri 2 menunjukkan adanya pengaruh nyata (p<0,05) terhadap perubahan suhu dan pH pada bakteri pembentuk histamin. Hasil uji lanjut Duncan menunjukkan bahwa pH 6 pada suhu 10oC berbeda nyata dengan pH 9 tetapi pH 5, 7 dan 9 tidak berbeda nyata (p>0,05) pada suhu 10, 30, 37 dan 50oC. c c b ab a bc c b b a d c b b a a a a a a 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 5 6 7 8 9 N ilai OD pH ab b ab ab a a a a a a a a a a a a a a a a 0 0,1 0,2 0,3 0,4 0,5 5 6 7 8 9 N ilai OD pH
23
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 10 Pengaruh suhu dan pH pada pertumbuhan isolat bakteri 4. Suhu 10 oC; Suhu 30 oC; Suhu 37 oC; Suhu 50 oC.
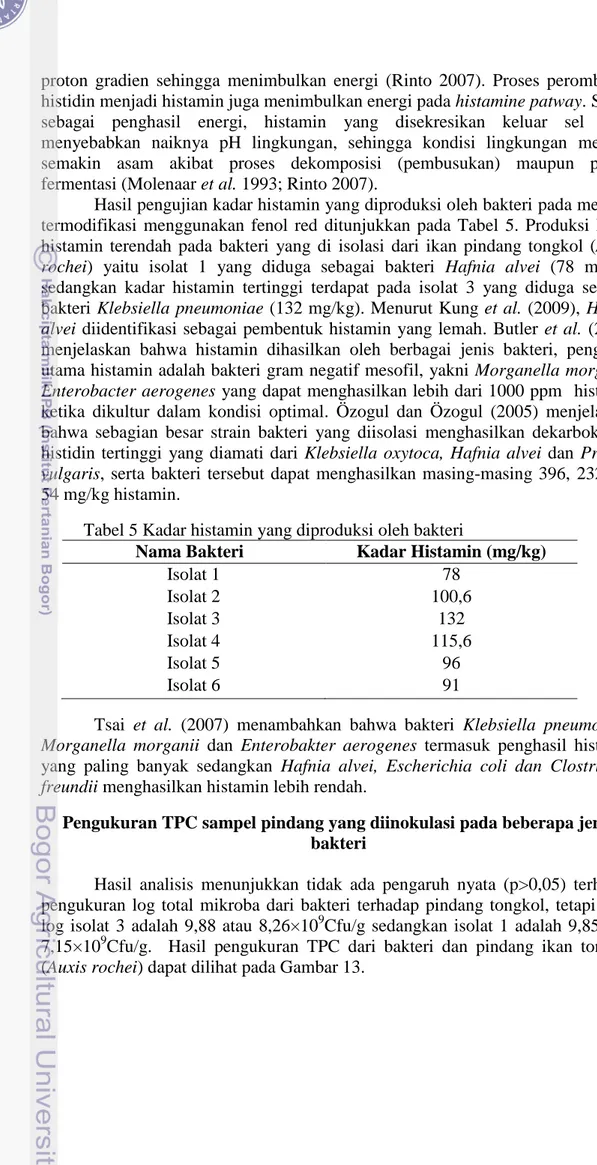
Hasil analisis ragam isolat bakteri 4 menunjukkan adanya pengaruh nyata (p<0,05) terhadap perubahan suhu dan pH pada bakteri pembentuk histamin. Hasil uji lanjut Duncan menunjukkan bahwa pH 9 pada suhu 30oC berbeda nyata dengan pH 5, 6, 7, dan 8 sedangkan pH 6 pada suhu 10oC berbeda nyata dengan pH 9, tetapi pH 8, 7 dan 5 tidak berbeda nyata (p>0,05) pada suhu 10, 30, 37 dan 50oC.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 11 Pengaruh suhu dan pH pada pertumbuhan isolat bakteri 3. Suhu 10 oC; Suhu 30 oC; Suhu 37 oC; Suhu 50 oC.
Hasil analisis ragam isolat bakteri 3 menunjukkan tidak ada pengaruh nyata (p>0,05) pada perubahan suhu dan pH pada bakteri pembentuk histamin.
Hasil penelitian ini menunjukkan bahwa isolat bakteri yang diduga sebagai bakteri H. alvei, P. vulgaris, M. morganii, E. aerogenes, K. oxytoca dan K. pneumoniae merupakan kelompok bakteri mesofil karena dapat tumbuh pada suhu 10 sampai 50 oC dengan pH 5 sampai 9. Menurut Butler et al. (2010), bakteri pembentuk histamin (BPH) umumnya merupakan golongan bakteri Gram negatif jenis enterik mesofilik. Bakteri mesofilik memiliki rentang suhu hidup 20-45 ºC. Menurut Ariyani et al. (2004), meskipun jumlah bakteri pada suhu kamar lebih banyak, tetapi bakteri histamin yang aktif pada suhu dingin tetap dapat tumbuh dengan kecepatan yang lebih rendah.
bc c ab bc a a a a a ab b b b b a a a a a a 0 0,1 0,2 0,3 0,4 0,5 5 6 7 8 9 N ilai OD pH b b ab b a ab b ab ab a b b b b a a a a a a 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 5 6 7 8 9 N ilai OD pH
24
Pengaruh konsentrasi NaCl pada pertumbuhan bakteri histamin Hasil pengukuran pengaruh konsentrasi NaCl terhadap pertumbuhan bakteri pembentuk histamin dapat dilihat pada Gambar 12. Hasil ini diperoleh setelah bakteri diinkubasi pada medium dengan berbagai konsentrasi garam (15, 20 dan 25%) inkubasi selama 48 jam.
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap konsentrasi NaCl pada bakteri. Hasil uji lanjut Duncan menunjukkan bahwa konsentrasi NaCl 15% berbeda nyata (p<0,05) dengan konsentrasi NaCl 25% pada isolat 1 dan isolat 3 sedangkan isolat 2, konsentrasi NaCl 20% berbeda nyata (p<0,05) dengan konsentrasi 25%, tetapi konsentrasi NaCl pada isolat 4, 5 dan 6 tidak berbeda nyata (p>0,05). Menurut Besas dan Dizon (2012), konsentrasi garam yang tinggi yakni (17,5% - 25%) dapat menghambat aktivitas mikroba dan enzim dekarboksilase. Hal ini disebabkan oleh adanya konsentrasi klorida natrium tinggi yang menyebabkan penarikan air dan pelarut lainnya dari sel melalui osmosis sehingga memperlambat atau menghambat pertumbuhan sel mikroba. Tanudjaja (1988) menjelaskan bahwa penurunan aktivitas bakteri karena adanya aktivitas sel-sel bakteri yang tidak tahan terhadap konsentrasi garam yang tinggi.
Rataan yang mempunyai huruf superscript yang berbeda (a,b,c) menunjukkan hasil yang berbeda nyata (p<0,05) untuk konsentrasi NaCl pada bakteri
Gambar 12 Pengaruh konsentrasi NaCl terhadap pertumbuhan bakteri histamin. konsentrasi 15%; konsentrasi 20%; konsentrasi 25%
Kadar histamin bakteri yang teridentifikasi sebagai pembentuk histamin Pembentukan histamin di dalam jaringan daging ikan seiring dengan penambahan jumlah bakteri, semakin banyak kandungan bakteri pada ikan maka kandungan histamin semakin besar (Rinto 2007). Kemampuan bakteri untuk tumbuh dan membentuk histamin pada daging ikan sangat dipengaruhi oleh kondisi lingkungan dan media tempat tumbuh. Menurut Kim et al. (2002), histamin dibentuk oleh bakteri sebagai metabolit sekunder untuk penyeimbang kondisi lingkungan yang semakin asam bagi pertumbuhan, bakteri yang dapat menghasilkan histamin adalah Morganella morganii, lactobacillus buchneri, Clostridium perfingens, Micrococcus spp, Klebsiella pneumoniae, Enterobacter aerogenes, Vibrio anguillarum dan Hafnia alvei.
Perombakan histidin menjadi histamin berlangsung secara intraseluler. Histidin bebas masuk ke dalam sel bakteri melalui sistem transportasi aktif, masuknya histidin bebas yang bermuatan positif ke dalam sel menyababkan
b ab b a a a ab b a a a a a a a a a a 0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 0,04
Isolat 1 Isolat 2 Isolat 3 Isolat 4 Isolat 5 Isolat 6
N
ilai
OD
25 proton gradien sehingga menimbulkan energi (Rinto 2007). Proses perombakan histidin menjadi histamin juga menimbulkan energi pada histamine patway. Selain sebagai penghasil energi, histamin yang disekresikan keluar sel akan menyebabkan naiknya pH lingkungan, sehingga kondisi lingkungan menjadi semakin asam akibat proses dekomposisi (pembusukan) maupun proses fermentasi (Molenaar et al. 1993; Rinto 2007).
Hasil pengujian kadar histamin yang diproduksi oleh bakteri pada medium termodifikasi menggunakan fenol red ditunjukkan pada Tabel 5. Produksi kadar histamin terendah pada bakteri yang di isolasi dari ikan pindang tongkol (Auxis rochei) yaitu isolat 1 yang diduga sebagai bakteri Hafnia alvei (78 mg/kg) sedangkan kadar histamin tertinggi terdapat pada isolat 3 yang diduga sebagai bakteri Klebsiella pneumoniae (132 mg/kg). Menurut Kung et al. (2009), Hafnia alvei diidentifikasi sebagai pembentuk histamin yang lemah. Butler et al. (2010) menjelaskan bahwa histamin dihasilkan oleh berbagai jenis bakteri, penghasil utama histamin adalah bakteri gram negatif mesofil, yakni Morganella morganii, Enterobacter aerogenes yang dapat menghasilkan lebih dari 1000 ppm histamin ketika dikultur dalam kondisi optimal. Özogul dan Özogul (2005) menjelaskan bahwa sebagian besar strain bakteri yang diisolasi menghasilkan dekarboksilasi histidin tertinggi yang diamati dari Klebsiella oxytoca, Hafnia alvei dan Proteus vulgaris, serta bakteri tersebut dapat menghasilkan masing-masing 396, 232 dan 54 mg/kg histamin.
Tabel 5 Kadar histamin yang diproduksi oleh bakteri
Nama Bakteri Kadar Histamin (mg/kg)
Isolat 1 78 Isolat 2 100,6 Isolat 3 132 Isolat 4 115,6 Isolat 5 96 Isolat 6 91
Tsai et al. (2007) menambahkan bahwa bakteri Klebsiella pneumoniae, Morganella morganii dan Enterobakter aerogenes termasuk penghasil histamin yang paling banyak sedangkan Hafnia alvei, Escherichia coli dan Clostridium freundii menghasilkan histamin lebih rendah.
Pengukuran TPC sampel pindang yang diinokulasi pada beberapa jenis bakteri
Hasil analisis menunjukkan tidak ada pengaruh nyata (p>0,05) terhadap pengukuran log total mikroba dari bakteri terhadap pindang tongkol, tetapi hasil log isolat 3 adalah 9,88 atau 8,26×109Cfu/g sedangkan isolat 1 adalah 9,85 atau 7,15×109Cfu/g. Hasil pengukuran TPC dari bakteri dan pindang ikan tongkol (Auxis rochei) dapat dilihat pada Gambar 13.
26
Rataan yang mempunyai huruf superscript yang berbeda (a) menunjukkan hasil yang tidak berbeda nyata (p>0,05) untuk total mikroba
Gambar 13 Pengukuran TPC sampel pindang yang diinokulasi pada beberapa jenis bakteri
Kung et al. (2009) menyatakan bahwa H.alvei diidentifikasi sebagai pembentuk histamin yang lemah. Menurut Tembhurne et al (2013), beberapa jenis bakteri enterobacteria yang diisolasi umumnya dari ikan tipe scombroid yang dapat menyebabkan keracunan histamin termasuk M. morganii, K. pneumoniae, H. alvei P. vulgaris, E. aerogenes, P. mirabilis, C. freudii, E. coli, P. stuartii , K. oxytoca, E. agglomerans, E. cloacae, S. liquefaciens, S. marcescens, Edwardsiella spp.
4 SIMPULAN DAN SARAN
SimpulanPenyimpanan pindang tongkol (Auxis rochei) pada suhu kamar selama 32 jam dapat meningkatkan kadar histamin dari 0,26 mg/kg hingga 6,6 mg/kg, namun masih aman untuk dikonsumsi dan masih di bawah level yang tidak membahayakan/menimbulkan keracunan. Hasil seleksi dan identifikasi terdapat 6 jenis isolat bakteri yang diduga merupakan bakteri pembentuk histamin pada pindang ikan tongkol (Auxis rochei) yakni P. vulgaris, H. alvei, M. morganii, E. aerogenes, K. oxytoca, K. pneumoniae.
Saran
Identifikasi bakteri yang dilakukan masih belum menentukan spesifik jenis bakteri pada ikan pindang sehingga perlu dilakukan analisis lanjutan menggunakan metode pemurnian bakteri yang lebih selektif. Perlu dilakukan penelitian lanjutan tentang aktivitas enzim dari bakteri pembentuk histamin pada waktu-waktu penyimpanan yang berbeda pada pindang ikan tongkol (Auxis rochei), serta perlu dilakukan penelitian tentang kandungan formalin pada produk-produk olahan ikan.
9,85a 9,90a 9,88a 9,88a 9,91a 9,87a 2,42 0 2 4 6 8 10 12
Isolat 1 Isolat 2 Isolat 3 Isolat 4 Isolat 5 Isolat 6 kontrol
L o g T o ta l M ik ro ba Jenis Bakteri