(Azadirachta indica A. Juss) FP10, FP20, FP30, DAN FP40 TERHADAP
KULTUR SEL HeLa
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Lestarining Wahyu Ndadari NIM: 038114029
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2007
(Azadirachta indica A. Juss) FP10, FP20, FP30, DAN FP40 TERHADAP
KULTUR SEL HeLa
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Lestarining Wahyu Ndadari NIM: 038114029
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2007
Ia membuat segala sesuatu indah pada waktunya, bahkan
Ia memberi kekekalan dalam hati mereka. Tetapi manusia
tidak dapat menyelami pekerjaan yang dilakukan Allah
dari awal sampai akhir. Pengkhotbah 3 : 11
Ku persembahkan karyaku ini kepada: Tuhan Yesus Kristus atas Kasih dan KaryaNya yang luar biasa dalam
hidupku Bapak dan Ibu yang menyayangiku dengan seluruh dukungan, restu dan doa yang selalu menyertaiku Semua teman-teman dan Almamaterku
Puji dan syukur kepada Tuhan Yang Maha Esa atas karunia dan anugerahNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Sitotoksisitas Fraksi Protein Daun Mimba (Azadirachta indica A. Juss) FP10,
FP20, FP30, dan FP40 terhadap Kultur Sel HeLa” sebagai salah satu syarat untuk
memperoleh gelar sarjana pada Fakultas Farmasi Universitas Sanata Dharma. Penulisan skripsi ini tidak mungkin terwujud tanpa adanya bimbingan, bantuan dan dukungan dari berbagai pihak yang senantiasa meluangkan waktu dan pikirannya. Oleh karena itu, pada kesempatan ini penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Rita Suhadi, M.Si., Apt., selaku dosen dan dekan Fakultas Farmasi Universitas Sanata Dharma yang bersedia berbagi ilmu dan pengalaman klinis.
2. Drs. A. Yuswanto, Ph.D., S.U., Apt., yang telah memberikan bimbingan, pengarahan, dan semangat selama penelitian dan penyusunan skripsi.
3. Drs. Mulyono, Apt., yang bersedia berdiskusi dan memberikan saran sebagai dosen penguji skripsi. yang bersedia meluangkan waktu dan memberikan masukan dalam menyelesaikan permasalahan.
4. dr. Luciana Kuswibawati, M. Kes., yang memberikan saran sebagai dosen penguji skripsi.
5. Ign. Y. Kristio Budiasmoro, M.Si. yang membantu dalam pengolahan statistik dan determinasi tanaman.
sumbangan ilmu dan tenaga.
7. Kedua orang tua, Bapak Wahjudi dan Ibu J. Endang Lestari serta keluarga besar atas doa, cinta, nasehat, semangat dan perhatian kepada penulis.
8. Bapak Rajiman, Mbak Yuli, Mbak Istini, Heni, Mas Dwi, segenap karyawan dan staf Laboratorium Ilmu Hayati UGM yang telah banyak membantu dan membimbing selama penelitian skripsi ini.
9. Nike, yang telah menjadi teman dan sahabat yang berharga yang Tuhan Yesus anugerahkan bagi penulis dalam suka, duka, tangis dan tawa ceria.
10. Teman-teman PMK Apostolos yang menjadi keluarga untuk berbagi suka dan keluh kesah, kekuatan yang menopang dan menarik kembali saat jauh dariNya, dan semangat dalam pelayanan, dalam mereka kelembutan kasih Tuhan terpancar.
11. Teman-teman Komunitas Tari Genta Rakyat atas kebersamaan yang indah dalam perjalanan yang mengagumkan untuk menemukan jati diri. Dance with
our Soul.
12. Leea, Vita, Sari, Lucy, Melon, Ana, Jenny (kelompok Mimba) dan Mila, Wati, Ratih, Agnes (kelompok Teki) untuk diskusi, kerjasama, dan sebagai teman seperjuangan suka maupun duka dalam menyelesaikan penyusunan skripsi ini. 13. Seluruh angkatan 2003 Fakultas Farmasi Universitas Sanata Dharma
khususnya kelas A kelompok B atas kebersamaan kita dalam setiap belajar di kelas maupun di luar kelas dan praktikum yang penuh dengan tantangan, ketegangan dan keceriaan.
yang tidak dapat disebutkan satu persatu.
Penulis menyadari masih banyak kekurangan baik dalam isi, bahasa maupun penulisan skripsi ini. Untuk itu, penulis mengharapkan koreksi dan saran dari seluruh pembaca untuk lebih menyempurnakan tulisan ini. Penulis berharap semoga skripsi ini bermanfaat dan memberikan sumbangan bagi ilmu pengetahuan.
Penulis
Terapi alternatif yang mulai digunakan untuk penyakit kanker adalah dengan daun mimba (Azadirachta indica A. Juss). Hasil penelitian sebelumnya fraksi protein daun mimba hasil pengendapan dengan amonium sulfat 30% dan 60% memiliki efek sitotoksik terhadap kultur sel HeLa. Tujuan dari penelitian ini adalah untuk mengetahui sitotoksisitas fraksi protein daun mimba FP10, FP20, FP30
dan FP40 terhadap kultur sel HeLa dan sel Vero.
Penelitian ini adalah penelitian eksperimental murni rancangan acak lengkap pola satu arah. Fraksi protein diendapkan menggunakan amonium sulfat dalam berbagai tingkat kejenuhan dan konsentrasi. Uji sitotoksisitas dilakukan terhadap sel HeLa dan sel Vero secara in vitro menggunakan metode MTT (3-(4,5-dimetil-tiazol-2-il)-2,5-dipheniltetrazolium bromide). Hasil uji berupa prosentase kematian sel. Analisis statistik dengan analisis probit dilakukan untuk mengetahui nilai LC50 dan uji t-independent sample untuk membandingkan
sitotoksisitas fraksi protein daun mimba terhadap sel HeLa dan sel Vero.
Hasil uji sitotoksisitas menunjukkan bahwa FP10, FP20, FP30 dan FP40
sitotoksik terhadap sel HeLa dan sel Vero. Nilai LC50 FP10, FP20, FP30 dan FP40
terhadap sel HeLa berturut-turut sebesar 1,5.107 µg/ml; 6.10-3 µg/ml; 3,7.10-13 µg/ml dan 1,8.10-2 µg/ml; sedangkan terhadap sel Vero berturut-turut sebesar 1,2.10-3 µg/ml; 1,2.104 µg/ml; 1,2.10-2 µg/ml dan 2,3.1011 µg/ml. Uji
t-independent sample menunjukkan bahwa seluruh fraksi protein daun mimba
memiliki perbedaan sitotoksisitas yang tidak signifikan antara sel HeLa dan sel Vero. FP10, FP20, FP30 dan FP40 daun mimba tidak berpotensi untuk
dikembangkan sebagai antikanker.
Kata kunci : daun mimba, sitotoksisitas, fraksi protein, LC50,sel HeLa, sel Vero
Neem leaves (Azadirachta indica A. Juss) is now being used as alternative therapy for cancer. Previous research showed that protein fraction of neem leaves which were precipitated using ammonium sulphate in concentration of 30% and 60% had cytotoxic activity against HeLa cells. This research aim to investigate the cytotoxicity of protein fraction of neem leaves PF10, PF20, PF30, and PF40
against HeLa and Vero cells (normal cells).
This research was pure experimental research with the complete random and one way design. Protein fractions were precipitated with ammonium sulphate in various saturation grades. The cytotoxicity test was determined against HeLa cells and Vero cells in vitro using MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide) method. Data collected was cell death percentage. Data were statistically analysis by probit analysis to determined the LC50 values
and independent samples t-test was used to identify whether the protein fractions have selectivity to HeLa cells.
The result indicated that PF10, PF20, PF30, and PF40 of neem leaves show
cytotoxic activity to HeLa and Vero cells. LC50 of PF20, PF30, and PF40 against
HeLa cells are 1,5.107 µg/ml; 6.10-3 µg/ml; 3,7.10-13 µg/ml and 1,8.10-2 µg/ml respectively; whereas LC50 of PF10, PF20, PF30 and PF40 against Vero cells are
1,2.10-3 µg/ml; 1,2.104 µg/ml; 1,2.10-2 µg/ml and 2,3.1011 µg/ml. The results of independent samples t-test showed that all protein fraction of neem leaves have no significant difference of cytotoxicity between HeLa and Vero cells. In conclusion, PF10, PF20, PF30, and PF40 of neem leaves were not recommended to be developed
as anticancer.
Keywords: neem leaves, cytotoxicity, protein fraction, LC50, HeLa cells, Vero
cells
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PRAKATA ... vi
PERNYATAAN KEASLIAN KARYA ... ix
INTISARI ... x
ABSTRACT ... xi
DAFTAR ISI ... xii
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xviii
DAFTAR LAMPIRAN ... xix
ARTI SINGKATAN DAN ISTILAH ASING ... xx
BAB I PENGANTAR ... 1 A. Latar Belakang ... 1 1. Permasalahan ... 3 2. Keaslian penelitian ... 3 3. Manfaat penelitian ... 4 B. Tujuan Penelitian ... 4 Tujuan umum ... 4 Tujuan khusus ... 4 xii
A. Tanaman Mimba (Azadirachta indica A. Juss.) ... 5
1. Nama daerah ... 5
2. Deskripsi tanaman ... 5
3. Kandungan kimia ... 6
4. Penelitian terhadap tanaman mimba ... 6
B. Protein ... 7
1. Pengertian protein ... 7
2. Jenis protein berdasarkan kelarutan ... 8
3. Pemurnian protein ... 9
4. Pengukuran konsentrasi protein ... 11
C. Kanker ... 11
1. Definisi ... 11
2. Proses terjadinya kanker ... 13
3. Kanker leher rahim ... 18
D. Kultur Sel ... 19
1. Sel HeLa ... 20
2. Sel Vero ... 21
E. Uji Sitotoksisitas In vitro ... 21
F. Landasan Teori ... 23
G. Hipotesis ... 24
BAB III METODOLOGI PENELITIAN ... 25
A. Jenis dan Rancangan Penelitian ... 25
C. Definisi Operasional ... 26
D. Bahan atau Materi Penelitian ... 26
E. Alat-alat Penelitian ... 27
F. Tatacara Penelitian ... 28
1. Determinasi tanaman ... 28
2. Pengumpulan daun mimba ... 28
3. Sterilisasi alat dan bahan ... 28
4. Pembuatan fraksi protein dari daun mimba ... 28
5. Pengukuran konsentrasi protein total ... 31
6. Propagasi dan panen sel HeLa ... 31
a. Propagasi sel HeLa ... 31
b. Panen sel HeLa ... 32
7. Propagasi dan panen sel Vero ... 32
a. Propagasi sel Vero ... 32
b. Panen sel Vero ... 33
8. Uji sitotoksisitas terhadap sel HeLa dan sel Vero ... 33
a. Uji sitotoksisitas dengan metode MTT terhadap sel HeLa ... 33
b. Uji sitotoksisitas dengan metode MTT terhadap sel Vero ... 34
G. Analisis Hasil ... 35
A. Preparasi Fraksi Protein Daun Mimba ... 36
B. Penetapan Konsentrasi Fraksi Protein ... 38
C. Uji Sitotoksisitas Fraksi Protein ... 39
BAB V KESIMPULAN DAN SARAN ... 53
A. Kesimpulan ... 53 B. Saran ... 53 DAFTAR PUSTAKA ... 54 LAMPIRAN ... 58 BIOGRAFI PENULIS ... 102 xv
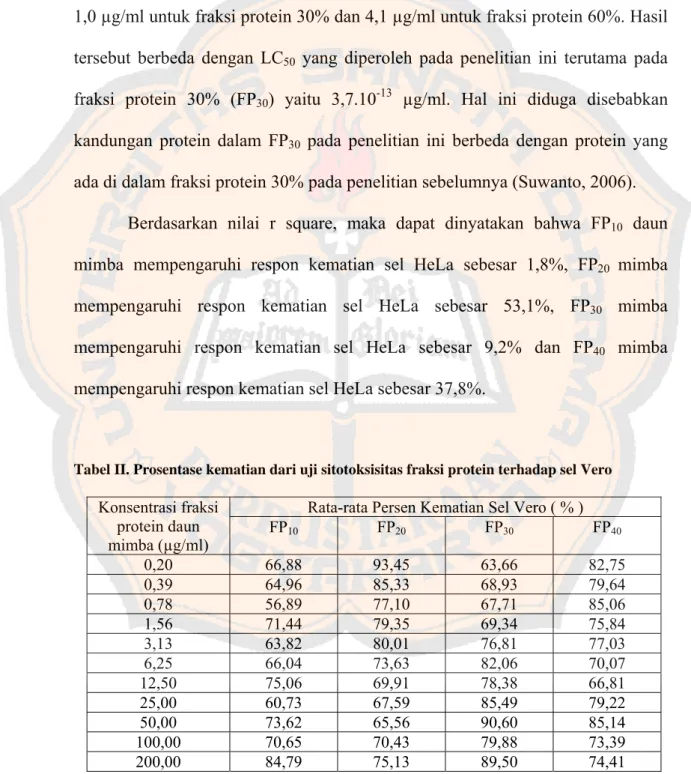
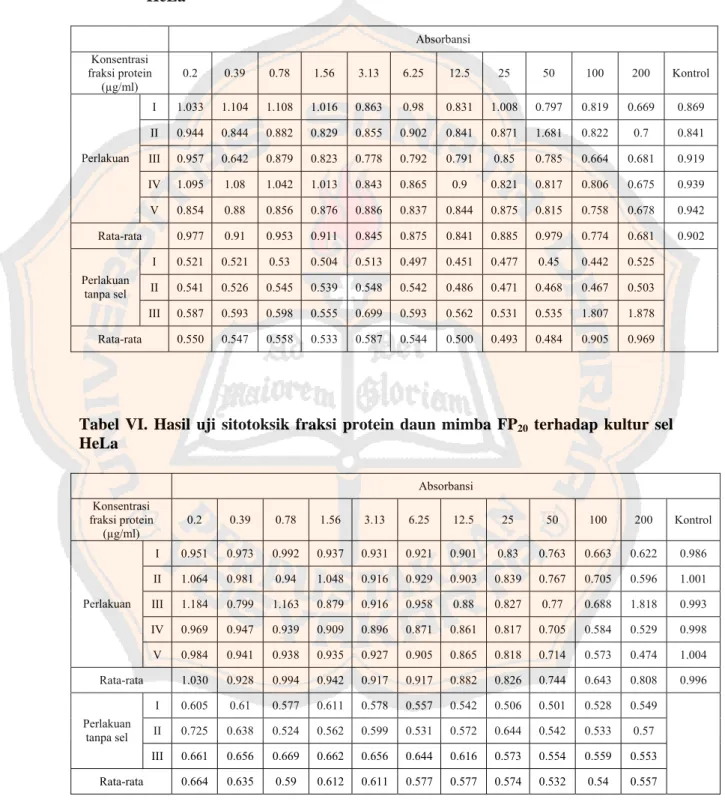
Halaman Tabel I. Prosentase kematian dari uji sitotoksisitas fraksi protein
terhadap sel HeLa ... 44 Tabel II. Prosentase kematian dari uji sitotoksisitas fraksi protein
terhadap sel Vero ... 46 Tabel III. Volume larutan ekstrak gubal protein daun mimba ... 58 Tabel IV. Absorbansi fraksi protein pada panjang gelombang
280 nm dan 260 nm ... 60 Tabel V. Hasil uji sitotoksik fraksi protein daun mimba FP10
terhadap kultur sel HeLa ... 61 Tabel VI. Hasil uji sitotoksik fraksi protein daun mimba FP20
terhadap kultur sel HeLa ... 61 Tabel VII. Hasil uji sitotoksik fraksi protein daun mimba FP30
terhadap kultur sel HeLa ... 62 Tabel VIII. Hasil uji sitotoksik fraksi protein daun mimba FP40
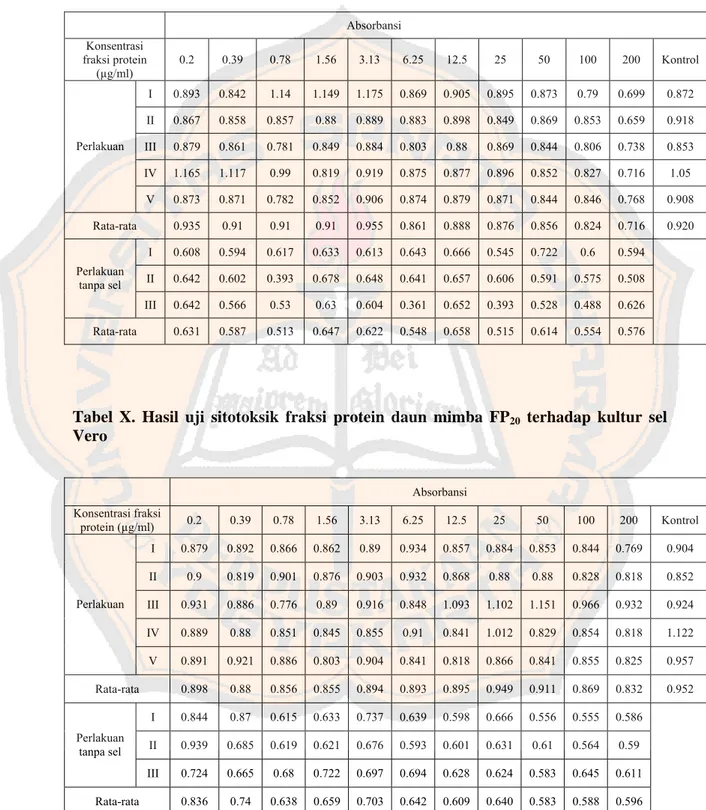
terhadap kultur sel HeLa ... 62 Tabel IX. Hasil uji sitotoksik fraksi protein daun mimba FP10
terhadap kultur sel Vero ... 63 Tabel X. Hasil uji sitotoksik fraksi protein daun mimba FP20
terhadap kultur sel Vero ... 63
terhadap kultur sel Vero ... 64 Tabel XII. Hasil uji sitotoksik fraksi protein daun mimba FP40
terhadap kultur sel Vero ... 64
Halaman
Gambar 1. Reaksi reduksi MTT menjadi formazan ... 22
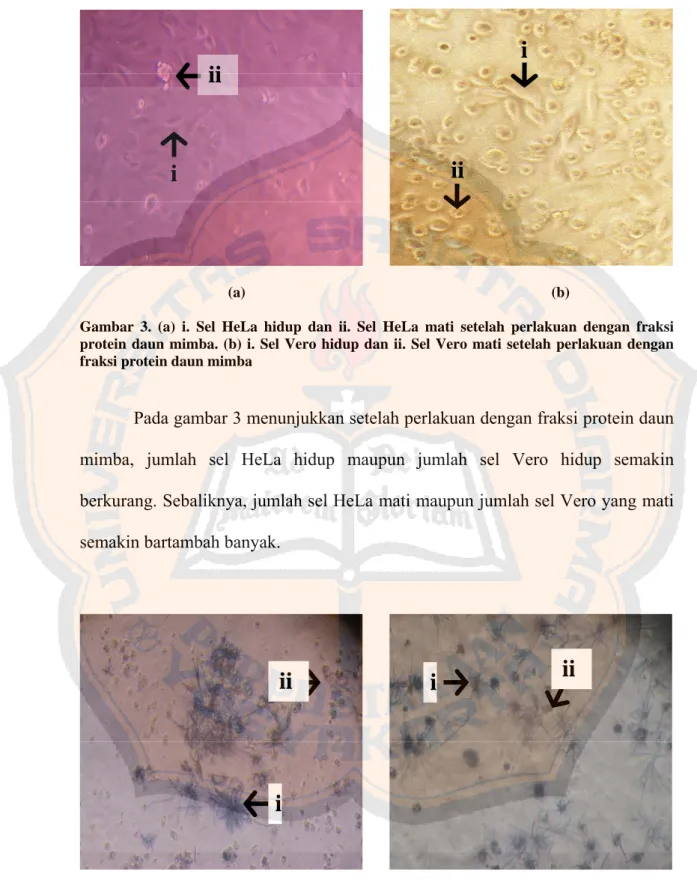
Gambar 2. Foto sel HeLa dan sel Vero tanpa perlakuan ... 41
Gambar 3. Foto sel HeLa dan sel Vero setelah perlakuan ... 42
Gambar 4. Foto kristal formazan ungu ... 42
Gambar 5. Grafik prosentase kematian sel HeLa ... 44
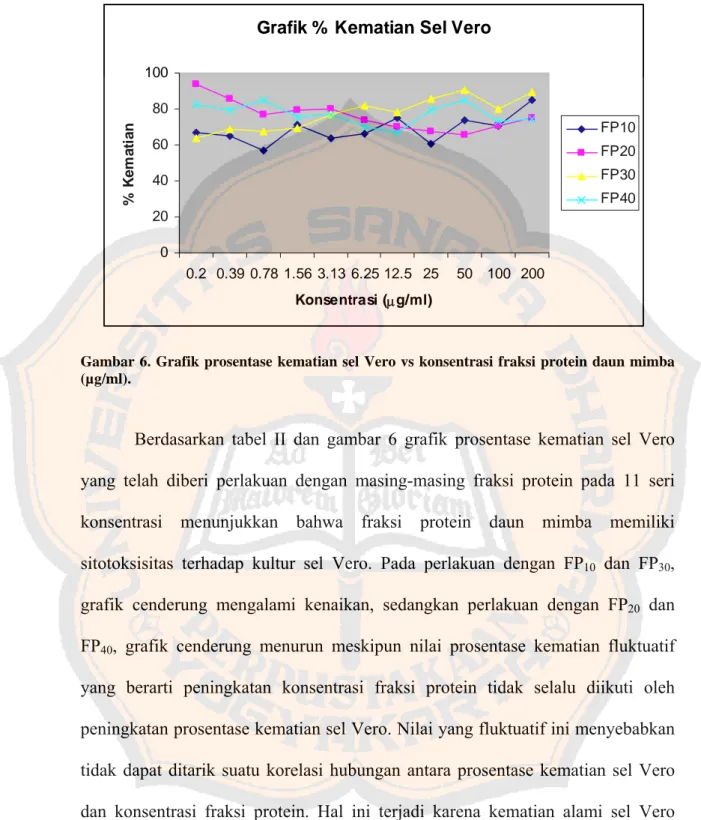
Gambar 6. Grafik prosentase kematian sel Vero ... 47
Gambar 7. Foto tanaman Azadirachta indica A. Juss ... 98
Gambar 8. Foto daun Azadirachta indica A. Juss ... 98
Gambar 9. Foto Hi-Mac Sentrifuge HITACHI SCP85 ... 99
Gambar 10. Foto ELISA reader SLT 340ATC ... 99
Gambar 11. Foto Mikroskop (Olympus IMT-2) ... 99 Gambar 12. Foto perlakuan dengan sel HeLa dalam 96 well plate 100 Gambar 13. Foto perlakuan dengan sel Vero dalam 96 well plate 100
Halaman Lampiran 1. Jumlah penambahan amonium sulfat ... 58 Lampiran 2. Perhitungan konsentrasi protein ... 60 Lampiran 3. Absorbansi sel dengan metode MTT ... 61 Lampiran 4. Hasil analisis probit LC50 fraksi protein terhadap sel
HeLa ... 66 Lampiran 5. Hasil analisis probit LC50 fraksi protein terhadap sel
Vero ... 78 Lampiran 6. Hasil distribusi data dengan Uji Kolmogorov-Smirnov 90 Lampiran 7. Hasil analisis Uji t-independent sample ... 94 Lampiran 8. Foto tanaman dan daun mimba
(Azadirachta indica A. Juss) ... 98 Lampiran 9. Foto Hi-Mac Sentrifuge HITACHI SCP85H, ELISA
reader SLT 340ATC dan mikroskop
(Olympus IMT-2) ... 99 Lampiran 10. Foto hasil uji sitotoksik fraksi protein daun mimba
FP40 terhadap kultur sel HeLa dan sel Vero dalam
96 well plate ... 100 Lampiran 11. Surat determinasi tanaman ... 101
continous cell lines : sel yang berasal dari sel primer yang ditumbuhkan terus
menerus
ELISA : Enzyme Link Immunosorbent Assay
FP10 (PF10) : fraksi protein (protein fraction) daun mimba hasil
pengendapan dengan amonium sulfat 10% jenuh
FP20(PF20) : fraksi protein (protein fraction) daun mimba hasil
pengendapan dengan amonium sulfat 20% jenuh
FP30(PF30) : fraksi protein (protein fraction) daun mimba hasil
pengendapan dengan amonium sulfat 30% jenuh
FP40(PF40) : fraksi protein (protein fraction) daun mimba hasil
pengendapan dengan amonium sulfat 40% jenuh FBS : Foetal Bovine Serum
MTT : 3-(4,5-dimetil-tiazol-2-il)-2,5-dipheniltetrazolium bromide) reagen stopper : reagen yang terdiri dari larutan SDS 10% dalam HCl 0,01N RPMI : Rosswell Park Memorial Institute
SDS : Sodium Dodesil Sulfat
tissue culture flask : tempat untuk menumbuhkan sel, berbentuk botol dengan
leher bengkok
96 well plate : sumuran mikro yang terdiri dari 96 lubang tempat menanam sel pada uji sitotoksisitas
BAB I PENGANTAR
A. Latar Belakang
Kanker memiliki reputasi sebagai penyakit yang mematikan (Anonim, 2005b). Dalam daftar Badan Kesehatan Dunia penyakit kanker masuk dalam urutan teratas dari kelompok penyakit. Di seluruh dunia penyakit kanker menempati urutan kedua setelah penyakit jantung, sedangkan di Indonesia masuk urutan keenam sebagai penyakit penyebab kematian. Penyakit kanker diperkirakan diidap oleh 15 orang per 100.000 penduduk di dunia (Mulyadi, 1996). Sampai saat ini penyakit kanker masih menjadi ancaman, sementara obat spesifik untuk menghentikan perkembangan sel kanker belum juga ditemukan (Hartono, 1999).
Upaya pencegahan terus diusahakan dengan berbagai terapi seperti pembedahan, radiasi dan sitostatika. Namun terapi-terapi tersebut membutuhkan biaya yang besar dan menimbulkan efek samping yang merugikan bagi penderita sehingga sebagian penderita lebih memilih terapi alternatif. Guna menakar besarnya manfaat dan risiko terapi alternatif, sangat diperlukan pemahaman tentang cara kerja terapi alternatif, termasuk penggunaan suplemen makanan (senyawa antioksidan serta vitamin mineral) dan preparat herbal yang dapat bekerja melawan kanker (Hartono, 1999).
Pada umumnya antineoplastik menekan pertumbuhan atau proliferasi sel dan menimbulkan toksisitas. Suatu antikanker diharapkan memiliki toksisitas
selektif artinya menghancurkan sel kanker tanpa merusak sel jaringan normal (Ganiswarna, 1995). Oleh sebab itu, penelitian-penelitian menggunakan bahan-bahan yang berasal dari alam misalnya tanaman, diharapkan dapat menjadi terapi antikanker alternatif yang bersifat selektif. Daun yang berasal dari tanaman mimba (Azadirachta indica A. Juss) telah lama diketahui memiliki banyak manfaat dalam dunia kesehatan antara lain, sebagai antiinflamasi, antirematik, antipiretik, penurun gula darah, antitukak lambung, hepatoprotektor, imunopotensiasi, antifertilitas, antivirus, dan antikanker (Sukrasno, 2003).
Penelitian tentang efek sitotoksik fraksi protein daun mimba terhadap kultur sel kanker telah dilakukan antara lain, fraksi total protein daun mimba terhadap kultur sel Raji (Ariyani, 2004), terhadap kultur sel SiHa (Lusia, 2004), terhadap kultur sel HeLa (Febriani, 2004), fraksi protein daun mimba hasil pengendapan dengan amonium sulfat 30%; 60% dan 100% jenuh terhadap kultur sel Myeloma (Hariadi, 2006), terhadap kultur sel SiHa (Candra, 2006), terhadap kultur sel Raji (Robbyono, 2006), dan terhadap kultur sel HeLa (Suwanto, 2006).
Suatu senyawa dapat dinyatakan memiliki potensi untuk dikembangkan sebagai antikanker apabila mempunyai nilai LC50 ≤ 20 µg/ml (Suffness and
Pezzuto, 1991) dan bersifat toksik selektif (Ganiswarna, 1995). Berdasarkan penelitian yang dilakukan oleh Suwanto (2006) diketahui bahwa fraksi protein daun mimba (Azadirachta indica A. Juss) hasil pengendapan dengan amonium sulfat 30%; 60% dan 100% jenuh memiliki efek sitotoksik terhadap kultur sel HeLa terutama pada fraksi 30% dan 60% dengan nilai LC50 sebesar 1,0 µg/ml dan
antikanker. Namun, penelitian yang dilakukan oleh Suwanto (2006) tersebut perlu dilakukan penelitian dengan fraksinasi yang lebih kecil dan seri konsentrasi yang lebih banyak untuk mengetahui secara lebih spesifik fraksi protein yang bersifat sitotoksik terhadap sel HeLa serta keselektifan efek sitotoksiknya terhadap sel normal. Oleh karena itu, pada penelitian kali ini akan dilakukan fraksinasi proteinnya dengan pengendapan menggunakan amonium sulfat dengan fraksi yang lebih kecil yaitu 10% (FP10), 20%(FP20), 30% (FP30) dan 40% (FP40) jenuh
dengan harapan dapat diperoleh hasil yang lebih spesifik dan membandingkan sitotoksisitasnya terhadap sel Vero (sel normal).
1. Permasalahan
a. Diantara fraksi protein daun mimba FP10, FP20, FP30 dan FP40, manakah
yang mempunyai sitotoksisitas terhadap sel HeLa dan sel Vero ?
b. Berapakah nilai LC50 dari fraksi protein daun mimba FP10, FP20, FP30 dan
FP40 terhadap sel HeLa dan sel Vero ?
c. Apakah fraksi protein daun mimba FP10, FP20, FP30 dan FP40 dapat
dikembangkan sebagai antikanker ?
2. Keaslian penelitian
Sebelumnya pernah dilakukan penelitian mengenai sitotoksisitas fraksi protein daun mimba (Azadirachta indica A. Juss.) hasil pengendapan dengan amonium sulfat 30%, 60% dan 100% jenuh terhadap kultur sel HeLa (Suwanto, 2006). Sejauh yang diketahui penulis belum pernah dilakukan penelitian sitotoksisitas fraksi protein daun mimba (Azadirachta indica A. Juss.) FP10, FP20,
3. Manfaat penelitian
a. Manfaat teoritis
Penelitian ini dapat melengkapi dan memperkaya teori yang telah ada mengenai khasiat, penggunaan, dan efek sitotoksisitas fraksi protein daun mimba terhadap sel HeLa dan sel Vero yang berguna dalam kemajuan bidang ilmu kefarmasian.
b. Manfaat praktis
Penelitian ini diharapkan dapat digunakan sebagai acuan yang mendukung penemuan obat alternatif antikanker dari daun mimba.
B. Tujuan Penelitian
Tujuan umum:
untuk mengetahui apakah fraksi protein daun mimba FP10, FP20, FP30 dan FP40
memiliki potensi untuk dikembangkan sebagai senyawa antikanker baru. Tujuan khusus:
a. untuk mengetahui fraksi protein daun mimba FP10, FP20, FP30 dan FP40
yang mempunyai daya sitotoksisitas terhadap sel HeLa dan sel Vero b. untuk mengetahui nilai LC50 dari fraksi protein daun mimba FP10, FP20,
FP30 dan FP40 terhadap sel HeLa dan sel Vero
c. untuk mengetahui apakah fraksi protein daun mimba FP10, FP20, FP30 dan
BAB II
PENELAAHAN PUSTAKA
A. Tanaman Mimba (Azadirachta indica A. Juss) 1. Keterangan botani tanaman mimba (Azadirachta indica A. Juss)
Tanaman mimba (Azadirachta indica A. Juss.) termasuk dalam divisi Spermatophyta, sub divisi Angiospermae, kelas Dicotyledonae, bangsa Meliales, suku Meliaceae, marga Azadirachta, jenis Azadirachta indica A. Juss. Tanaman mimba memiliki sinonim yaitu Melia azadirachta Linn. Dalam bahasa Inggris atau Belanda tanaman ini dikenal dengan nama Margosa tree, Neem tree, atau
Margosier.
(Backer and Backuizen van den Brink, 1963; 1965; Hutapea, 1993)
2. Nama daerah
Tanaman mimba (Azadirachta indica A. Juss.) memiliki nama daerah Jawa yaitu Imba, mimba, membha, mempheuh. Di wilayah Pasundan (Sunda) dikenal dengan nama nimba, di Bali dan Nusa Tenggara dikenal dengan nama intaran, dan di Madura dikenal dengan nama mimba, membha, atau mempheuh (Sukrasno, 2003).
3. Deskripsi tanaman
Tanaman mimba berupa pohon dengan tinggi 10-15 meter. Batang tegak, berkayu, bulat, permukaan kasar, percabangan simpodial, coklat. Daun majemuk, berhadapan, lonjong, melengkung, tepi bergerigi, ujung lancip, pangkal meruncing, pertulangan menyirip, panjang 5-7 cm, lebar 3-4 cm, tangkai panjang
8-20 cm, hijau. Bunga majemuk, berkelamin dua, di ujung cabang, tangkai silindris, panjang 8-15 cm, kelopak hijau, benang sari silindris, putih kekuningan, putik lonjong, coklat muda, mahkota halus, putih. Buah buni, bulat telur, hijau. Biji bulat, diameter kurang lebih 1 cm, putih. Akar tunggang, coklat (Hutapea, 1993). Pohon mimba dapat tumbuh di berbagai ketinggian tempat, tetapi di atas ketinggian 500 meter diatas permukaan laut sulit menghasilkan biji, hanya daunnya yang tumbuh lebat (Kardinan dan Taryono, 2003).
4. Kandungan kimia
Sampai saat ini, setidaknya ada sembilan senyawa yang telah diisolasi dan diidentifikasi dari daun mimba yaitu nimonol, nimbolida, 28-deoksi nimbolida, α-linolenat, 14-15-epoksinimonol, 6-K-O-asetil-7-deasetil-mimosinol, melrasinol, dan nimbotalin. Penelitian terhadap senyawa-senyawa yang terkandung dalam daun mimba tersebut mendukung pemanfaatannya dalam dunia kesehatan (Sukrasno, 2003).
5. Penelitian terhadap tanaman mimba
Beberapa penelitian untuk membuktikan kebenaran khasiat daun mimba terutama protein daun mimba sebagai antikanker telah dilakukan antara lain, penelitian sitotoksisitas fraksi total protein daun mimba terhadap kultur sel Raji (Ariyani, 2004), terhadap kultur sel SiHa (Lusia, 2004), terhadap kultur sel HeLa (Febriani, 2004), dengan kesimpulan bahwa fraksi protein daun mimba mempunyai efek sitotoksik terhadap ketiga jenis sel kanker tersebut walaupun belum dapat dinyatakan sebagai senyawa yang berpotensi untuk dikembangkan sebagai senyawa antikanker karena nilai LC50 yang diperoleh lebih besar dari 20
µg/ml. Penelitian lebih lanjut yaitu sitotoksisitas fraksi protein daun mimba hasil pengendapan dengan amonium sulfat 30%; 60% dan 100% terhadap sel Raji (Robbyono, 2006) dengan kesimpulan fraksi 30% berpotensi untuk dikembangkan sebagai antikanker karena nilai LC50 < 20 µg/ml, sedangkan pada penelitian
serupa terhadap sel HeLa (Suwanto, 2006), terhadap sel Myeloma (Hariadi, 2006) dan terhadap sel SiHa (Candra, 2006) menyimpulkan bahwa fraksi 30% dan 60% berpotensi untuk dikembangkan sebagai antikanker sebab nilai LC50 yang
diperoleh juga < 20 µg/ml.
B. Protein 1. Pengertian protein
Kata protein berasal dari protos atau proteos yang berarti pertama atau utama. Protein merupakan komponen penting atau komponen utama sel hewan atau manusia. Oleh karena sel itu merupakan pembentuk tubuh hewan maupun manusia, maka protein yang terdapat dalam makanan berfungsi sebagai zat utama dalam pembentukan dan pertumbuhan tubuh. Tumbuhan membentuk protein dari CO2, H2O dan senyawa nitrogen. Protein adalah suatu polipeptida yang
mempunyai molekul besar dengan bobot molekul bervariasi antara 5000 sampai jutaan (Poedjiadi, 1994). Protein terdapat dalam semua jenis zat hidup: tumbuhan, hewan, dan jasad renik. Semua protein, selain mengandung karbon, hidrogen, dan oksigen juga mengandung nitrogen dan sering mengandung belerang dan fosfor (Sakidja, 1989).
Protein merupakan polimer kondensasi asam amino dengan penghilangan unsur air dari gugus amino dan gugus karboksil. Asam amino pada protein mempunyai konfigurasi-L dan ikatan amida hanya terbentuk antara gugus amino-alfa dan gugus karboksil-amino-alfa dari asam amino yang bersangkutan. Beberapa protein beracun mempunyai peran ekologi dalam melindungi tumbuhan dari serangan mikroba. Protein beracun lain memberi harapan dalam pengobatan kanker dan penyakit yang disebabkan virus. Fraksinasi ekstrak protein dapat dilakukan dengan cara pengendapan menggunakan amonium sulfat (Robinson, 1991).
2. Jenis protein berdasarkan kelarutan
Beberapa jenis protein yang diklasifikasikan berdasarkan kelarutannya antara lain:
1. albumin merupakan protein yang dapat larut dalam air dan larutan garam, dapat terkoagulasi oleh panas. Larutan albumin di dalam air dapat diendapkan dengan penambahan amonium sulfat hingga jenuh.
2. globulin memiliki sifat sukar larut dalam air murni, tetapi dapat larut dalam larutan garam netral, misalnya larutan NaCl encer. Larutan globulin dapat diendapkan oleh penambahan garam ammonium sulfat hingga setengah jenuh. Globulin dapat diperoleh dengan jalan mengekstraksinya dengan larutan garam (5%-10%) NaCl kemudian ekstrak yang diperoleh diencerkan dengan penambahan air. Globulin akan mengendap dan dapat dipisahkan. Globulin juga dapat terkoagulasi oleh panas.
3. histon merupakan protein yang mempunyai sifat basa dan dapat larut dalam air. Pada proses hidrolisis menghasilkan banyak arginin dan lisin. Histon terdapat di dalam inti sel dalam bentuk ikatan dengan asam nukleat. 4. protamin merupakan protein yang bersifat basa seperti histon, tidak
mengandung tirosin dan triptofan, tetapi mengandung banyak arginin sehingga mempunyai kadar nitrogen antara 25%-30%. Protamin berikatan dengan asam nukleat. Protamin larut dalam etanol 70%-80% tetapi tidak larut dalam air serta etanol absolut.
5. skleroprotein tidak larut dalam air atau larutan garam, banyak mengandung asam amino Glysin, Alanin dan Prolin.
(Poedjiadi, 1994; Murray dkk, 1995)
3. Pemurnian protein
Suatu jenis protein dari bahan alam dalam keadaan murni tidak mudah diperoleh sebab molekul protein tidak stabil terhadap pemanasan serta pelarut organik. Pemurnian protein diawali dengan pemilihan bahan alam yang akan diproses berdasarkan kadar protein yang terkandung didalamnya yaitu yang berkadar protein tinggi dan mudah diperoleh. Selanjutnya mengeluarkan protein dari dalam bahan alam tersebut dengan cara memecahkan sel-sel jaringan secara mekanik misal dengan cara menghancurkan dan melumatkannya dalam suatu alat tertentu dan beberapa jenis protein dapat diperoleh dengan melarutkannya dalam air atau pelarut lain. Dalam proses ini perlu dijaga agar temperatur dan pH larutan tidak merusak protein. Pada temperatur 40°C protein mudah terdenaturasi, maka pemurnian protein sering dilakukan pada temperatur rendah, yaitu mendekati titik
beku pelarut yang digunakan. Disamping itu, protein juga sensitif terhadap asam atau basa dengan konsentrasi tinggi, dan biasanya pemurnian protein dilakukan pada pH mendekati netral dengan menggunakan larutan buffer tertentu (Poedjiadi, 1994).
Setelah diperoleh larutan yang berisi beberapa macam protein maka proses selanjutnya ialah fraksinasi yaitu memisahkan masing-masing protein dalam campuran secara fraksi demi fraksi. Dua cara yang biasa digunakan untuk proses fraksinasi ini yaitu pengendapan dan kromatografi. Proses pengendapan protein dapat dilakukan menggunakan amonium sulfat berkonsentrasi tinggi atau larutan jenuh. Beberapa protein berbeda kelarutannya dalam konsentrasi garam yang berbeda. Cara ini digunakan terutama bila diinginkan satu macam protein saja sedangkan protein lain tidak diperlukan. Selain dengan garam proses pengendapan protein dapat dilakukan dengan menyesuaikan pH titik isoelektrik protein yang diinginkan. Pada titik isoelektrik kelarutan protein berkurang hingga minimum dan protein yang diinginkan akan mengendap, sedangkan protein lain yang tidak diinginkan tetap di dalam larutan. Protein dapat dipisahkan satu dari yang lain dengan cara kromatografi. Kromatografi adsorpsi untuk pemurnian protein dilakukan dengan menggunakan alumina atau kalsium fosfat sebagai adsorben. Selain itu kromatografi penukar ion dapat digunakan pula untuk pemurnian protein. Kolom kromatografi diisi dengan DEAE-selulosa, suatu penukar ion yang mempunyai gugus dietilaminoetil yang terikat pada selulosa atau dengan penukar kation yaitu CM-selulosa yang mempunyai gugus karboksimetil terikat pada selulosa (Poedjiadi, 1994).
4. Pengukuran konsentrasi protein
Pada umumnya, metode pemurnian protein harus dilakukan pada temperatur rendah, pada range 0-4°C. Temperatur rendah meminimalkan degradasi protein selama pemurnian dengan menghalangi aktifitas protease (enzim yang memecah ikatan peptida) dan mengurangi kemungkinan protein akan terdenaturasi, atau membuka ikatannya (banyak protein yang sangat sensitif terhadap panas). Pada pH netral tirosin, triptofan dan fenilalanin mengabsorpsi sinar ultraviolet (UV) pada panjang gelombang 280 nm (Moran dkk, 1994; Murray dkk, 1995).
C. Kanker 1. Definisi
Kanker adalah penyakit yang disebabkan adanya perbanyakan dan penyebaran yang tidak terkontrol menjadi bentuk tubuh abnormal dari sel tubuh itu sendiri. Kanker merupakan salah satu penyebab utama kematian di Negara berkembang, setidaknya satu dari lima pada populasi di Eropa dan Amerika Utara diperkirakan meninggal karena kanker (Rang dkk, 2003). Kanker ditandai oleh pembelahan sel yang tidak terkontrol dan kemampuannya untuk menyerang jaringan lain, baik melalui pertumbuhan langsung pada jaringan (invasi) atau dengan migrasi sel ke jaringan yang lain (metastasis). Pertumbuhan yang tidak sesuai aturan ini disebabkan oleh kerusakan DNA, menghasilkan mutasi pada gen utama yang mengendalikan pembelahan sel, dan fungsi yang lain. Satu atau lebih
dari mutasi ini, baik yang diturunkan atau didapatkan, dapat menuntun ke pembelahan sel yang tak terkendali dan pembentukan tumor (Anonim, 2005b).
Tumor menunjukkan suatu massa yang abnormal di jaringan, baik berupa malignan (kanker) atau benigna (nonkanker). Tumor benigna tidak menyebar ke bagian lain tubuh atau menyerang jaringan lain, dan jarang perawatannya untuk bertahan hidup jika tidak secara kebetulan menekan struktur utama (vital). Tumor malignan dapat menyerang organ lain, menyebar ke lokasi yang jauh (metastasis) dan menjadi perawatan untuk bertahan hidup (Anonim, 2005b). Istilah kanker, neoplasma malignan dan tumor malignan merupakan sinonim. Keduanya dibedakan dari tumor benigna oleh dediferensiasi, keinvasifan dan kemampuan metastasis (penyebaran ke bagian lain dari tubuh). Kedua tumor baik benigna maupun malignan menunjukkan proliferasi yang tidak terkendali. Sel kanker memiliki karakteristik yang membedakannya dari sel normal, yaitu sel kanker mengalami pertumbuhan dan pembelahan sel yang tidak terkendali oleh regulasi pembelahan sel dan pertumbuhan jaringan yang normal, adanya gangguan diferensiasi dan kehilangan fungsi pada sel kanker, sel kanker mampu melakukan invasif dan metastasis (Rang dkk, 2003).
Untuk menghambat metastasis kanker, perlu diketahui cara sel tersebut menyebar. Ada dua cara sel kanker ber-metastasis: melalui angiogenesis (pembentukan pembuluh darah yang baru) dan penghancuran kolagen yang merupakan kerangka sel normal. Dengan demikian metastasis akan dapat dihambat bila angiogenesis dapat dicegah; sementara kolagen yang rusak dapat
diperbaiki oleh tubuh sendiri dengan memanfaatkan makanan tertentu (Hartono, 1999).
Pendekatan utama dalam pengobatan kanker yaitu pembedahan, irradiasi, dan kemoterapi. Penggunaan masing-masing pengobatan tersebut tergantung pada tipe tumor dan tingkat perkembangannya (Rang dkk, 2003).
2. Proses terjadinya kanker
Sel normal berubah menjadi sel kanker karena satu atau lebih mutasi pada DNA-nya baik secara diturunkan, bukan kanker itu sendiri yang diturunkan melainkan gen yang telah termutasi dan mudah berkembang menjadi kanker maupun dengan cara didapat dari luar sel akibat pemaparan zat kimia, ko-karsinogen, dan lain-lain. Perkembangan kanker merupakan proses yang rumit, melibatkan tidak hanya satu perubahan genetik tetapi juga yang lain, seperti faktor-faktor epigenetik (aksi hormonal, ko-karsinogen dan efek pemacu tumor) yang tidak hanya menghasilkan kanker itu sendiri melainkan dengan meningkatkan kemungkinan mutasi genetik yang akan menimbulkan kanker (Rang dkk, 2003).
Sel kanker mempunyai antigen pada permukan sel yang dapat dikenali dan bereaksi dengan sistem imun inang sehingga mampu mencegah pertumbuhan tumor yang tak terkendali. Teori ini dikenal sebagai immunosurveillance (pemantauan imun). Teori ini bermula dari percobaan yang dilakukan oleh Paul Ehrlich yang mengamati bahwa hewan dengan pertumbuhan tumor bervirulensi rendah mengalami penurunan pertumbuhan tumor setelah dilakukan inokulasi sel tumor berikutnya. Ehrlich menduga lubang pada struktur permukaan sel tumor
yang dapat dikenali sebagai sesuatu yang abnormal oleh inang. Penelitian dilanjutkan oleh Lewis Thomas yang memberikan teori penolakan allograft menggambarkan mekanisme utama dalam pertahanan alami terhadap neoplasia. Berdasarkan penelitian-penelitian tersebut, Macfarlane Burnet memberikan teori
immunosurveillance yang berpusat adanya antigen yang tergabung pada sel tumor
(Schwartz, 1991; Dasgupta, 1992).
Teori tersebut menyatakan bahwa sel efektor pada sistem imun secara aktif beredar di dalam tubuh untuk mengenali dan membasmi sel-sel tumor yang mulai terbentuk. Penelitian pada tahun 1970 mampu menemukan dan mengidentifikasi adanya sel T, sel ini menjadi sel efektor yang diduga memperantarai dalam
immunosurveillance. Lebih dari dua dekade terakhir, data-data memunculkan
pendapat bahwa konstituen sistem imun seperti sel natural killer (NK) dan jaringan cytokine mampu memberi pertahanan terhadap kanker (Ichim, 2005).
Aktivitas sel NK menjadi tanda penunjuk pada beberapa tipe tumor. Sel-sel NK terlibat baik secara langsung maupun tidak langsung dalam pemantauan kemunculan tumor dan mikrometastasis. Teori ini kemudian dibuktikan dengan data yang menunjukkan bahwa onkogen tertransfeksi fibroblas dapat lisis secara selektif oleh sel NK bila dibandingkan dengan kontrol yang tidak tertransfeksi. Mekanisme secara tepat sel NK dalam immunosurveillance belum diketahui secara pasti. Berkaitan dengan efek sitotoksik secara langsungnya, kemungkinan sel NK mengaktifkan sel lain dalam sistem imun dengan cara memperlengkapinya dengan bantuan cytokine. Sel NK yang mature tidak menghasilkan cytokine T-helper 2 (Th2), tetapi lebih pada cytokine T-T-helper 1 (Th1), tumor necrosis factor
(TNF)-α, interferon (IFN)-γ dan granulocyte-macrophage colony-stimulating
factor (GM-CSF). Pada kenyataanya, sekresi IFN-γ oleh sel NK dapat
mempengaruhi pembentukan respon imun tipe Th1 terhadap agen patogen maupun tumor terinduksi 3-methylcholanthrene (MCA) (Ichim, 2005).
Langkah awal respon imun memerlukan cytokine yang dihasilkan oleh sel-sel T-helper. Perbedaan cytokine yang dihasilkan oleh sel-sel menentukan tipe respon imun. Respon imun yang diperantarai sel membutuhkan cytokine Th1, sedangkan respon imun yang diperantarai antibodi membutuhkan cytokine Th2. Sel T-helper yang terdiferensiasi menjadi sel Th1 mensekresikan IFN-γ dan sedikit interleukin (IL)-2 dan IL-12, sedangkan sel Th2 mensekresikan IL-10, IL-4, dan sedikit IL-5. Namun, tumor memiliki beberapa cara baik spesifik maupun non-spesifik untuk menghindari respon Th1. Tumor mensekresikan sejumlah agen, termasuk
transforming growth factor (TGF)-β, IL-10 dan prostaglandin E-2, yang
menunjukkan meningkatkan respon imun Th2 ketika menekan respon imun Th1. Hal ini telah ditunjukkan bahwa jaringan cytokine dari beberapa pasien kanker cenderung mengarah ke Th2. Pasien-pasien tersebut menunjukkan peningkatan cytokine Th2 atau penurunan cytokine Th1 baik tumor sistemik maupun lokal. Penelitian mengenai tumor yang mengembangkan beberapa cara untuk menghindari respon Th1 sesuai dengan pengertian immunosurveillance. Fakta bahwa malignan memiliki banyak cara dalam menghindari respon Th1 menunjukkan bahwa kemampuan untuk menghindari respon ini memberikan keuntungan pertahanan pada sel malignan, yang selanjutnya menunjukkan bahwa respon Th1 menjadi ancaman bagi neoplasma (Ichim, 2005).
Cytokine Th1 IFN-γ berfungsi sebagai antitumor baik secara langsung maupun tidak langsung. Serangkaian penelitian menunjukkan arti penting IFN-γ dalam membasmi tumor awal dengan adanya peningkatan keberhasilan karsinogenesis saat tidak ada IFN-γ. IFN-γ menghambat pertumbuhan tumor dengan mempengaruhi proliferasi, apoptosis dan angiogenesis. IFN-γ juga mempunyai efek antitumor tidak langsung dengan memacu respon imun antitumor yang efektif. Sebagai tambahan dalam mempengaruhi keseimbangan cytokine Th1-Th2, IFN-γ mampu mengaktifkan makrofag sitotoksik, sel-sel NK dan sel-sel T NK (Ichim, 2005).
Bukti dari prinsip tipe respon imun yang tidak tepat akan meningkatkan pertumbuhan tumor telah dibuktikan pada awal 1907 oleh Flexner dan Jobling, yang menunjukkan bahwa injeksi sel tumor autologous mati meningkatkan pertumbuhan tumor yang ada lebih dulu. Secara umum, Th2 membawa respon antibodi ke tumor yang tidak terlindungi dan mendukung perkembangan tumor dengan menghambat respon imun yang diperantarai sel Th1. Namun, paham bahwa respon imun yang diperantarai antibodi dapat merugikan pada kanker telah diusulkan lama sebelum Mossman dan Coffman menunjukkan paradigma Th1-Th2 pada tahun 1986. Pada tahun 1950-an Kaliss mempopulerkan istilah ”immunological enhancement” untuk menggambarkan peningkatan pertumbuhan tumor oleh antibodi non-sitotoksik. Teori ini menyebutkan bahwa antibodi berikatan dengan sel tumor, melapisi atau menutup epitop sel tumor dan kemudian mencegah respon imun yang diperantarai sel sehingga sel tumor tidak bereaksi
dengan imun dan tetap bisa tumbuh dan berkembang, meskipun hal ini belum pernah dibuktikan dengan percobaan (Ichim, 2005).
Ada dua kategori utama perubahan genetik yang dapat mengakibatkan munculnya kanker, yaitu:
Aktivasi proto-onkogen menjadi onkogen
Proto-onkogen adalah gen yang secara normal mengendalikan pembelahan sel, apoptosis, dan diferensiasi tetapi dapat berubah menjadi onkogen oleh adanya aksi virus atau karsinogen.
Inaktivasi gen penekan tumor
Sel normal mengandung gen yang mempunyai kemampuan untuk menekan perubahan malignan yang disebut gen penekan tumor (anti-onkogen) dan sekarang terdapat bukti bahwa mutasi terhadap gen ini terlibat dalam pembentukan kanker yang berbeda-beda. Kehilangan fungsi dari gen penekan tumor dapat menjadi peristiwa penting dalam karsinogenesis (Rang dkk, 2003).
Kanker akan muncul bila DNA sel normal mengalami kerusakan sehingga menyebabkan mutasi genetik. Kalau ini tidak segera dikoreksi, perbanyakan sel yang DNA-nya rusak tersebut potensial menghasilkan sel kanker. Padahal perbanyakan sel dimaksudkan untuk pemulihan sel-sel yang aus atau rusak (Hartono, 1999).
Tingkatan perubahan sel pada pertumbuhan kanker adalah sebagai berikut: a. hiperplasi yaitu pembengkakan organ tubuh akibat pertumbuhan sel-sel
b. metaplasi yaitu perubahan epitel suatu jenis jaringan dewasa menjadi jaringan lain yang juga dewasa.
c. displasi yaitu perubahan sel dewasa ke arah kemunduran dalam hal bentuk, besar dan orientasinya. Masih bersifat reversibel.
d. anaplasi yaitu perubahan serupa displasi yang menyimpang lebih jauh dari normal. Merupakan suatu ciri tumor ganas yang sangat ireversibel.
e. karsinoma insitu yaitu gambaran sel menjadi sangat atipik namun belum terdapat pertumbuhan infiltratif.
f. invasi yaitu sel kanker telah menembus lapisan basal jaringan (Kuswibawati, 2000).
3. Kanker leher rahim
Kanker servik merupakan suatu bentuk malignan pada leher rahim (servik). Kanker leher rahim merupakan jenis kanker paling banyak kedua di dunia yang menyerang wanita dan peringkat ketiga kanker yang dapat menyebabkan kematian setelah kanker payudara dan kanker paru-paru. Kanker ini menyerang 16 per 100.000 orang wanita dan menyebabkan kematian 9 per 100.000 setiap tahunnya (Anonim, 2007a). Uji sitologi cervical (Pap smear) menunjukkan identifikasi dan penghilangan lesi prekanker (Anonim, 2005b). Gejala klinik kanker leher rahim adalah keputihan yang tidak gatal, nyeri dan perdarahan sehabis senggama, anemia serta gejala-gejala lain yang ditimbulkan pada metastasis jauh (Fenty, 2000).
Istilah Cervical Intra-epithelial Neoplasia (CIN) digunakan saat pada
Virus (HPV) pada stadium ini merupakan virus yang beresiko rendah dalam arti
tidak selalu berkembang menjadi kanker tetapi bisa juga menjadi virus beresiko tinggi menyebabkan kanker leher rahim. Apabila kanker leher rahim dideteksi lebih dini, maka kanker ini dapat diobati tanpa mempengaruhi kesuburan (Anonim, 2007a).
Kanker leher rahim atau karsinoma servik uteri paling sering ditemukan di antara tumor ganas ginekologik, dan umumnya paling banyak ditemukan pada wanita berusia 31-60 tahun (Fenty, 2000). Lebih dari 90% kasus kanker leher rahim disebabkan oleh Human Papilloma Virus (HPV) terutama tipe 16 dan 18.
Human Papilloma Virus (HPV) tipe 16 dan 18 mengandung dua macam gen yaitu
E6 dan E7 yang menghambat p53 dan Rb. Gen p53 dan Rb merupakan gen penekan tumor yang ada di dalam tubuh manusia. Gen p53 terlibat dalam regulasi apoptosis (bunuh diri sel) dan Rb bertanggung jawab untuk menghentikan siklus sel pada fase G1. Pada saat fungsi Rb melemah, sel melanjutkan siklus ke fase S dan mengalami mitosis sempurna, kemudian menghasilkan proliferasi sel dan dari hal ini menyebabkan adanya pembentukan neoplastik (Anonim, 2007a).
D. Kultur Sel
Kultur sel yang baru diisolasi dari suatu jaringan dan kemudian ditumbuhkan secara in vitro dikenal sebagai kultur sel primer. Subkultur adalah pemindahan sel ke flask baru dengan medium yang baru. Subkultur memungkinkan terjadinya perluasan kultur yang sekarang dikenal sebagai cell
cell line) atau berubah menjadi continuous cell line. Sel normal dapat mengalami
perubahan menjadi continuous cell line tanpa menjadi malignan, sedangkan tumor malignan dapat tumbuh pada media kemudian mengalami perubahan dan menjadi lebih atau kurang tumorigenik. Keuntungan penggunaan continuous cell line adalah lebih cepat tumbuh sehingga kepadatan populasi sel lebih tinggi, membutuhkan serum yang lebih rendah dan cukup mudah perawatannya pada media sederhana, serta memiliki kemampuan untuk tumbuh dalam suspensi. Kerugiannya meliputi ketidakstabilan kromosomal yang lebih besar, adanya penyimpangan dari fenotip donor, dan terjadi kehilangan penanda khusus jaringan (Freshney, 1986).
1. Sel HeLa
HeLa cell line merupakan continouous cell line yang tumbuh sebagai sel
yang semi melekat. HeLa cell line diturunkan dari sel epitel kanker leher rahim (cervix) manusia. Sel ini diisolasi dari seorang wanita penderita kanker leher rahim bernama Henrietta Lacks berusia 31 tahun, yang meninggal pada tahun 1951 akibat kanker yang dideritanya. HeLa cell line ini cukup aman dan umum digunakan untuk kepentingan kultur sel. Sel HeLa merupakan cell line cervix intraepitel (Cervical Intraepithelial Carcinoma) akibat infeksi HPV 18 (Widiyani, 2005).
Sel HeLa diketahui dapat hidup dan berkembang dengan sangat baik dalam kultur buatan di laboratorium. Kultur sel HeLa mengalami proliferasi yang sangat cepat, bahkan jika dibandingkan dengan jenis sel kanker yang lain. Sel-sel tersebut memiliki telomerase aktif selama pembelahan sel, yang dapat mencegah
bertambah pendeknya telomer-telomer yang mengakibatkan penuaan dan bahkan kematian sel. Sel HeLa mudah menginvasi atau mengkontaminasi kultur sel lain dalam satu laboratorium yang sama (Anonim, 2007b).
HeLa cell line merupakan immortal cell line yang digunakan dalam
penelitian dibidang kesehatan seperti uji antitumor, uji sitotoksisitas, biologi sel, dan kemampuan invasi bakteri. Sel ini dapat dikultur menggunakan media RPMI 1640. Media RPMI 1640 mengandung nutrisi yang dibutuhkan oleh sel seperti asam amino, vitamin, garam-garam anorganik dan glukosa (Freshney, 1986).
2. Sel Vero
Vero epithelial cell line ditemukan pertama pada tahun 1962 oleh Y.
Yasumura dan Y. Kawakita di Universitas Chiba di Chiba, Jepang. Sel Vero diambil dari ginjal kera dewasa (jenis African Green Monkey) yang sehat. Walaupun sering digunakan dalam tranfections dan produksi vaksin, sel Vero juga sering digunakan untuk mendeteksi verotoksin (sekelompok toksin yang berhubungan yang dihasilkan oleh beberapa strain Escherichia coli yang merupakan penyebab utama hemorrhagic colitic dan sindrom hemolytic uremic pada manusia) (Anonim, 2006b).
E. Uji Sitotoksisitas In Vitro
Uji untuk identifikasi agen kemoterapetik kanker yang baru biasanya dilakukan pada hewan percobaan yang mempunyai kesamaan sifat dengan manusia. Namun, ada beberapa pertimbangan yang menyebabkan kecenderungan untuk menggunakan kultur sel dibanding hewan uji. Pertimbangan tersebut antara
lain, tes in vitro lebih murah dibanding in vivo, ada perbedaan proses fisiologis antara hewan percobaan dan manusia, dan adanya pertimbangan moral di dalam penggunaan hewan sebagai objek penelitian (Freshney, 1986).
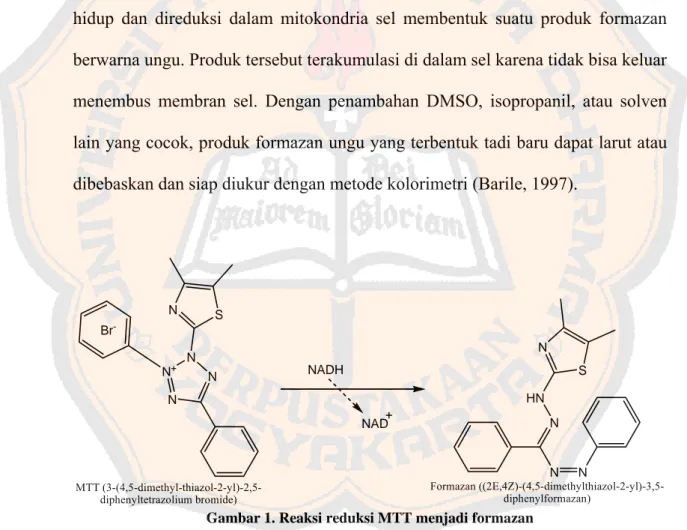
Uji MTT (3-(4,5-dimetil-tiazol-2-il)-2,5-dipheniltetrazolium bromide) didasarkan pada aktivitas mitokondria, yang diinterpretasikan sebagai tolok ukur kelangsungan hidup sel. Pada uji MTT, garam tetrazolium, 3-(4,5-dimetil-tiazol-2-il)-2,5-dipheniltetrazolium bromide secara aktif akan diabsorpsi ke dalam sel hidup dan direduksi dalam mitokondria sel membentuk suatu produk formazan berwarna ungu. Produk tersebut terakumulasi di dalam sel karena tidak bisa keluar menembus membran sel. Dengan penambahan DMSO, isopropanil, atau solven lain yang cocok, produk formazan ungu yang terbentuk tadi baru dapat larut atau dibebaskan dan siap diukur dengan metode kolorimetri (Barile, 1997).
N N+ N N S N Br -MTT (3-(4,5-dimethyl-thiazol-2-yl)-2,5-diphenyltetrazolium bromide) HN N N N S N Formazan ((2E,4Z)-(4,5-dimethylthiazol-2-yl)-3,5-diphenylformazan) NADH NAD
Gambar 1. Reaksi reduksi MTT menjadi formazan
Kematian sel merupakan respon uji sitotoksisitas maka konsentrasi yang menimbulkan kematian pada 50% populasi pada sel dalam waktu yang spesifik dan kondisi percobaan yang sesuai diistilahkan dengan median lethal
concentration atau LC50 (Cassaret and Doull, 2001). Semakin kecil harga LC50
suatu senyawa berarti senyawa tersebut semakin besar sitotoksisitasnya.
F. Landasan Teori
Penyakit kanker merupakan penyakit yang telah menjadi ancaman di seluruh dunia, sementara obat spesifik untuk menghentikan perkembangan sel kanker belum juga ditemukan. Tetapi upaya pencegahan terus diusahakan dengan terapi alternatif obat antikanker yang berasal dari tanaman.
Tanaman mimba merupakan salah satu tanaman yang diyakini mempunyai khasiat untuk mengobati kanker. Fraksi protein daun mimba ternyata dapat memberikan efek sitotoksik terhadap beberapa tipe sel kanker termasuk sel HeLa. Sel HeLa dapat hidup dan berkembang sangat baik dalam kultur buatan di laboratorium, diakui aman untuk digunakan dalam kultur sel, dan mampu memberikan respon yang cukup baik terhadap aktivitas dari senyawa-senyawa yang diujikan.
Beberapa penelitian tentang sitotoksisitas fraksi protein daun mimba terhadap sel HeLa sebagai subyek uji telah banyak dilakukan. Dari penelitian Suwanto (2006) diketahui bahwa fraksi protein hasil pengendapan amonium sulfat 30% dan 60% memiliki nilai LC50 yang berpotensi untuk dikembangkan sebagai
senyawa antikanker. Diduga bahwa protein yang berperan sebagai antikanker berada terutama antara kedua fraksi protein tersebut sehingga dimungkinkan untuk memfraksinasi protein kedalam konsentrasi yang lebih kecil lagi dengan cara pengendapan menggunakan amonium sulfat dengan tingkat kejenuhan 10%
(FP10), 20%(FP20), 30% (FP30) dan 40% (FP40). Dengan demikian, diharapkan
dapat diketahui pada fraksi mana protein yang memiliki potensi sebagai antikanker tersebut paling banyak terendapkan dan kespesifikan protein yang bersifat antikanker. Namun, fraksi protein daun mimba belum pernah dicobakan pada sel normal (sel Vero). Jika ternyata tidak menimbulkan kerusakan pada sel normal (sel Vero), fraksi protein daun mimba dapat diajukan sebagai alternatif obat antikanker baru. Hal-hal tersebutlah yang mendasari dilakukan penelitian fraksinasi protein daun mimba menjadi lebih kecil lagi untuk dilihat keberadaan protein yang berpotensi untuk dikembangkan menjadi senyawa antikanker.
G. Hipotesis
Fraksi protein daun mimba (Azadirachta indica A. Juss) FP10, FP20, FP30
dan FP40 memiliki efek sitotoksik terhadap sel HeLa dan berpotensi untuk
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian eksperimental murni sederhana tunggal dengan rancangan penelitian acak lengkap pola searah.
B. Variabel-variabel Penelitian
1. Variabel bebas
Konsentrasi fraksi protein daun Azadirachta indica A. Juss FP10, FP20, FP30
dan FP40.
2. Variabel tergantung
Prosentase kematian sel HeLa dan sel Vero pada masing-masing kultur sel. 3. Variabel pengacau terkendali
a. Medium tumbuh sel dikendalikan dengan menggunakan medium RPMI 1640 untuk sel HeLa dan medium M199 untuk sel Vero.
b. Tempat tumbuh dan waktu pemanenan daun mimba dikendalikan dengan memanen daun pada tempat dan waktu yang sama.
c. pH dan suhu pembuatan fraksi protein, dikendalikan pada pH 7,2 dan suhu 4oC.
4. Variabel pengacau tak terkendali
Kematian sel HeLa dan sel Vero secara alami.
C. Definisi Operasional
1. Uji sitotoksisitas adalah uji toksisitas secara in vitro menggunakan kultur sel. 2. Fraksi protein adalah protein yang didapat dari ekstrak gubal daun mimba
dengan pengendapan menggunakan amonium sulfat.
3. Lethal Concentration (LC50) adalah konsentrasi fraksi protein daun mimba
yang dapat mengakibatkan kematian 50% populasi sel HeLa maupun sel Vero.
D. Bahan atau Materi Penelitian
1. Bahan utama yang digunakan dalam penelitian ini adalah daun segar tanaman mimba (Azadirachta indica A. Juss). Daun mimba diambil dari tanaman mimba (Azadirachta indica A. Juss) yang tumbuh di pekarangan Laboratorium Hayati LPPT Unit III, Universitas Gadjah Mada, Yogyakarta, pada bulan Juni 2006. Daun mimba diambil pada saat tanaman mimba belum berbunga dan berbiji.
2. Kultur sel HeLa dari stok Laboratorium Ilmu Hayati Universitas Gadjah Mada 3. Kultur sel Vero dari stok Laboratorium Ilmu Hayati Universitas Gadjah Mada 4. Pereaksi untuk isolasi dan penetapan konsentrasi protein dari daun
Azadirachta indica A. Juss dengan bahan p.a (Merck):
a. larutan dapar natrium fosfat 5mM pH 7,2
b. larutan dapar natrium fosfat 5mM pH 7,2 yang mengandung 0,14 M NaCl c. amonium sulfat
5. Pereaksi untuk uji sitotoksisitas pada sel HeLa dan sel Vero
b. Media penumbuh sel HeLa : RPMI 1640 (Sigma), Foetal Bovine Serum (FBS) 10% (Gibco), Penisilin-Streptomisin 2% (Gibco), dan Fungison 0,5% (Gibco)
c. Media penumbuh sel Vero : M199 (Sigma), Foetal Bovine Serum (FBS) 10% (Gibco), Penisilin-Streptomisin 2% (Gibco), dan Fungison 0,5% (Gibco)
d. Reagen Stopper : natrium dodeksil sulfat 10% dalam HCl 0,01 N (Merck) e. MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide)
5 mg/ml (Sigma) f. Trypsin 0,25% (Sigma)
E. Alat-alat Penelitian
Peralatan yang digunakan dalam penelitian ini antara lain: alat-alat gelas (Pyrex), mortir dan stamper, kain monel, sentrifuge (Sigma K PLC series), spektrofotometer UV (CECIL Serie 2) dan kuvet 1 ml, mikroskop (Olympus Model IMT-2), haemocytometer (Nebauer), laminar air flow (Nuraire Class II type A/B3), inkubator 37ºC, aliran 5% CO2 (Nuraire IR Airflow), 96-well plate
(Nunc), ELISA Reader SLT 340ATC, tissue culture flask, pipet Pasteur, membran / tabung dialisis (Sigma), tangki nitrogen cair, penangas air, almari es (National), mikropipet, timbangan analitik (AND ER-400 H), alumunium foil, magnetic
stirrer, pH meter (TOA electronic HM-5S), mesin vortex (Thermolyne Maximi),
F. Tatacara Penelitian 1. Determinasi tanaman
Bahan utama yang akan digunakan dalam penelitian yaitu daun mimba, telah dideterminasi terlebih dahulu di laboratorium Farmakognosi Fitokimia, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta dan dipastikan juga kebenarannya menggunakan acuan baku (Backer and Backuizen van den Brink, 1963; 1965).
2. Pengumpulan daun mimba
Daun mimba yang digunakan diambil dari pohon mimba yang tumbuh di pekarangan Laboratorium Hayati, Universitas Gadjah Mada, Yogyakarta, pada bulan Juni 2006.
3. Sterilisasi alat dan bahan
Untuk mencegah terjadinya kontaminasi oleh organisme, maka alat-alat yang digunakan dalam penelitian ini harus disterilkan terlebih dahulu. Alat-alat tersebut dicuci dengan larutan sabun hingga bersih dan dikeringkan, setelah itu dibungkus dengan alumunium foil dan disterilkan dalam autoklaf selama 20 menit pada suhu 121oC (Gennaro, 2000).
4. Pembuatan fraksi protein dari daun mimba
Daun segar tanaman Azadirachta indica A. Juss dikumpulkan, diseleksi, dan dicuci bersih dengan air mengalir. Daun dipotong kecil-kecil, tulang daun dibuang dan ditimbang sebanyak 450 gram. Daun kemudian dibungkus dengan kantong plastik bersih dan disimpan dalam freezer –20ºC selama semalam, bersama dengan mortir, stamper, dan juga reagen-reagen yang akan digunakan
untuk proses selanjutnya dimana bahan-bahan tersebut sebelumnya telah disterilkan.
Daun ditumbuk halus dengan penambahan sesedikit mungkin dapar natrium fosfat 5mM pH 7,2 yang mengandung 0,14 M NaCl dalam mortir yang ditempatkan dalam baskom berisi air es. Hasil tumbukan diperas dengan kain monel, ditampung dalam tabung conical yang bersih dan steril. Cairan yang diperoleh disentrifus pada 8000 rpm selama 30 menit. Supernatan dikumpulkan dalam labu ukur 500 ml yang bersih dan steril.
Supernatan yang diperoleh kemudian diendapkan proteinnya dengan menambahkan 27,45 gram amonium sulfat perlahan-lahan sambil terus diaduk menggunakan magnetic stirrer dan dijaga suhunya, kemudian didiamkan selama semalam di dalam lemari es sambil terus diaduk.
Supernatan kemudian disentrifus lagi pada 8000 rpm selama 25 menit. Supernatan (1) ditampung dalam labu ukur 500 ml sedang pelet yang yang diperoleh dilarutkan dengan larutan dapar natrium fosfat 5mM pH 7,2 hingga volumenya mencapai 3 ml.
Supernatan (1) yang telah ditampung ditambahkan dengan 27,47 gram amonium sulfat perlahan-lahan sambil terus diaduk menggunakan magnetic
stirrer selama semalam dan dijaga suhunya dalam lemari es. Selanjutnya
supernatan (1) disentrifus 8000 rpm selama 25 menit. Supernatan (2) ditampung dalam labu ukur 500 ml sedang pelet yang diperoleh dilarutkan dengan larutan dapar natrium fosfat 5mM pH 7,2 hingga volumenya mencapai 3 ml.
Supernatan (2) yang ditampung ditambah dengan 28,35 gram amonium sulfat perlahan-lahan sambil terus diaduk menggunakan magnetic stirrer selama semalam dan dijaga suhunya dalam lemari es. Selanjutnya supernatan (2) disentrifus 8000 rpm selama 25 menit. Supernatan (3) ditampung dalam labu ukur 500 ml sedang pelet yang diperoleh dilarutkan dengan larutan dapar natrium fosfat 5mM pH 7,2 hingga volumenya mencapai 3 ml.
Supernatan (3) ditambah dengan 29,28 gram amonium sulfat perlahan-lahan sambil terus diaduk menggunakan magnetic stirrer selama semalam dan dijaga suhunya dalam lemari es. Selanjutnya supernatan (3) disentrifus 8000 rpm selama 25 menit. Supernatan (4) ditampung dalam labu ukur 500 ml sedang pelet yang diperoleh dilarutkan dengan larutan dapar natrium fosfat 5mM pH 7,2 hingga volumenya mencapai 3 ml.
Langkah selanjutnya dilakukan dialisis dengan memasukkan keempat sampel fraksi protein yang diperoleh tadi ke dalam tabung dialisis dan direndam dalam larutan dapar natrium fosfat 5mM pH 7,2, diaduk menggunakan magnetic
stirrer selama semalam dalam lemari es. Hasil dialisis ditambahkan larutan dapar
natrium fosfat 5mM pH 7,2 yang mengandung 0,14 M NaCl hingga volumenya mencapai 10 ml, sentrifus 8000 rpm selama 20 menit. Pelet dibuang sedang supernatan diambil sebagai sampel fraksi protein dengan konsentrasi 10% jenuh, sampel fraksi protein dengan konsentrasi 20% jenuh, sampel fraksi protein dengan konsentrasi 30% jenuh dan sampel fraksi protein dengan konsentrasi 40% jenuh.
5. Pengukuran konsentrasi protein total
Fraksi protein 10%, 20%, 30% dan 40% jenuh yang diperoleh, masing-masing sebanyak 10 μl kemudian ditambah larutan dapar natrium fosfat 5mM hingga volumenya mencapai 1 ml. Ambil dan masukkan ke dalam kuvet. Ukur serapan dengan spektrofotometer UV pada panjang gelombang 260 nm dan 280 nm dengan blanko larutan dapar natrium fosfat 5mM pH 7,2.
Concentration = [1.55E(280)] – [0.76E(260)] mg ml-1
(Layne cit., Richterich and Colombo, 1981)
6. Propagasi dan panen sel HeLa
a. Propagasi sel HeLa
Sel diambil dari tangki nitrogen cair, lalu dengan segera dicairkan diatas penangas air 37ºC. Ampul disemprot dengan etanol 70% dan dibuka. Sel kemudian dipindahkan ke dalam tabung conical steril yang berisi medium RPMI 1640. Suspensi sel disentrifus 8000 rpm selama 5 menit, supernatan yang didapat dibuang, kemudian medium RPMI diganti dengan yang baru, disuspensikan secara perlahan-lahan. Suspensi sel kemudian disentrifus lagi selama 5 menit. Supernatan dibuang sedang pelet ditambah dengan 1 ml medium penumbuh yang mengandung 20% FBS. Disuspensikan perlahan hingga homogen, kemudian sel ditumbuhkan dalam 3-4 tissue culture flask kecil, diinkubasi dalam inkubator pada suhu 37ºC dengan aliran 5% CO2. Setelah 24 jam, medium diganti dan sel
b. Panen sel HeLa
Setelah jumlah sel cukup, medium RPMI 1640 kemudian diganti dengan medium RPMI 1640 yang baru sebanyak 5 ml. Sel dilepaskan dari dinding flask dengan cara diresuspensikan menggunakan pipet Pasteur. Sel kemudian dipindahkan ke dalam tabung conical steril, ditambah medium RPMI 1640 sampai volume 10 ml dan kemudian disentrifus 8000 rpm selama 5 menit. Supernatan yang didapat dibuang sedang pelet diresuspensi kembali secara perlahan dengan 1 ml media. Jumlah sel dihitung menggunakan haemocytometer. Suspensi sel kemudian ditambahkan sejumlah medium sehingga diperoleh konsentrasi sel sebesar 5 x 104 sel / 200 μl yang akan digunakan untuk penelitian.
7. Propagasi dan panen sel Vero
a. Propagasi sel Vero
Sel diambil dari tangki nitrogen cair, lalu dengan segera dicairkan diatas penangas air 37ºC. Ampul disemprot dengan etanol 70% dan dibuka. Sel kemudian dipindahkan ke dalam tabung conical steril yang berisi medium M199. Suspensi sel disentrifus 8000 rpm selama 5 menit, supernatan yang didapat dibuang, kemudian medium M199 diganti dengan yang baru, disuspensikan secara perlahan-lahan. Suspensi sel kemudian disentrifus lagi selama 5 menit. Supernatan dibuang sedang pelet ditambah dengan 1 ml medium penumbuh yang mengandung 20% FBS. Disuspensikan perlahan hingga homogen, kemudian sel ditumbuhkan dalam 3-4 tissue culture flask kecil, diinkubasi dalam inkubator pada suhu 37ºC dengan aliran 5% CO2. Setelah 24 jam, medium diganti dan sel
b. Panen sel Vero
Setelah jumlah sel cukup (kurang lebih setelah berumur 7 hari), sel dicuci dengan FBS 10% sebanyak 3 ml. Untuk melepaskan sel-sel dari dinding flask, diberi trypsin 0,25% sebanyak 1 ml. Sel dipindahkan dalam tabung conical steril yang sudah berisi M199 sebanyak 7 ml. Kemudian sel dibilas kembali dengan FBS 10% sebanyak 3 ml. Hasil bilasan dituang ke dalam tabung conical yang sama dan disentrifus selama 5 menit. Untuk menghilangkan sisa trypsin, sel dicuci sekali lagi dengan menggunakan medium yang sama. Kemudian pelet ditambah media kultur sebanyak 1 ml. Selanjutnya lakukan perhitungan jumlah sel dengan menggunakan haemocytometer. Suspensi sel ditambah sejumlah medium sehingga memperoleh konsentrasi sel sebesar 2,5x104/100 μl dan siap dipakai untuk penelitian (Freshney, 1986; Jacoby and Pastan, 1979; Sambrook et al, 1989).
8. Uji sitotoksisitas terhadap sel HeLa dan sel Vero
a. Uji sitotoksisitas dengan metode MTT terhadap sel HeLa
Seratus μl suspensi sel HeLa dengan konsentrasi 5 x 104 sel / 200 μl dimasukkan ke dalam sumuran-sumuran pada 96-well plate dan diinkubasi bersama fraksi protein satu seri kadar selama 24 jam. Replikasi dilakukan sebanyak 5 kali dengan memberikan perlakuan yang sama terhadap 11 baris sumuran. Sebagai kontrol, 100 μl suspensi sel ditambahkan ke dalam sumuran yang berisi medium RPMI 1640 dan dapar natrium fosfat 5mM pH 7,2 sedangkan untuk faktor koreksi, 100 μl sampel ditambahkan ke dalam sumuran yang berisi medium RPMI 1640 dan dapar natrium fosfat 5mM pH 7,2. Selanjutnya sel diinkubasikan dalam inkubator dengan aliran 5% CO2 pada suhu 37ºC. Pada akhir
inkubasi, pada masing-masing sumuran ditambahkan 10 μl MTT 5 mg/ml, dan diinkubasi lagi semalam pada suhu 37ºC. Sel yang hidup akan bereaksi dengan MTT membentuk kristal formazan berwarna ungu. Reaksi MTT dihentikan dengan penambahan reagen stopper, diinkubasi lagi selama semalam pada suhu kamar. Kemudian serapan dapat dibaca dengan ELISA Reader pada panjang gelombang 550 nm.
b. Uji sitotoksisitas dengan metode MTT terhadap sel Vero
Seratus μl suspensi sel Vero dengan konsentrasi 5 x 104 sel / 200 μl dimasukkan ke dalam sumuran-sumuran pada 96-well plate dan diinkubasi bersama fraksi protein satu seri kadar selama 24 jam. Replikasi dilakukan sebanyak 5 kali dengan memberikan perlakuan yang sama terhadap 11 baris sumuran. Sebagai kontrol, 100 μl suspensi sel ditambahkan ke dalam sumuran yang berisi medium M199 dan dapar natrium fosfat 5mM pH 7,2 sedangkan untuk faktor koreksi, 100 μl sampel ditambahkan ke dalam sumuran yang berisi medium M199 dan dapar natrium fosfat 5mM pH 7,2. Selanjutnya sel diinkubasikan dalam inkubator dengan aliran 5% CO2 pada suhu 37ºC. Pada akhir inkubasi, pada
masing-masing sumuran ditambahkan 10 μl MTT 5 mg/ml, dan diinkubasi lagi semalam pada suhu 37ºC. Sel yang hidup akan bereaksi dengan MTT membentuk kristal formazan berwarna ungu. Reaksi MTT dihentikan dengan penambahan
reagen stopper, diinkubasi lagi selama semalam pada suhu kamar. Kemudian
G. Analisis Hasil
Prosentase kematian sel pada metode MTT adalah selisih absorbansi kontrol dengan absorbansi perlakuan dibagi absorbansi kontrol dikalikan 100% atau : Persen kematian = kontrol sel) tanpa perlakuan -(perlakuan -kontrol x 100%
(Meyer, Ferrigni, Putnam, Jacobsen, Nochols, Mc Laughlin, 1982) Hasil uji berupa prosentase kematian sel tersebut kemudian dianalisis secara statistik menggunakan analisis probit untuk mengetahui konsentrasi protein yang dapat mengakibatkan kematian 50% populasi sel HeLa maupun sel Vero (LC50). Analisis statistik menggunakan uji t-independent sample dilakukan untuk
membandingkan daya sitotoksisitas fraksi protein daun mimba terhadap sel HeLa dengan sel Vero.
BAB IV
HASIL DAN PEMBAHASAN
A. Preparasi Fraksi Protein Daun Mimba
Daun segar tanaman Azadirachta indica A. Juss yang telah dikumpulkan dan diseleksi, dicuci bersih dengan air mengalir supaya pengotor-pengotor yang menempel pada daun dapat dihilangkan. Daun dipotong dari tangkainya, kemudian digerus dengan penambahan larutan dapar natrium fosfat 5mM pH 7,2 yang mengandung 0,14 M NaCl sedikit demi sedikit dalam mortir yang ditempatkan dalam wadah berisi air es. Larutan dapar digunakan untuk menjaga stabilitas, sedangkan kandungan NaCl di dalam larutan dapar tersebut berfungsi untuk mempermudah kelarutan protein yang terkandung di dalam daun tanaman mimba. Penggerusan daun dalam mortir yang ditempatkan dalam wadah berisi air es dimaksudkan untuk menjaga temperatur percobaan supaya protein daun tetap stabil dan tidak mengalami kerusakan. Ekstrak gubal yang diperoleh dari 450 gram daun mimba sebanyak 515 ml.
Pembuatan fraksi protein daun mimba (Azadirachta indica A. Juss) dilakukan dengan cara pengendapan protein menggunakan amonium sulfat. Mekanisme pengendapan protein dengan penambahan amonium sulfat ini disebut
salting out. Amonium sulfat memiliki ion anorganik yang berkompetisi dengan
molekul protein dalam mengikat air. Amonium sulfat dapat mengikat air lebih banyak daripada protein karena sifat amonium sulfat lebih polar dibandingkan protein sehingga kelarutan protein dalam air menurun dan dapat mengendap.
Fraksi protein dibuat secara bertingkat dengan menambahkan amonium sulfat dalam jumlah tertentu hingga mencapai kejenuhan 10%, 20%, 30%, dan 40%. Fraksi protein 10% jenuh (FP10) diperoleh dengan menambahkan amonium
sulfat sebanyak 27,45 gram ke dalam ekstrak gubal yang pertama kali diperoleh yaitu 515 ml. Fraksi protein 20% jenuh (FP20) diperoleh dengan menambahkan
amonium sulfat sebanyak 27,47 gram ke dalam 500 ml ekstrak gubal dari pembuatan fraksi protein 10%. Fraksi protein 30% jenuh (FP30) diperoleh dengan
menambahkan amonium sulfat sebanyak 28,35 gram ke dalam 500 ml ekstrak gubal dari pembuatan fraksi protein 20%. Fraksi protein 40% jenuh (FP40)
diperoleh dengan menambahkan amonium sulfat sebanyak 29,28 gram ke dalam 500 ml ekstrak gubal dari pembuatan fraksi protein 30%.
Fraksi protein yang telah diperoleh kemudian dimurnikan dari amonium sulfat yang ikut terendapkan bersama protein dengan cara dialisis. Tabung dialisis dipanaskan dalam larutan EDTA-NaHCO3 untuk membersihkan tabung dialisis
tersebut dari bahan kimia yang tertinggal pada saat pembuatannya. Masing-masing fraksi protein dimasukkan ke dalam tabung dialisis terpisah tetapi direndam di dalam satu beaker glass yang berisi larutan dapar natrium fosfat 5mM pH 7,2 dengan pengadukan menggunakan magnetic stirrer selama semalam dan dijaga suhunya. Hal ini dilakukan supaya kejenuhan tidak hanya terjadi di sekitar tabung dialisis tetapi merata di seluruh isi beaker glass sehingga proses dialisis ini dapat berlangsung sempurna. Proses dialisis terjadi dengan mekanisme difusi pasif karena konsentrasi amonium sulfat di dalam tabung dialisis lebih tinggi daripada di luar tabung dialisis sehingga amonium sulfat akan keluar dari
tabung dialisis ke dalam beaker glass yang berisi larutan dapar natrium fosfat 5mM pH 7,2. Tabung dialisis bersifat semipermeabel dan mempunyai pori yang hanya mengeluarkan partikel-partikel kecil yang berukuran kurang dari 15.000-20.000 Dalton, misalnya partikel amonium sulfat, sedangkan protein yang merupakan makromolekul akan tersaring dan tetap tertinggal di dalam tabung dialisis. Pada saat dialisis dilakukan penggantian larutan dapar guna menjaga perbedaan konsentrasi amonium sulfat yang berada di dalam tabung dialisis dan yang berada di luar tabung dialisis tetap besar sehingga konsentrasi amonium sulfat di dalam larutan dapar tidak terlalu jenuh serta mekanisme difusi pasif tetap terjadi. Proses dialisis dilakukan selama satu malam dan diharapkan amonium sulfat dapat dikeluarkan semua dari sampel sehingga diperoleh fraksi protein murni. Penggunaan larutan dapar berfungsi menjaga nilai pH. Nilai pH larutan dapar dipengaruhi oleh perubahan temperatur. Oleh sebab itu, selama proses dialisis temperatur tetap dijaga dengan melakukan dialisis di dalam lemari es.
B. Penetapan Konsentrasi Fraksi Protein
Fraksi protein yang telah diperoleh selanjutnya ditetapkan konsentrasinya secara kolorimetri dengan menggunakan spektrofotometer ultraviolet pada panjang gelombang 280 nm dan 260 nm. Metode ini digunakan karena protein di dalam daun mimba mengandung residu asam amino tirosin, triptofan dan fenilalanin yang strukturnya mempunyai kromofor dan auksokrom sehingga mampu mengabsorpsi sinar secara maksimal pada panjang gelombang 280 nm. Penetapan konsentrasi fraksi protein juga dilakukan pada panjang gelombang 260