BAHAN DAN METODE
Subyek Penelitian
Penelitian ini menggunakan dua isolat Bacillus sp. yaitu B. licheniformis MB-2 dan Bacillus sp. MTS. B. licheniformis MB-2 adalah bakteri yang diisolasi dari sumber air panas Gn. Tompaso-Manado Sulawesi Utara yang tumbuh pada suhu 55oC dan pH 6.5. B. licheniformis MB-2 dilaporkan menghasilkan tiga fraksi kitosanase berukuran 75, 70.8 dan 55.9 kDa (Chasanah et al. 2006) dan kitinase berukuran 67 dan 102 kDa (Toharisman et al. 2005). Bacillus sp. MTS merupakan bakteri yang diisolasi dari tanah belerang Gn. Tangkuban Perahu-Bandung Jawa Barat yang tumbuh pada suhu 37oC dan pH 7.5. Bacillus sp. MTS dilaporkan menghasilkan enzim-enzim ekstraseluler yang mampu menghidrolisis berbagai substrat protein yaitu tepung bulu ayam, sarang laba-laba, kasein, albumin, gelatin, hemoglobin, kolagen, fibrinogen dan elastin (Ariesandi 2007).
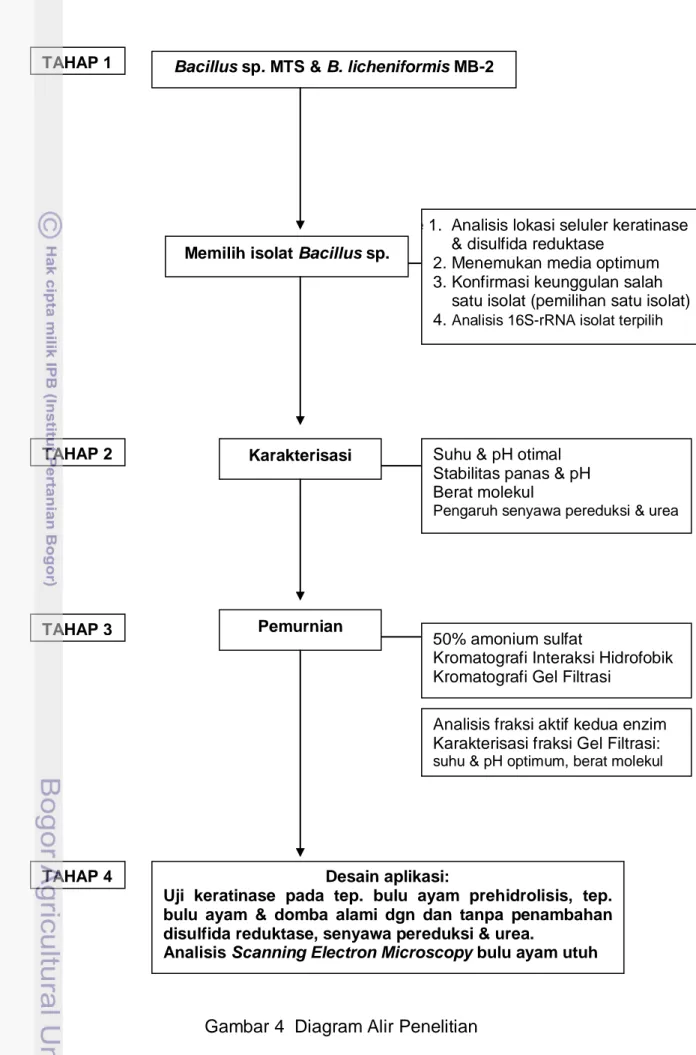
Strategi Penelitian
Tahap 1 Memilih Isolat Bacillus sp. Pendegradasi Keratin serta Identifikasi 16S-rRNA Isolat Terpilih.
Tujuan penelitian tahap pertama adalah memilih dua isolat bakteri yaitu B. licheniformis MB-2 dan Bacillus sp. MTS berdasar kemampuan mendegradasi keratin alami dan produksi enzim serta identifikasi 16S-rRNA isolat terpilih.
Metodologi yang digunakan adalah menumbuhkan kedua isolat dalam media cair berisi bulu ayam utuh, beberapa keratin alami dan dalam tiga jenis media produksi. Metode untuk identifikasi bakteri adalah isolasi DNA total, amplifikasi dan analisis 16S-rRNA isolat terpilih. Parameter yang diukur dan diamati yaitu kemampuan menghancurkan bulu ayam utuh, susut berat keratin alami, kemampuan produksi keratinase dan disulfida reduktase, lokasi seluler kedua enzim dan sekuen DNA isolat terpilih. Output tahap pertama adalah isolat Bacillus sp. yang telah teruji kemampuannya dalam menghasilkan enzim-enzim keratinolitik, informasi lokasi seluler dan media produksi terbaik kedua enzim serta identitas isolat terpilih.
Tahap 2 Karakterisasi Keratinase dan Disulfida Reduktase.
Tujuan penelitian tahap kedua adalah melakukan karakterisasi keratinase dan disulfida reduktase ekstraseluler Bacillus sp. MTS.
Metodologi yang digunakan adalah uji aktivitas enzim, SDS-PAGE dan zymografi. Parameter yang diukur dan diamati yaitu berat molekul, pH dan suhu optimum, ketahanan terhadap panas dan pH, pengaruh senyawa pereduksi dan urea. Output tahap ini adalah informasi karakteristik kedua enzim baik enzim kasar maupun enzim murni.
Tahap 3 Pemurnian Keratinase dan Disulfida Reduktase
Tujuan penelitian tahap ketiga adalah melakukan pemurnian keratinase dan disulfida reduktase ekstraseluler Bacillus sp. MTS serta karakterisasi kedua enzim murni.
Metodologi yang digunakan adalah pengendapan amonium sulfat, dialisis, kromatografi interaksi hidrofobik, gel filtrasi, dan uji aktivitas enzim. Parameter yang diukur dan diamati yaitu aktivitas kedua enzim dalam fraksi-fraksi hasil pemurnian, suhu dan pH optimum fraksi murni kedua enzim. Output tahap ini adalah enzim keratinase dan disulfida reduktase murni dengan tingkat kemurnian dan aktivitas spesifik tinggi serta informasi suhu dan pH otimum kedua enzim murni.
Tahap 4 Aktivitas Keratinase Murni pada Keratin Alami dengan Penambahan Senyawa Pereduksi, Urea dan Disulfida Reduktase Murni (Desain Aplikasi)
Tujuan penelitian tahap keempat adalah mengetahui keterlibatan disulfida reduktase, senyawa pereduksi dan urea dalam degradasi keratin bulu ayam dan domba alami serta bulu ayam prehidrolisis NaOH..
Metodologi yang digunakan adalah uji aktivitas keratinase murni dengan maupun tanpa penambahan disulfida reduktase, senyawa pereduksi, dan urea pada keratin bulu ayam dan domba alami serta bulu ayam prehidrolisis NaOH. Analisis SEM bulu ayam utuh akibat hidrolisis oleh keratinase murni dengan maupun tanpa penambahan disulfida reduktase dan DTT. Parameter yang diukur dan diamati yaitu aktivitas enzim dan tingkat kerusakan selongsong bulu utuh. Output tahap ini adalah informasi formula terbaik untuk degradasi keratin bulu ayam dan domba.
Gambar 4 Diagram Alir Penelitian
Bacillus sp. MTS & B. licheniformis MB-2
Suhu & pH otimal Stabilitas panas & pH Berat molekul
Pengaruh senyawa pereduksi & urea Memilih isolat Bacillus sp.
Karakterisasi
Pemurnian
Desain aplikasi:
Uji keratinase pada tep. bulu ayam prehidrolisis, tep. bulu ayam & domba alami dgn dan tanpa penambahan disulfida reduktase, senyawa pereduksi & urea.
Analisis Scanning Electron Microscopy bulu ayam utuh TAHAP 1
TAHAP 2
TAHAP 3
TAHAP 4
50% amonium sulfat
Kromatografi Interaksi Hidrofobik Kromatografi Gel Filtrasi
Analisis fraksi aktif kedua enzim Karakterisasi fraksi Gel Filtrasi: suhu & pH optimum, berat molekul e 1. Analisis lokasi seluler keratinase
& disulfida reduktase
2. Menemukan media optimum 3. Konfirmasi keunggulan salah satu isolat (pemilihan satu isolat) 4. Analisis 16S-rRNA isolat terpilih
Metode Penelitian
Pemilihan Isolat
Media Pertumbuhan dan Produksi
Bacillus sp. MTS ditumbuhkan pada media agar mengandung 0.05% K2HPO4, 0.04% KH2PO4, 0.05% NaCl, 1% tepung bulu ayam, dan 2% agar (modifikasi Macedo et al. 2005). Enzim keratinase Bacillus sp. MTS diproduksi dalam media cair minimal (media basal/media A) dengan komposisi: 0.05% NH4Cl, 0.05% NaCl, 0.03% K2HPO4, 0.01% MgCl2. 6 H2O, dan 0,6% tepung bulu ayam (modifikasi Lin et al. 1992). Kondisi produksi adalah pH 7.5, suhu 37oC, agitasi 100 rpm, dan lama produksi dua hari.
B. licheniformis MB-2 ditumbuhkan pada media agar mengandung 0.1% K2HPO4, 0.1% NaCl, 0.01% MgSO4. 7H2O, 0.7% (NH44)2SO4, 1% koloidal kitin, 0.1% ekstrak kamir, 0.1% tripton, 0.5% gelrite dan 1.5% agar (Toharisman et al. 2005). Enzim keratinase B. licheniformis MB-2 diproduksi dalam media cair (media basal/media A) dengan komposisi 0.1% K2HPO4, 0.1% NaCl, 0.01% MgSO4. 7H2O, 0.07% (NH44)2SO4, 0.01% ekstrak kamir, 0.01% tripton, dan substrat 0.6% tepung bulu (media basal/media A). Kondisi produksi adalah pH 6.5, suhu 55o
Kemampuan Degradasi Kedua Isolat Pada Keratin Alami C, agitasi 100 rpm, dan lama produksi empat hari.
Produksi enzim kedua isolat menggunakan inokulum bakteri yang ditumbuhkan dalam media Luria Broth berumur 16-18 jam. Inokulum yang dipakai sebanyak 10% (v/v) dari total media produksi.
Untuk mengetahui kemampuan degradasi kedua isolat pada substrat protein alami, maka kedua bakteri ditumbuhkan dalam media basal cair yang mengandung rambut manusia, kokon, benang sutera, dan sisik ikan. Lama inkubasi B. licheniformis MB-2 berlangsung 12 hari pada 55oC, sedangkan Bacillus sp. MTS enam hari pada 37o
Penentuan Lokasi Seluler Kedua Enzim
C. Semua substrat ditimbang dan dicatat beratnya sebelum dan sesudah inkubasi.
Pada tahap ini sebagai sumber enzim adalah cairan ekstraseluler dan intraseluler. Cairan ekstraseluler diperoleh dengan cara menyaring kultur media hasil inkubasi 48 jam dengan kertas saring Whatman 40, kemudian disentrifugasi
10.000 rpm, 4oC selama 10 menit. Filtrat yang diperoleh digunakan untuk pengujian aktivitas enzim ekstraseluler. Pelet sel yang diperoleh dicuci 3 kali dengan 0.05 M bufer Tris-HCl pH 7.0 kemudian dilisis menggunakan SONIPREP 150 dengan frekuensi 15 mA selama 8 menit. Setelah disentrifus 10.000 rpm, 4o
Pemilihan Media Produksi Enzim
C selama 10 menit maka filtrat yang diperoleh digunakan untuk pengujian aktivitas enzim intraseluler.
Kadar protein enzim diukur menggunakan metode Bradford pada λ 595 nm dengan BSA (Bovine Serum Albumin) sebagai standar (Waterborg 2002).
Untuk menentukan media terbaik bagi produksi kedua enzim, maka ke dalam media basal Bacillus sp. MTS dan B. licheniformis MB-2 ditambahkan ekstrak kamir dan tripton (sumber nitrogen) serta glukosa (sumber karbon). Media A adalah media basal (medium produksi) masing-masing bakteri. Media B berisi media A + 0.02% ekstrak kamir dan 0.02% tripton, sedangkan media C berisi media B + 0.02% glukosa.
Kondisi produksi untuk Bacillus sp. MTS adalah pH 7.5 dan suhu 37oC, sedangkan B. licheniformis MB-2 pada pH 6.5, suhu 50oC dan keduanya diagitasi pada 100 rpm selama enam hari inkubasi. Inokulum bakteri yang digunakan berumur 16-18 jam sebanyak 10% (v/v) dari total media produksi. Setiap hari dilakukan pengambilan cuplikan contoh untuk diukur kadar protein, aktivitas keratinase, dan disulfida reduktasenya.
Uji Aktivitas Keratinase
Penelitian ini menggunakan dua jenis substrat yaitu azokeratin dan tepung bulu ayam yang telah dihidrolisis menggunakan NaOH. Azokeratin digunakan pada tahap seleksi isolat, penentuan lokasi seluler kedua enzim dan karakterisasi ekstrak kasar enzim (kecuali efek senyawa pereduksi dan urea). Tepung bulu ayam yang telah dihidrolisis digunakan pada tahap pemurnian, karakterisasi enzim murni, studi keterlibatan disulfida reduktase, dan desain aplikasi.
Azokeratin dibuat berdasar prinsip reaksi antara keratin dengan diazotized aryl amine yang akan membentuk turunan kromoporik sulfanilii acid-azokeratin. Cara pembuatan azokeratin adalah: dibuat larutan A yang terdiri atas 1.5 g keratin bulu, 10 ml 10% NaHCO3, dan 90 ml akuades. Larutan A diaduk
semalam pada suhu dingin selanjutnya disaring dengan glasswool. Dibuat larutan B yang terdiri atas 0,865 g sulfanilic acid, 20 ml 0.12M NaOH dan 0.17 g NaNO2.Larutan B diaduk hingga larut kemudian tambahkan 10 ml 5M HCl, aduk kembali selama dua menit, selanjutnya ditambahkan 10 ml 5N NaOH. Larutan A dengan B digabungkan sambil terus diaduk selama lima menit. Larutan didialisis dalam akuades pada suhu 4oC semalam dengan mengganti akuades 2-3 kali. Kering-bekukan larutan, hasilnya disimpan dalam botol gelap 4oC. Azokeratin berwarna merah orange gelap (Riffel et al. 2003a).
Prosedur pengujian aktivitas keratinase menggunakan azokeratin adalah: sebanyak 200 μl enzim direaksikan dengan 400 μl azokeratin (10 g azokeratin dalam 50 mM bufer Tris-Cl pH 8.0) dan 400 μl bufer. Campuran reaksi diinkubasi pada suhu 55oC selama 15 menit, kemudian ditambah 630 μl 0.1M TCA (trichloroacetic acid) dan didiamkan selama 20 menit pada 37oC. Campuran reaksi disentrifugasi 10.000 rpm pada 4o
Blanko (μl) Sampel (μl) C selama 5 menit. Selanjutnya baca hasil pengujian menggunakan spektrofotometer pada λ 440 nm. Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang dapat menyebabkan perubahan absorbansi sebesar 0.01 pada λ 440 nm pada kondisi uji (Riffel et al. 2003a).
Tabel 9 Prosedur analisis aktivitas keratinase
Bufer Tris-Cl 0.05M pH 8.0 250 250 Keratin bulu 1% (b/v) 250 250 Enzim - 50 Akuades 50 -
Inkubasi pada suhu 50o
Trichloroacetic acids (0.1M) 500 500 Akuades - 50 C, selama 60 menit Enzim 50 - Inkubasi 37o Filtrat 375 375 Na
C, 10 menit. Kemudian sentrifugasi 6000 rpm selama 8 menit
2CO3
Folin ciocalteau (1 : 2) 250 250 1250 1250
Preparasi bulu ayam untuk substrat uji keratinase diawali dengan menghidrolisis bulu ayam utuh dalam akuades yang mengandung NaOH. Sebanyak 20 g bulu ayam dididihkan dalam akuades yang mengandung NaOH. Larutan dinetralkan menggunakan HCl untuk kemudian ditiriskan. Keringkan bulu ayam dalam oven 50o
Uji aktivitas Disulfida Reduktase
C selama dua hari. Setelah kering, bulu ayam dipotong-potong kemudian digiling dan diayak. Larutan 1% tepung bulu ayam dipakai sebagai substrat uji keratinase dengan metode Walter (1984) yang dimodifikasi yaitu menggunakan substrat 1% tepung bulu ayam dan pengukuran produk hidrolisis memakai kurva standar tirosin. Campuran reaksi dan proses pengujian keratinase dengan metode Walter (1984) dapat dilihat dalam Tabel 9.
Satu unit aktivitas keratinase diukur sebagai jumlah enzim yang melepaskan satu μmol tirosin/menit. Perhitungan aktivitas keratinolitik berdasarkan pada kurva standar tirosin.
Aktivitas disulfida reduktase diukur menggunakan metode Serrano et al. (1984) yang dimodifikasi, yaitu dengan menggunakan pereaksi DTNB {5,5’-dithiobis(2-nitrobenzoic acid)} dan dibaca pada panjang gelombang 405 nm. Campuran reaksi berisi 0,13 mM bufer Tris-Cl pH 9.0; 0.05 mM EDTA; 0.05 mM glutation teroksidasi (GSSG) dan 50 μl enzim diinkubasi pada suhu ruang (28o
Identifikasi isolat terpilih penghasil keratinase dideterminasi dengan menggunakan sekuen 16S-rRNA. Analisis pembanding sekuen DNA dilakukan dengan program Basic Local Aligment Search Tool dari National Center for Biotechnology Information. Untuk mengetahui sekuen 16S-rRNA bakteri dilakukan langkah-langkah sebagai berikut:
C) selama 10 menit. Campuran reaksi disentrifus pada 5.000 rpm selama 10 menit. Sebanyak 50 μl filtrat direaksikan dengan 100 μl 20 mM DTNB dan 1350 μl bufer Tris-Cl pH 9.0. Setelah 2 menit, segera baca campuran reaksi pada λ 405 nm. Warna kuning yang terbentuk merupakan produk TNB dalam bentuk tereduksi. Blanko berisi semua pereaksi namun GSSG digantikan dengan buffer. Satu unit aktivitas didefinisikan sebagai jumlah enzim yang diperlukan untuk melepas satu μmol sulfidril/menit pada kondisi uji. Perhitungan aktivitas reduktase berdasarkan pada kurva standar glutation tereduksi (GSH).
Isolasi DNA total bakteri
Isolasi DNA total bakteri dilakukan dilakukan sebagai berikut : Isolat bakteri termofil yang telah diketahui morfologinya dikultur dalam medium Luria Bertani selama 14–16 jam, suhu 37oC, 170 rpm. Sebanyak 10 ml suspensi bakteri disentrifugasi dengan kecepatan 6000 rpm selama 2 menit. Supernatan dibuang dan pelet bakteri dicuci dengan menambahkan 1 ml buffer TE 1x dan disentrifugasi pada kecepatan 6000 rpm, 2 menit. Kemudian pelet diambil dan ditambahkan 760 μl bufer TE 1 x, selanjutnya ditambahkan lisozim 10 μl, agar hasilnya optimal diinkubasi selama 130 menit, 37oC. Kemudian tambahkan 40 μl SDS 10% dan proteinase-K 10 mg/ml. Tabung ditutup kemudian dibolak balik secara perlahan-lahan dan inkubasi pada suhu 37oC, 1 jam. Selanjutnya ditambahkan 100 μl 10% CTAB/5 M NaCl yang telah dipanaskan pada suhu 65oC dan diinkubasi selama 20 menit 65oC. Selanjutnya ditambahkan 500 μl campuran (fenol : kloroform : isoamilalkohol = 25 : 24 : 1) dan dikocok kuat dengan voteks, kemudian sentrifugasi pada 10 000 rpm selama 10 menit. Supernatan (cairan bagian atas) dipipet dan dimasukkan dalam tabung mikro yang baru. Selanjutnya ditambahkan 600 μl propanol dingin dan diinkubasi pada -20oC selama 20 menit, dan sentrifugasi pada kecepatan maksimal selama 2 menit. Supernatan dibuang dan pelet (DNA) dikeringkan anginkan kemudian ditambahkan 50 μl ddH2O dan simpan pada suhu -20oC.
Amplifikasi dan analisis sekuen gen 16S-rRNA dengan Polymerase Chain Reaction (PCR)
DNA template yang telah dimurnikan sebanyak 0,4-0,5 μl (± 200 ng) diampifikasi dengan kit Ready-To-Go PCR Beads (Pharmacia, Biotech) menggunakan primer universal yang spesifik prokariot (Marchesi et al. 1998) yaitu : 63f (5’–CGA GCC TAA CAC ATG CAA GTC) dan 1387r (5’– GGG CGG WGT GTA CAA GGC). Ke dalam tabung eppendrof baru steril dimasukkan 18,5 μl ddH2O ; 2,5 μl buffer; 1,0 μl primer 63f ; 1,0 μl 1387r; 0,5 μl dNTP mix; 1,0 μl DNA polimerase; dan 0,5 μl DNA template, kemudian diaplikasikan pada alat Gene Amp®PCR System pada kondisi : Pre-PCR (94oC, 2 menit), Denaturasi (95oC, 30 detik), Anneling atau pelekatan primer (55oC, 30 detik), Elongasi atau perpanjangan primer (72oC, 1 menit) selama 30 siklus, Post-PCR (75oC, 5 menit). Gen 16S-rRNA disekuen lengkap di Laboratorium Bioteknologi pada Fakultas Teknobiologi Universitas Katolik Atma Jaya-Jakarta.
Karakterisasi Enzim
Karakterisasi enzim dilakukan terhadap enzim kasar dan enzim keratinase dan disulfida reduktase murni. Saat karakterisasi enzim kasar, uji keratinase masih menggunakan substrat azokeratin dengan metode Riffel et al. (2003a). Sedangkan enzim murni dikarakterisasi menggunakan substrat tepung bulu ayam prehidrolisis dengan metode Walter (1984) yang dimodifikasi. Uji disulfida reduktase menggunakan metode Serrano et al. (1984) yang dimodifikasi dengan substrat glutation teroksidasi (GSSG).
Penentuan Berat Molekul
Penentuan berat molekul enzim dilakukan menggunakan metode SDS-PAGE (Walker 2002) dengan komposisi gel penahan sebesar 4% dan gel pemisah 10% (Tabel 10). Sebelum dimasukkan ke dalam sumur gel, sampel dicampur dengan bufer sampel (rasio 1:4) kemudian dipanaskan 100o
Tabel 10 Komposisi gel penahan dan gel pemisah SDS-PAGE.
C selama 3 menit. Elektroforesis dilakukan pada tegangan 100 volt dan 50 A selama 1.5 jam. Selanjutnya gel diwarnai menggunakan metode pewarnaan perak Vorum (Moertz et al. 2001). Berat molekul enzim diukur dengan standar berat molekul rendah (LMW low molecular weight) berisi α-laktalbumin (14.4 kDa), tripsin inhibitor (20.1 kDa), karbonik anhidrase (30 kDa), bovine serum albumin (66 kDa), dan fosforilase b (97 kDa).
Pereaksi Gel penahan 4% (μl) Gel Pemisah 8% (μl)
Larutan A 670 2700 Larutan B ---- 2500 Larutan C 1250 ---- Akuades 3000 4800 10 % APS 50 100 TEMED 5 10
Keterangan : TEMED N,N,N’,N’-tetramethylenediamine APS amonium peroxodisulfat
Komposisi larutan A, B dan C terdapat dalam Lampiran 1.
Deteksi berat molekul berdasar aktivitas enzim secara insitu dilakukan dengan teknik analisis zymografi (Bressollier et al. 1999) Enzim diaplikasikan pada gel elektroforesis tanpa pemanasan. Analisis zymografi menggunakan metode SDS-PAGE dengan komposisi gel penahan 4% dan gel pemisah 8%
yang mengandung 0.4% gelatin. Bufer sampel pada analisis zymografi tidak mengandung β-merkaptoetanol. Elektroforesis dilakukan pada tegangan 70 volt dan 35 A selama 2-3 jam. Setelah elektroforesis, gel dicuci dengan 2.5% (v/v) Triton X-100 selama 60 menit, dilanjutkan inkubasi gel dalam 50 mMTris-HCl (pH 8.0) semalam pada 55°C. Gel kemudian diwarnai menggunakan Coomassie
Suhu dan pH Optimal
Penentuan suhu optimum dilakukan dengan mereaksikan enzim dengan substrat dalam 0.05 M bufer Tris-HCl pH 8.0. dan diinkubasi pada suhu 28, 37, 50, 60, 70, 80, 90, dan 95
brilliant blue R-250 dan dicuci dengan larutan pencuci. Pita protease akan tampak sebagai daerah bening yang dikelilingi oleh warna biru.
oC selama 15 menit. Penentuan pH optimum dilakukan dengan mereaksikan enzim dan substrat pada pH 4.0-12 (bufer universal) pada suhu optimal selama 15 menit. Komposisi bufer universal adalah 0.029 M larutan A (asam sitrat, KH2PO4, H3BO3
Stabilitas Terhadap Panas dan pH.
Pengujian stabilitas panas dilakukan dengan memanaskan enzim fraksi dialisis pada suhu 55, 70, 80, dan 90
, asam dietilbarbiturat) dan 0.2 N NaOH.
o
Pengaruh Senyawa Pereduksi dan Pendenaturasi
Senyawa pereduksi yang digunakan dalam pengujian adalah β-merkaptoetanol (BMT) dan dithiothreitol (DTT) serta urea sebagai senyawa pendenaturasi. Konsentrasi senyawa pereduksi dan urea adalah 0, 0.1 mM, 0.2 mM, dan 0.3 mM. Konsentrasi stok larutan DTT, BMT dan urea adalah 10 mM.
C masing-masing selama 15, 30, dan 45 menit. Pengujian stabilitas pH dilakukan dengan mereaksikan enzim pada berbagai tingkatan pH 8.0-11.0 selama 15, 30, dan 45 menit menggunakan bufer universal. Selanjutnya aktivitas keratinase dan disulfida reduktase diukur menggunakan spektrofotometer. Hasil analisis kuantitatif tersebut dikonfirmasi secara visual menggunakan teknik analisis zymografi dengan substrat 0.4% gelatin (Bressolier et al. 1999).
Sebelum dilakukan pengukuran aktivitas keratinase, substrat dipreinkubasi dengan agens pereduksi dan urea selama 15 menit pada
temperatur ruang. Selanjutnya ditambahkan enzim kasar dan diinkubasi pada kondisi optimum reaksi.
Pemurnian
Pengendapan Amonium Sulfat dan Dialisis
Tahap pemurnian diawali dengan menumbuhkan bakteri dalam media produksi pada kondisi optimal. Sebanyak 800 ml filtrat bebas sel kemudian diendapkan menggunakan 50% (b/v) amonium sulfat atau 73% kejenuhan. Setelah diendapkan semalam dalam ruang dingin 4oC, larutan disentrifugasi pada 10.000 rpm selama 30 menit. Pelet enzim yang diperoleh dilarutkan dalam 50 mM bufer Tris-Cl pH 8.0 sebanyak 1-2 kali volume. Proses dialisis menggunakan membran dialisis (SIGMA) berukuran cut off 12 kDa dalam bufer 20 mM bufer Tris-Cl pH 8.0 selama lima jam, di dalam ruang dingin bersuhu 4o
Tahap pelaksanaan: matriks di dalam kolom disetimbangkan dengan 40 ml 30% amonium sulfat dalam 50 mM bufer Tris-Cl pH 8.0. Masukkan 1.5 ml enzim ke dalam kolom kemudian dielusi secara berurutan menggunakan 60 ml 30% amonium sulfat dalam bufer; 60 ml 15% amonium sulfat dalam bufer dan terakhir 60 ml bufer Tris-Cl pH 8.0. Pada tahap ini laju alir diatur pada 0.5 ml/menit dan volume satu fraksi adalah 3 ml. Fraksi-fraksi yang diperoleh dari hasil elusi dengan gradien amonium sulfat 30-0% diukur kadar proteinnya menggunakan spektrofotometer pada λ 280 nm dan diukur aktivitas keratinase dan disulfida reduktasenya. Fraksi dengan aktivitas keratinase dan disulfida
C dan dilakukan penggantian bufer sebanyak dua kali. Selanjutnya enzim siap diaplikasikan ke dalam kolom kromatografi.
Kromatografi Interaksi Hidrofobik
Pemurnian menggunakan kolom kromatografi dilakukan melalui tiga tahap yaitu tahap persiapan, tahap pelaksanaan, dan tahap pencucian. Tahap persiapan: sebanyak 30 ml matriks Butyl sepharose FF (bentuk slurry dalam 20% etanol) dibersihkan dari oksigen dengan dipompa vakum. Secara hati-hati matriks dialirkan ke dalam kolom berukuran volume 20 ml dengan diameter 10 mm (10/20). Selanjutnya matriks dibersihkan dari etanol dengan mengalirkan 100 ml air bebas ion.
reduktase tertinggi dipilih dan dipekatkan menggunakan polietilenglikol (PEG) 6000 untuk diaplikasikan ke kolom Sephacryl S-200HR.
Tahap pencucian: sebelum matriks disimpan, matriks dicuci berturut-turut menggunakan air bebas ion, 0.2 N NaOH, dan air bebas ion masing-masing sebanyak 100 ml. Selanjutnya matriks disimpan dalam 20% etanol pada suhu dingin.
Kromatografi Gel Filtrasi
Pemurnian menggunakan kolom kromatografi dilakukan melalui tiga tahap yaitu tahap persiapan, tahap pelaksanaan, dan tahap pencucian. Tahap persiapan: sebanyak 60 ml matriks Sephacryl S-200HR (bentuk slurry dalam 20% etanol) dibersihkan dari oksigen dengan cara dipompa vakum. Secara hati-hati, matriks dialirkan ke dalam kolom berukuran volume 40 ml dengan diameter 10 mm (10/40). Selanjutnya matriks dibersihkan dari etanol dengan mengalirkan 200 ml air bebas ion.
Tahap pelaksanaan: matriks dalam kolom disetimbangkan menggunakan 120 ml 50 mM bufer Tris-Cl pH 8.0. Sebanyak 2 ml sampel dari fraksi Butyl Sepharose FF dialirkan ke dalam kolom dan dielusi menggunakan bufer yang sama. Pada tahap ini, laju alir diatur pada 0.2 ml/menit. Fraksi-fraksi yang diperoleh diukur kadar proteinnya menggunakan spektrofotometer pada λ 280 nm serta diukur aktivitas enzim keratinase dan disulfida reduktase.
Tahap pencucian: sebelum matriks disimpan maka matrik dicuci berturut-turut menggunakan air bebas ion sebanyak 400 ml. Selanjutnya matriks disimpan dalam 20% etanol pada suhu dingin.
Desain Aplikasi
Enzim murni keratinase dan disulfida reduktase yang diperoleh dari fraksi gel filtrasi dan memiliki aktivitas tertinggi digunakan sebagai sumber enzim untuk mempelajari keterlibatan disulfida reduktase dalam degradasi keratin. Enzim berasal dari fraksi Sephacryl S-200HR yaitu fraksi nomer 61 (keratinase) dan 65 (disulfida reduktase). Aktivitas enzim dan konsentrasi protein yang digunakan adalah keratinase kasar sebesar 0.004 U/ml dan 0.05 mg/ml ; keratinase murni 0.008 U/ml dan 0.0002 mg/ml; reduktase murni 0.014 U/ml dan 0.0002 mg/ml; proteinase K 0.102 U/ml dan 0.005 mg/ml. Volume enzim yang digunakan
adalah 100 μl, kecuali pada saat uji bersama keratinase dan disulfida reduktase murni digunakan nisbah 80:20 μl. Konsentrasi senyawa pereduksi dan urea adalah 20 μl 0.1 mM DTT, 40 μl 0.2 mM BMT dan 0.3 mM urea.
Tiga jenis substrat keratin digunakan dalam pengujian ini yaitu tepung bulu ayam prehidrolisis NaOH, tepung bulu ayam dan domba alami. Tabulasi data pengujian degradasi keratin oleh kedua enzim dan senyawa pereduksi dan urea tampak pada Tabel 11.
Tabel 11 Tabulasi data pengujian degradasi keratin. Sumber enzim Ker ksr DR** Ker*
+DR Keratinase murni ** + DTT1 + BMT2 + Urea3 Bacillus sp.MTS . Proteinase K
Keterangan: DR disulfida reduktase, DTT dithiotreitol, BMT β-merkaptoetanol Preinkubasi DR, DTT, BMT, urea: 35oC, 10 menit
Inkubasi Keratinase 50oC selama 60 menit Proteinase K 37oC selama 60 menit
Cara pengujian: sebanyak 1% susbtrat dalam 50 mM bufer Tris-Cl pH 8.0 ditambah disulfida reduktase, senyawa pereduksi (DTT dan BMT), dan urea masing-masing dalam tabung reaksi yang berbeda. Campuran reaksi diinkubasi 35oC selama 10 menit. Selanjutnya ditambahkan enzim keratinase dan proteinase K dan diinkubasi pada suhu optimal masing-masing enzim yaitu 50oC untuk keratinase dan 37o
Pada tahap analisis bulu ayam utuh menggunakan SEM, enzim yang digunakan berasal dari fraksi Sephacryl S-200HR yaitu fraksi nomer 61 (keratinase) dan 65 (disulfida reduktase). Aktivitas enzim dan konsentrasi protein yang digunakan adalah keratinase kasar sebesar 0.004 U/ml dan 0.05 mg/ml ; keratinase murni 0.008 U/ml dan 0.0002 mg/ml; reduktase murni 0.014 U/ml dan 0.0002 mg/ml. Volume enzim yang digunakan adalah 50 μl, kecuali C untuk proteinase K. Waktu inkubasi yang digunakan adalah 60 menit. Produk hidrolisis yang terbentuk diukur menggunakan metode Walter (1984).
pada saat uji bersama keratinase dan disulfida reduktase murni digunakan nisbah 40:10 μl. Konsentrasi senyawa pereduksi dan urea adalah 20 μl 0.1 mM DTT, 40 μl 0.2 mM BMT dan 0.3 mM urea.
Ke dalam lima tabung eppendorf diisikan:
(1) bulu ayam utuh (0.0056 g) + 1 ml 50 mM bufer Tris-Cl pH 8.0, (2) bulu ayam utuh (0.0052 g) + 1 ml bufer + enzim keratinase kasar.
(3) bulu ayam utuh (0.0048 g) + 1 ml bufer + keratinase + disulfida reduktase, (4) bulu ayam utuh (0.0046 g) + 1 ml bufer + keratinase + 0.1 mM DTT .
Bulu pada tabung 3 dan 4 direaksikan lebih dulu dengan disulfida reduktase dan DTT selama 30 menit pada 35oC, selanjutnya setelah penambahan keratinase maka semua tabung diinkubasi selama 90 menit pada suhu 50oC. Reaksi dihentikan dengan penambahan 0.1 M TCA dan dibiarkan pada suhu 37oC selama 10 menit. Bulu ayam utuh kemudian dipindahkan ke dalam tabung baru dan dicuci tiga kali menggunakan bufer yang sama. Bulu ayam utuh selanjutnya direndam dalam larutan fiksasi (2.5% glutaraldehid dan 2% formaldehid) selama 48 jam pada suhu 10oC (refrigerator). Tahap berikutnya bulu didehidrasi menggunakan aseton berseri 70-100% dan terakhir bulu di oven pada suhu 50oC selama 10 menit (modifikasi Ramnani et al 2005). Sebelum dilakukan observasi, bulu utuh digunting, dan diletakkan di atas metal holder, selanjutnya dilapisi emas selama 2 x 15 detik. Pengamatan sampel bulu menggunakan alat JSM-5310LV SEM di Jurusan Material Science FMIPA Universitas Indonesia. Untuk satu jenis perlakuan dilakukan pengambilan gambar 4-6 kali pada beberapa titik dengan perbesaran bervariasi yaitu 1000-3500 kali.