RIZSA MUSTIKA PERTIWI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
2016
EKSTRAKSI DAN KARAKTERISASI KOLAGEN LARUT
PAPAIN DARI KULIT IKAN TUNA SIRIP KUNING
iii
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa Skripsi berjudul “Ekstraksi dan Karakterisasi Kolagen Larut Papain dari Kulit Ikan Tuna Sirip Kuning” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2016 Rizsa Mustika Pertiwi NIM C34120053
*Pelimpahan hak cipta atas karya tulis dari penelitian kerja sama dengan pihak luar IPB harus didasarkan pada perjanjian kerja sama yang terkait
v
ABSTRAK
RIZSA MUSTIKA PERTIWI. Ekstraksi dan Karakterisasi Kolagen Larut Papain dari Kulit Ikan Tuna Sirip Kuning. Dibimbing oleh MALA NURILMALA dan TATI NURHAYATI.
Kolagen merupakan protein jaringan ikat yang banyak dihasilkan dari tubuh mamalia hingga mencapai 30%. Pemanfaatan limbah kulit ikan tuna sirip kuning menjadi kolagen adalah salah satu alternatif untuk meningkatkan nilai jual limbah. Tujuan penelitian ini adalah untuk ekstraksi dan karakterisasi kolagen larut papain dari kulit ikan tuna sirip kuning. Kolagen larut papain dilakukan dengan pretratment perendaman kulit ikan dalam 0,1 M NaOH dan asam asetat 0,5 M. Ekstraksi kolagen dilakukan dengan papain pada konsentrasi 3.000; 5.000 dan 7.000 U/mg/g kulit. Hasil ekstraksi pada konsentrasi tersebut menunjukkan rendemen kolagen larut papain sebesar 7,55±0,18%, 12,12±0,53%, dan 22,79±1,29%. Analisis SDS-PAGE kolagen pada ketiga perlakuan diperoleh pita β, α1 dan α2. Analisis FTIR menunjukkan adanya amida A, amida B, amida I, amida II, dan amida III. Nilai pH kolagen larut papain yaitu 5,96±0,09; 5,95±0,04; dan 5,90±0,22. Kelarutan kolagen sebesar 88,67±4,04%; 78,67±9,45%; dan 95,27±2,95%. Asam amino tertinggi glisina, prolina dan arginina.
Kata kunci : asam amino, enzim papain, kolagen, SDS-PAGE, tuna sirip kuning.
ABSTRACT
RIZSA MUSTIKA PERTIWI. Extraction and characterization Collagen soluble papain from Skin Yellowfin Tuna. Supervised by MALA NURILMALA and TATI NURHAYATI.
Collagen is the most abundant protein of animal origin, comprising approximately 30% of total animal protein. Utilization of waste from yellowfin tuna skin to produce collagen is one alternative to increase its market value. The purpose of the research was to extract and characterize collagen-soluble papain from skin of yellowfin tuna. Collagen soluble papain was carried out with soaked in 0,1 M NaOH wich was followed by 0,5 M acetic acid. Collagen extraction was done with papain at contrentration of 3,000; 5,000 and 7,000 U/mg/g of skin. The result showed of that collagen-soluble papain had yield 7.55±0.18%, 12.12±0.53%, and 22.79±1.29%. SDS-PAGE pattern of collagen showed β, α1 and α2 band. FTIR spectrum showed the existence of amide A, amide B, amide I, amide II, and amide III. Collagen had pH 5.96±0.09; 5.95±0.04; and 5.90±0.22. Solubility of collagen was 88.67±4.04%; 78.67±9.45%; and 95.27±2.95%. The major amino acid content of collagen were glycine, proline and arginin.
vii
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB.
ix
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
2016
Skripsisebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
RIZSA MUSTIKA PERTIWI
EKSTRAKSI DAN KARAKTERISASI KOLAGEN LARUT
PAPAIN DARI KULIT IKAN TUNA SIRIP KUNING
xiii
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT. yang telah memberikan rahmat dan karunia-Nya. Shalawat serta salam selalu tercurah kepada Rasulullah SAW, bersera keluarganya, sahabatnya, dan umatnya hingga akhir zaman. Doa dan harapan semoga Allah selau meridhoi dan melancarkan segala aktivitas sehingga penulis dapat menyelesaikan penyusunan skripsi dengan judul “Ekstraksi dan Karakterisasi Kolagen Larut Papain dari Kulit Ikan Tuna Sirip Kuning”. Skripsi disusun dalam rangka memenuhi salah satu syarat untuk menyelesaikan studi di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada pihak-pihak yang telah membantu penulis dalam menyelesaikan penyusunan skripsi, antara lain kepada:
1 Ibu Dr Mala Nurilmala, SPi MSi dan Dr Tati Nurhayati, SPi MSi selaku dosen pembimbing atas segala bimbingan, motivasi dan arahan yang telah diberikan kepada penulis dalam menyelesaikan skripsi,
2 Ibu Dra Ella Salamah, MSi selaku dosen penguji atas saran dan masukan yang telah diberikan kepada penulis,
3 Bapak Dr Eng Uju, SPi MSi selaku Ketua Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 4 Ibu Dr Desniar, SPi MSi selaku Komisi Pendidikan atas segala saran
masukan yang telah diberikan kepada penulis,
5 Dosen, staf administrasi dan Laboratorium Teknologi Hasil Perairan, serta staf Laboratorium Terpadu FPIK yang telah membantu selama penelitian, 6 Ayahanda Kosasih dan Ibunda Euis Sumartini, Rima Mustika Pertiwi SPd, keluarga besar Amat Subita dan Ono Sumana yang selalu memberi dukungan, bantuan, doa, dan kasih sayang kepada penulis,
7 Bidikmisi dan Direktorat Jenderal Pendidikan Tinggi Kementrian Riset dan Teknologi atas Penelitian Kerjasama Luar Negeri dan Publikasi Internasional,
8 Sahabat KANGEN, Bu Mala’s Student, Apriliya Damayanti, Rizky Febriansyah SPi MSi, Himawan Prasetyo SPi MSi, THP 49, THP 50, dan THP 51, serta keluarga WAPEMALA Sumedang yang telah memberikan dukungan, saran, dan semangat kepada penulis,
9 Semua pihak yang telah membantu dalam proses penyusunan skripsi. Penulis menyadari bahwa masih banyak kekurangan dalam penulisan. Oleh karena itu kritik dan saran yang dapat membangun sangat penulis harapkan. Semoga skripsi ini bermanfaat bagi semua pihak yang memerlukannya.
Bogor, Desember 2016
xv
DAFTAR ISI
DAFTAR TABEL ... ix DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... ix PENDAHULUAN ... 1 Latar Belakang ... 1 Perumusan Masalah ... 2 Tujuan Penelitian ... 2 Manfaat Penelitian ... 2Ruang Lingkup Penelitian ... 2
METODE PENELITIAN ... 3
Waktu dan Tempat ... 3
Bahan dan Alat ... 3
Prosedur Penelitian ... 3
Prosedur Analisis ... 6
Analisis Data ... 10
HASIL DAN PEMBAHASAN ... 10
Komposisi Kimia Kulit Ikan Tuna Sirip Kuning ... 10
Konsentrasi Protein Terlarut setelah Pretreatment Perendaman NaOH 0,1 M ... 12
Pengembangan (swelling) Kulit Ikan setelah Pretreatment Menggunakan Asam Asetat ... 12
Kolagen Larut Papain dari Kulit Ikan Tuna Sirip Kuning ... 13
Rendemen Kolagen Kulit Ikan Tuna Sirip Kuning... 14
Bobot Molekul Kolagen Kulit Ikan Tuna Sirip Kuning ... 15
Gugus Fungsi Kolagen Kulit Ikan Tuna Sirip Kuning ... 16
Nilai ph Kolagen Kulit Ikan Tuna Sirip Kuning ... 17
Kelarutan Kolagen Kulit Ikan Tuna Sirip Kuning ... 18
Asam Amino Kolagen Kulit Ikan Tuna Sirip Kuning ... 19
Komposisi Kimia Kolagen Kulit Ikan Tuna Sirip Kuning Perlakuan Terbaik ... 21
KESIMPULAN DAN SARAN ... 22
Kesimpulan ... 22
Saran ... 22
DAFTAR PUSTAKA ... 23
LAMPIRAN ... 29
DAFTAR TABEL
1 Komposisi kimia kulit ikan tuna sirip kuning ... 11
2 Rendemen kolagen ... 15
3 Gugus fungsi kolagen kulit ikan tuna sirip kuning ... 17
4 Komposisi asam amino kolagen kulit ikan tuna sirip kuning ... 20
5 Komposisi kimia kolagen kulit ikan tuna sirip kuning perlakuan terbaik ... 21
DAFTAR GAMBAR
1 Diagram alir penelitian ... 52 Konsentrasi protein terlarut pada NaOH 0,1M... 12
3 Reaksi hidrolisis asam amino ... 13
4 Kolagen hasil ekstraksi enzim papain ... 14
5 Rendemen kolagen hasil ekstraksi enzim papain ... 15
6 Pola pita protein kolagen hasil ekstraksi enzim papin ... 16
7 Spektra inframerah kolagen hasil ekstraksi enzim papin ... 17
8 Nilai pH kolagen larut papain ... 18
9 Kelarutan kolagen larut papain ... 19
DAFTAR LAMPIRAN
1 Kurva standar BSA ... 30
2 Dokumentasi larutan NaOH sisa perendaman ... 30
3 Dokumentasi kulit ikan sebelum dan setelah perendaman asam asetat . 30 4 Hasil uji ragam (ANOVA) dan DMRT untuk pengaruh konsentrasi enzim terhadap rendemen kolagen yang dihasilkan ... 30
5 Hasil uji ragam (ANOVA) pengaruh konsentrasi enzim terhadap pH kolagen yang dihasilkan ... 31
6 Hasil uji ragam (ANOVA) dan DMRT pengaruh konsentrasi enzim terhadap kelarutan kolagen yang dihasilkan ... 31
7 Contoh perhitungan rendemen protein ... 32
PENDAHULUAN
Latar belakang
Ikan tuna merupakan salah satu ikan ekonomis penting yang banyak diperoleh di wilayah perairan Indonesia serta menjadi salah satu jenis ikan yang banyak diminati di dalam dan di luar negeri. Ikan tuna terdiri dari tuna besar dan tuna kecil. Ikan tuna besar meliputi tuna sirip kuning (Thunnus albacares), tuna albakora (Thunnus alalunga), tuna mata besar (Thunnus obesus), dan tuna sirip biru selatan (Thunnus macoyii). Ikan tuna kecil terdiri dari ikan cakalang (Katsuwonus pelamis), tongkol (Eutynnus affinis), tongkol kecil (Auxis thazard) dan tongkol abu-abu (Thunnus tonggol). Volume produksi ikan tuna mengalami peningkatan dari tahun 2010 hingga tahun 2011 sebesar 12,81%, dan menyebabkan peningkatan volume produksi tiap jenis ikan tuna. Peningkatan volume ikan tuna sirip kuning sebesar 56,73%; ikan tuna sirip biru selatan 47,68%; ikan tuna mata besar 31,39% dan ikan tongkol abu-abu 4,64% (KKP 2012). Spesies tuna tersebut merupakan komoditas utama pada pasar tuna dunia karena menguasai lebih dari 80% dari jumlah ikan tuna di pasar internasional (Nurjanah et al. 2011). Ekspor ikan tuna dapat mencapai 101.111 ton, dengan negara tujuan Jepang, Hongkong, Taiwan, Thailand, Singapura dan berbagai negara lainnya. Total keuntungan ekspor ikan tuna dapat mencapai 210.341,5 US$ (BPS 2015).
Ikan tuna dipasarkan dalam bentuk segar (fresh tuna), tuna beku (frozen tuna) ataupun produk hasil pengolahan. Produk olahan ikan tuna diantaranya tuna kaleng (canned tuna), fillet tuna, tuna saku, steak, loin dan lain sebagainya. Proses pengolahan produk tersebut menghasilkan hasil samping atau limbah berupa tulang, kulit, dan jeroan dalam jumlah banyak. Industri pengolahan menghasilkan limbah kulit 4,0%; sirip 3,4%; kepala 12,0%; tulang 11,7%; duri 2%; serta isi perut 4,8% (Nurhayati dan Peranginangin 2009). PT. Prima Indo tuna menghasilkan limbah kulit sebesar 3-5%. Alternatif pengolahan limbah tersebut diantaranya dengan produksi gelatin, kolagen, dan tepung ikan. Han et al. (2011) menyatakan bahwa kulit, tulang, dan sirip ikan mengandung protein kolagen cukup tinggi.
Protein digolongkan menjadi tiga macam, yaitu protein sarkoplasma, protein miofibril, dan protein stroma. Protein stroma tersusun atas protein jaringan ikat yang meliputi kolagen dan elastin. Kolagen yaitu protein yang tersusun atas asam amino triple helix yang banyak terdapat pada tubuh mamalia terutama pada matriks ekstraseluler. Kolagen dikelompokkan menjadi 27 jenis serta banyak ditemukan pada tulang, kulit, kornea, pembuluh darah, dan usus (Brinckmann et al. 2005). Selama ini kolagen komersial banyak dihasilkan dari sapi dan babi, namun kendala etnis dan penyakit pada hewan menjadikan pencarian bahan alternatif untuk sumber kolagen. Penyakit pada hewan tersebut diantaranya bovine spongiform encephalopathy (BSE), the foot and mouth desease (FMD) dan avian flu (Kiew dan Don 2012). Jamilah et al. (2013) dan Wu et al. (2014) menggunakan kulit ikan by product dari industri pengolahan perikanan sebagai alternatif untuk memperoleh ekstrak kolagen yang aman bagi berbagai kalangan.
Lin et al (2010) menjelaskan bahwa ekstraksi kolagen dapat dilakukan dengan metode kimiawi, fisik dan enzimatis. Ekstraksi enzimatis kolagen telah banyak dilakukan, diantaranya ekstraksi kolagen dari kulit ikan black carp (Mylopharyngdon piceus) (Wu et al. 2014), serta ekstraksi kolagen dari kulit dan tulang spanish makerel (Scomberomorous niphonius) (Li et al. 2013). Ekstraksi enzimatis tersebut lebih banyak menggunakan enzim pepsin. Enzim pepsin merupakan salah satu enzim proteolitik (enzim pemecah protein) yang dihasilkan dari hewan. Enzim proteolitik lainnya yaitu enzim papain yang dihasilkan dari ekstrak pepaya. Astiana (2016) melakukan penelitian mengenai peranan enzim papain dalam ekstraksi kolagen dari kulit ikan ekor kuning dengan hasil optimum pada konsentrasi 5.000 U/mg/g kulit. Hal ini mendorong peneliti untuk melakukan ekstraksi kolagen larut papain dari kulit ikan tuna sirip kuning menggunakan enzim papain konsentrasi 3.000; 5.000 dan 7.000 (U/mg/g kulit) serta melakukan karakterisasi terhaddap kolagen yang dihasilkan.
Perumusan Masalah
Pengolahan perikanan menghasilkan produk samping dalam jumlah yang banyak namun belum dapat dimanfaatkan secara optimum. Kulit ikan salah satu hasil samping yang mengandung protein kolagen tinggi. Kulit ikan dapat dijadikan sebagai sumber alternatif kolagen. Penelitian ini dilakukan untuk memanfaatkan kulit ikan tuna sirip kuning sebagai sumber kolagen larut papain serta menentukan karakteristiknya.
Tujuan Penelitian
Tujuan penelitian ini yaitu ekstraksi kolagen larut papain dari kulit ikan tuna sirip kuning, karakterisasi kolagen dari kulit ikan tuna sirip kuning serta menentukan komposisi kimia kolagen kulit ikan tuna sirip kuning perlakuan terbaik.
Manfaat Penelitian
Manfaat penelitian ini adalah peningkatan nilai tambah kulit ikan tuna sirip kuning sebagai sumber kolagen dari bahan baku hasil perairan. Informasi konsentrasi optimum enzim papain sebagai bahan ekstraksi kolagen serta memberikan informasi mengenai karakteristik kolagen larut papain kulit ikan tuna sirip kuning untuk aplikasi kolagen pada berbagai bidang pengolahan dan industri.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah penerimaan dan preparasi sampel, pretreatment (perendaman NaOH 0,1 M, perendaman butil alkohol 10%, serta
3
hidrolisis asam asetat 0,5M), ekstraksi kolagen dengan enzim papain dan karakterisasi kolagen kulit ikan tuna sirip kuning.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April sampai Agustus 2016. Penelitian dilaksanakan di Laboratorium Karakterisasi Bahan Baku Hasil Perairan, Laboratorium Bioteknologi Hasil Perairan II, Departemen Teknologi Hasil Perairan, Laboratorium Terpadu Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Biokimia Terpadu, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Laboratorium Pusat Studi Biofarmaka, Laboratorium Terpadu Institut Pertanian Bogor, Laboratorium Saraswanti Indo Genetech dan Laboratorium Balai Perkebunan dan Bioindustri, Bogor.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini terdiri dari bahan baku utama dan bahan tambah. Bahan baku utama kulit ikan tuna sirip kuning segar diperoleh dari PT. Prima Indo Tuna, Makasar. Bahan tambah yang digunakan yaitu akuades, enzim papain (Merck) unit aktivitas 30.000 U/mg, NaOH teknis, asam asetat (CH3COOH) teknis, dan NaCl teknis.
Alat yang digunakan yaitu pada tahap ekstraksi dan pada analisis. Alat yang digunakan pada tahap ekstraksi terdiri dari termometer, timbangan digital (VERITAS), SPECTRO UV-Vis (RS SPECTROPHOTOMETERUV-2500), sentrifugator (J2-21 BECKMAN) dan freeze drier (Christ alpha 1-2 LD Plus). Alat yang digunakan pada saat analisis terdiri dari pH meter (Orion 3 star), oven (kirin), Fourier Transform InfraRed (Bruker Tensor 37) dan Ultra High Performance Liquid Chromatography (Waters Coorporation USA).
Prosedur Penelitian
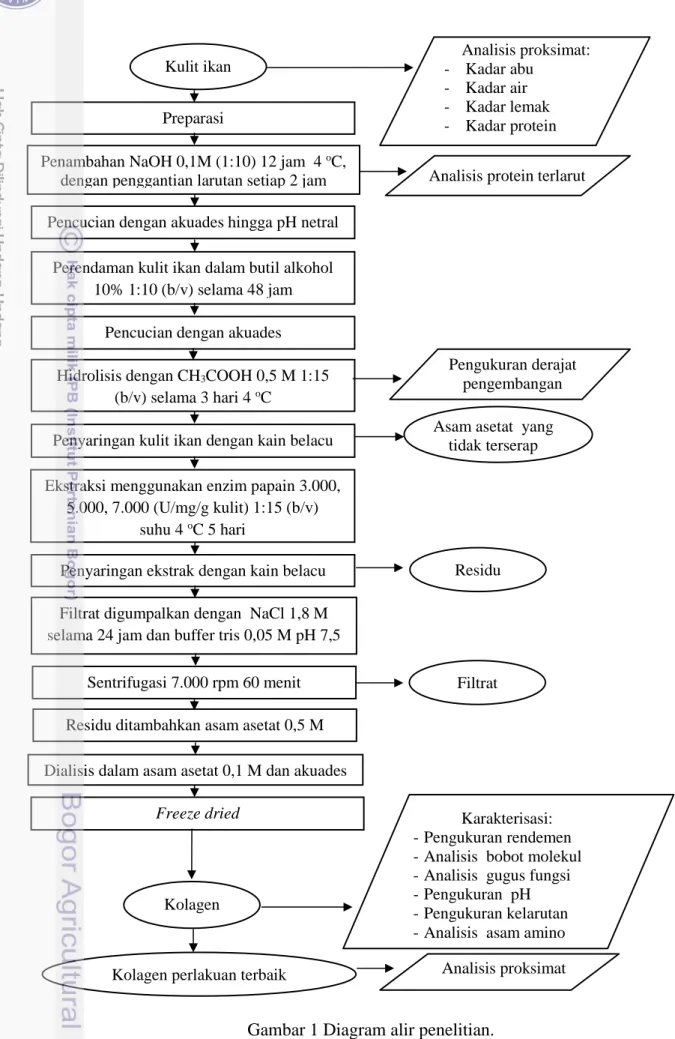
Prosedur penelitian ekstraksi dan karakterisasi kolagen larut papain dilakukan meliputi beberapa tahap. Tahap penelitian tersebut yaitu preparasi sampel, pretreatment sampel, ekstraksi kolagen, dan karakterisasi. Diagram alir penelitian dapat dilihat pada Gambar 1.
Bahan Baku dan Preparasi Sampel
Kulit ikan tuna sirip kuning dibersihkan dari daging dan sisik yang masih menempel. Kulit ikan tuna sirip kuning dianalisis komposisi kimia dan preparasi untuk ekstraksi. Kulit ikan untuk ekstraksi dipotong kira-kira 1 cm2 agar memudahkan proses ekstraksi. Kulit yang telah bersih kemudian disimpan kembali dalam freezer hingga akan digunakan sesuai kebutuhan.
Pretreatment kulit ikan tuna dilakukan dengan 2 tahap. Tahap pertama yaitu penghilangan protein non-kolagen dan lemak yang terdapat pada kulit. Tahap kedua hidrolisis kulit ikan menggunakan asam asetat.
1) Penghilangan protein non-kolagen
Penghilangan protein non-kolagen dilakukan dengan memodifikasi penelitian Hema et al. (2014). Proses ini dilakukan pada suhu 4 oC dengan merendam kulit ikan dalam larutan NaOH 0,1 M 1:10 (b/v) selama 12 jam. Larutan NaOH diganti setiap 2 jam, kemudian larutan sisa perendaman dikumpulkan dan dilakukan analisis protein terlarut dengan metode Bradford (1976). Kulit ikan dicuci dengan akuades dingin hingga pH netral, selanjutnya direndam dalam butil alkohol 10% 1:10 (b/v) selama 48 jam untuk penghilangan lemak, kemudian dicuci dengan akuades.
2) Hidrolisis kulit ikan dengan asam asetat
Kulit ikan dihidrolisis dengan asam asetat (CH3COOH) 0,5 M perbandingan 1:15 (b/v) pada suhu 4 oC. Hidrolisis kulit ikan dilakukan selama 3 hari, dilakukan pengadukan berkala setiap 6 jam secara manual. Kulit ikan yang telah mengalami pengembangan disaring menggunakan kain belacu dari asam asetat yang tidak terserap oleh kulit ikan.
Ekstraksi Kolagen
Ekstraksi kolagen dilakukan menggunakan metode Nalinanon et al. (2007) yang dimodifikasi. Penggunaan jenis enzim dan konsentrasi yang digunakan mengacu penelitian Astiana (2016). Kulit ikan hasil pretreatment diekstraksi menggunakan enzim papain konsentrasi 3.000, 5.000 an 7.000 U/mg/g kulit dan perbandingan terhadap akudes 1:15 (b/v) pada suhu 4 oC selama 5 hari. Ekstrak disaring menggunakan kain belacu hingga diperoleh filtrat kolagen. Filtrat kolagen dimurnikan dengan menggunakan modifikasi terhadap metode pengujian Li et a.l (2013). Penggumpalan filtrat dengan menggunakan NaCl 1,8 M selama 24 jam serta ditambahkan buffer tris HCl 0,05 M pH 7,5. Filtrat hasil penggumpalan disentrifugasi dengan kecepatan 7.000 rpm selama 1 jam pada suhu 4 oC. Pellet hasil sentrifugasi ditambahkan asam asetat 0,5 M, didialisis terhadap asam asetat 0,1 M dan akuades. Kolagen yang diperoleh pada ekstraksi kemudian dikeringkan dengan metode freeze drying. Kolagen larut papain dilakukan karakterisasi. Karakterisasi meliputi rendemen (AOAC 1995), bobot molekul (Laemmli 1970), gugus fungsi (Muyonga et al. 2004b), nilai pH (AOAC 2005), kelarutan (Shon et al. 2011), dan asam amino (Nollet 1996).
Analisis Komposisi Kimia Kolagen Larut Papain Perlakuan Terbaik
Kolagen larut papain perlakuan terbaik dipilih berdasarkan karakteristik yang dihasilkan. Analisis komposisi kimia meliputi kadar air, protein, abu, dan lemak. Analisis komposisi kimia kolagen larut papain perlakuan terbaik dilakukan untuk mengetahui keberhasilan ekstraksi, terutama pada kadar protein yang terkandung pada kolagen.
5
Karakterisasi: - Pengukuran rendemen - Analisis bobot molekul - Analisis gugus fungsi - Pengukuran pH - Pengukuran kelarutan - Analisis asam amino Ekstraksi menggunakan enzim papain 3.000,
5.000, 7.000 (U/mg/g kulit) 1:15 (b/v) suhu 4 oC 5 hari
Penambahan NaOH 0,1M (1:10) 12 jam 4 oC,
dengan penggantian larutan setiap 2 jam Kulit ikan
Pencucian dengan akuades
Penyaringan ekstrak dengan kain belacu
Sentrifugasi 7.000 rpm 60 menit
Dialisis dalam asam asetat 0,1 M dan akuades
Freeze dried
Hidrolisis dengan CH3COOH 0,5 M 1:15
(b/v) selama 3 hari 4 oC
Kolagen Preparasi
Penyaringan kulit ikan dengan kain belacu Pencucian dengan akuades hingga pH netral
Perendaman kulit ikan dalam butil alkohol 10% 1:10 (b/v) selama 48 jam
Kolagen perlakuan terbaik Filtrat digumpalkan dengan NaCl 1,8 M selama 24 jam dan buffer tris 0,05 M pH 7,5
Analisis proksimat: - Kadar abu
- Kadar air - Kadar lemak - Kadar protein
Analisis protein terlarut Pengukuran derajat pengembangan Analisis proksimat Residu Filtrat Residu ditambahkan asam asetat 0,5 M
Asam asetat yang tidak terserap
Analisis yang dilakukan pada penelitian meliputi analisis proksimat, analisis protein terlarut hasil perendaman NaOH 0,1 M, pengukuran derajat pengembangan kulit ikan oleh asam asetat, serta karakterisasi kolagen. Karakterisasi kolagen dilakukan pengukuran rendemen hasil ekstraksi, pengukuran pH, pengukuran kelarutan, analisis asam amino, analisis bobot molekul, analisis gugus fungsi dan analisis proksimat. Analisis proksimat yang dilakukan meliputi analisis kadar air, kadar abu, lemak, protein.
Analisis Konsentrasi Protein Terlarut (Bradford 1976)
Pengukuran konsentrasi protein terlarut dengan metode Bradford menggunakan Bovine serum Albumin (BSA) sebagai standar. Analisis protein menggunakan pereaksi Bradford yang terbuat dari campuran 10 mg coomassie briliant blue (CBB) dengan 5 mL etanol 95%, kemudian ditambahkan 10 mL larutan asam fosfat 85% dan akuades hingga volumenya mencapai 500 mL. Campuran dihomogenkan kemudian disaring menggunakan kertas saring Whatman 1. Pereaksi Bradford disimpan dalam botol gelap pada suhu chilling.
Analisis protein dilakukan dengan cara 0,1 mL sampel dimasukkan ke dalam tabung reaksi, ditambahkan 5 mL pereaksi Bradford. Campuran tersebut dihomogenkan dan diinkubasi selama 10 menit, kemudian diukur absorbansi dengan spektrofotometer pada panjang gelombang 595 nm. Pengujian protein tersebut dilakukan juga terhadap standar BSA dengan konsentrasi 0,01 sampai 0,15 mg/mL. Absorbansi standar protein dibuat kedalam kurva, kemudian dapat ditentukan konsentrasi protein yang terkandung di dalam sampel terhadap regresi yang diperoleh dari standar.
Derajat Pengembangan (Saito et al. 2007)
Pengukuran derajat pengembangan dilakuan untuk menentukan pengaruh lama perendaman asam asetat (CH3COOH) dalam hidrolisis kulit ikan tuna sirip kuning. Perendaman asam asetat dapat membuat kulit ikan menjadi mengembang, sehingga mempermudah saat ekstraksi. Perhitungan derajat pengembangan kulit ikan oleh asam asetat yaitu:
Derajat pengembangan = x 100% Keterangan:
W1 = Bobot sebelum perendaman (g) W2 = Bobot setelah perendaman (g) Pengukuran Rendemen (AOAC 1995)
Pengukuran rendemen diperoleh dari perbandingan kolagen yang dihasilkan terhadap berat bahan baku kulit. Perhitungan rendemen dapat hitung dengan menggunakan rumus:
Rendemen kolagen (%) = x 100% W2 – W1
W1
Berat kolagen (g) Berat bahan baku (g)
7
Analisis Bobot Molekul (Laemmli 1970)
Analisis bobot molekul protein kolagen menggunakan metode Sodium Dodesyl Sulfate-Polyacrilamide Gel Electrophoresis (SDS-PAGE). Analisis protein dengan SDS-PAGE menggunakan 7,5% separating gel (gel pemisah) dan 3 % stacking gel (gel pengumpul). Gel tersebut mengandung air deionisasi, akrilamida, buffer stacking, buffer separating, sodium dodesil sulfat (SDS), ammonium persulfat (APS), dan tetramethylethylenediamine (TEMED). Gel separating disiapkan hingga mengeras dalam kaca selama 60 menit, kemudian ditambahkan stacking gel hingga mengeras. Pembuatan stacking gel disiapkan sumur untuk injek sampel dengan menggunakan sisir sumur.
Analisis SDS-PSGE kolagen diperlukan pretreatment dengan melarutkan 2 mg kolagen dalam 1 mL SDS 5%, pemanasan pada waterbath 85 oC selama 1 jam. Kolagen pada pretreatment kemudian disentrifugasi 8000 rpm selama 5 menit. Supernatan diambil dan ditambahkan buffer sampel perbandingan 1:1 (v/v), kemudian dipanaskan pada waterbath 85 oC selama 10 menit. Injek sampel ke dalam sumur elektroforesis sebanyak 10 μL, sedangkan marker sebanyak 5 μL. Marker yang digunakan yaitu marker protein dengan bobot molekul 10 - 250 KDa. Elektroforesis dijalankan secara konstan pada arus 13 mA dan tegangan 100 volt selama 2 jam. Gel dikeluarkan dari slab kaca kemudian dilakukan proses staining dan destaining. Proses staning dengan Coomasie Blue selama 1 jam, sedangkan destaining selama kurang lebih 2 jam hingga pita-pita protein terlihat jelas. Pendeteksian bobot molekul dilakukan dengan software Photocapt.
Analisis Gugus Fungsi (Muyonga et al. 2004b)
Analisis gugus fungssi khas pada kolagen dilakukan menggunakan prinsip Spektrofotometer Infrared Transformasi Fourier (FTIR). Kolagen yang akan dianalisis dibentuk pelet dengan campuran kalium bromida (KBr). Kolagen sebanyak 2 mg ditumbuk halus dengan KBr 100 mg. Campuran kolagen dicetak dalam cetakan pelet. Pencetakan pelet dengan bantuan pompa hidrolik yang diberi tekanan sehingga dapat meminimalkan kandungan air dalam campuran sampel. Pellet yang dihasilkan kemudian dikeluarkan dari cetakan dan diletakkan pada tablet holde untuk dilakukan pengukuran dengan alat FTIR. Sinar inframerah ditembakkan dari spektofotometer inframerah IR-408 nm pada kolagen yang telah berbentuk pelet. Frekuensi bilangan gelombang kolagen yang dibaca dalam kisaran 1000-4000 cm-1. Pendeteksian gugus fungsi dapat dihasilkan pada monitor yang akan menampilkan puncak-puncak serapan bilangan gelombang.
Pengukuran pH (AOAC 2005)
Kolagen kering sebanyak 1 g dilarutkan dalam 20 mL akuades. Pengukuran pH dilakukan dengan menggunakan pH meter digital. Elektroda pada pH meter dicelupkan ke dalam sampel sampai diperoleh angka yang stabil pada proyektor pH meter.
Pengukuran Kelarutan (Shon et al. 2011)
Kolagen kering sebanyak 0,5 g dilarutkan dalam 5 mL akuades hingga homogen pada suhu ruang. Larutan sampel disentrifugasi selama 10 menit pada
dikeringkan dalam oven suhu 130 oC selama 20 menit kemudian ditimbang. Kelarutan kolagen diperoleh dengan rumus:
Ketidaklarutan (%) = x 100
Kelarutan (%) = 100 – ketidaklarutan
Analisis Asam Amino (Nollet 1996)
Analisis asam amino dilakukan terhadap sampel dan larutan standar asam amino. Sampel kolagen 0,1 gram dilarutkan 5 mL HCl 6N, divortex, kemudian dihidrolisis selama 22 jam pada suhu 110 oC. Sampel hasil hidrolisis didinginkan dan dipindahkan ke labu ukur 50 mL, serta ditetapkan hingga tanda batas. Sampel disaring menggunakan filter 0,45 μm. Filtrat 500 μL ditambahkan dengan 40 μm α-Aminobutyric acid (AABA) dan 460 μL aquabidest. Larutan sebanyak 10 μL ditambahkan dengan 70 μL JaccQ-Fluor Borate, kemudian dihomogenkan. Larutan ditambahkan dengan 20 μL reagent fluor A hingga homogen kemudian inkubasi pada suhu 55 oC selama 10 menit. Sampel diinjek pada bagian UPLC kemudian dilakukan running pengujian.
Analisis larutan standar dilakukan dengan mencampurkan 40 μL standar asam amino dengan 40 μL internal standar α-Aminobutyric acid (AABA) dan 920 μL akuabides, kemudian dihomogenkan. Standar sebanyak 10 μL dipipet dan ditambahkan dengan 70 μL AccQ-Fluor Borate kemudian dihomogenkan. Larutan ditambahkan 20 μL reagent fluor A hingga homogen kemudian inkubasi pada suhu 55 oC selama 10 menit. Sampel diinjek pada bagian UPLC kemudian dilakukan running pengujian.
Analisis Proksimat
1) Analisis kadar air (SNI-01-28911992)
Sampel sebanyak 5-10 gram dikeringkan dalam oven pada suhu 105 oC selama 3 jam. Sampel didinginkan dalam eksikator kemudian ditimbang hingga diperoleh bobot tetap. Perhitungan kadar air ditentukan dengan rumus:
Kadar air (%) = x 100%
Ketarangan:
W = Bobot sampel (g) W1 = Bobot kering (g)
2) Analisis kadar abu (SNI-01-28911992)
Sampel sebanyak 2-5 g ditimbang dan dimasukkan ke dalam sebuh cawan porselen yang telah diketahui bobotnya. Sampel diarangkan diatas pembakar hingga tidak berasap lagi. Sampel selanjutnya dimasukkan ke dalam tanur pengabuan pada suhu maksimum 550 oC sampai pengabuan sempurna. Cawan dimasukkan dalam eksikator lalu ditimbang sampai diperoleh bobot konstan. Perhitungan ditentukan dengan rumus:
Kadar abu (%) = x 100%
W – W1
W
W1 – W2
W Bobot sampel tidak larut
9
Keterangan:
W = Bobot sampel sebelum diabukan (g)
W1 = Bobot sampel + cawan sesudah diabukan (g) W2 = Bobot cawan kosong (g)
3) Analisis kadar lemak (AOAC 2005)
Sampel hasil penghilangan kadar air ditimbang sebanyak 1-2 gram dimasukkan ke dalam selongsong kertas yang dialasi dan disumbat dengan kapas. Sampel dikeringkan dalam oven 80 oC selama 1 jam, kemudian dimasukkan ke dalam alat sokhlet. Alat sokhlet telah dihubungkan dengan labu lemak berisi batu didih. Ekstraksi sampel dilakukan dengan heksana atau pelarut lemak lainnya selama ± 6 jam. Pelarut lemak disulingkan dan ekstrak lemak dikeringkan dalam oven pengering pada suhu 105 oC. Sampel didinginkan dan ditimbang hingga diperoleh bobot konstan. Perhitungan kadar lemak ditentukan dengan rumus:
Kadar lemak = x 100%
Keteranagan :
W = Bobot sampel (g)
W1 = Bobot labu sebelum ekstraksi (g) W2 = Bobot labu sesudah ekstraksi (g) 4) Analisis kadar protein (AOAC 2005)
Sampel 0,5 g dimasukkan ke dalam labu Kjeldhal 100 mL. Campuran 2 g selenium dan 25 mL H2SO4 pekat ditambahkan ke dalam sampel. Larutan dipanaskan diatas pemanas listrik atau pembakar bunsen sampai mendidih dan larutan menjadi jernih kehijau-hijauan (sekitar 2 jam). Larutan didinginkan dan dimasukkan ke dalam labu ukur 100 mL. Larutan sebanyak 5 mL dimasukkan ke dalam alat penyuling kemudian ditambahkan 5 mL NaOH 30%. Larutan disulingkan selama kurang lebih 10 menit. Larutan asam borat 2% sebanyak 10 mL disiapkan untuk digunakan sebagai penampung dan larutan HCl 0,01 N sebagai titran. Larutan blanko dikerjakan dengan metode yang sama. Perhitungan kadar protein ditentukan dengan rumus:
Kadar protein = x 100%
Keterangan:
W = Bobot sampel (mg)
V1 = Volume HCl 0,01 N yang dipergunakan pada titrasi sampel (mL) V2 = Volume HCl 0,01 N yang dipergunakan pada titrasi blanko (mL) N = Normalitas HCl
Fk = Faktor konversi, untuk protein dari makanan secara umum = 6,25 Fp = Faktor pengenceran
W2 – W1
W
(V1 – V2) x N x 0,014 x fk x fp
Karakteristik kolagen berdasarkan perbedaan konsentrasi enzim papain dilakukan analisis menggunakan rancangan acak lengkap (RAL). Karakteristik kolagen meliputi rendemen, pH dan kelarutan. Analisis data dilakukan sebanyak 3 kali ulangan dengan menggunakan program Statistical Product and Service Solutions (SPSS) 15. Model rancangan analisis data adalah sebagi berikut:
Yij = μ + τi + εij Keterangan:
Yij = Pengamatan perlakuan penambahan enzim ke-i dan ulangan ke-j μ = Rataan umum
τi = Pengaruh perlakuan penambahan enzim ke-i
εij = Galat pengamatan pada penambahan enzim ke-i dan ulangan ke ke-j i = 3.000 U; 5.000 U; 7.000 U
j = 1, 2, 3
Data diamati secara statistik dengan analisis ragam (ANOVA). Apabila hasil analisis menunjukkan berpengaruh nyata, maka dilanjutkan dengan uji Duncan’s Multiple Range Test (DMRT) dengan taraf kepercayaan 95%.
Hipotesis perlakuan enzim terhadap karakteristik kolagen
H0 = Konsentrasi enzim papain tidak berpengaruh nyata terhadap karakteristik kolagen yang dihasilkan.
H1 = Konsentrasi enzim papain berpengaruh nyata terhadap karakteristik kolagen yang dihasilkan.
HASIL DAN PEMBAHASAN
Komposisi Kimia Kulit Ikan Tuna Sirip Kuning
Ikan tuna merupakan ikan perenang cepat yang melakukan migrasi sepanjang hidupnya. Ikan tuna banyak ditemukan di Perairan Indonesia pada berbagai ukuran. Ukuran telur ikan tuna berkisar < 20 cm, juvenil tuna 20-99 cm, sedangkan ikan tuna dewasa >100 cm (Robinson 2006). Ikan tuna sirip kuning tertangkap di Samudra Hindia sekitar bulan Februari hingga April memiliki panjang total 110-151 cm yang tergolong tuna dewasa. Penangkapan ikan tuna sirip kuning dapat dilakukan menggunakan longline, tonda, handline, huhate dan pukat cincin. Makanan ikan tuna berupa ikan, cepalopoda atau cumi-cumi yang berda di kolom perairan (Jaenudin 2013).
Komposisi kimia kulit ikan tuna dilakukan untuk mengetahui kelayakan kulit ikan tuna tersebut sebagai bahan baku pembuatan kolagen. Kulit ikan tuna yang digunakan harus memiliki tingkat kesegaran yang baik, karena akan menghasilkan kolagen yang baik juga. Analisis komposisi kimia yang dilakukan meliputi kadar air, kadar abu, kadar lemak dan kadar protein. Komposisi kimia
11
dalam kulit ikan tuna sirip kuning dilakukan sebanyak dua kali pengulangan dapat dilihat pada Tabel 1.
Tabel 1 Komposisi kimia kulit ikan tuna sirip kuning
Sumber Kadar air
(% bb) Kadar abu (% bb) Kadar lemak (% bb) Kadar protein (% bb) Kulit tuna sirip kuning 59,38±1,20 2,21±0,06 1,15±0,09 36,45±0,50 Kulit tuna sirip kuning1 58,13±3,43 1,03±0,45 8,87±1,23 27,12±0,50 Kulit tuna albakor2 56,54±0,09 4,39±0,03 18,32±0,11 20,54±0,26
Keterangan: 1 Karunarathana & Attygalle (2010); 2 Hema et al. (2013);
Kadar air kulit ikan tuna sirip kuning mendekati nilai kadar air kulit ikan tuna sirip kuning pada literatur pembanding dan kulit ikan tuna albakor. Kadar air menentukan tingkat kesegaran bahan baku yang digunakan. Bahan baku dengan kadar air yang tinggi lebih mudah rusak. Faktor yang mempengaruhi kadar air diantaranya adalah musim penangkapan dan umur spesies.
Kadar abu kulit ikan tuna sirip kuning lebih tinggi dari kadar abu kulit tongkol dan kulit tuna sirip kuning literatur pembanding. Kadar abu dalam suatu bahan dapat ditentukan oleh kemampuan dalam menyimpan mineral-mineral yang berasal dari sekitarnya. Semakin tinggi suatu organisme menyerap mineral dari lingkungannya, maka semakin tinggi kadar abu yang terkandung dalam tubuhnya. Effinong dan Fakunle (2011) membuktikan bahwa ikan mengandung mineral Ca, K, Mg, Zn, Fe, dan Na dalam jumlah yang beragam.
Kadar lemak kulit tuna sirip kuning lebih rendah dari kadar lemak kulit ikan tuna literatur pembanding, kulit ikan tuna albakor, dan kulit ikan tongkol. Lemak dalam tubuh ikan digunakan pada saat ikan beraktivitas seperti menangkap makanan dan melakukan pergerakan. Faktor yang mempengaruhi kadar lemak dalam suatu bahan diantaranya musim penangkapan, spesies, geografis, variasi usia serta kematangan dalam spesies yang sama (Piggot dan Tucker 1990). Ikan yang melakukan migrasi dengan jarak yang jauh, sebelum memijah akan menggunakan protein dan lemaknya untuk keperluan energi sehingga menurunkan biologis ikan. Kematangan biota berhubungan juga dengan periode pemijahan ikan, selama periode pemijahan umumnya ikan tidak mencerna banyak makanan sehingga tidak dapat energi yang cukup. Kandungan protein dan lemak akan kembali normal setelah masa pemijahan karena ikan cenderung melakukan migrasi untuk mencari sumber makanan sesuai pola kebiasaan makan ikan tersebut (FAO 1995).
Kadar protein kulit ikan tuna sirip kuning lebih tinggi dari kadar protein ikan tuna sirip kuning pembanding, kulit ikan tuna albakor dan kulit ikan tongkol. Kadar protein kulit ikan tuna dan sumber lainnya dapat berbeda, hal ini disebabkan oleh beberapa faktor. Faktor yang mempengaruhi kadar protein diantaranya oleh proses preparasi bahan, perbedaan spesies, umur, masa penangkapan, dan habitat. Tingginya kadar protein pada hasil pengujian ini menjadi salah satu faktor utama dalam ekstraksi kolagen, semakin tinggi kadar protein dalam suatu bahan akan menghasilkan kolagen yang banyak.
Perendaman NaOH 0,1 M
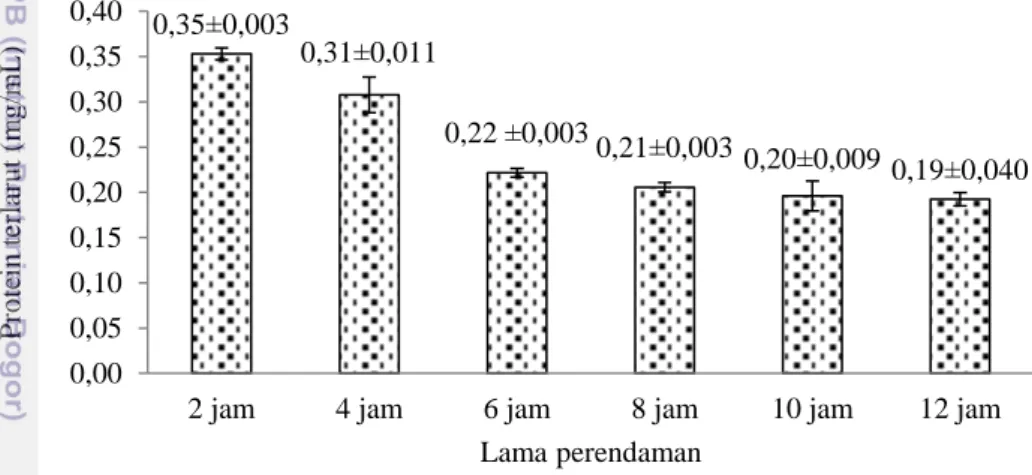
Pretreatment kolagen diperlukan untuk menghilangkan protein non-kolagen, lemak dan pengotor lainnya yang terdapat pada kulit ikan tuna. Proses penghilangan protein non-kolagen dilakukan menggunakan NaOH, sedangkan proses penghilangan lemak dengan menggunakan butil alkohol. Proses penghilangan protein non-kolagen menurut Zhou dan Regenstein (2005) dapat dilakukan menggunakan NaOH atau Ca(OH)2 pada konsentrasi 0,01 M sampai 0,1 M. Penggunaan NaOH pada penelitian ini dengan konsentrasi 0,1 M. Perendaman dilakukan selama 12 jam dengan penggantian larutan setiap 2 jam. Larutan sisa perendaman dikumpulkan dan diukur protein terlarut dengan bantuan standar protein (BSA). Kurva standar BSA dan dokumentasi larutan NaOH sisa perendaman dapat dilihat pada Lampiran 1 dan Lampiran 2. Hasil uji protein terlarut dapat dilihat pada Gambar 2.
Gambar 2 Konsentrasi protein terlarut pada perendaman NaOH 0,1 M. Gambar 2 menunjukkan penggunaan NaOH 0,1 M dapat melarutkan protein non-kolagen dalam kulit ikan. Perendaman semakin lama dan semakin sering penggantian larutan akan menurunkan konsentrasi protein terlarut. Menurunnya konsentrasi protein terlarut tersebut disebabkan oleh semakin menurunnya protein non-kolagen dalam kulit ikan. Protein terlarut setelah perendaman 6 jam tidak berbeda. Penghilangan protein non-kolagen pada kulit ikan tongkol penelitian Komala (2015) dengan konsentrasi NaOH 0,1 M selama 12 jam dapat menurunkan protein non-kolagen hingga 0,220 mg/mL. Konsentrasi protein terlarut tersebut tidak berbeda dengan hasil penelitian ini.
Pengembangan (swelling) Kulit Ikan setelah Pretreatment dengan Hidrolisis Asam Asetat
Asam asetat (CH3COOH) membantu hidrolisis kulit ikan hingga terjadi pengembangan. Konsentrasi asam asetat yang digunakan untuk hidrolisis kolagen yaitu 0,5 M dengan lama perendaman 3 hari. Pengembangan kulit ikan sebesar 466,67 ± 0,30%. Kulit ikan sebelum perendaman dan setelah perendaman asetat
0,35±0,003 0,31±0,011 0,22 ±0,003 0,21±0,003 0,20±0,0090,19±0,040 0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35 0,40
2 jam 4 jam 6 jam 8 jam 10 jam 12 jam
P ro tein ter lar u t ( m g /m L ) Lama perendaman
13
dapat dilihat pada Lampiran 3. Pengembangan kulit ikan kakap putih dengan asam asetat 0,2 M dapat mencapai 605,34% (Trisdiani 2015). Perbedaan derajat pengembangan tersebut diduga disebabkan oleh konsentrasi asam yang digunakan dan karakteristik kulit ikan yang berbeda. Asam asetat yang digunakan berfungsi untuk menghidrolisis protein kolagen sehingga mempermudah ekstraksi. Kulit ikan mampu menyerap air sehingga mengalami pengembangan, semakin banyak air yang terserap akan menyebabkan serat kolagen menjadi lebih mudah untuk dipisahkan (Nur’aenah 2013).
Kulit ikan mengalami pengembangan setelah perendaman asam asetat disebabkan oleh adanya gaya elektrostatik. Jaswir et al. (2011) menerangkan asam asetat dapat mengakibatkan terbentuknya ikatan hidrogen antara gugus non polar pada serat kolagen dengan H+ dari asam. Reaksi hidrolisis akan memisahkan ikatan peptida (COO-NH) dari rantai protein. Gugus COO akan berikatan dengan OH, sedangkan NH akan berikatan dengan H, sehingga akan membentuk asam amino tunggal (Almatsier 2002). Reaksi hidrolisis dapat dilihat pada Gambar 3.
Gambar 3 Reaksi hidrolisis asam amino.
Kolagen Larut Papain dari Kulit Ikan Tuna Sirip Kuning
Kulit ikan tuna sirip kuning berhasil diekstraksi menggunakan enzim dengan konsentrasi yang berbeda. Kolagen larut papain tersebut dapat dilihat pada Gambar 4. Kolagen dengan ekstraksi enzim papain 7.000 U lebih halus dan memiliki warna lebih putih dibandingkan dengan perlakuan lainnya. Warna kolagen merupakan salah satu karakter fisik yang menentukan kualitas dari kolagen. Kolagen berkualitas baik memiliki warna yang putih dengan derajat putih mendekati 100%. Hasil pengukuran derajat putih kolagen dari daging teripang gamma yaitu 69,01% (Alhana 2015).
Gambar 4 Kolagen hasil ekstraksi enzim papain konsentrasi (A): 3.000 U; (B): 5.000 U; (C): 7.000 U.
A B C
sintesis
hidrolisis
dilakukan karakterisasi pada kolagen yang dihasilkan. Karakterisasi kolagen dilakukan untuk menentukan ciri khas yang dimiliki kolagen larut papain tersebut, secara kuantitas maupun secara kualitas. Karakterisasi yang dilakukan meliputi rendemen, bobot molekul, gugus fungsi, pH, kelarutan, serta asam amino. Karakteristik kolagen terbaik kemudian dipilih menjadi perlakuan terbaik pada penelitian ini.
Rendemen Kolagen Kulit Ikan Tuna Sirip Kuning
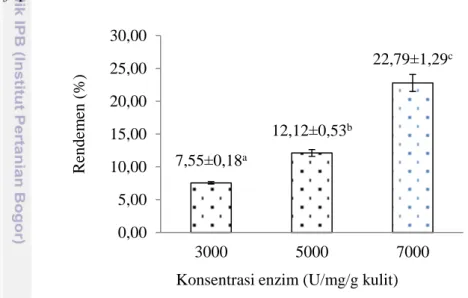
Rendemen merupakan salah satu faktor paling penting dalam menentukan efektifitas ekstraksi terhadap ekstrak yang dihasilkan. Rendemen menunjukkan bagian bahan baku yang dapat dimanfaatkan dan menjadi suatu parameter yang penting untuk mengetahui nilai ekonomis serta keefektifan suatu bahan atau produk. Rendemen kolagen dengan ekstrasi enzim papain berbagai konsentrasi tersaji pada Gambar 5.
Gambar 5 Rendemen kolagen hasil ekstraksi enzim papain.
Hasil analisis ragam (ANOVA) konsentrasi enzim papain memberi pengaruh sangat nyata (α = 0,05) terhadap rendemen kolagen yang dihasilkan. Hasil analisis ragam (ANOVA) dan DMRT rendemen kolagen dapat dilihat pada Lampiran 4. Kolagen yang diekstraksi enzim papain dapat dilihat pada Gambar 5. Konsentrasi enzim papain 7.000 U/mg/g kulit menghasilkan kolagen terbanyak. Karakteristik bahan baku, bahan pengekstrak, dan konsentrasi yang digunakan sangat menentukan kolagen yang dihasilkan. Penambahan konsentrasi enzim pada saat ekstraksi dapat meningkatkan rendemen yang dihasilkan. Rendemen kolagen dari berbagai jenis bahan baku dan bahan pengekstrak dapat dilihat pada Tabel 2.
Ekstraksi kolagen dengan enzim dapat menghasilkan rendemen lebih tinggi dibandingkan dengan ekstraksi menggunakan asam. Perbedaan hasil tersebut dikarenakan enzim bekerja aktif memutus protein tropokolagen. Tropokolagen merupakan penyusun dasar kolagen. Aktivitas enzim dipengaruhi oleh konsentrasi enzim, substrat, pH, dan suhu. Aktivitas enzim akan meningkat bila faktor tersebut sesuai. Penelitian Song et al. (2014) membuktikan bahwa pH optimum enzim papain untuk ekstraksi kolagen adalah pH 3.
7,55±0,18a 12,12±0,53b 22,79±1,29c 0,00 5,00 10,00 15,00 20,00 25,00 30,00 3000 5000 7000 R ende m en ( % )
15
Tabel 2 Rendemen kolagen
Keterangan: 1 Hema et al. ( 2013); 2 Jongjareonrank et al. (2005); 3 Wu et al. (2014);
4Astiana (2016).
Kolagen kulit ikan ekor kuning dengan ekstraksi enzim papain konsentrasi 5.000 U/mg/g kulit mampu menhasilkan rendemen lebih tinggi dibandingkan dengan kolagen kulit ikan tuna yang diekstraksi dengan enzim dan aktivitas yang sama. Perbedaan tersebut diduga oleh karakteristik bahan baku dan suhu yang digunakan berbeda. Kulit ikan ekor kuning lebih tipis dibandingkan dengan kulit ikan tuna, sehingga permukaan kulit yang kontak dengan enzim lebih banyak. Bobot Molekul Kolagen Kulit Ikan Tuna Sirip Kuning
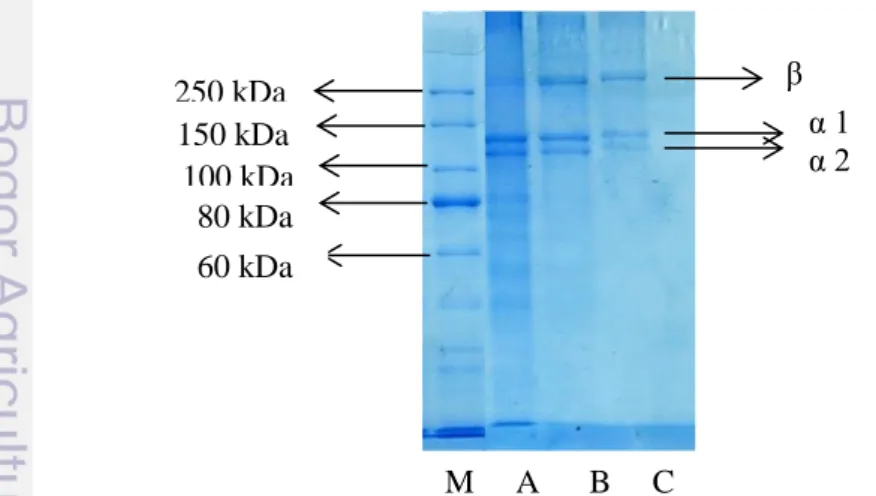
Bobot molekul protein dilakukan pengujian menggunakan prinsip Sodium Dodecyl Sulphate Polyacrilamid Gel Electrophoresis (SDS-PAGE). Elektroforesis dapat memisahkan protein berdasarkan ukuran molekul dan interaksinya terhadap muatan listrik. Gel poliakrilamida merupakan penyangga pada elektroforesis agar pita protein lebih stabil. Gel poliakrilamida terbentuk dari polimerisasi akrilamida dengan agen pembentuk ikatan silang bis-akrilamida. Ikatan silang dari polimer akrilamida akan menghasilkan pori-pori dengan ukuran yang berbeda-beda (Roy et al. 2012). Ukuran pori-pori gel poliakrilamida tersebut dapat mempengaruhi kecepatan elektroforesis. Pori-pori gel poliakrilamida semakin rapat akan memperlambat proses elektroforesis, demikian sebaliknya bila semakin renggang pori-pori gel akan mempercepat elektroforesisi. Pita molekul kolagen dengan ekstraksi enzim papain dapat dilihat pada Gambar 6.
Gambar 6 Pola pita protein kolagen hasil ekstraksi enzim papin (M) Marker; (A) 3.000 U; (B) 5.000 U; (C) 7.000 U.
Sumber kolagen Rendemen
(% bk) Kulit ikan tuna sirip kuning ekstrasi enzim 7.000 U/mg/g kulit 22,79±1,29% Kulit ikan tuna (Thunnus alalunga) ekstaksi asam1 13,97%
Kulit ikan kakap merah (Lutjanus vitta) ekstraksi enzim papain 750 U2 4,70%
Kulit ikan mas (Mylopharyngdon piceus) ekstraksi enzim pepsin
10.000 U3 45,7%
Kulit ikan ekor kuning (Caesio cuning) ekstraksi enzim papain
5.000 U/mg/g kulit4 33,28% 250 kDa 150 kDa 100 kDa 80 kDa β M A B C α 1 α 2 60 kDa
β, α1 dan α2. Silvipriya (2015) menjelaskan bahwa struktur dasar kolagen terdiri dari triple helix dengan rantai kembar (α1) dan (α2), serta biasanya kolagen yang dihasilkan dari ikan termasuk tipe 1. Bobot molekul kolagen pada ekstraksi enzim papain 3.000 U yaitu β (278 kDa), α1 (137 KDa) dan α2 (117 KDa). Bobot molekul kolagen ekstraksi enzim 5.000 U yaitu β (282 kDa), α1 (138 KDa) dan α2 (119 KDa). Bobot molekul kolagen ekstraksi enzim 7.000 U yaitu β (284 kDa), α1 (139 KDa) dan α2 (118 KDa). Kolagen dengan ekstraksi enzim papain berbeda konsentrasi menyebabkan perbedaan pola pita protein. Kolagen dengan ekstraksi enzim papain 3.000 U terdapat pita protein dengan bobot molekul rendah, sedangkan pada konsentrasi enzim 5.000 dan 7.000 U tidak terlihat pita protein dengan bobot molekul rendah.
Bahan dan konsentrasi pengekstrak dapat mempengaruhi karakteristik kolagen yang dihasilkan. Jamilah et al. (2013) memiliki berbagai ragam bobot molekul protein berdasarkan bahan pengekstrak, penggunaan enzim papain menyebabkan penurunan bobot molekul protein hingga 50 KDa, hal ini dikarenakan bahwa enzim papain merupakan enzim yang kuat memecah molekul pada bagian telopeptida dan tropokolagen. Konsentrasi asam yang digunakan juga akan mempengaruhi struktur asam amino. Konsentrasi asam yang semakin tinggi akan membuka struktur rantai asam amino, sehingga asam amino yang dihasilkan lebih banyak dan berantai pendek. Rantai polipeptida yang semakin pendek tersebut karena hidrolisis lanjut oleh sisa ion H+ menjadi dasar asumsi bahwa berat molekulnya semakin turun (Tazwir et al. 2007).
Gugus Fungsi Kolagen Kulit Ikan Tuna Sirip Kuning
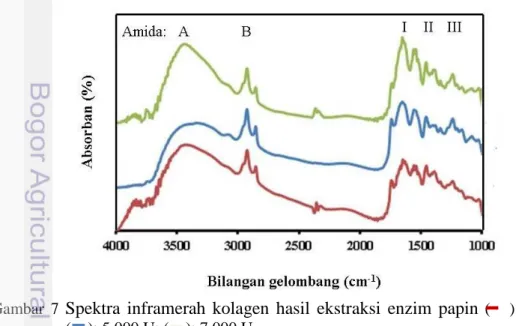
Gugus fungsi kolagen dapat dideteksi dengan menggunakan alat Spektroskopi Fourier Transform Infrared (FTIR). Spektroskopi FTIR adalah pengukuran panjang gelombang intensitas penyerapan radiasi IR oleh sampel. Data spektral IR berpolimer tinggi biasanya ditafsirkan dalam getaran unit berstruktur. Unit polipeptida dan protein menghasilkan sembilan karakteristik band penyerapan IR, yaitu Amida A, B, I-VII (Kong & Yu 2007). Gugus fungsi kolagen ekstrasi enzim papain dapat dilihat pada Gambar 7.
Gambar 7 Spektra inframerah kolagen hasil ekstraksi enzim papin ( ): 3.000 U; ( ): 5.000 U; ( ): 7.000 U.
17
Kolagen larut papain dari kulit ikan tuna sirip kuning memiliki 5 band penyerapan inframerah berupa Amida A, Amida B, Amida I, Amida II, dan Amida III. Muyonga et al. (2004b) menyatakan bahwa pada struktur kolagen terdiri dari Amida A, Amida I, Amida II, dan Amida III. Jeong et al. (2013) menyatakan bahwa Amida B termasuk salah satu band yang menentukan karakteristik kolagen. Amida A, B, I, II, dan III kolagen memiliki daerah serapan khusus. Daerah serapan kolagen kulit ikan tuna sirip kuning larut papain, kolagen tuna mata besar ekstraksi enzim pepsin, dan standar wilayah serapan dapat dilihat pada Tabel 3. Daerah serapan kolagen tersebut menunjukkan karakternya dari masing-masing gugus fungsi tersebut. Amida A: terdapat NH stretching, Amida B: CH2 asymmetrical stretch, Amida I: C=O stretching, Amida II: CN stretching dan NH bending, dan Amida III: CN stretching dan NH bending, sedangkan serapan bilangan gelombang 2500-2000 (cm-1) menunjukkan karakteristik terminal alkyne (Kong & Yu 2007).
Tabel 3 Gugus fungsi kolagen kulit ikan tuna sirip kuning
Bilangan gelombang puncak serapan (cm-1)
Daerah serapan Kolagen 3.000 U enzim Kolagen 5.000 U enzim Kolagen 7.000 U enzim Kolagen tuna mata besar1 Kolagen kulit ikan mas2 Standar wilayah serapan Amida A 3485 3465 3483 3446 3324 3490-34303 Amida B 2931 2931 2933 2926 2925 2935-29153 Amida I 1652 1677 1656 1645 1649 1690-16004 Amida II 1517 1525 1525 1554 1540 1575-14804 Amida III 1290 1257 1253 1263 1238 1301-12294
1 Jeong et al. (2013); 2 Duan et al. (2009); 3 Coates (2000); 4 Kong & Yu (2007).
Kolagen kulit ikan tuna sirip kuning memiliki daerah serapan amida sesuai dengan standar wilayah. Bilangan gelombang puncak serapan pada kolagen berbagai perlakuan enzim memiliki nilai yang hampir sama. Perbedaan dari perlakuan enzim tersebut terdapat pada puncak serapan pada masing-masing amida, yaitu pada kolagen dengan ekstraksi enzim 7.000 U terlihat lebih tajam dibanding dengan yang lainnya. Hal tersebut disebabkan oleh kuatnya ikan gugus fungsi kolagen pada perlakuan tersebut.
Struktur triple helix kolagen berdasarkan gugus fungsi dapat dilihat pada bilangan gelombang Amida III. Bilangan gelombang tersebut dibandingkan terhadap bilangan gelombang 1450 cm-1 dan dilihat seberapa besar integritas antar bilangan gelombang tersebut. Integritas kolagen dengan perlakuan enzim 3.000, 5.000 dan 7.000 U sebesar 0,89; 0,87; dan 0,86. Matmaroh et al. (2011) menegaskan bahwa bila integritas kolagen mendekati 1, struktur tersebut memiliki triple helix. Kolagen larut papain memiliki integritas mendekati 1 dan dapat dinyatakan memiliki struktur triple helix.
Nilai pH kolagen kulit ikan tuna sirip kuning
Nilai pH berfungsi untuk menentukan derajat asam atau basa suatu larutan. Pengukuran pH dilakukan dengan melarutkan kolagen dalam akuades kemudian diukur pH dengan pH meter. Kolagen dengan ekstraksi enzim papain pada konsentrasi 3.000, 5.000 dan 7.000 (U/mg/g kulit) tidak memberikan pengaruh nyata (α = 0,05) terhadap nilai pH yang dihasilkan. Hasil analisis ragam (ANOVA) pH kolagen dapat dilihat pada Lampiran 5. Nilai pH kolagen tersebut
pengujian Jamilah et al. (2013) yaitu 3,93, namun mendekati nilai pH kolagen kulit ikan buntal pisang penelitian Faisal (2014) yaitu 5,49.
Peng et al. (2004) mengukur nilai pH pada beberapa produk kolagen, dengan hasil yang diperoleh berkisar antara 3,8-4,7. Standar pH kolagen berdasarkan SNI (2014) yaitu 6,5-8. Kolagen kulit ikan tuna sirip kuning belum masuk ke standar pH yang ditentukan. Perbedaan nilai pH tersebut dapat disebabkan perbedaan jenis dan konsentrasi asam atau basa yang digunakan selama proses pembuatan kolagen. Penetralan akan mengurangi residu asam maupun basa pada kolagen yang dihasilkan. Proses penetralan yang baik akan menghasilkan pH akhir yang mendekati netral. Nilai pH kolagen larut papain dapat dilihat pada Gambar 8.
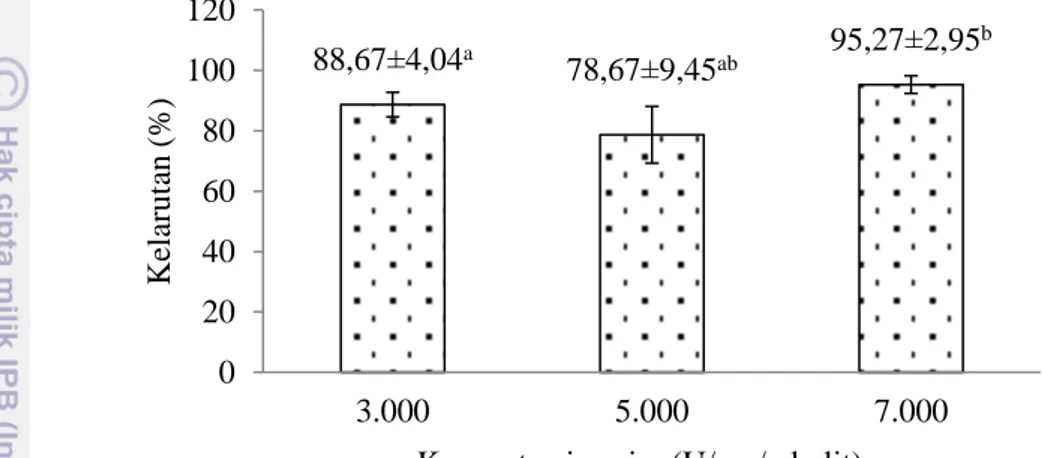
Gambar 8 Nilai pH kolagen larut papain. Kelarutan kolagen kulit ikan tuna sirip kuning
Kelarutan atau solubilitas didefinisikan sebagai kemampuan suatu zat kimia tertentu (solute) untuk larut dalam suatu pelarut (solvent). Kelarutan kolagen kulit ikan tuna sirip kuning dengan ekstraksi enzim papain 3.000, 5.000 dan 7.000 (U/mg/g kulit) diukur pada akudes pH netral di suhu ruang. Kelarutan kolagen pada pH netral akan mempermudah dalam aplikasi. Kelarutan kolagen kulit ikan tuna sirip kuning dengan ekstraksi enzim papain dapat dilihat pada Gambar 9. Ekstraksi kolagen kulit ikan tuna sirip kuning dengan enzim papain memberikan pengaruh nyata (α = 0,05) terhadap kelarutan kolagen. Hasil analisis ragam (ANOVA) kelarutan kolagen dapat dilihat pada Lampiran 6.
Kolagen kulit ikan tuna sirip kuning dengan ekstraksi enzim papain memiliki kelarutan yang berbeda, sedangkan kelarutan tertinggi pada perlakuan enzim 7.000 U/mg/g kulit. Kolagen kulit ikan kakap putih ekstraksi enzim papain memiliki kelarutan tertinggi pada pH 5, sedangkan kelarutan pada pH netral hanya mencapai 50% (Jamilah et al. 2013). Tabarestani et al. (2011) melaporkan kolagen kulit ikan rainbow trout memiliki kelarutan tertinggi pada pH 1, sedangkan kelarutan terendah pada pH 9. Kelarutan kolagen yang tinggi tersebut menunjukkan adanya interaksi kuat antara protein dan air pada pH netral. Kemampuan interaksi yang tinggi tersebut menunjukkan bahwa kolagen berada
5,96±0,09a 5,95±0,04a 5,90±0,22a 0 1 2 3 4 5 6 7 8 9 10 3.000 5.000 7.000 N il ai pH
19
pada pH diatas dan dibawah titik isoelektrik. Kittiphattanabawon et al. (2005) menegaskan bahwa ketika nilai pH berada di atas dan di bawah titik isoelektrik, protein memiliki kemampuan berinteraksi dengan air menjadi lebih tinggi, karena protein memiliki muatan positif atau negatif. Titik isoelektrik protein yaitu keadaan muatan molekul protein sama dengan nol, sehingga interaksi protein menjadi rendah dan menyebabkan pengendapan.
Gambar 9 Kelarutan kolagen larut papain.
Asam amino kolagen kulit ikan tuna sirip kuning
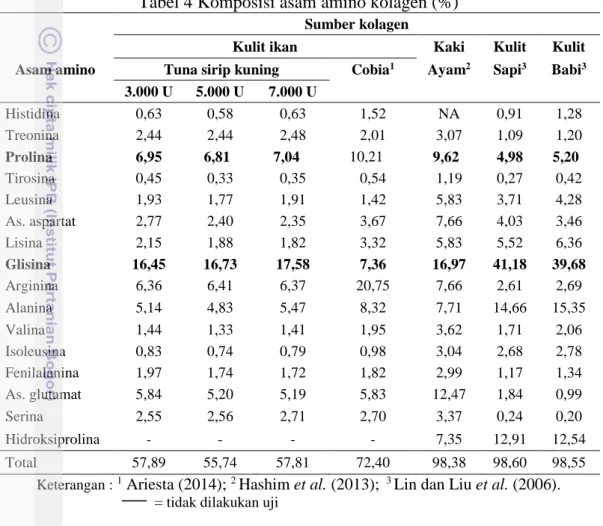
Asam amino terbagi menjadi asam amino esensial (tidak dapat disintesis tubuh) dan non esensial (dapat disintesis oleh tubuh). Tubuh manusia memerlukan komposisi asam amino esensial dan non esensial yang seimbang. Cara menyeimbangkan kebutuhan asam amino tersebut dengan mengkonsumsi bahan olahan yang mengandung asam amino yang diperlukan oleh tubuh. Asam amino pada kolagen kulit ikan tuna sirip kuning dengan berbagai perlakuan serta berbagai sumber lainnya dapat dilihat pada Tabel 4.
Komposisi asam amino tertinggi pada kolagen kulit ikan tuna sirip kuning yaitu glisina dan prolina. Hasil tersebut sesuai dengan penelitian Ariesta ( 2014), Kittiphattanabawon (2010), dan beberapa penelitian lainnya pada sampel kulit ikan. Asam amino glisina pada kolagen menjadi asam amino yang paling dominan, baik kolagen dari sapi, babi maupun ikan. Szpak (2011) menegaskan bahwa 30% bagian dari total asam amino kolagen adalah glisina. Glisina pada kolagen larut papain konsentrasi 3.000; 5.000; dan 7.000 U sebesar 28,42%; 30,01%; dan 30,41%. Kolagen larut papain termasuk kolagen tipe 1, menurut Nalinanon et al. (2011) kolagen tipe 1 yaitu dengan komposisi asam amino glisina dan prolina yang tinggi, serta tirosina dan histidina yang rendah.
Komposisi asam amino kolagen terdapat dua motif dominan yaitu glisina-prolina-x dan glisina-x-hidroksiprolina, dimana x merupakan asam amino lainnya. Kolagen kulit ikan dan kolagen kulit sapi ataupun kulit babi memiliki kecenderungan yang berbeda bila dilihat dari faktor dominan asam amino yang terkandung, namun secara umum masih dapat membentuk struktur triple helix. Kolagen kulit ikan tuna sirip kuning berdasarkan kandungan asam aminonya membentuk struktur triple helix dari glisina, prolina dan arginina. Asam amino
88,67±4,04a 78,67±9,45ab 95,27±2,95 b 0 20 40 60 80 100 120 3.000 5.000 7.000 K el ar ut an (% )
mamalia. Bhattacharjee dan Bansal (2005) menegaskan bahwa asam amino arginina mampu menggantikan asam amino hidroksipolina pada triple helix kolagen lebih stabil dibandingkan dengan asam amino lainnya. Sususnan triple helix kolagen dapat terbukti dari bentuk molekul hasil SDS-PAGE dengan pita α1 dan α2 sebagai penyusun triple helix, dan pita β monomer triple helix tersebut.
Tabel 4 Komposisi asam amino kolagen (%) Sumber kolagen
Kulit ikan Kaki Kulit Kulit Asam amino Tuna sirip kuning Cobia1 Ayam2 Sapi3 Babi3
3.000 U 5.000 U 7.000 U Histidina 0,63 0,58 0,63 1,52 NA 0,91 1,28 Treonina 2,44 2,44 2,48 2,01 3,07 1,09 1,20 Prolina 6,95 6,81 7,04 10,21 9,62 4,98 5,20 Tirosina 0,45 0,33 0,35 0,54 1,19 0,27 0,42 Leusina 1,93 1,77 1,91 1,42 5,83 3,71 4,28 As. aspartat 2,77 2,40 2,35 3,67 7,66 4,03 3,46 Lisina 2,15 1,88 1,82 3,32 5,83 5,52 6,36 Glisina 16,45 16,73 17,58 7,36 16,97 41,18 39,68 Arginina 6,36 6,41 6,37 20,75 7,66 2,61 2,69 Alanina 5,14 4,83 5,47 8,32 7,71 14,66 15,35 Valina 1,44 1,33 1,41 1,95 3,62 1,71 2,06 Isoleusina 0,83 0,74 0,79 0,98 3,04 2,68 2,78 Fenilalanina 1,97 1,74 1,72 1,82 2,99 1,17 1,34 As. glutamat 5,84 5,20 5,19 5,83 12,47 1,84 0,99 Serina 2,55 2,56 2,71 2,70 3,37 0,24 0,20 Hidroksiprolina - - - - 7,35 12,91 12,54 Total 57,89 55,74 57,81 72,40 98,38 98,60 98,55
Keterangan : 1 Ariesta (2014); 2 Hashim et al. (2013); 3 Lin dan Liu et al. (2006).
= tidak dilakukan uji
Asam amino yang telah diketahui terdapat 20 jenis, terdiri dari 9 asam amino esensial dan 11 asam amino nonesensial (Almatsier 2002). Asam amino pada kolagen biasanya diujikan sebanyak 15-17 jenis. Tidak dilakukannya uji asam amino tersebut akan mempengaruhi total asam amino hasil pengujian. Total asam amino kolagen dari kulit ikan tuna yang diekstraksi dengan asam yaitu 46,86% (Mayasari 2016). Total asam amino kulit ikan tuna ekstraksi enzim papain lebih tinggi dibandingkan dengan ekstraksi asam. Asam amino khas pada kolagen yang tidak dilakukan uji yaitu hidroksiprolina. Hidroksiprolina merupakan asam amino turunan prolina, gabungan asam amino tersebut dikenal dengan istilah asam imino yang memiliki fungsi sebagai bahan penstabil panas dari kolagen (Muyonga et al. 2004a).
Perlakuan terbaik ekstraksi kolagen larut papain dari kulit ikan tuna sirip kuning ditentukan berdasarkan karakteristiknya. Perlakuan enzim papain dengan konsentrasi 7.000 U/mg/g kulit dipilih menjadi perlakuan terbaik. Berdasarkan karakteristik kolagen seluruh perlakuan dapat dikategorikan kolagen dengan
21
struktur triple helix, namun bila diukur dari segi ekonomis perlakuan 7.000 U tersebut yang terpilih karena mampu menghasilkan kolagen dengan rendemen lebih tinggi dibandingkan perlakuan lainnya. Karakteristik kolagen larut papain konsentrasi tersebut memiliki pola pita protein murni kolagen, gugus fungsi dengan absorbansi lebih tinggi, kelarutan lebih tinggi serta komposisi asam amino lebih tinggi dari perlakuan lainnya.
Komposisi Kimia Kolagen Ikan Tuna Sirip Kuning Perlakuan Terbaik Komposisi kimia dalam suatu bahan sangat menentukan hasil dari proses ekstraksi yang dilakukan. Analisis komposisi kimia dilakukan pada kolagen perlakuan terbaik yaitu konsentrasi enzim papain 7.000 U/mg/g kulit saat ekstraksi. Komposisi kimia kolagen ikan tuna dapat dilihat pada Tabel 5.
Tabel 5 Komposisi kimia Komposisi kimia Kolagen larut papain dari
kulit ikan tuna sirip kuning
Kulit ikan tuna sirip kuning Kadar air (% bb) 12,07 59,38 Kadar abu (% bk) 3,64 5,44 Kadar lemak (% bk) 0,96 2,82 Kadar protein (% bk) 82,95 89,71
Kadar protein yang terkandung pada kolagen larut papain mendominasi komposisi kimia lainnya. Kadar protein menentukan keberhasilan ekstraksi protein kolagen ini. Rendemen protein pada kolagen larut papain yang berhasil diekstraksi dari kulit ikan tuna sirip kuning sebesar 92, 47%. Contoh perhitungan rendemen protein dapat dilihat pada Lampiran 7. Tingginya rendemen protein tersebut membuktikan bahwa ekstraksi protein kolagen berhasil dilakukan dengan baik.
Kadar air kolagen larut papain dari kulit ikan tuna sirip kuning berada pada batas kadar air yang disyaratkan SNI (2014), yaitu maksimum 12%. SNI 2014 dapat mengenai kolagen kasar dari sisik ikan dapat dilihat pada Lampiran 8. Kadar air kolagen kulit ikan tuna bila dibandingkan terhadap kadar air kulit ikan tuna bahan baku mengalami penurunan. Penurunan kadar air dalam bahan tersebut dikarenakan pada proses pembuatan kolagen terdapat pengeringan. Pengeringan menggunakan freeze dry dengan prinsip menghilangkan atau mengurangi kadar air dalam suatu bahan dengan mekanisme sublimasi yang terjadi pada suhu dingin (Hariyadi 2013). Proses pengeringan yang sempurna akan menghasilkan produk kolagen yang baik.
Kadar abu kolagen mengalami penurunan dari kadar abu bahan baku, namun melebihi kadar abu yang disyaratkan SNI (2014), kadar abu pada kolagen yaitu maksimum 1%. Kadar abu yang tinggi tersebut diduga disebabkan oleh penambahan NaCl dengan konsentrasi tinggi pada saat penggumpalan filtrat hasil ekstraksi. Supriyanti et al. (2013) menjelaskan bahwa kadar abu berhubungan dengan jumlah mineral berupa garam anorganik. Semakin banyak NaCl ditambahkan maka semakin banyak garam anorganik, sehingga semakin tinggi kadar abu dalam bahan. Peningkatan kadar abu pada kolagen juga terjadi pada
pembuatan kolagen juga akan meningkatkan kadar abu, hal ini dapat disebabkan karena proses penetralan yang tidak sempurna.
Kadar lemak kulit ikan tuna sirip kuning terhadap kolagennya mengalami penurunan. Penggunaan butil alkohol pada proses pretreatment berhasil menurunkan kadar lemak pada kolagen yang dihasilkan. Kadar lemak perlu diminimalisir atau bahkan dihilangkan karena untuk mempertahankan produk yang dihasilkan. Shon et al. (2011) menyatakan bahwa keberadaan lemak dan mineral-mineral lainnya akan mengganggu efektivitas kolagen dalam aplikasinya pada berbagai produk.
Kolagen telah banyak diaplikasikan dalam berbagai produk. Aplikasi kolagen diantaranya untuk industri farmasi, teknik jaringan dan industri biomedis (Silvipriya et al. 2015). Kolagen juga banyak digunakan untuk bahan tambah dalam pembuatan kosmetik dan pangan fungsional. Penambahan kolagen pada sediaan kosmetik berfungsi sebagai bahan pelembab. Kurniawan (2016) membuktikan bahwa penambahan kolagen pada sediaan gel menghasilkan kelembaban sebesar 92%. Kolagen dapat dihidrolisis dengan enzim agar diperoleh aktivitas biologis yang bermanfaat bagi kesehatan. Khirzin (2016) melaporkan hidrolisis kolagen selama 180 menit akan mengasilkan aktivitas penghabatan ACE (antihipertensi) dengan penghambatan sebesar 82,31%. Waktu hidrolisis kolagen 120 menit merupakan perlakuan terbaik untuk mendapatkan aktivitas antioksidan dengan nilai inhibition concentration 50 (IC50 ) sebesar 1,9 mg/ml.
KESIMPULAN DAN SARAN
Kesimpulan
Kolagen larut papain dari kulit ikan tuna sirip kuning dapat diekstraksi dengan baik. Konsentrasi enzim 7.000 U/mg/g kulit merupakan perlakuan terbaik dengan karakteristik sebagai berikut: rendemen 22,79±1,29%; bobot molekul dengan pita β, α1 dan α2; gugus fungsi terdiri dari Amida A, B, I, II, III; pH 5,90±0,22; kelarutan 95,27±2,95%; dan asam amino tertinggi glisina, prolina dan arginina. Komposisi kimia tertinggi pada kolagen yaitu kadar protein, dengan rendemen protein 92,47%.
Saran
Perbedaan suhu saat ekstraksi dapat dijadikan perlakuan untuk pengujian selanjutnya. Peningkatan konsentrasi enzim sebagai bahan pengkestrak untuk meningkatkan rendemen. Kolagen hasil ekstraksi dilakukan hidrolisis lanjutan agar menghasilkan aktivitas biologis yang bermanfaat serta dapat diaplikasikan dalam kehidupan sehari-hari.
23
DAFTAR PUSTAKA
Almatsier S. 2002. Prinsip Dasar Ilmu Gizi. Jakarta (ID): Gramedia Pustaka Utama.
Alhana. 2015. Ekstraksi dan karakterisasi kolagen dan nanokolagen dari daging teripang gamma (Stichopus variegatus) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Ariesta C. 2014. Ekstraksi dan karakterisasi kolagen dari kulit ikan cobia (Rachycentron canadum) [skripsi]. Bogor (ID): Institut Pertanian Bogor. [AOAC] Association of Official Analytical Chemyst. 1995. Official Method of
Analysis of The Association of Official Analytical of Chemist. Arlington, Virginia (US): Published by The Association of Official Analytical Chemist, Inc.
[AOAC] Association of Official Analytical Chemyst. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington, 15 Virginia (US): Published by The Association of Official Analytical Chemist, Inc.
Astiana I. 2016. Peranan enzim papain dalam menghasilkan kolagen dari kulit ikan ekor kuning (Caesio cuning) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Bhattacharjee A, Bansal M. 2005. Collagen structure: The madras triple helix and the current scenario. IUBMB Life. 57(3): 161 – 172.
[BPS] Badan Pusat Statistik. 2015. Ekspor ikan tongkol/tuna menurut negara tujuan utama, 2008-2011. Jakarta (ID): Badan Pusat Statistik.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analitical Biochemistry. 72: 248-254.
Brinckmann J, Notbohm H, Müller PK. 2005. Collagen Primer in Structure, Processing and Assembly. New York (USA): Springer.
Coates J. 2000. Encyclopedia of Analytical chemistry: Interpretation of infrared spectra, a practical approach. Meyers RA, editor. Chichester (USA): John Willey & Sons Ltd.
[DJPEN] Direktorat Jenderal Pengembangan Ekspor Nasional. 2012. Ikan tuna Indonesia. Edisi Juni. Jakarta (ID): Direktorat Jenderal Pengembangan Ekspor Nasional.
Duan R, Zhang J, Du X, Yao X, Kunihiko K. 2009. Properties of collagen from skin, scale and bone of carp (Cyprinus carpio). Food Chemistry. 112: 702– 706.
Effinong BN, Fakunle JO. 2011. Proximate and mineral composition of some commercially important fishes in Lake Kainji, Nigeria. Journal of Basic and Applied Scientific Research. 1(12): 2497-2500.
[FAO] Food Agricultural Organization. 1995. Quality and quality changes in fresh fish. Rome (IT): Food Agricultural Organization of United Nations.
Faisal F. 2014. Isolasi dan karakterisasi kolagen dari kulit ikan buntal pisang (Tetraodon lunaris) [skripsi]. Bogor (ID): Institut Pertanian Bogor.