1 BAB I PENDAHULUAN
A. Latar Belakang
Indonesia merupakan salah satu negara yang berada pada garis Khatulistiwa. Setiap negara yang dilalui oleh garis Khatulistiwa memiliki iklim tropis dengan curah hujan yang tinggi. Kondisi ini memberikan keuntungan terutama dalam hal keanekaragaman hayati, baik dari jumlah jenis, varietas, dan ekosistem (Lembaga Ilmu Pengetahuan Indonesia, 2013). Berbagai macam tumbuhan mudah untuk tumbuh di daratan Indonesia dan dapat dimanfaatkan oleh masyarakat untuk tujuan pangan, pertanian, farmasi, dan kelautan.
Tumbuhan memiliki kandungan metabolit sekunder yang dapat dimanfaatkan untuk mengatasi masalah kesehatan. Sebagai contoh adalah daun johar atau yang dikenal dengan nama Cassia siamea Lamk. Di Surakarta, minuman teh johar digunakan untuk pengobatan malaria (Heyne, 1987) berbeda dengan masyarakat Thailand, daun johar dimanfaatkan sebagai makanan kesehatan. Daun johar dibuat menjadi kari yang disebut dengan Khi Lek untuk mengatasi masalah kesulitan buang air besar dan kesulitan tidur (Padumanonda dkk., 2007). Sediaan daun johar juga telah beredar di Thailand dalam bentuk kapsul seberat 400 mg serbuk per kapsul digunakan dengan indikasi mengurangi kesulitan tidur (Teangpook dkk., 2011).
Kandungan daun johar yang bertanggung jawab terhadap efek tidur adalah senyawa barakol yang merupakan salah satu kandungan terbesar dalam daun johar
(Chaichantipyuth, 1979). Barakol diidentifikasi sebagai 3,4-dihidro-3,8-dihidroksi-2,5-dimetil-1,4 dioksapenalen (Hassanali dkk., 1969) yang memiliki efek ansiolitik seperti senyawa diazepam (Thongsaard dkk., 1996).
Johar merupakan pohon tahunan yang dapat hidup bertahun-tahun dan dapat tumbuh dengan cepat. Pohon ini mudah ditemui di daerah tropis seperti Indonesia, namun johar hanya digunakan sebagai pohon perindang karena tinggi dan memiliki daun yang rimbun. Sampai saat ini belum ditemukan adanya pemanfaatan daun johar dalam bidang kesehatan di Indonesia. Kondisi ini dapat dijadikan sebagai peluang bisnis bagi pelaku Usaha Kecil Obat Tradisional (UKOT) dan Industri Obat Tradisional (IOT).
Penggunaan obat tradisional di era modern ini tidak hanya dalam bentuk rebusan dan seduhan, tetapi sudah memperhatikan sediaan farmasetis. Bentuk sedian obat tradisional yang umum digunakan adalah kapsul dan pil. Untuk membuat sediaan obat tradisional tersebut dibutuhkan bahan baku ekstrak.
Pemilihan metode ekstraksi dan pemilihan pelarut merupakan hal penting yang harus diperhatikan dalam pembuatan bahan baku ekstrak untuk sediaan obat tradisional. Penggunaan pelarut yang tidak tepat dapat menurunkan efek atau dapat menghilangkan efek yang diinginkan, karena zat aktif tidak larut sempurna sehingga zat tersebut tidak tersari secara optimal. Selain itu, bagi pelaku bisnis obat tradisional pertimbangan biaya dan waktu produksi tidak dapat dikesampingkan karena berkaitan erat dengan keuntungan yang akan didapat (Departemen Kesehatan Republik Indonesia, 1986).
Maserasi dan infundasi merupakan metode ekstraksi sederhana yang memerlukan peralatan sederhana dan mudah didapat (Departemen Kesehatan Republik Indonesia, 1986) sehingga dapat diaplikasikan dalam UKOT. Pada pemilihan metode penyarian perlu dilakukan orientasi pendahuluan untuk mendapatkan metode ekstraksi yang menghasilkan kadar zat aktif paling optimal. Namun, belum ada penelitian yang membandingkan pengaruh metode ekstraksi antara maserasi dan infundasi daun johar terhadap kandungan aktif barakol. Dasar inilah yang mendorong peneliti melakukan penelitian agar didapatkan data ilmiah mengenai metode ekstraksi yang menghasilkan kandungan barakol paling tinggi, sehingga dapat dijadikan acuan bagi pelaku usaha obat tradisional dalam pemilihan metode ekstraksi daun johar.
B. Rumusan Masalah
Berdasarkan uraian diatas, dirumuskan permasalahan yang diajukan dalam penelitian ini, yaitu:
1. Apakah metode ekstraksi maserasi lebih efektif dalam menyari kandungan barakol dibandingkan metode infundasi?
2. Bagaimana pengaruh fraksinasi dari kedua metode ekstraksi terhadap kadar relatif barakol?
C. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui:
1. Pengaruh perbedaan metode ekstraksi secara maserasi dan infundasi terhadap efektifitas penyarian kandungan barakol.
2. Pengaruh fraksinasi dari kedua metode ekstraksi terhadap kadar relatif barakol.
D. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi ilmiah tentang pengaruh metode ekstraksi dan fraksinasi terhadap kadar relatif barakol yang dihasilkan, sehingga hasil penelitian ini dapat digunakan pelaku Usaha Kecil Obat Tradisional dalam memilih metode ekstraksi daun johar.
E. Tinjauan Pustaka 1. Johar
a. Nama Lain
Cassia siamea Lamk. memiliki beberapa sinonim, yaitu Cassia arborea Macfad., C. sumatrana Roxb., C. gigantea DC., C. arayatensis Naves. (Singh dkk., 2013) dan C. Florida Vahl. (Heyne, 1987). Di Jawa tanaman ini dikenal dengan sebutan tanaman Johar atau Juwar (Heyne, 1987).
b. Taksonomi
Divisi : Spermatophyta Anak divisi : Angiospermae Kelas : Dicotyledoneae Anak kelas : Rosidae
Bangsa : Rosales
Suku : Caesalpiniaceae Marga : Cassia
Jenis : Cassia siamea Lamk.
(Badan Pengawasan Obat dan Makanan Republik Indonesia, 2008; Heyne, 1987).
c. Morfologi
Johar merupakan pohon tahunan dengan tinggi antara 10-20 meter. Memiliki bentuk batang bulat, tegak, berkayu, kulit kasar, bercabang, dan berwarna putih kotor. Daun johar merupakan daun majemuk, berwarna hijau dengan pertulangan daun menyirip, berjumlah genap dan mempunyai
anak daun dengan bentuk bulat panjang. Pada ujung dan pangkal daun berbentuk bulat, bertepi rata dengan panjang 3-7,5 cm dan lebar 1-2,5 cm. Pohon ini memiliki bunga majemuk berwarna kuning yang terletak pada ujung batang, kelopak bunga berjumlah lima, berwarna hijau kekuningan dengan ukuran benang sari ±1 cm. Tangkai sari berwarna kuning, kepala sari berwarna cokelat, serta putik yang berwarna hijau kekuningan. Pada bagian bunga mempunyai daun pelindung yang cepat rontok dan berwarna kuning.
Buah johar berupa buah polong dengan bentuk pipih yang dapat terbelah dua dengan panjang 15-20 cm dan lebar ±1,5 cm. Ketika masih muda buah tersebut berwarna hijau dan setelah tua berubah warna menjadi hitam. Biji berbentuk bulat telur dan berwarna hitam. Memiliki perakaran tunggang dan berwarna hitam (Badan Pengawasan Obat dan Makanan Republik Indonesia, 2008).
d. Distribusi
Johar berasal dari Asia Selatan dan Asia Tenggara. Tumbuhan ini banyak dijumpai di daerah tropis dan dapat tumbuh pada rentang iklim yang luas, tetapi akan tumbuh lebih baik pada daerah dengan curah hujan antara 500-2800 mm yang biasanya memiliki suhu antara 20-31⁰ C dan musim kering antara 4-8 bulan. Tidak dapat tumbuh pada ketinggian lebih dari 1300 m di atas permukaan laut dan pada suhu di bawah 10⁰ C.
Tumbuhan ini dapat tumbuh pada tanah dengan derajat keasaman 5,5-7,5 dan dapat tumbuh di tanah yang tandus tetapi tidak
direkomendasikan karena tumbuhan ini tidak mampu mendegradasi nitrogen. Tumbuhan ini rentan terhadap angin besar karena sistem perakarannya yang dangkal (Joker, 2000).
e. Kandungan Kimia
Menurut Smith (2009), daun johar mengandung beberapa nutrisi yang dibutuhkan tubuh, antara lain protein (4,01%), serat (12,36%), lemak (12,02%), kandungan air (46,01%), kandungan abu (12,93%), dan karbohidrat (7,67%). Selain adanya kandungan nutrisi dalam daun johar, Smith (2009) juga menemukan adanya kandungan mineral antara lain Fe, Mg, Mn, K, Ca, Na, Cu, Pb, dan P.
Hasil dari skrining fitokimia yang dilakukan Smith (2009), didapatkan bahwa daun johar mengandung saponin, antrakuinon, fitobatanin, dan alkaloid. Selain itu, dalam daun johar juga terdapat kandungan β-sitosterol, barakol, apigenin, cassia chromone, 5,7-dihidroksi-3´,4´-metilendioksi flavon, dan 2,4´,5´,7-tetrahidroksi-8-C-glukosil isoflavon (Ganatapy dkk., 2002).
f. Manfaat
Daun johar banyak digunakan dalam pengobatan tradisional antara lain sebagai obat malaria, gatal, kudis, kencing manis, demam, luka, dan dimanfaatkan sebagai tonik karena memiliki kandungan flavonoid dan karotenoid yang cukup tinggi (Yuniarti, 2008). Selain itu, daun johar juga digunakan sebagai laksatif, penginduksi kantuk, antipiretik, dan
antihipersensitif. Di Indonesia daun johar banyak digunakan untuk antipiretik (Singhaburta, 1992).
Ekstrak air dari daun johar dapat direkomendasikan untuk mengatasi gangguan tidur atau insomnia (Thongsaard dkk., 1996). Efek kantuk berasal dari senyawa barakol yang merupakan salah satu kandungan kimia terbesar dalam daun johar. Sediaan daun johar telah diproduksi di Thailand dalam bentuk kapsul untuk mengurangi kesulitan tidur, dengan berat 400 mg serbuk daun johar per kapsul yang setara dengan 10 mg anhidrobarakol (Teangpook dkk., 2011).
2. Barakol
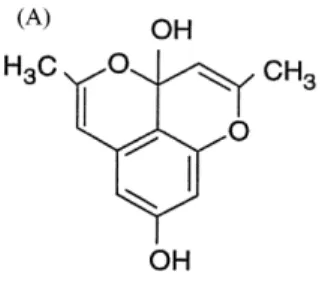
Barakol merupakan salah satu kandungan aktif dalam bunga dan daun muda johar yang telah diidentifikasi sebagai 3,4-hidro-3,8-dihidroksi-2,5-dimetil-1,4-dioksapenalen dan juga diketahui sebagai 2,5-dimetil-3 H piran-[2,3,4-de]-1-benzopiran-3a,8-diol. Barakol (C13H10O3) tersusun dari tiga ring siklik yang tidak stabil (Thongsaard dkk., 2001).
Gambar 2. Struktur kimia barakol (Thongsaard dkk., 2001)
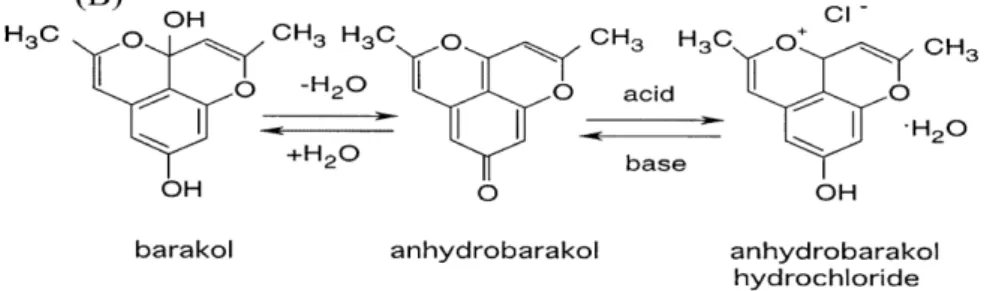
Senyawa ini dapat terdegradasi menjadi anhidrobarakol akibat hilangnya satu molekul H2O. Barakol dapat dibuat menjadi bentuk garam
yang stabil (anhidrobarakol hidroklorida) dengan penambahan asam klorida ke dalam larutan barakol (Thongsaard dkk., 2001).
Gambar 3. Reaksi perubahan barakol, anhidrobarakol, dan anhidrobarakol hidroklorida (Thongsaard dkk., 2001)
Perbedaan sifat kimia antara barakol, anhidrobarakol, dan anhidrobarakol hidroklorida menurut Thongsaard dkk. (2001), dapat dilihat pada Tabel I.
Tabel I. Perbedaan sifat kimia barakol, anhidrobarakol, dan anhidrobarakol hidroklorida
Sifat Barakol Anhidrobarakol
Anhidrobarakol hidroklorida Rumus molekul Warna Titik lebur C13H12O4 Kuning kehijauan 166-170°C C13H10O3 Hijau gelap 163°C C13H12ClO3 Kuning lemon 208-210°C 3. Ekstraksi
Penyarian atau ekstraksi yaitu proses pemisahan zat aktif yang terdapat dalam tumbuhan atau hewan, dari zat pengotor lainnya dengan menggunakan pelarut tertentu (Handa dkk, 2008). Menurut Departemen Kesehatan Republik Indonesia (1986), proses penyarian dapat dibagi menjadi:
a. Pembuatan serbuk
Simplisia adalah bahan alami yang belum mengalami pengolahan apapun digunakan sebagai obat, kecuali dinyatakan lain simplisia merupakan bahan yang dikeringkan (Departemen Kesehatan Republik Indonesia, 1985). Pada umumnya semakin halus serbuk simplisia, proses penyarian akan semakin baik karena permukaan simplisia yang bersentuhan dengan cairan penyari semakin luas (Handa, dkk., 2008). Tetapi dalam pelaksanaannya tidak selalu demikian, karena penyarian tergantung pada sifat fisik dan kimia simplisia tersebut (Departemen Kesehatan Republik Indonesia, 1986).
Dalam penyarian secara perkolasi, serbuk yang terlalu halus dapat menghambat proses penyarian karena ruang antarsel terlalu rapat sehingga mengakibatkan cairan penyari tidak dapat turun. Selain itu, serbuk yang terlalu halus dapat mempersulit penyaringan karena terbentuk suspensi yang sulit untuk dipisahkan (Departemen Kesehatan Republik Indonesia, 1986).
Pembuatan serbuk yang terlalu halus menyebabkan organ, jaringan, dan sel rusak (Handa, dkk., 2008). Dinding sel adalah salah satu organ tumbuhan, merupakan saringan untuk menjaga zat yang tidak larut tetap berada di dalam sel, jika dinding sel pecah maka zat yang tidak diinginkan akan keluar dan dapat mengotori hasil penyarian (Departemen Kesehatan Republik Indonesia, 1986).
b. Pembasahan
Pembasahan dimaksudkan untuk memberikan kesempatan sebesar-besarnya kepada cairan penyari memasuki seluruh pori-pori dalam simplisia sehingga mempermudah penyarian selanjutnya (Departemen Kesehatan Republik Indonesia, 1986).
c. Penyarian
Peristiwa yang berperan pada proses penyarian adalah difusi (Departemen Kesehatan Republik Indonesia, 1986). Difusi merupakan suatu perpindahan massa dari konsentrasi tinggi ke konsentrasi rendah melalui suatu membran. Untuk ekstraksi bahan aktif dari simplisia, pelarut harus berdifusi ke dalam sel dan selanjutnya zat aktif harus cukup larut dalam pelarut. Dengan demikian, akan dicapai kesetimbangan antara solut dan solven (Agoes, 2007).
Jarak antara cairan penyari dengan zat aktif yang terdapat dalam serbuk disebut dengan lapisan batas. Kecepatan dalam melintasi lapisan batas tersebut dipengaruhi oleh derajat perbedaan konsentrasi, tebal lapisan batas, serta koefisien difusi (Departemen Kesehatan Republik Indonesia, 1986).
Perbedaan konsentrasi antara cairan penyari dan zat aktif dalam serbuk akan mempengaruhi daya dorong zat aktif untuk keluar dari serbuk sehingga proses penyarian berjalan lebih cepat. Jarak lapisan batas berbanding lurus dengan ukuran serbuk, semakin besar ukuran serbuk maka semakin besar pula jarak lapisan batas sehingga proses penyarian
akan berjalan lambat. Tetapi serbuk yang terlalu halus akan merusak sel sehingga dapat mengotori hasil penyarian, oleh karena itu pemilihan derajat kehalusan serbuk harus optimal (Agoes, 2007). Selain itu, cairan penyari harus dapat mencapai seluruh serbuk dan secara terus-menerus mendesak larutan yang memiliki konsentrai tinggi untuk keluar (Departemen Kesehatan Republik Indonesia, 1986).
Pemahaman tentang kandungan senyawa dalam simplisia yang akan disari dapat mempermudah proses penyarian karena setiap golongan senyawa memiliki struktur kimia yang berbeda-beda, sehingga akan mempengaruhi kelarutan serta stabilitas terhadap pemanasan, logam berat, udara, cahaya, dan derajat keasaman. Dengan diketahuinya zat aktif yang terkandung dalam suatu simplisia akan mempermudah pemilihan cairan penyari dan metode penyarian yang tepat (Departemen Kesehatan Republik Indonesia, 1986).
Pemilihan cairan penyari harus mempertimbangkan banyak faktor. Kriteria cairan penyari yang baik yaitu murah dan mudah diperoleh, stabil secara fisika dan kimia, bereaksi netral, tidak mudah menguap dan tidak mudah terbakar, tidak mempengaruhi zat yang berkhasiat, dan diperbolehkan oleh peraturan, selektif (hanya menarik zat berkhasiat yang dikehendaki) (Agoes, 2007).
Berikut adalah tabel jenis cairan penyari dengan jenis senyawa yang terlarut didalamnya menurut Pramono (2013).
Tabel II. Jenis pelarut dan jenis senyawa terlarut (Pramono, 2013) No. Jenis Pelarut Jenis Senyawa Terlarut
1. Heksan, petroleum eter Lemak, terpenoid atau minyak atsiri, steroid atau aglikon triterpen, aglikon antrakuinon, flavonoid polimetil, resin, klorofil.
2. Toluen, kloroform, diklorometan
Semua senyawa di atas, isoflavon, alkaloid bebas (bukan garam), kurkumin, fenil propan, fenol sederhana.
3. Dietil eter Semua senyawa di atas, flavonoid polihidroksi, asam fenolat.
4. Etil asetat Semua senyawa di atas, flavonoid monoglikosida, antrakuinon glikosida, steroid glikosida, kumarin glikosida.
5. Etanol, metanol Semua senyawa di atas, flavonoid glikosida, tanin, saponin.
6. Air panas Semua senyawa yang larut dalam
penyari dietil eter sampai etanol, alkaloid garam, karbohidrat, protein, asam amino.
Berdasarkan Farmakope Indonesia, penyari yang dapat digunakan untuk penyarian antara lain air, etanol, campuran etanol-air, atau eter. Penyarian pada perusahaan obat tradisional terbatas pada penyari air, etanol, atau campuran etanol-air (Departemen Kesehatan Republik Indonesia, 1986).
Air banyak dipakai sebagai larutan penyari karena murah, mudah didapat, stabil, tidak mudah menguap, tidak mudah terbakar, tidak beracun, dan alamiah. Kerugian penggunaan air sebagai penyari adalah tidak selektif, sari dapat ditumbuhi kapang dan kuman sehingga cepat rusak, dan untuk pengeringan diperlukan waktu yang lama (Departemen Kesehatan Republik Indonesia, 1986).
Penyari etanol juga banyak digunakan dalam proses penyarian karena memiliki keuntungan antara lain kapang dan kuman sulit tumbuh dalam etanol 20% ke atas, tidak beracun, netral, etanol dapat campur dengan air pada segala perbandingan, dan panas yang diperlukan untuk pemekatan lebih sedikit. Kerugian dari etanol adalah harganya yang mahal (Departemen Kesehatan Republik Indonesia, 1986).
Disamping pemilihan pelarut, pemilihan metode penyarian merupakan faktor lain yang harus dipertimbangkan. Metode ekstraksi dapat dibedakan menjadi:
1) Infundasi
Infundasi adalah proses penyarian dengan penyari air pada suhu 90° C menggunakan panci infusa. Hasil penyarian secara infudasi dapat dibagi menjadi dua yaitu infusa dan dekokta. Perbedaan keduanya terletak pada waktu pemanasan, pemanasan pada dekokta lebih lama yaitu 30 menit sedangkan pada infusa 15 menit (Agoes, 2007). Pada umumnya infundasi digunakan untuk menyari zat aktif yang larut dalam air. Penyarian dengan cara ini menghasilkan sari
yang tidak stabil dan mudah tercemar oleh kuman dan kapang (Departemen Kesehatan Republik Indonesia, 1986).
2) Maserasi
Maserasi dilakukan dengan menempatkan simplisia dalam wadah tertutup dengan pelarut tertentu dan dibiarkan pada suhu kamar selama 3 hari dengan pengadukan (Handa dkk, 2008). Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol, atau pelarut lain. Keuntungan maserasi adalah cara pengerjaan mudah serta peralatan yang digunakan sederhana dan mudah didapat. Kerugian dari cara ini adalah pengerjaannya membutuhkan waktu yang lama dan penyarian kurang sempurna (Departemen Kesehatan Republik Indonesia, 1986).
Pada proses penyarian maserasi perlu dilakukan pengadukan untuk meratakan konsentrasi larutan di luar serbuk sehingga derajat perbedaan konsentrasi dapat terjaga (Departemen Kesehatan Republik Indonesia, 1986).
3) Digesti
Digesti merupakan cara maserasi dengan menggunakan pemanasan (Handa dkk, 2008) suhu 40°-50° C. Cara ini hanya dapat digunakan untuk penyarian simplisia yang zat aktifnya tahan terhadap pemanasan (Departemen Kesehatan Republik Indonesia, 1986). Keuntungan adanya pemanasan menurut Departemen Kesehatan Republik Indonesia (1986) antara lain:
a) Kekentalan pelarut berkurang sehingga dapat meningkatkan daya penetrasi.
b) Daya melarutkan cairan penyari akan meningkat, sehingga pemanasan tersebut memiliki pengaruh yang sama dengan pengadukan.
c) Koefisien difusi berbanding lurus dengan suhu absolut dan berbanding terbalik dengan kekentalan, sehingga kenaikan suhu akan berpengaruh pada kecepatan difusi.
4) Perkolasi
Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan cairan penyari melalui serbuk simplisia yang telah dibasahi. Cara ini lebih baik dibandingkan cara maserasi karena adanya aliran cairan penyari menyebabkan pergantian larutan sehingga meningkatkan derajat perbedaan konsentrasi (Departemen Kesehatan Republik Indonesia, 1986).
Penyarian dalam skala besar perlu memperhatikan alat, waktu, jumlah pelarut, jenis pelarut, ruangan penyarian, dan lain-lain sehingga proses penyarian dapat berlangsung aman dan dapat menghemat biaya yang dikeluarkan. Cairan penyari dipilih yang ekonomis, tidak merusak zat aktif, dan menguntungkan (dalam jumlah kecil dapat melarutkan banyak zat aktif sehingga waktu untuk pemekatan dapat dikurangi dan dapat mengurangi biaya produksi) (Departemen Kesehatan Republik Indonesia, 1986).
d. Penguapan
Penguapan adalah proses terbentuknya uap dari permukaan cairan sehingga didapatkan ekstrak yang lebih pekat. Faktor-faktor yang mempengaruhi penguapan antara lain:
1) Suhu
Suhu berpengaruh pada kecepatan penguapan, semakin tinggi suhu semakin cepat penguapan. Akan tetapi, suhu juga berperan dalam kerusakan bahan yang diuapkan. Oleh karena itu, pengaturan suhu sangat penting agar penguapan dapat berjalan cepat dan kemungkinan terjadinya peruraian dapat dihindari (Departemen Kesehatan Republik Indonesia, 1986).
2) Waktu
Penggunaan suhu yang relatif tinggi untuk waktu yang singkat dapat mengurangi kerusakan dibandingkan dengan penggunaan suhu rendah dengan waktu yang lama (Departemen Kesehatan Republik Indonesia, 1986).
3) Kelembaban
Beberapa senyawa kimia lebih mudah terurai bila kelembabannya tinggi. Reaksi peruraian seperti hidrolisis memerlukan air sebagai medium untuk berlangsungnya reaksi tersebut (Departemen Kesehatan Republik Indonesia, 1986).
4. Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) merupakan metode pemisahan fisikokimia (Stahl, 1985) berbentuk kromatografi planar dengan fase diam berupa lapisan tipis pada permukaan bidang datar yang didukung oleh lempeng kaca, pelat aluminium, atau pelat plastik (Gandjar & Rohman, 2010). Campuran yang akan dipisahkan berupa larutan, ditotolkan berupa bercak atau pita (Stahl, 1985).
a. Fase diam
Fase diam yang banyak digunakan pada KLT adalah silika dan selulosa. Ukuran partikel fase diam akan mempengaruhi proses elusi pada KLT, semakin kecil ukuran rata-rata partikel dan kisaran ukuran partikel fase diam, maka proses KLT lebih efisien serta hasil resolusinya semakin baik. Mekanisme sorpsi yang utama pada KLT adalah partisi dan adsorpsi (Gandjar & Rohman, 2010).
Silika gel merupakan silika amorf yang terdiri dari globula-globula SiO4 tertrahedral yang tersusun secara tidak teratur dan beragregasi membentuk kerangka tiga dimensi yang lebih besar. Rumus silika gel secara umum adalah SiO2.xH2O (Sriyanti dkk., 2005).
Ikatan antara silikon dan oksigen disebut dengan kelompok siloksan (Si-O-Si), sedangkan ikatan antara silikon dan hidroksi (Si-OH) disebut dengan kelompok silanol. Pemisahan pada silika terjadi karena adanya migrasi molekul sampel yang disebabkan oleh ikatan hidrogen, ikatan dipol-dipol, dan ikatan elektrostatik dengan permukaan silanol. Kekuatan adsorpsi ini tergantung pada jumlah kelompok silanol yang aktif, sifat kimia molekul sampel yang akan dipisahkan, dan kekuatan elusi dari fase gerak (Hajnos dkk., 2008).
Silika gel sangat higroskopis, pada kelembaban relatif 45-75% dapat mengikat air hingga 7-20%. Masalah aktivasi silika gel tidak begitu mempengaruhi kebanyakan jenis pemisahan, tetapi deaktivasi silika gel merupakan hal yang perlu dipertimbangkan. Derajat deaktivasi ditentukan oleh kelembaban relatif kamar tempat pemisahan dilakukan dan lempeng silika gel disimpan (Sudjadi, 1986).
Menurut Sudjadi (1986), terdapat beberapa jenis silika gel, diantaranya:
1) Silika gel dengan pengikat. Umumnya menggunakan gipsum (CaSO4 5-15%) sebagai pengikat, disebut dengan silika gel G, sedangkan untuk silika yang menggunakan pati sebagai pengikatnya disebut dengan silika gel S.
2) Silika gel dengan pengikat dan indikator fluoresensi. Jenis silika gel ini biasanya berfluoresensi kehijauan jika dilihat pada sinar ultraviolet panjang gelombang pendek. Sebagai indikator digunakan timah
kadmium sulfida atau mangan timah silikat aktif. Lapisan ini digunakan untuk memudahkan deteksi senyawa yang menyerap pada panjang gelombang 254 nm dan membentuk zona pada latar belakang yang terang (Hajnos dkk., 2008). Jenis ini dikenal dengan silika gel GF254.
3) Silika gel tanpa pengikat. Lapisan ini lebih stabil jika dibandingkan dengan silika gel yang mengandung CaSO4. Beberapa produk ini dinamakan silika gel H atau silika gel N.
b. Fase gerak
Fase gerak akan bergerak sepanjang fase diam karena pengaruh kapiler pada pengembangan secara menaik atau karena pengaruh gravitasi pada pengembangan secara menurun. Fase gerak pada KLT dapat dipilih dari pustaka atau dari hasil orientasi (Gandjar & Rohman, 2010).
Pelarut yang digunakan sebagai fase gerak adalah pelarut dengan mutu analitik (p.a). Penggunaan fase gerak sebaiknya dalam bentuk tunggal, jika menggunakan sistem multikomponen, sedapat mungkin menggunakan campuran sederhana dan maksimal tiga komponen (Stahl, 1985). Fase gerak multikomponen tidak boleh digunakan berulang-ulang karena volatilitas pelarut dapat merubah komposisi dari fase gerak sehingga dapat mempengaruhi pengulangan kromatografi (Hajnos dkk., 2008).
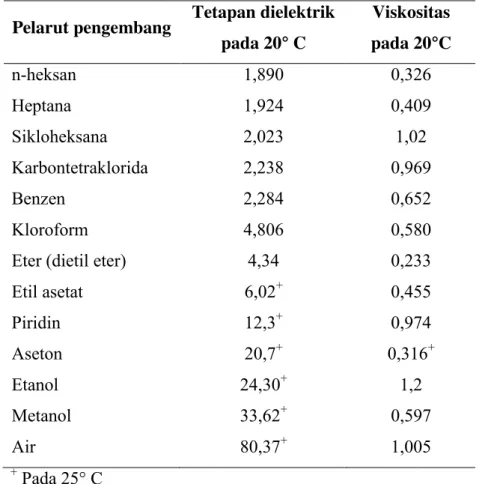
Tabel III. Deret elusi fase gerak menurut Stahl (1985)
Pelarut pengembang Tetapan dielektrik pada 20° C Viskositas pada 20°C n-heksan Heptana Sikloheksana Karbontetraklorida Benzen Kloroform Eter (dietil eter) Etil asetat Piridin Aseton Etanol Metanol Air 1,890 1,924 2,023 2,238 2,284 4,806 4,34 6,02+ 12,3+ 20,7+ 24,30+ 33,62+ 80,37+ 0,326 0,409 1,02 0,969 0,652 0,580 0,233 0,455 0,974 0,316+ 1,2 0,597 1,005 + Pada 25° C
Fase gerak dapat diurutkan berdasarkan efek elusinya. Efek elusi naik seiring dengan kenaikan kepolaran fase gerak. Kepolaraan suatu senyawa dapat dilihat dari angka tetapan dielektrik sedangkan laju rambat tergantung pada viskositas fase gerak yang digunakan (Stahl, 1985).
Fase gerak yang digunakan untuk KLT harus memenuhi berbagai persyaratan antara lain: memiliki kemurnian yang tinggi, viskositas rendah, tidak merusak fase diam, tidak bereaksi dengan senyawa yang akan dipisahkan, mudah dihilangkan dari lapisan fase diam, dan harus sesuai dengan metode deteksi (Hajnos dkk., 2008).
c. Penotolan dan pengamatan
Penotolan bercak atau sampel biasanya sebanyak 1-10 µL dengan konsentrasi 0,1-1%. Penotolan disarankan menggunakan mikropipet berujung runcing dengan skala 1-10 µL. Lapisan fase diam tidak boleh rusak selama penotolan sampel. Jarak antara bercak dengan tepi lempeng fase diam sekurang-kurangnya 10 mm (Stahl, 1985).
Pengamatan KLT dilakukan dengan cara membandingkan nilai Rf solut dengan nilai Rf senyawa baku (Gandjar & Rohman, 2010). Nilai Rf yang diperoleh hanya spesifik pada fase gerak dan fase diam yang digunakan (Sastrohamidjojo, 2002).
Rf =jarak yang digerakkan oleh senyawa dari titik asal jarak yang digerakkan oleh pelarut dari titik asal
Menurut Sastrohamidjojo (2002), faktor yang mempengaruhi gerakan bercak dalam KLT yang juga mempengaruhi harga Rf antara lain: 1) Struktur kimia dari senyawa yang sedang dipisahkan.
2) Sifat dari penjerap dan derajat aktivasinya. Aktivasi dicapai dengan pemanasan menggunakan oven, hal ini akan mengeringkan molekul-molekul air yang menempati pusat-pusat serapan dari penjerap.
3) Tebal dan kerataan dari lapisan penjerap. 4) Fase gerak (Gandjar & Rohman, 2010)
a) Fase gerak harus mempunyai kemurnian yang sangat tinggi karena KLT merupakan teknik yang sensitif.
b) Daya elusi fase gerak harus diatur sedemikian rupa sehingga harga Rf terletak antara 0,2-0,8 untuk memaksimalkan pemisahan.
c) Untuk pemisahan dengan menggunakan fase diam polar seperti silika, polaritas fase gerak akan menentukan kecepatan migrasi solut yang berarti juga menentukan nilai Rf. Penambahan pelarut yang bersifat sedikit polar seperti dietil eter ke dalam pelarut nonpolar seperti metil benzen akan meningkatkan nilai Rf secara signifikan.
5) Derajat kejenuhan uap dalam bejana.
6) Teknik percobaan, arah pelarut bergerak pada pelat.
7) Jumlah sampel yang digunakan. Jumlah sampel yang berlebihan memberikan tendensi penyebaran noda-noda dengan kemungkinan terbentuknya ekor.
8) Suhu. Proses pemisahan dikerjakan pada suhu tetap untuk mencegah adanya perubahan komposisi fase gerak yang disebabkan oleh penguapan.
9) Kesetimbangan. Atmosfer dalam bejana harus jenuh dengan uap fase gerak, bila atmosfer dalam bejana tidak jenuh dengan uap fase gerak, akan terjadi pengembangan berbentuk cekung.
Deteksi KLT paling sederhana untuk senyawa yang memiliki serapan pada daerah UV gelombang pendek yaitu radiasi pada panjang gelombang 254 nm dan 366 nm. Senyawa yang tidak memiliki serapan di daerah UV dapat dilakukan penyemprotan dengan pereaksi kimia yang sesuai. Selain itu, deteksi biologi juga dapat digunakan untuk mendeteksi senyawa hasil KLT (Stahl, 1985).
d. Kegunaan
KLT dapat digunakan untuk berbagai analisis, antara lain: 1) Analisis kualitatif
KLT dapat digunakan untuk pemeriksaan identitas dan kemurnian suatu senyawa, pemeriksaan simplisia, pemeriksaan komposisi dan komponen aktif dari suatu sediaan (Roth & Blaschke, 1981). Dua senyawa dikatakan identik jika mempunyai nilai Rf yang sama jika diukur pada kondisi KLT yang sama. Untuk meyakinkan, identifikasi dapat dilakukan dengan menggunakan lebih dari satu fase gerak dan jenis pereaksi semprot (Gandjar & Rohman, 2010).
2) Analisis kuantitatif
Ada dua cara yang digunakan untuk analisis kuantitatif dengan KLT. Pertama, bercak diukur langsung pada lempang dengan menggunakan ukuran luas atau dengan teknik densitometri. Kedua, dengan mengerok bercak lalu menetapkan kadar senyawa yang terdapat dalam bercak tersebut dengan metode spektrofotometri. Pada cara pertama, tidak terjadi kesalahan yang disebabkan oleh pemindahan bercak atau kesalahan ekstraksi, sementara pada cara kedua sangat mungkin terjadi kesalahan karena pengambilan atau karena ekstraksi (Gandjar & Rohman, 2010).
3) Analisis preparatif
Analisis preparatif ditujukan untuk memisahkan analit dalam jumlah yang banyak. Pada KLT ini, sampel ditotolkan pada lempeng
dengan lapisan yang besar lalu dikembangkan dan dideteksi dengan cara yang non-destruktif. Bercak yang mengandung analit selanjutnya dikerok dan dilakukan analisis lebih lanjut (Gandjar & Rohman, 2010). Keuntungan dari KLT adalah mudah, murah, dan peralatan yang digunakan sederhana. Selain itu, KLT dapat digunakan untuk tujuan analisis, identifikasi komponen dapat dilakukan dengan pereaksi warna, fluoresensi, atau dengan radiasi menggunakan sinar UV. KLT memiliki ketepatan penentuan kadar yang baik karena komponen yang akan ditentukan berupa bercak yang tidak bergerak (Gandjar & Rohman, 2010). Menurut Sastrohamidjojo (2002), KLT hanya membutuhkan penjerap dan cuplikan dalam jumlah yang sedikit, waktu yang dibutuhkan untuk elusi juga lebih singkat (tergantung jenis fase gerak yang digunakan).
5. Densitometri
Analisis kuantitatif KLT biasanya dilakukan dengan densitometer langsung pada lempeng KLT. Kebanyakan densitometer mempunyai sumber cahaya, monokromator untuk memilih panjang gelombang yang cocok, sistem untuk memfokuskan sinar pada lempeng, pengganda foton, dan rekorder. Densitometer dapat bekerja secara serapan atau fluoresensi (Gandjar & Rohman, 2010).
a. Sistem serapan dapat dilakukan dengan metode pantulan atau transmisi. 1. Cara pantulan, yang diukur adalah sinar yang dipantulkan, dapat
2. Cara transmisi, dilakukan dengan menyinari bercak dari satu sisi dan mengukur sinar yang diteruskan pada sisi lain.
Gangguan pada sistem ini adalah adanya fluktuasi latar belakang yang dapat dikurangi dengan beberapa cara, misalnya menggunakan alat berkas ganda (sistem pantulan dan transmisi secara bersamaan) atau dengan sistem dua panjang gelombang (Gandjar & Rohman, 2010).
b. Sistem fluoresensi lebih dipilih untuk senyawa yang dapat dibuat berfluoresensi. Batas deteksi sistem ini lebih rendah, kelinieran respon dan selektivitasnya lebih tinggi. Selain itu, gangguan fluktuasi latar belakang juga lebih rendah.
Bercak yang diukur dengan sistem fluoresensi, serapan ultraviolet, atau sinar tampak dapat ditetapkan lebih teliti daripada bercak yang disemprot dengan pereaksi warna karena keseragaman penyemprotan merupakan hal yang sangat menentukan (Gandjar & Rohman, 2010). Kurva baku dalam densitometri dibuat untuk setiap lempeng dan kadar senyawa dihitung seperti pada metode spektrofotometri (Sudjadi, 1986).
Faktor yang menyebabkan ketidaksuksesan dalam densitometri antara lain pemisahan sampel yang tidak sempurna, penggunaan standar terlalu kecil sehingga tidak dapat dibaca, aplikasi reagen semprot tidak seragam, dan rapuhnya lempeng KLT. Masalah-masalah tersebut dapat diminimalisir, oleh karena itu, metode densitometri ini dapat diterima sebagai metode kuantitatif untuk KLT (Stahl, 1985).
F. Landasan Teori
Barakol merupakan salah satu kandungan terbesar dalam daun johar yang memiliki aktivitas ansiolitik untuk mengurangi kesulitan tidur (Padumanonda dkk., 2007). Barakol atau 3a-4-dihidro-3a,8-dihidroksi-2,5-dimetil-1,4-dioksafenalen (Hassanali dkk., 1969) larut dalam metanol, etanol, dan aseton, cukup larut dalam kloroform dan diklorometan, dan mudah larut dalam karbon tetraklorida, etil eter, dan air (Thongsaard, 1998). Berdasarkan sifat kelarutan tersebut, barakol dapat diekstraksi menggunakan metode maserasi dengan pelarut etanol dan infundasi dengan pelarut akuades.
Berdasarkan hasil penelitian Padumanonda & Gritsanapan (2006), didapatkan kadar barakol dalam rebusan daun johar segar sebesar 0,4035% b/b, sedangkan pada penelitian yang dilakukan oleh Sakunpak dkk. (2014), didapatkan kadar barakol dalam ekstrak metanol daun johar sebesar 2,6% b/b. Kedua penelitian tersebut menggunakan metode KLT-densitometri untuk menghitung kadar barakol.
Barakol memiliki cincin trisiklik yang tidak stabil dan dapat berubah menjadi anhidrobarakol. Dalam suasana asam, anhidrobarakol berubah menjadi bentuk garam yang stabil (Thongsaard, 1998). Struktur barakol memiliki banyak ikatan C-C, karenanya barakol bersifat nonpolar yang larut dalam pelarut nonpolar. Bentuk garam barakol yaitu anhidrobarakol hidroklorid berbentuk ion yang larut dalam air.
Pelarut etanol merupakan pelarut semipolar dengan struktur C2H5OH. Etanol memiliki gugus hidroksi (OH) yang bersifat polar dan gugus etil (C2H5)
yang bersifat nonpolar. Oleh sebab itu, etanol dapat melarutkan baik senyawa polar (garam) maupun nonpolar (barakol dan anhidrobarakol). Berbeda dengan akuades (H2O) hanya memiliki gugus OH yang bersifat polar. Berdasarkan sifat tersebut etanol dapat melarutkan berbagai bentuk ubahan barakol, sedangkan air hanya dapat melarutkan barakol yang berbentuk garam. Dengan demikian, diduga ekstraksi daun johar secara maserasi menghasilkan ekstrak dengan kadar relatif barakol lebih tinggi dibandingkan ekstraksi secara infundasi.
Fraksinasi merupakan upaya untuk menghilangkan senyawa-senyawa tidak berguna yang ikut tersari sehingga kadar senyawa aktif dapat diperoleh dengan kadar lebih tinggi. n-Heksan dapat melarutkan senyawa pengganggu seperti klorofil yang terdapat dalam daun. Fraksinasi dengan etanol terhadap ekstrak hasil infundasi dapat menghilangkan polisakarida yang menyebabkan gelatinisasi pada ekstrak dekokta karena polisakarida tidak larut dalam etanol. Oleh karena itu, proses fraksinasi ekstrak maserasi dan ekstrak dekokta dapat berpengaruh terhadap kandungan barakol.
G. Hipotesis
1. Ekstraksi daun johar secara maserasi lebih efektif dalam menyari kandungan barakol dibandingkan ekstraksi secara infundasi.
2. Proses fraksinasi dari kedua metode ekstraksi memiliki pengaruh terhadap kadar relatif barakol yang tersari.