1
Penyakit infeksi merupakan salah satu masalah global yang dihadapi saat ini. Mikroorganisme patogen seperti bakteri, virus, parasit, atau fungi merupakan penyebab penyakit infeksi (WHO, 2017). Produk bahan alam menjadi sumber yang kuat sebagai antimikroba seperti penisilin yang ditemukan pada tahun 1940. Hal ini mendorong melakukan penelitian mengenai penemuan agen antimikroba yang berasal dari bahan alam (Cushnie dan Lamb, 2005). Namun, beberapa tahun terakhir, penelitian tentang mikroorganisme lingkungan darat sulit dilakukan karena senyawa yang dihasilkan serupa dalam hal struktur kimia. Dibandingkan dengan lingkungan darat, lingkungan laut memiliki karakteristik yang unik. Baru-baru ini, beberapa produk mikroorganisme laut dilaporkan memiliki struktur kimia yang menarik dan memiliki bioaktivitas (Kim, 2013).
Indonesia merupakan sebuah negara kepulauan yang memiliki luas lautan dua pertiga dari luas wilayah Indonsia. Hal ini ditunjukkan dengan adanya garis pantai hampir di setiap pulau di Indonesia (Anonim, 2015a). Keberadaan spons di perairan Indonesia cukup besar dengan jumlah spesies mencapai 850 spesies (Nurhayati, 2009). Spons merupakan salah satu hewan invertebrata laut yang menghasilkan senyawa aktif dan mempunyai potensi aktivitas biologi (Yulianty, 2011). Ekstrak metabolit dari spons diketahui mempunyai aktivitas seperti: sitotoksik, fungisid (Setyowati, 2005), dan antimikroba (Yulianty, 2011).
Diketahui hampir 40% tubuh spons terdiri atas mikroba, sehingga ada kemungkinan senyawa yang dihasilkan merupakan senyawa yang diproduksi oleh mikroba simbionnya. Contohnya, Depsipetida yang diisolasi dari spons laut diketahui dihasilkan oleh bakteri Bacillus pumilus yang berasosiasi dengan spons (Thakur dan Muller, 2004). Produk alam laut juga memiliki masalah ketersediaan bahan baku. Selain itu, adanya larangan panen liar organisme laut karena dapat mengancam kelestariannya. Sebagai alternatif, penggunaan mikroorganisme dinilai lebih menguntungkan. Salah satu mikroorganisme tersebut adalah fungi. Pertumbuhan fungi lebih cepat dibandingkan dengan inangnya dan dapat diproduksi dalam skala besar dengan metode fermentasi (Anggraini, 2012)
Pada penelitian ini akan dilakukan uji aktivitas antimikroba fungi kode SAL 3 asosiasi spons Stylissa flabelliformis dari perairan kawasan Pulau Menjangan Taman Nasional Bali Barat terhadap Staphyloccus aureus, E. coli, dan C. albicans. Penelitian ini juga akan mencari senyawa bioaktif yang bertanggung jawab sebagai antimikroba dari fermentasi fungi kode SAL 3 asosiasi spons S. flabelliformis yang berasal dari perairan kawasan Pulau Menjangan Taman Nasional Bali Barat.
B. Rumusan Masalah
1. Apakah fungi kode SAL 3 asosiasi spons S. flabelliformis dari perairan kawasan Pulau Menjangan Taman Nasional Bali Barat memiliki aktivitas antimikroba ? 2. Bagaimana aktivitas ekstrak etil asetat hasil fermentasi fungi kode SAL 3 ? 3. Termasuk golongan apakah senyawa antimikroba tersebut ?
C. Tujuan Penelitian
1. Mengetahui aktivitas antimikroba fungi kode SAL 3 asosiasi spons S. flabelliformis dari perairan kawasan Pulau Menjangan Taman Nasional Bali Barat.
2. Mengetahui aktivitas antimikroba ekstrak etil asetat hasil fermentasi fungi kode SAL 3.
3. Mengetahui golongan senyawa antimikroba tersebut.
D. Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat bermanfaat dalam penemuan senyawa bioaktif yang memiliki aktivitas antimikroba dan dapat memberikan informasi mengenai metode lain untuk mendapatkan senyawa bioaktif dari spons selain mengambilnya dari spons secara langsung.
E. Tinjauan Pustaka 1. Spons dan Simbionnya
Spons merupakan organisme multiseluler tingkat rendah dan termasuk invertebrata laut dalam filum porifera (Setyowati dkk., 2004). Spons merupakan hewan bersifat filter feeder dengan tubuh berpori, dimana spons mengambil makanan dengan cara menyaringnya (Proksch dkk., 2002). Spons Stylissa flabelliformis berbentuk kipas tipis, uni-planar hingga multi planar, atau tidak beraturan dengan warna merah pucat, orange, kuning, atau krem memiliki tekstur lunak (Alvarez dan Hooper, 2010). Pada spons S. flabelliformis ditemukan senyawa Jaspamide.
Jaspamide menunjukkan adanya aktivitas antimikroba (Setyowati, 2004; Setyowati, 2005). Klasifikasi spons S. flabelliformis sebagai berikut :
Kerajaan : Animalia Divisi : Porifera Kelas : Demospongiae Ordo : Halichondrida Genus : Stylissa
Spesies : Stylissa flabelliformis
(Hooper dan Soest, 2002) Spons laut merupakan tempat hidup bagi mikroorganisme yang dapat mencapai 40% dari volume spons. Mikroorganisme laut memiliki hubungan yang erat dengan organisme laut untuk bertahan hidup. Beberapa bakteri dan jamur hidup di permukaan, di dalam tubuh atau sel-sel dari makroorganisme laut seperti spons. Hubungan antara mikroorganisme dengan inangnya dapat berupa simbiosis yang saling menguntungkan, organisme inang akan memenuhi kebutuhan nutrisi mikroorganisme simbionnya sedangkan mikroorganisme simbion akan melindungi inangnya dengan cara menghasilkan metabolit sekunder (Himaya dan Kim, 2013). Mikroorganisme tersebut dapat berupa bakteri, fungi, dan mikroalga (Thomas dkk., 2010).
Fungi asosiasi merupakan fungi yang hidup pada jaringan inang tanpa menyebabkan penyakit pada inangnya. Fungi asosiasi dapat menghasilkan senyawa-senyawa yang memiliki aktivitas antibakteri, antifungi, antivirus, antikanker, antimalaria, dan sebagainya (Strobel, 2003). Fungi dapat menghasilkan berbagi
senyawa bioaktif seperti terpenoid, alkaloid, fenolik, flavonoid, fenil propanoid, poliketida, senyawa alifatik dan peptida. Senyawa golongan terpenoid dan poliketida merupakan senyawa yang paling banyak ditemukan sedangkan flavonoid dan lignan jarang ditemukan pada fungi (Mousa dan Raizada, 2013). Menurut Samuelsson (1999), flavonoid tersebar dalam tumbuhan paku dan tumbuhan tingkat tinggi.
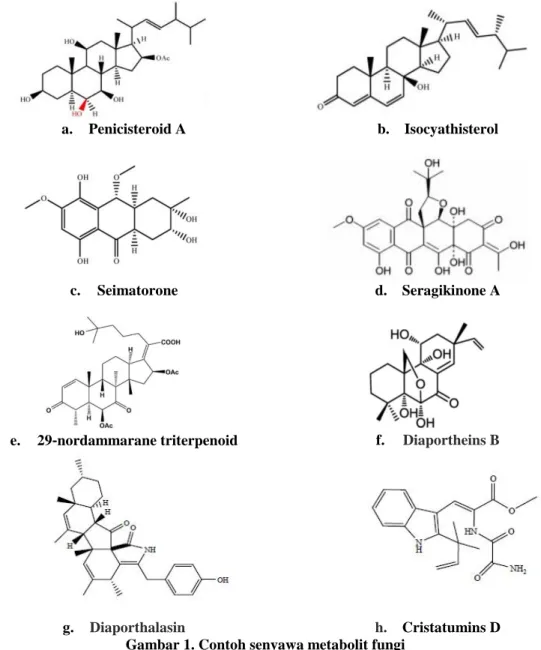
Senyawa yang memiliki aktivitas antimikroba berhasil diisolasi dari fungi yang berasal dari laut. Penicisteroid A (Gambar 13. a) diisolasi dari Penicillium chrysogenum QEN-24S yang memiliki aktivitas antifungi terhadap Aspergillus niger
dan Alternaria brassicae. Isocyathisterol (Gambar 13. b) diisolasi dari Aspergillus ustus cf-42 menunjukkan adanya aktivitas antimikroba terhadap E. coli dan S. aureus.
Eimatorone (Gambar13. c) yang diisolasi dari Seimatosporium sp. No. 8883 menunjukkan aktivitas antibakteri terhadap E. coli dan Bacillus megaterium (Xu dkk., 2015). Fungi K063 aosisasi rhodopyta Ceratodictyon spongiosum menghasilkan Seragikinone A (Gambar 13. d) yang menunjukkan aktivitas anti fungi terhadap C. albicans (Bugni dan Ireland, 2002). Fungi Aspergillus sydowi PFW1‐13 yang diisolasi dari driftwood yang berasal dari laut Baishamen, Hainan, China, menghasilkan senyawa 29‐nordammarane triterpenoid (Gambar 13. e). Senyawa tersebut memiliki aktivitas antimikroba terhadap E. coli, Bacillus subtilis dan Micrococcus lysoleikticus (Zhang dkk., 2008). Aktivitas antimikroba
terhadap Mycobacterium tuberculosis dihasilkan oleh pimarane diterpenes,
(Dettrakul dkk., 2003). Alkaloid indol Diaporthalasin diisolasi dari Diaporthaceae sp.
PSU-SP2/4, menunjukkan aktivitas terhadap S. aureus dan methicillin-resistant S. aureus (MRSA) (Khamtong dkk., 2014). Cristatumins D dari Eurotium cristatum
EN-220 menunjukkan aktivitas abtimikroba terhadap S. aureus (Zhou dkk., 2014).
a. Penicisteroid A b. Isocyathisterol
c. Seimatorone d. Seragikinone A
e. 29‐nordammarane triterpenoid f. Diaportheins B
g. Diaporthalasin h. Cristatumins D
Gambar 1. Contoh senyawa metabolit fungi
(Xu dkk., 2015; Bugni dan Ireland, 2002; Zhang dkk., 2008; Dettrakul dkk., 2003; Khamtong
2. Media Pertumbuhan Mikroorganisme
Media pertumbuhan harus mengandung nutrisi yang dibutuhkan mikroorganisme untuk melakukan biosintesis. Nutrisi yang dibutuhkan antara lain berupa sumber karbon, nitrogen, sulfur, fosfor, mineral, dan growth factor (Brooks dkk., 2013). Berdasarkan kandungan nutrisinya, media dibedakan menjadi media sintetik dan media kompleks. Media sintetik merupakan media yang komponen penyusunnya diketahui secara pasti. Media kompleks merupakan media yang tersusun dari komponen yang secara kimia tidak diketahui. Menurut konsistensinya, media dibedakan menjadi media cair dan media padat. Pada media padat, ditambahkan bahan pembeku misalnya agar (Pratiwi, 2008).
Media SDA berisi Dekstrosa (glukosa), pepton, dan agar. Pepton diperoleh dari digesti enzimatik kasein dan jaringan hewan. Pepton merupakan sumber nitrogen dan vitamin yang dibutuhkan untuk pertumbuhan organisme. Dekstrosa merupakan sumber energi dan karbon. Media SDA memiliki pH asam sekitar 5,6 yang dapat mencegah pertumbuhan bakteri sehingga selektif untuk pertumbuhan khamir dan fungi berfilamen (Anonim, 2017b).
Media NA merupakan media umum yang digunakan untuk pertumbuhan berbagai mikroorganisme. Media ini dibuat dari beef extract, pepton, NaCl, dan Agar. Beef extract mengandung vitamin, karbohidrat, nitrogen dan garam untuk
pertumbuhan bakteri. Pepton merupakan hidrolisat protein, diperoleh dari digesti parsial daging, kasein, bubuk kedelai, gelatin dan sumber protein lain yang berperan sebagai sumber energi, karbon, dan nitrogen. Adanya garam dalam NA menjaga
konsentrasi garam dalam media agar serupa dengan sitoplasma mikroorganisme (Anonim, 2017c; Pratiwi, 2008).
3. Fermentasi a. Sistem Batch
Sistem batch merupakan sistem tertutup, dimana nutrsi untuk pertumbuhan mikroba dan produsi metabolit sekunder berada dalam satu tempat. Dalam sistem ini, tidak ada penambahan nutrisi dan pengambilan produk selama fermentasi (Stanbury dkk., 1995).
b. Sistem Fed-Batch
Sistem fed-batch adalah suatu sistem yang dilakukan penambahan media baru secara teratur pada kultur tertutup tanpa mengeluarkan cairan kultur yang ada di dalam sistem fermentasi sehingga volume kultur makin lama makin bertambah. c. Sistem Continuous
Sistem continuous merupakan sistem gabungan dari sistem batch dan fed-batch (Stanbury dkk., 1995). Selama fermentasi berlangsung, dilakukan penambahan nutrisi atau media baru dan dilakukan pengeluaran massa sel yang dihasilkan. Pembentukan biomassa baru dalam kultur sebanding dengan pengeluaran massa sel dari fermentor.
Pertumbuhannya mikroba mengalami empat fase yaitu fase lag, fase log, fase stasioner, dan fase kematian. Fase lag merupakan fase adaptasi dimana mikroorganisme mengalami penyesuaian pada lingkungan baru. Pada fase lag, hanya terjadi penambahan ukuran sel, tidak terjadi penambahan jumlah sel. Fase log atau fase eksponensial merupakan fase dimana mikroorganisme mulai tumbuh dan
memperbanyak jumlah sel secara cepat dan dalam jumlah banyak. Pada fase stasioner, pertumbuhan mikroorganisme berhenti. Pada fase ini, terjadi kekurangan nutrien dan akumulasi produk buangan toksik. Fase yang terakhir adalah fase kematian. Pada fase ini akumulasi produk buangan toksik meningkat sehingga menyebabkan kematian sel. Selain itu, kematian sel disebabkan karena media kultur sudah tidak dapat menyediakan nutrisi bagi pertumbuhan mikroorganisme pada fase kematian, sel mati dan mengalami lisis (Brooks dkk., 2013; Pratiwi, 2008).
Pertumbuhan mikroorganisme dapat diukur secara langsung maupun tidak langsung. Pengukuran pertumbuhan mikroorganisme secara langsung dapat dilakukan dengan pengukuran menggunakan bilik hitung, electronic chamber, platting technique, dan teknik filtrasi membran. Pengukuran pertumbuhan sel secara tidak
langsung dilakukan dengan pengukuran kekeruhan dengan spektrofotometer, pengukuran aktivitas metabolik dan pengukuran berat kering sel.Pengukuran berat kering sel merupakan metode yang umum digunakan untuk mengukur pertumbuhan fungi berfilamen. Miselium fungi dipisahkan dari media kemudian dikeringkan hingga diperoleh berat konstan dan dihitung sebagai berat kering sel (Pratiwi, 2008). 4. Uji Aktivitas Antimikroba
a. Metode Difusi
Prinsip metode difusi adalah kemampuan agen antimikroba untuk berdifusi ke dalam media agar yang telah ditanam dengan bakteri uji. Beberapa metode difusi yang sering digunakan antara lain adalah disc diffusion (tes Kirby & Bauer), E-test, ditch-plate technique, cup-plate technique, dan gradient-plat technique.
Metode disc diffusion untuk menentukan aktivitas agen antimikroba. Paper disc yang mengandung agen antimikroba diletakkan di permukaan media Agar yang telah ditanam bakteri uji sehingga agen antimikroba akan berdifusi pada media Agar tersebut. Adanya area jernih yang terbentuk menunjukkan adanya hambatan pertumbuhan bakteri oleh agen antimikroba.
Selain metode disc-diffusion, uji yang dapat dilakukan untuk mengamati zona hambat bakteri adalah metode sumuran (cup-plate technique). Dibuat sumuran pada media Agar padat yang telah ditanam bakteri, agen antimikroba diletakkan dalam sumuran yang dibuat (Pratiwi, 2008). Pengamatan dilakukan dengan melihat ada tidaknya diameter hambat yang timbul di sekitar sumuran (Lorian, 1980).
b. Metode Dilusi
Metode dilusi dibagi menjadi dua yaitu dilusi cair (broth dilution) dan dilusi padat (solid dilution). Perbedaan dari kedua metode ini adalah media yang digunakan dalam uji aktivitas antimikroba. Dilusi cair menggunakan media cair sedangkan dilusi padat menggunakan media padat.
Metode dilusi cair mengukur MIC (minimum inhibitory concentration) atau KHM (kadar hambat minimum) dan MBC (minimum bactericidal concentration) atau KBM (kadar bunuh minimum). Cara yang dilakukan adalah dengan membuat seri pengenceran agen antimikroba pada media cair yang ditambahkan bakteri uji. Konsentrasi agen antimikroba terendah yang dapat menghambat pertumbuhan mikroba dideteksi kekeruhannya secara visual, larutan agen antimikroba kadar terkecil yang terlihat jernih ditetapkan sebagai MIC. Larutan yang ditetapkan sebagai
MIC dikultur ulang pada media cair kemudian diinkubasi. Media yang tetap terlihat jernih setelah inkubasi ditetapkan sebagai MBC. Metode dilusi padat serupa dengan metode dilusi cair, namun media yang digunakan adalah media padat (Pratiwi, 2008). 5. Mikroba Uji
a. Staphylococcus aureus
Bakteri S. aureus merupakan bakteri Gram positif termasuk dalam famili Staphylococcaceae (Todar, 2008). Bakteri S. aureus berbentuk bulat atau lonjong (0,8 sampai 0,9 µ) dan tersusun secara berkelompok seperti buah anggur. Bakteri ini bersifat aerob dan tumbuh baik pada suhu pada temperatur 37oC dan pH 7,4 (Gupte, 2010).
b. Escherichia coli
E coli merupakan bakteri Gram negatif termasuk dalam Enterobacteriaceae. E.
coli hidup di dalam kolon usus manusia dan usus hewan berdarah panas (Welch,
2006). E. coli berbentuk batang pendek berukuran 2,4 µ x 0,4 sampai 0,7 µ. bakteri E. coli bersifat aerob atau anaerob fakultatif dan tumbuh baik pada suhu 37oC dan pH 7,4 (Gupte, 2010).
c. Candida albicans
C. albicans secara mikroskopik terlihat sebagai budding cell berbentuk lonjong
bertunas, berukuran kecil, dan menghasilkan pseudomiselium dalam biakannya. C. albicans merupakan flora normal selaput lendir saluran pernafasan, saluran
pencernaan dan genitalia wanita. Infeksi pada genitalia wanita dapat menyebabkan vulvovaginitis (Brooks dkk., 2013).
6. KLT-Bioautografi
a. KLT (Kromatografi Lapis Tipis)
Kromatografi merupakan suatu metode analisis untuk memisahkan senyawa berdasarkan kepolarannya. Pada KLT, terdapat dua fase yaitu fase diam yang berupa bidang datar dan fase yang akan bergerak atau mengembang disepanjang fase diam, fase ini disebut fase gerak dan terjadi karena adanya pengaruh kapiler. Istilah kromatografi pada mulanya diperkenalkan oleh E. Stahl pada tahun 1956 dan mendefinisikan kromatografi sebagai proses pemisahan dimana fase diam terdiri dari lapisan tipis yang dijerapkan pada suatu substrat padat. Keuntungan menganalisis senyawa dengan metode ini adalah karena peralatan yang digunakan sederhana, cepat dan dapat diidentifikasi dengan fluoresensi dibawah sinar ultraviolet, maupun dengan pereaksi warna (Deinstrop, 2007; Gandjar dan Rohman, 2007).
b. Bioautografi
Uji bioautografi adalah metode spesifik untuk mendeteksi bercak pada kromatogram hasil KLT yang memiliki aktivitas antibakteri, antifungi, dan antivirus. Metode ini dapat menentukan letak bercak sehingga dapat mendeteksi senyawa antimikroba dan senyawa aktif tersebut dapat diisolasi.
Menurut Choma (2005), bioautografi dibedakan menjadi tiga, yaitu : 1) Bioautografi kontak
Bioautografi kontak dilakukan dengan meletakkan plat KLT hasil elusi pada media Agar yang sudah diinokulasikan bakteri uji dan didiamkan beberapa menit hingga beberapa jam. Senyawa antumikroba akan berdifusi pada media Agar dan
menghambat pertumbuhan bakteri uji yang ditunjukkan dengan zona jernih pada permukaan media Agar. Kekurangan dari metode ini adalah kesulitan dalam mendapatkan kontak yang sempurna antara agar dan plat.
2) Bioautografi overlay
Bioautografi overlay dilakukan dengan cara menuangkan media Agar yang telah diinokulasikan bakteri uji pada permukaan plat KLT. Media ditunggu memadat dan diinkubasi serta dilakukan dideteksi menggunakan tetrazolium klorida. Senyawa yang memiliki aktifitas antimikroba tampak sebagai area jernih dengan latar belakang ungu (Pratiwi, 2008).
3) Bioautografi langsung
Bioautografi langsung dilakukan dengan cara menyemprot suspensi bakteri uji pada plat KLT atau mencelupkan plat KLT pada pada suspense bakteri uji yang telah ditumbuhkan pada media yang cocok kemudian diinkubasi. Zona hambat yang terbentuk divisualisasikan dengan menyemprot plat KLT dengan tetrazolium klorida.
Penentuan bercak pemisahan hasil KLT yang umumnya tidak berwarna dapat dilakukan dengan cara kimia, fisika, dan biologi. Penyemprotan dengan pereaksi merupakan cara kimia yang biasa digunakan sehingga bercak menjadi jelas (Gandjar dan Rohman, 2007). Golongan suatu senyawa dapat dideteksi dengan pereaksi semprot. Beberapa reagen yang digunakan pada KLT misalnya Anisaldehid-asam sulfat, Dragendorff, DNPH (2,4-dinitrophenylhydrazine), Liebermann-Burchard, Sitroborat, dan FeCl3.
Anisaldehid-asam sulfat merupakan reagen umum yang digunakan untuk mendeteksi produk alam seperti komponen minyak atsiri, terpenoid, steroid, glikosida, sapogenin, dan fenol (Wall, 2005). Hasil positif ditunjukkan dengan bercak berwarna biru, hijau, merah atau cokelat di bawah sinar tampak dan kemerahan atau biru di bawah sinar UV 365 nm (Wagner dan Bladt, 1996; Oleszek, 2007).
Dragendorff digunakan untuk deteksi senyawa alkaloid dan senyawa nitrogen heterosiklik. Hasil positif ditunjukkan dengan bercak berwarna orange atau orange kecokelatan dengan latar belakang kuning pucat (Wagner dan Bladt, 1996; Wall, 2005).
Reagen Liebermann-Burchard digunakan untuk mendeteksi triterpen dan steroid misalnya saponin. Hasil positif ditunjukkan dengan dengan bercak warna biru, hijau, pink, cokelat, kekuningan pada UV dan sinar tampak (Oleszek dkk., 2007).
Reagen sitroborat digunakan untuk deteksi senyawa fenolik yang memiliki gugus orto dihidroksi atau orto hidroksi karbonil contohnya pada senyawa kumarin, flavonoid, dan kuinon. Hasil positif ditunjukkan dengan terbentuknya fluoresensi kuning sampai kuning kehijauan atau orange di bawah sinar UV 365 nm (Pramono, 1989).
DNPH (2,4-dinitrophenylhydrazine) digunakan untuk deteksi senyawa karbonil misalnya keton dan aldehid (Wagner dan Bladt, 1996). Senyawa DNPH akan bereaksi menyerang gugus karbonil keton dan aldehid membentuk senyawa hidrazon yang memiliki ikatan rangkap terkonjugasi lebih panjang dari sebelumnya sehingga terlihat pada sinar tampak berwarna kuning hingga orange (Jork, dkk., 1990).
Pereaksi semprot FeCl3 digunakan secara luas untuk mendeteksi senyawa fenol,
tetapi tidak dapat digunakan untuk membedakan macam-macam golongannya (Robinson, 1995). Hasil positif akan menunjukkan warna biru gelap (Sutrisno, 1986).
F. Keterangan Empiris
Keterangan yang ingin diperoleh dari penelitian ini adalah aktivitas antimikroba dari fungi kode SAL 3 asosiasi spons S. flabelliformis dari kawasan perairan Pulau Menjangan Taman Nasional Bali Barat dan aktivitas antimikroba ekstrak etil asetat hasil fermentasi fungi kode SAL 3 serta golongan senyawa aktifnya.