PRO
FOTO
PADA
PHOT
UV R
Moha
NRP.
Dosen
Prof.
NIP.
JURU
Fakul
Institu
Surab
OPOSA
OKATA
A SISTE
TOCAT
RAY SYS
ammad K
3307.10
n Pembim
Dr Yulin
1953070
USAN TE
ltas Tekn
ut Tekno
baya 201
AL TUG
ALISIS P
EM SINA
TALYSIS
STEM W
Khoirudin
00.080
mbing:
nah T.MA
6198403
EKNIK L
nik Sipil d
ologi Sep
1
GAS A
POLUTA
AR UV D
S POLL
WITH CA
n Alfan
APP.Sc
32004
LINGKU
dan Pere
uluh Nop
AKHIR
AN MIN
DENGA
UTANT
ATALY
UNGAN
encanaan
pember
R
NYAK BU
AN KATA
T OIL IN
YST TiO
2UMI DI
ALIS Ti
N SEA W
2AIR LA
iO
2WATER
AUT
ON
ABSTRAK
Indonesia merupakan negara kepulauan yang memiliki luas wilayah laut sebesar 2/3 dari luas total wilayah negara. Letak strategisnya menjadikan perairan Indonesia sebagai jalur pembawa tanker minyak. Selain itu, Indonesia pun memiliki ratusan anjungan eksplorasi dan anjungan eksploitasi lepas pantai. Tingginya aktivitas perminyakan tentunya menimbulkan resiko pencemaran minyak di laut, seperti: kecelakaan yang dialami tanker minyak dapat menimbulkan kebocoran muatan minyak mentah maupun bahan bakar. Hal ini menyebabkan berbagai macam zat berbahaya yang terkandung dalam minyak dilepaskan ke lingkungan perairan.
Senyawa hidrokarbon yang terkandung dalam minyak bumi berupa benzene, touleuna, ethylbenzen, dan isomer xylena, dikenal sebagai BTEX, merupakan komponen utama dalam minyak bumi, bersifat mutagenic dan karsinogenik pada manusia. Senyawa ini bersifat rekalsitran, yang artinya sulit mengalami perombakan di alam, baik di air maupun didarat, sehingga hal ini akan mengalami proses biomagnetion pada ikan ataupun pada biota laut lain. Bila senyawa aromatik tersebut masuk ke dalam darah, akan diserap oleh jaringan lemak dan akan mengalami oksidasi dalam hati membentuk phenol yang membahayakan bagi tubuh Dapat disimpulkan pencemaran laut oleh tumpahan minyak membawa dampak negatif, sehingga diperlukan penanganan serius untuk mereduksi polutan minyak.
Metode yang dapat digunakan dalam mengatasi pencemaran minyak di perairan yaitu dengan fotokatalisis dengan bantuan sinar UV. Teknologi fotokatalisis merupakan kombinasi dari proses fotokimia dan katalis yang terintegrasi untuk dapat melangsungkan suatu reaksi transformasi kimia. Reaksi transformasi tersebut berlangsung pada permukaan bahan katalis semikonduktor yang terinduksi oleh sinar. Beberapa jenis semikonduktor yang dapat dipakai untuk proses fotokatalisis dari kelompok oksida misalnya: TiO2, Fe2O3, ZnO, WO3, atau
SnO2, sedangkan dari kelompok sulfida adalah CdS, ZnS, CuS, FeS, dan lain-lain. Diantara
sekian banyak jenis semikonduktor, hingga saat ini serbuk TiO2 (terutama dalam bentuk
kristal anatase) memiliki aktivitas fotokatalitik yang tinggi, stabil dan tidak beracun. Secara komersial serbuk TiO2 juga mudah didapat dan diproduksi dalam jumlah besar.
Tujuan dari penelitian kali ini adalah Menentukan dosis penambahan TiO2 yang dapat
menghasilkan prosentase (%) removal tertinggi untuk mengolah air laut yang tercemar minyak bumi dengan sitem sinar UV dan Menentukan laju removal 3 jenis minyak bumi, yaitu alifatik, aromatik, siklik pada air laut yang tercemar minyak bumi dengan sitem sinar UV . Pada penelitian Fotokatalisis dengan menggunakan katalis TiO2 dalam sistem sinar UV
digunakan lampu UV 40 W Sampel yang digunakan adalah sampel buatan, yaitu sampel dengan kadar garam 3,5 % dan jumlah TiO2 yang dibubuhkan adalah sebesar0; 0,5; 1,0; 1,5;
dan 2 gr/L. Sampel dengan dosis pembubuhan TiO2 sebesar 0 gr/L digunakan sebagai
kontrol.
BAB I PENDAHULUAN 1.1 Latar Belakang
Pesatnya perkembangan aktivitas industri perminyakan akhir-akhir ini telah menyebabkan permasalahan lingkungan, salah satunya akibat pencemaran yang dihasilkan dari minyak bumi yang tertumpah ke permukaan. Minyak adalah pencemar utama di lautan (Connel, 1995). Tumpahan minyak baik yang berasal dari kegiatan penambangan lepas pantai, kebocoran, kecelakaan kapal tanker dan lain sebagainya menyebabkan minyak masuk ke dalam laut. Meski hanya terjadi dalam jangka waktu yang pendek, hal ini dapat menimbulkan efek lokal yang serius terhadap hewan dan tumbuhan yang berada di dalam laut (Goldberg, 1991). Selain itu Menurut Peraturan Pemerintah No.19/1999 tentang Pengendalian Pencemaran dan atau Perusakan Laut, pencemaran laut adalah masuknya atau dimasukkannya makhluk hidup, zat, energi, dan atau komponen lain ke dalam lingkungan laut oleh kegiatan manusia sehingga kualitasnya turun sampai ke tingkat tertentu yang menyebabkan lingkungan laut tidak sesuai lagi dengan baku mutu dan atau fungsinya.
Beberapa pencemaran yang menjadi perhatian masyarakat sekarang ini diantaranya adalah pencemaran di daerah pantai yang diakibatkan oleh tersemburnya minyak bumi ke permukaan laut. Pada umumnya, pengeboran minyak bumi di laut dapat menyebabkan terjadinya peledakan (blow out) di sumur minyak. Ledakan ini mengakibatkan semburan minyak menyebar ke lokasi sekitar laut, sehingga menimbulkan pencemaran. Contohnya, ledakan anjungan minyak yang terjadi di Teluk Meksiko sekitar 80 kilometer dari Pantai Louisiana pada 22 April 2010. Pencemaran laut yang diakibatkan oleh pengeboran minyak di lepas pantai itu dikelola perusahaan minyak British Petroleum (BP). Ledakan itu memompa minyak mentah 8.000 barel atau 336.000 galon minyak ke perairan di sekitarnya dan daerah pantai.
Berbagai metode digunakan untuk mengatasi tumpahan minyak, salah satunya adalah dengan cara proses biodegradasi, yaitu penguraian minyak bumi oleh aktifitas mikroorganisme, merupakan proses yang sangat penting dalam menurunkan kadar pencemaran minyak. Proses ini dapat berlangsung dengan bantuan mikroorganisme yang secara alami terdapat di laut atau dengan menambahkan mikroorganisme pengurai ke perairan yang tercemar (Arief, 2007). Namun cara ini memilik kelemahan, yaitu tidak dapat mengatasi tumpahan minyak dalam waktu yang singkat, yaitu kurang lebih sekitar 2 bulan.
Cara lain yang digunakan adalah cara kimiawi, yaitu dengan menambahkan dispersan (pemecah) kimiawi yang berfungsi untuk memecah minyak menjadi tetesan kecil sehingga dapat dihindarkan berbagai dampak yang merugikan terhadap berbagai organisme laut. Namun cara ini juga memiliki banyak kelemahan. Selain hanya bisa menyisihkan 50 % minyak yang tumpah di laut, termasuk dispersi alami, dispersan juga berpotensi menimbulkan dampak negatif terhadap beberapa organisme laut. Besaranya dampak yang ditimbulkan juga tergantung dari jenis oraganisme yang terpapar, dosis, waktu pemaparan, jenis dispersan, dan minyak yang didispersikan (Sudarman, 2009).
Oleh karena itu diperlukan alternatif pengolahan yang lebih efektif dan efisien. Salah satunya adalah dengan pengolahan secara fotokatalitis, yaitu pengolahan dengan pembubuhan katalis dan cahaya, pada air limbah. Prinsip dari metode fotokatilisis ini adalah merubah hidrokarbon minyak bumi menjadi zat yang tidak berbahaya yaitu CO2 (Wise, 1991).. Fotokatalisis adalah
proses reaksi kimia yang dibantu oleh cahaya dan katalis padat. Dimana dalam reaksi fotokatalisis itu sendiri melibatkan pasangan elektron-hole (e- dan h+). Dari definisi tersebut menunjukan bahwa beberapa langkah-langkah fotokatalis adalah merupakan reaksi redoks yang melibatkan pasangan e- dan h+ (Arutanti dkk. 2009).
Menurut Herman (1999), metode fotokatalisis adalah suatu proses yang memerlukan bantuan cahaya dan katalis semikonduktor untuk melangsungkan atau mempercepat transformasi kimia, dimana sumber cahaya yang digunakan bisa berasal dari matahari atau lampu UV. Semikonduktor tersebut jika terkena oleh sinar UV atau sinar matahari yang mempunyai foton lebih dari energi bahan semikonduktornya ( hv ≥ EG ) akan menghasilkan elektron ( e- ) di pita konduksi yang dapat mereduksi senyawa logam dan hole (h +) di pita valensi yang dapat mengoksidasi senyawa organik yang berada di permukaan. Katalis semikonduktor yang banyak digunakan untuk proses fotokatalisis antara lain TiO2, Fe2O3, SnO2, ZnO, ZnS, CuS,
CeO2 ZrO2 dan WO3 (Khalil et al., 1998). Tetapi hingga saat ini TiO2 lebih sering digunakan
dalam aplikasi fotokatalisis khususnya pengolahan limbah, karena banyak terdapat di alam mempunyai sifat stabil terhadap cahaya, tidak beracun, kemampuan untuk mengoksidasi yang tinggi dan tidak larut dalam kondisi eksperimen (Linsebigler et al., 1995).
Pada penelitian sebelumnya Ziolli dan Jardim (2001), menyebutkan bahwa fotokatalisis dengan menggunakan TiO2 dengan kadar berat/volume (w/v) 0,1% dan lampu Hg sebagai
sumber cahaya dapat menyisihkan senyawa karbon sebesar 90% (berkisar 9-45 mg/L). Ziolli dan Jardim (2001), juga menyebutkan bahwa metoda tersebut merupakan metoda yang efisien dan ekonomis untuk digunakan dalam upaya remediasi air laut yang tercemar oleh minyak bumi.
1.2 Perumusan Masalah
Rumusan masalah dalam penelitian ini adalah :
1. Berapakah dosis pembubuhan TiO2 yang dapat menghasilkan persentase (%) removal
tertinggi untuk mengolah air laut yang tercemar minyak bumi dengan sinar UV ? 2. Berapakah efisiensi removal dua jenis minyak bumi, yaitu solar (diesel) dan oli
(lubricating oil) pada fotokatalisis TiO2 dengan sinar UV?
1.3 Tujuan
Tujuan dalam penelitian kali ini adalah :
1. Menentukan dosis pembubuhan TiO2 yang dapat menghasilkan persentase (%) removal tertinggi untuk mengolah air laut yang tercemar minyak bumi. dengan sinar
UV.
2. Menentukan efisiensi removal dua jenis minyak bumi, yaitu solar (diesel) dan oli (lubricating oil) pada fotokatalisis TiO2 dengan sinar UV.
1.4 Manfaat
Manfaat yang diperoleh dari penelitian kali ini adalah mengetahui tingkat kinerja dari teknologi fotokatalisis TiO2 dengan sinar UV dalam menyisihkan minyak bumi yang
mencemari air laut.
Ruang lingkup dari penelitian ini adalah:
1. Penelitian dilakukan dalam skala laboratorium.
2. Sampel merupakan sampel air laut buatan dengan salinitas 33 ‰.
3. Pada penelitian kali ini dilakukan dua variasi yaitu variasi pembubuhan dosis TiO2
dan variasi jenis pencemar minyak bumi.
4. Pada variasi pembubuhan dosis TiO2, dosis TiO2 yang ditambahkan sebesar 0 g/L
(sebagai kontrol); 0,5 g/L; 1 g/L; 1,5 g/L; 2 g/L dengan lama penyinaran dengan sinar UV adalah selama 7 hari. Pengambilan sampel air pada hari ke-7 untuk menentukan dosis optimum dari TiO2.
5. Pada variasi jenis pencemar minyak bumi yaitu, minyak solar dan minyak pelumas, dengan pembubuhan dosis TiO2 optimum. Lama penyinaran dengan sinar UV adalah
selama 7 hari dengan pengambilan sampel air pada hari ke-0; hari ke-1; hari ke-3; hari ke-5; hari ke-7.
6. Parameter yang dianalisa adalah Total Petroleum Hydrocarbons (TPH) dan gugus-gugus yang terbentuk yang ditentukan dengan spektrofotometri IR.
BAB II
TINJAUAN PUSTAKA
2.1 Hidrokarbon
2.1.1 Pengertian Hidrokarbon
Hidrokarbon merupakan persenyawaan antara hidrogen dan karbon. Hidrokarbon merupakan segolongan senyawa yang banyak terdapat di alam sebagai minyak bumi. Seluruh hidrokarbon memiliki rantai karbon dan atom-atom hidrogen yang berikatan dengan rantai tersebut. Istilah tersebut digunakan juga sebagai pengertian dari hidrokarbon alifatik. Sebagai contoh metana (CH4) adalah hidrokarbon dengan satu atom karbon dan empat atom hidrogen: Etana adalah
hidrokarbon yang terdiri dari dua atom karbon bersatu dengan sebuah ikatan tunggal, masing-masing mengikat tiga atom karbon (C2H6). Propana memiliki tiga atom C (C3H8) dan seterusnya
(CnH2n+2).
2.1.2 Klasifikasi Hidrokarbon
a. Berdasarkan Jenis Ikatan Atom Karbon
Berdasarkan ikatan yang terdapat pada rantai karbonnya, hidrokarbon dibedakan menjadi: 1. Hidrokarbon jenuh, yaitu hidrokarbon yang pada rantai karbonnya semua berikatan
tunggal. Hidrokarbon ini disebut juga sebagai alkana.
2. Hidrokarbon tak jenuh, yaitu hidrokarbon yang pada rantai karbonnya terdapat ikatan rangkap dua atau rangkap tiga.
Hidrokarbon yang mengandung ikatan rangkap dua disebut alkena dan hidrokarbon yang mengandung ikatan rangkap tiga disebut alkuna. Tiap-tiap atom karbon tersebut dapat mengikat empat atom lain atau maksimum hanya 4 buah atom hidrogen. Jumlah atom hidrogen dapat ditentukan dari jenis hidrokarbonnya yaitu:
a. Alkana (CnH2n+2)
Alkana merupakan hidrokarbon alifatik jenuh yaitu hidrokarbon dengan rantai terbuka dan semua ikatan karbon-karbonnya merupakan ikatan tunggal. Alkana juga disebut parafin yang berarti sukar bereaksi. Alkana C1-C10 berguna sebagai sumber
energi misalnya metana, etana, propana, dan butana sebagai bahan bakar gas. Sifat-sifat alkana adalah sebagai berikut:
1. Pada umumnya alkana sukar bereaksi dengan senyawa lain maka disebut parafin. 2. Pada suhu kamar dapat bereaksi dengan Cl dan Br karena pengaruh sinar ultraviolet
dari sinar matahari.
3. Pembakaran sempurna alkana dengan gas oksigen akan dihasilkan gas CO2 dan uap
air serta dibebaskan panas. b. Alkena (Cn H2n)
Alkena adalah senyawa hidrokarbon yang mempunyai satu ikatan rangkap dua ( C=C ) pada rantai karbonnya. Sehingga alkena yang paling sederhana mempunyai 2 atom C. Alkena disebut juga olefin dari kata olefiant gas (gas yang membentuk minyak).
c. Alkuna
Alkuna adalah hidrokarbon alifatik tak jenuh yang mempunyai satu ikatan rangkap tiga (C≡C) pada rantai karbonnya. Dibandingkan dengan alkana dan alkena yang sesuai, alkuna mempunyai lebih jumlah atom (H) yang lebih sedikit (Syukri, 1999).
b. Berdasarkan Bentuk Rantai Karbon
1. Hidrokarbon alifatik terdiri atas rantai karbon yang tidak mencakup bangun siklik. Golongan ini sering disebut sebagai hidrokarbon rantai terbuka atau hidrokarbon siklik. Contoh hidrokarbon alifatik yaitu :
C2H6 (etana); CH3CH2CH2CH2CH3 (pentana)
2. Hidrokarbon alisiklik atau hidrokarbon siklik terdiri atas atom karbon yang tersusun dalam satu lingkar atau lebih.
3. Hidrokarbon aromatik merupakan golongan khusus senyawa siklik yang biasanya digambarkan sebagai lingkar enam dengan ikatan tunggal dan ikatan rangkap bersilih–ganti. Kelompok ini digolongkan terpisah dari hidrokarbon asiklik dan alifatik karena sifat fisika dan kimianya yang khas (Syukri, 1999).
2.1.3 Reaksi-Reaksi Senyawa Hidorkarbon
Reaksi senyawa hidrokarbon pada umumnya merupakan pemutusan dan pembentukan ikatan kovalen. Ada beberapa jenis reaksi senyawa hidrokarbon, diantaranya yaitu reaksi substitusi, adisi, oksidasi, dan eliminasi.
1. Reaksi Subtitusi
Pada reaksi substitusi, atom atau gugus atom yang terdapat dalam suatu molekul digantikan oleh atom atau gugus atom lain. Reaksi substitusi umumnya terjadi pada senyawa yang jenuh (semua ikatan karbon-karbon merupakan ikatan tunggal), tetapi dengan kondisi tertentu dapat juga terjadi pada senyawa tak jenuh. Sebagai contoh adalah halogenasi hidrokarbon (penggantian atom H oleh halogen).
2. Reaksi Adisi
Reaksi adisi terjadi pada senyawa yang mempunyai ikatan rangkap dua atau rangkap tiga, senyawa alkena atau senyawa alkuna, termasuk ikatan rangkap karbon dengan atom lain.
Dalam reaksi adisi, molekul senyawa yang mempunyai ikatan rangkap menyerap atom atau gugus atom sehingga ikatan rangkap berubah menjadi ikatan tunggal. Untuk alkena atau alkuna, bila jumlah atom H pada kedua atom C ikatan rangkap berbeda, maka arah adisi ditentukan oleh kaidah Markovnikov, yaitu atom H akan terikat pada atom karbon yang lebih banyak atom H.
3. Reaksi Eliminasi
Pada reaksi eliminasi, molekul senyawa berikatan tunggal berubah menjadi senyawa berikatan rangkap dengan melepas molekul kecil. Jadi, eliminasi merupakan kebalikan dari adisi. Sebagai contoh adalah eliminasi air (dehidrasi) dari alkohol. Apabila dipanaskan dengan asam sulfat pekat pada suhu sekitar 1800°C, alkohol dapat mengalami dehidrasi membentuk alkena.
4.Reaksi Oksidasi
Apabila senyawa alkana dibakar menggunakan oksigen, senyawa yang dihasilkan ialah karbon dioksida dan air. Reaksi tersebut dikenal dengan reaksi oksidasi atau pembakaran.
2.1.4 Solar (Diesel) dan Oli (Lubricating Oil)
Minyak solar merupakan salah satu fraksi dari minyak bumi yang diperoleh dengan cara destilasi yang dipisahkan berdasarkan titik didih dengan atom karbon per molekulnya C15-C18
dan titik didihnya 300-400°C dan berbentuk liquid (Keenan et al., 1993).
Salah satu jenis dari solar adalah biosolar. Biosolar didefinisikan sebagai ester alkil (RCOCH3) dari asam-asam lemak (SNI 04-7182-2006). Biosolar merupakan hasil rekasi
minyak atau asam lemak dengan alcohol dan menghasilkan alkil eseter. Alkil ester ini lah yang disebut sebagai biosolar. Biosolar berebentuk cair dan memiliki titik nyala dan titik didih sebesar 60°C dan 370°C. Biosolar stabil terhadap cahaya (MSDS Pertamina, 2007). Oli juga merupakan salah satu fraksi dari minyak bumi yang diperoleh dengan cara destilasi yang dipisahkan berdasarkan titik didih. Oli merupakan rantai karbon panjang, yaitu memiliki atom karbon C20 – C50 yang terdiri dari alkana, sikloalkana, dan cincin aromatik.
Semua jenis oli pada dasarnya sama. Yakni sebagai bahan pelumas agar mesin berjalan mulus dan bebas gangguan. Sekaligus berfungsi sebagai pendingin dan penyekat. Oli mengandung lapisan-lapisan halus yang berfungsi mencegah terjadinya benturan antar logam dengan logam komponen mesin seminimal mungkin dan mencegah goresan atau keausan. Untuk beberapa keperluan tertentu, aplikasi khusus pada fungsi tertentu, oli dituntut memiliki sejumlah fungsi-fungsi tambahan. Mesin diesel misalnya, secara normal beroperasi pada kecepatan rendah tetapi memiliki temperatur yang lebih tinggi dibandingkan dengan Mesin bensin. Mesin diesel juga memiliki kondisi kondusif yang lebih besar yang dapat menimbulkan oksidasi oli, penumpukan deposit dan perkaratan logam-logam bearing (Keenan et al., 1993).
2.2 Fotokatalisis
Fotokatalisis adalah proses reaksi kimia yang menggunakan energi cahaya dan dipercepat katalis padat (Arutanti dkk., 2009). Dengan pencahayaan ultraviolet (254 nm) permukaan
TiO2 m senyaw dapat m dan nitr Penyina dan hol atau hi hidrofob Fotokat didasark terirrad langkah Fenome semikon pada pi ) pad kembal sebagia pada a mengin hal ini s Pada pr donasi pita val dihasilk memilik mengok (Arutan mempunyai k wa organik d membersihk
rit yang bera aran permu le positif pa idrofilik (su bik (tidak s talisis deng kan pada iasi-UV. D h fotokatalis TiO2 + ena fotokat nduktor tip ita valensi ( da pita val i, baik di p an lain dari akhirnya, ( nisiasi reaks semikonduk rinsipnya, r elektron da lensi ini cu kan gugus ki potensia ksidasi seba nti dkk., 200 kemampuan dapat dioks kan air dari acun dapat ukaan TiO2
ada permuk uka akan a
uka air) set gan titanium pembentuk Definisi umu s merupakan + hv → e -alisis pada e n dikenai (vb) akan pi lensi, diseb permukaan a ( / ) da ) dapat si reduksi z ktor tersebu reaksi oksid ari substrat k ukup besar hidroksil. al redoks agian besar 09). n mengionis sidasi menja pencemar o diubah men yang bersi kaannya jug air) dan ke elah bebera m dioksida kan pasan um tersebu n reaksi red + h+ permukaan i cahaya ( indah ke pit but eksitasi. ataupun di apat bertaha menginisia at kimia ya t adalah tita dasi pada pe ke ( ). Ap untuk men Radikal h sebesar 2,8 r zat organi sasi reaksi k adi karbon organik. Sen njadi senyaw fat semikon ga menjadik emudian be apa lama tid a didefinisi ngan elektr ut mempun doks yang m n TiO2 dap ) dengan ta konduksi . Sebagaian dalam bulk an sampai asi reaksi ang ada dis anium dioks ermukaan s pabila poten ngoksidasi a hidroksil m 8 Volt. Po ik menjadi kimiawi. Di dioksida d nyawa-seny wa lain yang nduktor me kan permuka erubah lagi dak mendapa ikan sebaga ron-lubang yai implika melibatkan ( pat dijelaska energi yan i (cb), dan n besar ( k partikel, d pada permu oksidasi d ekitar perm sida (TiO2). emikonduk nsi oksidasi air pada pe merupakan s otensial seb air, asam i dalam med dan air, bera yawa anorga g relatif tida enghasilkan aan tersebut i menjadi n atkan penyi ai proses r ( / ), asi bahwa / ). an sebagai ng sesuai, m meninggalk / ) ini ak disebut de-e ukaan semi dan dilain mukaan sem ktor dapat b i yang dimi ermukaan p spesi peng besar ini c mineral da
dia air, keb arti proses anik seperti ak beracun. pasangan ut bersifat p nonpolar d inaran. reaksi kim ketika fot beberapa l berikut. Jik maka elektr kan lubang kan bereko eksitasi. Sed ikonduktor, pihak ( mikonduktor berlangsung iliki oleh ( partikel, ma goksidasi k cukup kua an karbon d anyakan tersebut i sianida elektron olar dan dan atau mia yang tokatalis langkah-ka suatu ron ( ) positif ( ombinasi dangkan dimana ) akan r. Dalam melalui ) pada aka akan uat dan at untuk dioksida
2.3 Titanium mempu g/cm3. S Ditinjau logam d celah ya memun penyina daripad valensi Titanium dan bro stabil. A Titanium sinar ul 2.4 Cahaya transfor sebenar karena meman tinggi u Gambar 2 Titanium D m dioksida unyai masaa Sedangkan u dari sifat dan isolator ang dimilik ngkinkan un aran pada pe da band gap menuju pita m dioksida ookite. Ben Anatase da m dioksida traviolet da Sinar Ultra a dapat digu rmasi yang rnya tidak m selain me carkan radi untuk meny 2.1 Proses E Dioksida (T atau Titani a molar 79,8 untuk titik l kelistrikan r atau dapa ki titanium d ntuk digunak ermukaan s semikondu a konduksi a yang terja tuk yang p an brookite , terutama d an cahaya. aviolet (UV unakan seba luas pada d mungkin ter emancarkan iasi ultravio yebabkan te Eksitasi dan Sumber: TiO2) ium (IV) ok 87 g/mol dan leburnya me nnya, titaniu at pula titan dioksida seb kan sebagai semikonduk uktor tersebu sehingga ak di di alam aling umum e baik untu dalam bentu V) agai pemacu dekomposisi rjadi bila m n radiasi olet. Radias erjadinya r n De-Eksitas Arutanti dk ksida memp n memiliki encapai 184 um dioksid nium dioksi besar 3,2 eV i katalis dala ktor TiO2 ole
ut, maka ak kan mengha seperti min m adalah ru uk dikonver uk anatase u terjadinya i polutan di memakai rea inframerah si ultraviole reaksi kimia si Pada TiO kk., 2009 punyai nam wujud putih 43 oC dan ti a memiliki ida memilik V. Adanya s am proses f eh cahaya d kan bterjadi asilkan pasa neral juga d util, juga m rsi ke ruti adalah foto a reaksi kim idalam air. B aktan konv h dan cah et tersebut m a (bila diba O2 di bawah ma lain yaitu h padat den itik didihnya konduktivi ki sifat sem sifat ini pad fotokatalisis dengan ener perpindaha angan elektr dikenal seb merupakan b l dengan a okatalis den mia untuk m Beberapa re ensional. H aya tampa mempunyai andingkan Sinar UV u Titania. U ngan kepada a 2972 oC. vitas listrik mikonduktor da titanium d s. Setelah di rgi yang leb an elektron
ron dan hole agai rutil, a bentuk yang adanya pem ngan sumbe mendapatkan eaksi kimia Hal ini dapa ak, mataha i kemampu dengan kan Unsur ini atan 4,23 diantara r, energi dioksida ilakukan bih besar dari pita e. anatase, g paling manasan. er energi n seleksi tersebut at terjadi ari juga uan yang ndungan
energi radiasi inframerah dan cahaya tampak). Walaupun tidak semua polutan organik menyerap cahaya, namun banyak diantaranya yang mudah terdekomposisi dengan atau berbagai macam cara. Oleh karenanya, pengetahuan terhadap mekanisme kimia pada reaksi fotokimia akan bermanfaat dalam merencanakan sistem pengolahan secara fotokimia untuk air yang tercemar.
Sumber cahaya dapat digolongkan menjadi dua, yaitu sinar matahari dan cahaya buatan. a. Sinar matahari
Radiasi ultraviolet (UV) matahari adalah energi elektromagnetik dengan panjang gelombang antara 0,2 – 0,4 mikron dan mempunyai energi yang lebih besar dibanding cahaya tampak. Sinar matahari dimanfaatkan sebagai sumber cahaya untuk mengolah air yang terkontaminasi dengan fotolisis. Berdasarkan panjang gelombangnya, radiasi ultraviolet (UV) matahari terbagi atas:
1. UV-A (0,32 – 0,4 mikron) merupakan panjang gelombang dan memancarkan radiasi yang besarnya konstan sepanjang tahun. Radiasi ini dapat menyebabkan penuaan dini pada kulit.
2. V-B (0,28 – 0,32 mikron) merupakan panjang gelombang pendek dan lebih intens dibanding UV-A. UV B lebih kuat terabsorpsi oleh beberapa polutan bimolekul.
3. UV-C (0,2 - 0,28 mikron ) merupakan radiasi UV yang paling intensif dan berbahaya serta berpotensi untuk menimbulkan kerusakan pada organisme. Pada dasarnya, tingkat kerusakan pada paparan radiasi UV tergantung dari kuantitas dan jenis radiasi yang dipaparkan. Dimana semakin pendek panjang gelombang radiasi maka energi yang dihasilkan semakin besar yang berarti tingkat kerusakannya juga tinggi. Berdasarkan kandungan energi kimianya, radiasi UV mempunyai kemampuan untuk menimbulkan kerusakan langsung pada molekul penting senyawa yang menyerapnya dan menghancurkan polutan didalam air (Richard dan Eric, 1994). Sesuai dengan hukum pertama fotokimia yang menyatakan bahwa perubahan kimia hanya akan terjadi bila sistem menyerap radiasi (Kopecky, 1992), maka cahaya harus diabsorpsi oleh sistem supaya reaksi dapat berlangsung. Molekul– molekul harus bisa menyerap panjang gelombang minimal sebesar 290 nm supaya dapat dipengaruhi oleh cahaya matahari.
b. Cahaya Buatan
Sumber cahaya buatan untuk reaksi fotokimia dapat berasal dari lampu yang tersedia pada variasi luas mulai dari lampu bohlam (bulb) tungsten-filamen sederhana sampai lampu dengan pancaran bunga api listrik merkuri (mercury arc). Lampu bohlam tungsten filamen memancarkan secara kuat pada daerah tampak, sedangkan lampu mercury arc menghasilkan sinar UV dengan panjang gelombang kurang dari 290 nm (UV-C : 0,2–0,28) yang mempunyai intensitas tinggi. Sumber cahaya UV yang banyak digunakan adalah lampu dengan daya 4 – 40 watt dan intensitas maksimum pada panjang gelombang 254 nm. Lampu ini mudah didapatkan di pasaran dan banyak digunakan sebagai lampu germical.
Reaksi fotokimia merupakan reaksi kimia yang menggunakan cahaya untuk mendekomposisi polutan organik didalam air dengan cara menyerap cahaya untuk memutuskan ikatan dari senyawa–senyawa kimia. Cahaya dapat berupa panjang gelombang dan bersifat sebagai
partikel (particle like properties) dimana cahaya merupakan gabungan dari ayunan elektrikal terhadap arah propagasi dari gelombang (Schwarzenbach dan Gschwend, 1993).
Energi sinar UV dan cahaya tampak dapat mengeksitasi elektron suatu molekul dari kondisi dasar kekondisi tereksitasi. Sehingga pada prinsipnya, ikatan dapat diputuskan dengan absorpsi cahaya (Schwarzenbach dan Gschwend, 1993).
Pada reaksi fotokimia, penghancuran molekul diawali dengan penyerapan foton (Richard dan Eric, 1994). Saat foton mendekati molekul, terjadi interaksi antar medan elektromagnetik yang menyertai molekul. Terjadinya perubahan secara fotokimia disebabkan karena energi yang diabsorpsi mengubah molekul pada kondisi dasar (ground state) menjadi kondisi tereksitasi (excited state) yang tidak stabil.
Supaya terjadi penyerapan foton guna mendapatkan kondisi eksitasi, molekul harus mempunyai pita absorpsi pada spektrum UV cahaya tampak yang mencakup panjang gelombang foton tersebut (Richard dan Eric, 1994). Karena radiasi UV – C mempunyai panjang gelombang minimum 200 nm. Maka molekul organik harus menyerap cahaya diatas 200 nm supaya terjadi proses fotolisis (Larson and Weber, 1994). Energi radiasi ini berhubungan dengan energi eksitasi molekul dengan λ = 200 – 700 nm (Kopecky, 1992). Proses kimia yang dialami oleh molekul tereksitasi untuk kembali ke kondisi dasar merupakan suatu bentuk transformasi dan juga penyisihan (removal) suatu senyawa (Schwarzenbach dan Gschwend, 1993). Senyawa–senyawa baru hasil transformasi dapat termasuk pemutusan ikatan, penyusunan kembali atau reaksi intermolekuler (Richard dan Eric, 1994). Selanjutnya senyawa-senyawa tersebut akan bereaksi dengan proses fotokimia, kimia atau biologi. Akibatnya sangat sulit untuk menentukan dan mengukur seluruh hasil transformasi fotokimia (Schwarzenbach dan Gschwend, 1993).
2.5 Fotokatalisis TiO2 Pada Minyak Bumi (Crude Oil)
Sebelumnya pernah dilakukan penelitian mengenai tingkat kinerja fotokatalisis titanium dioksida (TiO2) pada air laut yang tercemar oleh minyak bumi (crude oil) terlarut dengan
sinar ultraviolet (UV). Sampel yang digunakan adalah air laut dengan salinitas 3,3 %, sedangkan sampel minyak bumi (crude oil) berasal dari hasil eksplorasi minyak bumi lepas pantai di campos Rio de Jeneiro, Brazil. Minyak bumi (crude oil) yang ditambahkan adalah sebesar 1/20 v/v terhadap air laut. Titanium dioksida yang digunakan adalah degusa P-25, dengan spesifik area 50 m2 g-1 dengan konsentrasi TiO
2 dalam air sampel adalah 0,1 % w/v
atau 1 g/L (Ziolli dan Jardim, 2001).
Air sampel sebanyak 1200 mL, yaitu air laut dengan salinitas 3,3 %, konsentrasi TiO2 1 g/L,
dan konsentrasi crude oil sebesar 1/20 v/v, diaduk dengan magnetic stirrer selama 30 menit dan kemudian disimpan dalam ruangan gelap dalam suhu ruangan selama 15 hari untuk mendapatkan minyak bumi (crude oil) yang terlarut. Setelah 15 hari, diambil 1200 mL sampel dengan tanpa mengganggu dari permukaan air sampel (Ziolli dan Jardim, 2001). Sampel kemudian diolah dengan menggunakan reaktor fotokatalisis yang terbuat dari gelas Pyrex dan sampel diaduk dengan magnetic stirrer untuk menjaga agar larutan tetap homogen atau partikel TiO2 tidak mengendap. Sumber cahaya berasal dari lampu mercury 125 W
(Philips, HPL-N) dengan panjang gelombang maksimum mencapai 366 nm. Pengolahan ini dilakukan selama 7 hari (Ziolli dan Jardim, 2001).
Dalam p crude o 2.6 2.6.1 a. Alkana mengha puncak sangat s C – H C – H2 C – H3 C – H2 C – C Contoh b. penelitian y oil mencapai Analisis S Senyawa H Alkana menunjuk asilkan emp bending C sederhana d Stre Pad frek Jika abso mem Gug 146 Gugu cm Ger dala panj Stre : Alkena yang dilakuk i sebesar 90 Spektra Inf Hidrokarbo kkan sangat pat atau leb CH2 dan CH dan memilik etching terja da alkana (k kuensi kuran a senyawa m orpsi C-H miliki hibrid gus metilen 5 cm-1. us metil me 1. rakan bendi am rantai te njang ). etching tidak G kan oleh Zi 0 % setelah fra Red on : Alkana t sedikit p bih puncak H3 pada dae ki sedikit pu adi pada dae kecuali seny ng dari 3000 memiliki vin adalah leb disasi sp2 da n memiliki emiliki kara ing (rocking erbuka terja k secara _ia Gambar 2.2 Sumb
iolli dan Jar pengolahan a, Alkena, A pita absorp k Stretching erah 1475 – uncak. erah sekitar yawa lingk 0 cm-1 ( 300 nilik, aroma bih besar an sp. karakteristi akteristik ab g) digabung adi sekitar agnostic_ive 2 Spektra IR ber : Pavia, rdim (2001) n selama 7 h Alkuna si dalam s g disekitar – 1365 cm-1 r 3000 cm-1 ar), absorps 00 - 2800 cm atik, asetile dari 3000 ik absorpsi bsorpsi bend gkan dengan daerah 720 e berguna, b R dari dekan 2001 ), didapatka hari. spektra infr daerah 300 . Spektra da si C-H sp3 m-1 ).
nik, atau sik cm-1. Sen bending p ding pada d n empat ata cm-1 ( din banyak punc na an efisiensi fra merah. 00 cm-1 d ari alkana b selalu terja iklopropil h nyawa-seny pada daerah daerah sekit au lebih gug namakan pit cak lemah. removal Mereka ditambah biasanya adi pada idrogen, awa ini h sekitar tar 1375 gus CH2 ta rantai
Alkena diagnos 3000 c dibawah daerah melihat = C – H = C – H Pita –pi C = C Contoh c. Alkuna hibridis spektrum frekuen bending pada 33 spektrum ≡C-H C≡C menunjuk stic adalah p cm-1, dilanj hnya. Juga 1000-650 t puncak Str H Stret 3095 H Bend
ita ini dapat
Stret C=C Seca mera Seca serin : Alkuna terminal a sasi sp ikata m alkuna nsi Stretchin g untuk gu 300 cm-1. m. Stre Stret freku kkan lebih puncak Stre jutkan den yang meno cm-1. Untu retching C= tching untu 5 – 3010 ). ding out of p t digunakan tching terja C ke frekuen ara simetris ah (tidak ad ara simetris ng menghila Ga akan menun an C-H. Ika terminal,m ng C-H un gus CH2 da Ikatan C≡C etching untu tching terja uensi lebih r banyak pu etching C-H ngan punca onjol yaitu o uk senyaw =C dekat 165 uk C-H sp2 f plane (oop) n untuk men adi pada 16 nsi yang lebi
mengganti a perubahan s disubstitu ang, sedangk ambar 2.3 S Sumb njukkan pun atan C≡C ju mencapai se ntuk atom an CH3. Alk C pada 215 uk C-H sp b adi dekat rendah. uncak darip H untuk kar ak C-H un out of plane wa asimetris 50 cm-1. terjadi den ) terjadi pad nentukan der 660-1600 c ih rendah d ikan ikatan n dipol). usi (trans) i
kan cis lebi
Spektra IR d ber : Pavia, ncak yang uga akan me ekitar 2150 karbon sp3 kuna non te 50 cm-1 ak iasanya terj 2150 cm -pada diagn rbon sp2 pad ntuk atom e dari punca s, seharusn ngan harga da daerah 10 rajat substit cm-1,sering an menaikk n-ikatan yan ikatan rang h kuat. dari 1-Heks 2001 menonjol p enjadi karak cm-1. Ran 3. Karakteri erminal tidak kan sangat jadi sekitar 1, konjuga o. Puncak da harga ya karbon sp ak bending nya mempe lebih besa 000-650 cm tusi pada ika
terjadi per kan intensita ng tidak dia gkap, absor ena pada sekita kteristik yan ntai alkil a istik lain te k akan men lemah atau 3300 cm-1. si mengge utama dar ang lebih be p3 mencap yang dicap erkecualikan ar dari 3000 m-1. atan rangka rgerakan ko as. absorp dala rpsinya lem ar 3300 cm ng menonjo akan menu ermasuk pa nunjukkan p u tidak ada eser Stretch ri harga esar dari pai nilai pai pada n untuk 0 cm-1 ( ap. onjugasi am infra mah dan m-1 untuk ol dalam unjukkan ada pita pita C-H a dalam hing ke
2.6.2 Senyaw dari me harga le yang sa antara s biasany untuk a dicapai cm-1, da = C- H = C-H C=C Overton untuk m Contoh Con Senyawa wa aromatik ereka tidak m ebih besar ama, ini mu senyawa alk ya mencapa alkena (165 pada daera apat digunak Stre 301 dap Abs cm -ne/kombina menandai po : ntoh: G Cincin Aro k menunjukk memiliki ha dari 3000 c ungkin sulit kena dan aro
i antara 160 50 cm-1). Y ah 900-690 kan untuk m etching untu 0 cm-1). Out of at digunaka sorpsi Stretc 1.
asi pita dicap ola substitus G Gambar 2.4 S Sumb omatik kan jumlah arga diagno cm-1. Karen t untuk men omatik. Ak 00 dan 145 Yang juga m cm-1, yang menandai su uk C-H sp2 plane (oop an untuk me ching cincin pai antara 2 si cincin. Gambar 2.5 Sumb Spektra IR d ber : Pavia, pita absorp ostik. Punca na pita Stre nggunakan kan tetapi, p 50 cm-1 dilu menonjol y g mana diiri ubstitusi pad terjadi pada p) bending enandai pola n sering ter 2000 dan 16 Spektra IR ber : Pavia, dari 1-Oktu 2001 psi dalam sp ak Stretching etching untu pita Stretc ita Stretchin uar daerah b yaitu out of ingi pita ov da cincin (P a harga lebi terjadi pad a substitusi rjadi pada p 667 cm-1. Ab R dari Tolue 2001 una pektra infra g C-H untu uk alkena d hing C-H u ng C=C unt biasanya di f plane pun ertone lema Pavia, 2001) ih besar dar da 900-690 pada cincin pasangan 16 bsorpsi lema n merah,keb uk karbon m dicapai pada untuk memb tuk cincin a imana C=C ncak bendin ah pada 20 ). ri 3000 cm -cm-1. Pita n. 600 cm-1 d mah dapat dig
anyakan mencapai a daerah bedakan aromatik C dicapai ng yang 00-1667 1 (3050--pita ini an 1475 gunakan
BAB III
METODOLOGI PENELITIAN 3.1 Umum
Pada penelitian ini dilakukan penelitian mengenai kinerja Fotokatalisis TiO2 dalam
menyisihkan minyak bumi pada air laut dengan bantuan sinar ultraviolet (UV).
3.2 Kerangka Penelitian
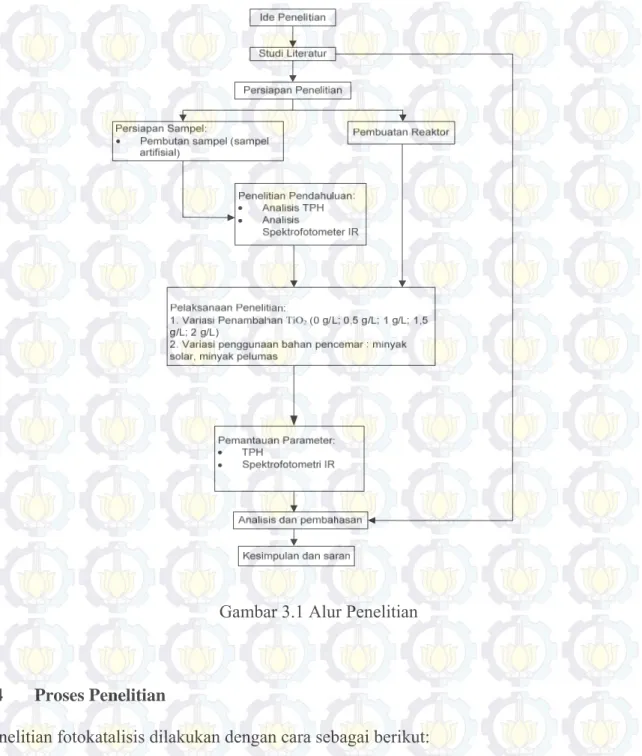
Kerangka penelitian merupakan gambaran dari tahapan – tahapan penelitian yang akan dilakukan. Hal ini dilakukan untuk memudahkan dalam pelaksanaan penelitian sesuai tahapan yang ada, sehingga penelitian dapat dilakukan sesuai prosedur dan sistematis. Skema umum dari alur penelitian dapat dilihat pada Gambar 3.1.
3.3 Tahapan 3.3.1 Ide Studi
Ide studi adalah mencari suatu konsep removal yang lebih efektif dan efisien pada air laut yang tercemar oleh minyak bumi.
3.3.2 Studi Literatur
Studi literatur merupakan studi terhadap dasar dari penelitian ini. Studi literatur dapat berasal dari buku – buku referensi, jurnal ilmiah, artikel, media cetak dan elektronik serta penelitian terdahulu. Studi literatur merupakan jawaban dari permasalahan yang ada dalam penelitian. Untuk penelitian ini menggunakan studi literatur mengenai pencemaran laut, fotokatalis, TiO2, hidrokarbon, sinar UV, dan spektrofotometer IR.
3.3.3 Persiapan penelitian
Persiapan penelitian merupakan langkah persiapan sebelum melakukan penelitian. Dalam penilitian ini dilakukan persiapan dengan penyediaan sampel air laut tercemar minyak bumi Selain itu juga dilakukan persiapan dengan pembuatan reaktor penyinaran dengan sinar UV.
3.3.4 Penelitian Pendahuluan
Pada penelitian pendahuluan kali ini ini dilakukan analisa Total Petroleum Hydrocarbons (TPH) untuk mengetahui jumlah awal hidrokarbon yang terkandung di dalam air limbah.
3.3.5 Pelaksanaan Penelitian
Pada penelitian kali ini dilakukan variasi pembubuhan dosis TiO2 sebesar 0 g/L (sebagai
kontrol); 0,5 g/L; 1 g/L; 1,5 g/L; 2 g/L dengan lama penyinaran dengan sinar UV adalah selama 7 hari dengan pengambilan sampel air pada hari ke-7 untuk menentukan dosis optimum dari TiO2. Dilakukan variasi jenis pencemar minyak bumi yaitu minyak solar dan
minyak pelumas, dengan pembubuhan dosis TiO2 optimum. Lama penyinaran dengan sinar
UV adalah selama 7 hari dengan pengambilan sampel air pada hari ke-0; hari ke-1; hari ke-3; hari ke-5; hari ke-7 (Ziolli dan Jardim, 2001).
3.3.6 Pengamatan Parameter
Parameter yang diamati dalam penelitian kali ini adalah Total Petroleum Hydrocarbons (TPH). Dilakukan analisa TPH pada sampel air limbah pada ke-7 untuk penelitian penentuan dosis optimum dan pada hari ke-0; hari ke-1; hari ke-3; hari ke-5; hari ke-7 untuk menentukan laju removal atau pathway degradasi dengan pengambilan sampel tiap waktunya adalah 5 ml untuk mengetahui % removal dari minyak bumi pada air sampel. Kemudian juga dilakukan analisis Fourier Transform Infra Red (FTIR) untuk mendapatkan informasi tentang gugus hidrokarbon untuk menetukan pathway degradasi yang terjadi.
3.3.7 Analisis Data dan Pembahasan
Data yang diperoleh dari hasil pengamatan parameter kemudian diolah untuk dianalisa dan dibahas sehingga dapat menghasilkan tujuan dari penelitian kali ini.
3.3.8 Kesimpulan dan Saran
Pada tahap ini akan diambil kesimpulan yang didapat dari hasil analisa percobaan dan pembahasan yang telah dilakukan dengan mengacu pada tujuan yang ingin dicapai pada penelitian ini.
Gambar 3.1 Alur Penelitian
3.4 Proses Penelitian
Penelitian fotokatalisis dilakukan dengan cara sebagai berikut:
1. Disiapkan air laut buatan dengan kadar salinitas 33 ‰. Kadar salinitas air laut adalah antara 33 ‰ - 37 ‰ (Mangkoediharjo, 2005)
2. Dimasukkan 1500 mL sampel air laut buatan ke dalam gelas ukur.
3. Ditambahkan minyak bumi pada gelas ukur tersebut dengan perbandingan 1 : 20 v/v terhadap air laut (Ziolli dan Jardim, 2001).
4. Larutan tersebut diaduk menggunakan magnetic stirrer selama 30 menit di tempat gelap. Setelah pengadukan selesai, larutan didiamkan selama 15 hari.
5. Diambil larutan dengan mengalirkan keluar sebanyak 1200 ml sampel melalui kran yang berada pada bagian bawah gelas ukur untuk mengambil bagian yang terlarut atau
soluble.
6. Dilakukan variasi pembubuhan TiO2 untuk menentukan dosis optimum TiO2.
7. 8. 9. y 10. diberi dosis 2 g/L. Sam kontrol. Ilu G Sampel dis yang telah Larutan da waktu peny Gam Setelah pe sebanyak ± Efisiensi re Keterangan y = kadar T x = kadar T Disiapkan aromatik ( didaptkan p s pembubuh mpel denga ustrasi samp Gambar 3.2. sinari denga disiapkan alam kondis yinaran. mbar 3.3 Ske nyinaran d ± 5 ml untuk emoval miny n : TPH pada h TPH pada h 3 larutan s (minyak pe pada percob
han TiO2 seb
n dosis pem pel dapat dil
Variasi Pem an lampu U sebelumny si teraduk s ema Reakto dengan lam k penentuan yak dihitung hari ke-0 hari ke-n sampel vari elumas) yan baan pertam Lamp besar 0 g/L mbubuhan lihat pada G mbubuhan D UV fluorese ya. Skema secara stabi or Fotokalis mpu selama n kadar TPH g dengan ru iasi hidroka ng diberi p ma mpu UV 6 W (sebagai ko TiO2 sebes Gambar 3.2. Dosis TiO2 en biru 6 W reaktor dap il dengan m is (Ziolli da 7 hari di H dan spektr umus sebaga arbon yaitu pembubuha ontrol); 0,5 sar 0 gr/L Pada Samp W/G8T5 da pat dilihat magnetic sti an Jardim, 2 lakukan pe rum IR. ai berikut : u: alifatik (m an dosis op g/L; 1 g/L; digunakan pel alam sistem pada Gam irrer hingg 2001) engambilan minyak sol ptimum Ti 1,5 g/L; sebagai m reaktor mbar 3.3. a 7 hari sampel lar), dan iO2.yang
11. 12. 13. 14. 15. y 3.5 Pelaksa Limbah Kimia U Sampel dis yang telah Larutan da waktu peny Diambil sam dilakukan. proses peng Setelah pen sebanyak ± Pada hari k spektrum IR Efisiensi re Keterangan y = kadar T Tempat Pe anaan pene h B3, Jurusa UBAYA. sinari denga disiapkan alam kondis yinaran. mpel pada s Setelah sam gadukan. Sa nyinaran de ± 5 ml pada ke-3, 5 dan 7 R. emoval miny n : TPH pada h elaksanaan litian dilak an Teknik L an lampu U sebelumny si teraduk s saat pengam mpel diamb ampel kemu engan lampu ketiga samp 7 dilakukan yak dihitung hari ke-0, n Penelitian kukan di L Lingkungan UV fluorese ya. Skema secara stabi mbilan 5 mL bil dipasang udian diuku u selama 1 pel untuk pe n prosedur y g dengan ru n Laboratorium n ITS, dan d en biru 6 W reaktor dap il dengan m L sampel pa g lampu pad r kadar hidr hari dilaku enentuan ka yang sama g umus sebaga x = kadar m Teknolo di Laborato W/G8T5 da pat dilihat magnetic sti ada t0, prose da reaktor ta rokarbon de ukan penga adar TPH da guna mengu ai berikut : TPH pada h ogi Pengelo orium Polim alam sistem pada Gam irrer hingg es pengaduk anpa mengh engan analis ambilan sam an spektrum ukur kadar T hari ke-n olaan Samp mer, Jurusan m reaktor mbar 3.3. a 7 hari kan terus hentikan sis TPH. mpel (t1) m IR. TPH dan pah dan n Teknik
BAB IV
JADWAL KEGIATAN DAN RAB 1.1 Pelaksanaan Tugas Akhir
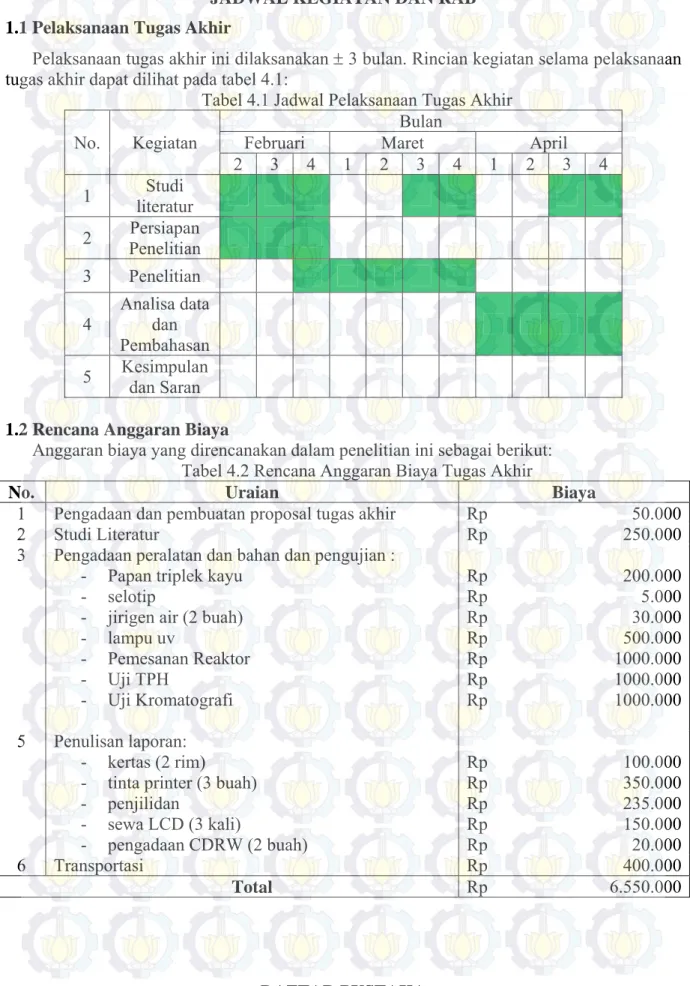
Pelaksanaan tugas akhir ini dilaksanakan 3 bulan. Rincian kegiatan selama pelaksanaan tugas akhir dapat dilihat pada tabel 4.1:
Tabel 4.1 Jadwal Pelaksanaan Tugas Akhir No. Kegiatan
Bulan
Februari Maret April
2 3 4 1 2 3 4 1 2 3 4 1 Studi literatur 2 Penelitian Persiapan 3 Penelitian 4 Analisa data dan Pembahasan 5 Kesimpulan dan Saran
1.2 Rencana Anggaran Biaya
Anggaran biaya yang direncanakan dalam penelitian ini sebagai berikut: Tabel 4.2 Rencana Anggaran Biaya Tugas Akhir
No. Uraian Biaya
1 Pengadaan dan pembuatan proposal tugas akhir Rp 50.000
2 Studi Literatur Rp 250.000
3 Pengadaan peralatan dan bahan dan pengujian : - Papan triplek kayu
- selotip
- jirigen air (2 buah) - lampu uv - Pemesanan Reaktor - Uji TPH - Uji Kromatografi Rp Rp Rp Rp Rp Rp Rp 200.000 5.000 30.000 500.000 1000.000 1000.000 1000.000 5 Penulisan laporan: - kertas (2 rim)
- tinta printer (3 buah) - penjilidan - sewa LCD (3 kali) - pengadaan CDRW (2 buah) Rp Rp Rp Rp Rp 100.000 350.000 235.000 150.000 20.000 6 Transportasi Rp 400.000 Total Rp 6.550.000 DAFTAR PUSTAKA
Arutanti, O., Abdullah, M., Khairurrijal., dan Mahfudz, H. 2009. Penjernihan Air Dari
Pencemar Organik dengan Proses Fotokatalisis pada Permukaan Titanium Dioksida (TiO2). Jurnal Nanosains dan Nanoteknologi. Edisi Khusus ISSN
1979-088V, 53-55, Agustus.
Arief, B.M. 2007. Studi Pengaruh Bulking Agent Pada Proses Bioremediasi Lumpur
Minyak. Universitas Diponegoro. Semarang.
Bansal, P., Singh, D., and Sud, D. 2010. Photocatalytic degradation of azo dye in aqueous
TiO2 suspension: Reaction pathway and identification of intermediates products by LC/MS. Journal of Hazardous Material 156.
Connell, D. 1995. Kimia dan Ektoksikologi Pencemaran (Terjemahan Y. Koestoer,
2006).UI Press. Jakarta.
Fatimah, I., dan Wijaya, K. 2005. Sintesis TiO2/Zeolit Sebagai Fotokatalisis pada Pengolahan Limbah Cair Industri Tapioka Secara Adsorpsi-Fotodegradasi,
TEKNOIN, Vol. 10, No. 4, Desember, 257-267.
Goldberg, R. 1991. Marine Oil Spil Academy of Natural Sciences. Philadelphia.
Herman, J.M. 1999. Heterogenous Photocatalysis Fundamental and Aplication to the
Removal of VariousTypes of Aqueous Pollutants, Catal Today, 53, 115-129.
Khalil, L.B., Mourad, W.E., and Rophael, M.W. 1998. Photocatalytic reduction of
Environmental pollutans Cr(VI) over some semiconductor under UV/Visible Light illumination, Appl. Catal, B:Environ., 173, 267- 273.
Keenan, C.W., Kleinfelter, D.C., and Wood, J.H. 1989. Kimia Untuk Universitas jilid 1
(Terjemahan Hadyana A.P., 1999). Erlangga. Jakarta.
Kopecky, J. 1992. Organic Photochemistry : A Visual Approach.VHC Publishers. New York.
Linsebigler, A.L., Lu, G., and Yates, J.T. 1995. Photocatalysis on TiO2 Surfaces: Principles, Mechanisms, and Selected Result, Chem. Rev. 95, 735-738.
Mangkoediharjo, S. 2005. Pengendalian Pencemaran Dan Kerusakan Wilayah Pesisir Dan
Laut. ITS, Surabaya.
Pavia, 2001. Introduction to Spectroscopy, Fourth Edition, Bellingham Washington. Pertamina. 2006. Material Safety Data Sheet Enduro 20W-50. Pertamina. Jakarta. Pertamina. 2007. Material Safety Data Sheet Biosolar. Pertamina. Jakarta.
Richard, A.L., and Eric, J.W. 1994. Reaction mechanisms in environmental organic
Schwarzenbach, R.P., and Gschwend, P.M. 1993. Environmental Organic Chemistry.New York.Jhon Wiley & Sons, Inc.
Smith, B. 1999. Infrared Spectral Interpretation A Systematic Approach. CRC Press. New York.
Sudarman, R. 2009. Pengolahan Limbah Minyak Bumi. Universitas Haluoleo. Kendari. Syukri, S. 1999. Kimia Dasar 1. ITB. Bandung,
Wise, H., and Sancier, K.M. 1991. Photocatalyzed Oxidation of Crude Oil Residue by
Beach Sand. Catalysis Letters, 11, 277-284
Wulandari, A. 2001. Laporan Hidrokarbon Teknik Kimia Unjani.Unjani.Cimahi.
Yuliandari, W. 2002. Studi Literatur Penanggulangan Tumpahan Minyak Mentah (Crude
Oil) di Lautan Menggunakan Dispersan Kimiawi.Teknik Lingkungan ITS.Surabaya.
Ziolli, R.L., dan Jardim, W.F. 2001. Photocatalytic decomposition of seawater-soluble
crude-oil fractions using high surface area colloid nanoparticles of TiO2. Journal of Photochemistry and Photobiology A: Chemistry. Vol. 147: 205-212.