PREPARASI DAN KARAKTERISASI NANOKATALIS Ni
0,6Fe
2Co
0,4O
4UNTUK REAKSI HIDROGENASI KATALITIK CO
2(Skripsi)
Oleh
Sanjaya Yudha Gautama
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
BANDAR LAMPUNG
2016
ABSTRACT
PREPARATION AND CHARACTERISATION OF Ni
0,6Fe
2Co
0,4O
4NANOCATALYST FOR REACTION HYDROGENATION CATALYTIC OF CO
2By
Sanjaya Yudha Gautama
In this study, nano catalyst Ni
0,6Fe
2Co
0,4O
4has been prepared by sol gel – freeze dry method using pectin as an emulsifying agent, and then the sample was subjected to calcination treatment and subsequently characterized using the techniques of X-ray diffraction (XRD), Rietveld and Scherrer Methods, FTIR, PSA and SEM analysis. Its catalytic activity was tested for CO
2/H
2conversion to alcohol at a temperature of 200 - 400°C. The results of XRD characterization indicated that Ni
0,6Fe
2Co
0,4O
4calcined at 600°C materials consist of three crystalline phases which are Fe
2NiO
4(25.3%), Fe
3O
4(51.5%), and CoFe
2O
4(23.2%). The results of size analysis using both Scherrer method and SEM show that the size of the catalyst is in the range of 11,8 – 22,0 nm. Then, particle size analyzer (PSA) proved that particle size distribution is in the range of 0-2%. Catalytic activity tests showed that Ni
0,6Fe
2Co
0,4O
4nanocatalysts are active. Product analysis using gas chromatography indicates that the Ni
0,6Fe
2Co
0,4O
4nanocatalyst calcined at 600°C is the most active for conversion of CO
2/H
2at a reaction temperature of 200 °C and propanol yield is 53134.83 ppm.
Keywords; nano catalysts, pectin, , sol gel – freeze dry, alcohol
ABSTRAK
PREPARASI DAN KARAKTERISASI NANOKATALIS Ni
0,6Fe
2Co
0,4O
4UNTUK REAKSI HIDROGENASI KATALITIK CO
2Oleh
Sanjaya Yudha Gautama
Pada penelitian ini telah dibuat nanokatalis Ni
0,6Fe
2Co
0,4O
4dengan metode sol- gel dan freezedry menggunakan pektin, serta dilakukan uji aktivitas katalitiknya terhadap reaksi konversi (CO
2/H
2) menjadi alkohol pada suhu 200 – 400°C. Hasil karakterisasi katalis setelah kalsinasi 600 °C menunjukan terbentuknya 3 fasa kristalin yaitu Fe
2NiO
4(25,3%), Fe
3O
4(51,5%), dan CoFe
2O
4(23,2%). Hasil analisis ukuran XRD menggunakan persamaan Scherrer dan analisis menggunakan SEM menunjukan ukuran katalis pada rentang 118 - 220 nm. Hasil analisis ukuran distribusi partikel menggunakan PSA menghasilkan katalis berskala nanometer pada rentang 0 - 2 %. Hasil uji aktivitas katalitik menunjukkan bahwa katalis Ni
0,6Fe
2Co
0,4O
4aktif dan memiliki selektifitas yang tinggi. Analisis menggunakan kromatografi gas menunjukkan bahwa katalis Ni
0,6Fe
2Co
0,4O
4pada suhu kalsinasi 600°C dengan suhu reaksi 200 °C paling aktif terhadap konversi CO
2/H
2menghasilkan propanol yaitu 53134,83 ppm.
Kata kunci ; nanokatalis, pektin, PSA, Scherrer, solgel-freezedry, SEM
PREPARASI DAN KARAKTERISASI NANOKATALIS Ni
0,6Fe
2Co
0,4O
4UNTUK REAKSI HIDROGENASI KATALITIK CO
2Oleh :
Sanjaya Yudha Gautama
Skripsi
Sebagai salah satu syarat untuk mencapai gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
BANDAR LAMPUNG
2016
RIWAYAT HIDUP
Penulis dilahirkan di Bandarlampung pada tanggal 05 Mei 1993, anak kedua dari empat bersaudara, yang merupakan buah kasih dari pasangan ayahanda Drs. Joni Rene Rubiyanto dan ibunda Agnesia Evi Susilowati.
Penulis menyelesaikan pendidikan Sekolah Dasar di SD Fransiskus 1 Tanjung Karang 2005, Sekolah Menengah Pertama (SMP) Xaverius 4 Bandar Lampung pada tahun 2008, dan Sekolah Menengah Atas (SMA) BPK Penabur Bandar Lampung pada tahun 2011. Penulis diterima sebagai Mahasiswa jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung pada tahun 2011 melalui jalur Seleksi Bersama Masuk Perguruan Tinggi Negri (SBMPTN).
Selama menjadi mahasiswa, penulis pernah aktif dalam organisasi
kemahasiswaan, Organisasi Himpunan Mahasiswa Kimia (HIMAKI) periode
2011-2012 sebagai anggota Kader Muda HIMAKI (KAMI), periode 2012-2013
sebagai anggota Bidang Sains dan Penalaran Ilmu Kimia HIMAKI, dan periode
2013-2014 sebagai Kepala Biro Penerbitan HIMAKI. Penulis pernah menjadi
Jurusan Kimia. Asisten Kimia dasar periode 2014-2015 untuk Mahasiswa Jurusan
Kimia.
MOTTO
(Sanjaya Yudha Gautama)
(Jack Ma)
“Sometimes life is going to hit you in the head with a brick. Don’t lose faith.”
(Steve Jobs)
“Failure is an option here. If things are not failing, you are
not innovating enough.”
(Elon Musk)
Dengan segala Puji Syukur kepada Tuhan Yang Maha Esa, aku persembahkan karyaku ini untuk:
Bapak dan Ibu tersayang, yang senantiasa mendo’akan, mendukung, memberi semangat, dan kegigihan serta perjuangan dan pengorbanan Ibu dan Bapak untuk ku sampai bisa seperti ini semoga kasih
sayang dan lindungan Tuhan Yesus tak lepas dari kalian.
Kakak dan Adik-adikku Tiara, Galih, dan Gandhi, serta seluruh keluarga besar ku yang tidak dapat ku sebutkan satu persatu yang senantiasa mendoa’kan, mendukung dan memberi semangat, tanpa kalian aku
tak akan pernah meraih semua ini.
Almamater tercinta Universitas Lampung.
Rekan-rekan seperjuangan .
Segala puji dan syukur hanya milik Tuhan Yang Maha Esa karena berkat anugerah-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul ʻʻ Preparasi Dan Karakterisasi Nanokatalis Ni
0,6Fe
2Co
0,4O
4untuk Reaksi Hidrogenasi Katalitik CO
2’’ dengan baik. Semoga rahmat selalu senantiasa tercurah untuk kita semua sekarang sampai selama – lamanya. Amin.
Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan gelar Sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung. Tidak sedikit masalah yang dihadapi penulis dalam menyelesaikan penulisan skripsi ini, tapi Puji Tuhan, karena kuasa-Nya, Dia memberikan orang – orang terpercaya yang dapat membantu penulis menghadapi masalah ini . Dalam kesempatan ini, penulis menyampaikan banyak terima kasih kepada :
1. Tuhan Yesus Kristus yang telah menjadi panutan, motivator, guru terbaik, serta sahabat yang selalu mendengarkan curhatan hati anak-Nya.
2. Bapak Dr. Rudy TM Situmeang, M.Sc., selaku pembimbing utama, guru, rekan, teman, sekaligus ayah bagi penulis yang dengan sabar memberikan bimbingan dan dukungan kepada penulis.
3. Prof. Wasinton Simanjuntak, Ph.D., selaku pembimbing II penulis, atas
saran, motivasi, masukan dan diskusi-diskusinya hingga selesainya skripsi
ini.
5. Bapak Prof. Sutopo Hadi, Ph.D. selaku Pembimbing Akademik yang telah memberikan informasi, saran kepada mahasiswa.
6. Bapak Dr. Suripto Dwi Yuwono, M.T., selaku Ketua Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
7. Bapak Prof. Warsito, S.Si., D.E.A., Ph.D. selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
8. Kedua orang tua ku tersayang, Bapak Drs. R. Joni Rene R. dan Ibu Agnesia Evi Susilowati atas seluruh cinta, do’a, dan kasih sayang kepada penulis dari masih dalam buaian hingga saat ini. Semoga Tuhan Yesus tetap menjaga masa tua kalian hingga akhir hayat. Serta kakakku, Gentiara Surya Prativi dan kedua adikku Rene Hario Galih dan Pedro Anggara Gandhi, terima kasih telah menjadi saudaraku dan menemaniku di dalam keluarga indah ini.
9. Staf dan karyawan Badan Riset dan Standarisasi Nasional (Bandar Lampung) yang membantu dalam memfasilitasi penelitian ini.
10. Mbak Liza selaku PLP (Pranata Laboratorium Pendidikan) Kimia Anorganik-Fisik, terima kasih atas kemudahan dan kelancaran yang diberikan dalam pengurusan peminjaman alat-alat laboratorium.
11. Mbak Nora dan Pak Gani, terima kasih atas kemudahan dan kelancaran
yang diberikan dalam pengurusan administrasi akademik.
Pengetahuan Alam Universitas Lampung.
13. Keluarga besar penulis yang selalu memberikan saran, motivasi, dan dukungan kepada penulis.
14. Teman – teman satu tim: Eva Dewi Noviyanti Sirait S,Si., dan Fatma Maharani S,Si., yang telah duluan memperoleh gelar sarjana. Terima kasih atas kerja sama, motivasi, dan bantuan yang kalian berikan selama
penelitian ini.
15. Catalyst Crew: Kak Septian M.Si., dan Pak Rodhi M.Si., yang selama ini membimbing dalam proses penelitian ini. Kak Dani S.Si., mbak Lolita S.Si., dan mbak Surtini S.Si., yang terus membantu dengan memberikan bantuan, saran, ajaran, dan fasilitas dalam menjalankan penelitian ini. Feby dan Ana yang juga turut membantu melaksanakan penelitian ini.
16. Teman satu peer group Kimia Fisik; Eva (si tunangan), Fatma (Jjang), Endah (Gege), Umi (Umbel), Yusri (Yucli), Tata (Big Mom), Lusi(Luzee), Vevi, Ivan, dan Ramos. Terima kasih kalian telah memberikan motivasi, semangat, keceriaan buat tim yang selalu ngeyel ini.
17. Teman – teman peer group Biokimia: Ayu B (Ay – Ay), Ajeng, Ana, April, Uswa, Azis, Windy, Jeje. Peer group Anorganik: Melli, Dewi, Nopitasari, Asti, Rio W., Tamara, Rina, Yunia, Nico, Melly A., Irkham.
Peer group kimia organik: Ridho, Andri, Yulia, Jelita, Mirfat, Junaidi, Rio
F., Wagiran, Miftah, Arik. Peer group kimia analitik: Ayu F, Anggino,
Lewi, Daniar, Mila, Fany, Mardian, dan Mega, serta beberapa teman yang
18. Keluarga tempat Kerja Kuliah Nyata (KKN), Pak Slamet Riyadi dan keluarga serta teman-teman KKN Lampung Utara. Terima kasih atas pengalaman dan pendewasaannya selama di sana.
19. Teman-teman geng st. Tarcisius Anto, Lili, Neri, Vivo, dan lain-lain yang selalu membuat keceriaan di gereja.
20. Teman-teman dari TK Fransiskus, SD Fransiskus, SMP Xaverius, dan SMA BPK Penabur.
21. Keluarga di tempat Fitness, dari Platinum Gym: Bang Robby, Bang Idho, Bang Ivan, Bang Jeje, Bang Thamrin, dan Bang Satrio. Centra Fitness:
Koh Andi, Adhi, Arief, Mbak Dewi, Mbak Nita. Terima kasih karena telah mengajari bahwa keluarga tidak didapat di dalam rumah saja.
22. Semua pihak yang telah membantu dan mendukung penulis dalam penyusunan skripsi ini.
Penulis berharap semoga Tuhan Yang Maha Esa membalas semua kebaikan yang diberikan kepada penulis. Amin. Akhir kata, penulis menyadari bahwa skripsi ini masih jauh dari kata sempurna, namun demikian penulis berharap semoga skripsi ini dapat berguna dan menjadi langkah perkembangan teknologi selanjutnya bagi mahasiswa dan pembaca pada umumnya. Amin.
Bandar Lampung, Juni 2016
Sanjaya Yudha Gautama
DAFTAR ISI
Halaman
DAFTAR ISI ……….. i
DAFTAR TABEL ………..………..…. iii
DAFTAR GAMBAR..………..…. iv
DAFTAR LAMPIRAN ... vi
I. PENDAHULUAN A. Latar Belakang …..………..………...………. 1
B. Tujuan Penelitian …...…...………...….……... 6
C. Manfaat Penelitian ………..……...…… 6
II. TINJAUAN PUSTAKA A. Karbon Dioksida (CO
2) ... 7
B. Spinel Ferite ... 9
C. Material Nanopartikel... 10
D. Katalis... 12
E. Hidrogenasi Katalitik CO
2... 14
F. Karakterisasi Katalis... 17
1. Analisis Struktur Kristal... 17
2. Keasaman Katalis... 20
3. Analisis Morfologi Permukaan Katalis... 23
4. Penentuan Ukuran Partikel Katalis... 26
G. Kromatografi Gas... 28
III. METODELOGI PENELITIAN A. Tempat dan Waktu Penelitian...……….…………... 30
B. Alat dan Bahan ………….…..………. 30
C. Prosedur Kerja …...………...………... 31
1. Pembuatan Nanokatalis... 31
2 Karakterisasi Katalis... 32
a. Analisis Struktur Katalis... 32
b. Analisis Keasaman Katalis... 32
c. Analisis Morfologi Permukaan Katalis... 33
d. Analisis Distribusi Ukuran Partikel Katalis... 33
3. Uji Aktivitas Katalis... 34
4. Analisis Produk dengan Kromatografi Gas... 35
IV. HASIL DAN PEMBAHASAN A. Pembuatan Nanokatalis Ni
0,6Fe
2Co
0,4O
4... 36
B. Karakterisasi Nanokatalis... 39
1. Analisis Struktur Kristal... 39
2. Analisis Kuantitatif Struktur Kristal... 43
C. Analisis Keasaman Katalis... 46
D. Analisis Ukuran Partikel... 50
1. Analisis Ukuran Kristal... 50
2. Analisis Morfologi Permukaan... 51
3. Analisis Ukuran Partikel Menggunakan PSA... 53
E. Uji Aktivitas Katalis... 54
1. Analisis Produk Menggunakan Rapid Testing Strip... 55
2. Analisis Produk Menggunakan Kromatografi Gas... 57
V. SIMPULAN DAN SARAN A. Simpulan... 61
B. Saran... 62 DAFTAR PUSTAKA
LAMPIRAN
DAFTAR TABEL
Tabel Halaman
1 Sifat-sifat fisika dan kimia dari CO
2... 7 2 Puncak-puncak representatif masing-masing difraktogram acuan untuk
senyawa Ni
0,6Fe
2Co
0,4O
4...
41
3 Parameter sel pada material Ni
0,6Fe
2Co
0,4O
4berdasarkan perhitungan rietvield ...
44
4 Persentase fasa kristalin Ni
0,6Fe
2Co
0,4O
4... 44 5 Perubahan parameter kisi pada masing – masing fasa kristalin pada
katalis Ni
0,6Fe
2Co
0,4O
4...
45
6 Keasaman katalis Ni
0,6Fe
2Co
0,4O
4... 46 7 Perubahan nilai Full Width at Half Maximum (FWHM) berdasarkan
data XRD pada katalis Ni
0,6Fe
2Co
0,4O
4.....
50
8 Ukuran butir kristal menggunakan rumus Scherrer pada katalis
Ni
0,6Fe
2Co
0,4O
4...
51
9 Komponen atom dalam katalis menggunakan analisis EDS ... 52 10 Distribusi ukuran partikel katalis Ni
0,6Fe
2Co
0,4O
4yang dikalsinasi pada
temperatur 600 °C...
54
11 Distribusi ukuran partikel katalis Ni
0,6Fe
2Co
0,4O
4yang dikalsinasi pada temperatur 800 °C...
54
12 Hasil uji aktivitas katalis Ni
0,6Fe
2Co
0,4O
4terhadap gas CO
2/H
2... 56 13 Hasil analisis uji aktivitas menggunakan kromatografi gas ... 57 14 Hasil kuantitatif propanol yang terbentuk dari konversi CO
2pada
katalis Ni
0,6Fe
2Co
0,4O
4...
59
DAFTAR GAMBAR
Gambar Halaman
1 Model koordinasi antara CO
2dengan logam ... 8
2 Struktur kristal spinel ferite ... 9
3 Siklus reaksi katalisis ... 13
4 Mekanisme karbida ... 16
5 Mekanisme enol ... 16
6 Mekanisme penyisipan CO ... 17
7 Proses pembentukan puncak pada XRD ... 19
8 Difraktogram nanokristal NiFe
2O
4... 19
9 Difraktogram standar NiFe
2O
4PDF 10-0325 ... 20
10 Skema instrumentasi FTIR ... 22
11 Contoh spektra FTIR dalam penentuan jenis situs asam ... 23
12 Skema kerja dari SEM ... 24
13 Mikrograf SEM dari Fe
2O
3... 25
14 Particle Size Analyzer (PSA) ... 27
15 Susunan komponen-komponen instrumentasi kromatografi gas ... 28
16 Skema reaktor katalitik ... 34
17 Gel membentuk Prekursor Ni
0,6Fe
2Co
0,4O
4... 37
18 Serbuk prekursor Ni
0,6Fe
2Co
0,4O
4setelah Freezedry ... 37
19 Profil suhu yang digunakan dalam proses kalsinasi ... 38
20 Padatan bubuk Ni
0,6Fe
2Co
0,4O
4setelah proses kalsinasi ... 39
21 Difraktogram nanokatalis Ni
0,6Fe
2Co
0,4O
4sebelum uji aktivitas (a). T = 800°C, (b). T = 600°C ... 40
22 Pencocokan pola difraktogram antara Ni
0,6Fe
2Co
0,4O
4dengan NiFe
2O
4suhu 600° C (96-591-0065), Fe
3O
4(96-900-5842), dan CoFe
2O
4(96- 591-0064) ... 42
23 Pencocokan pola difraktogram antara Ni
0,6Fe
2Co
0,4O
4dengan NiFe
2O
4suhu 600° C (96-591-0065), Fe
3O
4(96-900-5842), dan CoFe
2O
4(96- 591-0064) ... 42
24 Hasil penghalusan antara hasil pola difraksi sinar – X terhadap sampel dengan perhitungan menggunakan program rietvield ... 43
25 Spektra deuterium mengubah hidrogen pada ikatan N
+- H – O yang teradsorpsi (a) selama 4 jam, (b) penambahan D
2O dan diisolasikan, (c) pencucian D
2O selama 3 kali ... 47
26 Spektra inframerah (a) Pektin, (b) katalis Ni
0,6Fe
2Co
0,4O
4suhu 600°C ,(c) katalis Ni
0,6Fe
2Co
0,4O
4suhu 800°C ... 48
27 Mikrograf hasil analisis SEM dengan perbesaran (a) 1000x dan (b) 2000x (c) beberapa butir katalis 1, 2, dan 3 ... 51
28 Hasil analisis EDS pada katalis Ni
0,6Fe
2Co
0,4O
4pada kalsinasi 600°C ... 52
29 Distribusi ukuran partikel katalis Ni
0,6Fe
2Co
0,4O
4suhu 600°C ... 53
30 Analisis produk menggunakan Rapid Testing Strip ... 55
31 Terbentuknya padatan karbon pada uji aktivitas pada suhu Reaksi 400°C ... 56
32 Kromatogram produk hasil uji aktivitas katalis Ni
0,6Fe
2Co
0,4O
4temperatur uji aktivitas 200°C, pada temperatur 600°C ... 57
33 Kromatogram produk hasil uji aktivitas katalis Ni
0,6Fe
2Co
0,4O
4temperatur uji aktivitas 300°C, pada temperatur 600°C ... 58
34 Kromatogram produk hasil uji aktivitas katalis Ni
0,6Fe
2Co
0,4O
4temperatur uji aktivitas 200°C, pada temperatur 800°C ... 58
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Diagram alir penelitian ... 71
A. Sintesis dan karakterisasi katalis ... 71
B. Uji aktivitas katalis ... 72
Lampiran 2 Perhitungan Scherrer ... 73
Lampiran 3 Perhitungan derajat keasaman ... 74
Lampiran 4 Hasil uji PSA ... 75
Lampiran 5 Perhitungan konsentrasi propanol pada produk hasil uji aktivitas
Katalis ... 76
I. PENDAHULUAN
A. Latar Belakang
Pemanasan global mendapat perhatian dunia setelah Konferensi Tingkat Tinggi (KTT) yang diadakan PBB pada bulan Juli 1992 di Rio de Janeiro, yang lebih dikenal sebagai KTT Bumi (Sugiyono, 2002). Erat kaitannya dengan pemanasan global adalah emisi CO
2, karena gas ini merupakan komponen utama, yakni 83 % dari gas rumah kaca (Indala, 2004). Sumber utama CO
2adalah penggunaan bahan bakar fosil untuk berbagai kegiatan, terutama industri yang menyumbangkan 74 % dari total emisi CO
2(Sugiyono, 2002). Emisi CO
2ini diperkirakan akan terus meningkat karena masih besarnya ketergantungan terhadap bahan bakar fosil sebagai pemenuh kebutuhan energi (Santosa dan Yudiartono, 2006).
Menyikapi hal tersebut, para peneliti telah melakukan pencarian sumber energi alternatif dan sumber energi terbarukan dengan cadangan yang berlimpah dan ramah lingkungan. Sumber energi tersebut antara lain, energi surya, energi angin, energi air, energi nuklir, dan energi berbasis biomassa (Kadiman, 2006). Saat ini, yang sedang menarik perhatian para peneliti adalah pemanfaatan gas CO
2sebagai sumber energi terbarukan, sebagaimana yang kita ketahui bahwa gas CO
2merupakan gas rumah kaca yang menyebabkan pemanasan global (Sugiyono,
2006 ; Song, 2006).
Salah satu upaya pemanfaatan gas CO
2adalah melalui konversi (Indala, 2004).
Salah satu metode konversi CO
2yang banyak dikembangkan adalah hidrogenasi katalitik, karena dengan metode ini CO
2dapat dikonversi menjadi metanol (Cabrera et al., 1998 ; Joo, 1999), LPG, etilen dan propilen (Fujiwara et al., 1995), serta olefin ringan atau hidrokarbon cair (Jun et al., 2006). Selain itu, metode ini juga dapat menghasilkan CO yang dapat digunakan dalam proses Fischer-Tropsch (Srinivas et al., 2009).
Produk hidrogenasi katalitik CO
2sangat bergantung pada katalis yang digunakan.
Sebagai contoh, CO dihasilkan sebagai produk utama jika digunakan katalis logam Cu yang diembankan pada material karbon berpori, namun CH
4akan dihasilkan jika digunakan katalis logam Ni atau Co dengan pengemban yang sama (Lapidus et al., 2006). Dengan demikian, pemilihan katalis yang tepat akan
mengarahkan reaksi ke arah produk utama yang diinginkan (Srinivas et al., 2009)
Konversi gas CO
2menjadi senyawa kimia bermanfaat dilakukan dengan menggunakan katalis. Salah satu metode konversi gas CO
2yang telah banyak dikembangkan adalah hidrogenasi katalitik untuk menghasilkan alkohol, karena dengan metode ini molekul-molekul gas CO
2dapat berinteraksi sangat kuat
dengan logam transisi dan menimbulkan kepolaran dan kereaktifan sehingga dapat bereaksi dengan molekul-molekul syn-gas. Berdasarkan alasan ini, banyak
peneliti telah melaporkan pengembangan berbagai jenis katalis.
Pada penelitian sebelumnya yang dilakukan oleh Situmeanget al., (2010) konversi
CO
2/H
2dengan katalis NiFe
2O
4(dimana perbandingan mol Ni terhadap Fe 0,1 –
0,5) yang dipreparasi menggunakan metode sol-gel sitrat dengan ukuran partikel
50 μm, serta uji aktifitas katalitik dilakukan pada kondisi suhu 100 – 400
oC dan tekanan 1 atm, diperoleh senyawa alkohol metanol, etanol, propanol dan butanol.
Pada penelitian ini katalis Ni
0,2Fe
0,8O
4adalah katalis yang memiliki aktivitas paling tinggi terhadap konversi CO
2/H
2menjadi alkohol pada suhu 200
oC dan 400
oC dengan rendemen alkohol 793,62 ppm.
Kemudian dilakukan pengembangan oleh Situmeang et al., (2013) konversi CO
2/H
2dengan katalis Ni
xCo
yFe
1-x-yO
4(perbandingan mol x= 0,1 – 0,3 dan y = 0,2) dipreparasi dengan metode sol-gel putih telur dengan ukuran partikel 85 – 110 nm. Katalis diuji aktifitasnya pada kondisi suhu 600°C dengan tekanan 1 atm, diperoleh senyawa alkohol etanol dan propanol. Pada penelitian ini, katalis
Ni
0,2Co
0,2Fe
0,6O
4adalah katalis yang memiliki aktifitas tertinggi terhadap konversi CO
2/H
2menjadi alkohol pada suhu 600°C dengan rendemen alkohol 5.000 ppm.
Katalis berbasis kobalt (Co) juga telah banyak digunakan sebagai katalis untuk reaksi Fischer-Tropsch (Diehl and Khodakov, 2009; Breejen, et al., 2007), reaksi reduksi karbon dioksida (Khedr, et al., 2006) serta reaksi metanasi dan
desulfurisasi (Wan Abu Bakaret al., 2008).Storsǽte et al., (2005) melakukan
konversi H
2/CO dengan katalis berpendukung kobalt (Co) pada kondisi suhu
483
oK dan tekanan 20 bar, dengan selektifitas 40 – 45%. Chen et al., (2003)
melaporkan nanopartikel CoO
xdan Au/CoO
x(dimana x rasio atom antara 1.00
sampai 1.33) memiliki aktifitas yang tinggi terhadap reaksi oksidasi karbon
monoksida, dimana semakin tinggi nilai x aktifitas oksidasi karbon monoksida
semakin tinggi.
Menurut El-Kherbawi (2010), katalis dengan berbagai macam campuran oksida logam dalam suatu sistem katalis mempunyai keaktifan yang lebih tinggi jika dibandingkan dengan logam tunggal itu sendiri. Kim et al., (2001) melaporkan bahwa katalis Ni
xZn
1-xFe
2O
4-ymenunjukan efisiensi yang besar terhadap
dekomposisi gas CO
2dibandingkan katalis NiFe
2O
4-y. Hwang dan Wang (2004) telah melakukan studi dekomposisi CO
2menggunakan katalis Mn-Zn ferrite dan Mn-Ni ferrite nanopartikel. Dalam studi ini katalis Mn-Zn ferrite nanopartikel menunjukan aktifitas yang tinggi terhadap dekomposisi CO
2dibandingkan katalis Mn-Ni ferite, dengan kandungan Mn yang sama.
Penggunaan metode sol gel didasarkan pada kemudahan memasukkan satu atau dua logam aktif sekaligus dalam prekursor katalis (Lambert dan Gonzalez, 1998).
Keuntungan dari metode ini meliputi: dispersi yang tinggi dari spesi aktif yang tersebar secara homogen pada permukaan katalis, tekstur porinya memberikan kemudahan difusi dari reaktan untuk masuk ke dalam situs aktif (Lecloux dan Pirard, 1998), luas permukaan yang cukup tinggi, peningkatan stabilitas termal (Lambert dan Gonzalez, 1998).
Selain itu, penggunaan teknik pengeringan, freeze drying dalam preparasi katalis
ternyata memberikan beberapa keuntungan seperti hasilnya homogen, murni dan
ukuran partikel dapat diproduksi ulang serta aktivitasnya seragam dan mempunyai
kemampuan untuk diproduksi kembali (Bermejo et al., 1997). Hal ini dengan jelas
mengindikasikan adanya pengaruh metode preparasi yang signifikan terhadap
perilaku katalis.
Burianova et al., (2011) melakukan preparasi katalis Ni
1-xCo
xFe
2O
4/ 5SiO
2(x=
0,0; 0,2; 0,4; 0,6; 0,8; 1,0) dengan metode sol – gel TEOS, dan HNO
3sebagai asam katalis. Katalis dikalsinasi sampai suhu 900°C dan dihasilkan ukuran antara 13 – 21 nm. Dilakukan kembali penelitian selanjutnya oleh Situmeang et al., (2015) konversi CO
2/H
2menggunakan katalis NiCo
xFe
2-xO
4(x = 0,1 – 0,3) yang dipreparasi dengan metode sol-gel dengan ukuran partikel 15-46 nm.
Material nanopartikel telah banyak menarik peneliti karena material nanopartikel menunjukan sifat fisika dan kimia yang sangat berbeda dari bulk materialnya, seperti kekuatan mekanik, elektronik, magnetik, kestabilan termal, katalitik dan optik (Mahalehet al., 2008; Derazet al., 2009). Material nanopartikel menunjukan potensi sebagai katalis karena material nanopartikel memiliki area permukaan yang luas dan rasio-rasio atom yang tersebar secara merata pada permukaanya.
Sifat ini menguntungkan untuk transfer massa di dalam pori-pori dan juga
menyumbangkan antar muka yang besar untuk reaksi-reaksi adsorpsi dan katalitik (Widegrenet al., 2003).
Berdasarkan penjelasan di atas dan mengacu pada penelitian sebelumnya, maka
dalam penelitian ini dilakukan preparasi nanokatalis Ni
0,6Fe
2Co
0,4O
4dengan
metode sol-gel, serta uji aktifitas katalitiknya terhadap reaksi konversi (CO
2/ H
2).
B. TujuanPenelitian
Mempelajari cara pembuatan nanokatalisNi
0,6Fe
2Co
0,4O
4, dan menguji keaktifan nanokatalis Ni
0,6Fe
2Co
0,4O
4terhadap reaksi konversi (CO
2/ H
2) pada suhu 200 – 400
oC.
C. ManfaatPenelitian
Memperoleh pengetahuan tentang pembuatan nanokatalis Ni
0,6Fe
2Co
0,4O
4dengan
metode sol-gel dan langkah awal dalam penanganan dan pemanfaatan gas CO
2.
II. TINJAUAN PUSTAKA
A. Karbon Dioksida (CO
2)
CO
2merupakan molekul linear yang simetris, dengan panjang ikatan C – O sebesar 1,16 Å (Volpin and Kolomnikov, 1972). Beberapa sifat-sifat fisika dan kimia dari CO
2dirangkum dalam Tabel 1 berikut.
Tabel 1. Sifat-sifat fisika dan kimia dari CO
2(Song et al., 2002)
Sifat-sifat Nilai dan Satuan
Panas pembentukkan pada 25 oC -393,5 kJ/mol Entropi pembentukkan pada 25 oC 213,6 J/K.mol Energi bebas Gibbs pembentukkan pada 25 oC -394,3 kJ/mol
Titik sublimasi pada 1 atm -78,5 oC
Titik tripel pada 5,1 atm -56,5 oC
Temperatur kritis 31,04 oC
Tekanan kritis 72,85 atm
Densitas kritis 0,468 g/cm3
Densitas gas pada 0 oC dan 1 atm 1,976 g/L Densitas cair pada 0 oC dan 1 atm 928 g/L
Densitas padat 1560 g/L
Panas terkandung dalam penguapan pada 0 oC 231,3 J/g Kelarutan dalam air
Pada 0 oC dan 1 atm Pada 25 oC dan 1 atm
0,3346 g CO2/100 g H2O 0,1449 g CO2/100 g H2O
Dari Tabel 1 di atas, panas pembentukkan ( H
0) dan energi bebas Gibbs
pembentukkan ( G
0) dari CO
2adalah dua sifat penting. Nilai-nilai tersebut
secara luas digunakan untuk memperkirakan panas pembentukkan dan energi bebas Gibbs standar dari berbagai reaksi (Indala, 2004).
CO
2adalah molekul yang sangat stabil, akibatnya sejumlah energi harus diberikan untuk mendorong reaksi ke arah yang diinginkan (Creutz and Fujita, 2000).
Namun, berdasarkan energi bebas Gibbs-nya, energi yang diberikan untuk melangsungkan reaksi akan lebih kecil jika CO
2digunakan sebagai ko-reaktan bersama dengan reaktan lain yang memiliki energi bebas Gibbs yang lebih besar seperti metana, karbon (grafit), atau hidrogen (Song et al., 2002).
Karbon dioksida menunjukkan beberapa model koordinasi dengan senyawa logam transisi, yang pertama melalui donasi pasangan elektron bebas dari oksigen ke orbital kosong dari logam. Kedua melalui donasi elektron dari logam ke orbital karbon dengan membentuk turunan asam logam. Dan ketiga melalui
pembentukkan kompleks-π melalui ikatan ganda C = O. Ketiga model koordinasi tersebut ditunjukkan pada Gambar 1 berikut.
M O C O
I II III
Gambar 1. Model koordinasi antara CO
2dengan logam
(I) melalui donasi elektron bebas oksigen ke orbital kosong dari logam (II) melalui donasi elektron dari logam ke orbital karbon
(III) melalui pembentukkan kompleks-π melalui ikatan ganda C = O Dari ketiga model koordinasi di atas, model II dan III adalah model yang paling disukai. Model pertama hanya akan terjadi jika senyawa logam merupakan asam Lewis yang kuat (Volpin and Kolomnikov, 1972).
M
C
O O
M O
C O
B. Spinel Ferite
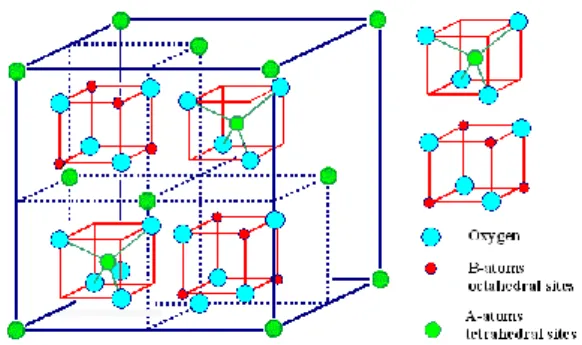
Spinel ferite adalah material magnetik yang sangat penting, karena sifat magnetik, elektrik dan kestabilan termal dari material tersebut sangat menarik. Spinel ferite ini secara teknologi penting dan telah banyak digunakan dalam berbagai aplikasi seperti media perekam magnetik, pemindai magnetik resonansi (MRI), katalis, sistem pembawa obat dan zat pewarna (Maensiri et al., 2007; Kasapoglu et al., 2007). Spinel ferite memiliki rumus umum AB
2O
4dimana A adalah kation-kation bervalensi 2 seperti Fe, Ni, Co, dll., yang menempati posisi tetrahedral dalam struktu kristalnya dan B adalah kation-kation bervalensi 3 seperti Fe, Mn, Cr dll., yang menempati posisi oktahedral dalam struktur kristalnya, serta terdistribusi pada lattice fcc yang terbentuk oleh ion O
2-(Kasapoglu et al., 2007 ; Almeida et al., 2008 ; Iftimie et al., 2006). Gambar 2 berikut adalah struktur kristal spinel ferite.
Gambar 2. Struktur kristal spinel ferite
Kation – kation yang terdistribusi dalam struktur spinel terdapat dalam tiga bentuk
yaitu normal, terbalik (inverse) dan diantara normal dan terbalik. Pada posisi
normal ion – ion logam bervalensi 2 terletak pada posisi tetrahedral (posisi A)
atau dapat dituliskan (M
2+)
A[M
23+]
BO
4,pada posisi terbalik (inverse) ion – ion
logam bervalensi 2 terletak pada posisi oktahedral (posisi B) atau dapat dituliskan (M
3+)
A[M
2+M
3+]
BO
4dan posisi diantara normal dan terbalik, setengah dari ion - ion logam bervalensi 2 dan 3 menempati posisi tetrahedral dan oktahedral atau dapat dituliskan (M
2+M
3+)
A[M
1-x2+M
2-λ3+]
BO
4(Manova et al.,2005).
Nikel ferite (NiFe
2O
4) merupakan salah satu material spinel ferite yang sangat penting. Nikel ferite ini memiliki struktur spinel terbalik (inverse) yang mana setengah dari ion Fe mengisi pada posisi tetrahedral (posisi A) dan sisanya menempati posisi pada oktahedral (posisi B) hal ini dapat dituliskan dengan rumus (Fe
3+1.0)[Ni
2+1.0Fe
3+1.0]O
2-4(Kasapoglu et al., 2007 ; Maensiri et al., 2007).
NiFe
2O
4telah banyak digunkan sebagai katalis untuk benzoilasi toluene dengan benzil klorida dan kemampuan sebagai sensor gas klorin pada konsentrasi rendah (Ramankutty and Sugunan, 2001 ; Reddy et al., 1999 ; Iftimie et al., 2006) untuk reaksi hidrogenasi (CO
2+ H
2) menjadi senyawa alkohol (Situmeang et al., 2010).
C. Material Nanopartikel
Nanopartikel didefinisikan sebagai partikulat yang terdispersi atau partikel-
partikel padatan dengan ukuran partikel berkisar 10 – 100 nm (Mohanraj and
Chen, 2006 ; Sietsma et al., 2007 ; Abdullah dkk., 2008). Material nanopartikel
telah banyak menarik peneliti karena material nanopartikel menunjukkan sifat
fisika dan kimia yang sangat berbeda dari bulk materialnya, seperti kekuatan
mekanik, elektronik, magnetik, kestabilan termal, katalitik dan optik (Mahaleh et
al., 2008; Deraz et al., 2009). Ada dua hal utama yang membuat nanopartikel
berbeda dengan material sejenis dalam ukuran besar (bulk) yaitu : (a) karena
ukurannya yang kecil, nanopartikel memiliki nilai perbandingan antara luas
permukaan dan volume yang lebih besar jika dibandingkan dengan partikel sejenis dalam ukuran besar. Ini membuat nanopartikel bersifat lebih reaktif. Reaktivitas material ditentukan oleh atom-atom di permukaan, karena hanya atom-atom tersebut yang bersentuhan langsung dengan material lain; (b) ketika ukuran partikel menuju orde nanometer, hukum fisika yang berlaku lebih didominasi oleh hukum-hukum fisika kuantum (Abdullah dkk., 2008).
Sifat-sifat yang berubah pada nanopartikel biasanya berkaitan dengan fenomena- fenomena berikut ini. Pertama adalah fenomena kuantum sebagai akibat
keterbatasan ruang gerak elektron dan pembawa muatan lainnya dalam partikel.
Fenomena ini berimbas pada beberapa sifat material seperti perubahan warna yang dipancarkan, transparansi, kekuatan mekanik, konduktivitas listrik dan magnetisasi. Kedua adalah perubahan rasio jumlah atom yang menempati permukaan terhadap jumlah total atom. Fenomena ini berimbas pada perubahan titik didih, titik beku, dan reaktivitas kimia. Perubahan-perubahan tersebut
diharapkan dapat menjadi keunggulaan nanopartikel dibandingkan partikel sejenis dalam keadaan bulk (Abdullah dkk., 2008).
Material nanopartikel menunjukkan potensi sebagai katalis karena material
nanopartikel memiliki area permukaan yang luas dan rasio-rasio atom yang
tersebar secara merata pada permukaanya, sifat ini menguntungkan untuk transfer
massa di dalam pori-pori dan juga menyumbangkan antar muka yang besar untuk
reaksi-reaksi adsorpsi dan katalitik (Widegren et al., 2003). Selain itu, material
nanopartikel telah banyak dimanfaatkan sebagai katalis untuk menghasilkan
bahan bakar dan zat kimia serta katalis untuk mengurangi pencemaran lingkungan (Sietsma et al., 2007).
Banyak metode yang telah dikembangkan untuk preparasi material nanopartikel, seperti metode pemanasan sederhana dalam larutan polimer. Secara sederhana prinsip kerja dari metode ini adalah mencampurkan logam nitrat dalam air dengan larutan polimer dengan berat molekul tinggi yang disertai dengan pemanasan (Abdullah dkk, 2008). Metode sintesis koloid, prinsip kerja dari metode ini adalah membuat suatu larutan koloid yang kemudian ditambahkan surfaktan, yang akan mendeaktivasi pertumbuhan partikel koloid dan melindungi permukaan koloid (Soderlind, 2008). Metode pembakaran, dalam metode ini logam nitrat
dicampurkan dengan suatu asam amino (glisin) dalam air, kemudian dipanaskan sampai mendidih dan sampai terbentuk bubur kering yang produknya berupa oksida logam (Soderlind, 2008). Metode kopresipitasi, prinsip kerja dari metode ini adalah dengan mengubah suatu garam logam menjadi endapan dengan menggunakan pengendap basa hidroksida atau karbonat, yang kemudian diubah ke bentuk oksidanya dengan cara pemanasan (Pinna, 1998). Metode Sol-Gel, prinsip kerja dari metode ini adalah hidrolisis garam logam menjadi sol, yang kemudian sol ini mengalami kondensasi membentuk gel (Ismunandar, 2006).
D. Katalis
Katalis didefinisikan oleh Berzelius sebagai suatu senyawa yang dapat
meningkatkan laju dari suatu reaksi kimia, tapi tanpa terkonsumsi selama reaksi
(Stoltze, 2000). Katalis dapat membentuk ikatan dengan molekul-molekul yang
bereaksi, dan membiarkan mereka bereaksi untuk membentuk produk kemudian
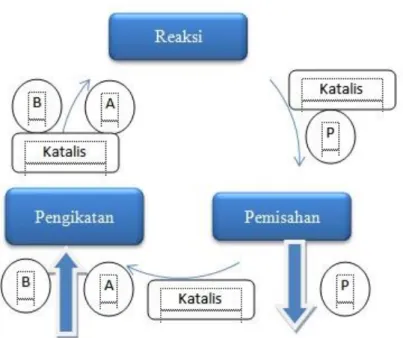
terlepas dari katalis. Suatu reaksi terkatalisis digambarkan sebagai suatu siklus peristiwa dimana katalis berpartisipasi dalam reaksi dan kembali ke bentuk semula pada akhir siklus. Siklus tersebut digambarkan pada Gambar 3 berikut (Chorkendroff and Niemantsverdriet, 2003).
Gambar 3. Siklus reaksi katalisis
Dari Gambar 3 di atas, siklus diawali dengan pengikatan molekul-molekul A dan B (reaktan) pada katalis. Kemudian A dan B bereaksi dalam bentuk kompleks ini membentuk produk P, yang juga terikat pada katalis. Pada tahap akhir, P terpisah dari katalis sehingga siklus kembali ke bentuk semula.
Secara umum, katalis dikelompokkan menjadi dua kelompok yaitu katalis
homogen dan katalis heterogen. Untuk katalis homogen, katalis dan reaktan
berada dalam fase yang sama. Sedangkan untuk katalis heterogen, katalis dan
reaktan berada pada fase yang berbeda. Untuk tujuan praktis, penggunaan katalis
heterogen saat ini lebih disukai dibandingkan dengan katalis homogen (Chorkendroff and Niemantsverdriet, 2003)
Saat ini, proses katalitik heterogen dibagi menjadi dua kelompok besar, reaksi- reaksi reduksi-oksidasi (redoks), dan reaksi-reaksi asam-basa. Reaksi-reaksi redoks meliputi reaksi-reaksi dimana katalis mempengaruhi pemecahan ikatan secara homolitik pada molekul-molekul reaktan menghasilkan elektron tak berpasangan, dan kemudian membentuk ikatan secara homolitik dengan katalis melibatkan elektron dari katalis. Sedangkan reaksi-reaksi asam-basa meliputi reaksi-reaksi dimana reaktan membentuk ikatan heterolitik dengan katalis melalui penggunaan pasangan elektron bebas dari katalis atau reaktan (Li, 2005).
E. Hidrogenasi Katalitik CO
2Hidrogenasi katalitik CO
2merupakan gabungan dua tahap reaksi yaitu pergeseran terbalik air dan gas (RWGS) dan reaksi sintesis Fischer-Tropsch (Joo dan Jung, 2003). Reaksi pergeseran terbalik air dan gas (RWGS) adalah reaksi antara CO
2dengan H
2untuk menghasilkan CO dan H
2O. Konversi CO
2menjadi CO ini memainkan peran yang sangat penting dalam hidrogenasi CO
2, karena kestabilan CO
2tidak memungkinkan untuk melakukan hidrogenasi secara langsung (Joo, 1999). Persamaan reaksi untuk RWGS adalah
O H CO H
CO
2
2
katalis
2 H
0 41 kJ mol , G
0 29 kJ mol (1)
CO yang dihasilkan dari RWGS kemudian mengalami reaksi hidrogenasi melalui
reaksi sintesis Fischer-Tropsch. Produk yang dihasilkan dapat berupa parafin-
parafin linear, α-olefin, ataupun hidrokarbon mengandung oksigen seperti alkohol dan eter (Bakhtiari et al., 2008).
Konversi gas CO
2menjadi senyawa alkohol dapat dilakukan dengan mereaksikan gas CO
2dengan gas H
2, yang mana gas H
2merupakan agen reduksi yang terbaik.
Reaksi pembentukan senyawa alkohol dari gas CO
2dan H
2seperti metanol (2) juga dapat diikuti dengan pembentukan produk-produk senyawa kimia lainnya seperti reaksi Sabatier (3), reaksi Bosch (4), reaksi pergeseran air dan gas (5) dimetileter (6), dan asam format (7). Mekanisme reaksi di atas dapat dituliskan di bawah ini :
CO
2+ 3H
2→ CH
3OH + H
2O ∆H
298= -49,4 Kj mol
-1(2) CO
2+ 4H
2→ CH
4+ H
2O ∆H
298= -164,1 Kj mol
-1(3) CO
2+ 2H
2→ C + 2H
2O ∆H
298= -14,6 Kj mol
-1(4) CO
2+ H
2→ CO + H
2O ∆H
298= +42,3 Kj mol
-1(5) CO
2+ 6H
2→ CH
3OCH
3+ 3H
2O ∆H
298= -112,2 Kj mol
-1(6) CO
2+ H
2→ HCOOH ∆H
298=+16,7 Kj mol
-1(7) Reaksi (2), (3), (4),dan (6), adalah reaksi eksotermis sedangkan reaksi (5) dan (7) adalah reaksi endotermis. Pada reaksi di atas seluruh reaksi sebanding dan
bersaing (Atkins, 2004).
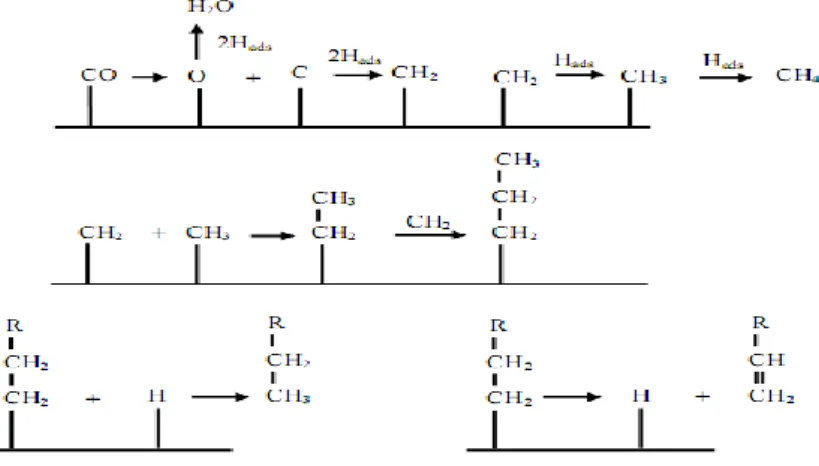
Mekanisme reaksi sintesis Fischer-Tropsch secara garis besar dikelompokkan menjadi 3 yaitu, mekanisme karbida, mekanisme enol, dan mekanisme penyisipan CO. Mekanisme karbida diajukan oleh Fischer dan Tropsch pada tahun 1926.
Dalam mekanisme ini, CO yang teradsorpsi dipisahkan menjadi C dan O, karbida
yang terbentuk kemudian terhidrogenasi menjadi CH
x(monomer). Monomer
metilen terpolimerisasi spesies alkil permukaan kemudian mengalami terminasi membentuk produk. Mekanisme ini digambarkan pada Gambar 4 berikut (Fischer dan Tropsch, 1926).
Gambar 4. Mekanisme karbida
Mekanisme enol diajukan oleh Storch et al (1951). Dalam mekanisme ini, pertumbuhan rantai diinisiasi melalui kondensasi dua spesies hidroksikarbena teradsorpsi (CHOH
ads) dengan mengeliminasi air. Mekanisme enol ini
ditunjukkan dalam Gambar 5 berikut.
Gambar 5. Mekanisme enol
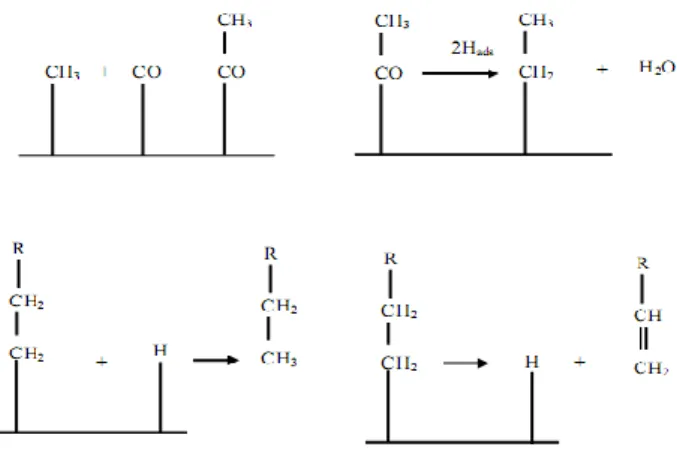
Mekanisme yang terakhir, mekanisme penyisipan CO diajukan oleh Pichler dan Schulz (1970). Mekanisme ini melibatkan penyisipan CO yang teradsorpsi ke dalam ikatan alkil metil. Karbon teroksigenasi kemudian mengalami hidrogenasi untuk menghilangkan oksigen. Gambar 6 berikut menunjukkan mekanisme penyisipan CO.
Gambar 6. Mekanisme penyisipan CO
F. Karakterisasi Katalis
Karakterisasi adalah hal yang sangat penting dalam bidang katalisis. Beberapa metode seperti difraksi, spektroskopi, dan mikroskopi memberikan kemudahan dalam menyelidiki sifat-sifat suatu katalis, sehingga diharapkan kita dapat mendapatkan pemahaman yang lebih baik tentang katalis agar kita dapat meningkatkan atau mendesain suatu katalis yang memiliki aktivitas yang lebih baik (Chorkendorf and Niemantsverdriet, 2003).
1. Analisis Struktur Kristal
Analisis struktur kristal katalis dilakukan menggunakan instrumentasi difraksi
sinar-X (X-ray Difraction/XRD). XRD merupakan salah satu metode karakterisasi
material yang paling tua dan paling sering digunakan hingga saat ini. Teknik ini digunakan untuk mengidentifikasi suatu material berdasarkan fasa kristalin dalam material dengan cara menentukan parameter kisi serta untuk mendapatkan ukuran partikel suatu material (Auda, 2009).
Metode XRD didasarkan pada fakta bahwa pola difraksi sinar-X untuk masing- masing material kristalin adalah karakteristik. Dengan demikian, bila pencocokan yang tepat dapat dilakukan antara pola difraksi sinar-X dari sampel yang tidak diketahui dengan sampel yang telah diketahui, maka identitas dari sampel yang tidak diketahui itu dapat diketahui (Skoog dan Leary, 1992).
Difraksi sinar-X terjadi pada hamburan elastis foton-foton sinar-X oleh atom dalam sebuah kisi periodik. Hamburan monokromatis sinar-X dalam fasa tersebut memberikan interferensi yang konstruktif. Dasar dari penggunaan XRD untuk mempelajari kisi kristal adalah berdasarkan persamaan Bragg (Ismunandar, 2006):
n d . sin
2 (8) dimana :
d = jarak antara dua bidang kisi (nm)
θ = sudut antara sinar datang dengan bidang normal n = bilangan bulat yang disebut sebagai orde pembiasan λ = panjang gelombang sinar-X yang digunakan (nm)
Gambar 7 berikut menunjukkan proses terjadinya pembentukkan puncak-puncak
difraksi pada XRD.
Gambar 7. Proses pembentukkan puncak pada XRD
Berdasarkan persamaan Bragg, jika seberkas sinar-X dijatuhkan pada sampel kristal, maka bidang kristal itu akan membiaskan sinar-X yang memiliki panjang gelombang yang sama dengan jarak antar kisi dalam kristal tersebut. Sinar yang dibiaskan akan ditangkap oleh detektor, kemudian diterjemahkan sebagai puncak difraksi. Semakin banyak bidang kristal yang sama terdapat dalam sampel, semakin kuat intensitas pembiasan yang dihasilkan. Tiap puncak yang muncul pada pola XRD mewakili satu puncak bidang kristal yang memiliki orientasi tertentu dalam sumbu tiga dimensi (Auda, 2009).
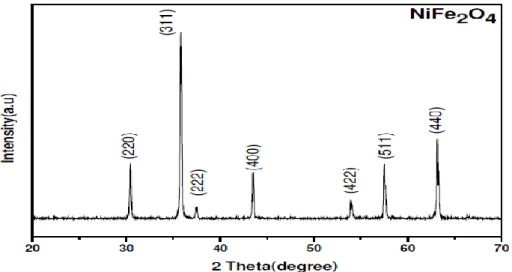
Gambar 8 berikut adalah contoh difraktogram sinar-X NiFe
2O
4yang dipreparasi menggunakan metode EDTA-assited hydrothermally.
Gambar 8. Difraktogram nanokristal NiFe
2O
4(Kasapoglu et al., 2007).
Difraktogram di atas diinterpretasikan melalui pencocokan dengan difraktogram standar. Gambar 9 berikut adalah difraktogram standar yang digunakan dalam pencocokan difraktogram di atas.
Gambar 9. Difraktogram standar NiFe
2O
4PDF 10-0325 (PCPDFwin, 1997)
Dari Gambar 9 di atas, puncak-puncak yang mewakili NiFe
2O
4terdapat pada 2θ 35,73
o, 62,974
o, 57,409
odan 30,319
o.
2. Keasaman Katalis
Keasaman katalis dapat dikategorikan menjadi dua yaitu jumlah situs asam dan jenis situs asam. Jumlah situs asam memberikan informasi tentang banyaknya situs asam yang terkandung pada katalis, yang pada umumnya berbanding lurus dengan situs aktif pada katalis yang menentukan keaktifan suatu katalis.
Penentuan jumlah situs asam dalam katalis dapat dilakukan dengan menggunakan metode gravimetri melalui adsorpsi basa adsorbat dalam fasa gas pada permukaan katalis (ASTM, 2005).
Basa adsorbat yang dapat digunakan untuk menentukan jumlah situs asam katalis
antara lain amoniak atau piridin. Jumlah situs asam menggunakan adsorpsi
amoniak sebagai basa adsorbat merupakan penentuan jumlah situs asam total katalis, dengan asumsi bahwa ukuran molekul amoniak yang kecil sehingga memungkinkan masuk sampai ke dalam pori-pori katalis. Sedangkan penentuan jumlah situs asam menggunakan piridin sebagai basa adsorbat merupakan penentuan jumlah situs asam yang terdapat pada permukaan katalis, dengan asumsi bahwa ukuran molekul piridin yang relatif besar sehingga hanya dapat teradsorpsi pada permukaan katalis (Rodiansono dkk., 2007).
Penetuan jenis situs asam pada katalis dapat ditentukan menggunakan spektroskopi infra merah (FTIR) dari katalis yang telah mengadsorpsi basa adsorbat (Seddigi, 2003). Spektroskopi inframerah adalah metode analisis yang yang didasarkan pada absorpsi radiasi inframerah oleh sampel yang akan menghasilkan perubahan keadaan vibrasi dan rotasi sampel. Frekuensi yang diabsorpsi tergantung pada frekuensi vibrasi dari molekul (karakteristik).
Intensitas absorpsi bergantung pada seberapa efektif energi foton inframerah dipindahkan ke molekul, yang dipengaruhi oleh perubahan momen dipol yang terjadi akibat vibrasi molekul (Åmand and Tullin, 1999)
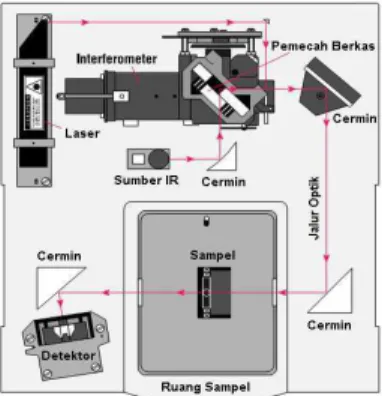
Instumen FTIR menggunakan sistem yang disebut dengan interferometer untuk
mengumpulkan spektrum. Interferometer terdiri atas sumber radiasi, pemisah
berkas, dua buah cermin, laser dan detektor. Skema lengkap dari instrumentasi
FTIR ditunjukan pada Gambar 10.
Gambar 10. Skema instrumentasi FTIR.
Berdasarkan Gambar 10 cara kerja dari instrumentasi FTIR adalah sebagai berikut. Energi inframerah diemisikan dari sumber bergerak melalui celah sempit untuk mengontrol jumlah energi yang akan diberikan ke sampel. Di sisi lain, berkas laser memasuki interferometer dan kemudian terjadi “pengkodean spektra”
menghasilkan sinyal interferogram yang kemudian keluar dari interferogram.
Berkas laser kemudian memasuki ruang sampel, berkas akan diteruskan atau dipantulkan oleh permukaan sampel tergantung dari energinya, yang mana merupakan karakteristik dari sampel. Berkas akhirnya sampai ke detektor (Bradley, 2008).
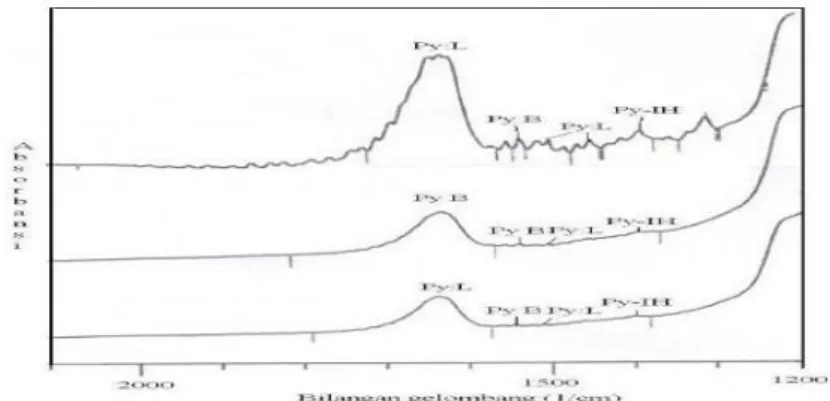
Dari spektra yang dihasilkan dari FTIR, jenis situs asam (Brønsted-Lowry atau Lewis) yang terdapat pada katalis dapat diketahui melalui puncak-puncak serapan yang dihasilkan dari interaksi basa adsorbat dengan situs-situs asam tersebut. Pada penggunaan piridin sebagai basa adsorbat, situs asam Brønsted-Lowry akan ditandai dengan puncak serapan pada bilangan-bilangan gelombang 1485 – 1500,
~1620, dan ~1640 cm
-1. Sedangkan untuk situs asam Lewis ditandai dengan
puncak-puncak serapan pada bilangan-bilangan gelombang 1447 – 1460, 1488 –
1503, ~1580, dan 1600 – 1633 cm
-1(Tanabe, 1981).
Gambar 11 berikut adalah contoh spektra FTIR dalam analisis penentuan jenis situs asam dalam katalis.
Gambar 11. Contoh spektra FTIR dalam penentuan jenis situs asam (Rodiansono dkk., 2007)
3. Analisis Morfologi Permukaan Katalis
Interaksi antara gas dengan permukaan material dan reaksi-reaksi pada permukaan material memiliki peran yang sangat penting dalam bidang katalisis. Siklus awal katalisis diawali dengan adsorpsi molekul reaktan pada permukaan katalis. Oleh karena itu kita perlu untuk mempelajari morfologi permukaan dari katalis (Chorkendorff dan Niemantsverdriet, 2003). Untuk mempelajari morfologi permukaan katalis cara yang paling umum digunakan adalah instrumentasi Scanning Electron Microscopy (SEM) (Ertl et al., 2000).
SEM merupakan metode untuk menggambarkan permukaan suatu bahan dengan
resolusi yang tinggi. Resolusi yang tinggi pada SEM dihasilkan dari penggunaan
elektron dalam menggambarkan permukaan bahan. Resolusi yang dihasilkan juga
jauh lebih tinggi dibandingkan dengan mikroskop cahaya (0,1 – 0,2 nm untuk
SEM dan 200 nm untuk mikroskop cahaya) (Hanke, 2001).
SEM memiliki beberapa peralatan utama meliputi :
1. Pistol elektron, berupa filamen yang terbuat dari unsur yang mudah melepas elektron misalnya tungsten.
2. Lensa untuk elektron, berupa lensa magnetik karena elektron yang bermuatan negatif dapat dibelokan oleh medan magnet.
3. Sistem vakum, karena elektron sangat kecil dan ringan maka jika ada molekul udara yang lain elektron yang berjalan menuju sasaran akan terpencar oleh tumbukan sebelum mengenai sasaran.
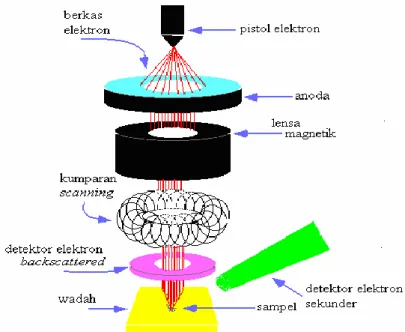
Skema kerja dari SEM ditunjukan dalam Gambar 12 berikut.
Gambar 12. Skema kerja dari SEM
Dalam Gambar 12, sebuah pistol elektron memproduksi berkas elektron dan
dipercepat di anoda. Lensa magnetik kemudian memfokuskan elektron menuju
sampel. Berkas elektron yang terfokus memindai (scan) keseluruhan sampel
dengan diarahkan oleh kumparan pemindai. Ketika elektron mengenai sampel,
maka sampel akan mengeluarkan elektron baru yang akan diterima oleh detektor (Hanke, 2001).
Gambar yang dihasilkan SEM, dibentuk dari elektron sekunder yang dipantulkan sampel pada peristiwa penembakan berkas elektron dari alat. Permukaan yang lebih tinggi akan memberikan warna yang lebih cerah daripada permukaan yang lebih rendah, ini diakibatkan oleh lebih banyaknya elektron sekunder yang dibebaskan menuju detektor (Ertl et al., 2000). Contoh mikrograf SEM untuk Fe
2O
3ditunjukan dalam Gambar 13.
Gambar 13. Mikrograf SEM dari Fe
2O
3(Dar et al., 2005)
Dari Gambar 13 di atas, beberapa informasi yang bisa didapatkan dari SEM
adalah perkiraan ukuran serta distribusi partikel, dan bentuk keseragaman
morfologi sampel.
4.Penentuan Ukuran Partikel Katalis
Analisis ukuran partikel katalis dilakukan menggunakan instrumentasi Particle Size Analyzer (PSA). PSA merupakan salah satu metode karakterisasi yang tidak hanya dapat digunakan untuk mengetahui ukuran partikel dari suatu material, namun juga dapat menginformasikan besaran distribusi ukuran partikel tersebut.
Sehingga dapat diasumsikan bahwa hasil pengukuran tersebut merupakan gambaran keseluruhan dari kondisi sampel. Hal ini lah yang menjadi kelebihan PSA dari instrumentasi lain yang pada umumnya menggunakan metode
mikroskopi dan holografi dalam penentuan ukuran partikel, seperti pada SEM dan TEM. Alat ini mampu mengukur ukuran partikel dan molekul dalam rentang 0,15 nm sampai 10 µm.
Prinsip kerja PSA pada dasarnya menggunakan metode Dinamyc Light Scattering (DLS). Suatu material yang akan dianalisis (sampel) dimasukkan kedalam
suspensi yang telah diinduksi oleh penambahan molekul pelarut. Hal ini
menyebabkan partikel dari material akan bergerak bebas secara acak bersamaan dengan molekul pelarut mengikuti aturan gerak Brown. Molekul pelarut bergerak karena adanya energi termal. Saat partikel terus bergerak dan kemudian
ditembakan cahaya, kecepatan gerak partikel akan berfluktuasi akibat adanya
intensitas cahaya yang dihamburkan oleh partikel tersebut, kecepatan gerak ini
bergantung pada besarnya ukuran partikel. Pengukuran dilakukan dengan prinsip
bahwa partikel-partikel yang lebih kecil akan bergerak lebih cepat daripada
partikel-partikel yang lebih besar (Skoog et al., 1996).
PSA terbagi dalam dua metode, terdiri atas : spesimen.
a. Metode kering (Dry Dispersion Unit)
Metode ini memanfaatkan aliran udara sebagai media pelarut partikel yang akan dianalisis. Metode ini lebih baik digunakan pada material yang berukuran besar atau kasar, karena hubungan yang terjadi antar partikel cukup lemah dan kecil memungkinkan partikel saling beraglomerasi.
b. Metode basah (Wet Dispersion Unit)
Metode ini memanfaatkan media cair untuk mendispersi partikel yang akan dianalisis. Pada umumnya metode ini lebih baik digunakan pada material yang berukuran nano dan submicron, karena akan besar kemungkinan untuk partikel saling beraglomerasi.