III
BAHAN DAN METODE PENELITIAN
3.1 Bahan Penelitian 3.1.1 Objek Penelitian
Objek dari penelitian ini adalah semen yang berasal dari kambing Peranakan Etawah (PE) yang berumur 3 tahun. Kambing Peranakan Etawah (PE) tersebut dikandangkan secara individu di Kandang Kambing Perah Fakultas Peternakan Universitas Padjadjaran Desa Ciparanje, Kecamatan Jatinangor, Kabupaten Sumedang yang setiap harinya diberi makan berupa rumput, konsentrat dan leguminosa. Semen diambil pada hari Senin dan Rabu pukul 09.00 WIB.
3.1.2 Bahan dan Peralatan Penelitian
Beberapa bahan dan peralatan penelitian yang diurutkan sesuai proses penelitian berlangsung.
a. Penampungan Semen
Bahan dan peralatan yang digunakan pada proses penampungan semen adalah vagina buatan atau artificial vagina, vaselin, air hangat, tabung penampungan semen, pompa udara, dan kertas tabel.
b. Evaluasi Semen Segar
Bahan dan peralatan yang digunakan pada proses evalusi semen segar adalah semen segar kambing Peranakan Etawah (PE), NaCl fisiologis, pewarna eosin, tabung penampungan semen, pH indikator, object glass, cover glass, batang pengaduk, pipet haemocytometer, kamar Neubaeur, mikroskop, pembakar busen, korek api, counter, dan tisu.
c. Separasi dan Pencucian Spermatozoa
Bahan dan peralatan yang digunakan pada proses separasi dan pencucian spermatozoa adalah semen kambing Peranakan Etawah yang sudah dievaluasi, Bovine Serum Albumin (BSA) merek Sigma, Brackett-Oliphant (BO), water bath, aquabidetilata, tabung reaksi, tabung sentrifugasi, alat sentrifugasi, rak tabung, mikro pipet, kertas tabel, dan tisu.
d. Pengenceran Semen
Bahan dan peralatan yang digunakan pada proses pengenceran semen adalah semen segar kambing Peranakan Etawah (PE) hasil sexing, tris kuning telur, Penicillin, Streptomycin, gliserol, aquabidetilata, tabung reaksi, rak tabung, mikro pipet, kertas tabel, dan tisu.
e. Pengemasan Semen Cair
Bahan dan peralatan yang digunakan pada proses pengemasan semen cair adalah semen kambing Peranakan Etawah (PE) hasil sexing, mini straw volume 0,25 ml, dan alat pengemasan semen.
f. Pembekuan Semen
Bahan dan peralatan yang digunakan pada proses pembekuan semen adalah mini straw volume 0,25 ml yang berisi semen cair kambing Peranakan Etawah (PE) hasil sexing, N
2cair, styrofoam, rak besi, penjepit besi, container, canister, goblet, dan thermometer.
g. Thawing Straw
Bahan dan perlatan yang digunakan pada saat proses thawing straw adalah mini straw volume 0,25 ml yang berisi semen beku kambing Peranakan Etawah (PE) hasil sexing, bejana berisi air hangat bersuhu 38˚C, gunting, dan tisu.
h. Pengamatan Kualitas Semen Post Thawing
• Motilitas Spermatozoa Post Thawing
Pengamatan ini membutuhkan beberapa bahan dan peralatan antara lain semen kambing Peranakan Etawah (PE) hasil sexing post thawing, object glass, cover glass, pipet haemocytometer, kamar Neubaeur, mikroskop, counter dan tisu.
• Keutuhan Membran Plasma Spermatozoa Post Thawing
Pengamatan ini membutuhkan beberapa bahan dan peralatan antara lain semen kambing Peranakan Etawah (PE) hasil sexing post thawing, larutan Hypoosmotic Swelling Test (HOST Test) yaitu fruktosa, natrium sitrat, dan aquabidestila, object glass, cover glass, mikroskop, counter dan tisu.
• Abnormalitas Spermatozoa Post Thawing
Pengamatan ini membutuhkan beberapa bahan dan peralatan antara lain semen kambing Peranakan Etawah (PE) hasil sexing post thawing, pembakar busen, pewarna eosin, aquabidestila, object glass, cover glass, mikroskop, counter dan tisu.
3.2 Metode Penelitian 3.2.1 Prosedur Penelitian
Berikut adalah prosedur yang akan dilakukan dalam penelitian ini, a. Pembuatan Media Brackett-Oliphant (BO)
Pembuatan Media Brackett-Oliphant (BO) berguna untuk media separasi spermatozoa dan diracik sehari sebelum pelaksanaan separasi spermatozoa karena larutan ini harus digunakan dalam keadaan segar. Media Brackett-Oliphant (BO) ini digunakan dengan melarutkan dua larutan, yaitu larutan stok A dan stok B.
Larutan stok A terdiri dari NaCl 0,1 M, KCl, NaH
2PO
4.H
2O, CaCl
2.2H
2O, dan MgCl
2.6H
2O yang dilarutkan di dalam aquabidestilata dan stok B yang terdiri dari NaHCO
3juga dilarutkan di dalam aquabidestilata.
Volume Brackett-Oliphant yang digunakan untuk separasi dalam satu kali
ulangan adalah 100 ml, yang terdiri dari 76 ml stok A dan 24 ml stok B. Volume
Brackett-Oliphant yang digunakan untuk mengencerkan semen tergantung pada
volume semen, motilitas, konsentrasi, volume yang diinginkan dan konsentrasi spermatozoa yang diinginkan.
b. Penampungan Semen
Penampungan semen dilakukan di Kandang Kambing Perah Fakultas Peternakan Universitas Padjadjaran selama dua kali dalam seminggu pada hari Senin dan Rabu pukul 09.00 WIB. Semen yang akan ditampung berasal dari satu ekor kambing jantan Peranakan Etawah (PE). Sebelum proses penampungan semen dilakukan, persiapkan satu set vagina buatan atau artificial vagina. Satu set vagina buatan atau artificial vagina ini sebelumnya harus dicuci menggunakan air panas agar steril. Setelah itu satu set vagina buatan siap digunakan masukan air panas dengan suhu 38-40˚ ke dalam AV, kemudian dikocok lalu tiup lubang vagina buatan untuk menyesuaikan dengan penis kambing jantan Peranakan Etawah (PE), dan lalu mengoleskan vaselin ke area ujung depan selongsong karet.
Pemancing atau teaser yang digunakan adalah seekor kambing betina Peranakan Etawah (PE) yang diikat di kandang jepit. Penampungan dilakukan dengan melihat seekor jantan yang sudah melakukan false mount selama 2-3 kali.
Tangan kanan memegang vagina buatan sedangkan tangan kiri memegang pangkal penis untuk diarahkan ke vagina buatan. Semen diejakulasikan ke dalam vagina buatan dan biarkan kambing jantan memberikan dorongan ke vagina buatan agar semen yang keluar lebih banyak. Setelah semen tertampung, lepaskan tabung penambung semen dari set vagina buatan dan semen siap dibawa ke laboratorium untuk dilakukan evaluasi.
c. Evaluasi Semen Segar
Evaluasi semen segar dibagi menjadi dua bagian yaitu evaluasi makroskopis dan mikroskopis.
• Evaluasi Makroskopis
o Volume
Volume semen kambing yang diperoleh dari proses penampungan dapat diketahui dengan cara membaca skala yang terdapat pada tabung penampungan.
Volume semen kambing bervariasi yaitu 0,5-1,5 ml.
o Warna
Warna semen dapat diketahui langsung dengan cara melihat semen yang terdapat pada tabung penampungan. Warna putih krem adalah warna normal semen kambing. Jika warna selain warna putih krem seperti merah atau hijau kekuning- kuningan, kemungkinan semen mengandung bakteri ataupun darah dan semen akan diafkir.
o Bau
Bau semen dapat diketahui langsung dengan cara mencium bau semen yang terdapat di tabung penampungan. Bau semen kambing normal memiliki bau khas semen. Jika tercium bau tidak wajar atau busuk kemungkinan banyak spermatozoa yang telah mati dan semen akan diafkir.
o Konsistensi
Konsistensi atau kekentalan atau viskositas semen akan berkaitan dengan kepadaran atau konsentrasi spermatozoa. Konsistensi dapat dilihat dengan cara menggoyangkan tabung penampung berisi semen secara perlahan. Semen dengan konsistensi kental akan terlihat pada proses kembalinya larutan semen ke posisi tegak akan lebih lama dibandungkan dengan semen yang konsistensinya encer.
Konsistensi semen kambing yang baik adalah konsistensi yang kental.
o pH
Pemerikasaan derajat keasaman atau pH dilakukan dengan cara
menempelkan pH indikator ke semen. pH semen kambing yang normal berkisar antara 6,8-7,0.
• Evaluasi Mikroskopis
o Gerakan Massa
Gerakan masa diamati dengan cara meletakkan satu tetes semen ke object glass tanpa menggunakan cover glass kemudian diamati dibawah mikroskop dengan perbesaran 10x10. Gerakan massa spermatozoa digolongkan sebagai berikut:
• Sangat baik (+++ atau 3+), jika gerakan bergelombang cepat dan padat, membentuk pusaran-pusaran gelombang.
• Baik (++ atau 2+), jika gerakan aktif kedepan.
• Lumayan atau sedang (+ atau 1+), jika gerakan sangat lemah atau gerakan berayun.
• Buruk (nekrospemia atau nilai 0), jika sperma tidak bergerak.
Standar gerakan massa untuk dapat diproses lebih lanjut adalah (++ atau 2+ dan +++ atau 3+).
o Konsentrasi Spermatozoa Total
Metode ini dilakukan dengan menggunakan pipet haemocytometer dan kamar hitung neubauer. Cara perhitungannya adalah sebagai berikut:
• Semen dihisap dengan pipet hemocytometer sampai tanda 0,5.
• Hisap larutan NaCl 3% 0,1 M sampai tanda 101.
• Kocok larutan dengan gerakan membentuk angka 8 selama 2–3 menit.
• Beberapa tetesan pertama dibuang dan dikocok lagi.
• Kamar hitung neubauer ditutup dengan cover glass.
• Satu tetes semen diteteskan pada sisi cover glass.
• Jumlah sel spermatozoa dihitung dalam 5 kamar menurut arah diagonal.
Setiap kamar mempunyai 16 ruangan kecil, maka di dalam 5 kamar terdapat 80 ruangan kecil. Seluruh gelas hemocytometer memiliki 400 ruangan kecil.
Dengan volume setiap ruangan kecil adalah 0,1 mm
3dan pengenceran 200
kali, maka dapat dihitung konsentrasi sperma dengan perhitungan sebagai
berikut:
Konsentrasi Total = Jumlah spermatozoa × 10
7sperma per ml o Motilitas Spermatozoa
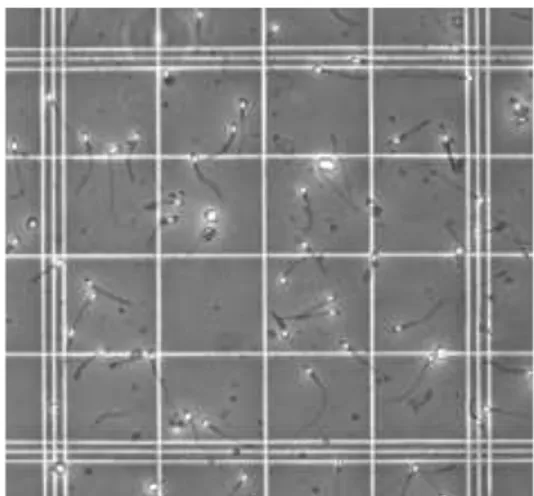
Motilitas spermatozoa adalah kemampuan spermatozoa untuk melakukan gerak maju atau progresif. Motilitas spermatozoa dapat dihitung dengan menggunakan pipet haemocytometer dan kamar hitung neubauer. Semen diambil dengan menggunakan haemocytometer samapai pada angka 0,5 kemudian diencerkan dengan NaCl fisiologis. Setelah itu dari haemocytometer tersebut dikeluarkan sebanyak 1 tetes. Sehingga pengenceran yang dilakukan pada semen adalah 200 kali. Kemudian teteskan semen pada kamar hitung neubauer dan diamati jumlah sperma motil sebanyak 5 lapang pandang. Persentase motilitas spermatozoa yaitu:
%M = KT − KM
KT × 100%
Keterangan:
M : Motilitas
KT : Konsentrasi Total
KM : Konsentrasi Sperma Mati/ Non Motil
Ilustrasi 1. Pengamatan Motilitas Spermatozoa di Kamar Neubauer Sumber: Rizal, dkk (2006)
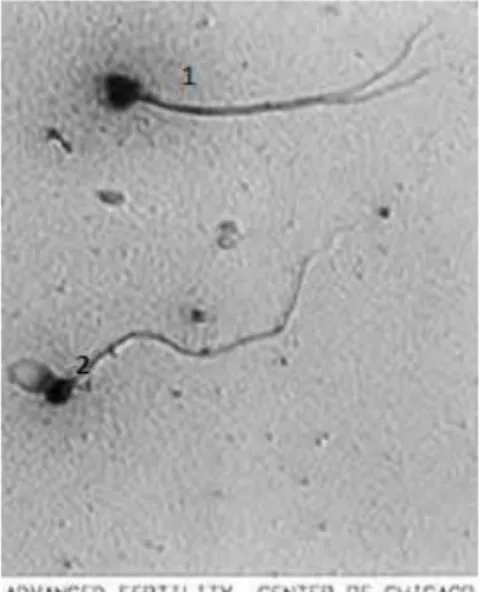
o Abnormalitas Spermatozoa
Abnormalitas spermatozoa adalah keadaan dimana spermatozoa tidak
dalam bentuk yang normal. Abnormalitas meliputi abnormalitas primer dan
sekunder. Abnormalitas primer terjadi bukan karena kecelakaan proses produksi tetapi bersifat genetik yaitu kepala kembar, kepala pipih, kepala besar atau kecil, ekor dua, ekor kecil atau besar dan lain-lain sedangkan abnormalitas sekunder terjadi karena kecelakaan proses produksi antara lain badan atau leher patah, ekor melingkar atau keriting, kepala terpisah dari ekor dan lain-lain. Abnormalitas spermatozoa dihitung dengan membuat preparat ulas eosin. Jumlah spermatozoa yang abnormal dihitung bersama dengan spermatozoa yang normal kurang lebih sebanyak 200 sel spermatozoa. Persentase sel spermatozoa yang abnormal adalah:
Ab = A
A + B × 100%
Keterangan:
Ab : Persentase Spermatozoa Abnormal A : Jumlah spermatozoa yang Abormal B : Jumlah Spermatozoa yang Normal
Ilustrasi 2. Pengamatan Abnormalitas Spermatozoa Sumber: Lodhi, dkk, 2008
Keterangan:
1 = spermatozoa double-tail 2 = spermatozoa twin-head
d. Separasi dan Pencucian Spermatozoa
Separasi dilakukan dengan cara memasukan larutan BSA 10% dan 5%
masing-masing 2 ml kedalam tabung, kemudian masukan 1 ml semen yang telah diencerkan dengan BO dengan perbandingan semen dan BO yaitu 1:7 pada tabung yang sama. Inkubasi tabung yang telah berisi larutan BSA dan semen dalam water bath pada suhu 35
oC selama 45, 60 dan 75 menit, setelah diinkubasi 1 ml larutan bagian atas dibuang karena dianggap sebagai spermatozoa mati dan 4 ml larutan berikutnya dipisahkan berdasarkan batas antara konsentrasi larutan 5% dan 10%, lapisan bagian atas diberi label X dan lapisan bawah diberi label Y. Tambahkan larutan BO sebanyak 5 ml pada masing-masing tabung dan sentrifugasi dengan kecepatan 1800 rpm selama 10 menit, setelah disentrifugasi cairan supernatan dibuang sedangkan bagian bawah yang berbentuk pellet merupakan spermatozoa hasil separasi.
e. Pengenceran Semen
Tabung reaksi yang berisi semen hasil sexing atau pellet ditambahkan dengan larutan pengencer BO dengan cara menuangkankan larutan BO melalui dinding tabung reaksi secara perlahan. Pellet tersebut kemudian diencerkan dengan tris kuning telur yang telah mengandung antibiotik penicillin dengan dosis 1000 IU/ml pengencer dan streptomycin sebanyak 1 mg/ml pengencer. Proses selanjutnya adalah menambahkan gliserol sebanyak 6% dari total pengencer pada tabung koleksi yang berisi campuran semen dan pengencer. Kocok secara perlahan agar tidak terjadi gelembung menggunakan mikropipet.
f. Pengemasan Semen Cair
Semen cair hasil sexing kemudian akan dikemas ke mini straw bervolume
0,25 ml. Pemasukan semen cair ke dalam mini straw menggunakan alat
pengemasan berupa pompa penghisap dan selang plastik penghisap. Bagian mini
straw yang memiliki sumbat disambungkan dengan selang plastik penghisap
sedangkan ujung selang plastic lainnya disambungkan ke pompa penghisap.
Tuangkan semen cair hasil sexing ke dalam cawan untuk pengisian mini straw, kemudian hidupkan pompa penghisap agar semen masuk ke dalam mini straw.
Selanjutnya ujung mini straw ditutup dengan tepung polyvinyl alcohol.
g. Equilibrasi
Straw yang telah berisi semen cair kemudian disimpan ke dalam lemari es dengan temperatur 5°C selama 2-4 jam, proses ini dinamakan proses equilibrasi.
Proses ini bertujuan agar spermatozoa menyesuaikan diri dengan pengencer dan persiapan sebelum proses pembekuan.
h. Pembekuan Semen
Beberapa tahapan proses pembekuan dimulai dari proses pre-freezing yaitu dengan cara menguapi mini straw yang telah berisi semen cair hasil sexing dengan uap N
2cair di dalam styrofoam berusuhu -80˚ sampai dengan -100˚C selama 7-8 menit dengan jarak mini straw dengan permukaan cairan sekitar 3-5 cm. Tahapan berikutnya adalah proses freezing dengan cara memindahkan mini straw ke dalam container yang berisi N
2cair hingga suhu -196˚C. Pengangkatan mini straw menggunakan pinset, kemudian dimasukan ke goblet yang nantinya ditempatkan ke dalam canister yang akan dimasukan ke dalam container.
i. Thawing Semen
Thawing semen dilakukan untuk mencairkan kembali semen beku dilakukan dengan cara memasukan mini staw yang membeku tadi ke dalam bejana berisi air dengan suhu 38˚C selama 30 detik.
j. Pengamatan Kualitas Semen Post Thawing
Kualitas semen yang diamati saat post thawing adalah membran plasma utuh, motilitas dan abnormalitas.
• Motilitas Spermatozoa
Prosedur yang digunakan untuk mengamati motilitas sperma hampir sama
dengan yang digunakan saat evaluasi mikroskopis semen segar hanya berbeda pada
sampel. Sampel yang diamati adalah semen diambil dari mini straw setelah dilakukannya proses post thawing. Pengambilan semen ini dilakukan dengan cara memotong mini straw di bagian tengah.
• Keutuhan Membran Plasma
Prosedur yang digunakan untuk mengamati keutuhan membran plasma adalah sebagai berikut.
1. Membuat larutan hypoosmotik swelling test (HOST-Test) yaitu larutan 0,179 gr NaCl 0,1 M dalam 100 ml aquabidestilata.
2. Menggunting bagian tengah mini straw untuk mengambil sampel semen, lalu masukan ke larutan hypoosmotik swelling test (HOST-Test). Inkubasi selama 1 jam.
3. Membuat preparat ulas dari larutan tersebut.
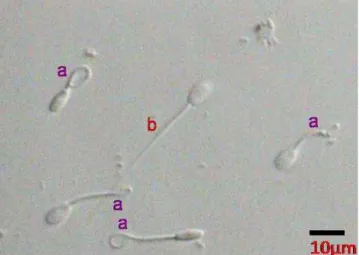
4. Mengamati preparat ulas dengan pembesaran 40 kali, dengan menghitung 200 sel spermatozoa. Spermatozoa yang membran plasmanya masih utuh ditandai dengan ekor yang membengkak, melingkar, dan menggembung akibat terpapar larutan hypoosmotik swelling test (HOST-Test) sedangkan yang rusak, ekornya lurus (Saili, 1999).
Ilustrasi 3. Pengamatan Keutuhan Membran Plasma Spermatozoa Sumber: Ariswan, 2014
Keterangan:
a = spermatozoa bermembran plasma utuh (swelling)
b = spermatozoa bermembran plasma tidak utuh (non-swelling)
• Abnormalitas Spermatozoa
Prosedur yang digunakan untuk mengamati abnormalitas sperma hampir sama dengan yang digunakan saat evaluasi mikroskopis semen segar hanya berbeda pada sampel. Sampel yang diamati adalah semen diambil dari mini straw setelah dilakukannya proses post thawing. Pengambilan semen ini dilakukan dengan cara memotong mini straw di bagian tengah.
3.2.2 Perlakuan Percobaan
Perlakuan yang dicobakan adalah sebagai berikut:
P1 = 45 menit waktu inkubasi P2 = 60 menit waktu inkubasi P3 = 75 menit waktu inkubasi
Setiap perlakuan diulang sebanyak 6 kali.
3.2.3 Peubah yang Diamati
• Motilitas Spermatozoa (%)
Pengamatan motilitas dilakukan setelah proses post thawing, persentase motilitas spermatozoa dihitung dengan rumus sebagai berikut:
% Motilitas spermatozoa = konsentrasi total – sperma yang mati
konsentrasi total sperma ×100%
• Keutuhan Membran Plasma (%)
Evaluasi untuk melihat keutuhan membran plasma dilakukan dengan
menggunakan mikroskop dengan pembesaran 40 kali, dengan menghitung 200 sel
spermatozoa. Keutuhan membran plasma diamati dengan cara memasukan sampel
semen kedalam larutan hypoosmotik swelling test (HOST-Test) yaitu larutan 0,179
gr NaCl dalam 100 ml aquabidestilata. Presentase keutuhan membran plasma dihitung menggunakan rumus:
MPU = P
P + Q × 100%
Keterangan:
MPU : Membran Plasma Utuh
P : Jumlah spermatozoa ekor melingkar Q : Jumlah spermatozoa ekor lurus
• Abnormalitas Spermatozoa (%)
Pengamatan abnormalitas dilakukan setelah proses post thawing, presentasi abnormalitas spermatozoa dihitung dengan rumus sebagai berikut:
Ab = A
A + B × 100%
Keterangan:
Ab : Persentase Spermatozoa Abnormal A : Jumlah spermatozoa yang Abormal B : Jumlah Spermatozoa yang Normal
2.2.4 Rancangan Percobaan dan Analisis Data
Metode yang digunakan adalah metode eksperimental. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan tiga perlakuan dan enam kali ulangan. Model matematika Rancangan Acak Lengkap (RAL) yang digunakan adalah:
Y
ij= µ + α
i+ ε
ijKeterangan:
Y
ij= respon hasil pengamatan pada perlakuan ke-i dan ulangan ke-j µ = rata-rata perlakuan
α
i= pengaruh perlakuan ke-i
ε
ij= pengaruh galat yang timbul dari perlakuan ke-i pada ulangan ke-j
Selanjutnya untuk mengetahui pengaruh perlakuan dilakukan analisis sidik
ragam dapat dilihat pada Tabel 2.
Tabel 2. Sidik Ragam
Sumber keragaman db JK KT F
hitungF
tabelPerlakuan t-1 = 2 JKP KTP KTP KTG Galat t(r-1) = 15 JKG KTG
Total tr – 1 = 17 JKT Keterangan:
db = Derajat Bebas JK = Jumlah Kuadrat KT = Kuadrat Tengah t = Total Perlakuan r = Banyaknya Ulangan Hipotesis:
H
0: P
1= P
2= P
3H
1: P
1≠ P
2≠ P
3atau minimal ada sepasang perlakuan yang tidak sama.
Kaidah keputusan:
1. Bila Fhitung < Ftabel, maka terima H
0artinya tidak ada perbedaan yang nyata (non significant).
2. Bila Fhitung ≥ Ftabel, maka tolak H
0dan terima H
1artinya ada perbedaan yang nyata (significant).
Jika didapatkan kesimpulan dari analisis ragam yaitu menolak H
0atau terdapat perbedaan pengaruh perlakuan yang nyata terhadap hasil pengamatan yang dilakukan maka perlu dilakukan uji lanjutan menggunakan metode Ortogonal Polinomial. Menurut Hanifiah (1991), metode ini digunakan untuk menguji kecenderungan hubungan fungsional antara perlakuan – perlakuan dan pengaruhnya terhadap objek penelitian pada percobaan – percobaan faktor tunggal (disebut juga trend comparison). Hubungan fungsional antara variabel bebas y dan peragam tak bebas x secara polinomial dinyatakan sebagai berikut:
Ƴ = ∝+ 𝛽1𝑥+ 𝛽2𝑥
2+ ... + 𝛽𝑛𝑥
nKeterangan:
α = Intersepsi
β
i= (i =1 ,2,…, n) = koefisien regresi parsial yang berasosiasi dengan derajat
polynomial ke- i
Y = Respon X = Perlakuan
Gomez dan Gomez (1995) telah menguraikan perhitungan untuk mendapatkan koefisien ortogonal polinomial untuk derajat polinomial pertama (linier), derajat polinomial kedua (kuadratik), dan derajat polinomial ketiga (kubik), sebagai berikut:
L = a+ Xi
Qi b cXi + Xi
2Ci = d+ eXi + fXi
2+ Xi
3Tabel 3. Analisis Ragam Sesuai Dengan Pembandingan Ortoghonal Polynomial Sumber
Keragaman
Derajat Bebas (db)
Jumlah Kuadrat (JK)
Kuadrat Tengah (KT)
Statistik Uji F
Perlakuan Linier Kuadratik Kubik Kuartik
t – 1 1 1 1 1
JKP JKP
1JKP
2JKP
3JKP
4KTP KTP
1KTP
2KTP
3KTP
4F F
1F
2F
3F
4Galat Percobaan
Sisa JKG KTG
Total n-1 JKT
Pengambilan keputusan dapat dilihat dari hasil pembandingan nilai statistik
uji F yang telah dihitung dengan nilai kritis. Penentuan derajat polinomial
didasarkan pada kontras-kontras ortogonal yang nyata, sehingga akan didapatkan
hubungan fungsi respon antar perlakuan sesuai dengan derajat polinomial yang
signifikan (Widhiarih, 2001).
3.2.5 Tataletak Percobaan
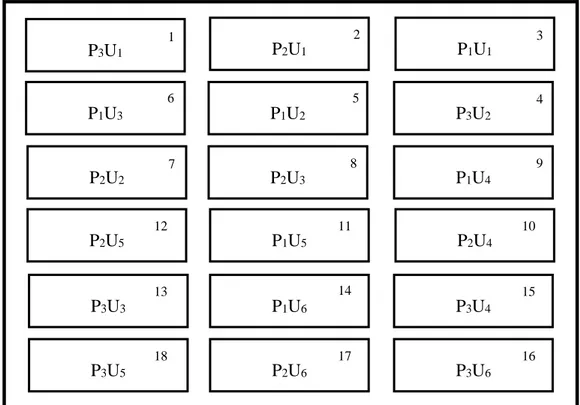
Ilustrasi 4. Pengacakan Perlakuan
Tabel 4. Data Pengamatan
Penampungan
Perlakuan
P
1P
2P
31 P
1U
1P
2U
1P
3U
12 P
1U
2P
2U
2P
3U
23 P
1U
3P
2U
3P
3U
34 P
1U
4P
2U
4P
3U
45 P
1U
5P
2U
5P
3U
56 P
1U
6P
2U
6P
3U
6Keterangan:
P : Perlakuan ke (1,2,3) U : Ulangan ke (1,2,...,6)
P
3U
1P
2U
1P
1U
1P
1U
3P
1U
2P
3U
2P
2U
2P
2U
3P
1U
4P
2U
5P
1U
5P
2U
4P
3U
3P
1U
6P
3U
4P
3U
5P
2U
6P
3U
61 2 3
5 4 6
7 8 9
10 11
12
13 14 15
16 17
18