POTENSI BAKTERI PELARUT FOSFAT, PENGIKAT NITROGEN DAN PENGHASIL HORMON IAA DARI RHIZOSFER TUMBUHAN POACEAE PANTAI DALAM MENINGKATKAN PERTUMBUHAN PADI (Oryza sativaL.)
SKRIPSI
ARTHA JOSEVA HUTAPEA 130805066
PROGRAM STUDI BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
POTENSI BAKTERI PELARUT FOSFAT, PENGIKAT NITROGEN DAN PENGHASIL HORMON IAA DARI RHIZOSFER TUMBUHAN POACEAE PANTAI DALAM MENINGKATKAN PERTUMBUHAN PADI (Oryza sativaL.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ARTHA JOSEVA HUTAPEA 130805066
PROGRAM STUDI BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
PERNYATAAN ORISINALITAS
POTENSI BAKTERI PELARUT FOSFAT, PENGIKAT NITROGEN DAN PENGHASIL HORMON IAA DARI RHIZOSFER TUMBUHAN POACEAE PANTAI DALAM MENINGKATKAN PERTUMBUHAN PADI (Oryza sativaL.)
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2018
Artha Joseva Hutapea 130805066
PENGESAHAN SKRIPSI
Judul : Potensi Bakteri Pelarut Fosfat, Pengikat Nitrogen dan Penghasil Hormon IAA Dari Rhizosfer Tumbuhan Poaceae Pantai Dalam Meningkatkan Pertumbuhan Padi (Oryza sativa L.)
Kategori : Skripsi
Nama : Artha Joseva Hutapea
Nomor Induk Mahasiswa : 130805066 Program Studi : Sarjana Biologi
Fakultas : MIPA – Universitas Sumatera Utara
Disetujui di Medan, Juni 2018
Ketua Program Studi Pembimbing,
Dr. Saleha Hannum, M.Si Dr. Yurnaliza, M.Si
NIP. 197108312000122001 NIP.197107181999032001
PENGESAHAN SKRIPSI
Judul : Potensi Bakteri Pelarut Fosfat, Pengikat Nitrogen dan Penghasil Hormon IAA Dari Rhizosfer Tumbuhan Poaceae Pantai Dalam Meningkatkan Pertumbuhan Padi (Oryza sativa L.)
Kategori : Skripsi
Nama : Artha Joseva Hutapea
Nomor Induk Mahasiswa : 130805066 Program Studi : Sarjana Biologi
Fakultas : MIPA – Universitas Sumatera Utara
Disetujui di Medan, Juni 2018
Komisi Pembimbing
Pembimbing 2 Pembimbing 1
Dra. Nunuk Priyani, M.Sc Dr. Yurnaliza, M.Si
NIP.196404281996032001 NIP.197107181999032001
Ketua Program Studi
Dr. Saleha Hannum, M.Si NIP. 197108312000122001
POTENSI BAKTERI PELARUT FOSFAT, PENGIKAT NITROGEN DAN PENGHASIL HORMON IAA DARI RHIZOSFER TUMBUHAN POACEAE PANTAI DALAM MENINGKATKAN PERTUMBUHAN PADI (Oryza sativa L.)
ABSTRAK
Penelitian ini bertujuan untuk mendapatkanbakteri pelarut fosfat, pengikat nitrogen dan penghasil IAA dari rhizosfer Poacea pantai serta untuk mengetahui pengaruhnya terhadap pertumbuhan tanaman padi (Oryza sativa L.). Bakteri dengan kemampuan melarutkan fosfat, mengikat nitrogen dan menghasilkan IAA diisolasi dari rhizosfer tumbuhan Poaceaepantai menggunakan media selektif. Bakteri yang tumbuh diseleksi kemampuan melarut fosfat, mengikat nitrogen dan menghasilkan IAA. Hasil isolasi bakteri rhizosfer diperoleh sebanyak 6 isolat bakteri pelarut fosfat, 6 isolat bakteri pengikat nitrogen dan 8 isolat bakteri penghasil IAA. Tiga isolat terpilih dari masing-masing kemampuan diuji sinergis sebelum diaplikasikan ke tanaman padi. Potensi tiga isolat bakteri sebagai biakan tunggal dan konsersiumnya diujikan pada tanaman padi untuk mengetahui pengaruhnya dalam meningkatkan tinggi tanaman, panjang akar, berat basah tajuk dan akar dan berat kering tajuk dan akar. Tiga isolat bakteri terpilih dengan kemampuan terbaik dari masing-masing uji yaitu PP03, RG08 dan PI05 bersifat sinergis satu dengan lainnya. Aplikasi ketiga isolat bakteri ini dan kombinasinya ke tanaman padi menunjukkan hasil yang berbeda nyata terhadap kontrol (tanpa bakteri) terutama dalam pengamatan tinggi tanaman dan panjang akar. Perlakuan kombinasi ketiga isolat bakteri menunjukkan hasil terbaik terhadap tinggi tanaman dengan rata-rata 44,84 cm, berat basah tajuk (0,80 g) dan akar (0,47 g), berat kering tajuk (0,13 g) dan akar tanaman padi (0,14 g).
Isolat PP03, RG08 dan PI05 dapat dijadikan sebagai pupuk hayati.
Kata Kunci : Bakteri Pelarut Fosfat, Bakteri Pengikat Nitrogen, Bakteri Penghasil Iaa, Pantai, Padi
POTENTIAL OF PHOSPHATE SOLUBILIZING BACTERIA, NITROGEN FIXING BACTERIA ANDIAA PRODUCING BACTERIAFROM RHIZOSPHERE OF COASTALPOACEAE
PLANT TO INCREASE RICE GROWTH (Oryza sativa L.)
ABSTRACT
The aim of this research was to obtain phosphate solubilizing bacteria, nitrogen fixing bacteria and IAA producing bacteria from rhizosphere of coastal Poaceae and to knowtheir effect on rice plant growth (Oryza sativa L.).Those bacteria were isolated from the rhizosphere of the Poaceae coastal on selective medium. The growing colonies were selected for the ability solubilizingphosphate, fixing nitrogen and producing IAA. The results showed that there were 6 isolates of phosphate solubilizing bacteria, 6 isolates of nitrogen fixing bacteria and 8 isolates of IAA producing bacteria. The three selected isolates of each criteria were tested synergistically before being applied to rice plant seedling. The potential of three isolates as a single culture as well as a mixed culture were tested furtherincreasing the growth of rice plant such as plant height, root lenght, wet weight of plant canopies and roots and dry weight of canopies and roots.Three selected bacterial isolates with the best ability of each test which were PP03, RG08 and PI05 were synergistic each other. The aplication of these three bacterial isolates to rice plants showed significantly promotes the plant growth compare to control (without bacteria), especially in the plant height and root length. The treatment of the combinations of the three bacterial isolates showed the best results in increasing plant height (44,84 cm), wet weight of plant canopies(0,80 g), and roots (0,47 g) and dry weight of canopies (0,13 g) and roots (0,14 g). Isolates PP03, RG08 and PI05can be used as bifertilizer.
Key words: Phosphate Solubilizing Bacteria, Nitrogen Fixing Bacteria, Iaaproducing Bacteria, Beach, Rice Plant
PENGHARGAAN
Segala puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas segala rahmat dan karuniaNya sehingga penulis dapat menyelesaikan hasil penelitian yang berjudul Potensi Bakteri Pelarut Fosfat, Pengikat Nitrogen dan Penghasil Hormon IAA Dari Rhizosfer Tumbuhan Poaceae Pantai Dalam Meningkatkan Pertumbuhan Padi (Oryza sativaL.).
Pada kesempatan ini penulis mengucapkan terimakasih yang sebesar- besarnya kepada orangtua terkasih dan tercinta Ayahanda Edison Hutapea dan Ibunda Intan Situngkir yang selalu memberikan doa, semangat, perhatian, kasih sayang dan pengorbanan yang begitu besar kepada penulis serta kakak Berliana Hutapea, Nurita Hutapea dan adik Asima Hutapea, Victor Hutapea yang selalu memberikan dukungan semangat dan perhatian kepada penulis.
Penulis jugamengucapkan terimakasih yang sebesar-besarnya kepada Ibu Dr.
Yurnaliza,M.Si selaku dosen pembimbing I dan Ibu Dra.NunukPriyani, M.Sc selaku dosen pembimbing II yang telah meluangkan waktunya dalam memberikan bimbingan dan arahan selama penulisan hasil penelitian ini serta Bapak Prof. Dr.
Dwi Suryanto, M.Sc selaku dosen penguji I dan Ibu Dr. Saleha Hannum, M.Si selaku dosen penguji II yang telah memberikan banyak masukan dan arahan dalam penyempurnaan penulisan hasil penelitian ini. Bapak Riyanto Sinaga, M.Si selaku dosen pembimbing akademik yang telah memberikan nasehat dan semangat selama masa perkuliahan serta seluruh pegawai dan staf departemen biologi.
Pada kesempatan ini penulis juga mengucapkan terimakasih kepada sahabat- sahabat (Christin Silaen, Mai Gultom,Laura Barus, Henni Sibarani, Melprina Simangunsong, Nadya Damanik, Deasy Tobing, Agnes Simanjuntak, Anita Sinaga, Erika Tambunan, Ruth Banjarnahor, Reza Siregar, Johannes Tampubolon) yang telah membantu dan memberikan semangat selama penelitian. Terimakasih kepada Tempeh Family (Nadya, Yuli, Yunsu, Aya, Dzulaika, Ira, Vina, Sarah, Johannes, Reza), teman-teman seperjuangan 13iosfer, adek asuh SOY terutama adek asuh kandung Anna Mendrofa, serta rekan-rekan asisten Laboratorium Biologi Molekuler dan Genetika (Kak Wilda, Kak Nolok, Bang Freddy, Nadya, Sahreza, Fattia, Rahmi)
yang telah memberikan semangat dan canda tawa yang menghiasi hari-hari penulis selama penelitian dan penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa masih terdapat banyak kekurangan dalam penyusunan skripsi ini. Kritik dan saran yang membangun sangat diharapkan demi kesempurnaan skripsi ini. Untuk segala partisipasi dan dukungannya penulis mengucapkan banyak terimakasih.
Medan, Juni2018
Artha Joseva Hutapea
DAFTAR ISI
Halaman
PENGESAHAN SKRIPSI i
ABSTRAK iv
ABSTRACT v
PENGHARGAAN vi
DAFTAR ISI viii
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Tujuan Penelitian 3
1.4 Manfaat Penelitian 3
BAB 2 TINJAUAN PUSTAKA
2.1Graminae 4
2.2 Mikroorganisme Rhizosfer 4
2.3Bakteri Pelarut Fosfat 6
2.4 Bakteri Penambat Nitrogen 7
2.5 Bakteri Penghasil IAA 8
BAB 3 METODE PENELITIAN
3.1 Waktu dan Tempat 9
3.2 Metode Penelitian
3.2.1 Bahan Penelitian 9
3.2.2Pengambilan Sampel Rhizosfer Tumbuhan Poaceae 9 3.2.3Isolasi Bakteri Pelarut Fosfat, Pengikat Nitrogen dan
Penghasil Hormon IAA
10 3.2.4Seleksi Bakteri Pelarut Fosfat 10 3.2.5Seleksi Bakteri Pengikat Nitrogen 10
3.2.6Seleksi Bakteri Penghasil IAA 11
3.2.7Uji Sinergis Isolat Bakteri Pelarut Fosfat, Pengikat Nitrogen dan Penghasil IAA
11 3.2.8 Uji Aplikasi Isolat Terpilih Pada Benih Tanaman
Padi
12
BAB 4 HASIL DAN PEMBAHASAN
4.1 Isolat Bakteri Pelarut Fosfat 13
4.2 Isolat Bakteri Pengikat Nitrogen 15
4.3 Isolat Bakteri Penghasil IAA 16
4.4 Kombinasi Kemampuan Bakteri Pelarut Fosfat, Pengikat 18
Nitrogen dan Bakteri Penghasil IAA
4.5 Karakteristik Isolat Bakteri Potensial 20
4.6 Sinergisme Bakteri Terpilih 21
4.7 Parameter Pengamatan Bakteri Terpilih Pada Bibit Padi (Oryza sativa L.)
22
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 25
5.2 Saran 25
DAFTAR PUSTAKA 26
LAMPIRAN
DAFTAR TABEL
Tabel Judul Halaman
3.1 Perlakuan dan kombinasi bakteri yang diaplikasikan 12 4.1 Karakteristik Morfologi Bakteri Pelarut Fosfat dari Rhizosfer
Poaceae Pantai
13 4.2 Indeks Pelarutan Fosfat Bakteri Pelarut Fosfat dari Rhizosfer
Poaceae Pantai
14 4.3 Karakteristik Morfologi Bakteri Pengikat Nitrogen dari
Rhizosfer Poacea Pantai
15 4.4 Pelikel yang Terbentuk oleh Bakteri Pengikat Nitrogen 16 4.5 Karakteristik Morfologi Bakteri Penghasil IAA dari Rhizosfer
Poaceae Pantai
17 4.6 Kombinasi KemampuanBakteri Pelarut Fosfat, Pengikat
Nitrogen dan Penghasil IAA
19 4.7 Morfologi Sel dan Pewarnaan Gram Bakteri Terpilih 20 4.8 Karakteristik Biokimia Isolat Bakteri Terpilih 20 4.9 Rata-rata Pertumbuhan Tanaman Padi Setelah 30 Hari Tanam 23 4.10 Rekapitulasi Perlakuan Isolat Bakteri Terpilih Terhadap
Parameter Pertumbuhan Tanaman Padi
24
DAFTAR GAMBAR
Gambar Judul Halaman
3.1 Tumbuhan Graminae Tebu salah (Phragmites karka)Pantai Sialang Buah, Kabupaten Serdang Bedagai, Sumatera Utara
9 3.2 Metode gores uji senergis antar isolat bakteri pada media
Nutrient Agar
12 4.1 Zona Bening Di Sekitar Koloni Bakteri Pada Media
Pikovskaya Agar
15 4.2 Produksi IAA 8 isolat bakteri berdasarkan waktu inkubasi 2,
4 dan 6 hari
18 4.3 Sinergisme antar isolat PP03 dengan RG08, RG08 dengan
PI05 dan PI05 dengan PP03
22 4.4 Perbedaan bibit padi setelah 30 hari tanam 23
DAFTAR LAMPIRAN
Lampiran Judul Halaman
1 Komposisi Media Selektif dan Reagen Salkowski 29
2 Kurva Standar IAA 31
3 Analisis DMRT Parameter Tanaman 32
4 Dokumentasi Penelitian 36
5 Surat Identifikasi Tumbuhan Graminae 38
BAB 1 PENDAHULUAN
1.1Latar Belakang
Indonesia merupakan salah satu negara yang memiliki jumlah penduduk terbanyak di dunia. Pertambahan jumlah penduduk yang sangat pesat menyebabkan kebutuhan pangan juga meningkat. Berbagai langkah dilakukan masyarakat dan pemerintah untuk menjaga tetap tersedianya pangan dunia. Namun sejauh ini upaya yang telah dilakukan dalam usaha peningkatan produksi pangan masih perlu ditingkatkan. Salah satu upaya dalam peningkatan pangan yang dapat dilakukan yaitu dengan memanfaatkan mikroorganisme rhizosfer untuk pembudidayaan tanaman (Glick, 1995).
Pantai merupakan salah satu lahan marginal yang dapat dimanfaatkan secara optimal antara lain dengan melakukan penanaman dengan tanaman yang adaptif pada lahan pasir. Di lahan pantai dijumpai sejumlah tanaman yang tetap mampu tumbuh dan berkembang. Kemampuan tersebut antara lain diakibatkan karena adanya keikutsertaan mikroorganisme yang berada pada zona perakaran tanaman yang dapat menciptakan kondisi mikro yang dapat diterima dengan baik oleh tanaman. Dengan kenyataan tersebut, maka salah satu cara agar tanaman mampu bertahan dan dapat tumbuh dengan baik pada lahan marginal adalah dengan mengupayakan adanya simbiosis dengan mikroorganisme pada sistem perakaran.
Bakteri pelarut fosfat merupakan bakteri tanah yang bersifat nonpatogenik dan termasuk dalam kategori bakteri pemacu pertumbuhan tanaman. Bakteri tersebut menghasilkan vitamin dan fitohormon yang dapat memperbaiki pertumbuhan akar tanaman dan meningkatkan serapan hara (Glick, 1995). Bakteri pelarut fosfat tersebut berperan juga dalam transfer energi, penyusunan protein, koenzim, asam nukleat dan senyawa-senyawa metabolik lainnya yang dapat meningkatkan aktivitas penyerapan P pada tumbuhan yang kekurangan P (Rao, 1994).
Selain bakteri pelarut fosfat, di dalam tanah terdapat pula bakteri penambat nitrogen simbiotik dan bakteri penambat nitrogen nonsimbiotik. Bakteri penambat nitrogen simbiotik berperan sebagai mikro simbion dalam proses simbiosis dengan
tanaman Leguminosa yang berperan sebagai makro simbion. Bakteri penambat nitrogen nonsimbiotik adalah bakteri penambat nitrogen yang umumnya tumbuh baik di sekitar tanaman non-Leguminosa dan membantu tanaman tersebut dalam penyerapan nitrogen (Widawati dan Suliasih, 2005). Selain itu, beberapa hasil penelitian juga melaporkan bahwa bakteri penambat nitrogen juga memiliki kemampuan dalam menghasilkan zat pengatur tumbuh seperti IAAdan memiliki kemampuan dalam melarutkan fosfat(Chitraselvi et al., 2015). Berdasarkan hal tersebut, maka campuran bakteri pelarut fosfat, bakteri penghasil IAA dan bakteri penambat nitrogen dapat diinokulasikan dalam kompos sebagai pupuk alami.
Mengingat potensi besar mikroorganisme rhizosfer sebagai agen hayati yang mampu mendukung pertumbuhan tanaman, maka penelitian ini perlu dilakukan.
Penelitian ini menitikberatkan pada perolehan bakteri rhizosfer mutualistik bagi tanaman. Bakteri rhizosfer diisolasi dari tumbuhan Graminaedominan di pantai. Serta akan diuji kemampuannya dalam memicu pertumbuhan tanaman padi (Oryza sativaL.).
1.2 Permasalahan
Lahan produktif di Sumatera Utara yang semakin hari semakin berkurang jumlahnya dan tuntutan kebutuhan pangan semakin meningkat sejalan dengan bertambahnya penduduk akan mengakibatkan tanaman mengalami gangguan pertumbuhan. Salah satu upaya yang dapat dilakukan adalah dengan menggunakan mikroorganisme rhizosfer. Telah banyak penelitian yang membuktikan adanya kemampuan mikroorganisme dari daerah rhizosfer yang dapat mendukung pertumbuhan tanaman, namun sejauh ini belum banyak penelitian yang memperhatikan kondisi salinitas dari daerah tepi pantai dengan menggunakan mikroorganisme rhizosfer yang dimanfaatkan untuk meningkatkan pertumbuhan padi (Oryza sativaL.).
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah:
a. Untuk mendapatkanbakteri pelarut fosfat, pengikat nitrogen dan penghasil hormon IAA dari rhizosfer tumbuhan Graminae pantai.
b. Untuk mengetahui kemampuanbakteri tersebut dalam melarutkan fosfat, mengikat nitrogendan menghasilkan hormon IAA.
c. Untuk mengetahui kemampuan bakteri pelarut fosfat, pengikat nitrogen dan penghasil hormon IAA potensial dalam meningkatkan pertumbuhan padi (Oryza sativaL.).
1.4 Manfaat Penelitian
Penelitian ini bertujuan untuk mendapatkan sumber isolat bakteri baru yang berpotensi memicu pertumbuhan tanaman padi (Oryza sativaL.) serta sebagai informasi bagi masyarakat umum tentang pemanfaatan bakteri rhizosferGraminae pantai sebagai agen pupuk hayati.
BAB 2
TINJAUAN PUSTAKA
2.1 Graminae
Graminae (rumput-rumputan) merupakan salah satu tumbuhan darat yang paling banyak dijumpai karena dapat tumbuh diberbagai tempat dan dalam segala keadaan. Graminae merupakan tumbuhan yang memiliki perakaran merambat dan juga merumpun. Ciri-ciri suku Graminae adalah memiliki daun yang berbentuk pita, tulang daun sejajar dan melekat langsung pada batang, batang berongga, berakar serabut, bunganya berbentuk bulir dan mudah terbang jika tertiup angin.
Penyerbukan suku Graminaebanyak dibantu oleh angin.Graminae merupakan tumbuhan monokotil yang terdiri dari tiga famili yaitu Poaceae, Cyperacea, dan Juncaceae, namun di daerah tropik hanya ditemukan famili Poaceae dan Cyperaceae.
Kedua famili ini memiliki perbedaan struktur, morfologi dan penyebaran (Hipp, 2008).
Poaceae disebut juga Gramineae yang merupakan nama untuk kelompok rumput-rumputan. Poaceae memiliki daun tunggal dengan pertulangan daun linear, daun terdiri dari tiga bagian yang berbeda, yaitu sheat (pelepah), blade (helai daun) dan ligule merupakan bagian yang terletak antara helaian daun dan pelepah daun yang berfungsi sebagai penghubung antar keduanya. Sistem perakaran pada rumput terbagi dua yaitu rhizom dan stolon. Rhizom merupakan batang yang menjalar di bawah permukaan tanah, pada buku akar terdapat mata kuncup yang dapat tumbuh menjadi tunas sedangkan stolon merupakan tunas yang muncul di atas permukaan tanah (Peterson & Soreng, 2007). Contoh dari Poaceae adalah jagung (Zea mays), padi (Oryza sativa), gandum (Tritium sativum) dan lain-lain.
2.2 Mikroorganisme Rhizosfer
Rhizosfer adalah bagian tanah yang berada di sekitar perakaran tumbuhan danberperan sebagai pertahananluar bagi tumbuhan terhadap serangan patogen.
Rhizosfer merupakan habitat yang sangat baik bagi pertumbuhan mikroorganisme karena akar tumbuhan menyediakan berbagai bahan organik yang umumnya dapat
meningkatkan pertumbuhan mikroorganisme. Dengan adanya bahan organik yang dapat meningkatkan pertumbuhan mikroorganisme menyebabkan jumlah mikroba di lingkungan rhizosfer sangat tinggi.Populasi mikroorganisme di rhizosferlebih banyak dan beragam dibandingkan pada tanah bukan rhizosfer (Jeger, 2001).
Menurut Purwaningsih (2009), tanah yang banyak mengandung berbagai macam mikroorganisme secara umum dapat dikatakan bahwa tanah tersebut memiliki sifat fisik dan kimia yang baik. Salah satu mikroorganisme yang terdapat dalam tanah antara lain bakteri penambat nitrogen non-simbiotik. Dengan adanya mikroorganisme ini akan berpengaruh pada tingkat kesuburan tanah, karena mikroorganisme memegang peranan penting dalam proses pelapukan bahan organik dalam tanah sehingga unsur hara menjadi tersedia bagi tanaman serta sebagai pengendali hayati terhadap patogen akar.
Tanaman dan mikroorganismeberinteraksi dan saling menstimulasi yangdisebabkan oleh eksudat akar. Sedangkan eksudat akarmempengaruhi pertumbuhan dan aktivitasmikroorganisme di rhizosfer, rizoplan dan sekitarnya.Mikroorganisme yang menghunirhizosfer sangat beragam, yaitu fungi, bakteri, aktinomisetes, algadan nematoda. Aktivitas mikroorganisme di rhizosferdan rhizoplan berbeda dengan tanah sekitarnyatergantung pada eksudat akar yang dikeluarkan.Akar tanaman mengeluarkan beberapa senyawaseperti asam amino, vitamin, gula, tanin dan lainsebagainyayang antara 5-23% dikeluarkan dari hasil seluruh fotosintesistanaman yang ditransfer ke akar sebagai eksudat. Sebaliknya bahan organikpada non-rhizosfer lebih lambat dimetabolisme olehmikroorganisme (Niswati et al., 2008).
Mikroorganisme yang tumbuh pada perakaran atau sering juga disebut dengan zona rhizosfer merupakan mikroorganisme yang sangat mempengaruhi pertumbuhan dari tanaman. Fungsi mikroorganisme tersebut antara lain mampu memacu pertumbuhan tanaman atau sering disebut dengan plantgrowth promoting rhizospheric microorganism. Mikroorganisme yang berada pada zona rhizosfer yang mempunyai kemampuan untuk membentuk mantel di daerah perakaran, berperan juga sebagai unsur hara tanaman misalnya penyedia nitrogen, fosfor dan kalium yang tersedia bagi tanaman, meningkatkan kemampuan tanaman untuk memanfaatkan unsur hara, meningkatkan ketahanan tanaman terhadap kekeringan dan penyakit dan
masih banyak lagi peran lainnya yang menguntungkan bagi tanaman. Dengan perannya tersebut mikroorganismerhizosfer dianggap sebagai pemacu pertumbuhan tanaman atau plantgrowth promoting rhizospher microorganism dan dapat menyebabkan peningkatan kemampuan tanaman dalam memanfaatkan air, peningkatan ketersediaan hara, serta peningkatan ketahanan tanaman terhadap serangan patogen (Aiman et al., 2013).
2.3 Bakteri Pelarut Fosfat
Bakteri pelarut fosfatmerupakan kelompok bakteri tanah yang memiliki kemampuan melarutkan fosfat yang terfiksasi dalam tanah dan mengubahnya menjadi bentuk yang tersedia sehingga dapat diserap oleh tanaman. Pelarutan ini dapat disebabkan oleh adanya sekresi asam organik oleh bakteri tersebut seperti asam formiat, asetat, propionat, laktat, glikolat, fumarat, tartarat, ketobutirat, suksinat dan sitrat. Bakteri pelarut fosfat merupakan bakteri yang bersifat non patogenik dan termasuk dalam kategori bakteri pemacu pertumbuhan tanaman. Bakteri tersebut diketahui mampu menghasilkan vitamin dan fitohormon yang dapat memperbaiki pertumbuhan akar tanaman dan meningkatkan serapan unsur hara (Widawati et al., 2010).
Menurut Alexander (1977), pelarutan fosfat oleh aktivitas bakteri pelarut fosfat terjadi pada saat perubahan kelarutansenyawa fosfat organik yang menghasilkan asam-asam organik (asam sitrat, glutamat dan suksinat)dan bereaksi dengan Al3+, Fe3+, Ca2+ atau Mg2+membentuk komplek stabil serta membebaskan ionfosfat terikat menjadi tersedia bagi tanaman.Bakteri pelarut fosfat menghasilkan enzim fitasedan enzim fosfatase penghasil asam–asam organikyang dapat memineralisasi fosfat organik dalam tanah. Enzim fosfatase ataufosfomonoesterase (PMEase) dipengaruhi olehadanya reaksi asam dan basa dalam tanah sertaakan mempengaruhi transformasi fosfat yang disintesisoleh bakteri pelarut fosfat dalam tanah. Enzim-enzim tersebutjuga bertanggung jawab pada proses hidrolisisfosfat organik menjadi fosfat anorganik (H2PO4-, HPO4-) yang tersedia bagi tanaman (Kustiyaningsih, 2003). Mikroorganisme tersebut jugamemproduksi asam amino, vitamin dan growthpromoting substance seperti IAA dan asamgiberelin yang dapat meningkatkan pertumbuhan tanaman (Ponmugaran, 2006).
2.4 Bakteri Penambat Nitrogen
Nitrogen merupakan unsur makro yang penting, tetapi unsur ini terdapat dalamjumlah yang sedikit didalam tanah sedangkan yang diangkat tanaman cukup banyak. Sumbernitrogen untuk tanaman adalah N2 di atmosfer. Dalam bentuk N2
Nitrifikasi adalah proses oksidasi amonia menjadi nitrit dan kemudian menjadi nitrat secara biologis oleh bakteri autotrof. Bakteri autotrof umumnya berasal dari genus Nitrosomonasdan Nitrobacteryang merupakan genus yang terpenting dari bakteri autotrof. Bakteri autotrof yang melakukan proses nitrifikasi membutuhkan senyawa anorganik sebagai sumber energi dan karbondioksida sebagai sumber karbon. Nitrifikasi melalui dua tahapan reaksi, yaitu tahap pertama oksidasi amonium menjadi nitrit yang dilakukan oleh mikroorganisme pengoksidasi amonium (Nitrosomonas sp.), pada tahap kedua oksidasi nitrit menjadi nitrat oleh mikroorganisme pengoksidasi nitrit (Nitrobacter sp.) (Kusmawati, 2013).
, nitrogen tidak dapat langsungdimanfaatkan tanaman dan terlebih dahulu dirubah menjadi nitrat atau amonium melaluiproses tertentu sehingga tersedia bagi tanaman (Azizah, 2011).
Nitrifikasi adalah suatu proses oksidasi senyawa nitrogen tereduksi oleh mikroorganisme menjadi nitrit dan selanjutnya oksidasi nitrit menjadi nitrat.
Sedangkan pengubahan nitrat dan nitrit menjadi gas nitrogen dilakukan melalui proses denitrifikasi. Pada keadaan sawah yang kering, gas N2O dihasilkan melalui proses nitrifikasi. Sedangkan pada daerah yang tergenang gas N2O dihasilkan oleh mikroorganisme pelaku denitrifikasi. Bakteri penitrifikasi termasuk ke dalam dua kelompok fisiologi yang berbeda, yang terpenting dari masing-masing kelompok adalah Nitrosomonasyang mengoksidasi amonium menjadi nitrit dan Nitrobacter yang mengoksidasi nitrit menjadi nitrat. Kedua macam bakteri itu berbentuk batang kecil, Gram negatif, tidak membentuk endospora, berflagella polar dan bersifat aerob obligat (Dewi, 2007). Selain Nitrosomonasdan Nitrobacter, ada juga Rhizobium(root nodulating bacteria) adalah bakteri yang mampu menambat nitrogen dari udara melalui simbiosis dengan membentuk bintil akar pada tanaman Leguminoceae (Kyuma, 2004).
2.5 Bakteri Penghasil IAA
Sumber hormon IAA yang alami tidak hanya dihasilkan oleh tumbuhan saja tetapi juga dihasilkan oleh rhizobakteri.Mikroorganismedalam tanah memiliki banyak peran penting di tanah terutama dalam daur unsur organik untuk kehidupan seperti penghasil hormon IAA. Hormon IAA adalah auksin endogen yang berperan dalam perkembangan akar, menghambat pertumbuhan tunas samping, merangsang terjadinya absisi, serta berperan dalam pembentukan jaringan xilem dan floem (Silitonga, 2008).
Auksin merupakan salah satu hormon tanaman yang dapat meregulasi banyak proses fisiologi, seperti pertumbuhan, pembelahan dan diferensiasi sel serta sintesa protein. Fungsi auksin adalah menyebabkan terjadinya pembelahan sel pada lapisan kambium. Pada konsentrasi auksin optimum, sel-sel penyusun kambium aktif membelah dan terbentuk lapisan xilem yang cukup tinggi. IAA adalah hormon auksin endogen yang disintesis dalam batang dan akar. Prinsip karakterisasi adalah mengontrol proses fisiologis dan menstimulasi kapasitas perpanjangan sel dalam batang dan bagian koleoptil, mempengaruhi inang pada respon perkembangan termasuk inisiasi akar, perkembangan bunga maupun buah (Ekowahyuni, 2002).
Kelompok bakteri yang bermanfaat bagi pertumbuhan tanaman secara langsung adalah kelompok penghasil zat pengatur tumbuh. Kelompok bakteri ini berperan penting pada pertanian di wilayah tropis. Beberapa kelompok bakteri yang memiliki kemampuan untuk merangsang pertumbuhan tanaman diantaranya yaitu beberapa strain bakteri dari genus Azospirillummemiliki kemampuan merangsang pertumbuahan tanaman, hal ini disebabkan karena bakteri tersebut mampu memproduksi fitohormon, yaitu IAA (Lestariet al., 2007).Selain Azospirillum, beberapa mikroorganisme tanah yang menghasilkan IAA antara lain yaitu Bacillus sp. dapat meningkatkan pertumbuhan tanaman dan menghambat perkembangan patogen akar, Enterobacter sp., Azotobacter sp., Klebsiela sp., Alcaligenes faecalis, Azoarcus sp., Serratia sp., Cyanobacteria dan bakteri sulfur dapat mendorong pertumbuhan tanaman serta Azotobacter chroococcum, A. Vinelandii dan A. Paspali mampu menghasilkan auksin (Azcon & Barea, 1975).
BAB 3
METODOLOGI PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juni 2017 sampai dengan Januari 2018 di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
3.2 Metode Penelitian 3.2.1 Bahan Penelitian
Bahan yang digunakan pada penelitian ini adalah tanah rhizosfer tumbuhan Graminae Pantai Sialang Buah, Kabupaten Serdang Bedagai, Sumatera Utara (Gambar 3.1), media Nutrient Agar (NA), Nutrient Broth (NB),media Luria Bertani (LB), triptofan, media Pikovskaya, dan media James Nitrogen Free Malat Bromthymol Blue (JNFB) (Lampiran 1, halaman 29).
Gambar 3.1. Tumbuhan Graminae Tebu Salah (Phragmites karka)Pantai Sialang Buah, Kabupaten Serdang Bedagai, Sumatera Utara
3.2.2 Pengambilan Sampel Rhizosfer Tumbuhan Poaceae
Tanah yang menempel pada akar tumbuhan Poaceae diambil sebanyak ±100 gram. Tanah diambil dari 3 titik pengambilan sampel dan dimasukkan ke dalam plastik klep untuk dibawa ke laboratorium.
3.2.3 Isolasi Bakteri Pelarut Fosfat, Pengikat Nitrogen dan Penghasil Hormon IAA
Sebanyak 1 gram sampel tanah dimasukkan ke dalam tabung reaksi yang berisi 9 mlakuades steril dan dihomogenkan. Secara serial, berikutnya sebanyak 1 ml suspensi tanah dari pengenceran sebelumnya dimasukkan ke dalam 9 ml akuades steril yang baru.Pengenceran dibuat sampai 10-5. Sebanyak 0,1 ml suspensi tanah dari pengenceran terakhirdisebar di atas permukaan medium Pikovskaya, JNFB dan LB + triptofan secara aseptis.Medium kultur diinkubasi selama 2-3 hari pada suhu ruang. Pertumbuhan bakteri pelarut fosfat ditandai dengan adanya zona berwarna terang jernih atau zona bening di sekeliling koloni bakteri pada medium pikovskaya.
Uji positif bakteri pengikat nitrogen ditandai dengan adanya koloni yang tumbuh pada medium JNFB, sedangkan uji positif bakteri penghasil IAA ditandai dengan adanya koloni yang tumbuh pada medium LB + triptofan. Bakteri yang tumbuh pada medium pikovskaya, JNFB dan LB + triptofan diipilih untuk dimurnikan dan dikarakterisasi lebih lanjut.
3.2.4 Seleksi Bakteri Pelarut Fosfat
Isolat bakteri yang telah dimurnikan selanjutnya diujikan kembali kemampuannya dalam melarutkan fosfat untuk mengetahui indeks kelarutannya.
Sebanyak 1 ose kultur ditotolkan padamedium pikovskaya padat secara aseptis dan diinkubasi selama 7 hari pada suhu ruang. Zona bening yang terbentuk diukur dan dikalkulasi sebagai Indeks Pelarutan Fosfat (IPF). Nilai IPF diperoleh dari hasil perbandingan antaradiameter zona bening yang terbentuk disekeliling koloni bakteri dan diameter koloni bakteri (Premono et al., 1996).
3.2.5 Seleksi Bakteri Pengikat Nitrogen
Isolat bakteri yang telah dimurnikan selanjutnya diujikan kembali kemampuannya dalam mengikat nitrogenberdasarkan ukuran pelikel yang terbentuk pada media JNFB semi padat. Sebanyak 1 ose kultur bakteri diinokulasikan pada
media JNFB semi padat secara aseptis dan diinkubasi selama 10 hari pada suhu ruang. Pelikel yang terbentukdi permukaan media JNFB semi padat diukur dan dicatat.
3.2.6 Seleksi Bakteri Penghasil IAA
Pengukuran kemampuan bakterimenghasilkan IAA dilakukan secara kuantitatif dengan menggunakan spektrofotometer.Suspensi bakteri dibuat sebanyak 10 ml dengan kerapatan selpada OD6000,5 (≈ 108CFU/ml). Sebanyak 3 ml suspensi bakteri tersebutdimasukkan ke dalam 27 ml media LB cair + triptofan.
Medium kultur diinkubasi pada suhu 28oC selama 6 haridan digoyang dengan kecepatan 100 rpm. Setiap 2 hari sekali sebanyak 10 mlcairan kulturdiambil dan selanjutnya disentrifugasi dengan kecepatan 5500 rpm selama 10 menit. Supernatan yang terbentukdipindahkan ke dalam tabung reaksi steril barukemudian ditambahkan reagen Salkowski dengan perbandingan 4:1 (supernatan : salkowski) dan diinkubasi selama 20 menit pada suhu ruang.Secara kolorimetri perubahan warna yang terbentuk diukur dengan alat spektrofotometerpada panjang gelombang 535 nm.
Konsentrasi IAA yang dihasilkan dari sampel dihitung dari hasil kalibrasi kepersamaan regresi linier dari absorbansi IAA murni yang diukur dengan serial konsentrasi 0, 5, 10 sampai 30 ppm.
3.2.7Uji Sinergis Isolat Bakteri Pelarut Fosfat, Pengikat Nitrogen dan Penghasil IAA
Uji sinergis dilakukan secara kualitatif untuk melihat kompatibilitas antara isolat terpilih untuk kemungkinan dibuat dalam bentuk konsorsium ketika diaplikasikan ke tanaman. Tiga isolat terpilih dari masing-masing pengujianbakteri pelarut fosfat, pengikat nitrogen dan bakteri penghasil IAA digoreskan dengan ose pada permukaan media nutrien agar. Masing-masing isolat digoreskan bersinggungan satu sama lain menggunakan metode gores sehingga antar isolat akan bertemu (Gambar 3.2). Medium kultur diinkubasi selama 24 jam dan selanjutnya diamati apakah terdapat zona bening atau zona hambat diantara dua isolat yang bersinggungan. Isolat dikatakan kompatibel apabila tidak terdapat zona penghambatan pada daerah pertemuan kedua isolat dan dikatakan tidak kompatibel apabila terdapat zona penghambatan pada daerah pertemuan kedua isolat tersebut.
Gambar 3.2. Metode gores uji senergis antar isolat bakteri pada media Nutrient Agar
3.2.8 Uji Aplikasi Isolat Terpilih Pada Benih Tanaman Padi
Sebanyak 3 isolat bakteri terpilih dari masing-masing pengujian ditumbuhkan pada medium Nutrient Broth steril sampai terbentuk kerapatan sel padaOD6000,5 (≈ 108CFU/ml). Sebanyak 10 mlsuspensi bakteridituangkan kemedium tanah steril yang mengandung pasir dengan perbandingan tanah : pasir (3:1). Benih padi umur 1 minggu yang sebelumnya telah ditumbuhkan dalam polibag yang berisi tanah pasir dipindahkan ke dalam tanah yang telah diintroduksi bakteri uji. Setiap polibag berisi 3 bibit tanaman. Bakteri uji yang digunakan ada 3 isolat dan dengan kombinasinya sehingga diperoleh 7 perlakuan (Tabel 3.1). Masing-masing perlakuan memiliki 3 ulangan sehingga seluruhnya menjadi 21 perlakuan.Pengamatan pertumbuhan tanaman padi dilakukan terhadap tinggi tanaman, panjang akar, berat basah dan berat kering tajuk dan akar serta kemungkinan adanya tanaman yang mati.Pengamatan pertumbuhan tanaman padi dilakukan pada 30 hari setelah tanam.
Tabel 3.1. Perlakuan dan kombinasi bakteri yang diaplikasikan
NO. Kode Perlakuan Deskripsi
1 P0 Tanpa bakteri sebagai kontrol
2 P1 Isolat PP03
3 P2 Isolat RG08
4 P3 Isolat PI05
5 P4 Isolat PP03 + RG08
6 P5 Isolat PP03 + PI05
7 P6 Isolat RG08 + PI05
8 P7 Isolat PP03 + RG08 + PI05
BAB 4
HASIL DAN PEMBAHASAN
4.1 Isolat Bakteri Pelarut Fosfat
Sebanyak 6 isolat bakteri pelarut fosfatdiperoleh dari rhizosfer tumbuhan Poaceaepantai pada media pikovskaya padat. Keenam isolattersebut dipilih karenamemiliki zona bening di sekitar koloni bakteri ketika tumbuh pada media pikovskaya. Berdasarkan pengamatan morfologi koloni menunjukkan bahwa keenam isolat ini adalah jenis yang berbeda. Perbedaan ini terlihat dari bentuk, tepi elevasi dan warna koloni yang bervariasi pada semua isolat. Bentuk koloni dari enam isolat bakteri ada tiga yaitu circular, irregular dan rhizoid.Bentuk koloni bakteri yang mendominasi adalahcircular. Semua koloni bakteri berwarna putih, dengan elevasi flat dan raised, sementara tepi koloni berbentuk entire, undulate dan filamentous (Tabel 4.1). Dari hasil penelitian Umul et al. (2013) diperoleh 14 isolat bakteri pelarut fosfat yang diisolasi dari berbagai rhizosfer tumbuhan pantai Samas dan diantaranya 13 isolat memiliki bentuk morfologi koloni circular dan 3 isolat yang berwarna putih.
Tabel 4.1. Karakteristik Morfologi Koloni Bakteri Pelarut Fosfat dari Rhizosfer Poaceae Pantai
Isolat Bakteri
Morfologi Koloni
Bentuk Tepi Elevasi Warna
PP01 Irregular Entire Flat Putih
PP02 Irregular Undulate Flat Putih
PP03 Circular Filamentous Raised Putih
PP04 Circular Undulate Raised Putih
PP05 Circular Entire Flat Putih
PP06 Rhizoid Filamentous Flat Putih
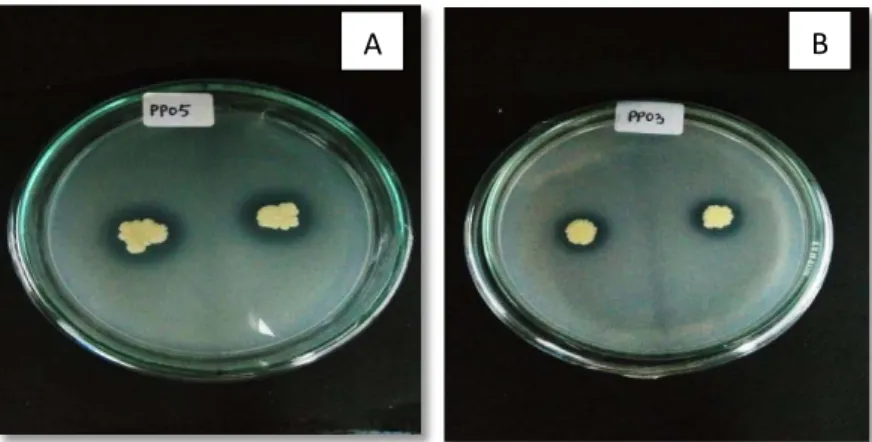
Kemampuan melarutkan fosfat dari keenam isolat bakteri pelarut fosfat bervariasi dengan diameter zona bening terbesar yaitu isolat PP05 sebesar 18 mm dan yang terkecil yaitu isolat PP06 sebesar 7 mm(Tabel 4.2). Sedangkan Indeks Pelarutan Fosfat (IPF) yang diperoleh pada penelitian ini memiliki nilai IPF tertinggi 3,07 oleh isolat PP03dan terendah yaitu isolat PP06 sebesar 1,4.Hasil ini
melarutkan fosfat meskipun diameter zona bening isolat PP05 cukup besar (Gambar 4.1). Hal ini dikarenakan isolat PP05 memiliki diameter koloni yang cukup besar, sehingga zona beningjika dibandingkan dengan diameter koloninilai IPF hanya sebesar 2,25. Sehingga berdasarkan nilai IPF, isolat PP03 memiliki potensi pelarutan fosfat lebih tinggi jika dibandingkan dengan isolat lainnya.Hal ini sesuai dengan pendapat S. Alam et al (2002) yang mengatakan bahwabesarnya lebar zona bening tidak selalu mengidentifikasikan banyaknya jumlah konsentrasi fosfat yang terlarut dan kemampuan pelarutan fosfat bakteri dapat dilihat dari nilai indeks pelarutan fosfatnya(Hesham dan Mohamed, 2011).
Tabel 4.2. Indeks Pelarutan Fosfat Bakteri Pelarut Fosfat dari Rhizosfer Poaceae NO Kode Isolat Diameter Koloni
(mm)
Diameter Zona Bening (mm)
Indeks Pelarutan Fosfat (IPF)
1 PP01 10,5 15 1,43
2 PP02 9,5 14 1,47
3 PP03 3,63 11,13 3,07
4 PP04 5 9 1,8
5 PP05 8 18 2,25
6 PP06 5 7 1,4
Kemampuan bakteri dalam melarutkan fosfat kemungkinan disebabkan oleh adanya aktivitas enzim fosfatase yang berbeda dari tiap isolat bakteri. Enzim fosfatase yang dihasilkan isolat bakteri tersebut kemudian digunakan untuk melarutkan trikalsium fosfat yang terkandung di dalam media, sehingga media disekitar koloni bakteri yang semula berwarna putih keruh menjadi bening.
Kemampuan bakteri dalam melarutkan fosfat juga dipengaruhi olehasam organik yang dihasilkan tiap bakteri. Dalam aktivitasnya, mikroba pelarut fosfat akan menghasilkan asam-asam organik diantaranya ialah asam sitrat, glutamat, suksinat, laktat, oksalat, glioksalat, malat, fumarat, tartarat dan α-ketobutirat (Richardson, 2001).Asam-asam organik sangat berperan dalam pelarutan fosfat karena asam organik tersebut relatif kaya akan gugus-gugus fungsional karboksil dan hidroksil yang bermuatan negatif sehingga kemungkinan membentuk senyawa kompleks dengan ion (kation) logam yang biasa disebut khelat. Asam-asam organik yang mampu mengkhelat kation (terutama Ca) yang berikatan dengan fosfat melalui gugus karboksilnya, sehingga fosfat lepas dan menjadi terlarut (Chen et al., 2006).
Gambar 4.1. Zona bening di sekitar koloni bakteri pada media Pikovskaya Agar yang diinkubasi selama 7 hari pada suhu ruang. A. isolat PP05, B. Isolat PP03
4.2Isolat Bakteri Pengikat Nitrogen
Sebanyak 6 isolat bakteri pengikat nitrogendiperoleh dari rhizosfer tumbuhan Poaceaepantaiyang tumbuh pada media JNFB. Karakteristik morfologi koloni keenam isolat bakteri penambat nitrogen tersebut bervariasi. Keenam isolat ini berbeda secara morfologi, kecuali isolat RG08 dan RG05 yang memiliki morfologi koloni yang sama.Warna koloni bakteri umumnya putih, tetapi satu isolat memiliki warna koloni orange. Bentuk koloni bakteri yang ditemukan hanya dua yaitu rhizoiddan circular (Tabel 4.3). Penelitian oleh Hartono dan Jumadi (2014) diperoleh 20 isolat bakteri pengikat nitrogen dari rhizosfer jagung dan padi asal Kabupaten Barru, Sulawesi Selatan dan diantaranya 12 isolat memiliki bentuk morfologi koloni circular.
Tabel 4.3. Karakteristik Morfologi Bakteri Pengikat Nitrogen dari Rhizosfer Poaceae Pantai
Berdasarkan kemampuannya menambat N yang diamati secara kualitatif dengan melihat pelikel putih yang terbentuk pada permukaan media JNFB semi
Isolat Bakteri
Morfologi Koloni
Bentuk Tepi Elevasi Warna
RG01 Circular Entire Flat Putih
RG02 Circular Undulate Flat Putih
RG05 Rhizoid Filamentous Flat Putih
RG06 Circular Undulate Raised Orange
RG07 Circular Undulate Raised Putih
RG08 Rhizoid Filamentous Flat Putih
A B
nitrogendengan baik. Berdasarkan ketebalan pelikel yang terbentuk, isolat RG01 memiliki pelikel yang paling tebal yaitu 8,25 mm dan terendah RG07 yaitu 5,75 mm (Tabel 4.4). Pelikel yang terbentuk pada media JNFB semi padat merupakanselaput atau cincin putih yang terbentuk saat jumlah nitrogen pada media telah terakumulasi.
Ukuran pelikel yang terbentuk menunjukkan aktivitas nitrogenase yang bervariasi.
Semakin tebal pelikel, maka aktivitas enzim nitrogenase semakin tinggi (Susilowati et al., 2007).
Tabel 4.4. Pelikel yang Terbentuk oleh Bakteri Pengikat Nitrogen
NO Kode Isolat Tebal Pelikel (mm)
1 RG01 8,25
2 RG02 6,5
3 RG05 7,25
4 RG07 5,75
Berdasarkan ukuran pelikel yang terbentuk, kemampuan menambat nitrogen dari bakteri yang diperoleh pada penelitian ini cukup tinggi jika dibandingkan dengan penelitian Tarigan et al. (2013) dari rhizosfer tanah perkebunan kedelai dan Shasi et al. (2011) dari rhizosfer padi pelabuhanyang memperoleh bakteri pengikat nitrogen masing-masing tebal pelikel 6 mm dan 12 mm.Terbentuknya pelikel disebabkan oleh karena di dalam medium tidak ada kelebihan oksigen, laju difusi oksigen sama dengan laju respirasi organisme merupakan kondisi yang baik untuk aktivitas enzim nitrogenase yang membantu mereduksi asetilen menjadi etilen (Susilowatiet al., 2007).
4.3Isolat Bakteri Penghasil IAA
Sebanyak 8 isolat bakteri penghasil IAAdiperoleh dari rhizosfer tumbuhan Poaceaepantaiyang tumbuh pada medium LB + triptofan. Karakteristik morfologi koloni kedelapan isolat penghasil IAA tersebut bervariasi. Delapan isolat ini berbeda secara morfologi, kecuali isolat PI01 dan PI07 yang memiliki morfologi koloni yang sama. Bentuk koloni bakteri umumnya irregular, tetapi satu isolat memiliki bentuk rhizoid. Warna koloni bakteri yang ditemukan hanya dua warna yaitu putih dan putih kekuningan (Tabel 4.5).Penelitian Tarigan et al (2013) memperoleh 5 isolat bakteri penghasil IAA yang diisolasi dari rhizosfer tanah perkebunan kedelai dan diantaranya 1 isolat memiliki bentuk morfologi koloni irregular.
Tabel 4.5. Karakteristik Morfologi Bakteri Penghasil IAA dari Rhizosfer Poaceae Pantai
Isolat Bakteri
Morfologi Koloni
Bentuk Tepi Elevasi Warna
PI01 Irregular Filamentous Flat Putih
PI02 Irregular Entire Raised Putih Kekuningan
PI03 Circular Entire Flat Putih
PI04 Circular Entire Raised Putih Kekuningan PI05 Irregular Filamentous Raised Putih Kekuningan
PI06 Irregular Entire Flat Putih
PI07 Irregular Filamentous Flat Putih
PI08 Rhizoid Filamentous Flat Putih
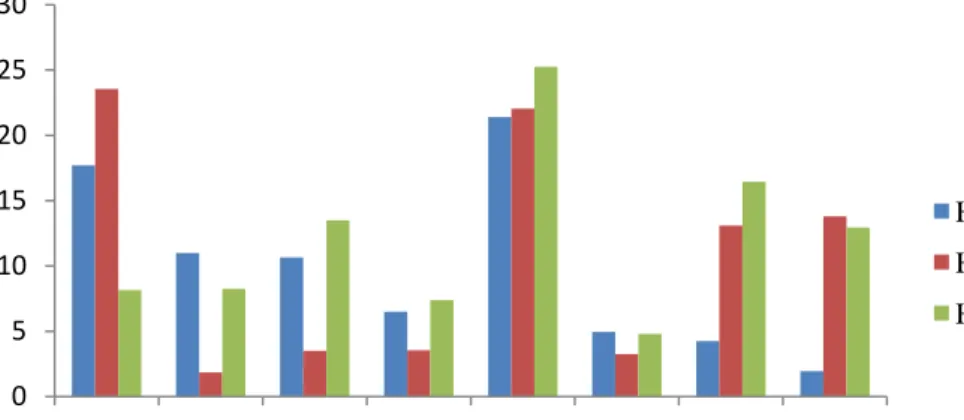
Berdasarkan kemampuannya menghasilkan IAA yang diamati secara kuantitatifdengan mengukur absorbansi IAA menggunakan spektrofotometer pada panjang gelombang λ=535 nm, dari 8 isolat yang diujikan, hanya 2 isolat yang mampu menghasilkan IAA dengan baik yaitu PI01 dan PI05. Dari ke-2 isolat tersebut hanya isolat bakteri PI05 yang mengalami kenaikan konsentrasi IAA yang tinggi dan stabil. Masing-masing isolat bakteri menghasilkan konsentrasi IAA yang berbeda pada pengamatan hari ke-2, 4 dan 6. Pada pengamatan hari ke-2, isolat PI05 menghasilkan IAA dengan konsentrasi tertinggi yaitu 21,4 ppm dan yang terendah adalah PI08 yaitu 1,95 ppm. Pada pengamatan hari ke-4 isolat PI05 menghasilkan konsentrasi IAA yaitu 22,05 ppm dan yang terendah adalah PI02 yaitu 1,85 ppm.
Pada pengamatan hari ke-6 isolat PI05 masih menghasilkan konsentrasi IAA tertinggi yaitu 25,25 ppm dan yang terendah adalah isolat PI06 yaitu 4,8 ppm. Isolat PI05 mengalami kenaikan konsentrasi IAA yang stabil pada hari ke-2, 4 dan 6 dan merupakan konsentrasi IAA yang tertinggi (Gambar 4.2).
Berdasarkan kemampuan bakteri dalam menghasilkan IAA, kemampuan penghasil IAA pada penelitian ini tidak jauh berbeda jika dibandingkan dengan penelitian Silitonga(2008) dan Lwin et al. (2012) yang menghasilkan IAA masing- masing konsentrasi 33,3 ppm dan 37,2 ppm pada hari ke-6. Variasi konsentrasi hormon IAA yang dihasilkan oleh masing-masing isolat diduga karena perbedaan kemampuan kecepatan bakteri dalam mensintesis triptofan menjadi IAA. Biosintesis IAA oleh mikroba dapat ditingkatkan dengan penambahan triptofan sebagai prekursor (Tarigan, 2013).
Gambar 4.2. Produksi IAA 8 isolat bakteri berdasarkan waktu inkubasi 2, 4 dan 6 hari
4.4 Kombinasi Kemampuan Bakteri Pelarut Fosfat, Pengikat Nitrogen dan Bakteri Penghasil IAA
Hasil uji silang kemampuan bakteri menunjukkan bahwa dari20 isolat bakteri yang diujikan, 14 isolat bakteri dapat melarutkan fosfat dengan kemampuan tertinggi (+++) yaitu isolat bakteri PP03. Pada uji pengikat nitrogen, 20 isolat bakteri dapat tumbuh pada media JNFB padat, tetapi hanya 9 isolat bakteri yang dapat menghasilkan pelikel pada media JNFB semi padat dan yang potensial yaitu PP03, RG01, RG02, RG05, RG07, PI05 dan PI08. Isolat bakteri yang tumbuh pada media LB cair + triptofan,ke-20 isolat bakteri dapat menghasilkan IAA tetapi hanya 2 isolat bakteri yang potensial menghasilkan IAA yaitu PP03 dan RG08 (Tabel 4.6). Tujuh isolat bakteri hanya dapat melarutkan fosfat dan menghasilkan IAA. Dari uji silang tersebut diperoleh dua isolat bakteri hanya dapat mengikat nitrogen dan menghasilkan IAA, empat isolat bakteri hanya dapat menghasilkan IAA, tujuh isolat bakteri yang dapat melarutkan fosfat, mengikat nitrogen dan menghasilkan IAA.
Bakteri yang dapat melarutkan fosfat, mengikat nitrogen dan menghasilkan IAA meliputi beberapa bakteri seperti Rhizobium, Azospirillum, Azotobacter(penambat nitrogen) dan bakteri pelarut fosfat seperti Pseudomonas, Micrococcus dan Bacillus. Bakteri ini dapat bersimbion dalam bintil akar, rhizosfer, permukaan akar tanaman maupun hidup bebas dalam tanah. Bakteri Rhizobium,Bacillus, Azospirillum danAzotobacterdapat menyediakan unsur nitrogen
0 5 10 15 20 25 30
PI01 PI02 PI03 PI04 PI05 PI06 PI07 PI08
Konsentrasi IAA (ppm)
Isolat Bakteri
Hari Ke-2 Hari Ke-4 Hari Ke-6
dan beberapa mampu menyediakan unsur fosfat bagi tanaman serta dapat memproduksi hormon tumbuh seperti IAA (Widawati dan Muharam, 2012).
Tabel 4.6. Kombinasi Kemampuan Bakteri Pelarut Fosfat, Pengikat Nitrogen dan Penghasil IAA
NO Isolat Bakteri
Indeks Pelarutan Fosfat
Tebal Pelikel Bakteri Pengikat Nitrogen
Konsentrasi IAA Bakteri Penghasil
IAA
1 PP01 + - +
2 PP02 + - ++
3 PP03 +++ +++ +++
4 PP04 + - ++
5 PP05 ++ - +
6 PP06 + - +
7 RG01 + +++ +
8 RG02 + +++ +
9 RG05 + +++ +
10 RG06 + - ++
11 RG07 + +++ +
12 RG08 + - +++
13 PI01 - + +
14 PI02 - - +
15 PI03 - - +
16 PI04 - - +
17 PI05 ++ +++ ++
18 PI06 + ++ +
19 PI07 - - ++
20 PI08 - +++ +
Keterangan: Indeks Pelarutan Fosfat : -(0), +(1-2), + + (2-3),+++ (3-4) Ukuran pelikel (mm) : - (0), + (1-3), + + (3-5), +++ (5-9) Konsentrasi IAA (ppm) : - : 0, + (1-14), ++ (15-27), + + + (28-40)
Isolat yang diperoleh dari rhizosfer tumbuhan Poaceae pantai sebanyak 20 isolat.Jumlah isolat yang diperoleh pada penelitian ini lebih banyak jika dibandingkan dengan penelitian dari Widawati (2015), yang memperoleh 11 isolat bakteri dari rhizosfer perkebunan karet asal Lampung yang terdiri dari Rhizobium, Azospirillum, Azotobacter dan Pseudomonas. Isolat tersebut berpotensi sebagai agen pupuk hayati. Hasil analisis menunjukkan bahwa bakteri tersebut memiliki aktivitas pelarutan fosfat, mengikat nitrogen dan produksi hormonIAA.
4.5 Karakteristik Isolat Bakteri Potensial
Berdasarkan hasil uji kualitatif ditetapkan 3 isolat yangdipilih untuk diaplikasikan ke tanaman padi yaitu isolatPP03, RG08 dan PI05. Ketiga isolat ini memiliki kemampuan yang tinggi terhadap ketiga parameter yang diujikan.
Berdasarkan karakter morfologi sel dan sifat Gram ketiga isolat tersebut menunjukkan perbedaan. Dua isolat merupakan bakteri Gram positif dengan sel berbentuk monokokus dan monobasil, sedangkan satu isolat adalah Gram negatif dengan penataan sel streptokokus (Tabel 4.7).
Tabel 4.7. Morfologi Sel dan Pewarnaan Gram Bakteri Terpilih Isolat Bakteri Morfologi Sel
Gram Bentuk dan Penataan
PP03 Streptokokus -
RG08 Monokokus +
PI05 Monobasil +
Hasil karakteristik biokimia sederhana terhadap ketiga isolat terpilih menunjukkan bahwaketiga isolat memiliki karakter biokimia yang berbeda (Tabel 4.8). Isolat RG08 dan PI05 mampu menggunakan sitrat sebagai sumber karbon dan hanya isolat RG08 yang mampu memfermentasikan sukrosa dan laktosa sedangkan isolat PP03 dan PI05 hanya mampu memfermentasi glukosa.
Tabel 4.8. Karakteristik Biokimia Isolat Bakteri Terpilih
Isolat
Uji Biokimia
Sitrat Gelatin Motilitas Hidrolisis pati Katalase
Sulfida
Glukosa Sukrosa Laktosa Endapan Keretakan
PP03 - + + + + + - - - -
RG08 + + + + + + + + - -
PI05 + + + + + + - - - -
Keterangan : (+) = uji positif ; (-) = uji negatif
Berdasarkan hasil karakteristik isolat bakteri potensial, kemungkinan isolat PP03 adalah bakteri Pseudomonas.Bakteri Pseudomonas sendiri memiliki karakteristik seperti:Gram negatif, berbentuk batang (rods) atau kokus (coccus),
motil mempunyai flagel polar, oksidase positif, katalase positif, pati positif, gelatin positif dan banyak ditemukan di sebagian besar habitat tanah (Suyono dan Salahudin, 2011). Genus Pseudomonas merupakan salah satu bakteri yang dapat menghasilkan IAA dan melarutkan fosfat (Rubio at al., 2000).
Isolat bakteri RG08 kemungkinan adalah Micrococcus. Karakteristik biokimia Micrococcusadalah Gram positif, katalase positif, dapat menghidrolisis gelatin, sedikit menghasilkan asam dari glukosa maupun laktosa dan biasanya terdapat di tanah dan air(Holt et al., 1994). Pada rhizosfer tanaman umbi di bawah tegakan hutan rakyat kemiri, Prayudyaningsih et al., (2015) memperoleh bakteri pelarut fosfat yang merupakan genusMicrococcus.
Isolat bakteri PI05 kemungkinan merupakan bakteri Bacillus. Bacillus sp.
merupakan bakteri tanah yang seringkali dijumpai di daerah rhizosfer tanaman.
Bakteri yang termasuk dalam genus Bacillus memiliki sel berbentuk batang, Gram positif, motil, hidrolisis pati dan katalase positif (Astuti, 2008).Bacillus memiliki kemampuan dalam melarutkan fosfat dan memproduksi IAA, amonia, HCN, katalase, amilase, selulase dan kitinase (Bhatt dan Vyas, 2014).
4.6SinergismeBakteri Terpilih
Hasil uji sinergisme 3 bakteri terpilih menunjukkan adanya kompatibilitas antara ke-3 isolat yangditunjukkan dengan tidak adanya zona hambat pada persinggungan antar isolat (Gambar 4.3).Kombinasi antar bakteri dapat meningkatkan laju pertumbuhan yang memicu meningkatnya produksi enzim dari masing-masing isolat. Bakteri yang sinergis dapat memberikan hasil yang lebih optimum karena aktivitas metabolisme yang saling mendukung dari setiap isolat bakteri. Suatu konsorsium akan menghasilkan produk yang dapat dimanfaatkan bersama, sehingga dapat saling mendukung pertumbuhan isolat tunggal dan lainnya (Bailey et al., 2006).
Gambar 4.3. Sinergisme antar isolat PP03 dengan RG08, RG08 dengan PI05 dan PI05 dengan PP03
4.7 Parameter Pengamatan Bakteri Terpilih Pada Bibit Padi (Oryza sativa L.) Hasil pengamatan yang dilakukan terhadap tinggi dan panjang akar tanaman padi setelah 30 hari tanam, menunjukkan bahwa perlakuan P7 (PP03 + RG08 + PI05) berbeda nyata terhadap perlakuan P0 (tanpa bakteri).Tetapi pada pengamatan panjang akar, perlakuan P2 (RG08) memiliki rata-rata yang lebih tinggi dari pada perlakuan P7 yaitu 10,50 cm. Perbedaan nilai rata-rata tersebut kemungkinan disebabkan karena isolat RG08 memiliki konsentrasi IAA yang sesuai dengan pertumbuhan akar tanaman. Bakteri penghasil IAA berpotensi bergabung dengan beberapa proses fisiologis tanaman, sehingga tanaman lebih sensitif dalam mengubah konsentrasi IAA yang dimilikinya dan mengakibatkan proses pembentukan akar yang lebih cepat. Bakteri yang mengeluarkan metabolit seperti hormon IAA dapat menyebabkan perkembangan akar yang lebih cepat dan permukaaan akar menjadi lebih luas ( Fallik et al., 1994). Adapun pada berat basah dan berat kering tajuk dan akar pada uji DMRT menunjukkan hasil yang tidak berbeda nyata pada setiap perlakuan. Tetapi pada perlakuan P7 memiliki berat basah dan berat kering tajuk dan akar yang lebih tinggijika dibandingkan dengan setiapperlakuan terutama pada perlakuan P0 (Tabel 4.9).
Peningkatan bobot basah disebabkan karena meningkatnya pengambilan air sel tumbuhan. IAA yang dihasilkan oleh bakteri akan dimanfaatkan oleh tanaman dan akan mengalami proses metabolisme di dalam tubuh tanaman sehingga
PI
0 P
P
RG08
membantu dalam proses pertambahan tinggi, panjang akar dan berat basah tanaman (Spaepen et al., 2007).
Tabel 4.9. Rata-rata Pertumbuhan Tanaman Padi Setelah 30 Hari Tanam
Perlakuan
Parameter Pertumbuhan Benih Rata-rata Tinggi
tanaman (cm)
Panjang akar (cm)
Berat basah
tajuk (g)
Berat basah akar (g)
Berat kering tajuk (g)
Berat kering
akar (g) P0 (tanpa bakteri) 35,04a 4,71a 0,75a 0,20a 0,13a 0,07a
P1 (PP03) 39,99b 8,67bc 0,71a 0,36a 0,11a 0,09
P2 (RG08)
a
39,10b 10,50c 0,61a 0,35a 0,08a 0,09 P3 (PI05)
a
42,09bc 5,08a 0,73a 0,42a 0,10a 0,10 P4 (PP03+RG08)
a
41,90bc 9,43bc 0,74a 0,37a 0,11a 0,10 P5 (PP03+PI05)
a
41,31bc 8,10bc 0,48a 0,19a 0,08a 0,06 P6 (RG08+PI05)
a
42,55bc 8,44bc 0,67a 0,43a 0,09a 0,09 P7
(PP03+RG08+PI05)
a
44,84c 7,81b 0,80a 0,47a 0,13a 0,14a Keterangan: Nilai rata-rata yang mempunyai huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji DMRT pada taraf nyata 5 %
Fosfor dan nitrogen secara bersamaan akan mempengaruhi pertumbuhan tanaman pada pembentukan sel-sel baru di jaringan meristematik tanaman, sehingga dapat membantu proses pertumbuhan dan perkembangan tanaman (Tania et al.,2012).Adanya unsurnitrogen dan fosfor juga mendukung proses fotosintetis sehingga fotosintat yang dihasilkan semakin banyak, kemudian fotosintat tersebut akan ditranslokasikan ke bagian vegetatif tanaman untuk digunakan membentuk batang dan daun sehingga dapat meningkatkan bobot kering tanaman secara keseluruhan (Gusniwati et al., 2008).
P0 P1 P2 P3 P4 P5 P6 P7
Gambar 4.4. Perbedaan bibit padi setelah 30 hari tanam dengan perlakuan P0 (Tanpa perlakuan), P1 (bakteri PP03), P2 (bakteri RG08), P3 (bakteri PI05), P4 (bakteri PP03 dan RG08), P5 (bakteri PP03 dan PI05), P6 (bakteri RG08 dan PI05) dan P7 (bakteri PP03, RG08 dan PI07).
Hasil rekapitulasi perlakuan isolat bakteri terpilih terhadap parameter pertumbuhan tanaman padi menunjukkan bahwa perlakuan P7 (PP03 + RG08 + PI05) memiliki pengaruh yang lebih baikjika dibandingkan dengan perlakuan yang lainnya, yang ditunjukkan dengan nilai rekapitulasi yang lebih tinggi yaitu 0.95 (Tabel 4.9). Peranan rizobakteri sebagai pelarut fosfat akan menjadilebih baik apabila didukung oleh kondisi lingkungan dan hubungan asosiasi antara bakteri dengan tanaman sekitarnya. Dengan adanya asosiasi yang baik, maka akar tanaman akan melepaskan bahan organik dan anorganik berupa eksudat penting ke dalam rhizosfer. Begitu pula dengan hubungan yang terbentuk dari isolat-isolat uji dengan tanaman, sehingga dapat memacu pertumbuhan tanaman padi yang lebih baik(Salamiah dan Wahda, 2015).
Tabel 4.10 Rekapitulasi Perlakuan Isolat Bakteri Terpilih Terhadap Parameter Pertumbuhan Tanaman Padi
Perlakuan
Rasio Parameter Pertumbuhan Bibit Padi
Nilai Rekapitulasi Tinggi
tanaman (cm)
Panjang akar (cm)
Berat basah tajuk (g)
Berat basah akar
(g)
Berat kering
tajuk (g)
Berat kering akar
(g) P0 (tanpa
bakteri) 0,78 0,45 0,94 0,43 1 0,5 0,69
P1 (PP03) 0,89 0,83 0,83 0,77 0,85 0,64 0,80
P2 (RG08) 0,87 1 0,70 0,74 0,62 0,64 0,76
P3 (PI05) 0,94 0,48 0,85 0,89 0,77 0,71 0,77
P4
(PP03+RG08) 0,93 0,90 0,86 0,90 0,85 0,71 0,85
P5
(PP03+PI05) 0,92 0,77 0,56 0,40 0,62 0,43 0,61
P6
(RG08+PI05) 0,95 0,80 0,78 0,91 0,69 0,64 0,80
P7
(PP03+RG08 +PI05)
1 0,74 1 1 1 1 0,95
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian dapat diambil kesimpulan sebagai berikut:
a. Bakteri yang berhasil diisolasi dari rhizosfer tumbuhan Graminae pantai Sialang Buah adalah 20 isolat. Bakteri pelarut fosfat yang didapatkan sebanyak 6 isolat, bakteri pengikat nitrogen sebanyak 6 isolat dan bakteri penghasil IAA yang didapatkan sebanyak 8 isolat.
b. Indeks pelarutan fosfat terbesar yaitu 3,07 oleh isolat bakteri PP03, tebal pelikel terbesar yang terbentuk 8,25 mm oleh isolat RG01 dan konsentrasi IAA terbesar yang diperoleh yaitu 25,25 ppm oleh isolat PI05. Akan tetapi dari hasil uji kombinasi kemampuan masing-masing isolat bakteri, isolat yang potensial dalam melarutkan fosfat, mengikat nitrogen dan menghasilkan hormon IAA yaitu isolat PP03, RG08 dan PI05.
c. Isolat bakteri dengan perlakuan P7 (PP03 + RG08 + PI05) dapat meningkatkan pertumbuhan tanaman padi (Oryza sativa L.).
5.2 Saran
Perlu dilakukan penelitian lebih lanjut tentang identifikasi dari isolat bakteri pelarut fosfat, pengikat nitrogen dan penghasil IAA.
DAFTAR PUSTAKA
Aiman, Bambang, Didiet, 2013. Eksplorasi Mikrobia Rhizosfer Tumbuhan PantaiPotensial Sebagai Pemacu Pertumbuhan Tanaman. Program Studi Agroteknologi Fakultas Agroindustri UMBY. Yogyakarta.
A. E. Hesham, H. M. Mohamed, 2011. Molecular Genetic Identification of Yeast Strains Isolated from Egyptian Soils for Solubilization of Inorganic Phosphates and Growth Promotion of Corn Plants. Journal Microbiology Biotechnology. 21 (1): 55-61.
Alexander M, 1997. Introduction to Soil Mycrobiology. 467.2nd (Eds). John Wiley and Sons. New York.
Astuti RP, 2008. Rhizobakteria Bacillus sp. Asal Tanah Rizosfer Kedelai yang Berpotensi Memicu Pertumbuhan Tanaman. Tesis. Sekolah Pascasarjana IPB.
Bogor.
Azcon R, J. M. Barea, 1975. Synthesis of Auxins, Gibberellins and Cytokinins by Azotobactervinelandii and Azotobacterbeijerinckii Related to Effects Produced on Tomato Plants. Journal Plant Soil. 43: 609-619.
Azizah, 2011. Pengaruh Tiga Inokulan Bakteri Rhizobium Terhadap Pembentukan Bintil Akar Tanaman Kedelai (Glycine max L. Merril). Padang: Universitas Andalas.
Bhatt PV, Vyas BRM, 2014. Screening and Characterization of Plant Growth and Health Promoting Rhizobacteria. Journal of Current Microbiology and Applied Sciences
Chitraselvi P. E., Kalidass S., R. Kant, 2015. Efficiency of Rhizosphere Bacteria in Production of Indole Acetic Acid, Siderophore and Phosphate Solubilization.
International Journal of ChemTech Research. 7(6).
. 3(6): 139-155.
Chen Y.P., P.D. Rekha, A.B. Arun, F.T. Shen, W.A. Lai, C.C. Young, 2006.
Phosphate Solubilizing Bacteria from Subtropical Soil and Their Tricalcium Phosphate Solubilizing Ability. Journal AppliedSoil Ecology. 34:33-41.
Dewi I.R, 2007. Rhizobacteria Pendukung Pertumbuhan Tanaman. Padjajaran:
Universitas Padjadjaran.
Ekowahyuni L. P, 2002. Fenomena vivipary Labu (Isechiumedulejacgaswartz) Varietas Lokal Desa Barukupa Baeah Cipanas. Makalah Falsafah Sains.
Bogor: IPB.
Fallik, Okon, Y Epstein, A. Goldman, M. Fischer, 1994. Identification and Qualification of IAA and IBA Azospirillum brasilense Inoculated Maize Roots. Journal Soil Biology Biochemistry. 21: 147-153.
Glick B. R, 1995. The Enhancement of Plant Growth by Free Living Bacteria. Can.
Journal Microbiology. 41:109-117.
Gusniwati, N. M. E. Fatia, R. Arief, 2008. Pertumbuhan dan Hasil Tanaman Jagung Dengan Pemberian Kompos Alang-Alang. Jurnal Agronomi.12 (2): 23-27.
Hartono, Jumadi O, 2014. Seleksi dan Karakterisasi Bakteri Penambat Nitrogen Non Simbiotik Pengekskresi Amonium Pada Tanah Pertanaman Jagung (Zea mays L.) dan Padi (Oryza sativa L. ) Asal Kabupaten Barru, Sulawesi Selatan, Indonesia. Jurnal Sainsmat. 3(2): 143-153
Hipp A, 2008. Field Guide to Wisconsin Sedges. England: The University of Wisconsin Press.
Jeger M J, 2001. Biotic interaction and plant-pathogen association. In: Jeger M J, Spence N J. Biotic Interaction in Plant. Pathogen Association. New York (USA): CABL publishing.
Jumadi, Liawati, Hartono, 2015. Produksi Zat Pengatur Tumbuh IAA (Indole Acetic Acid) dan Kemampuan Pelarutan Fosfat Pada Isolat Bakteri Penambat Nitrogen Asal Kabupaten Takalar. Jurnal Bionature. 16 (1): 43-48.
Kusmawati I, 2013. Isolasi Bakteri Nitrifikasi pada Daerah Rhizosfer Tanaman Padi Lokal Pulu Mandoti (Oryza sativa L.) di Desa Salakunan, Kabupaten Enrekang, Sulawesi Selatan. Makassar: Universitas Hasanuddin.
Kustiyaningsih, 2003. Pengaruh Sumber Karbon TerhadapAktivitas Bakteri pelarut fosfat dari Isolat Tanah BukitBangkirai, Kalimantan Timur. Insitut Pertanian Bogor. [Skripsi].
Kyuma K, 2004. Paddy soil science. Kyoto Univ. Press and TransPacific Press.
Kyoto.
Lestari P, N.S Dwi, I.R. Eny, 2007. Pengaruh Hormon Asam Indol Asetat yang Dihasilkan Azospirillum sp. Terhadap Perkembangan Akar Padi. Jurnal Agro Biogen. 3: 66-72.
Lwin K, Myint M, Tar, Aung W, 2012. Isolation of Plant Hormone (Indole-3-Acetic Acid IAA) Producing Rhizobacteria and Study on Their Effects on Maize Seedling. Engineering Journal. 16 (5): 138-144.
M. J. Bailey, A. K. Lilley, T. M. Timms-Wilson, T. M. Spencer-Phillips.
2006.Microbial Ecology of Aerial Plant Surface. United Kingdom: CAB International.
Niswati A, Yusnaini S, Arif M, 2008. Populasi Mikroorganisme Pelarut Fosfat dan P-tersedia pada Rhizosfer Beberapa Umur dan Jarak dari Pusat Perakaran Jagung (Zea mays L.). Lampung: Universitas Lampung. 13 (2): 123-130.
Peterson P, Soreng R, 2007. Systematics of California Grasses (Poaceae). London:
University of California Press.
Purwaningsih S, 2009. Populasi bakteri Rhizobiumdi tanah pada beberapa tanaman dari Pulau Buton, Kabupaten Muna, Provinsi Sulawesi Tenggara. Jurnal Tanah Tropical. 14 (1): 65-70.
Premono E, Moawad M.A, Vleck P.L.G, 1996. Effect of Phosphate Solubilizing Pseudomonas Putida
Prayudyaningsih, Nursyamsi, Sari, 2015. Mikroorganisme Tanah Bermanfaat Pada Rhizosfer Tanaman Umbi Di Bawah Tegakan Hutan Rakyat Sulawesi Selatan. Pros Sem Nas Masy Biodiv Indon. 1(4): 954-959.
On The Growth Of Maize and Its Survival In The Rhizosphere, Indonesian. Journal Crop Science. 11: 13–23.
Rao S, 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. 353. Edisi ke 2.
UI Press, Jakarta.
Rubio M, Plata, Castillo J, Nieto P, 2000. Isolation of Enterobacteria, Azobacter sp., and Pseudomonas sp. Producers of Indole-3-Cetic Acid and Siderophores From Colombian Rice Rhizosphere. Review Latin Microbiology. 42:171-176. Richardson A E, 2001. Prospect For Using Soil Microorganisms To Improve The A
Quisition of Phosphorus By Plants. Aust. Journal Plant Physiology. 58: 797- 906.