MOOD STABILIZERS
SEBAGAI TERAPI ADJUVAN
PADA SKIZOFRENIA
Oleh
Dr. IGA ENDAH ARDJANA, Sp.KJ (K)
DIBAWAKAN PADA ACARA KONAS PSIKIATRI BIOLOGI MAKASAR
PROGRAM STUDI ILMU KEDOKTERAN JIWA
FK UNUD/RSUP SANGLAH DENPASAR
DAFTAR ISI
KATA PENGANTAR ... Error! Bookmark not defined.
DAFTAR ISI ... i
DAFTAR GAMBAR ... ii
DAFTAR SINGKATAN ... iii
BAB I PENDAHULUAN ... 4
1.1 Latar Belakang ... 4
1.2 Batasan Pembahasan ... 5
1.3 Tujuan dan Manfaat ... 6
BAB II TINJAUAN PUSTAKA ... 7
2.1 Skizofrenia ... 7
2.1.1 Sejarah Skizofrenia ... 7
2.1.2 Kriteria Diagnosis Skizoprenia ... 8
2.1.3 Epidemiologi Skizofrenia ... 10
2.1.4 Etiologi Skizofrenia ... 11
2.2 Mood Stabilizers sebagai Terapi Skizofrenia Masa Depan ... 21
2.2.1 Mood stabilizers ... 22
2.2.2 Jenis-Jenis Mood Stabilizers ... 23
2.2.3 Interaksi Mood Stabilizer dan Kontraindikasi ... 35
BAB III RINGKASAN ... 37
DAFTAR GAMBAR
Gambar 1. Dua Tokoh Psikiatri Dunia (Sadock n Sadock, 2013). ... 7
Gambar 2. Peta Alokasi Kerusakan Pada Otak Dan Gejala Yang Ditimbulkan Pada Skizofrenia (Stahl, 2013). ... 13
Gambar 3. Jalur Glutamat Di Dalam Otak Manusia (Stahl, 2013). ... 16
Gambar 4. Hipotesis Disfungsi Glutamat Pada Skizofrenia (Stahl, 2013). ... 18
Gambar 5. Hipofungsi NMDA Di Kortek Yang Dihubungkan Dengan Gejala Positif Pada Skizofrenia (Stahl, 2013). ... 19
Gambar 6. Hipofungsi NMDA Di Hipokampus Dan Gejala Positif Pada Skizofrenia ... 20
Gambar 7. Hipofungsi Reseptor NMDA Di Ventral Hipokampus Dan Gejala Negatif Pada Skizofrenia (Stahl, 2013). ... 20
Gambar 8. Skema Tingkatan Tatalaksana Skizofrenia dan Pemberian Mood Stabilizer Menurut TMAP (Argo et all, 2008). ... 22
Gambar 9. Mekanisme Kerja Mood Stabilizers (Stahl, 2013). ... 23
Gambar 10. Mekanisme Kerja Lithium (Stahl, 2013). ... 24
Gambar 11. Bentuk Molekul Asam Valproat (Stahl, 2013). ... 26
Gambar 12. Mekanisme Kerja Asam Valproat Pada Kanal Voltase Natrium . ... 27
Gambar 13. Mekanisme Kerja Asam Valproat Dengan GABA. Asam Valproat Memiliki Kemungkinan Efek Meningkatkan Transmisi Saraf GABA Dengan Menghambat Reuptake GABA, Peningkatan Produksi Atau Intervensi Metabolisme GABA Melalui GABA Transaminasi (GABA-T) (Stahl, 2013). ... 27
Gambar 14. Mekanisme Kerja Asam Valproat (Stahl, 2013). ... 28
Gambar 15. Bentuk Molekul Carbamazepin (Stahl, 2013)... 30
Gambar 16. Mekanisme Kerja Dari Carbamazepin (Stahl, 2013). ... 31
Gambar 17. Bentuk Molekul Lamotrigin (Stahl, 2013). ... 33
Gambar 18. Mekanisme Kerja Lamotrogin (Stahl, 2013). ... 34
DAFTAR SINGKATAN
CR : Controlled-Release
DSM-5 : Diagnostic And Statistical Manual Of Mental Disorder, Fifth Edition
DTNBP1 : Dystrobrevin Binding Protein-1 ECT : Electroconvulsive Therapy GABA : Gamma Aminobutyric Acid GSK-3 : Glycogen Syntase Kinase 3 LC : Locus Coeruleus
NMDA : N-Methyl-D-Aspartate PCP : Phencyclidine
TMAP : Texas Medication Algorithm Project VSSCs : Voltage Sensitive Sodium Channels VTA : Ventral Tegmental Area
BAB I
PENDAHULUAN
1.1 Latar Belakang
Skizofrenia adalah Gangguan jiwa yang berat penyakit dibidang psikiatri. Secara keseluruhan terdapat 1% dari populasi akan mengalami penyakit skizofrenia. Menurut data Riset Kesehatan Dasar (Riskesdas) 2013, prevalensi Skizofrenia di Indonesia mencapai 1,27 permil. Orang yang mengalami skizofrenia tidak mampu mengenali realitas sehingga orang dengan skizofrenia tidak mampu menjalankan kehidupan sehari-hari layaknya seperti orang normal. Manifestasi ini menyebabkan orang dengan skizofrenia memerlukan penanganan yang cepat dan tepat, sehingga prognosis pasien ini bisa menjadi lebih baik dan pasien mampu menjalankan kehidupan mendekati orang normal dan tidak jatuh ke fase deteorisasi mental yang menyebabkan kerugian semua pihak, baik itu keluarga maupun negara.
Pengobatan di bidang biologi pada pasien skizofrenia sampai saat ini telah berkembang dari electroconvulsive therapy (ECT), penggunaan pertama dari chlorpromazine pada tahun 1952 sebagai antipsikotik tipikal dan termasuk juga pengobatan antipsikotik generasi kedua (atipikal) dan yang terbaru adalah penggunaan mood stabilizers. Perkembangan pengobatan skizofrenia ini, diharapkan mampu membantu pasien skizofrenia mendapatkan kehidupan yang lebih baik dan sejahtera (Djimandjaja, 2010). Bagi klinisi ini merupakan tantangan untuk memutuskan pengobatan apa yang terbaik untuk penanganan skizofrenia, yang disesuaikan dengan risiko dan benefit pada pasien itu sendiri (Murray et all, 2008).
untuk mencoba memikirkan solusi untuk menemukan obat alternatif bagi pasien skizofrenia yang tidak optimal dengan pemberian antipsikotik ini.
Adanya bukti-bukti pengananan skizofrenia dengan memakai antipsikotik yang memakai dasar hipotesis dopamin tidak relevan lagi. Bukti-bukti tersebut menunjukkan dimana gejala inti skizofrenia, simptom negatif dan defisit kognitif, ternyata tidak berespon baik terhadap antipsikotik yang bersifat antagonis dopamin. Bukti-bukti ini mengakibatnya timbul dugaan bahwa gejala-gejala inti tersebut tidak berkaitan dengan aktifitas dopamin saja. Oleh karena itu, hipotesis dopamin tersebut direvisi kembali dengan memasukkan neurotransmiter lainnya, misalnya serotonin, glutamat dan Gamma Aminobutyric Acid (GABA) yang saling berinteraksi menyebabkan orang menderita skizofrenia (Amir, 2008).
Akhir-akhir ini, banyak dilakukan penelitian tentang obat-obat skizofrenia salah satunya obat golongan mood stabilizers. Mood stabilizers saat ini menjadi salah satu kunci dari terapi dari pasien skizofrenia yang tidak mampu diatasi hanya dengan pemberian antipsikotik saja. Secara internasional saat ini banyak dilakukan penambahan terapi termasuk mood stabilizers pada pasien skizofrenia sebagai terapi adjuvan (Kang Sim, 2011). Obat tambahan ini bisa digunakan untuk mengurangi gejala dan keluhan seperti agresifitas dan mania pada skizofrenia (Murray et all, 2008).
Penulis dalam tinjauan puskata ini akan membahas bagaimana peran mood stabilizers sebagai terapi adjuvan dalam penanganan skizofrenia dan juga akan dipaparkan bagaimana interaksi dengan obat antipsikotik serta efek sampingnya.
1.2 Batasan Pembahasan
1.3 Tujuan dan Manfaat
BAB II
TINJAUAN PUSTAKA
2.1 Skizofrenia
2.1.1 Sejarah Skizofrenia
Besarnya masalah klinis skizofrenia secara terus menerus telah menarik perhatian tokoh-tokoh utama psikiatri dan neurologi sepanjang sejarah gangguan ini. Dua tokoh tersebut adalah Emil Kraepelin (1856-1926) dan Eugen Bleuler (1857-1939). Sebelumnya Benedict Morel (1809-1873), seorang psikiater Prancis, menggunakan istilah demence precoce untuk pasien dengan penyakit yang dimulai pada masa remaja yang mengalami perburukan (Sadock & Sadock, 2013).
Gambar 1. Dua tokoh psikiatri dunia (Sadock, 2013).
menyatakan bahwa Kraepelin menganggap demensia precox memiliki perjalan penyakit dengan perburukan yang yang tak terhindarkan.
Tahun 1908, Bleuler mencetuskan istilah schizophrenia, yang menggantikan istilah demensia precox dalam literatur. Ia memilih istilah tersebut untuk menunjukkan adanya schisme (perpecahan) antara pikiran, emosi dan perilaku, namun tidak mengalami deteorisasi. Setelah Bleuler mencetuskan konsep ini, insidensi skizofrenia di Amerika Serikat meningkat hingga dua kali dibandingkan insiden di Eropa yang mengikuti prinsip Kraepelin dan setelah DSM-III diterbitkan, diagnosis skizofrenia di Amerika beralih ke konsep Kraepelin, namun istilah skizofrenia dari Bleuler diterima secara internasional untuk gangguan seperti ini. 2.1.2 Kriteria Diagnosis Skizofrenia
Kriteria Skizofrenia diambil Menurut Diagnostic And Statistical Manual Of Mental Disorder, Fifth Edition (DSM-5), yaitu dijelaskan bahwa untuk menegakkan diagnosis skizofrenia harus memenuhi kriteria :
A. jika ada dua atau lebih gejala dibawah ini, dimana gejala ini tampak secara signifikan selama period 1 bulan (atau kurang jika dilakuan terapi yang berhasil) dan sedikitnya satu dari gejala nomor 1,2, atau 3 :
1. Waham 2. Halusinasi
3. Bicara yang kacau
4. Perilaku katatonik atau aneh
5. Simptom negatif (emosi yang hilang, atau penarikan diri)
B. Adanya gangguan secara fungsi satu atau lebih fungsi penting, seperti bekerja, hubungan interpersonal, atau perawatan diri.
pada kriteria A dan juga termasuk gejala prodromal atau gejala sisa. Selama gejala prodromal atau gejala sisa, keluhan yang nampak berupa gejala negatif atau dua atau lebih gejala yang ada pada kriteria A.
D. Gangguan skizoafektif dan depresi atau gangguan bipolar dengan psikotik dikesampingkan jika 1) tidak ada gambaran depresi mayor atau episode manik yang terjadi pada fase aktif ini, atau 2), jika terjadi episode mood selama fase aktif, yang menunjukkan gejala minimal atau sebagian besar pada fase aktif atau gejala sisa pada penyakit saat ini.
E. Gangguan ini tidak diakibatkan oleh efek psikologi dari penggunaan obat seperti penyalahgunaan obat atau kondisi medis lain.
F. Jika ada riwayat gangguan spektrum autism atau gangguan komunikasi pada masa anak, diagnosis tambahan skizofrenia dibuat jika ada gejala dominan halusinasi atau waham minimal 1 bulan (atau kurang jika dengan keberhasilan pengobatan).
Beberapa gejala harus persisten secara berkelanjutan selama periode sedikitnya 6 bulan. Gejala prodromal sering mendahului pada fase aktif dan diikuti dengan gejala sisa yang ditandai dengan ringannya atau batas ambang mulai adanya halusinasi atau waham. Penderita bisa menampilkan kepercayaan disertai ideas of reference atau magis, mereka bisa memiliki persepsi yang tidak seperti biasanya (merasakan kehadiran seseorang yang tidak bisa dilihat nyata), kata-katanya mungkin tidak bisa dimengerti dan samar-samar, dan kebiasaan yang aneh tetapi tidak jelas (seperti : mengomel pada orang orang). Gejala negatif sering pada masa prodromal ini dan dapat menjadi berat. Individu yang aktif secara sosial dapat menjadi menarik diri dari kebiasaanya. Gejala-gejala ini sering menjadi petanda awal dari penyakit skizofrenia.
saat tidak adanya episode gangguan mood. Episode gangguan mood secara keseluruhan bisa terjadi hanya minimal dari fase aktif atau fase residual pada skizofrenia.
2.1.3 Epidemiologi Skizofrenia
Prevalensi dari penyakit skizofrenia ini kira-kira 0,3-0,7%, walaupun dilaporkan adanya variasi berdasarkan ras dan lintas negara. Di Amerika, angka prevalensi kejadian skizofrenia berkisar 1%, yang berarti ada satu orang yang menderita skizofrenia dalam 100 orang populasi, sedangkan menurut data Riset Kesehatan Dasar (Riskesdas) 2013, prevalensi skizofrenia di Indonesia mencapai 1,27 permil. Diantara orang dengan skizofrenia tersebut terdapat 14,3% yang dipasung oleh keluarganya sendiri. Penyakit ini peluang kejadiannya sama antara pria dan wanita, dan onset umur lebih awal terjadi pada pria dibandingkan dengan yang wanita.
Gambaran psikotik pada skizofrenia biasanya muncul pada masa remaja akhir dan pada pertengahan umur 30 tahun. Onset pada usia remaja jarang terjadi. Usia puncak sering munculnya skizofrenia pada episode pertama psikotik adalah awal umur 20-an untuk pria dan akhir 20-an untuk wanita. Skizofrenia yang muncul pada umur diatas 45 tahun, maka dikategorikan sebagai skizofrenia dengan onset lambat. Onset skizofrenia dengan umur dibawah 10 tahun dan diatas 60 tahun sangat jarang terjadi. Onset penyakit ini bisa terjadi secara tiba-tiba, tetapi sebagian besar terjadi secara perlahan dan gradual. Setengahnya dari kasus ini menunjukkan gejala depresi (Sadock & Sadock, 2013).
banyak penyakit kronis dengan eksaserbasi dan remisi dengan gejala yang aktif dan deteorisasi mental yang progresif (Sadock & Sadock, 2013).
2.1.4 Etiologi Skizofrenia
Menurut model diatesis-stress, skizofrenia terjadi karena gangguan integrasi dari faktor biologis, psikososial dan lingkungan. Seseorang yang rentan (diatesis), bila diaktifkan oleh pengaruh yang penuh tekanan antara faktor biologis, psikososial dan lingkungan, akan memungkinkan timbulnya skizofrenia. Komponen biologis dapat berupa kelainan genetik, gangguan fungsi atau struktural otak, neurokimia, infeksi, sedangkan psikologis (contohnya situasi keluarga yang penuh tekanan atau kematian kerabat dekat), dan komponen lingkungan seperti penyalahgunaan zat, stres psikososial, dan trauma (Amir, 2008 dan Sadock & Sadock, 2012).
1. Genetik
Faktor genetik yang turut menentukan timbulnya skizofrenia dibuktikan dengan penelitian tentang keluarga penderita skizofrenia. Angka kesakitan bagi saudara kandung adalah 7-15%; bagi anak dengan orangtua yang skizofrenia 7-16%; bila kedua orang tua menderita skizofrenia 40-68%; bagi kembar dua telur (heterozigot) 2-15%; bagi kembar satu telur (monozigot) 61-86%. Anak yang lahir langsung dari orang tua yang menderita skizofrenia 10 kali lipat akan lahir menjadi skizofrenia dibandingkan anak yang lahir dari orangtua normal (Sadock & Sadock, 2013).
Model pengaruh genetik pada penderita skizofrenia ternyata belum jelas diketahui dan tidak sesederhana hukum Mendel. Skizofrenia diperkirakan bahwa potensi untuk mendapatkan skizofrenia (bukan penyakit itu sendiri) melalui gen yang resesif. Potensi ini mungkin kuat, mungkin juga lemah, tetapi selanjutnya tergantung pada lingkungan individu itu, apakah akan terjadi manifestasi skizofrenia atau tidak (mirip halnya dengan faktor genetik pada penyakit diabetes). Hasil analisis tahun belakangan ini, mutasi gen Dystrobrevin Binding Protein-1 (DTNBP1) dan neureglin 1 telah diketahui sebagai penyebab timbulnya gejala negatif pada skizofrenia (Sadock & Sadock, 2013).
2. Hipotesis Perkembangan saraf
Studi autopsi dan studi pencitraan otak memperlihatkan abnormalitas struktur dan morfologi otak penderita skizofrenia, antara lain berupa berat otak yang rata-rata lebih kecil 6% dari pada otak normal dan ukuran anterior-posterior yang 4% lebih pendek, pembesaran ventrikel otak yang non spesifik, gangguan metabolisme di daerah frontal dan temporal dan kelainan susunan seluler pada struktur saraf di beberapa kortek dan subkortek tanpa adanya gliosis yang menandakan kelainan tersebut terjadi pada saat perkembangan.
Studi neuropsikologis mengungkapkan defisit dibidang atensi, pemilahan konseptual, fungsi eksekutif dan memori pada skizofrenia. Semua bukti tersebut melahirkan hipotesis perkembangan saraf yang menyatakan bahwa perubahan patologis gangguan ini terjadi pada awal kehidupan, mungkin sekali akibat pengaruh genetik dan kemudian dimodifikasi oleh faktor maturasi dan lingkungan (Sadock & Sadock, 2013).
3. Neurobiologi
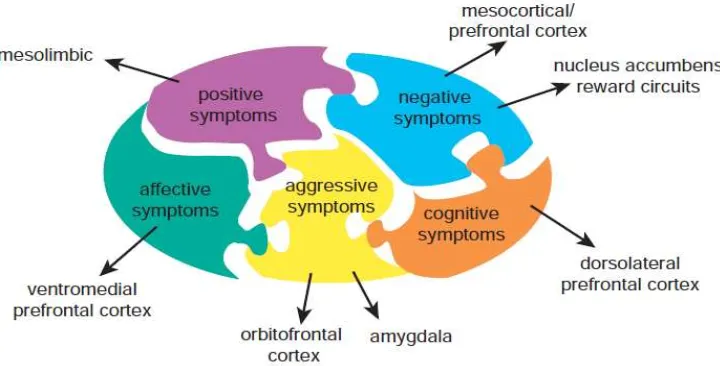
Gambar 2. Peta alokasi kerusakan pada otak dan gejala yang ditimbulkan pada skizofrenia (Stahl, 2013).
Secara spesifik, gejala positif dari skizofrenia dihipotesiskan oleh karena adanya malfungsi pada sirkuit mesolimbik, sementara gejala negatif karena adanya malfungsi di area mesokortek dan juga melibatkan area mesolimbik khususnya yang melibatkan nucleus acumbens yang diperkirakan menjadi bagian dari sirkuit reward dari otak, sehingga jika ada masalah dengan reward dan motivasi pada skizofrenia maka kelainannya diduga berasal dari area ini. Nucleus acumbens juga akan teraktivasi karena penggunaan zat yang tampak pada pasien skizofrenia. Gejala positif bisa menumpuk dengan gejala negatif yang ditandai dengan mulai adanya keinginan untuk merokok, penyalahgunaan obat dan alkohol, mungkin di hubungkan pada area otak ini.
Gejala kognitif pada skizofrenia mencakup berkurangnya perhatian dan berkurangnya proses informasi di otak yang bermanifestasi pada berkurangnya kelancaran berbicara (kemampuan berbicara spontan), bermasalah dengan pembelajaran secara serial, dan berkurangnya kewaspadaan untuk fungsi eksekutif (mempertahankan dan fokus perhatian, konsentrasi, prioritas dan perilaku sosial, kesulitan untuk memecahkan masalah). Fungsi-fungsi ini tidak mencakup gejala demensia dan gangguan memori yang dimiliki oleh penyakit alzheimer. Gejala kognitif pada skizofrenia sangat penting untuk ditegakkan karena dia sangat kuat berhubungan dengan fungsi nyata di dunia, lebih kuat dibandingkan gejala negatif.
Sangat sulit juga kita membedakan gejala disfungsi kognitif dari gejala afektif dan gejala negatif, tetapi peneliti mencoba untuk melokalisasi area yang spesifik dari disfungsi otak yang terkena untuk setiap gejala utama pada pasien skizofrenia ini dengan harapan hasil pengobatan pasien yang lebih baik.
Model ini sangat jelas dan sederhana karena setiap area otak memiliki beberapa fungsi dan setiap fungsi akan berpengaruh pada lebih dari satu area otak. Secara spesifik, pasien memiliki gejala yang unik dan respon yang berbeda terhadap pengobatan. Model ini dengan mengacu pada gejala yang tampak pada pasien dimana kita bisa menghubungkan dengan malfungsi kerusakan pada otak. Setiap area otak memiliki neurotransmiter yang berbeda-beda, reseptor, enzim, dan gen yang mengatur bisa dipakai pedoman para klinisi untuk mengobati pasien secara lebih maksimal (Stahl, 2013).
a. Hipotesis Dopamin
apakah hiperaktivitas neuron dopamin mengakibatkan banyaknya pengeluaran dopamin? Lebih banyak reseptor dopamin? Hipersensitifitas reseptor dopamin dengan neurotransmiter dopamin? Atau kombinasi dari semua mekanisme tersebut yang menyebabkan orang menjadi skizofrenia?. Keterlibatan neurotransmiter lain seperti serotonin, noradrenalin, GABA dan glutamat serta neuropeptida lain masih terus diteliti.
b. Hipotesis Abnormalitas Reseptor NMDA
Beberapa tahun terakhir di era 2000-an, adanya kerusakan reseptor N-Methyl-D-Aspartate (NMDA) yang mempengaruhi produksi neurotransmiter glutamat, yang dihipotesiskan sebagai kunci terjadinya patofisiologi dari skizofrenia. Hipotesis ini akan menjadi target pengobatan masa depan skizofrenia. Hipotesis ini menjelaskan bagaimana abnormalitas dari reseptor NMDA mempengaruhi hiperaktifas glutamat yang menyebabkan timbulnya gejala skizofrenia. Glutamat menjadi neurotransmiter mayor untuk eksitasi pada sistem saraf sentral dan sering menjadi kunci penting dalam pengaturan sistem eksitasi dalam otak.
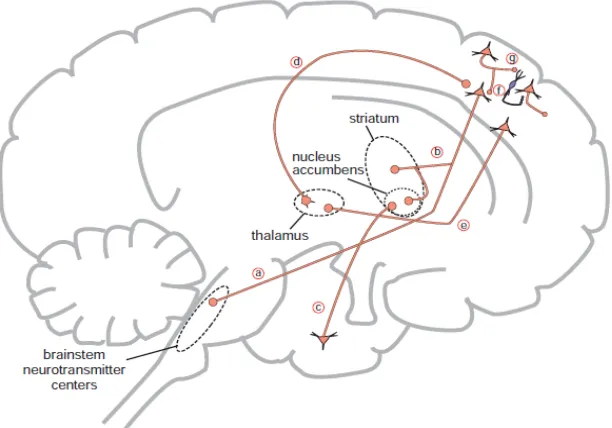
Glutamat adalah neurotransmiter eksitasi yang mengeksitasi neuron di dalam otak (master swicth). Ada 6 jalur glutamat dalam otak manusia, diantaranya :
a) Jalur Cortico-brainstem
Gambar 3. Jalur glutamat di dalam otak manusia (Stahl, 2013)..
b) Jalur Cortico-striatal
Jalur ini merupakan jalur glutamatergik yang kedua dari kortek piramidal menuju komplek striatum. Jalur ini diketahui sebagai jalur glutamat cortico-striatal menuju ke dorsal striatum atau jalur glutamat cortico-accumbens saat menuju ke area ventral striatum yang dikenal dengan nucleus accumbens. Jalur glutamat ini memutuskan neuron GABA dibagian lain dari komplek striatal yang disebut dengan globus pallidus.
c) Jalur Hippocampal-accumbens
Jalur glutamat yang lain, yang menjalar dari hipocampus menuju nucleus accumbens dan ini diketahui dengan jalur glutamat hippocampal-accumbens. Sama seperti glutamat pada jalur cortico-striatal dan cortico-accumbens, hippocampal-accumbens ini menuju nucleus accumbens dengan menghentikan neuron GABA yang berhubungan dengan globus Pallidus.
d) Jalur Thalamo-cortical
e) Jalur Cortico-thalamic
Jalur Glutamat yang ke-5 yang dikenal sebagai jalur glutamat cortico-thalamic, yang mengantar signal kembali ke talamus, sebagai respon reaksi dari informasi sensoris. f) Jalur Cortico-cortical (direct)
Komplek dari berbagai jalur glutamat cortico-cortical memperlihatkan kortek dengan satu kesatuan, neuron piramidal bisa mengeksitasi sesama yang lainnya yang ada di kortek cerebral melalui sinaps langsung dari neurotransmiter glutamat itu sendiri.
g) Jalur Cortico-cortical (indirect)
Di lain pihak, neuron piramidal yang satu bisa menghambat yang lainnya secara tidak langsung, melalui interneuron yang mengeluarkan GABA.
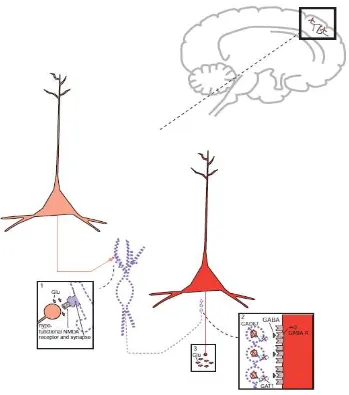
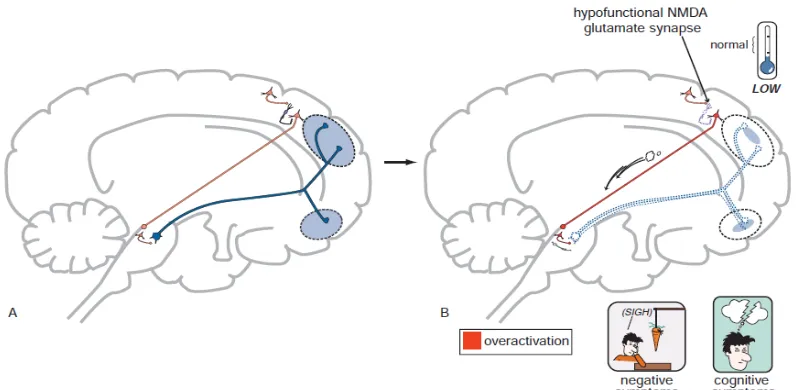
Pada Gambar 4, memperlihatkan bagaimana disfungsi glutamat sebagai hipotesis terjadinya skizofrenia. Tampak dari dekat neuron kortek pyramidal yang berhubungan dengan interneuron GABAergik dan hipofungsi reseptor NMDA ini. (1) Glutamat yang dikeluarkan dari neuron intrakortikal, akan tetapi reseptor NMDA yang akan mengikat glutamat itu sendiri mengalami hipofungsi, sehingga tidak terjadi efek maksimal oleh reseptor NMDA. (2) Hal ini menyebabkan berkurangnya pengeluaran GABA dari interneuron, sehingga stimulasi dari α2
GABA reseptor pada akson neuron glutamat lainnya tidak terjadi. (3) Saat GABA tidak berikatan dengan α2 GABA reseptor pada aksonnya, neuron pyramidal tidak akan dihambat,
Gambar 4. Hipotesis disfungsi glutamat pada skizofrenia (Stahl, 2013).
Hipofungsi reseptor NMDA menyebabkan abnormalitas pembentukan glutamat yang akan menyebabkan gejala psikotik pada seseorang yang menunjukkan gejala sama pada skizofrenia. Amfetamin yang merangsang pengeluaran dopamin, juga mengakibatkan gejala psikotik dengan ditandai adanya halusinasi dan waham yang dimasukan dengan gejala positif dari skizofrenia. Perbedaan dengan amfetamin yang hanya menyebabkan gejala positif, Phencyclidine (PCP) dan ketamin juga menyebabkan gejala kognitif, negatif, afektif, penarikan diri, dan gangguan fungsi eksekutif pada skizofrenia.
Telah terjadi kesalahan program genetik pada semua interneuron GABA yang dapat diidentifikasi dimana pada prefrontal kortek yang interneuron GABA ini banyak berikatan dengan kalsium yang berikatan dengan protein yang disebut degan parvalbumin. Ikatan parvalbumin dengan GABA interneuron ini yang merusak reseptor NMDA sehingga terjadi
hipofungsi (Stahl 2013).
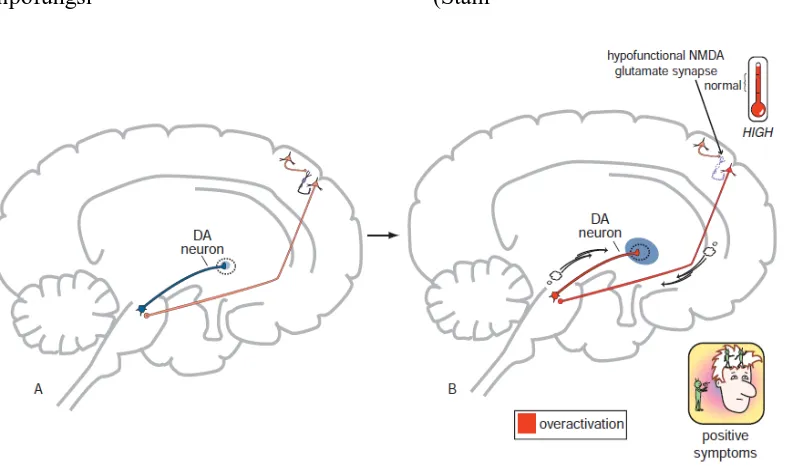
Gambar 5. Hipofungsi NMDA di kortek yang dihubungkan dengan gejala positif pada skizofrenia (Stahl, 2013).
Hipofungsi dari reseptor NMDA ini akan menyebabkan hiperaktifitas dari glutamat pada jalur cortico-brainstem neuron glutamat yang menginervasi neuron dopamin pada VTA menuju nucleus acumbens (area mesolimbik). Akibat dari hiperaktifitas glutamat ini, maka di VTA akan terjadi penurunan dopamin, sehingga akan terjadinya hiperaktifitas dopamin sebagai kompensasinya. Ini adalah dasar biologi terjadinya hiperaktifitas dopamin pada mesolimbik yang diasosiasikan dengan munculnya gejala positif pada skizofrenia.
Gambar 6. Hipofungsi NMDA di hipokampus dan gejala positif pada skizofrenia (Stahl, 2013).
Ini tampak berbeda dengan apa yang terjadi pada jalur glutamat cortico-brainstem. Jalur glutamat cortico-brainstem secara tidak langsung menginervasi sistem GABA interneuron, yang menginervasi neuron dopamin di mesokortek. Bisa kita bayangkan apa yang terjadi, jika neuron glutamat sangat aktif di VTA? maka akan terjadi hipoaktif dopamin di mesokortek. Ini sangat jelas apa yang dihipotesiskan untuk terjadinya skizofrenia. Hipoaktif dopamin pada mesokortek diasosiasikan sebagai munculnya gejala negatif pada skizofrenia. Patofisiologi jalur glutamat dan GABA ini nantinya akan menjadi dasar pengobatan skizofrenia masa depan (Stahl, 2013).
2.2 Mood Stabilizers sebagai Terapi Skizofrenia Masa Depan
Mood stabilizers merupakan kelas terapi lain yang digunakan untuk pengobatan gangguan skizofrenia dan bipolar (Dorothy, 2009). Lithium, asam valproat, carbamazepin dan lamotrigin, semuanya digunakan terapi adjuvan pada skizofrenia, walaupun masih sedikit penelitian tentang efikasi pengobatan pada psikosis (Rosenberg dan Salman 2007; Grunze 2008).
Kurang jelasnya patofisiologi pada penyakit psikiatri, lebih dari setengah psikiater memakai obat psikotropika kombinasi. Antipsikotik (tipikal atau atipikal) masih menjadi pusat utama dari pengobatan skizofrenia. Banyak penderita skizofrenia perlu kombinasi obat, termasuk dari kelas obat yang berbeda seperti antidepresan, anticemas, mood stabilizers dan beberapa obat lain untuk mengobati efek samping dari antipsikotik. Polifarmasi sangat sering, dimana 1/5-1/3 penderita skizofrenia tidak berespon terhadap antipsikotik (Stahl, 2013).
Texas Medication Algorithm Project (TMAP) dan konsensus skizofrenia Indonesia 2011 juga memberikan rekomendasi tingkatan pengobatan skizofrenia, dimana pada dasarnya pengobatan tetap didahului dengan memakai antipsikotik, jika berespon parsial bisa dilakukan kombinasinya, dan jika tidak mengalami perbaikan, maka pada tahap akhir bisa ditambahkan obat golongan mood stabilizers sebagai terapi adjuvan yang sesuai pada alur dibawah ini. (Argo, et al., 2008).
Mood stabilizers ini mampu menjaga keseimbangan mood pada pasien bipolar, tetapi penggunaan mood stabilizers ini telah berkembang ke berbagai penyakit psikiatri yang lainnya, seperti penggunaan mood stabilizers sebagai terapi adjuvan atau tambahan pada penderita skizofrenia, walaupun studi secara empiris pada kasus ini masih terbatas (Horowitz, 2014).
Gambar 8. Skema tingkatan tatalaksana skizofrenia dan pemberian mood stabilizer menurut TMAP (Argo et all, 2008).
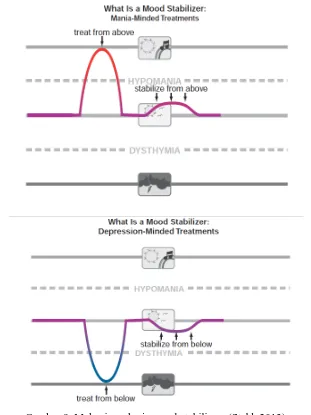
2.2.1 Mood stabilizers
Mood stabilizers adalah obat mampu mengobati dan menstabilkan mood pasien dari atas sehingga bisa mencegah mania sedangkan pada keadaan depresi, mood stabilizers mampu
Tahap I
Berikan 1 Antipsikotik Atipikal
Tahap II
Berikan 1 Antipsikotik Atipikal yang belum dicoba pada Tahap I
Tahap III CLOZAPINE
Tahap IV
CLOZAPINE ditambah 1 SGA atau 1 FGA atau ECT
TAHAP VI: TERAPI KOMBINASI FGA dan SGA, dua SGA,
ECT dan 1 SGA atau FGA,
Mood Stabilizers dan 1 SGA atau FGA Tahap V
menstabilisasi mood dari bawah keatas atau dengan kata lain mencegah mood yang depresi (Gambar 9).
Gambar 9. Mekanisme kerja mood stabilizers (Stahl, 2013).
2.2.2 Jenis-Jenis Mood Stabilizers
Adapun jenis-jenis mood stabilizers yang sering digunakan adalah :
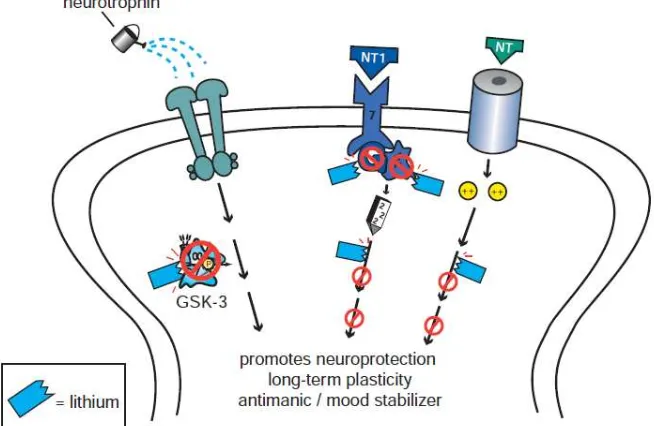
A. Litium, sebagai mood stabilizer klasik
dari Glycogen Syntase Kinase 3 (GSK-3) dan protein C kinase (gambar bagian kiri). Semua aktifitas dari lithium ini akan mempengaruhi terbentuknya proteksi pada saraf dan plastisitas jangka panjang dari sel saraf yang mampu mengurangi toksisitas dari hiperglutamat pada skizofrenia (Gabbard, 2015 & Stahl, 2013).
Gambar 10. Mekanisme kerja lithium (Stahl, 2013).
Guideline terbaru mengatakan lithium dipakai sebagai obat lini pertama pada pasien dengan episode akut bipolar dengan depresi, yang bisa bekerja sebagai mencegah bunuh diri (Leishouth, 2010). Beberapa orang dengan skizofrenia yang tidak bisa mendapat antipsikotik mungkin bisa efektif dengan pengobatan lithium tersendiri .Begitu juga pasien yang agresif, lithium disini berfungsi sebagai antiagresif yang bisa digunakan untuk menangani agresifitas pada skizofrenia (Sadock& Sadock, 2013).
Sediaan obat lithium ini ada yang 150 mg, 300 mg, 600 mg lithium karbonat (generik), lithium karbonat tablet (lithotabs) 450 mg Controlled-Release (CR)lithium karbonat capsul (Eskalith CR dan Lithonat), dan 8 mEq/5 mL lithium sitrat sirup.
konsentrasi di plasma darah 0,6-1 mEq/L. Dosis pemeliharaan bisa diberikan 2-3 kali sehari atau sekali dosis yang CR. Pemberhentian obat lithium harus secara pelan-pelan untuk mengurangi kekambuhan gejala mania (Sadock & Sadock, 2013).
Efek samping dari lithium berupa gejala intestinal seperti dispepsia, mual, muntah, dan diare, kenaikan berat badan, rambut rontok, tremor, mengantuk, dan menurunnya kognitif. Ada juga efek pemakaian jangka panjang berupa gangguan ginjal dan tiroid. Untuk mengatasi efek samping ini, sebaiknya dilakukan monitor level obatnya dalam plasma. Lithium ini biasanya dipakai dosis yang paling rendah dan jika hasilnya tidak memuaskan akan dikombinasi dengan mood stabilizers yang lainnya (Stahl, 2013). Tabel dibawah ini secara singkat dijelaskan spesifikasi dari obat lithium :
Lithium
Mekanisme kerja ‒ Proteksi dan plastisitas jangka panjang dari sel saraf yang mampu mengurangi toksisitas NMDA dari hiperglutamat Sediaan ‒ Lithium carbonat 150 mg, 300 mg, 600 mg
Dosis ‒ Dosis awal untuk dewasa adalah 300 mg 3 kali sehari. ‒ Jika ada gangguan fungsi ginjal, dimulai dengan 300 mg 1-
2 kali sehari.
‒ Dosis untuk stabilisasi biasanya 900-1200 mg per hari Efek samping ‒ Sering : gangguan intestinal (dispepsia, mual, muntah, dan
diare), kenaikan berat badan, rambut rontok, tremor, mengantuk, dan menurunnya kognitif.
‒ Efek jangka panjang : gangguan ginjal dan tiroid.
Interaksi Antipsikotik : hati-hati terjadi perburukan dari gejala ekstrapiramidal dan sindrom neuroleptik maligna
Antidepresan : sindrom serotonin, dengan penghambatan uptake serotonin
B. Asam Valproat
Gambar 11. Bentuk molekul asam valproat (Stahl, 2013).
Asam valproat sudah diciptakan sejak tahun 1800-an. Obat ini disebut asam valproat karena dengan cepat berubah menjadi bentuk asam saat masuk ke dalam perut. Asam valproat meningkatkan respon pengobatan terapi dengan antipsikotik pada penderita skizofrenia khususnya mengatasi gejala agresif dan agitasi. Asam valproat kurang bermanfaat jika monoterapi untuk mengatasi gejala psikotik pada skizofrenia, maka dari itu asam valproat biasanya sebagai terapi adjuvan pada skizofrenia (Versayanti, 2010, Sadock, 2013).
Gambar 12. Mekanisme kerja asam valproat pada kanal voltase natrium (Stahl, 2013).
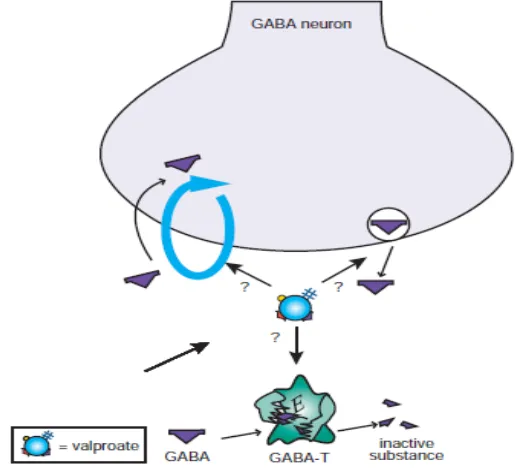
Gambar 13. Mekanisme kerja asam valproat dengan gaba. (Stahl, 2013).
yang dapat menjelaskan efek antimania pada asam valproat dan mengurangi gejala pada skizofrenia.
Saat mulai terapi dengan asam valproat, harus terlebih dahulu dilakukan tes fungsi hati, darah lengkap dan tes kehamilan pada wanita. Pemberian untuk kasus mania akut, dimulai dengan pemberian oral 20-30-mg/kgBB per hari. Jika pasien sangat gelisah maka bisa dimasukkan kedalam infus intravena. Untuk pemberian obat pertama kalinya, dosis yang dianjurkan mulai dosis kecil, yaitu 250 mg setelah makan dan bisa dilanjutkan sampai 3 kali sehari setelah melewati 3-6 hari. Sebagian besar orang mendapat dosis 1200 mg dan 1500 mg sehari dengan dosis terbagi dengan dosis maksimalnya adalah 2000 mg perhari. Jika diminum, akan mulai diserap dalam waktu 2 jam dan waktu paruh plasmanya 6-16 jam (Semple, 2010). Sediaan yang tersedia di Indonesia yaitu asam valproat yang 125 mg, 250 mg, dan 500 mg. Jika gejala sudah teratasi maka bisa diminum sekali sebelum tidur. (Sadock & Sadock, 2013).
Gambar 14. Mekanisme kerja asam valproat (Stahl, 2013).
badan, dan rambut rontok. Masalah efek samping yang serius dapat dicegah dengan menurunkan dosis obat, dan bila perlu setelah diturunkan dikombinasi juga dengan mood stabilizers lainnya.
Obat ini juga menyebabkan terganggunya fungsi hati dan pankreas, menimbulkan toksik bagi janin (defek pada saraf), gangguan metabolisme tubuh serta kemungkinan terjadinya amenorea dan kista ovarium jika diberikan pada anak wanita. Pada wanita juga sering didapatkan efek gangguan pada menstruasi, hiperandrogenism, obesitas dan resisten hormon insulin pada pemberian asam valproat ini.
Metabolisme dari asam valproat ini terjadi pada sitokrom P-450 di sel hati. Asam valproat memiliki kemampuan untuk menghambat pemecahan obat yang dimetabolisme di hati sehingga asam valproat sebaiknya tidak diberikan pada orang dengan gangguan hati (Murray, 2008).
Asam valproat
Mekanisme kerja ‒ Merubah sensitifitas ion kanal natrium dengan menghambat kerja enzim yang mengatur masuknya ion natrium, dan blockade langsung pada kanal natrium, sehingga ion natrium berkurang masuk kedalam sel yang menyebabkan berkurangnya eksitasi glutamat (efek antimania)
‒ Meningkatkan pengeluaran GABA dengan menghambat reuptake GABA, dan memperlambat inaktifasi GABA pada sel GABAnergik
Sediaan ‒ 125mg, 250 mg, 500 mg (depakote), ikalep 300 mg
Dosis ‒ Pemberian pertama kali dianjurkan mulai dosis kecil, yaitu 250 mg setelah makan dan dilanjutkan sampai 250 mg 3 kali sehari setelah 3-6 hari.
‒ Sebagain besar orang mendapat dosis 1200 mg dan 1500 mg sehari dengan dosis terbagi.
Efek samping ‒ Sering : gangguan pencernaan (mual, muntah dan mengantuk), penambahan berat badan, dan rontok.
‒ terganggunya fungsi hati dan pankreas, toksik bagi janin (defek pada saraf), kemungkinan terjadinya amenorea dan kistik ovarium jika diberikan pada anak wanita.
‒ Pada wanita juga sering didapatkan efek gangguan pada menstruasi, hiperandrogenism, obesitas dan resisten hormon insulin
Interaksi Antipsikotik : Meningkatkan sedasi, ekstrapiramidal sindrom, delirium dan stupor (pada beberapa kasus)
Antidepresan : Meningkatkan konsentrasi dalam plasma (amitriptilin dan fluoxetin)
Antikonvulsan : Menurunkan serum asam vaproat (carbamazepine)
C. Carbamazepin
Gambar 15. Bentuk molekul carbamazepin (Stahl, 2013).
Carbamazepin dimetabolisme pada enzim sitokrom P-450 dan meningkatkan mekanisme kerja dari enzim hati CYP tipe 3A4. Peningkatan dosis boleh diberikan setelah pengobatan dilakukan beberapa bulan (Ketter et al.,1999; Moseman et al.,2003). Metabolism dari carbamazepin mungkin dipengaruhi oleh gangguan fungsi hati. Dosis terapi pada darah untuk pengobatan akut mania atau episode campuran diperlukan sekitar 4-12 ug.ml. Konsentasi dalam plasma tercapai setelah 4-8 jam dan waktu paruh di dalam plasma 18-55 jam (Semple, 2010).
Gambar 16. Mekanisme kerja dari carbamazepin (Stahl, 2013).
Target dosis untuk mengatasi mania dari carbamazepin ini adalah 1200 mg per hari, walaupun ada variasinya di setiap Negara. Carbamazepin biasa diperlukan dosis 3-4 kali sehari dan obat yang Extended-Release (XR) lebih di utamakan karena cukup diminum 1-2 kali sehari. Salah satu sediaan carbamazepin generik adalah 100 mg, 200 mg, 400 mg, tegretol 100 mg dan 200 mg dan bentuk carbamazepin lepas lambat adalah Extended-Release (XR) carbatrol yang tersedia dalam kemasan 100, 200, 300 mg tablet.
saja terjadi, seperti kelainan darah seperti anemia aplastik dan agranulositosis, hepatitis dan reaksi kulit yang serius. (Sadock & Sadock, 2013).
Berlawanan dengan lithium dan asam valproat, carbamazepin tidak menyebabkan kenaikan berat badan. Kebanyakan efek samping penggunaan carbamazepin ini terjadi jika plasma level diatas 9 ug/mL. Efek yang sangat berat sering juga terjadi seperti agranulositosis, anemia aplastik, gangguan fungsi hepar, hipersensitifitas sistemik, gangguan ginjal, gangguan konduksi jantung, psikosis, Steven-Johnson syndrome, trombositopenia dan pankreatitis. Efek samping ini diatasi dengan pemeriksaan test fungsi hepar, ginjal dan elektrolit (Semple 2010 & Murray, 2008).
Carbamazepin
Mekanisme kerja ‒ memblok VSSCs, langsung pada sisi yang membuka kanal ion dari VSSCs sub unit α.
‒ Memperbaiki fungsi NMDA Glutamate-Receptor Channels
Sediaan ‒ 100 mg, 200 mg, 300 mg tablet
Dosis ‒ Target dosis untuk mengatasi mania ini adalah 1200 mg per hari, walaupun ada variasinya di setiap negara. ‒ Pengobatan diperlukan dosis 3-4 kali sehari dan obat yang
lepas lambat (XR) cukup diminum 1-2 kali sehari.
Efek samping ‒ Efek samping yang paling sering adalah ganguan gastrointestinal yang ringan seperti mual, muntah, konstipasi, diare, anoreksi dan gangguan pada saraf pusat (diplopia, lemas, pusing, tremor, ataxia, penglihatan kabur).
‒ Efek berat bisa saja terjadi, seperti kelainan darah seperti anemia aplastik dan agranulositosis, hepatitis dan reaksi kulit yang serius.
ginjal, gangguan konduksi jantung, psikosis, Sindrom Steven-Johnson, trombositopenia dan pankreatitis
Interaksi ‒ Carbamazepin menurunkan efek obat dalam plasma (olanzapin, quetiapin, aripriprazol, clozapin, lamotrigin, asam valproat, haloperidol, alprazolam, clonazepam, amitriptilin, fluphenazin)
D. Lamotrigin
Lamotrigin ditetapkan sebagai mood sta bilizers dengan mekanisme kerjanya yang saling melengkapi dengan obat carbamazepin yang sama-sama bekerja pada kanal VSSCs, dan obat ini yang tidak disarankan untuk gejala mania pada bipolar karena kemungkinana mekanisme kerjanya tidak kuat untuk memblok kanal natrium, atau perlu waktu yang panjang untuk memberikan efek dari obat ini untuk mengatasi gejala mania, sedangkan secara umum diperlukan respon obat yang bekerja dengan cepat.
Gambar 17. Bentuk molekul lamotrigin (Stahl, 2013).
Pada penelitian klinis, pemberian lamotrigin dianjurkan diatas 200 mg per hari. Kebanyakan pasien mendapat 100 mg dan 200 mg per hari, namun hasil ini masih belum konsisten. Jika diminum, konsentrasi puncak diplasma akan terjadi dalam waktu 1-5 jam, dan waktu paruhnya 24 jam (Semple, 2010). Sediaan obat yang ada dipasaran mulai dari 25 mg, 100 mg, 150 mg dan 200 mg tablet. Obat yang bisa dikunyah juga tersedia dalam dosis 2,5 dan 25 mg. Obat ini tidak dianjurkan pada umur dibawah 16 tahun (Sadock & Sadock, 2013).
Gambar 18. Mekanisme kerja lamotrogin (Stahl, 2013).
Efek samping yang paling sering dari pemberian lamotrigin ini adalah pusing, ataxia, somnolen, pandangan kabur, mual, namun ringan. Penurunan kognitif dan nyeri sendi dan punggung dilaporkan sering terjadi. Efek lainnya dari obat ini bisa menyebabkan Sindrom Steven Johnson, tetapi sangat jarang. Reaksi rash pada kulit bisa terjadi, tetapi bisa diminimalisasi dengan pemberian obat secara titrasi yang sangat pelan selama fase inisiasi pemberian obat ini. Tabel dibawah menjelaskan akan spesifikasi dari obat lamotigin untuk lebih mudah dimengerti :
Mekanisme kerja ‒ Memblok kanal natriun dan beberapa reaksi tambahan dari sinaps sel menyebabkan pengurangan eksitasi glutamat Sediaan ‒ 25 mg, 100 mg, 150 mg dan 200 mg tablet
Dosis ‒ 200 mg per hari
Efek samping ‒ Paling sering adalah pusing, ataxia, somnolence, pandangan kabur, mual, namun ringan, penurunan kognitif dan nyeri sendi dan punggung
‒ Efek lainnya dari obat ini bisa menyebabkan Sindrom Steven Johnson, tetapi sangat jarang.
Keunggulan ‒ Tidak menyebabkan mengantuk, penambahan berat badan dan efek metabolik lainnya
Interaksi ‒ Lamotrigin menurunkan plasma level 25% obat asam valproat
‒ Lamotrigin jika dikombinasi dengan carbamazepin, konsentasinya berkurang 40-50%
2.2.3 Interaksi Mood Stabilizer dan Kontraindikasi
Pasien yang mendapatkan tambahan mood stabilizers rata-rata berusia muda, karena kemungkinan pasien muda lebih banyak gejala positif dan meningkatnya agresifitas atau perilaku impulsif. Pada pasien geriatri, banyak studi menunjukkan adanya efek samping yang lebih banyak seperti jatuh, infeksi, gangguan gastrointestinal (Horowitz, 2014). Selama kehamilan, sebagian besar mood stabilizers yang juga bekerja sebagai antikonvulsan (asam valproat dan carbamazepine) dan lithium memiliki risiko tinggi untuk toxisitas terhadap fetus. (Stahl, 2013).
mitokondria, sehingga adanya defek mitokondria pada penderita skizofrenia bisa diperbaiki dan akhirnya bisa mengurangi gejala skizofrenia itu sendiri (Corena M et all, 2013).
Penggunaan kombinasi aripiprazol dengan lithium atau asam valproat mampu mengurangi relaps gangguan mood pada kasus mania bipolar I yang bisa diaplikasikan juga untuk mengurangi relaps skizofrenia jangka panjang (Marcus, 2011).
Pemberian carbamazepin harus diperhatikan apabila dikombinasi dengan obat antipsikotik seperti haloperidol, fluphenazin, clozapin, olanzapin, quetiapin dan aripriprazol. Obat ini jika diberikan bersamaan dengan carbamazepin maka akan terjadi hiperaktivasi oleh enzim sitokrom P-450 tipe 3A4, yang menyebabkan peningkatkan metabolisme obat antipsikotik tersebut, sehingga obat tersebut akan menjadi cepat dibuang keluar oleh tubuh. Pemberian carbamazepin dengan obat-obatan tersebut, baik antipsikotik tipikal dan atipikal tidak direkomendasi (Amir, 2008, Stahl, 2013 & Sadock, 2013). Interaksi obat carbamazepin dengan dapat menurunkan kadar haloperidol sebanyak 50-60% (Monaco & Cicolin, 1999).
Gambar 19. Carbamazepin Menginduksi Enzim Sitokrom P-450 tipe 3A4 (Stahl, 2013).
Gejala klinis, resiko genetik, epidemiologi dan patofisiologi neurotransmiter yang tampak pada skizofrenia, sering overlapping dengan gangguan bipolar, maka dari itu untuk penanganan skizofrenia dengan bipolar penatalaksanaanya juga hampir sama. Sekitar 60% pasien bipolar yang overlapping dengan skizofrenia, menurut Kraepelin, ini merupakan proses yang berkelanjutan dari bipolar untuk menjadi skizoafektif dan terakhir jatuh menjadi skizofrenia (Bambole, 2013).
Berikut ini beberapa rekomendasi terapi kombinasi pemberian antipsikotik dan mood stabilizer yang ideal untuk penanganan skizofrenia yang tidak optimal dengan pemberian antipsikotik saja. Jika pasien menunjukkan gejala positif yang tumpang tindih dengan gejala mania pada bipolar maka first line terapinya adalah dengan pemberian Antipsikotik Atipikal (AA) atau kombinasi valproat/lithium dengan antipsikotik atipikal (risperidon, quetiapin, olanzapin, atau aripiprazol). Tidak di rekomendasi pemberian kombinasi carbamazepin dengan antipsikotik atipikal (risperidon, olanzapin quetiapin ataupun aripiprazol).
Jika yang menonjol gejala negatif, yang tumpang tindih dengan gejala depresi pada bipolar, maka dapat diberikan first line terapi dengan kombinasiquetiapin/ Olanzapin dengan SRRI dan jika tidak berespon optimal bisa diberikan kombinasi
valproat/lithium dengan lurasidone (second line) atau valproat/lithium dengan tricyclic antidepresan dan quetiapine dikombinasi dengan lamotrigine (third line
BAB III
RINGKASAN
Patofisiologi yang terbaru telah diketahui bahwa adanya abnormalitas reseptor NMDA yang mempengaruhi jalur glutamat, secara tidak langsung menyebabkan terjadinya skizofrenia. Teori ini mampu menjelaskan terjadinya gejala positif dan negatif pada skizofrenia.
DAFTAR PUSTAKA
1. Amir, Nurmiati. 2009, ‘Interaksi Neurotransmiter pada skizofrenia dan implikasi terapeutiknya’, Perjalanan panjang skizofrenia, Yayasan Kesehatan Jiwa Dharmawangsa, Jakarta dan dibawakan pada kongres internasional WPA regional meeting ‘Mental Health Disaster : Beyond Emergency Respone’, Nusa Dua, Bali, Indonesia
2. Argo, T., Crismon, M., Miller, A. & Moore, T., 2008. Texas Medication Algorithm Project Procedural Manual: Schizophrenia Algorithm. Texas Department of State Health Services. 3. Bambole V., Johnston M., Shah N., Sonavane S., Desouza A., Shrivastava A., 2013,
Symptom overlap between schizophrenia and bipolar mood disorder: Diagnostic issues.
Open journal of Psychiatry, Mumbai, India page 8-15.
4. Corena M, Walss-Bass C, Oliveros A, Villegas A.G. Ceballos C. Charlesworth C.M. 20013. New Model of action for mood stabilizers: Phosphoproteome from rat Pre-Frontal Cortex Synaptoneurosomal Preparations. Plos one Journal. www.plosone.org.
5. Diagnostic and statistical manual ofmental disorders fifth edition (DSM-5). 2013. American Psychiatris Assosiacion. Washington DC, USA
6. Dorothy, Choinski M, Mhicael J, Gasior. 2009. Mood stabilizer increase prepulse inhibition in DBA/ 2NCrl mice. Psychopharmacology. Springer Journal. USA. Page 369-377
7. Gabbard G., 2015. Treatment of Psychiatric disorder DSM-5 edition. New York University. Washington DC. USA
8. Horowitz E, Bergman L.C., Ashkenazy C, Moscona I, Grinvald H, Magnezi R, 2014, ‘Off
label use of Sodium Valproate for Skizoprenia’, Plos One Journal, Volum 9, Israel.
9. Kang Sim, Kian Hui Yioung, et all. 2011. Adjunctive mood stabilizer treatment for hopspitalized schizophrenia patients: Asia psychotropic prescription study (2001-2008). International journal of Neuropshicopharmacology. Page 1157-1164.
10.Leishout R.J. and MacQueen M. 2010, Efficacy and acceptability of mood stabilizers in the treatment of acute bipolar depression : systematic review. BJPsych Journal. p266-273. 11.Marcus R., Khan A., Rollin L, Morris B, Timko K, Carson W, et all. 2011, Efficay of
Aripiprazole adjunctive to lithium or valproat in the long term treatment of patient with
bipolar I disorder with an inadequate response to lithium and valproate monotherapy:
12.Murray, R.M. et all, 2008. Essential Psychiatry fourth edition. Cambride University Press, United States of America, p. 586.
13.Rapat kerja consensus nasional terapi gangguan bipolar, 2010. Panduan Tatalaksana Gangguan bipolar Pokja SPM dan Seksi Bipolar PDSKJI. Jakarta
14.Sadock, B.J. and Sadock, V.A. 2003. Kaplan and Sadock’s Synopsis of Psychiatry ninth edition. Philadelphia, USA. Pippincot Williams and Wilikins p.623-631
15.Semple D. dan Smyth R., 2010. Oxford Handbook of Psychiatry second edition. Oxford University Press. USA
16.Stahl, Stephen M. 2013. Stahl’s Essential Psychopharmacology Neuroscientific Basis and Practical Application fourth edition. New York. Cambrige Medicine Press.
17.Triananda K., Di Indonesia terdapat 1,27 permil orang dengan skizofrenia. www.berita satu.com, akses 23 November 2013.
18.Versayanti S., 2010, Berbagai tantangan pada pengobatan skizofrenia. Kepatuhan dan Rehabilitasi Kognitif sebagai penentu keberhasilan terapi skizofrenia dalam Majalah Jiwa Psikiatri. Yayasan Kesehatan Jiwa Dharmawangsa, tahun XLIII no.3 September 2010. Jakarta hal 1-24.
19.Widyawati Ika, 2011, Penatalaksanaan Skizoprenia Masa Anak dan Gangguan Bipolar Masa Kanak, Pertemuan Nasional Akeswari II, 5-7 Mei 2011, Hotel Inna Garuda, Yogyakarta.