LAPORAN AKHIR
RISET INVENSI UDAYANA
TAHUN I
PENGEMBANGAN FORMULA
PLANT GROWTH PROMOTING
RHIZOBACTERIA
UNTUK MENGINDUKSI KETAHANAN
TERHADAP PENYAKIT BLAS DAN MENINGKATKAN HASIL
TANAMAN PADI LOKAL BALI
Tim Peneliti
Prof.Dr.Ir. Dewa Ngurah Suprapta, M.Sc./0028115802
Khamdan Khalimi, SP., M.Si./0001047805
Drs. Anak Agung Ketut Darmadi, M.Si./0015016801
Dibiayai oleh
DIPA PNBP Universitas Udayana
Sesuai dengan Surat Perjanjian Penugasan Pelaksanaan
Penelitian
Nomor : 246-361/UN14.2/PNL.01.03.00/2015, tanggal 21 April
2015
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS UDAYANA
2015
Pengembangan Formula Plant Growth Promoting Rhizobacteria untuk Menginduksi Ketahanan terhadap Penyakit Blas dan Meningkatkan Hasil
Tanaman Padi Lokal Bali
ABSTRAK
Development of Plant Growth Promoting Rhizobacteria Formula to Induce
Resistance Against Blast Disease and Increase the Yield of Rice Bali Local
Variety
ABSTRACT
DAFTAR ISI
1.1. Latar Belakang Permasalahan... 1
1.2. Tujuan Khusus... 2
1.3. Urgensi (Keutamaan) Penelitian... 2
1.4. Luaran Penelitian... 5
BAB II. TINJAUAN PUSTAKA... 6
2.1. Keragaman Genetik Padi... 6
2.2. Penyakit Blas dan Upaya Pengendaliannya... 7
2.3. Plant Growth Promoting Rhizobacteria... 10
2.4. Ketahanan Terinduksi... 12
BAB III. METODE PENELITIAN... 14
3.1. Koleksi Benih Padi Lokal Bali... 14
3.2. Uji Ketahanan terhadap Penyakit Blas... 14
3.3. Isolasi Rizobakteri... 16
3.4. Uji Kemampuan Rizobakteri untuk Memacu Pertumbuhan Bibit Padi Lokal Bali... 16
3.5. Pengujian Kemampuan Rizobakteri untuk Menginduksi Ketahanan... 17
3.6. Identifikasi Rizobakteri... 18 BAB IV.
4.1
HASIL PENELITIAN ... Varietas Padi Lokal Bali yang Dikoleksi ...
4.2 4.3 4.4 4.5 4.6. BAB. V
5.1. 5.2.
Ketahanan terhadap Penyakit Blas
Isolat Rizobakteri yang Diperoleh ... Isolat Rizobakteri sebagai PGPR ... PGPR yang Dapat Menginduksi Ketahanan ... Hasil amplifikasi DNA ... KESIMPULAN DAN TINDAK LANJUT ... Kesimpulan ... Tindak Lanjut ...
25 26 29 30 30 34 34 34 DAFTAR PUSTAKA...
LAMPIRAN
DAFTAR TABEL
Nomor
Tabel
Judul Halaman
4.1 Persentase bibit padi lokal Bali yang terinfeksi penyakit Blas setelah diinokulasi dengan spora jamur
Pyricularia oryzae ... 26 4.2 Daftar nama isolat rizobakteri yang diisolasi dari
rizosfer beberapa jenis tanaman di Bali ... 26 4.3
4.4
Daftar nama isolat rizobakteri yang dapat memacu pertumbuhan akar tanaman Padi Merah ...
Perbandingan persentase kemiripan gen 16S RNA rizobakteri isolat Al7Kla dengan beberapa sekuen DNA di Genbank menggunakan program BLAST ...
30
DAFTAR GAMBAR
Nomor Gambar Judul Halaman
4.1 Padi Cicih Medang Selem ... 20
4.2 Cicih Medang Putih ... 21
4.3 Padi Merah Penebel ... 22
4.4 Ketan Hitam (Injin) ... 23
4.5 Ketan Medang Selem ... 24 4.6
4.7
4.8
Padi Del ... Amplifikasi PCR gen 16S rRNA rizobakteri dengan primer 63F dan 1387R. M1= 1 kb DNA ladder (Thermo), Lane 1-4 berturut turut adalah isolat Al7Kla, O3.8, KdDDA2, OR3. M2 = 100 bb DNA ladder (Thermo) .... Pohon filogeni yang dibangun dari sekuen gen 16S RNA dari library Genbank bakteri yang telah diidentifikasi. Nilai Bootstrap sebesar 77% ...
25
31
BAB I
PENDAHULUAN
1.1. Latar Belakang Permasalahan
Indonesia memiliki banyak ragam varietas padi lokal yang tersebar di seluruh nusantara. Introduksi beberapa jenis varietas padi unggul menyebabkan jenis padi lokal mulai ditinggalkan dan diperkirakan sedikitnya 9.000 padi varietas lokal punah dari 12.000 varietas padi lokal yang dimiliki Indonesia. Hilangnya ribuan varietas padi lokal tersebut terjadi ketika lembaga penelitian padi dunia (IRRI) mengambil untuk dikembangkan menjadi varietas unggul (Adinata, 2003). Jumlah plasma nuftah padi lokal yang terdaftar di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian Departemen Pertanian hanya 3.800 plasma nuftah (Anwar, 2008).
Ada beberapa jenis padi lokal Bali yang dibudidayakan oleh petani Bali seperti varietas cicih gundil, ijo gading, cicih medang selem, beras merah, ketan, ketan hitam dan cicih. Secara umum, jenis padi lokal Bali memiliki umur dalam (panjang), batang relatif tinggi, leher malai relatif panjang dengan rasa nasi pulen dan disukai oleh konsumen. Walaupun demikian, tidak banyak petani Bali membudidayakan jenis padi lokal Bali karena produktivitasnya rendah dan umur panennya lebih panjang bila dibandingkan dengan varietas padi unggul. Produktivitas padi lokal paling banyak 4 ton per hektar dengan umur panen 5-6 bulan setelah tanam, sedangkan produktivitas padi unggul bisa mencapai lebih dari 7 ton dengan umur panen sekitar 3 bulan (Swatantra, 2013; Suprapta et al., 2014a). Rendahnya produktivitas padi lokal Bali disebabkan karena jenis padi ini tidak responsif terhadap pemupukan. Sifat ini kemungkinan disebabkan oleh sifat perakaran tanaman padi lokal yang memiliki jumlah bulu akar terbatas. Selain kurang responsif terhadap pemupukan, beberapa jenis padi lokal juga peka terhadap penyakit blas.Penyakit blas disebabkan oleh jamur Magnaporthe grisea
promoting rhizobacteria (PGPR) terbukti bisa meningkatkan jumlah bulu akar tanaman, meningkatkan hasil dan menginduksi ketahanan terhadap penyakit tertentu (Wei, 1991; Press et al., 1997; Palukaitis et al., 1992; Sherata et al., 2008; Khalimi, 2009; Suprapta et al., 2014b).
Berdasarkan fakta di atas, maka perlu dilakukan upaya intensif untuk dapat meningkatkan produktivitas tanaman padi lokal Bali agar jenis padi ini menguntungkan untuk dibudidayakan dan mencegah kepunahannya.
1.2. Tujuan Khusus
Berdasarkan latar belakang permasalahan yang telah dipaparkan di atas maka penelitian yang akan dilakukan ini bertujuan untuk :
1) Mengkoleksi padi lokal Bali yang masih dibudidayakan di berbagai daerah di Bali.
2) Melakukan karakterisiasi morfologi padi varietas lokal Bali yang masih dibudidayakan sampai saat ini.
3) Menguji ketahanan padi lokal Bali terhadap penyakit blas
4) Mendapatkan agen hayati berupa plant growth promoting rhizobacteria (PGPR) yang dapat meningkatkan jumlah bulu akar, meningkatkan hasil dan menginduksi ketahanan padi lokal Bali terhadap penyakit blas.
5) Menghasilkan formula PGPR yang berfungsi meningkatkan jumlah bulu akar, meningkatkan hasil dan menginduksi ketahanan padi lokal Bali terhadap penyakit blas.
6) Menghasilkan publikasi ilmiah pada jurnal internasional.
7) Menghasilkan hak paten formula PGPR yang sudah teruji pada skala lapangan untuk meningkatkan produktivitas padi lokal Bali.
1.3. Urgensi (Keutamaan) Penelitian
Jenis padi lokal dapat digunakan sebagai sumber gen untuk sifat-sifat tertentu yang diinginkan dalam upaya pemuliaan tanaman padi.
Tanaman padi lokal Bali merupakan bagian dari sumber plasma nuftah (sumber daya genetik) padi nasional yang sangat diperlukan untuk menghasilkan varietas padi unggul baru. Pada tahun 1970 telah dapat dikoleksi sebanyak 11.690 varietas padi lokal nusantara (Khush, 1996). Sebagian dari jenis padi lokal ini telah mengalami kepunahan akibat introduksi besar-besaran varietas padi unggul dan hibrida yang berumur pendek dan dengan daya hasil yang tinggi. Berdasarkan survei pendahuluan yang dilakukan pada bulan November sampai Desember 2014 di Kabupaten Tabanan, Gianyar, Buleleng dan Karangasem ditemukan sebanyak 5 (lima) jenis padi lokal Bali yaitu Cicih Medang Selem, Cicih Medang Putih, Beras Merah, Ketan Hitam (Injin), dan Ketan. Beberapa varietas yang sebelumnya pernah dibudidayakan dan cukup popular di kalangan petani Bali seperti varietas Ijo Gading dan Cicih Gundil belum diperoleh. Diketahui bahwa berbagai sifat yang dimiliki oleh varietas padi unggul dan padi hibrida sesungguhnya berasal dari sifat-sifat yang dimiliki oleh padi lokal. Oleh karena itu, bila padi lokal mengalami kepunahan maka akan terjadi kepunahan kekayaan sumber daya genetik bagi pengembangan varietas padi unggul. Perlu ada upaya secara terus menerus untuk mengidentifikasi masalah serta dirumuskan pemecahan masalah untuk melindungi, melestarikan dan memanfaatkan padi lokal Bali secara berkelanjutan.
Ada dua masalah yang akan ditemukan pemecahannya melalui penelitian ini yaitu masalah sifat padi lokal Bali yang kurang responsif terhadap pemupukan karena terbatasnya jumlah bulu akar, dan masalah kepekaan terhadap penyakit blas. Beberapa peneliti sebelumnya telah berhasil menemukan rizobakteri yang yang berfungsi untuk meningkatkan jumlah bulu akar, meningkatkan hasil dan menginduksi ketahanan tanaman terhadap penyakit tertentu (Wei, 1991; Press et al., 1997; Palukaitis et al., 1992; Sherata et al., 2008; Khalimi, 2009; Suprapta et al., 2014b).
fisik atau kimia yang dipicu oleh mikroorganisme dalam hal ini PGPR.. Ketahanan sistemik terinduksi atau systemic induced resistance terjadi akibat perlakuan rizobakteri berspektrum luas baik terhadap virus, bakteri maupun jamur (Murphy, 2000). Verhagen et al. (2006) melaporkan bahwa rhizobacteria
Pseudomonas aeruginosa yang diaplikasikan pada akar dapat menginduksi ketahanan tembakau terhadap infeksi Tobacco mosaic virus. Kishore et al. (2005) melaporkan bahwa rhizobakteria Pseudomonas sp. mampu menghasilkan hormon pemacu pertumbuhan tanaman yang dapat meningkatkan 9% berat kering tanaman jagung, sedangkan Salmonella liquefaciens meningkatkan 10% berat kering dibandingkan kontrol. Khalimi (2009) melaporkan bahwa rhizobakteria P. aeruginosa Paj yang diformulasikan dalam bentuk kompos dapat meningkatkan berat kering akar kedelai sebesar 67,52%, berat kering biomassa kedelai sebesar 224,6%, dan berat kering biji kedelai sebesar 232,2 % dibandingkan kontrol.
Kedua, PGPR merupakan rizobakteri yang diisolasi dari daerah perakaran tanaman padi dan seralia lainnya secara local sehingga tidak perlu dikhawatirkan akan menjadi pencemar lingklungan. PGPR yang dihasilkan mampu melakukan perbaikan terhadap sistem perakaran, terutama meningkatkan jumlah bulu akar tanaman padi sehingga mampu meningkatkan luas permukaan akar dan lebih efisien untuk menyerap unsur hara tanah. Selain itu, penggunaan formula PGPR akan dapat mengurangi penggunaan pupuk sintetis, sehingga potensi pencemaran lingkungan, khususnya perairan bisa dikurangi.
Ketiga, PGPR bisa menginduksi ketahanan tanaman padi terhadap penyakit blas, sehingga bisa mengurangi penggunaan pestisida sintetis, lebih murah, sederhana dan menguntungkan petani.
Keempat, formula PGPR yang dihasilkan bersifat non-patogen dan tidak membahayakan baik manusia maupun lingkungan.
1.4. Luaran Penelitian
Ada beberapa luaran yang ditargetkan untuk dihasilkan pada penelitian yang direncanakan berlangsung selama 3 (tiga) tahun yaitu :
1) Benih varietas padi lokal Bali yang masih dibudidayakan sampai saat ini oleh petani di beberapa daerah di Bali.
2) Data tentang karakteristik morfologi varietas padi lokal Bali yang masih ada sampai saat ini.
3) Data tentang ketahanan varietas lokal Bali terhadap penyakit blas yang disebabkan oleh jamur Pyricularia oryzae.
4) PGPR yang dapat memacu pertumbuhan bulu akar dan menginduksi ketahanan padi lokal Bali terhadap penyakit blas.
5) Formula PGPR yang siap diaplikasikan di lapangan untuk memacu pertumbuhan, menginduksi ketahanan terhadap penyakit blas dan meningkatkan hasil padi lokal Bali.
6) Paper yang diterbitkan pada jurnal ilmiah internasional minimal sebanyak 2 (dua) buah.
BAB II
TINJAUAN PUSTAKA
2.1. Keragaman Genetik Padi
Genus Oryza memiliki 22 spesies (Kush, 1997; Vaughan, 1994) tetapi jenis tanaman padi yang dibudidayakan di Asia umumnya tergolong spesies Oryza sativa. Dalam spesies Oryza sativa telah terbentuk populasi genotipe padi yang sangat beragam dari satu sentra produksi ke sentra produksi lainnya. Populasi genotipe yang homogen, unik dan stabil disebut sebagai varietas atau kultivar. Setiap varietas padi memiliki persamaan berbagai sifat, tetapi juga memiliki karakter yang unik. Adanya persamaan dan perbedaan sifat tersebut digunakan untuk mengetahui jauh dekatnya hubungan kekerabatan genetik antara varietas padi. Pengelompokan berdasarkan karakter yang sama merupakan dasar dalam pengklasifikasian varietas.
Berdasarkan perbedaan karakter morfologi dan wilayah adaptasi agroekosistem, Oryza sativa dibedakan menjadi tiga subspecies (Chang, 1988). 1. Subspesies Indica, umumnya tersebar di Negara-negara tropis.
2. Subspesies Japonica, menyebar di Negara-negara subtropis seperti Jepang, Korea, Eropa, Afrika, Australia, Amerika Utara dan Amerika Selatan.
3. Subspesies Javanica atau subjaponica atau Japonica tropis, atau indojaponica, menyebar di Jawa, Bali, dan Lombok. Misalnya Pandanwangi (Cianjur), Rojolele (Klaten), Ketan Bulu Putih (Garut). Padi Javanica juga dikenal dengan “padi bulu” yang telah digunakan oleh IRRI sebagai tetua donor dalam perakitan padi varietas unggul (IRRI, 1995).
Padi varietas lokal telah ditanam secara turun menurun oleh petani di suatu daerah dan telah beradaptasi dengan kondisi tanah dan iklim di daerah tersebut. Secara alami, varietas padi lokal telah teruji ketahanannya terhadap berbagai tekanan lingkungan serta hama dan penyakit sehingga merupakan aset yang sangat berharga bagi pemuliaan tanaman (Siwi dan Kartowinoto, 1989).
mengakibatkan terjadinya erosi genetik yaitu berkurangnya dan bahkan punahnya sejumlah varieas padi lokal yang memiliki daya adaptasi spesifik pada kondisi tertentu (Silitonga, 1998). Jumlah varietas padi lokal yang sudah dikoleksi pada tahun 1987 sebanyak 11.980 yang terdiri atas 8.855 padi sawah, 2.134 padi gogo dan 705 padi rawa. Sebagian besar merupakan golongan padi cere yaitu sebanyak 9.034 dan sebanyak 2.656 termasuk golongan padi bulu (Siwi dan Kartowinoto, 1989).
Berdasarkan survei pendahuluan yang dilakukan pada bulan November sampai Desember 2014 di Kabupaten Tabanan, Gianyar, Buleleng dan Karangasem ditemukan sebanyak 5 (lima) jenis padi lokal Bali yaitu Cicih Medang Selem, Cicih Medang Putih, Beras Merah, Ketan Hitam (Injin), dan Ketan. Beberapa varietas yang sebelumnya pernah dibudidayakan dan cukup populer di kalangan petani Bali seperti varietas Ijo Gading dan Cicih Gundil belum diperoleh.
2.2. Penyakit Blas dan Upaya Pengendaliannya
Penyakit blas dapat menginfeksi tanaman padi pada semua stadia pertumbuhan. Pada tanaman stadium vegetatif biasanya menginfeksi daun, disebut blas daun (leaf blast) dan pada stadium generatif, selain dapat menginfeksi daun juga menginfeksi leher malai yang disebut blas leher (neck blast) (Anonim, 2009). Gejala penyakit blas dapat muncul pada daun, batang, malai dan gabah, tetapi yang umum adalah pada daun dan leher malai.
menentukan ketebalan dan kekerasan dinding sel sehingga mempengaruhi terjadinya penetrasi patogen ke dalam jaringan tanaman. Pupuk nitrogen berkorelasi positif terhadap intensitas penyakit blas, dimana semakin tinggi pupuk nitrogne, semakin tinggi intensitas penyakit (Anonim, 2009). Bila periode basah lebih dari 5 jam, sekitar 50% konidium dapat menginfeksi jaringan tanaman dalam waktu 6-10 jam. Suhu optimum untuk perkecambahan konidium dan pembentukan apresorium adalah 25-28oC.
Keberhasilan pengelolaan penyakit blas pada padi dihasilkan oleh pendekatan yang komprehensif dengan menerapkan beberapa strategi antara lain teknik budidaya, penggunaan varietas tahan, dan penggunaan fungisida sintetis (TeBeest, 2007; Ghazanfar et al., 2009; Anonim., 2009; IRRI, 2010). Pengendalian penyakit blas yang sampai saat ini dianggap paling efektif adalah penggunaan varietas padi tahan, tetapi jamur Pyricularia oryzae sangat mudah untuk membentuk ras baru yang lebih virulen sehingga bisa mematahkan ketahanan padi terhadap penyakit blas. Jadi penggunaan varietas tahan sangat dibatasi oleh waktu dan tempat, artinya varietas yang semua tahan setelah ditanam beberapa musim akan menjadi peka, dan varietas yang tahan di satu tempat mungkin peka di tempat lain (Anonim, 2009). Mengingat ketahanan padi terhadap penyakit blas tidak bisa berlangsung lama, maka penggunaan varietas tahan perlu didukung dengan komponen pengendalian lainnya. Sekitar 40 gen untuk ketahanan terhadap blas telah diketahui, namun getotipe baru dari patogen berkembang sangat cepat sehingga mematahkan ketahanan inang (Zeigler et al., 1994). Pada beberapa situasi, penyakit blas bisa dikendalikan melalui penanaman beberapa varietas dengan ketahanan yang berbeda disertai dengan modifikasi teknik budidaya. Pengendalian blas malai (panicle blast) diperoleh melalui rotasi varietas padi (Zhu et al., 2000). Penggunaan galur majemuk yang terdiri atas beberapa galur yang membawa gen ketahanan yang berbeda sukses digunakan untuk mengendalikan penyakit blas di Jepang (Koizumi, 2001).
sehingga sangat sesuai dengan perkembangan penyakit blas. Menggenangi tanah sesering mungkin bisa efektif khususnya di daerah tropis (IRRI, 2010).
Penggunaan fungisida sintetis merupakan teknologi yang sangat praktis dalam mengatasi penyakit blas, namun sering menimbulkan efek samping yang tidak diinginkan diantaranya menimbulkan resistensi patogen dan pencemaran bagi lingkungan. Banyak jenis fungisida telah dikembangkan untuk mengendalikan penyakit blas, khususnya fungisida sistemik. Penggunaan fungisida dengan mekanisme kerja yang mirip dalam periode yang lama tidak dianjurkan, karena bisa menyebabkan munculnya populasi patogen yang resisten terhadap fungisida (Kim et al., 2008). Beberapa jenis fungisida sintetis yang sering digunakan untuk mengendalikan penyakit blas di Indonesia adalah Topsin 500 F, Topsin 70 WP, Kasumiron 25/1 WP dan Delsene MX 80 WP (Anonim, 2009). Ada dua teknik dasar yang dapat digunakan untuk mengelola penyakit tanaman dengan fungisida sintetis, yaitu perlakuan benih untuk mencegah infeksi pada bibit setelah berkecambah dan teknik menggunakan fungisida untuk mencegah infeksi pada daun dan malai selama masa pertumbuhan. Perlakuan fungisida bisa dilakukan sekali atau dua kali dengan menyemprotkan pada daun untuk melindungi malai ketika baru muncul (TeBeest et al., 2007).
Beberapa penelitian telah dilakukan untuk mengembangkan agen hayati untuk mengendalikan penyakit blas pada tanaman padi. Taguchi et al. (2003) menguji Bacillus subtilis strain IK-1080 sebagai agen hayati untuk mengendalikan penyakit blas pada padi. Ketika B. Subtilis IK-1080 dibiakan bersama-sama dengan jamur patogen penyakit blas (Pyricularia grisea) pada medium potato sucrose agar (PSA), pertumbuhan hifa jamur patogen tertekan. Kawamata et al. (2004) menguji sebanyak 967 isolat jamur, sebagian besar tergolong spesies
Epicoccum, sebagai agen hayati untuk mengendalikan penyakit blas pada padi. Lima isolat yaitu MKP5111B, MKP5112, NOP541, NOP5112 dan MKP33222 menunjukkan daya hambat yang sangat kuat terhadap perkecambahan konidia jamur patogen penyakit blas karena menghasilkan antibiotika.
Induksi ketahanan terkait dengan peningkatan lipoxygenase yang diakibatkan oleh perlakuan akar dengan strain B2, tetapi tidak terkait dengan peningkatan aktivitas peroksidase, phenylalanine ammonia lyase, tyrosin ammonia lyase, BETA,-1,3-glucanase, BETA,-1,4-glycosidase, N-acetylhexosaminidase atau chitinase (Someya et al., 2002). Formulasi biofungisida yang mengandung bahan aktif
Serratia marcescens diuji untuk mengendalikan penyakit blas yang disebabkan oleh Pyricularia ozyzae (Jaiganesh et al., 2007).
Formulasi agen hayati yang mengandung Bacillus megaterium diuji di lapangan untuk mengendalikan penyakit blas di Thailand (Kanjanamaneesathian
et al., 2009). Hasil pengujian menunjukkan bahwa formula agen hayati yang mengandung B. megaterium efektif untuk mengendalikan penyakit blas dan meningkatkan hasil padi. Suprapta et al. (2014b) membuktikan bahwa formula biofungisida yang mengandung suspensi Enterobacter agglomerans Gg14D efektif menekan intensitas penyakit blas pada tanaman padi varietas Ciherang. 2.3. Plant Growth Promoting Rhizobacteria
Daerah perakaran tanaman dikenal dengan istilah rizosfer (Dobbelaere et al., 2003). Daerah ini kaya akan unsur hara akibat akumulasi eksudat yang dihasilkan tanaman seperti asam amino dan gula yang merupakan sumber energi dan unsur hara bagi bakteri (Gray and Smith, 2005). Rizosfer ditempati oleh banyak jenis mirkoorganisme, dan bakteri yang mengkolonisai rizosfer disebut dengan rizobakteri (Schroth and Hancock, 1982). Bakteri yang hidup bebas pada rizosfer dan bermanfaat bagi tanaman biasanya dikenal sebagai plant growth promoting rhizobacteria (PGPR) (Kloepper et al., 1989). Sekitar 1-2% rizobakteri dapat memacu pertumbuhan tanaman (Antoun and Kloepper, 2001). Walaupun banyak jenis rizokateri diidentifikasi sebagai PGPR, tetapi sebagian besar termasuk ke dalam genus Bacillus dan Pseudomonas (Podile and Keshore, 2006).
lingkungan (Glick, 1995). Pengaruh secara tidak langsung terjadi ketika PGPR mengurangi atau mencegah mikroorganisme yang bersifat sebagai patogen melalui produksi antibiotik atau melalui induksi ketahanan pada tanaman (Glick, 1995). Beberapa peneliti telah membuktikan bahwa PGPR dapat memacu pertumbuhan tanaman, menginduksi ketahanan tanaman terhadap infeksi patogen dan meningkatkan hasil tanaman (Wei, 1991; Press et al., 1997; Palukaitis et al., 1992; Sherata et al., 2008; Khalimi, 2009; Suprapta et al., 2014b).
Mekanisme rhizobakteri dalam memacu pertumbuhan tanaman adalah (1) mampu menghasilkan atau mengubah konsentrasi hormon tanaman seperti asam indol asetat (IAA), asam giberelat, sitokinin, dan etilen atau prekursornya (1-aminosiklopropena-1-karboksilat deaminase) di dalam tanaman; (2) mampu memfiksasi N2, mempengaruhi pembintilan atau menguasai bintil akar; (3) mampu memproduksi osmolit sebagai osmoprotektan dalam kondisi cekaman osmotik maupun cekaman kekeringan, seperti Azospirillum halopraeferens
menghasilkan osmoprotektan glisin betain yang mampu memacu aktivitas nitrogenase dalam fiksasi N pada kondisi cekaman osmotik; (4) memberi efek antagonis terhadap patogen tanaman melalui beberapa cara yaitu produksi antibiotik, siderofore, enzim kitinase, β-1,3-glucanase, sianida, parasitisme, kompetisi sumber nutrisi dan relung ekologi; (5) melarutkan mineral fosfat; (6) menginduksi ketahanan tanaman secara sistemik (Fernando et al., 2005, Cattelan
et al., 1999).
Salah satu mekanisme rhizobakteri untuk melindungi tanaman adalah menginduksi ketahanan sistemik sehingga adanya infeksi patogen bisa dihambat dan tidak sampai mengganggu metabolisme tanaman. Ketahanan sistemik terinduksi bergantung pada kolonisasi sistem perakaran oleh rhizobakteri. Kolonisasi oleh rhizobakteri dapat terjadi melalui penyelubungan benih atau penambahan suspensi rhizobakteri ke dalam tanah pada saat pindah tanam.
pada biji labu dapat meningkatkan ketahanan tanaman terhadap Zuccini yellow mosaic potyvirus dibandingkan dengan perlakuan kontrol yang tidak diberi rhizobakteri. Khalimi (2009) melaporkan bahwa perlakuan Pseudomonas aeruginosa isolate PaJ mampu meningkatkan pertumbuhan tanaman kedelai. Hal ini terbukti secara signifikan meningkatkan tinggi tanaman maksimum, jumlah daun maksimum, dan luas daun maksimum. Perlakuan P.aeruginosa PaJ juga mampu mengurangi penghambatan tinggi akibat infeksi Soybean stunt virus
(SSV), menurunkan konsentrasi SSV didalam tanaman kedelai, dan meningkatkan aktivitas peroksidase. Hasil penelitian tersebut menunjukkan bahwa P. aeruginosa
isolate PaJ berhasil mereduksi keparahan penyakit kerdil pada tanaman kedelai akibat infeksi SSV.
2.4. Ketahanan Terinduksi
Rizobakteri yang bersifat non-patogen terbukti dapat menekan penyakit tanaman melalui mekanisme induksi ketahanan di dalam tanaman yang disebut ketahanan sistemik terinduksi (Induced systemic resistance, ISR) (Van Loon et al., 1998). Ketahanan terinduksi adalah suatu kondisi dimana kemampuan pertahanan tanaman terhadap penyakit meningkat karena mendapat rangsangan yang sesuai (Van Loon et al., 1998). Penomena ISR diuraikan oleh Van Peer et al. (1991) pada tanaman carnation yang terlindungi secara sistemik oleh
Pseudomonas fluorescens strain WCS417r terhadap Fusarium oxysporum f.sp.
dianthi. Wei et al. (1991) juga melaporkan bahwa beberapa strain rizobakteri melindungi daun tanaman mentimun dari penyakit antraknosa yang disebabkan oleh Colletotrichum orbiculare. Sebagian besar genus rizobakteri yang telah diteliti dan terbukti dapat menginduksi ketahanan tanaman berasal dari genus
Pseudomonas dan Bacillus (Kloepper et al., 2004; Van Wees et al., 2008).
Kemampuan untuk mengembangkan ketahanan terinduksi sebagai respon terhadap rizobakteri telah dibuktikan pada beberapa spesies tanaman (Van Loon et al., 1998) dan tampaknya tergantung pada kekhususan interaksi antara rizobakteri dan tanaman (Van Loon, 2007). Kegagalan untuk menginduksi ketahanan pada inang tertentu mungkin disebabkan karena tidak adanya produksi komponen penginduksi di dalam rizosfer atau ketidak mampuan spesies tanaman tertentu untuk merespon senyawa tersebut (Van Loon, 2007). Fakta menunjukkan bahwa diperlukan pengenalan khusus antara tanaman dan rizobakteri untuk menginduksi ketahanan. Sebagai contoh, Pseudomonas putida WCS358r dan P. fluorescens
WCS374r bekerja dengan cara berbeda tergantung pada spesies tanaman. Pada tanaman Arabidopsis, WCS358r menginduksi ketahanan, tetapi tidak pada lobak dan carnation (Van Peer et al., 1991; Van Peer and Schippers, 1992; Van Wees et al., 1997). Sebaliknya, tanaman lobak responsif terhadap P. fluorescens
BAB III
METODE PENELITIAN
3.1. Koleksi Benih Padi Lokal Bali
Kegiatan pengumpulan benih padi lokal Bali akan dilakukan di seluruh Bali, baik dari pertanaman maupun dari penyimpanan yang dilakukan oleh petani dan Balai Pusat Sertifikasi Benih (BPSB) Bali. Beberapa informasi dicatat pada saat melakukan pengumpulan benih yang meliputi nama varietas, lokasi, grup (cere atau bulu), umur (genjah atau dalam) dan informasi lain yang terkait.
3.2. Uji Ketahanan terhadap Penyakit Blas
Uji ketahanan terhadap penyakit blas dilakukan terhadap semua varietas padi lokal Bali yang berhasil dikumpulkan dan ditumbuhkan. Benih untuk setiap varietas ditanam pada nampan plastik ukuran 30 x 15 x 5 cm yang diisi media tanah subur dan kompos dengan perbandingan 3:1 ditambahkan pupuk Urea, SP-36 dan KCl masing-masing sebanyak 6 g, 3 g dan 2 g per nampan. Penambahan pupuk dilakukan sehari sebelum tanam. Benih ditanam pada jarak tanam 3 cm x 4 cm Inokulasi dengan suspensi spora jamur Pyricularia oryzae dilakukan pada tanaman berumur 18 hari sejak tanam. Jamur dibiakan pada media rice floor agar (dalam 1 liter mengandung 20 gram tepung beras, 2,5 gram yeast extract, 1,5 % agar dan air suling) diinkubasi selama 2 minggu pada suhu 28 – 30oC. Spora jamur dipanen dengan membasuh cawan Petri dengan 5-7 ml air steril mengandung 0,5% gelatin, disaring dengan kain kasa 4 lapis, segera ditempatkan pada wadah dengan berisi es untuk mencegah perkecambahan spora. Konsentrasi spora diatur menjadi 106 spora/ml. Inokulasi jamur dilakukan pada petang hari dengan menyemprotkan suspensi spora sebanyak 50 ml per nampan. Segera setelah inokulasi, nampan dimasukkan ke dalam ruang lembab selama 48 jam dengan kelembaban lebih dari 90%. Selanjutnya nampan dipindahkan ke dalam rumah kaca dengan alasnya kain goni basah untuk mempertahankan kelembaban.
mengamati seluruh daun yang sudah membuka sempurna. Penentuan ketahanan terhadap penyakit blas ditentukan berdasarkan sistem evaluasi standar untuk penyakit blas daun yang dikembangkan IRRI (1996) dengan ketentuan :
- Skala 0-2 = tahan - Skala 3 = moderat tahan - Skala 4-6 moderat rentan - Skala 7-9 = rentan
Penentuan intensitas penyakit dilakukan dengan rumus :
IP = x 100%
V : skala keparahan tertinggi v : skala keparahan penyakit (0-9)
Tabel.1 Skor penilaian tingkat serangan jamur P.oryzae (IRRI, 1996)
-Skor Skala Kerusakan 0 Tidak ada bercak
1 Bercak sebesar ujung daun
2 Bercak lebih besar dari ujung daun
3 Bercak nekrotik, abu-abu, bundar, sedikit memanjang, ukuran 1-2 mm, tepi coklat
4 Bercak khas blas (belah ketupat), luas daun terserang kurang 2 % 5 Bercak khas blas, luas daun terserang 2 – 10 %
6 Bercak khas blas, luas daun terserang 11– 25 % 7 Bercak khas blas, luas daun terserang 26 – 50 %
8 Bercak khas blas, luas daun terserang 51– 75 %, beberapa daun mulai mati 9 Semua daun mati
Isolasi rizobakteri dilakukan dari rizosfir tanaman padi dan serealia lainnya seperti jagung, rumput gajah, alang-alang dll. Pengambilan sampel rizosfir tanaman padi dan serealia lainnya dilakukan di beberapa daerah di Bali. Pengambilan sampel dari rizosfir tanaman padi dilakukan untuk aneka jenis padi lokal dan padi unggul yang dibudidayakan pada saat sampling dilakukan. Pada setiap lokasi pengambilan sampel diambil sebanyak 3 titik sampel untuk tanaman padi dan 3 titik sampel untuk tanaman serealia lainnya. Berat masing-masing sampel sekitar 20 gram tanah rizosfir (akar dan tanah yang melekat pada akar). Sebanyak 10 gram sampel dimaserasi pada mortal kemudian diencerkan dengan 100 ml bufer posfat salin (PBS). Selanjutnya dibuat seri pengenceran dengan PBS sampai pengenceran 10-7 .
Media yang digunakan untuk mengisolasi rizobakteri adalah media tryptic soy agar (TSA), dengan komposisi per liter : 3,0 g ekstrak daging; 3,0 g ekstrak yeast; 15,0 g pepton dari casein; 5,0 g pepton dari daging; 10 g laktose; 1,0 g glukose; 10 g sukrose; 0,5 g NH3+Fe3+ citrat; 5 g NaCl; 0,5 g sodium thiosulfat; 0,024 g phenol red; 12 g agar dan air dengan total volume media 1.000 ml. Ph media diatur 7,4. Media ini ditambahkan benomyl (20 mg/ml) atau Nystatin (50 mg/liter) untuk mengurangi pertumbuhan jamur (Basham et al., 1993).
3.4. Uji Kemampuan Rizobakteri untuk Memacu Pertumbuhan Bibit Padi
Lokal Bali
0,01%. Sebanyak 3 tabung reaksi disiapkan untuk masing-masing isolat yang diuji. Biakan ini dipelihara pada rak kultur dengan 12 jam penyinaran dengan sinar fluorescens pada suhu 28 + 2oC. Pertumbuhan akar dan batang diamati selama 10 hari dan dibandingkan dengan kultur tanpa perlakuan rizobakteri. 3.5. Pengujian Kemampuan Rizobakteri untuk Menginduksi Ketahanan
Isolat rizobakteri yang menunjukkan kemampuan memacu pembentukan bulu akar dan merangsang pertumbuhan tanaman padi diuji kemampuannya untuk menginduksi ketahanan terhadap pentakit blas. Pengujian dilakukan dengan tahapan sebagai berikut :
Benih padi yang digunakan adalah varietas Padi Merah (Penebel) yang dibuktikan paling rentan terhadap penyakit blas. Benih padi direndam dengan air bersih selama 24 jam, kemudian ditiriskan dan diperam selama 24 jam agar benih mulai berkecambah. Benih ini kemudian direndam dengan suspensi rizobakteri (106 CFU/ml) selama 30 menit. Benih yang hanya direndam dengan air steril digunakan sebagai kontrol. Benih kemudian ditanam pada cup plastic dengan diameter permukaan 5,5 cm, tinggi 4 cm yang sudah diisi media berupa tissue basah steril yang ditambahkan larutan nutrisi 1% KNO3. Sebanyak 5 benih ditanam pada setiap cup dan sebanyak 3 cup disiapkan untuk setiap isolate yang diuji. Tanaman dipelihara di dalam rak kultur jaringan dengan penyinaran florescens selama 12 jam per hari dan suhu 28oC. Bibit yang berumur 9 hari diinokulasi dengan suspensi P. oryzae (1 x 105 spora/ml) secara merata di seluruh permukaan bibit menggunakan hand sprayer mini. Setelah inokulasi, tanaman dipelihara di dalam growth chamber dengan RH 90% dan suhu 28oC selama 48 jam. Tanaman selanjutnya dikeluarkan dari growth chamber dan dipelihara pada rak kultur dengan penyinaran florescens selama 12 jam. Gejala penyakit blas diamati setiap hari untuk memilih isolate mana yang mampu menginduksi ketahanan tanaman padi terhadap penyakit blas dengan membandingkan intensitas penyakit pada perlakuan rizobakteri dengan kontrol.
Sebanyak 3 (tiga) isolat rizobakteri yang menunjukkan kemampuan paling baik untuk memacu pertumbuhan bulu akar tanaman padi dan dapat menginduksi ketahanan terhadap penyakit blas diidentifikasi untuk menentukan spesies. Identifikasi diawali dengan mengamati morfologi dan pertumbuhan koloni. Uji gram dilakukan untuk menentukan apakah rizobakteri yang diperoleh bersifat gram gegatif atau gram positif. Koloni diwarnai dengan pewarna gram (purple cristal selama 1 menit, yodium selama 1 menit, alkohol 90% selama 30 detik dan safranin selama 30-60 detik). Pengamatan dilakukan di bawah mikroskop dengan pembesaran 400 kali.
Pengujian sifat fisiologis rizobakteri dilakukan menggunakan uji Microbact (Oxoid Microbacttm GNB Kits). Biakan rizobakteri yang berumur 18-24 jam digunakan untuk uji ini. Pertama dilakukan uji oksidasi dengan memasukkan 4 tetes biakan rizobakteri ke dalam lubang tray, ditambahkan 2 tetes minyak mineral ke lubang berwarna hitam. Inkubasi selama 18-24 jam pada suhu 35oC. Bila positif oksidatif, berwarna biru atau ungu. Untuk kelompok oksidasi positif digunakan Microbact 12E dan 12B, sedangkan untuk kelompok oksidasi negatif hanya menggunakan Microbact 12E.
Identifikasi secara molekuler dilakukan dengan mengamplifikasi gen 16S-rRNA dengan PCR. Primer yang digunakan adalah primer universal untuk bakteri
berupa forward primer 63f (5’-CAG GCC TAA CAC ATG CAA GTC-3’) dan
dari situs NCBI (national center for biotechnology information). Konstruksi pohon filogeni dilakukan dengan menggunakan program MEGA 4.0, dengan
BAB IV
HASIL PENELITIAN
4.1 Varietas Padi Lokal Bali yang Dikoleksi
Ada 6 varietas padi lokal Bali yang berhasil dikumpulkan yaitu varietas Cicih Medang Selem, Cicih Medang Putih, Padi Merah, Ketan Hitam (Injin), Ketan Medang Selem, dan Padi Del. Lima varietas berhasil ditumbuhkan, sedangkan Padi Del belum berhasil ditumbuhkan, kemungkinan karena terlalu lama disimpan.
1. Varietas Cicih Medang Selem
Varietas ini termasuk grup atau kelompok bulu. Warna bulu (medang): hitam dengan panjang 2,5-5,5 cm. Lemma & palea (kulit luar beras) berwarna coklat kehitaman berbulu tipis. Endosperm (daging beras) berwarna putih kekuningan dengan panjang 6-7 mm. Panjang malai berkisar antara 21-40 cm. Rata-rata anakan maksimum 27 dengan tinggi maksimum 109 cm (Gambar 4.1).
Gambar 4.1. Padi Cicih Medang Selem
Varietas padi Cicih Medang Selem termasuk kelompok genjah sesuai namanya
“Cicih” berarti genjah. Umur tanaman dari tanam sampai panen berkisar antara
135-145 hari
2. Varietas Cicih Medang Putih
Jenis padi ini termasuk grup bulu. Bulu (medang) berwarna putih dengan panjang 1,3-3,5 cm. Lemma & palea (kulit luar beras) berwarna coklat muda, berbulu tipis. Endosperm berwarna putih, dengan panjang 7-8 mm. Panjang malai berkisar antara 24-34 cm. Rata-rata jumlah anakan maksimum 18 dengan tinggi maksimum 165 cm (Gambar 4.2). Umur tanaman padi ini mirip dengan padi Cicih Medang Selem yaitu berkisar antara 130-140 hari setelah tanam.
3. Varietas Padi Merah
Varietas Padi Merah ini termasuk grup bulu. Bulu (medang) berwarna coklat muda dengan panjang 4,5 -7 cm. Lemma & palea berwarna coklat muda, berbulu halus. Endosperm berwarna merah muda dengan panjang 6-7 mm. Panjang malai berkisar antara 35-45 cm. Rata-rata jumlah anakan maksimum 33 dengan tinggi maksimum 120 cm (Gambar 4.3). Umur tanaman Padi Merah bervariasi antara 145-155 hari setelah tanam.
Gambar 4.3. Padi Merah Penebel 4. Ketan Hitam (Injin)
Varioetas Ketan Hitam, di Bali dikenal dengan nama Injin termasuk grup padi bulu. Bulu berwarna kekuningan dengan panjang berkisar antara 0,5-1,5 cm.
Lemma & palea berwarna coklat muda, berbulu tipis. Endosperm berwarna hitam dengan panjang sekitar 6 mm. Panjang malai berkisar antara 25-29 cm. Rata-rata jumlah anakan maksiumum 35 dengan tinggi maksimum 118 cm (Gambar 4.4). Umur Injin betrkisar antara 145-155 hari.
Gambar 4.4. Ketan Hitam (Injin) 5. Varietas Ketan Medang Selem
Ketan Medang Selem termasuk grup padi bulu. Bulu berwarna hitam dengan panjang berkisar antara 3,5- 7,5 cm. Lemma & palea berwarna coklat muda berbulu. Endosperm berwarna putih dengan panjang sekitar 7 mm. Panjang malai berkisar antara 32-37,5 cm. Rata-rata jumlah anakan maksimum 26 dengan tinggi
maksimum 124 cm (Gambar 4.5). Umur padi jenis ini berkisar antara 150-160 hari.
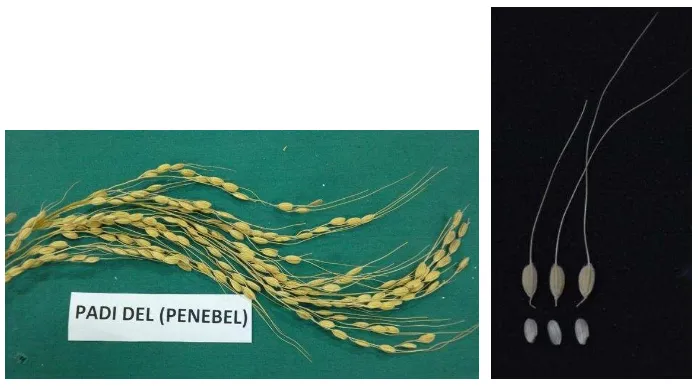
Gambar 4.5. Ketan Medang Selem Penebel 6. Padi Del
Padi Del sesuai dengan namanya berarti berumur panjang atau termasuk tipe padi
dengan umur “dalam”. Padi ini termasuk kelompok padi bulu. Bulu berwarna putih kekuningan dengan panjang 2,5-6 cm. Lemma & palea berwarna Coklat muda, berbulu tipis. Endosperm berwarna putih kekuningan, dengan panjang 7-8 mm. Panjang malai berkisar antara 32-34 cm (Gambar 4.6).
Gambar 4.6. Padi lokal Del Penebel
4.2 Ketahanan terhadap Penyakit Blas
Tabel 4.1. Persentase bibit padi lokal Bali yang terinfeksi penyakit Blas setelah diinokulasi dengan spora jamur Pyricularia oryzae
No. Varietas padi lokal Jumlah bibit yang
Sebanyak 95 isolat rizobakteri berhasil diperoleh pada kegiatan penelitian ini. Isolat ini diisolasi dari rozosfer beberapa jenis tanaman di Bali. Daftar nama isolat yang diperoleh disajikan pada Tabel 4.2.
Tabel 4.2. Daftar nama isolat rizobakteri yang diisolasi dari rizosfer beberapa jenis tanaman di Bali
No. Kode isolat Asal (rizosfer tanaman)
41 KT6A1 Kacang tanah
52 KcT2GRA10 Kacang tanah
53 Paj Kedelai
62 C2.7 Padi (konvensional)
63 EdX2 Edamame
64 DKP2 Kacang panjang
65 C2.4 Padi (konvensional)
66 O1.4 Padi (organik)
67 O2.6 Padi (organik)
68 EdBX4 Edamame
69 C4.3 Padi (konvensional)
70 C2.6 Padi (konvensional)
72 C2.5 Padi (konvensional)
73 C3.2 Padi (konvensional)
74 O1.4 Padi (organik)
75 O1.3 Padi (organik)
76 O1.1 Padi (organik)
77 O4.2 Padi (organik)
78 EdB3 Edamame
79 DKP4 Kacang panjang
80 DKP5 Kacang panjang
81 EdX1 Edamame
82 C3.9 Padi (konvensional)
83 C4.13 Padi (konvensional)
84 C4.8 Padi (konvensional)
85 C4.1 Padi (konvensional)
86 C1.4 Padi (konvensional)
87 C2.5 Padi (konvensional)
88 O2.5 Padi (organik)
89 O2.2 Padi (organik)
90 C1.7 Padi (konvensional)
91 C3.4 Padi (konvensional)
92 C4.12 Padi (konvensional)
93 C1.1 Padi (konvensional)
94 EdBx3 Edamame
95 Gl4 Gulma
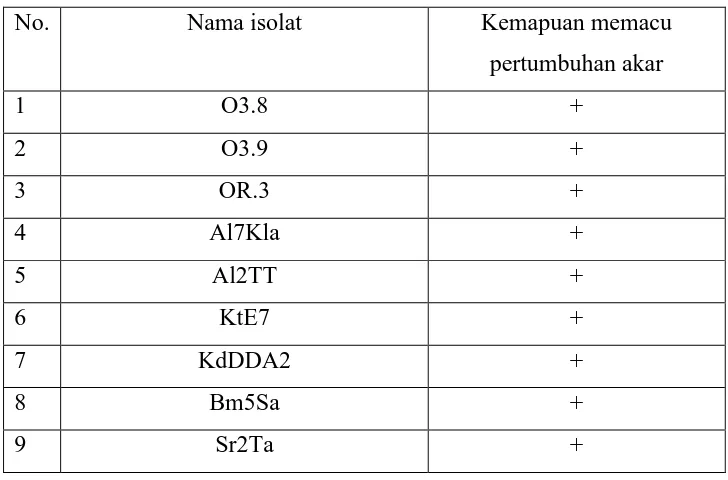
4.4 Rizobakteri Sebagai PGPR
growth promoting rizobacteria (PGPR). Daftar isolat rizobakteri yang bersifat sebagai PGPR disajikan pada Table 4.3.
Tabel 4.3.
Daftar nama isolat rizobakteri yang dapat memacu pertumbuhan akar tanaman Padi Merah
No. Nama isolat Kemapuan memacu
pertumbuhan akar
1 O3.8 +
2 O3.9 +
3 OR.3 +
4 Al7Kla +
5 Al2TT +
6 KtE7 +
7 KdDDA2 +
8 Bm5Sa +
9 Sr2Ta +
4.5 PGPR yang dapat Menginduksi Ketahanan
Semua (95 isolat) rizobakteri diuji kemampuannya untuk memacu pertumbuhan dan menginduksi ketahanan terhadap penyakit blas. Hasil pengujian menunjukkan bahwa hanya 4 (empat) isolat yaitu Al7Kla, OR3, O3.8 dan KdDDA2 yang mampu memacu pertumbuhan sekaligus menginduksi ketahanan
tanaman padi varietas Padi Merah terhadap penyakit blas. Sebanyak 91 isolat tidak mampu menginduksi ketahanan terhadap penyakit blas. Keempat isolat ini selanjutnya akan diidentifikasi untuk menentukan spesies.
4.6. Hasil Amplifikasi DNA
Amplifikasi DNA menggunakan 2 x Go Taq Green PCR Master (Pomega), pasangan primer 16S (63F 5’-CAG GCC TAA CAC ATG CAA GTC-3' dan
sebanyak 30 siklus berturut turut pada 94C selama 30 detik, 55C selama 45 detik, dan 72C selama 2 menit, terakhir ditambah 72C selama 10 menit. Hasil PCR divisualisasi pada agarosa gel 1% dan dielektroforesis di dalam buffer tris-acetic EDTA (TAE), yang diwarnai dengan pewarna berfluoresens non toksik (PeqGREEN). Amplifikasi DNA menghasilkan fragmen DNA berukuran ± 1300 pb seperti disajikan pada Gambar 4.7.
Gambar 4.7.
Amplifikasi PCR gen 16S rRNA rizobakteri dengan primer 63F dan 1387R. M1= 1 kb DNA ladder (Thermo), Lane 1-4 berturut turut adalah isolat Al7Kla, O3.8, KdDDA2, OR3. M2 = 100 bb DNA ladder (Thermo).
Fragmen DNA selanjutnya difurifikasi dan disekuensing untuk menentukan spesies rizobakteri berdasarkan kemiripan dengan spesies bakteri lainnya yang telah teridentifikasi.
Sekuen nukleotida rizobakteri isolat Al7Kla produk PCR hasil amplifikasi gen 16S RNA adalah sebagai berikut :
CTGGACAAAGACTGACGCTCAGGTGCGAAAGCGTGGGGAGCAAACAGGATTAGATACCCTGGT AGTCCACGCTGTAAACGATGTCGATTTGAAGGTTGTTCCCTTGAGGAGTGGCTTTCGGAGCTAA CGCGTTAAATCGACCGCCTGGGGAGTACGGCCGCAAGGTTAAAACTCAAATGAATTGACGGGG GCCCGCACAAGCGGTGGAGCATGTGGTTTAATTCGATGCAACGCGAAGAACCTTACCTACTCTT GACATCCAGAGAACTTAGCAGAGATGCTTTGGTGCCTTCGGGAACTCTGAGACAGGTGCTGCAT GGCTGTCGTCAGCTCGTGTTGTGAAATGTTGGGTTAAGTCCCGCAACGAGCGCAACCCTTATCC TTTGTTGCCAGCGATTCGGTCGGGAACTCAAAGGAGACTGCCGGTGATAAACCGGAGGAAGGT GGGGATGACGTCAAGTCATCATGGCCCTTACGAGTAGGGCTACACACGTGCTACAATGGCGTAT ACAAAGAGAAGCGACCTCGCGAGAGCAAGCGGAACTCATAAAGTACGTCGTAGTCCGGATTGG AGTCTGCAACTCGACTCCATGAAGTCGGAATCGCTA3’
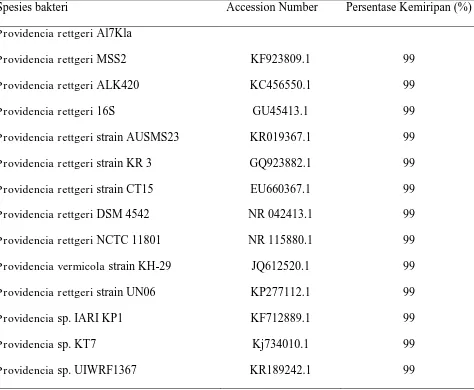
Tabel 4.4.
Perbandingan persentase kemiripan gen 16S RNA rizobakteri isolat Al7Kla dengan beberapa sekuen DNA di Genbank menggunakan program BLAST
Spesies bakteri Accession Number Persentase Kemiripan (%)
Providencia rettgeri Al7Kla
Providencia rettgeri MSS2 KF923809.1 99
Providencia rettgeri ALK420 KC456550.1 99
Providencia rettgeri 16S GU45413.1 99
Providencia rettgeri strain AUSMS23 KR019367.1 99
Providencia rettgeri strain KR 3 GQ923882.1 99
Providencia rettgeri strain CT15 EU660367.1 99
Providencia rettgeri DSM 4542 NR 042413.1 99
Providencia rettgeri NCTC 11801 NR 115880.1 99
Providencia vermicola strain KH-29 JQ612520.1 99
Providencia rettgeri strain UN06 KP277112.1 99
Providencia sp. IARI KP1 KF712889.1 99
Providencia sp. KT7 Kj734010.1 99
Gambar 4.8.
Pohon filogeni yang dibangun dari sekuen gen 16S RNA dari library Genbank
bakteri yang telah diidentifikasi. Nilai Bootstrap sebesar 77%.
Hasil analisis menggunakan metode Maximum Parsimony (MP) dengan 1.000 kali ulangan Bootstrap menunjukkan bahwa rizobakteri isolat Al7Kla adalah
Providencia rettgeri, karena satu klade dengan sekuen Providencia rettgeri
MSS2, Providencia rettgeri ALK420, Providencia rettgeri 16S, Providencia rettgeri strain AUSMS23, Providencia rettgeri strain KR 3, Providencia rettgeri
strain CT15, Providencia rettgeri DSM 4542, Providencia rettgeri NCTC 11801,
Providencia vermicola strain KH-29, Providencia rettgeri strain UN06,
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan hasil penelitian Tahun I ditemukan sebanyak 9 (sembilan) isolat rizobakteri bersifat sebagai plant growth promoting rhizobacteria (PGPR) yaitu dapat memacu pertumbuhan tanaman padi lokal Bali. Sebanyak 4 (empat) PGPR terbukti dapat menginduksi ketahanan tanaman Padi Merah terhadap penyakit blas. Keempat isolat PGPR tersebut adalah Al7Kla, O3.8, OR3 dan KdDDA2. Satu isolat yaitu Al7Kla telah diidentifikasi dan termasuk ke dalam spesies Providencia rettgeri.
5.2. Tindak Lanjut
DAFTAR PUSTAKA
Adinata, K. 2003. Sembilan ribu varietas padi lokal hilang. Tempo Interaktif 15 Juni 2003. Anonim. 2009. Penyakit blas. Balai Besar Penelitian Tanaman Padi, Sukamnadi, Subang Jawa
Barat. Diakses tanggal 20 Januari 2012 dari
file:///D/My%20Documents/Penyakit%20blas%202.htm.
Antoun, H. and J.W. Kloepper. 2001. Plant growth promoting rhizobacteria. In : Brenner, S. and J.H. Miller (Eds.) Encyclopedia of Genetics. Academics, New York. Pp. 1477-1480. Anwar, N.K. 2008. Eksistensi varietas padi lokal terancam. Hasyim Asya’ari Institute, Yogyakarta.
Cattelan, A.J., P.G.Hartel and J.J. Fuhrmann. 1999. Screening for plant growth promoting rhizobacteria to promote early Soybean growth. Soil Sci.Soc. AM.J. 63: 1670-1680. Chang, T.T. 1988. The ethnobotany of rice in island Southeast Asia. Asian Perspectives 26 (1): 69-76.
Chin, K.M. 1975. Fungicidal control of the rice blast disease. Mardi Research Bulletin 2(2): 82-84.
De Laat, A.M.M. and L.C. Van Loon. 1982. Regulation of ethylene biosynthesis in virus-infected tobacco leaves : II. Time course of levels of intermediates and in vivo conversion rates. Plant Physiology 69: 240-245.
Dobbelaere, S., J. Vanderleyden, and Y. Okon. 2003. Plant growth promoting effects of diazotrophs in the rhizospehere. CRC Critical Review of Plant Science 22: 107-149. Gray, E.J. and D.L. Smith. 2005. Intracellular and extracellular PGPR: commonalities and
distinctions in plant-bacterium signaling processes. Soil Biology and Biochemistry 37: 395-412.
Fernando, D., Nakkeeran and Z. Yilan. 2005. biosynthesis of antibiotics by PGPR and its relation in biocontrol of plant diseases.dalam: Z.A. Siddiqui (ed.),PGPR: Biocontrol and Biofertilization 67-109. Springer, Dordrecht, The Netherlands.
Ghazanfar, M.U., W. Wakil, S.T. Sahi and Saleem-il-Yasin. 2009. Influence of various fungicides on the management of rice blast disease. Mycopath 7(1): 29-34.
Glick, B.R. 1995. The enhancement of plant growth by free-living bacteria. Canadian Journal of Microbiology 41: 109-117.
IRRI. 1995. Parentage of IRRI crosses. Plant Breeding, Genetics, and Biochemistry Divison. International Rice Research Institute, Los Banos, Philippines.
IRRI. 1996. Standard evaluation system of rice. 4th Edition. International Rice Research Institute. Los Banos Philippines.
IRRI. 2010. Rice blast. Rice Fact Sheets. International Rice Research Institute. Los Banos Philippines.
Jaiganesh, V., A. Eswaran, P. Balabaskar and C. Kannan. 2007. Antagonistic activity of Serratia marcescens against Pyricularia oryzae. Not.Bot.Hort.Agrobot.Cluj. 35 (2): 48-54.
Kanjanamaneesathian, M., A. Chumtong, A. Pengnoo and R. Wiwattanapatapee. 2009. Bacillus megaterium suppresses major Thailand rice diseases. Asian Journal of Food and Agro-industry. Special Issue, S154-S159.
Kato, H. 2001. Rice blast disease. Pesticide Outlook February 2001. pp.23-25.
Kawamata, H., K. Narisawa and T. Hashiba. 2004. Suppression of rice blast by phylloplane fungi isolated from rice plants. Journal General Plant Pathology 70(2): 131-138.
Khalimi, K. 2009. Application of Plant Growth Promoting Rhizobacteria (PGPR) to Control
Soybean Stunt Virus in Soybean. Proceeding of the Ibaraki Sustainability Meetings, Asian Agriculture and Sustainable Society. Ibaraki 10-11 December 2009.
Khalimi, K., D.N. Suprapta, and Y. Nitta. 2012. Effect of Pantoeaagglomerans on growth promotion and yield of rice. Agricultural Science Research Journal 2(5): 240-249. Khus, G.S. 1997. Origin dispersal cultivation and variation of rice. Plant Molecular Biology 35:25-34.
Kishore, G.K., S. Pande, A.R. Podile. 2005. Phylloplane bacteria increase seedling emergence, growth and yield of field-grown groundnut (Arachis hypogaea L.). Letter in Applied Microbiology 40: 260-268.
Kloepper, J.W., Lifshitz, R., and Zablotomicz, R.M. 1989. Free-living bacterial inocula for enhancing crop productivity. Treends in Biotechnology 7: 39-44.
Kloepper, J.W., C.M. Ryu, and S.A. Zhang. 2004. Induced ssystemic resistance and promotion of plant growth by Bacillus spp. Phytopathology 94: 1259-1266.
Koizumi, S. 2001. Rice blast control with multilines in Japan. In : Mew, T.W., Borromeo, E., Hardy, B. Eds. Exploiting biodiversity for sustainable pest management. Los Banos (Philippines): International Rice Research Institute. p. 143-157.
Leeman, M., J.A. Van Pelt, F.M. Den Ouden, M. Heinsbroek, P.A.H.M. Bakker, and B. Schippers. 1995. Indudction of systemic resistance by Pseudomonas fluorescens in raddish cultivar differing in susceptibility to fusarium witl, using a novel bioassay. European Journal of Plant Pathology 101: 655-664.
Marchesi, J.R. T. Sato., A.J. Weightman, T.A. Martin, J.C. Fry, S.J. Hiom, and W.G. Wade. 1998. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA. Applied Environmental Microbiology 64: 795-799. Mauch, F., L.A. Hadwiger, and T. Boller. 1994. Ethylene: symptom, not signal for the induction
of chitinase and 1,3-glucanase in pea pods by pathogens and elicitors. Plant Physiology 76: 607-611.
Murphy, J.F., G.W. Zehnder, D.J. Schuster, E.J. Sikora, J.E. Polston, J.W. Kloepper. 2000. Plant growth promoting rhizobacterial mediated protection in tomato against Tomato mottle virus. Plant Disease 84: 779-784.
Palukaitis, P., M.J. Roossinck, R.G. Dietzgen, R.I.B. Francki. 1992. Cucumber mosaic virus. Adv. Virus Res 41: 281-346Eun CAJ. 2000. Molecular beacons: A new approach to plant virus detection. The American Phytopathological Society 90: 269-275.
Pieterse, C.M.J., J.A. Van Pelt, J.Ton, S. Parchmann, M.J. Mueller, A.J. Buchala, J.P. Metraux, and L.C. Van Loon. 2000. Rhizobacteria mediated induced systemic resistance (ISR) in
Podile, A.R. and G.K. Kishore. 2006. Plant growth promoting rhizobacteria. In: Gnanamanickam, S.S. (Ed.) Plant associated bacteria. Springer, Netherlands. Pp. 195-230. Press, C.M., M. Wilson, S. Tuzun, J.W. Kloepper. 1997. Salicylic Acid Produced by Serratia
marcescens 90-166 Is Not the Primary Determinant of Induced Systemic Resistance in Cucumber or Tobacco. The American Phytopathological Society 10: 761-768.
Schroth, M.N. and J.G. Hancock. 1982. Disease-suppresive soil and root-colonizing bacteria. Science 216: 1376-1381.
Shehata, S. Fawzy, A.M. Borollosy. 2008. Induction of resistance against Zuccini yellow mosaic potyvirus and growth enhancement of squash plants using some plant growth promoting rhizobacteria. Australian Journal of basic and applied sciences 2: 174-182. Silitonga, T.S. 1998. Pelestarian dan pemanfaatan plasma nuftah padi di Indonesia. Warta Plasna Nuftah Indonesia 5: 6-8.
Siwi, B.H. dan S. Kartowinoto. 1989. Plasma nuftah padi dalam Padi Buku 2. Badan Penelitian dan Pengembangan Pertanian, Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor.
Someya, N., M. Nakajima, T. Hibit, I Yamaguchi and K. Akutsu. 2002. Induced resistance to rice blast by antagonistic bacterium, Serratia marcescens strain B2. Journal General Plant Pathology 68(2): 177-182.
Suprapta, D.N., N.M.I. Maulina, and K. Khalimi. 2014a. Effectiveness of Enterobacter cloacae to promote the growth and increase the yield of rice. Journal of Biology, Agriculture and Healthcare 4(1): 44-50.
Suprapta, D.N., V. Quintao, and K. Khalimi. 2014b. Effectiveness of rhizobacteria to reduce rice blast disease intensity. Journal of Biology, Agriculture and Healthcare 4(3): 35-41
Swatantra, N. 2013. Lestarikan Padi Lokal, Distanak Buleleng Buka Demplot Seluas 180 hektar. Bisnis Bali 31 Maret 2013.
Taguchi, Y., M. Hyakumachi, H. Horinouchi and F. Kawane. 2003. Biological control of rice blast disease by Bacillus subtilis IK-1080. Jpn.J. Phytopathol. 69: 85-93.
TeBeest, D.O., C. Guerber and M.Ditmore. 2007. Rice blast. The Plant Health Instructor. DOI: 10.1094/PHI-I-2007-0313-07. APSnet. Diakses tanggal 18 Januari 2012 dari
Van Loon, L.C., P.A.H.M. Bakker, and C.M.J. Pieterse. 1998. Systemic resistance induced by rhizospehere bacteria. Annual Review of Phytopathology 36: 453-483.
Van Loon, L.C. 2007. Plant responses to plant growth promoting rhizobacteria. European Journal of Plant Pathology 119: 243-254.
Van Peer, R., G.J. Niemann, and B. Schippers. 1991. Induced resistance and phytoalexin accumulation in biological control of fusarium wilt of carnation by Pseudomonas sp. Strain WCS417r. Phytopathology 91: 728-734.
Van Wees, S.C.M., S. Van der Ent, and C.M.J. Pieterse. 2008. Plant immune responses triggered by beneficial microbes. Current Opinion in Plant Biology 11: 443-448.
Vaughan, D.A. 1994. The wild relatives of rice. A Genetic Resources Handbook IRRI, Los Banos, Philippines.
Verhagen, B.W.M., L.C. Van Loon, C.M.J. Pieter. 2006. Induced disease resistance signaling in plants. Floriculture, Ornamental and Plant Biotechnology 3: 334-343.
Wei, G., J.W. Kloepper, S. Tuzun. 1991. Induction of systemic resistance of cucumber to Colletotricum arbiculare by select strain of plant growth-promoting rhizobacteria. Phytopathology 81: 1508-1512.
Zeigler, R.S., S.A. Leong, P.S. Teng (eds.. 1994. Rice blas disease. In : Zeigler, R.S., S.A. Leong, P.S. Teng. Editors. Rice blast disease. Wallingford, Oxon (United Kingdom): CAB International, Los Banos (Philippines):
International Rice Research Institute. 626 p.