Tinjauan Pustaka
Gangguan pertumbuhan
sebagai komplikasi talasemia • mayor
Nur Robbiyah, Hakimi, Melda Deliana, Siska Mayasari
. Departemen Ilmu Kesehatan Anak Fakultas Kedokteran Universitas Sumatera Utara/Rumah Sakit Umum Pusat H. Adam Malik, Medan
Abstrak
Talasemia Is-mayor merupakan penyakit kelainan darah yang diturunkan secara genetik. Gangguan pertumbuhan merupakan komplikasi yang sering dijumpai pada pasien talasemia Is-mayor. Patogenesis gangguan pertumbuhan pada pasien talasemia Is-mayor disebabkan oleh multi faktor diantaranya anemia kronis dan hipoksia, gangguan fungsi hati, defisiensi zink dan asam folat, iron overload dan toksisitas anti kelasi besi. Manajemen yang tepat bagi setiap pasien talasemia Is-mayor, seperti pengenalan dini gangguan pertumbuhan, pemberian terapi kelasi yang tepat adalah sangat penting untuk memperbaiki kualitas hidup.
Kata kunci : talasemia ß-mayor; gangguan pertumbuhan
Abstract
Beta-thalassemias major are a group of hereditary blood disorders disease. Growth disorders are afrequent complication of patient with Beta-thalassemias major. The pathogenesis of disorders is multifactorial and is mainly due to chronic anemia and hypoxia, chronic liver disease, zinc and folic acid deficiency, iron overload and intensive use of chelating agents. Proper management of each patient with beta-thalassemias major include early recognition of growth disorders and appropriate of iron chelation therapy is very important to improve the quality of life.
Keywords : beta-thalassemias major; growth disorders PENDAHULUAN
Talasemia Is-mayor merupakan penyakit kelainan darah yang diturunkan secara genetik, dengan karakteristik kurangnya atau tidak ada sintesa rantai Is hemoglobin, yang mengakibatkan penurunan kadar hemoglobin dalam sel darah merah, penurunan produksi sel darah merah dan anemia.1,2
Penanganan paling utama pada pasien talasemia Is-mayor adalah pemberian transfusi darah secara rutin. Pasien talasemia Is-mayor yang tidak mendapatkan terapi transfusi atau tidak mendapat transfusi yang adekuat kerap mengalami keterlam- batan pertumbuhan dan pubertas.2
Efek transfusi darah secara rutin dapat memperpanjang kelangsungan hidup penderita talasemia Is-mayor, namun dapat menimbulkan keadaan iron overload. Komplikasi yang dapat terjadi akibat iron overload adalah hemosiderosis yang pada akhirnya akan menyebabkan gangguan pada berbagai organ seperti hati, jantung, dan organ endokrin.2,3
Beberapa kelainan endokrin yang ditimbulkan antara lain gangguan pertumbuhan dan perkembangan, keterlambatan pubertas yang dapat disertai dengan kerusakan pada aksis hipotalamus-hipofisis dan diabetes mellitus (DM).4
Dari beberapa penelitian dilaporkan angka kejadian
gangguan pertumbuhan pada pasien talasemia Is-mayor bervariasi.
Studi di Malaysia didapati 54.4%,5 studi di Iran didapati 62%,6 sedangkan studi di India didapati 54% anak talasemia Is-mayor mengalami gangguan pertumbuhan.7,8
Tingginya angka kejadian gangguan pertumbuhan pada talasemia Is-mayor, selain disebabkan oleh anemia kronis yang tidak mendapat transfusi yang adekuat, beberapa faktor yang berperan terhadap terjadinya kerusakan organ endokrin adalah iron overload, toksisitas Desferoxamine (DFO) yaitu iron chelathing agent yang berfungsi untuk mengurangi kelebihan besi, faktor emosional, defisiensi zink dan asam folat serta gangguan fungsi hati.1,3,9
Beberapa pemeriksaan untuk menilai gangguan pertumbuhan yang terjadi pada pasien talasemia Is-mayor yaitu pengukuran tinggi badan, kecepatan pertumbuhan, penilaian potensi tinggi genetik (PTG), status pubertas, usia tulang, fungsi tiroid dan Growth hormone (GH).9
Untuk mengurangi kejadian gangguan pertumbuhan pada pasien talasemia Is-mayor harus dilakukan manajemen pembe- rian transfusi yang benar, pemberian terapi iron chelating agent yang tepat, monitoring pertumbuhan pada semua anak talasemia
E-mail : nurrobbiyah75@yahoo.co.id
I-mayor dan pemberian terapi GH bila memang dijumpai defisiensi GH.1,9
DEFINISI
Pertumbuhan didefinisikan sebagai proses meningkatnya ukuran sel oleh penambahan jaringan, dapat diamati pada seluruh organisme, bagian tubuh, sistem organ dan pada sel.10
Pertumbuhan merupakan proses interaksi beberapa faktor seperti faktor genetik, lingkungan terutama nutrisi, serta pengaruh faktor endokrin. Pertumbuhan pada anak terjadi terutama pada lempeng epifisis yang merupakan tempat terjadinya deposisi tulang sehingga terjadi penambahan tinggi badan.11
Pertumbuhan terbagi menjadi beberapa tahapan yaitu pertumbuhan prenatal, pertumbuhan pasca natal yang terbagi menjadi fase bayi, kanak-kanak dan fase pubertas.
Pertumbuhan pasca natal pada fase bayi ditandai oleh pertumbuhan yang pesat, kemudian diikuti penurunan kece- patan tumbuh secara progresif.11,12
Masa pubertas mempunyai dua peranan pada pertumbuhan yaitu akselerasi kecepatan pertumbuhan dan maturasi skeletal yang meningkat akibat penutupan lempeng tulang epifisis.
Beberapa faktor hormonal berperan dalam mempengaruhi pertumbuhan pebertas yaitu GH, Insuline Like Growth Hormone Factor- I (IGF-I), hormon steroid seks, dan hormon tiroid.10,11
Gangguan pertumbuhan adalah gangguan pada kecepatan pertumbuhan tinggi berdasarkan umur dan derajat pubertas, apakah anak tersebut pendek atau tinggi dari pengukuran tinggi dan dari potensi tinggi orang tua.12
Pola pertumbuhan pada pasien talasemia yang mendapat transfusi relatif normal sampai usia 9 sampai 10 tahun, mulai terganggu dimana kecepatan pertumbuhan mulai melambat yang menyebabkan terjadinya perawakan pendek.13-15
Dikatakan perawakan pendek bila : 10-15
1. Tinggi badan dibawah persentil 3 atau -2 SD untuk usia dan jenis kelamin
2. Tinggi badan signifikan dibawah PTG yaitu -2 SD dibawah PTG
3. Kecepatan pertumbuhan yang lambat
Rata-rata kecepatan pertumbuhan pada fase yang berbeda:
a) Fase prenatal : 1.2 sampai 1.5 cm perminggu b) Fase bayi : 23 sampai 28 cm pertahun c) Kanak-kanak : 5 sampai 6.5 cm pertahun d) Pubertas: 8.3 cm/pertahun (perempuan)
9,5 cm pertahun (laki-laki)
4. Pertumbuhan menurun memotong garis persentil pada kurva pertumbuhan terutama setelah usia 18 bulan.
Patofisiologi gangguan pertumbuhan pada pasien tala- semia R-mayor
Gangguan pertumbuhan pada pasien talasemia I-mayor disebabkan oleh multi faktor yaitu disebabkan oleh anemia kronis dan hipoksia, gangguan fungsi hati, defisiensi zink dan asam folat, iron overload, toksisitas DFO, faktor emosional, dan gangguan endokrin.9,16,17
Pada tahap awal kehidupan, yaitu usia satu sampai lima
tahun, faktor emosional, defisiensi zink dan asam folat serta anemia kronis dan hipoksia merupakan faktor penyebab terja- dinya gangguan pertumbuhan pada pasien talasemia I-mayor.16
Penyakit kronis mempengaruhi kesehatan psikologis dan kepercayaan diri pasien talasemia I-mayor. Gangguan cemas, depresi, gangguan emosi dan gangguan somatik adalah masa- lah psikologis yang banyak ditemukan pada pasien talasemia I- mayor.13
Gangguan psikologis dapat mempengaruhi gangguan pertumbuhan dengan mempengaruhi hipofisis anterior mengakibatkan terjadinya defisiensi GH.10
Defisiensi zink merupakan faktor yang berperan dalam gangguan pertumbuhan pada pasien talasemia I-mayor. Zink sebagai elemen penting pada banyak aktifitas metabolisme, seperti sintesis DNA pada sel-sel pertumbuhan dan sintesis protein.
Zink diabsorbsi pada usus kecil, dan lebih dari 80% zink berikatan dengan albumin dalam sirkulasi darah. Defisiensi zink dapat menyebabkan keterlambatan perkembangan, kebotakan, diare dan kehilangan berat badan.
Zink diekresi melalui urin dan meningkat akibat hemolisis yang terjadi pada pasien talasemia, pemberian agen kelasi besi juga dapat meningkatkan ekskresi zink melalui urin.9,12,18
Anemia kronis dan hipoksia terjadi akibat penderita tala- semia I mayor tidak mendapat transfusi yang adekuat, hal ini juga menyebabkan gangguan pertumbuhan, anak tumbuh lebih kecil dari saudara kandungnya yang normal.1
Hipoksia yang berat akan merangsang produksi eritropoetin dengan ekspansi yang terus menerus tetapi tidak efektif pada sumsum tulang yang menyebabkan hipersplenisme. Splenomegali meningkatkan konsumsi darah, meningkatkan kelebihan besi, memperburuk anemia yang memberikan pengaruh negatif terhadap pertumbuhan.17
Akan tetapi anemia kronis dan hipoksia saat ini tidak lagi memberikan kontribusi yang lama terhadap terjadinya gangguan pertumbuhan apabila pasien talasemia mayor mendapat transfusi secara teratur.9
Jika transfusi diberikan secara teratur dan kadar Hb dipertahankan lebih dari 9 g/dL maka anak akan mengalami pertumbuhan dan perkembangan yang normal sampai usia 10-12 tahun.2,8,17
Pemberian transfusi yang regular pada pasien talasemia I-mayor menyebabkan terjadi iron overload. Hal ini dapat memicu terjadinya kerusakan jaringan akibat penumpukan radikal bebas pada organ.
Transfusi darah yang diberikan secara teratur akan mengakibatkan pemenuhan kapasitas pengikatan besi transferin di tubuh, akibatnya besi bebas ini akan terakumulasi dalam jaringan dan darah. Tanpa intervensi terapi, besi bebas yang dikenal dengan non transferin binding protein (NTBI) akan bersirkulasi sistemik ke jaringan sebagai radikal bebas dan merusak lemak, protein dan DNA sehingga menimbulkan kerusakan organ seperti hati jantung dan organ endokrin.1,3,16,19
Setiap unit sel darah merah menghantarkan 200 sampai 250 mg besi melalui transfusi, tanpa pemberian agen kelasi besi 10 sampai 20 unit atau lebih taransfusi sel darah merah
Nur Robbiyah, dkk Gangguan pertumbuhan sebagai komplikasi talasemia • mayor
Nur Robbiyah, dkk
akan meningkatkan risiko kerusakan organ.20
Kelebihan besi pada organ endokrin pada beberapa studi memperlihatkan kelainan endokrin, yang paling banyak adalah hipogonadotropik hipogonadisme, defisiensi GH, diabetes me- llitus, hipotiroid, hipoparatiroid dan insufisiensi adrenal.4,21-25
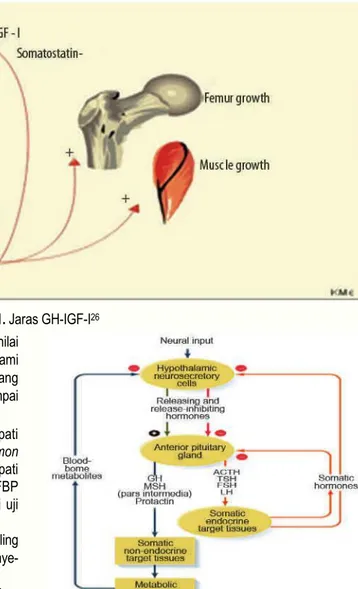
Pengaruh hormonal sebagai penyebab gangguan pertum- buhan pada pasien talasemia Is-mayor sangatlah kompleks, selain disebabkan oleh hipogonadisme, hipotiroidisme, jaras GH-IGF-I secara nyata berperan terhadap gangguan pertum- buhan.9
Pada pemeriksaan dengan Magnetic Resonance Imaging (MRI) didapati deposisi besi pada kelenjar hipofisis anterior.9,24
Deposisi besi menyebabkan kerusakan hipofisis anterior yang mengakibatkan terganggunya jaras GH-IGF-I.9,25
Kerusakan pada hipofisis anterior menyebabkan pelepasan GH terganggu, yang mengakibatkan produksi IGF-I dan IGFBP3 oleh hati terganggu karena stimulasi GH terhadap hati berkurang, sehingga terjadi penurunan GH dan IGF-I.
Defisiensi GH dan IGF-I mempengaruhi kecepatan pertumbuhan tulang pada lempeng pertumbuhan tulang.10
(gambar 1)
hemosiderosis pada organ tersebut. Gonadotropin yang dihasilkan oleh hipofisis anterior sangat sensitif terhadap kerusakan oksidatif yang disebabkan oleh kelebihan zat besi.
Pada MRI hipofisis anterior dijumpai gambaran penurunan intensitas sinyal spin–echo dari hipofisis, hal ini dikaitkan dengan meningkatnya deposisi besi di hipofisis anterior dan dapat menjadi alat investigasi yang berguna dalam penilaian hemosiderosis hipofisis.9,25
Untuk meneliti pengaruh pubertas terlambat terhadap pertumbuhan linier remaja talasemia digunakan skala Tanner dalam memantau perkembangan seksualnya, pengukuran hormon gonadotropin seperti: Luteinizing Hormone (LH), Folicle-Stimulating Hormone (FSH) dan Hormon Testosteron.
Didapati hasil bahwa keterlambatan pubertas berpengaruh terhadap gangguan pertumbuhan pada pasien talasemia.24
Penumpukan besi pada sel gonad pada hipofisis anterior menyebabkan berkurangnya sekresi hipofisis anterior yang memicu terjadinya hipogonadotropik hipogonadisme dan pubertas terlambat.13 (gambar 2).
Gambar 1. Jaras GH-IGF-I26
Beberapa studi melakukan uji provokasi untuk menilai respons GH pada pasien talasemia Is-mayor yang mengalami perawakan pendek. Satu studi melaporkan sekresi GH yang normal pada beberapa anak namun beberapa anak dijumpai responsnya menurun setelah dilakukan uji provokasi.27
Studi lain yang juga melakukan uji provokasai didapati respons GH terhadap Growth Hormone Releasing Hormon (GHRH) dilaporkan menurun,28 satu studi yang lain didapati responsnya normal.29 Sedangkan serum IGF-I dan IGFBP didapati rendah pada sebagian besar sampel setelah uji uji provokasi.29,30
Hipogonadisme merupakan komplikasi endokrin paling sering pada pasien talasemia Is-mayor dan merupakan penye- bab penting gangguan pertumbuhan pada saat remaja.
Hipogonadotropik-hipogonadisme terjadi akibat kerusakan
hipotalamus dan hipofisis anterior yang disebabkan oleh Gambar 3. Jaras Hipotalamus-hipofisis-gonad31
46
Gangguan pertumbuhan sebagai komplikasi talasemia • mayor Beberapa studi melaporkan prevalensi hipotiroidisme pada
talasemia I-mayor, pada penelitian ini dijumpai hubungan yang signifikan antara perawakan pendek dengan hipotiroid.32,33
Hormon tiroid berperan penting dalam maturasi tulang, mempengaruhi sekresi GH, mempengaruhi kondrosit secara langsung dengan meningkatkan sekresi IGF-I, serta memacu maturasi kondrosit.11
Kadar serum ferritin yang tinggi selama dekade pertama kehidupan akibat pemberian transfusi mengakibatkan terjadinya perawakan pendek, keadaan ini merupakan indikasi untuk pemberian terapi iron chelating agent yang berguna untuk mencegah atau membatasi komplikasi ini.3,9
Obat pertama yang tersedia adalah Desferoxamine (DFO).2
Akan tetapi beberapa studi menunjukkan tingginya kejadian perawakan pendek pada anak dan remaja talasemia yang mendapat pengobatan dengan DFO secara intensif.1,3,9 Hal ini disebabkan oleh intoksikasi DFO yang dapat menghambat proliferasi sel, menghambat sintesis DNA, mengganggu deposisi mineral seperti kuprum dan zink.1,9
Mekanisme yang kompleks tersebut menyebabkan platis- pondilosis dimana dijumpai vertebra menjadi rata, pemendekan tulang panjang,9 dan pemendekan spinal yang menyebabkan penurunan tinggi badan baik dalam keadaan duduk maupun berdiri.9,17
Pemberian terapi iron chelating agent yang terlalu cepat yaitu pada usia antara 2 sampai 5 tahun dapat juga meng- ganggu pertumbuhan, hal ini disebabkan karena sebelum tubuh mengalami kelebihan besi akibat pemberian transfusi, DFO menjadi kelasi terhadap mineral lain selain besi.34
Prosedur untuk menilai gangguan pertumbuhan
Gangguan pertumbuhan merupakan komplikasi yang sering dijumpai pada pasien talasemia I-mayor. Pola pertumbuhan pada anak tersebut relatif normal sampai usia 10 tahun. Anak talasemia I-mayor harus secara rutin dimonitor pertumbuhan dan perkembangannya sampai mencapai tinggi dewasa dan perkembangan seksual yang lengkap.35
Beberapa pemeriksaan yang dilakukan untuk menilai gangguan pertumbuhan yang terjadi pada pasien talasemia I-mayor:9
1. Pengukuran tinggi badan berdiri atau duduk.
Pengukuran ini dilakukan setiap 6 bulan, pengukuran tinggi badan ini selanjutnya diproyeksikan pada kurva pertumbuhan sesuai usia dan jenis kelamin.9 Kurva pertumbuhan digunakan untuk memantau pertumbuhan anak sesuai dengan populasi acuannya. Untuk negara- negara yang tidak memiliki kurva pertumbuhan, WHO menganjurkan penggunaan kurva The Centres Disease Control and Prevention ( CDC) sebagai acuan, akan tetapi kurva ini menggunakan populasi Amerika Serikat, sehingga tidak sesuai untuk setiap negara dan perlu penyesuaianpenyesuaian tertentu. 11
2. Pengukuran Potensial Tinggi Genetik (PTG)
Oleh karena faktor genetik mempunyai pengaruh penting terhadap pertumbuhan dan potensi tinggi seorang anak, maka sangat penting menilai perawakan dari orang tua
dan saudara kandung anak tersebut. Perkiraan tinggi dewasa seorang anak berhubungan dengan target tinggi kedua orang tua.10 Potensial tinggi genetik (PTG) dihitung dengan menggunakan rumus berikut:10
- PTG laki-laki : Tinggi ayah + ( tinggi ibu + 13 cm) ± 8,5 cm 2
- PTG Perempuan : Tinggi ibu + (tinggi ayah-13 cm) ± 8,5 cm 2
Bila didapati pola pertumbuhan anak mengalami deviasi dari orang tua atau saudara kandungnya maka di dapati kondisi patologis yang mendasarinya, tetapi bila didapati kelainan patologis yang nyata dari orang tua maka pengukuran ini tidak dapat digunakan.10
3. Menilai kecepatan pertumbuhan
Pertumbuhan merupakan suatu proses yang dinamik, sehingga diperlukan pengukuran yang berkala untuk mengukur kecepatan pertumbuhan dalam satu satuan waktu.11 Minimal harus ada dua titik pengukuran supaya dapat menilai kecepatan pertumbuhan. Dengan demikian dapat dilihat pola pertumbuhan anak, apakah sejajar dengan persentil atau melenceng. Anak dengan gangguan pertumbuhan akan mengalami pertumbuhan di bawah persentil 25 pada kurva kecepatan pertumbuhan10
4. Pemeriksaan status pubertas.
Sebagaimana telah dikatakan di atas bahwa keterlambatan pubertas berpengaruh terhadap gangguan pertumbuhan pada pasien talasemia.9,25
Penumpukan besi pada sel gonad pada hipofisis anterior menyebabkan berkurangnya sekresi hipofisis anterior yang memicu terjadinya hipogonadotropik hipogonadisme dan pubertas terlambat. Oleh sebab itu perlu dilakukan penilaian status pebertas.13
Status pubertas dapat dinilai dengan menggunakan skala Tanner. Pemeriksaan ini harus dilakukan setiap 6 bulan sejak usia 10 tahun sampai mencapai perkembangan seksual yang lengkap. Untuk menilai volume testis dengan menggunakan Orchidometer (Prader)35
5. Menilai maturasi tulang.
Maturasi tulang dapat diamati secara langsung dengan melihat pertumbuhan lempeng epifisis dengan menggu- nakan X-ray.
Pada anak normal, didapati pusat perkembangan epifisis sesuai usia, yang memungkinkan untuk dihasilkannya standart maturasi tulang pada masing jenis kelamin selama masa anak dan remaja.12
Usia tulang ( bone age ) merupakan pengukuran kuantitatif maturasi fisik tulang, caranya adalah dengan memban- dingkan Wrist X-ray pasien dengan Wrist X-ray normal untuk laki-laki dan perempuan seperti yang terlihat pada atlas Greulich and Pyle. Kegunaan dari penilaian usia tulang ini adalah untuk memonitor potensi pertumbuhan dari waktu ke waktu, dapat juga digunakan untuk menentu- kan perkiraan tinggi dewasa.12
Nur Robbiyah, dkk
6. Pemeriksaan darah rutin, jumlah ferritin, fungsi hati dan zink, elektrolit dan urin rutin.
7. Pemeriksaan fungsi tiroid (T3,T4,TSH), GH dan IGF-I.
Manajemen penatalaksanaan gangguan pertumbuhan pada pasien talasemia R-mayor
Manajemen penatalaksanaan gangguan pertumbuhan pada pasien talasemia Is-mayor, harus mencakup semua aspek yang menjadi penyebab gangguan pertumbuhan tersebut, seperti transfusi yang tidak optimal, gangguan endokrin, defisiensi zink, dan toksisitas DFO.
Manajemen yang tepat bagi setiap pasien talasemia Is- mayor, seperti pengenalan dini gangguan pertumbuhan, pemberian terapi kelasi yang tepat adalah sangat penting untuk memperbaiki kualitas hidup.9
1. Pemberian transfusi secepatnya bila diagnosis telah ditegakkan.
Transfusi teratur seumur hidup harus dilakukan untuk menekan eritropoesis, mencegah hipoksia kronis dan mencegah hipersplenisme. Lamanya jarak antara setiap transfusi adalah 2 sampai 6 minggu tergantung berat badan, umur, pekerjaan dan jadwal sekolah. Pemantauan rutin Hb sebelum transfusi, dimana akan optimal bila kadar Hb sebelum transfusi 9 g/dL sampai 10.5 g/dL.3,13
2. Pemberian suplementasi seperti zink dan asam folat Pada satu studi yang membandingkan antara dua kelompok, dimana kelompok pertama adalah pasien talasemia Is- mayor yang mendapat suplementasi zink dengan dosis 60 mg sekali sehari selama 18 bulan, sedangkan kelompok kedua adalah kelompok pasien talasemia Is-mayor yang tidak mendapat zink. Pada penelitian tersebut dihasilkan pemberian suplementasi zink hanya bermanfaat pada pasien talasemia Is-mayor yang mengalami defisiensi zink, sedangkan profilaksis zink tidak mempunyai efek terhadap pertumbuhan linier.18
3. Pencegahan terhadap Iron overload
Terapi iron chelating agent dapat diberikan jika pasien sudah menerima 100ml/kg PRC, serum feritin lebih dari 1000 µg/L, jika anak sudah tiga sampai lima tahun menggunakan DFO dan tidak dijumpai tanda-tanda gagal tumbuh dan ekskresi besi dinilai baik, dan konsentrasi besi di hati (diukur 1 tahun setelah transfusi) melebihi 7 mg/g berat kering hati yang diukur dengan menggunakan biopsi hati maupun MRI.1 Terapi iron chelating agent dimulai dengan pemberian DFO dengan dosis 20-40 mg/kgbb/hari selama 8 sampai 12 jam, 5 sampai 7 hari perminggu, dosis maksimal tidak boleh melebihi 50 mg/kgbb/hari.13-15,35 Suatu penelitian membandingkan antara iron chelating agent oral yaitu deferiprone dan subkutan yaitu DFO. Pada studi tersebut diambil kesimpulan bahwa iron chelating agent oral sedikit lebih efektif dibandingkan dengan pemberian iron chelating agent subkutan sebagai terapi iron chelating agent pada hepar, dan sangat potensial dalam mengeluarkan besi dari kelenjar endokrin dan jantung, karena kerja deferiprone dapat melakukan penetrasi hingga intraselular.36
4. Evaluasi endokrin.
Evaluasi endokrin harus dilakukan bila dijumpai penurunan kurva pertumbuhan, penurunan kecepatan pertumbuhan (<
persenti 25) dan keterlambatan maturitas tulang.35,37 Evaluasi ini meliputi:37
- Penilaian status diet oleh ahli gizi
- Pemeriksaan laboratorium : Serum Ca, PO4, albumin, asam urat, kultur
urin, T4, TSH dan IGF-I
5. Diagnosa pasti penyebab gangguan pertumbuhan Hal ini dilakukan untuk memastikan apakah gangguan pertumbuhan disebabkan oleh defisiensi GH, gangguan hormon lainnya, defisiensi nutrisi, atau disebabkan oleh toksisitas DFO. Bila dijumpai defisiensi GH harus segera dilakukan uji stimulasi GH untuk memastikan adanya defisiensi GH.15 Uji stimulasi GH yang dilakukan dapat berupa uji toleransi insulin, uji arginin, uji levadova, uji klonidin, ataupun dengan latihan fisik38
6. Pemberian terapi GH bila dijumpai defisiensi GH.
Pemberian terapi GH telah menunjukkan peningkatan pertumbuhan untuk jangka pendek dan juga peningkatan tinggi akhir saat dewasa pada anak-anak dengan berbagai macam masalah pertumbuhan.11,39 Tetapi penggunaan terapi GH ini hanya direkomendasikan bila memang dijumpai defisiensi GH.15,37 Hal ini disebabkan efek samping yang dapat muncul akibat pemakaian terapi GH tersebut.40
Kriteria diagnosis defisiensi GH:11 - TB dibawah persentil 3 atau -2SD
- Kecepatan pertumbuhan di bawah P25 - Usia tulang terlambat > 2 tahun
- Kadar GH<7 ng/ml pada 2 jenis uji provokasi - IGF-I rendah
- Tidak ada kelainan dismorfik tulang atau sindroma tertentu.
Recombinant human GH (rhGH) merupakan GH sintetik yang mulai ada sejak tahun 1980an, yang bekerja sebagai pengganti GH di hipofisis anterior pasien dengan defisiensi GH. Dosis yang direkomendasikan untuk defisiensi GH adalah 23-39 µg/kgbb/hari atau 0.7-1.0 mg/m2/hari dengan dosis maksimal 2.7 mg/hari. Respons yang dinilai untuk memantau terapi GH :41
1. Penilaian secara regular terhadap pertumbuhan anak setiap 3 bulan selama satu tahun.
2. Bila respons pengobatan memuaskan, interval penilaian dapat diperpanjang menjadi 4-6 bulan
3. Pemeriksaan fungsi tiroid dilakukan pertahun atau bila ada indikasi
4. Penilaian status hipofisis untuk menilai kemungkinan defisiensi hormon lain yang tersembunyi akibat pemakaian terapi GH
5. Terapi hormon seks untuk menginduksi pubertas pada waktu yang tepat, bila ada indikasi
6. Penilaian terhadap perkembangan, respons dan berbagai perubahan selama pengobatan.
Terapi GH harus segera dihentikan bila respons pengobatan tidak adekuat yaitu bila peningkatan kecepatan pertumbuhan
Gangguan pertumbuhan sebagai komplikasi talasemia • mayor
< 2 cm/tahun.41
RINGKASAN
Gangguan pertumbuhan merupakan komplikasi yang cukup banyak terjadi pada anak yang menderita talasemia ß-mayor.
Anemia kronis, transfusi darah yang tidak adekuat, penumpukan besi pada organ-organ endokrin dan efek samping dari penggu- naan terapi kelasi besi merupakan beberapa penyebab terja- dinya gangguan pertumbuhan pada pasien talasemia ß-mayor.
Tatalaksana yang tepat dapat mencegah dan mengatasi gangguan pertumbuhan pada pasien talasemia ß- mayor.
DAFTAR PUSTAKA
1. Weatherall DJ, Clegg JB. The ß- thalassaemias. In:
Weatherall DJ, Clegg JB, editors. The thalassaemia syndrome. 4th Ed. London: Blackwell Science; 2001. p.
287-356.
2. Galanello R, Origa R. Beta-thalasssemia. Orphanet J of Rare Disease. 2010;5:11-5.
3. Olivieri NF, Brittenham GM. Iron-chelating therapy and the treatment of thalassemia. Blood J. 1997;89:739-61.
4. Najafipour F, Aliashgarjadeh A, Niafar M, Mobaseri M, Agamohamadzadeh N, Sorkhabi RS. Evaluation of glucose metabolism, thyroid function, growth and development pattern and calcium status in patients with thalassemia major. Medwel J. 2008;3:867-73.
5. Hamidah A, Rahmah R, Azmi T, Aziz J, Jamal R. Short stature and truncal shortening in transfusion dependent thalassemia patients: result from a thalassemia center in Malaysia. Shouteast Asian J. 2001;32:625-30.
6. Moayeri H, Oloomi Z. Prevalence of growth and puberty failure with respect to growth hormone and gonadotropin secretion in beta-thalassemia major. Arc Iranian. 2006;
9:329-34.
7. Bhala AK, Marwaha RK, Kaur H. Longitudinal growth attainments of transfusion dependent ß-thalassemia children. Mankin quarterly. 2008;48:484-93.
8. Saxena A. Growth retardation in thalassemia major patients. Int J Hum Genet. 2003;4:237-46.
9. Kyriakou A, Skordis N. Thalassemia and aberration of growth and puberty. Medit J Hemat Infec Dis. 2009;4:1-8.
10. Grimberg A, Leon DD. Disorders of growth. In: Mosang T, editor. Pediatric endocrinology. Philadelphia: Elsevier Mosby; 2005. p. 127-67.
11. Batubara J, Susanto R, Cahyono HA. Pertumbuhan dan gangguan pertumbuhan. In: Batubara J, Trijaya B, Pulungan AB, editors. Buku ajar endokrinologi anak. Jakarta: Ikatan Dokter Anak Indonesia; 2010. p. 19-41.
12. Patel L, Clayton PE. Normal and disordered growth. In:
Brook CGD, Clyton PE, Brown RS, Savage MO, editors.
Clinical pediatric endocrinology. 5th Ed. Massachusette:
Blackwell; 2005. p. 90-111.
13. Dubey AP, Parakh A, Dublish S. Current trends of the management of beta thalassemia. Ind J Pediatr.
2008;7:739- 43.
14. Cappellini MD, Congenite CA, Cohlen A, Piga A, Porter J.
Guideline for the clinical management of thalassemia. 2nd
Ed. Cyprus: Thalassemia International Federation; 2011.
p. 64-70.
15. Ibrahim HM, Ayob Y, Mahayiddin AA, Sathar J, Musa Z, Bakri R, et al. Management of transfusion dependent thalassaemia. Malaysia: Ministry of Health Malaysia;
2009. p.1-84.
16. Skordis N. Endocrine investigation and follow up in thalassemia: times for specific guidlines. Thalassemia reports. 2011;1:1-16.
17. Sanctis V, Urso, Scialpi, Mangiagli. Endocrine complications in ß-thalassemia major. In: Maggio A, Hoffbrand AV, editors.
Clinical aspects and therapy of haemoglobinopathies. Italy:
Proprieta letteraria riservata; 2004. p. 293-310.
18. Faranoush M, Rahiminejad MS, Karamizadeh Z, Ghorbani R, Owji SM. Zinc supplementation effect linear growth in transfusion dependent ß thalassemia. IJBC.
2008;1:29- 32.
19. Prabhu R, Prabhu V, Prabhu RS. Iron Overload in beta thalassemia –a revew. J Biosci Tech. 2009;1;20-31.
20. Barton JC, Edwards CQ, Phatak PD, Britton RS, Bacon BR. Handbook of iron overload. New York: Cambridge university Press; 2010. p. 233-41.
21. Mehvar A, Azarkeivan A, Faranoush M, Mehvar N, Saberinedjhad J, Ghorbani R. Endocrinophaties with transfution dependent betha thalassemia. Pediatr Hem Onk. 2008;25:187-94.
22. Shamshirzas AA, Bekheirnia MR, Kamgar M, Pourzahedgilani N, Bouzari N, Habibzadeh M, et al.
Metabolic and endocrinologic complications in beta- thalassemia major: a multicenter study in Taheran. BMC Endocrine Disorders. 2003;3:1-6.
23. Khan FUR, Khan MH, Ayub T, Shah SH. Frekuency of complications in beta thalassemia major in D.I. Khan.
Biomedica. 2007;23:31-3.
24. Soliman AT, Khalafallah H, Ashour R. Growth and factors affecting it in thalassemia major. Hemoglobin. 2009;33:116- 26.
25. Low LCK. Growth of children with ß-thalassemia major.
Indian J Ped. 2005;72:159-63.
26. Paulev PE, Calleja GZ. Other hormones and disorders.
In: Paulev PE, Calleja GZ, editors. New human fisiology.
2nd Ed. Copenhagen: Elsevier; 2010. p. 251-3.
27. Karamifar H, Amirhakimi GH. Linier growth deficiency in ß-thalassemia patiens: is it growth hormone dependent?
IJMS. 2002;27:47-50.
28. Fica S, Albu A, Vladareanu F, Barbu C, Bunghez R, Nitu L, et al. Endocrine disorders in ß- thalassemia major:
cross sectional data. Act Endocr. 2005;1:201-12.
29. Roth C, Perkum A, Bartz M, Jarry H, Eber S, Lakomek M. Short stature and failure of pubertal development in thalassemia major: evidence for hypothalamic neurose- cretory disfuncion of growth hormone secretion and defective pituitary gonadotropin secretion. Eur J pediatr.
1997;156:777-83.
30. Vogiatzi MA, Macklin EA, Tractenberg FL, Fung EB, Cheung
AM, Vichinscy E. Differences in the prevalence of growth, endocrine and vitamin D abnormalities among the various thalassemia syndromes in North America.
British J of haematology. 2009;146:546-56.
31. Reiter EO, D’Ercole AJ. Disorders of anterior pituitary gland, hypothalamus and growth. In: Rudolf AM, Hotcler MK, Lister G, Siegel NJ, editors. Rudolf’s pediatric. 23rd Ed. California: McGraw-Hill; 2003. p. 2002.
32. Rindang C, Batubara JL, Amalia P, Satari H. Some aspects of thyroid dysfunction in thalassemia major patients with severe iron overload. Paediatr indones. 2011;51:67-72.
33. Eshragi P, Tamaddoni A, Zarifi K, Mohammadhasani A, Aminzadeh M. Thyroid function in major thalassemia patients: is it related to height and chelation therapy?
Casp J Inern Med. 2011;2:189-93.
34. Angelucci E, Barosi G, Camaschella C, Cappelini DM, Cazzola, Galanello R. Italian society of hematology practice guidelines for the management of iron overload in thalas- semia major and related disorders. Haematologica. 2008;
93.741-52.
35. Sayani F, Warner M, Wu J, Rieger DW, Humphreys K, Odame I. Guidelines for the clinical care of patient with thalassemia in Canada. Toronto: Thalassemia foundation of Canada; 2009. p. 15-38.
36. Wang CH, Wu KH, Tsai FJ, Peng CT, Tsai CH.
Comparison of oral and subcutaneous iron chelation therapies in the prevention of major endocrinopathies in ß thalassemia major patients. Hemoglobin. 2006;2:257-62.
37. Elghany WA. Guidelines for monitoring and management of endocrine function in children and adolescents with B thalassemia major. University Hospital of Leicester. 2010;1-4.
38. Hindmarsh PC, Swift PGF. An assessment of growth hormone provocation tests. Arch dis. 1995;72:362-68.
39. Lee PA, Germak J, Gut R, Khutoryansky N, Ross J.
Identification of factors associated with good response to growth hormone therapy in children with short stature:
result from the ANSWER program. Int J pediatric endocrinol. 2011;6:1-7.
40. Darendaliler F. Safety of growth hormone treatment. J Clin Res Ped endo. 2009;1:36-43.
41. Kirk J, Butler G. Treatment of children with recombinant human growth hormone (r-hGH) shared care guidelines.
London: British society for paediatric endocrinology and diabetes (BSPED); 2006. p. 1-6.**
Nur Robbiyah, dkk Gangguan pertumbuhan sebagai komplikasi talasemia • mayor